Chinese Journal of Tissue Engineering Research ›› 2021, Vol. 25 ›› Issue (5): 791-797.doi: 10.3969/j.issn.2095-4344.3017
Previous Articles Next Articles
Mechanism of DNA methylation in exercise intervention for osteoporosis
Liu Bo, Chen Xianghe, Yang Kang, Yu Huilin, Lu Pengcheng
- College of Physical Education, Yangzhou University, Yangzhou 225127, Jiangsu Province, China
-
Received:2020-04-26Revised:2020-04-28Accepted:2020-05-28Online:2021-02-18Published:2020-12-01 -
Contact:Chen Xianghe, PhD, Lecturer, College of Physical Education, Yangzhou University, Yangzhou 225127, Jiangsu Province, China -
About author:Liu Bo, Master candidate, College of Physical Education, Yangzhou University, Yangzhou 225127, Jiangsu Province, China -
Supported by:the China Postdoctoral Science Foundation, No. 2019M661957
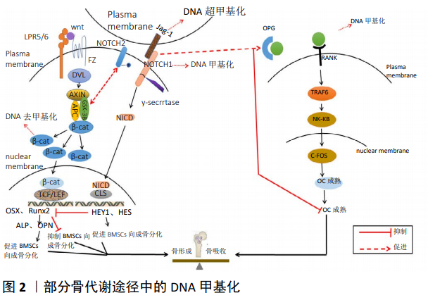
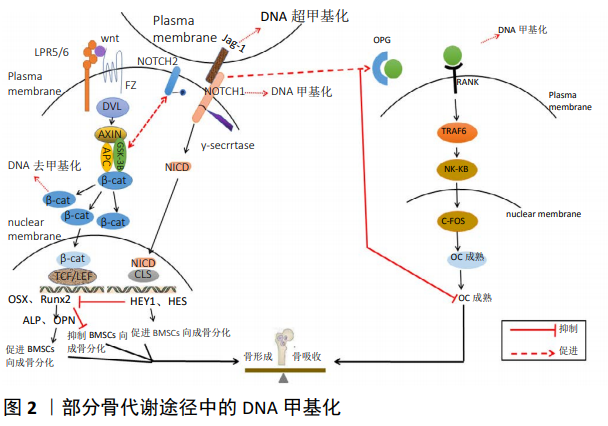
2.1 DNA甲基化 DNA甲基化是表观遗传学的研究热点,分为维持甲基化和从头甲基化,呈现甲基在供体分子间的级联反应的一碳代谢过程。S-腺苷甲硫氨酸在由DNA甲基转移酶(DNA methyltransferase, DNMTs)催化的反应中将其甲基基团供给胞嘧啶,此位点位于CpG岛二核苷酸胞嘧啶的5号碳原子(C5)[6]。CpG岛是基因中胞嘧啶(C)和鸟嘌呤(G)大量存在的二核苷酸重复序列,C和G通过磷酸二酯(p)相连,CpG岛与基因启动子的功能高度相关。研究证实,基因启动子中CpG岛密度越高,DNA甲基化程度对其转录水平的制约就越强。 DNA甲基化可以通过多种方式调控基因表达:①发生甲基化的DNA与转录因子结合发生障碍。由于在DNA双螺旋结构的大沟内存在含有CpG位点的启动子序列,且该处是许多转录因子与DNA集合的位置,当此处发生甲基化后,一些对甲基化敏感的转录因子如核转录因子、转录因子2等与识别位点的结合发生障碍,这会抑制转录过程,干扰基因表达。②甲基CpG结合蛋白对基因表达的抑制或沉默。甲基CpG结合蛋白是特异性转录抑制物,并以蛋白复合体的形式发挥作用,包括甲基CpG结合蛋白1和甲基CpG结合蛋白2两种甲基CpG结合蛋白复合体,而后者对单一的甲基化CpG位点高度亲和,当转录因子的启动子识别序列中的 CpG位点发生甲基化时,其会与转录因子竞争甲基化结合位点,从而导致基因表达受影响。③DNA甲基化引起染色质结构改变,抑制基因表达。发生DNA甲基化后,组蛋白H3,H4氨基端赖氨酸残基出现去乙酰化,核小体结构受到影响,并改变组蛋白H1的连接活性来调节基因活性。另外,DNA甲基化会阻止转录因子进入而诱导染色质失活,防止染色质活化[7]。一般认为,高甲基化的DNA序列表达水平低;反之,表达水平高。DNA甲基化水平在甲基化和去甲基化的共同作用下保持动态平衡,而衰老、饮食、运动、内分泌干扰物、细菌感染等外界环境因素会引起DNA甲基化发生变化,从而引起各种疾病的发生。 2.2 DNA甲基化与骨质疏松症 2.2.1 单基因水平中的DNA甲基化 成骨细胞来源于间充质干细胞分化,在间充质干细胞成骨分化过程中往往伴随着关键因子的DNA甲基化变化,目前研究较多的包括Runx2、Osx、碱性磷酸酶、骨形态发生蛋白2等。Runx2在间充质干细胞成骨分化中起初始调节器的作用,随后通过Osx调节,碱性磷酸酶与骨钙素分别代表早期与晚期成骨标志物。Xu等[8]通过分离人骨髓来源的间充质干细胞和脂肪组织来源的间充质干细胞并诱导其向成骨分化,结束后检测到骨髓间充质干细胞中Runx2表达上升,且Runx2基因启动子CPG位点甲基化水平降低,而成脂相关基因PPARγ表达降低,并出现高甲基化。王剑等[9]使用鹿茸中药复方来处理骨质疏松症大鼠,发现鹿茸中药复方能有效降低骨组织Runx2、Osx启动子甲基化水平,从而增加骨形成,提高骨密度。WAKITANI等[10]对小鼠原代间充质干细胞 培养过程中,观察到Runx2表达与其甲基化率呈负相关,该甲基化区域位于Runx2启动子-2.7至-2.2 kb,是新发现的差异甲基化区域,在诱导间充质干细胞向成骨分化后,Runx2此区域甲基化修饰程度降低且表达上升,这与其他研究相似[11],提示Runx2甲基化变化对成骨分化有重要作用。但HAGH等[12]在人骨髓间充质干细胞成骨分化中并未发现Runx2启动子出现甲基化,反观其下游靶点Osx启动子出现动态甲基化变化,这与上述研究相矛盾,但这是否说明Osx的DNA甲基化修饰在间充质干细胞成骨分化中起主要作用仍有待研究,造成此差异原因可能与实验对象、环境等有关。 此外,骨形态发生蛋白2作为关键骨形成因子,能在体外刺激成骨细胞分化和成骨结节形成,以及在体内刺激成骨。研究表明,骨形态发生蛋白2也受DNA甲基化调控。RAJE等[13]发现,与健康人群相比,骨质疏松症患者骨形态发生蛋白2启动子区甲基化水平较高,使其转录活性降低,同时降低了骨形成标志物表达,在使用DNA甲基化抑制剂处理之后骨形态发生蛋白2表达上调[14]。另外,一些其他的成骨特异性基因如远端缺失同源盒基因5、骨钙素等在脂肪源性干细胞成骨分化中,其启动子区发生去甲基化并伴随着基因表达上调,在此过程中还伴随着生长阻滞和DNA损伤诱导蛋白的表达增加,在降低DNA损伤诱导蛋白表达后,成骨特异性基因启动子甲基化水平升高,导致转录活性降低并抑制了脂肪源性干细胞向成骨分化,这说明DNA损伤诱导蛋白参与了DNA甲基化对基因表达的调控过程[15]。 骨硬化蛋白是硬化蛋白基因编码由骨细胞通过旁分泌作用于成骨细胞的功能蛋白,对骨组织具有高度选择性,可负性调节骨形成[16]。硬化蛋白基因也受DNA甲基化调控,其基因-581-+30区富含CPGs,在成骨细胞中该区域呈现高甲基化,而随着向骨细胞转变其甲基化水平逐渐降低,通过使用5-氮胞苷(甲基转移酶抑制剂)处理后硬化蛋白基因表达增加并促进成骨细胞向骨细胞转变[17]。研究表明,绝经后骨质疏松患者血浆硬化蛋白甲基化阳性率显著低于无骨质疏松者,且前者硬化蛋白mRNA相对表达量明显高于后者[18],表明硬化蛋白基因甲基化异常导致骨质疏松症产生。此外,Osx等成骨转录因子可通过与硬化蛋白中CG富集点结合来活化硬化蛋白,对其进行正向调控进而影响骨形成过程[19],而DNA甲基化又在此过程中发挥重要作用,干扰素调节因子8是调控破骨细胞分化的关键负性调节因子,DNMT3a能通过增加干扰素调节因子8远侧调节元件的甲基化进而抑制干扰素调节因子8,同时S-腺苷蛋氨酸浓度增加能促进其甲基化[20]。调节性T细胞可抑制破骨细胞分化及活性,影响骨代谢[21]。调节性T细胞调节骨代谢依赖于Foxp3基因的正常表达,而Foxp3基因保守非编码序列2去甲基化有助于其稳定表达[22],研究表明,骨质疏松症患者调节性T细胞中Foxp3 保守非编码序列2去甲基化水平远远低于观察组[22]。上述研究表明,DNA甲基化在间充质干细胞成骨分化以及成骨细胞、破骨细胞增殖分化中起重要作用。 2.2.2 Wnt/β-catenin、Notch信号通路与DNA甲基化 Wnt信号通路在干细胞成骨分化以及骨形成代谢中发挥重要作用。在经典Wnt/β-catenin通路中,Wnt蛋白与膜受体卷曲蛋白(Frizzled, Fz)结合,经过一系列蛋白的相互作用,使β-catenin稳定沉聚,并在细胞核内对T细胞转录因子和淋巴增强因子发生作用,通过启动Runx2及下游基因Osx、远端缺失同源盒基因5等的表达来促进成骨细胞分化、成熟[23]。研究表明,Wnt信号通路相关基因受到DNA甲基化调控。在对骨质疏松性髋部骨折患者和髋骨关节炎患者Wnt相关基因表达及其甲基化水平进行检测时,发现骨折患者Wnt通路中的FZD10、TBL1X、CSNK1E、WNT8a、CSNK1A1L、SFRP4基因甲基化水平高于后者,导致Wnt通路活性降低并抑制了成骨细胞分化成熟[24]。β-catenin是Wnt信号通路靶基因,通过建立骨髓间充质干细胞成骨分化诱导体系,发现在成骨诱导3d后β-catenin基因表达明显上调,经甲基化特异性PCR法检测发现β-catenin基因甲基化水平明显下降,而β-catenin基因表达增加促进了骨髓间充质干细胞向成骨分化[25]。WU 等[26]研究发现,股骨头坏死患者的间充质干细胞中Wnt受体Frizzled1基因转录水平较低,同时伴有Frizzled1基因启动子异常高甲基化,这使得Wnt/β-catenin通路功能被抑制并直接影响间充质干细胞成骨分化及骨形成。另外,在该过程中Wnt信号通路共受体酪氨酸激酶样孤核受体2可通过诱导成骨转录因子Osx改变干细胞分化表型,而其自身表达增加并伴随DNA甲基化水平降低[27]。综上所述,Wnt/β-catenin信号通路相关的基因甲基化水平改变,会影响其表达进而对骨形成产生影响。 Notch信号通路广泛存在于哺乳动物细胞内,由5种配体(Delta-like-1, Delta-like-3, Delta-like-4, Jagged-1和Jagged-2)、4种受体(Notch1-4)、下游传导靶基因和调节分子组成,当其受体与配体结合后, Notch受体释放部分胞外片段, 胞内部分经γ-促分泌酶(γ-secretase)酶切后释放可溶性的Notch胞内段(Intracellular domain of Notch, NICD)。NICD转移至细胞核内,与转录抑制因子结合后即成为转录活化因子, 最终影响细胞的分化、增殖和凋亡[28]。研究表明,Notch信号通路对成骨分化具有抑制和促进的双重作用,且Notch1、Notch4、Delta-like-1等受体或配体受DNA甲基化调控。Notch1可抑制间充质干细胞成骨分化,ZHOU等[29]在研究中发现,诱导成骨分化14 d后,钙化性主动脉瓣疾病和人主动脉瓣间质细胞中Notch1启动子甲基化水平显著升高,导致Notch1表达下调进而促进了成骨分化,增加了钙化程度,而使用5-氮胞苷处理之后则抑制了成骨分化。另一研究中,HADJI等[30]在钙化性主动脉瓣疾病中观察到长链非编码RNA H19表达增加,且启动子区甲基化降低,进一步分析表明,H19通过阻止P53募集到其启动子区进而沉默Notch1,促进了成骨分化。 目前关于DNA甲基化通过Notch信号通路来调节骨代谢的研究较少。研究表明,Notch1、Notch4基因均存在甲基化,且Delta-like-1基因启动子的超甲基化可调控其表达,当这些配体或受体启动子甲基化水平改变时会激活Notch信号通路,引起下游信号分子HES1上调,进而对骨形成产生影响[31]。此外,Wnt和Notch信号通路并不完全独立,Wnt信号通路中的糖原合成酶激酶3β和Notch通路可相互作用, 通过结合和磷酸化Notch2来调节Notch的活化。Wnt信号通路在成骨调控中其目的基因的表达依赖Runx2的活性,Notch信号通路目的基因HEY1编码的蛋白质可对抗并降低Runx2的转录活性,进而抑制Wnt目的基因的表达,而当Notch1启动子DNA甲基化水平升高时,会导致其表达降低而使NICD释放减少,进而促进Wnt/β-catenin信号通路激活,促进成骨分化[29-30,32]。基于以上分析,作者认为Notch1基因甲基化水平降低时会促进其表达,发挥其对Wnt通路的抑制作用,从而抑制成骨分化;当Notch1基因甲基化水平升高时则会抑制其表达,从而对骨形成产生积极作用,另外,LncRNA 在其中也发挥一定作用。 2.2.3 OPG/RANKL/RANK系统与DNA甲基化 OPG/RANKL/RANK系统是调节骨吸收代谢的关键途径分子轴。成骨细胞分泌的RANKL可以激活破骨细胞上的核因子κB受体活化因子(Receptor activator of nuclear factor kappa B, RANK)并与其结合,在肿瘤坏死因子受体相关因子的参与下激活信号转导,从而促进破骨细胞成熟,增强骨吸收作用,而骨保护素可以抑制RANKL与RANK的结合,降低骨吸收[33]。目前研究表明,肿瘤坏死因子受体相关因子参与OPG/RANKL/RANK系统调节骨代谢的可能途径为:①核转录因子κB途径,首先RANK会与肿瘤坏死因子受体相关因子6结合,激活核转录因子κB诱导激酶并使得核转录因子κB转移至细胞核上调c-Fos的表达,使得破骨细胞生成基因开始转录,并诱导破骨细胞成熟;②JNK途径, RANK与肿瘤坏死因子受体相关因子6结合后激活细胞外信号调节激酶(Extracellular signal-regulated kinase, ERK)、丝裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK)、c-Jun氨基末端激酶 (c-Jun N-terminal kinase, JNK), 并诱导c-Jun/Fos活化蛋白1(AP-1) 活化, 使c-Jun磷酸化, c-Fox表达增加, 最终使破骨前体细胞功能活跃, 分化生成破骨细胞;③蛋白激酶B (Protein kinase B, PKB, 又称为Akt)途径, RANK与肿瘤坏死因子受体相关因子6结合, 激活磷脂酰肌醇, 活化Akt, 参与核转录因子κB活化, 促进破骨细胞成熟[34]。 DNA甲基化可以调控OPG/RANKL/RANK系统影响骨代谢。在对小鼠ST2的骨髓间充质干细胞研究中发现,诱导分化的骨髓间充质干细胞中RANKL基因转录起始位点周围的CPG出现甲基化,导致启动子沉默,抑制了RANKL基因表达,影响成骨细胞分化。进一步实验表明,仅RANKL基因启动子TATA-box上游的单一CpG位点的甲基化就可调节其表达,进而影响破骨细胞分化[35]。DELGADO-CALLE等[36]使用5-氮胞苷处理高甲基化的HEK-293细胞,发现RANKL和骨保护素表达明显上调,而此变化会影响破骨细胞形成,影响骨稳态。另外,DNMT3a能够通过偶联S-腺苷甲硫氨酸介导的代谢途径, 抑制抗破骨细胞形成基因的表达, 调节破骨细胞分化,且此代谢过程涉及RANKL通路相关基因甲基化的改变。虽然HUSAIN等[37]曾表示在人体研究中尚未发现骨质疏松症患者组间RANKL基因的甲基化差异,但WANG等[38]通过分离非骨质疏松/骨质疏松性骨折组织,对骨保护素和RANKL启动子的CPG岛中CPG位点甲基化状态进行检测,结果发现,骨质疏松症组RANKL表达显著高于非骨质疏松症组,而RANKL基因启动子的甲基化水平远远低于非骨质疏松症组。以上分析表明,RANKL基因甲基化水平降低会促进其表达,使OPG/RANKL降低并提高了破骨细胞活性,促进了骨吸收,导致骨流失加速并产生骨质疏松症(图2)。 综上所述,在经典的Wnt/β-catenin、Notch信号通路、OPG/RANKL/RANK系统中,部分受体或配体及下游因子存在DNA甲基化,如β-catenin、Frizzled、Notch1、Jag-1、RANKL、以及Runx2、Osx、骨桥蛋白等众多下游基因,这些基因在骨质疏松症体内往往出现甲基化异常,导致骨形成受阻以及骨吸收增加,骨代谢失衡。而除了Wnt/β-catenin与Notch信号通路之间的交互影响外,Notch信号通路中的Notch1也可促进骨保护素表达,进而抑制破骨细胞形成,减少骨吸收[39]。"
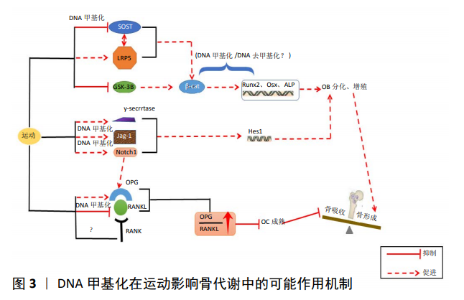
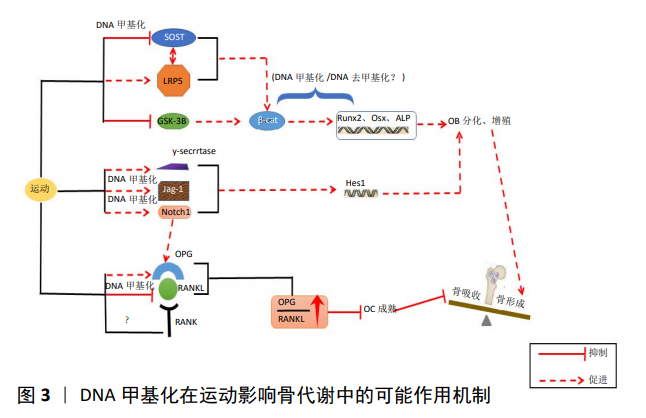
2.3 DNA甲基化在运动影响骨质疏松症中的作用研究 2.3.1 运动产生的机械效应与骨质疏松症 运动引起的肌肉收缩、血流速度改变、重力变化等宏观负荷可在骨骼内转变为机械刺激[40],这种刺激是调控骨转换、生长、矿化的关键调节器,合理运动产生的力学刺激能有效地刺激骨的生长。体外研究表明,在细胞水平上,机械负荷通过作用于骨引起骨髓腔产生压力及流动力,从而给间充质干细胞刺激并引起其向成骨分化。前面说过,β-catenin是Wnt信号通路的核心转导因子,研究证实,无论体内、体外机械应力刺激都能促进β-catenin蛋白表达进而激活Wnt信号通路,促进骨形成,并且随着Wnt信号通路的激活,成骨细胞对外源刺激将变得更加敏感[41]。生长期小鼠在经过跑台运动后,相较于未运动组,其内源性甲状旁腺素和雌激素浓度提高,使得LRP5基因和β-catenin蛋白表达上升并导致骨矿含量升高[42]。对小鼠骨髓间充质干细胞施加2%的牵张力干预后,GSK3β活性被抑制,降低了对β-catenin降解作用,使β-catenin大量聚集于细胞质并转移入核,从而激活Wnt信号通路[43]。 除了间充质干细胞外,流体剪切应力能诱导成骨细胞中骨形态发生蛋白受体表达进而激活Smad1/5,上调白细胞介素11的表达最终促进成骨细胞分化。也有研究发现,采用10%、频率为1 Hz强度的机械应力能通过骨形态发生蛋白受体Ⅰ来激活Smad1/5,进而上调Runx2来促进骨形成[44]。通过对MC3T3-E1成骨细胞系施加不同形变幅度和时间的牵张应力干预,结果发现,中等强度(3%和6%)和中等时间 (4 h)的干预能有效促进碱性磷酸酶、Runx2、骨钙素、Osx等mRNA表达升高,并降低硬化蛋白 mRNA[45],使得Wnt信号通路被激活,从而促进骨形成。GAO等[46]也有相似发现,机械振动(0.5 gn,45 Hz)促进了成骨细胞增殖和细胞外基质矿化,改善了原代成骨细胞中细胞骨架的排列,进一步检测到碱性磷酸酶、骨形态发生蛋白2、骨保护素 mRNA表达增加,硬化蛋白表达被抑制,另外还检测到Wnt3a、β-catenin蛋白表达上升,这种变化促进了骨形成。另外,骨保护素大鼠经负重爬梯训练后,骨组织中骨保护素表达上升而RANKL表达下降,OPG/RANKL比例上升,从而抑制破骨细胞分化,使骨吸收/骨形成逆向迁移,对骨质疏松症产生改善作用[47]。 2.3.2 DNA甲基化在运动调控骨质疏松症中的作用机制 目前,运动在防治某些疾病如2型糖尿病、肥胖、阿尔茨海默症中受到越来越多重视,而研究表明,运动能通过调节相关基因甲基化水平改善这些疾病。何标等[48]对APP/PS1转基因小鼠施加10周跑台运动后,小鼠海马中DNMT1、DNMT3a、DNMT3b mRNA表达显著增加,造成小鼠海马甲基化水平升高,降低了APP/PS1/ Aβ42等蛋白表达水平,从而提高小鼠空间记忆能力。田雪文[49]分别采用低氧运动和常氧运动处理肥胖大鼠后发现,低氧运动能有效降血脂、调节脂代谢进而降低体质量、体脂,对相关因子mRNA和蛋白表达进行检测后发现,与脂代谢相关的基因表达出现显著变化,并用RRBS技术检测到两种运动方式使大鼠全基因组中675个基因的CPG岛发生显著的甲基化变化,其中Wnt信号通路相关基因的mRNA表达和甲基化最明显。这些研究直接证明了运动可以通过改变DNA甲基化来对机体产生影响。 研究证实,DNA甲基化在运动影响骨代谢中具有重要调控作用。将小鼠体内分离出来的间充质干细胞置于振荡流液中进行3 h机械刺激,经检测,在排除生物化学诱导分化的影响后,骨桥蛋白表达增加了2.3倍,且启动子甲基化下降了35%,并且3周的生化诱导分化所引起的骨桥蛋白低甲基化与3 h机械刺激引起的低甲基化差异不大,证明了机械刺激较生化调节来说是一种较强的调节手段。该实验首次验证了机械微环境能通过降低骨桥蛋白启动子甲基化水平来上调其表达,并促进间充质干细胞的迁移进而增加成骨分化的潜力[50]。 GNAS基因与多种骨疾病有关,GNAS1基因编码的刺激性G蛋白α亚基(Stimulatory protein subunit α, Gsα)可通过经典Wnt/β-catenin信号通路以及Hedgehog信号途径对成骨分化和骨形成产生影响。VLAIKOU等[51]对从成年男性和女性供体获得的AT-MSC施加循环机械拉伸,15d后从细胞形态上观察到成骨率明显升高,并检测到NESP CpG24,GNASXL CpG27和GNASXL CpG26三个CPG位点的总体甲基化水平在15 d后显著降低,这促进了人脂肪组织多能基质细胞(hAT-MSC)成骨分化。 综上,以上研究证实了长期的机械应力能诱导GNAS基因甲基化水平改变,从而诱导人脂肪组织多能基质细胞(hAT-MSC)向成骨分化,促进骨形成。非受体酪氨酸蛋白激酶和非受体酪氨酸激酶作为影响骨形成代谢的重要因子,可通过抑制骨桥蛋白、Osx以及Runx2等骨形成基因来调节骨量,非受体酪氨酸蛋白激酶或非受体酪氨酸激酶基因缺失小鼠都表现出高骨量[52]。非受体酪氨酸蛋白激酶和非受体酪氨酸激酶可以响应对骨骼的机械负荷,HUM等[52]通过对MC3T3成骨细胞施加流体剪切应力后发现,非受体酪氨酸蛋白激酶和非受体酪氨酸激酶被激活并大量转移入核并与甲基CPG结合域蛋白2(MBD2)结合,后者再与基因启动子中的CPG岛结合导致基因沉默,该过程同时还增加了骨桥蛋白与环氧合酶2表达,促进了骨形成。 综上所述,DNA甲基化引发的骨代谢紊乱导致骨质疏松症发生,而运动防治骨质疏松症中伴随着β-catenin、Osx、骨桥蛋白、Runx2、RANKL、Notch1等基因的表达改变。研究表明,运动可通过DNA甲基化来防治多种疾病,如肥胖、2型糖尿病、阿尔茨海默症等。体外实验证明,外界产生的机械负荷可以作用于间充质干细胞,通过降低骨桥蛋白、GNAS1等骨形成基因的甲基化水平来上调其表达进而促进间充质干细胞成骨分化。因此,结合相关研究,运动可能通过DNA甲基化来影响骨质疏松症的几个位点:运动能使硬化蛋白基因发生甲基化,下调其表达从而减少对Wnt通路的抑制,上调β-catenin表达进而促进骨形成;运动能使Notch1和Jag-1发生去甲基化并促进其表达,激活Notch通路,上调下游信号分子HES1表达,进而促进骨形成,同时 Notch1表达增加会促进骨保护素表达上升,减弱骨吸收;运动使RANKL甲基化水平提高并降低其表达,使OPG/RANKL上升,协同Notch通路抑制破骨细胞活性,减弱骨吸收(图3)。"
| [1] 马远征,王以朋,刘强,等.中国老年骨质疏松症诊疗指南(2018)[J].中国骨质疏松志, 2018, 24(12):1541-1567. [2] 周隆,任兆舟,张展,等. 运动疗法对防治绝经后妇女骨质疏松症的疗效分析及对骨密度的影响[J]. 中国妇幼保健, 2020, 35(7): 1270-1273. [3] LETAROUILLY JG,BROUX O,CLABAUT A.New insights into the epigenetics of osteoporosis.Genomic.2019; 111(4):793-798. [4] 胡晓青,张辛,代岭辉,等.骨髓间充质干细胞成骨分化过程中Runx2的表观遗传学修饰[J].中国生物化学与分子生物学报, 2014, 30(2):150-155. [5] CHISATI EM, CONSTANTINOU D, LAMPIAO F. Management of reduced bone mineral density in HIV:pharmacological challenges and the role of exercise. Front Physiol.2018; 7(9):1074. [6] CHEN R, REN L, CAI Q, et al. The role of epigenetic modifications in the osteogenic differentiation of adipose-derived stem cells. Connect Tissue Res. 2019;60(6):507-520. [7] 赵倩, 王巍, 孙野青. 植物DNA甲基化与基因表达的关联性研究进展[J]. 生物技术通报, 2016, 32(4):16-23. [8] XU L, LIU Y, SUN Y, et al. Tissue source determines the differentiation potentials of mesenchymal stem cells: a comparative study of human mesenchymal stem cells from bone marrow and adipose tissue.Stem Cell Res Ther. 2017;8(1):275. [9] 王剑,李屹,王实,等.基于骨组织Runx2、Osterix启动子甲基化探究鹿茸中药复方对去卵巢骨质疏松症大鼠的疗效机制[J/OL]. 世界科学技术-中医药现代化, 2020:1-6. [10] WAKITANI S, YOKOI D, HIDAKA Y, et al. The differentially DNA-methylated region responsible for expression of runt-related transcription factor 2. J Vet Med Sci.2017; 79:230-237. [11] 朱筱. 1、Runx2甲基化状态变化对血管平滑肌细胞成骨样分化影响的研究 2、Vaspin对人成骨细胞凋亡的作用机制研究[D]. 长沙:中南大学, 2012:34-50. [12] HAGH MF, NORUZINIA M, MORTAZAVI Y, et al. Different methylation patterns of RUNX2, OSX, DLX5and BSP in osteoblastic differentiation of mesenchymal stem cells. Cell J.2015;17:71-82. [13] RAJE MM, ASHMA R. Epigenetic regulation of BMP2 gene in osteoporosis: a DNA methylation study. Mol Biol Rep.2019;46(8):1667-1674. [14] FU B, WANG H, WANG J, et al. Epigenetic Regulation of BMP2 by 1,25-dihydroxyvitamin D3 through DNA Methylation and Histone Modification. PLoS ONE. 2013; 8(4):e61423. [15] 张瑞鹏. DNA去甲基化在脂肪干细胞分化与红细胞发育中的作用研究[D]. 浙江大学, 2011:33-39. [16] 张爽, 高艳虹. sclerostin在骨代谢中的作用和机制[J].上海交通大学学报(医学版), 2015, 35(4):589-593. [17] 牛亚丹, 林伊荷, 张汉清, 等. DNA甲基化与骨代谢调节及骨质疏松症研究进展[J].生命科学, 2020, 32(2):162-169. [18] 时宇博,朱福良,李立军,等. 绝经后骨质疏松症患者血浆SOST表达变化及其与基因甲基化的关系[J]. 山东医药, 2016, 56(16):35-37. [19] YANG F, TANG W, SO S, et al. Sclerostin is a direct target of osteoblast-specific transcription factor osterix. Biochem Biophys Res Commun. 2010;400(4):684-688. [20] 张丽君,王艺璇,胡泽兵,等. 表观遗传学调控骨骼细胞功能的研究进展[J].解放军医学院学报, 2019, 40(12):1199-1202+1206. [21] HONG L, KATHARINA SB, ANKE D, et al. Regulatory T cell-mediated anti- inflammatory effects promote successful tissue repair in both indirect and direct manners.Front Pharmacol . 2015;6:184. [22] 李子祺,葛鸿庆,王君鳌,等. 外周血CD4+T细胞Foxp3基因CNS2去甲基化与绝经后骨质疏松症的关系[J].实用医学杂志, 2018, 34(14):2329-2332. [23] DAO C, LIU, SI H, et al. Different effects of Wnt/β-catenin activation and parathyroid hormone on diaphyseal and metaphyseal in the early phase of femur bone healing of mice.Clin Exp Pharmacol Physiol. 2019; 46(7):652-663. [24] GARCÍA-IBARBIA C, DELGADO-CALLE J, CASAFONT I, et al. Contribution of genetic and epigenetic mechanisms to Wnt pathway activity in prevalent skeletal disorders. Gene.2013; 532(2):165-172. [25] 潘乐.补肾药对BMSCs成骨与成脂分化及β-catenin、PPARγ甲基化的影响[D].陕西中医学院, 2014. [26] WU F, JIAO J, LIU F, et al. Hypermethylation of Frizzled1 is associated with Wnt/β-catenin signaling inactivation in mesenchymal stem cells of patients with steroid-associated osteonecrosis. Exp Mol Med.2019; 51(2): 23. [27] TARFIEI G, NORUZINIA M, SOLEIMANI M, et al. ROR2 promoter methylation change in osteoblastic differentiation of mesenchymal Stem Cells. Cell J.2011; 13(1):11-15. [28] LEE S Y, LONG F. Notch signaling suppresses glucose metabolism in mesenchymal progenitors to restrict osteoblast differentiation. J Clin Invest. 2018;128(12):5573-5586. [29] ZHOU Y, LI J, ZHOU K, et al. The methylation of Notch1 promoter mediates the osteogenesis differentiation in human aortic valve interstitial cells through Wnt/β‐catenin signaling.J Cell Physiol. 2019; 234(11):20366-20376. [30] HADJI F, BOULANGER M, GUAY S, et al. Altered DNA Methylation of Long Noncoding RNA H19 in Calcific Aortic Valve Disease Promotes Mineralization by Silencing NOTCH1. Pubmed.2016;134(23):1848-1862. [31] 傅涛, 李佳欢, 蔡逊. Notch信号通路在胃肠道肿瘤机制研究中的新进展[J]. 肿瘤学杂志, 2015, 21(10):852-855. [32] 任磊, 代光明, 林枭, 等. 骨细胞 Wnt/β-Catenin 通过 Notch 信号促进 BMSCs 成骨分化[J]. 中国骨质疏松杂志, 2018, 24(5):600-605. [33] ROCHETTE L, MELOUX A, RIGAL E, et al. The Role of Osteoprotegerin in Vascular Calcification and Bone Metabolism: The Basis for Developing New Therapeutics. Calcif Tissue Int. 2019;105(3):239-251. [34] 李子怡, 李玉坤. OPG/RANK/RANKL信号通路在骨质疏松症中的研究进展和应用[J]. 中华老年骨科与康复电子杂志, 2017, 3(2): 124-128. [35] KITAZAWA S, KITAZAWA R. Epigenetic control of mouse receptor activator of NF-κB ligand gene expression. Biochem Biophys Res Commun. 2002;293(1):126-131. [36] DELGADO-CALLE, JESÚS, FERNÁNDEZ, et al. Role of DNA methylation in the regulation of the RANKL-OPG system in human bone. Epigenetics. 2012; 7(1):83-91. [37] HUSAIN A, JEFFRIES MA. Epigenetics and Bone Remodeling.Curr Osteoporos Rep. 2017;15(5):450-458. [38] WANG P, CAO Y, ZHAN D, et al.Influence of DNA methylation on the expression of OPG/RANKL in primary osteoporosis. Int J Med Sci. 2018; 15(13):1480-1485. [39] 李永贤, 张顺聪, 郭丹青. Notch信号通路调控OPG/RANKL/RANK系统对骨质疏松椎体骨折影响的研究进展[J]. 中国中医骨伤科杂志, 2015, 23(11):73-77. [40] 胡晓磐,李世昌,孙朋. 生物力学因子YAP/TAZ与骨代谢的关系[J]. 生命科学, 2019, 31(6):602-608. [41] 仝晓阳,张玲莉,郭健民,等. 运动对骨代谢信号通路影响的研究进展[J].中国康复理论与实践, 2016, 22(12):1425-1429. [42] 杨念恩.不同方式运动对生长期小鼠骨合成代谢和Wnt信号通路的影响[D].上海:华东师范大学, 2014. [43] CASE N, THOMAS J, XIE Z, et al. Mechanical input restrains PPARgamma2 expression and action to preserve mesenchymal stem cell multipotentiality. Bone.2013; 52(1):454-464. [44] RATH B, NAM J, DESCHNER J, et al. Biomechanical forces exertanabolic effects on osteoblasts by activation of SMAD 1/5/8 through type 1 BMP receptor. Biorheology. 2011; 48(1):37-48. [45] 陈熙, 郭健 民, 元宇, 等. 不同牵张应力对成骨细胞MC3T3-E1分化及Wnt信号转导通路的影响研究[J]. 中国骨质疏松杂志, 2016, 22(1): 9-13. [46] GAO H, ZHAI M, WANG P, et al. Low level mechanical vibration enhances osteoblastogenesis via a canonical Wnt signaling associated mechanism. Pubmed.2017;16(1):317-324. [47] 刘晨涛, 张娟娟, 苗华, 等. 负重爬梯运动调节去卵巢大鼠OPG/Ikkα/Runx2基因表达以及对股骨结构和生物力学的影响[J]. 中国运动医学杂志, 2019, 38(4):296-304. [48] 何标,徐波,张宪亮.运动通过提高DNA甲基化水平改善阿尔茨海默病小鼠空间学习记忆能力[J].天津体育学院学报, 2016, 31(4): 333-339. [49] 田雪文. 基于iTRAQ的低氧运动肥胖大鼠肝脏蛋白质组学及Wnt/β-catenin信号通路的作用机制研究[D]. 上海:上海体育学院, 2018. [50] ARNSDORF EJ, TUMMALA P, CASTILLO AB, et al. The epigenetic mechanism of mechanically induced osteogenic differentiation. Biomech.2010;43(15):2881–2886. [51] VLAIKOU AM, KOUROUPIS D, SGOUROU A, et al. Mechanical stress affects methylation pattern of GNAS isoforms and osteogenic differentiation of hAT-MSCs.Biochim Biophys Acta Mol Cell Res. 2017; 1864(8):1371-1381. [52] HUM JM, DAY RN, BIDWELL JP, et al. Mechanical Loading in Osteocytes Induces Formation of a Src/Pyk2/MBD2 Complex That Suppresses Anabolic Gene Expression. Plos One.2014; 9(5):e97942. |
| [1] | Zhang Yu, Tian Shaoqi, Zeng Guobo, Hu Chuan. Risk factors for myocardial infarction following primary total joint arthroplasty [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1340-1345. |
| [2] | Xiao Guoqing, Liu Xuanze, Yan Yuhao, Zhong Xihong. Influencing factors of knee flexion limitation after total knee arthroplasty with posterior stabilized prostheses [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1362-1367. |
| [3] | Wang Haiying, Lü Bing, Li Hui, Wang Shunyi. Posterior lumbar interbody fusion for degenerative lumbar spondylolisthesis: prediction of functional prognosis of patients based on spinopelvic parameters [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1393-1397. |
| [4] | Yuan Jiawei, Zhang Haitao, Jie Ke, Cao Houran, Zeng Yirong. Underlying targets and mechanism of Taohong Siwu Decoction in prosthetic joint infection on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1428-1433. |
| [5] | Zhang Chao, Lü Xin. Heterotopic ossification after acetabular fracture fixation: risk factors, prevention and treatment progress [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1434-1439. |
| [6] | Gu Xia, Zhao Min, Wang Pingyi, Li Yimei, Li Wenhua. Relationship between hypoxia inducible factor 1 alpha and hypoxia signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1284-1289. |
| [7] | Wang Yongsheng, Wu Yang, Li Yanchun. Effect of acute high-intensity exercise on appetite hormones in adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1305-1312. |
| [8] | Wu Xun, Meng Juanhong, Zhang Jianyun, Wang Liang. Concentrated growth factors in the repair of a full-thickness condylar cartilage defect in a rabbit [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1166-1171. |
| [9] | Shen Jinbo, Zhang Lin. Micro-injury of the Achilles tendon caused by acute exhaustive exercise in rats: ultrastructural changes and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1190-1195. |
| [10] | Li Jing, Xie Jianshan, Cui Huilin, Cao Ximei, Yang Yanping, Li Hairong. Expression and localization of diacylglycerol kinase zeta and protein kinase C beta II in mouse back skin with different coat colors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1196-1200. |
| [11] | Tang Hui, Yao Zhihao, Luo Daowen, Peng Shuanglin, Yang Shuanglin, Wang Lang, Xiao Jingang. High fat and high sugar diet combined with streptozotocin to establish a rat model of type 2 diabetic osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1207-1211. |
| [12] | Chai Le, Lü Jianlan, Hu Jintao, Hu Huahui, Xu Qingjun, Yu Jinwei, Quan Renfu. Signal pathway variation after induction of inflammatory response in rats with acute spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1218-1223. |
| [13] | Geng Qiudong, Ge Haiya, Wang Heming, Li Nan. Role and mechanism of Guilu Erxianjiao in treatment of osteoarthritis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1229-1236. |
| [14] | Tan Jingyu, Liu Haiwen. Genome-wide identification, classification and phylogenetic analysis of Fasciclin gene family for osteoblast specific factor 2 [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1243-1248. |
| [15] | Li Zhongfeng, Chen Minghai, Fan Yinuo, Wei Qiushi, He Wei, Chen Zhenqiu. Mechanism of Yougui Yin for steroid-induced femoral head necrosis based on network pharmacology [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1256-1263. |
| Viewed | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
Full text 317
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Abstract 617
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||