Chinese Journal of Tissue Engineering Research ›› 2018, Vol. 22 ›› Issue (16): 2619-2624.doi: 10.3969/j.issn.2095-4344.0217
Management of biosamples transferred from hospitals to laboratories: main problems and solutions
Cheng Ming1, Jiang Feng2
- 1School of Biomedical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China; 2Chongming Branch of Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine & Xinhua Translational Institute for Cancer Pain, Shanghai 202150, China
-
Received:2018-01-23Online:2018-06-08Published:2018-06-08 -
Contact:Jiang Feng, M.D., Research assistant, Chongming Branch of Xinhua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine & Xinhua Translational Institute for Cancer Pain, Shanghai 202150, China -
About author:Cheng Ming, Master, Engineer, School of Biomedical Engineering, Shanghai Jiao Tong University, Shanghai 200240, China -
Supported by:the Medical Cross Foundation for the Youth of Shanghai Jiao Tong University, No. YG2016QN66
CLC Number:
Cite this article
Cheng Ming1, Jiang Feng2. Management of biosamples transferred from hospitals to laboratories: main problems and solutions[J]. Chinese Journal of Tissue Engineering Research, 2018, 22(16): 2619-2624.
share this article
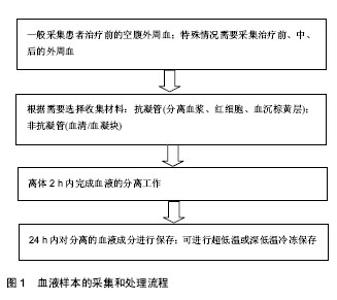
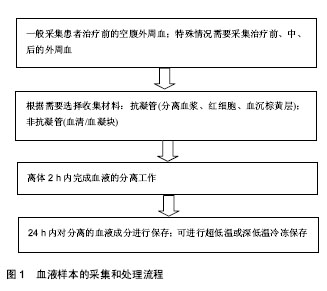
2.1 临床医师与基础研究者合作开展转化医学研究的必要性 转化医学的概念于2003年由美国国立卫生研究院(NIH)正式提出,至今已有十几年的时间[10]。中国的转化医学研究正处于起步阶段,在政府的大力支持下,势头强劲。转化医学研究起始之初即是基于临床需求出发,整个研究过程都应针对临床实际需求进行,促进研究成果的及时转化。目前,几乎所有的临床专业都已经进行或正在进行转化研究,也取得了一些鼓舞人心的成果。然而,必须清醒地认识到,目前中国转化医学研究成果的转化效率仍然不够高,转化成果对于临床实际的推动力仍然不够 强[11]。解决上述问题,不仅需要临床医师与基础研究者更加深入的探讨合作,更需要国家层面以及各级管理部门的积极引导,大力支持和保障科研成果的产出和转化。 事实上,由于临床与基础研究之间的巨大鸿沟,对于能够把握临床问题、判断患者疾病类型并可能获取患者生物样本的临床医师而言(尤其是基层和地方医院的医师),由于基础研究专业知识的欠缺,对于基础研究工作一头雾水,不知如何利用手中珍贵的生物样本资源;而对于拥有丰富研究经验的基础研究者而言,对于特异性疾病的认识非常有限,而仅仅利用细胞或动物模型去解释人类的各类疾病也是远远不够的[7,12]。因此,临床医师与基础研究工作者的合作对于转化医学研究的重要性不言而喻。作为一个人口大国,具有人口基数大,民族多样,病例资源丰富的特点,在人类遗传资源方面具有独特的优势。国外的研究机构和制药公司纷纷看中中国丰富的病例资源,来到中国寻求合作机会。丰富的人类疾病样本资源为中国的转化医学研究提供了得天独厚的优势。 近年来兴起的生物样本库就是很好的有助于实现转化医学的模式[13-15]。临床医师收集生物样本并集中保存于生物样本库中,通过生物样本库的统一规范化管理,再提供给临床和基础研究人员进行科学研究。中国最早的生物样本库是于1994年由中国科学院建立的中华民族永生细胞库;2010年,中国医药生物技术协会组织样本库分会成立,并于2011年出台了“中国医药生物技术协会生物样本库标准(试行)”,极大地推动了中国生物样本库的规范化发展。在国家及政府的大力支持下,国家级、各省市级以及各医院级的生物样本库蓬勃兴起,成为转化医学研究的有力支柱。然而目前,中国生物样本库,尤其是基层医院的生物样本库仍存在管理不规范、利用率低、伦理缺乏等诸多问题;且生物样本库本身耗资巨大,目前尚未有标准收费机制维持其运营成本,因此也并非所有城市及医院都可以建立起生物样本库[16-18]。基于此,目前很多临床医师和基础研究者仍然是以个人及实验室为单位进行靶向性的合作。 这种以个人及实验室为单位进行的靶向性的合作是十分重要且必要的,可极大程度地利用临床医师手中的病例资源,又可避免由于不必要的样本储存而造成的资源浪费。同时,这种靶向性的合作通常基于更加完善的课题设计,因此通常能够更快更好地获得预期研究成果。事实上,临床医师与基础研究者的合作不应仅仅局限于疾病相关的人体生物样本的供给关系,更应该是从具体临床疾病本身出发,由临床医师通过临床观察分析为基础研究者的科学研究提供思路,最终将研究成果应用于临床。只有通过这样的合作方式,才能真正有效利用珍贵的人体生物样本资源,解决临床上最亟需解决的问题,最终实现双赢的模式。 2.2 临床与基础研究实验室生物样本对接管理中的主要问题及对策 在临床医师与基础研究者的科研合作中,疾病相关的人体生物样本无疑是合作的核心和关键。这其中涉及到生物样本采集的伦理问题,样本采集标准流程的设定、样本的采集、运输、保存、登记和管理,以及样本相关的知识产权分割等问题。 2.2.1 生物样本采集的伦理问题 建立完善的人体生物样本相关的伦理审查、知情同意和隐私保护制度是保护捐献者利益的关键[19]。任何涉及人体生物样本的采集均需通过科学技术管理委员会和伦理委员会的审批。事实上,任何涉及人体生物样本的课题在立项之前,就应向科学技术管理委员会和伦理委员会提出立项申请,并提交相应的生物样本采集方案。科学技术管理委员会和伦理委员会应召开正式会议讨论该申请,并做书面会议记录。审核通过后,科学技术管理委员会和伦理委员会应签发正式的书面意见书。伦理审核通过后,方可开展相关的样本采集工作[20]。 所有的涉及人体生物样本的采集必须获得捐赠者的知情同意。知情同意书应当通俗易懂,捐献者或其法定监护人应能够从知情同意书中获取足够的信息以便其自主地决定是否捐献样本及其个人信息。生物样本的采集不应影响患者的诊断和治疗。采集的生物样本应仅供科学研究,不得进行商业出售。同时,做好捐献者的隐私保护工作十分重要,应保护捐献者权益不受侵犯[20-21]。 2.2.2 生物样本采集标准流程的设定 疾病相关的临床生物样本在转化医学研究中的重要性不言而喻,但能够接触到患者生物样本的临床医师究竟应该收集何种生物样本、收集的数量、如何收集,以及后续如何运输、保存等仍需要临床医师与基础研究者的共同探讨和沟通。对于临床医师来说,尽管对疾病本身非常熟悉,可由于对基础研究了解有限,并不清楚哪些样本可以用于哪些研究,以及这些样本该如何收集、运输和保存;而对于基础研究者来说,对疾病的认识度也十分有限,并不清楚哪些样本是可以获得的,样本取用量可以达到多少。尤其对于一些特殊患者,例如重症患者、幼儿患者来说,可以取用的样本量十分有限,但基础工作者往往对此并不知晓。针对上述有限的样本量,基础研究者需要提前设置并优化好实验条件,争取能够利用最少的样本量做最多的实验,获取最多的科研成果。因此,针对特定转化医学合作研究来说,需要双方在进行合作之前就进行深入的沟通,共同设计并优化研究方案,使其更加合理可行。在此基础上,设定针对特定研究项目的生物样本采集标准操作流程,对于保证样本质量能够适用于后续的转化医学研究十分重要,可以尽可能地稳定样本的质量,防止由于采集人的不同而导致样本采集的差异性[22-23]。 2.2.3 生物样本的采集 高质量的生物样本是保证转化医学研究科学性和准确性的关键因素[24]。生物样本在采集之初就应保证其质量的可靠性,可用于后续的科研工作中。生物样本的采集又可分为采集前、采集中和采集后。 (1)样本采集前:临床医师应当收集患者个人信息、临床信息、实验室检验数据等,并将其详细记录下来,作为后续科学研究重要的参考内容;同时,临床医师应确认样本采集前患者的生理病理、饮食和用药情况,并对这些样本进行详细的注释,以明确样本采集前患者的状态等对于实验结果的影响。当采集的生物样品具有感染性时,应设立有效的防止病原扩散的措施[25-26]。 (2)样本采集中:临床医师应当根据已建立的标准操作流程进行样本采集,防止由于标本采集人的不同而导致样本采集的差异性;在样本采集过程中,临床医师应明确区分采集样本的类型,例如采集癌症患者标本时,应明确区分癌症标本和癌旁标本,必要时可请教病理科医师,保证取样的科学性和严谨性。尽可能在最短的时间内完成样本的采集,不适当的采集处理时间将直接影响和干扰研究的结果。例如,组织样本的采集要求必须在手术标本离体后30 min内完成,样本取材的顺序应遵循距离肿瘤病灶中心由远及近的原则[26-27]。 (3)样本采集后:生物样本从患者体内取出后应当尽快予以适当方式的保存,例如组织样本应迅速分割成适当大小和份数,加入适当的样本保护液或者直接投入液氮中进行快速冷冻。通常情况下,应用不同目的的样本采集后的处理方式有所不同。例如用于RNA提取等特殊要求的样本应在离体30 min内投入液氮中进行保存;用于DNA提取的标本应在离体2 h内低温保存;用于活细胞培养及观察的样本,应在离体4 h之内低温保存;用于普通染色及观察的标本,应在离体24 h内低温保存。随着各类生物样本保护剂的出现,极大程度地突破了上述时间的限制,使得采集后的样本短暂保存变得十分便利[26,28-29]。 在实验室与临床的科研合作中,需非常重视生物样本采集的质量控制,针对特定的科研项目设置了特异性的样本收集的标准操作流程。如图1,显示了血液样本的采集和处理过程。临床医师根据流程采集患者样本,保证了采集样本的质量和稳定性。"
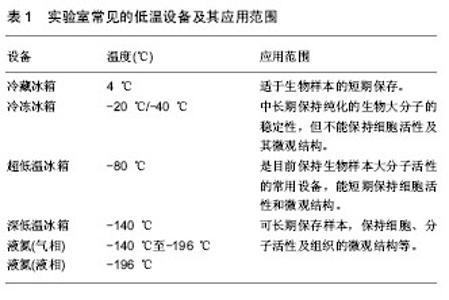
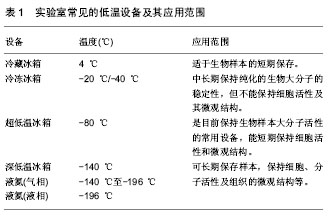
2.2.4 生物样本的运输 生物样本的运输方式也是影响其质量的重要因素[25,27,30]。所有人体相关的生物样本都应被视为具有潜在的生物危害风险,因此样本的包装和运输应严格遵循国家的相关规定。之前人们通常采用冰上运输或干冰运输等方式运送生物样本,这样的运输方式限制了样本的运输时间不能过长,路途不能过远,一定程度上阻碍了临床医师与基础研究者的科研合作。尤其对于异地合作而言,样本的运输问题更成为了影响合作的一个大问题。随着近年来各种类型生物样本保护剂的出现,例如RNAlater, Allprotect、DNA/RNAstable等样本保护剂,可保证即使在室温条件下进行运输,短时间内也不会影响样本的质量[29]。因此使用类似上述样本保护剂,非常适用于样本的短期运输,可用于将样本转移至更为稳定的保存环境之前的暂时保存。样本保护剂的出现,极大地方便了生物样本的运输过程,既保证了样本在运输过程中质量的稳定性,又降低了运输成本。尤其对于异地科研合作项目来说,这样的运输方式显得尤为重要。鉴于此,通常选用RNAlater对组织样本进行保护,并尽快运输至稳定的保存环境处,充分保证了样本的质量能够用于后续的科研工作中。 2.2.5 生物样本的保存及后期质量控制 对于特定研究型实验室来说,大多数具备样本保存的条件(液氮、-80 ℃冰箱、-20 ℃冰箱、4 ℃冰箱等,如表1)。各种不同类型的样本应给予不同的保存条件,并按照实验的要求分割成适当的大小和份数分别保存,避免反复冻融。例如,血液样本通常需要先将血清、血浆、白细胞等预先分离出来,再分别冻存;用于DNA,RNA 提取及后续其他分子生物学研究的样本可以将组织切割成直径小于1 cm的组织块,然后分装冻存;用于普通染色观察的标本,可用4%甲醛溶液常温固定,大约可保存1个月左右[24,31-32]。"
| [1] Fudge N,Sadler E,Fisher HR,et al.Optimising Translational Research Opportunities: A Systematic Review and Narrative Synthesis of Basic and Clinician Scientists' Perspectives of Factors Which Enable or Hinder Translational Research. PloS one. 2016;11(8):e0160475.[2] Marjanovic S,Soper B,Ismail S,et al.Changing the Translational Research Landscape: A Review of the Impacts of Biomedical Research Units in England. Rand health quarterly.2012;1(4):12. [3] Sofaer N,Eyal N.Translational research beyond approval: a two-stage ethics review. The American journal of bioethics: AJOB. 2010;10(8):W1-3. [4] 姬小利,李倩,吕志宝,等. 精准医学背景下生物样本库发展中存在的问题及对策[J]. 中华医院管理杂志,2016,32(9):692-694. [5] Anandagoda N,Lord GM.Boosting translational research in the U.K. Science translational medicine.2016;8(357):357fs15.[6] Kimmelman J, Kesselheim AS. Translational research and the U.S. federal elections. Science translational medicine. 2016;8(361):361ed13. [7] 阴赪宏,孙芳芳,齐海宇,等.以转化医学理念指导临床科学研究[J]. 医学研究杂志, 2011,40(1):23-5. [8] 赵玉沛.加快转化医学发展,促进医学模式转变[J].中华医学杂志, 2011, 91(4):217-9. [9] [No authors listed] .Perspectives in Translational Research in Life Sciences and Biomedicine. Anticancer research. 2016;36(8):4373. [10] 张鹏,秦岭. 转化医学:基础医学与临床医学实践的桥梁[J].实用医学杂志, 2010;26(18):3277-3279. [11] 时占祥,詹启敏,顾申,等. 转化医学在中国:五年回顾与展望[J].科学通报, 2015,(22):2151-2156. [12] 吴静,顾怡珺,周君梅. 我院生物样本库“一病一卡”管理制度的建立与应用[J]. 中华医院管理杂志,2013,29(11):866-867. [13] Meir K, Gaffney EF, Simeon-Dubach D, et al.The Marble Arch International Working Group On Biobanking MM. The human face of biobank networks for translational research. Biopreserv Biobank. 2011;9(3):279-285. [14] Lassalle S,Hofman V,Ilie M,et al. Setting up a Prospective Thyroid Biobank for Translational Research: Practical Approach of a Single Institution (2004-2009, Pasteur Hospital, Nice, France). Biopreserv Biobank. 2011;9(1):9-19. [15] 陆怡. 转化医学与生物样本库现状[J].生命的化学,2012,32(3):287-293. [16] 董哲君,肖飞,郭健.生物样本库建立现况及进展[J].中华检验医学杂志, 2013,36(2):130-135. [17] 刘克新,郑琳,王莹, 等.生物样本库的现状及研究进展[J].中国病案, 2014, 15(9):32-34. [18] 张雪娇,李海燕,龚树生.国内生物样本库建设现状分析与对策探讨[J].中国医院管理, 2013,33(7):76-77. [19] 李昆. 临床病例生物样本库建设及其面临的医学伦理问题[J]. 西南军医, 2015,17(6):696-698. [20] Saha K, Hurlbut JB. Research ethics: Treat donors as partners in biobank research. Nature.2011;478(7369):312-313.[21] Wolf SM. Return of results in genomic biobank research: ethics matters. Genet Med. 2013;15(2):157-159.[22] 胡庆澧.上海重大疾病临床样本库伦理管理指南[J].中国生物样本库国际研讨会暨中国生物样本库发展战略高峰论坛,2013.[23] 丁桂龄,何妙侠,郑建明.临床生物样本库的建立、管理与质量控制[J].临床与实验病理学杂志,2015,31(11):1301-1303. [24] 张育军,高芳芳,彭卫康,等.生物样本库质量控制体系建立的经验和体会[J].转化医学杂志,2014(3):170-173. [25] 胡颖,张连海,宋丽洁, 等.生物样本质量的影响因素与评估[J].中国医药生物技术, 2013,8(1):69-72. [26] 中国医药生物技术协会生物样本库标准(试行) [J]. 中国医药生物技术, 2011(1):71-79. [27] 蒋超,曹日昇,陈俊娣,等. 生物样本库样本质量控制体系建立的初步探索[J].江苏医药,2016,42(2):198-200. [28] Forster JL, Harkin VB, Graham DA, et al. The effect of sample type, temperature and RNAlater on the stability of avian influenza virus RNA. J Virol Methods. 2008;149(1):190-194. [29] Medeiros M, Sharma VK, Ding R,et al. Optimization of RNA yield, purity and mRNA copy number by treatment of urine cell pellets with RNAlater. J Immunol Methods. 2003;279(1-2):135-142. [30] 隋鑫. 生物样本库质量控制体系的构建研究[J].科学与财富, 2015,(18): 120. [31] 姚静怡,杨爱婷, 李秀红,等.样本库质量控制评估体系的建立[J]. 临床和实验医学杂志,2015,14(21):1758-1760. [32] 阮亮亮,郑培永,杨佳泓,等.生物样本库RNA质量控制的方法学验证[J]. 转化医学杂志, 2015,4(3):161-165. [33] Campbell LD, Betsou F, Garcia DL, et al. Development of the ISBER Best Practices for Repositories: Collection, Storage, Retrieval and Distribution of Biological Materials for Research. Biopreserv Biobank. 2012;10(2):232-233. [34] Auer H, Mobley JA, Ayers LW,et al. The effects of frozen tissue storage conditions on the integrity of RNA and protein. Biotech Histochem. 2014; 89(7):518-528. [35] Chu TY, Hwang KS, Yu MH,et al. A research-based tumor tissue bank of gynecologic oncology: characteristics of nucleic acids extracted from normal and tumor tissues from different sites. Int J Gynecol Cancer. 2002;12(2):171-176. [36] 郭爱华,张翠,余永国,等.二维码技术在生物样本库编码中的应用与评价[J].中国医药生物技术,2012,7(4):306-308. [37] 王琼,邹宇辉,林春发,等.医院生物样本库管理系统[C].2014中华医院信息网络大会,2014.[38] 俞红,王从容.生物样本库信息管理系统的设计和实现[J].中国数字医学, 2013,(10):79-81. [39] 唐密. 生物样本库共享理论与实证研究[D].复旦大学,2014.[40] Akervall J,Pruetz BL,Geddes TJ,et al.Beaumont health system biobank: a multidisciplinary biorepository and translational research facility. Biopreserv Biobank.2013;11(4):221-228.[41] 樊光辉.聚力推进转化医学创新发展[J].转化医学电子杂志, 2016,3(1): 1-4. |
| [1] | Zhang Tongtong, Wang Zhonghua, Wen Jie, Song Yuxin, Liu Lin. Application of three-dimensional printing model in surgical resection and reconstruction of cervical tumor [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(9): 1335-1339. |
| [2] | Zeng Yanhua, Hao Yanlei. In vitro culture and purification of Schwann cells: a systematic review [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1135-1141. |
| [3] | Xu Dongzi, Zhang Ting, Ouyang Zhaolian. The global competitive situation of cardiac tissue engineering based on patent analysis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 807-812. |
| [4] | Wu Zijian, Hu Zhaoduan, Xie Youqiong, Wang Feng, Li Jia, Li Bocun, Cai Guowei, Peng Rui. Three-dimensional printing technology and bone tissue engineering research: literature metrology and visual analysis of research hotspots [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 564-569. |
| [5] | Chang Wenliao, Zhao Jie, Sun Xiaoliang, Wang Kun, Wu Guofeng, Zhou Jian, Li Shuxiang, Sun Han. Material selection, theoretical design and biomimetic function of artificial periosteum [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 600-606. |
| [6] | Liu Fei, Cui Yutao, Liu He. Advantages and problems of local antibiotic delivery system in the treatment of osteomyelitis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 614-620. |
| [7] | Li Xiaozhuang, Duan Hao, Wang Weizhou, Tang Zhihong, Wang Yanghao, He Fei. Application of bone tissue engineering materials in the treatment of bone defect diseases in vivo [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 626-631. |
| [8] | Zhang Zhenkun, Li Zhe, Li Ya, Wang Yingying, Wang Yaping, Zhou Xinkui, Ma Shanshan, Guan Fangxia. Application of alginate based hydrogels/dressings in wound healing: sustained, dynamic and sequential release [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 638-643. |
| [9] | Chen Jiana, Qiu Yanling, Nie Minhai, Liu Xuqian. Tissue engineering scaffolds in repairing oral and maxillofacial soft tissue defects [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(4): 644-650. |
| [10] | Xing Hao, Zhang Yonghong, Wang Dong. Advantages and disadvantages of repairing large-segment bone defect [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(3): 426-430. |
| [11] | Chen Siqi, Xian Debin, Xu Rongsheng, Qin Zhongjie, Zhang Lei, Xia Delin. Effects of bone marrow mesenchymal stem cells and human umbilical vein endothelial cells combined with hydroxyapatite-tricalcium phosphate scaffolds on early angiogenesis in skull defect repair in rats [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3458-3465. |
| [12] | Wang Hao, Chen Mingxue, Li Junkang, Luo Xujiang, Peng Liqing, Li Huo, Huang Bo, Tian Guangzhao, Liu Shuyun, Sui Xiang, Huang Jingxiang, Guo Quanyi, Lu Xiaobo. Decellularized porcine skin matrix for tissue-engineered meniscus scaffold [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3473-3478. |
| [13] | Mo Jianling, He Shaoru, Feng Bowen, Jian Minqiao, Zhang Xiaohui, Liu Caisheng, Liang Yijing, Liu Yumei, Chen Liang, Zhou Haiyu, Liu Yanhui. Forming prevascularized cell sheets and the expression of angiogenesis-related factors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3479-3486. |
| [14] | Liu Chang, Li Datong, Liu Yuan, Kong Lingbo, Guo Rui, Yang Lixue, Hao Dingjun, He Baorong. Poor efficacy after vertebral augmentation surgery of acute symptomatic thoracolumbar osteoporotic compression fracture: relationship with bone cement, bone mineral density, and adjacent fractures [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3510-3516. |
| [15] | Liu Liyong, Zhou Lei. Research and development status and development trend of hydrogel in tissue engineering based on patent information [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(22): 3527-3533. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||