Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (26): 4254-4264.doi: 10.12307/2023.528
Muscle effect, dose-effect relationship, and physiological mechanism of KAATSU-resistance training
Lei Senlin1, Zhang Minghui2, Ma Chunlian3, Gao Weifeng4, Xia Xiaoyan1, Dong Kunwei1
- 1College of Arts, 2College of Physical Education, 3College of Health Sciences, 4College of Sports Training, Wuhan Sports University, Wuhan 430079, Hubei Province, China
-
Received:2022-08-04Accepted:2022-08-29Online:2023-09-18Published:2023-01-28 -
Contact:Dong Kunwei, Associate professor, College of Arts, Wuhan Sports University, Wuhan 430079, Hubei Province, China -
About author:Lei Senlin, Master candidate, College of Arts, Wuhan Sports University, Wuhan 430079, Hubei Province, China -
Supported by:the National Natural Science Foundation of China, No. 82100440 (to MCL); Natural Science Foundation of Hubei Province, No. 2021CFB496; Research and Innovation Team Project of Wuhan Sports University, No. 21KT04
CLC Number:
Cite this article
Lei Senlin, Zhang Minghui, Ma Chunlian, Gao Weifeng, Xia Xiaoyan, Dong Kunwei. Muscle effect, dose-effect relationship, and physiological mechanism of KAATSU-resistance training[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(26): 4254-4264.
share this article

2.1 加压抗阻训练诱发的肌肉训练效应 训练会产生肌肉适应及神经适应[14],比如肌纤维增加强化力量表现、血管增生和有氧氧化酶活性升高从而增强肌肉耐力以及促进运动神经元兴奋能力增强。传统抗阻训练可引起乳酸等代谢产物的积累,促进肌肉合成相关激素的分泌,进而导致肌肉肥大而增强肌肉力量和耐力[15]。自从加压手段被应用于抗阻训练中以来,学者们发现加压抗阻训练不仅能促进肌肉适应,而且相比传统抗阻训练在促进神经适应方面还有着更多的效益。 2.1.1 加压抗阻训练强化肌肉力量表现 力量表现的定义为肌肉对外界阻力所产生力量的能力。肌肉肥大及运动神经元兴奋能力增强是影响力量表现的主要因素[14]。前期加压抗阻训练的试验研究主要探讨了长期中小运动强度加压抗阻训练对肌肉适应程度的改变,侧重点在于考量骨骼肌肥大以及肌肉力量增加2个主要指标。YAMANAKA等[16]和YASUDA等[17]相继刊文指出,在相同强度的抗阻训练过程中实施加压干预能够更加有效地促进骨骼肌肥大,增加肌肉力量。YAMANAKA等[16]对高水平足球运动员采用20%1RM的强度进行为期4周、每周3次、每次训练包括3组20次深蹲及卧推抗阻训练后,发现加压组卧推及深蹲1RM的质量分别增加7.0%和8.0%,胸围及腿围均增加3%,而非加压组各指标均无显著变化。YASUDA等[17]安排10名初级训练者以30%1RM的强度进行每天2次、每周6 d、持续2周的高频卧推训练,加压组在此基础上还进行上肢递增强度的加压干预,压力从100 mmHg逐级递增到160 mmHg(每天增加10 mmHg),结果发现加压组肱三头肌和胸大肌厚度比训练前分别增加8%和16%,显著高于非加压组的1%和2%,加压组卧推1RM提升了6%,而非加压组降低了2%。DAVIDS等[18]进一步研究发现,加压联合低强度抗阻训练能够产生与非加压高强度抗阻训练相似的增肌效果。21名抗阻训练爱好者以60%AOP压力联合30%-40%1RM的低强度进行9周抗阻训练,结果发现加压联合低强度抗阻训练对促进下肢肌肥大、提高膝关节屈等距峰值扭矩方面与75%-80%1RM的高强度抗阻训练效果相当,但75%-80%1RM高强度抗阻训练能使深蹲1RM的质量增加(73.7±2.7)%,而加压联合低强度抗阻训练只使其增加(30.5±3.3)%,提示加压联合低强度抗阻训练具有提高肌肉体积的优势,而在提高肌肉力量方面却不及高强度抗阻训练。 然而,国内有学者对高水平手球运动员进行一系列加压抗阻训练的研究却表示,加压联合低强度抗阻训练对于精英运动员肌肉力量、肌肉功能的提升效果均能够达到高强度抗阻训练相似的效果,甚至更佳[19-21]。运动员进行下肢加压联合低强度抗阻训练后,膝关节等速肌力以及部分核心肌群的最大力量提升效果明显优于传统高强度抗阻训练[19];同时加压训练能更加有效地促进与肌肉合成相关激素和生物活性因子的良性变化[20];且对于等速肌力、下肢爆发力、无氧代谢能力的部分指标影响效果与传统高强度抗阻训练相当,并在提升运动员股后肌群力量、纵跳能力、短时冲刺跑和灵敏素质方面还优于传统抗阻训练[21]。与以上研究结果相似,最新研究发现,持续6周的递增加压(160 mmHg增加至200 mmHg)联合低强度膝关节屈伸抗阻训练在提升受训者肌肉力量和横截面积方面均能达到传统高强度抗阻训练后相似的增益程度[3]。有趣的是,部分研究结果显示抗阻训练中实施加压干预并不能给肌肉适应带来增益效果。BRUMITT团队[22-23]通过系列试验研究表示,在持续8周、每周2次的低频次抗阻训练中,相同运动强度下加压组与非加压组受训者的肩袖小肌群肌肉肥大程度以及肌肉力量的改变均无差异。新近一份研究结果还表明,6周加压联合低强度抗阻训练对受试者小腿肌群的力量增益效果也远不及传统高强度抗阻训练[24]。尽管现阶段结果不尽相同、研究结论说法不一,其中的原因可能受到训练方案、加压方式、受试者的训练水平以及肌肉测量部位的差异等因素影响,因而导致各研究所报告的试验结果及结论一致性不高。但对于较高运动水平的受试者来说,加压抗阻训练总体上仍呈现出对受训者肌肉肥大或肌肉力量带来增益效果的潜在作用。这在加压训练对下肢肌肉影响的Meta分析中得到进一步的验证[25],分析显示加压抗阻训练既可以显著提升下肢伸肌最大力量(WMD=14.95,95%CI 10.07-19.83,P < 0.01),同时也能显著增加股四头肌横截面积(WMD=4.07,95%CI 1.47-6.68,P < 0.01)。 表1汇总了加压抗阻训练强化肌肉力量表现的试验研究。"


2.1.2 加压抗阻训练提升肌肉耐力表现 耐力表现指肌肉在一定时间内保持特定运动负荷或动作质量的能力。既往研究表示提升其表现的运动干预方式通常为中低强度的耐力训练[36],但目前国内外新近研究均指出加压联合低强度抗阻训练不仅能够改善受训者的心肺耐力[12,33,37-42],其肌肉耐力也能显著提升[43-48]。国内学者对于加压抗阻训练影响肌肉耐力表现的研究聚焦于血液载氧及肌肉摄氧的能力提升方面[49-51]。潘颖等[50]对受试者进行4组加压联合腿屈伸的低强度抗阻训练,结果发现相比单纯抗阻训练组,加压组血氧饱和度显著降低,运动后血流速度升高。于亮等[51]在2周下肢深蹲训练中观察到加压干预能够显著增加受试者左心室射血分数以及心输出量水平。国外学者还发现,为期8周的加压抗阻训练能够改善受试者血流动力学反应,显著降低收缩压(-10 mmHg,P=0.020)[52]。最新研究也表示,以20%1RM的强度进行膝关节屈伸抗阻训练力竭后发现,加压组微血管氧合的平均变化速率比未加压组高43%[53]。上述试验数据表明相较于单纯抗阻训练,加压刺激更有利于提高心血管功能以及肌肉组织利用氧的能力。 Wilk团队[43-48,54]在近两年进行了有关加压抗阻训练对力量耐力产生增益效应的系列研究。单次卧推加压抗阻训练中设计加压及未加压的对比研究,结果发现不同加压压力,比如70%AOP的低加压[47]、150%AOP的高加压[43],以及不同加压方式,比如持续加压和间歇加压[44,54],均能使重复次数、肌张力下降持续时间、峰值功率、平均功率等反映肌肉耐力的指标显著升高,且高于非加压组。上述研究表示,在抗阻训练中实施加压干预比单纯的抗阻训练更能提升受训者的肌肉耐力表现。然而,CHATLAONG等[55]对受试者膝关节加压抗阻训练研究发现,在低强度的抗阻训练基础上无论是进行80%AOP的高压力干预还是进行40%AOP低压力干预,加压抗阻训练对于耐力表现的提升程度均不及单纯高强度抗阻训练组。加压抗阻研究中上、下肢的训练部位不同、施压压力及时间不同、耐力检测指标及时间不同等可能是产生研究结果分歧的原因。 表2汇总了加压抗阻训练提升肌肉耐力表现的试验研究。"

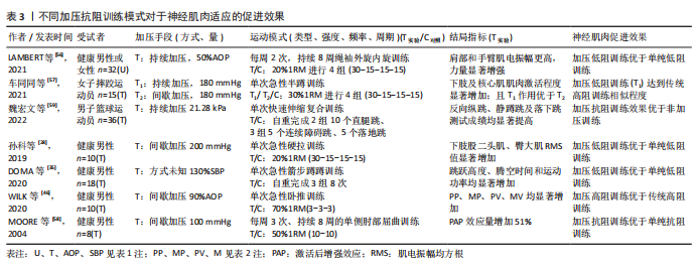
2.1.3 加压抗阻训练促进神经肌肉适应 肌肉适应及神经适应是影响肌肉功能表现的主要因素[14]。越来越多的研究显示,加压抗阻训练相比单纯的抗阻训练不仅能促进肌肉适应,而且在促进神经适应方面表现出更多的优势[10,28,50,56-57]。潘颖等[50]研究发现,进行4组低强度伸膝抗阻训练后,受试者下肢股外侧肌产生的神经肌肉激活程度较低,而在抗阻训练基础上实施加压刺激可进一步增强神经肌肉激活,并能达到高强度抗阻训练对神经肌肉激活相似的程度。孙科等[28]报道称,在相同强度的下肢单次急性抗阻训练中,加压组下肢股二头肌、臀大肌肌电振幅均方根(root mean square,RMS)显著大于非加压组,说明加压干预能提高神经对股二头肌和臀大肌肌纤维的募集。车同同等[57]进一步研究发现,在下肢半蹲抗阻训练中相比非加压干预,加压干预不仅能显著提升原动肌RMS值,而且能显著提高腹直肌、腹外斜肌以及竖脊肌的RMS值。LAMBERT等[56]对32名受试者进行8周肩袖肌群加压及非加压抗阻训练的对比研究,结果发现加压组以50%AOP的压力干预可以促进肩袖肌群肌电振幅的显著升高。 加压抗阻训练促进神经肌肉适应还体现在诱导激活后增强效应(post-activation potentiation,PAP)发生方面[35,46,58-59]。MOORE等[58]在上肢加压抗阻训练的试验中发现,当安排受试者以100 mmHg的加压压力,以50%1RM的运动强度进行单臂肘屈伸训练后,加压干预能够导致PAP效应量增强51%。WILK等[46]同样进行上肢加压训练,但以90%AOP的闭塞压力和70%1RM的运动强度进行3组3次重复的卧推训练,结果发现无论有无加压干预第2组卧推的峰值输出功率以及峰值速度均显著高于第1组(PAP效应发生),而加压组PAP效应量显著高于非加压对照组。在下肢加压训练中,DOMA等[35]对受试者实施加压弓箭步训练方案后的6-15 min内发现,受试者跳跃高度、腾空时间和运动功率均显著增加。魏宏文等[59]进一步研究发现,加压刺激后的快速伸缩复合训练比单纯快速伸缩复合训练对PAP激活的效益更高,尽管两种模式均能够诱导受试者跳跃测试表现显著提升,但前者产生PAP作用的持续时间更长为16 min,显著高于后者的4-8 min。综上,加压抗阻训练能够促进神经肌肉适应,主要表现为促进神经对肌纤维的募集和激活后增强效应两个方面。 表3汇总了加压抗阻训练促进神经肌肉适应的试验研究。"

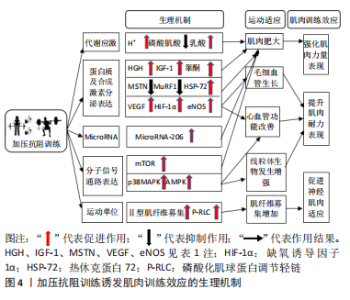
2.2 不同加压量与肌肉训练效应的量效关系 加压压力是加压抗阻训练增加代谢刺激诱发训练效应的重要指标。目前,常用的加压压力指标有AOP和静息肢体闭塞压(resting limb occlusion pressure,LOP),通常以AOP或LOP的百分数或动脉血压值代表加压压力的高低,加压形式一般分为持续加压和间歇加压。不同训练水平人群进行加压抗阻训练的敏感压力不同,以不同的压力进行抗阻训练对肌肉的力量及耐力会产生不同的训练效果。因此,梳理加压抗阻与肌肉训练的量效关系,寻找不同肌肉训练目的下的敏感压力具有重要的实践指导意义。 2.2.1 加压量与肌肉力量表现的量效关系 系列有关加压抗阻训练强化力量表现的试验研究发现,闭塞压力越高,其刺激效果就越明显。SUGA等[60]对26名健康受试者进行3组90次加压联合低强度跖屈训练,对比分析高加压压力(200 mmHg)和低加压压力(100 mmHg)对机体代谢和应激的影响,结果发现高加压压力所引起的机体代谢压力以及应激产物累积水平均显著高于低加压压力。LIMA等[4]对受试者进行长期手臂加压抗阻训练后发现,以100%AOP[(233±8) mmHg]的高加压压力联合低强度抗阻训练所诱导的氧化应激和肌肉损伤刺激显著高于50%AOP[(108±5) mmHg]的低闭塞压力。研究发现,不同加压压力的抗阻训练对肌肉合成相关激素水平的影响也存在不同。YINGHAO等[31]以30%1RM的低强度对受试者进行6组共计90次膝关节屈伸的抗阻训练,对比研究在相同强度抗阻训练中不同加压压力对肌肉生成相关激素的影响。结果发现,70%AOP的高加压压力诱导血清中的生长激素、胰岛素样生长因子1以及睾酮等促进肌肉蛋白合成的激素水平显著高于40%AOP的低加压压力。上述急性加压抗阻训练的研究均从促进肌肉增长的合成激素层面印证了更大的加压量对肌肉力量表现的提升效果更加有效这一论点。从目前国际上有关加压抗阻训练的实验研究来看,学界缺乏对于不同闭塞压力的长期加压抗阻训练后力量表现提升效果的差异研究,可能的原因是同一闭塞压力会由于运动周期的延长而导致对受试者的刺激效果减弱,因此学者们普遍设计的加压干预方式为逐级递增的闭塞压力。多项研究相继刊文指出,随着运动干预周期的延长,无论是采取逐天增压或逐周增压,或是从低压逐渐增长到中压(100-160 mmHg)、还是从中压增长到高压(160-200 mmHg),递增闭塞压力的加压方式干预下肌肥大以及肌肉力量的提升效果越来越佳,呈现一种递增趋势[3,17,61]。YASUDA等[17]对受试者采用6周递增加压干预的下肢抗阻训练后发现,第3周中测时(闭塞压力为180 mmHg)的肌肉CSA%增加幅度显著大于第1周前侧时(160 mmHg),同时显著小于第6周后侧时(200 mmHg)的增幅;同时标志着肌肉生长的睾酮、胰岛素样生长因子1以及类胰岛素生长因子结合蛋白1(IGFBP1)的表达分泌水平也随着加压以来的增加而急剧增加,提示长期加压抗阻训练中更高的闭塞压力能够带来更佳的肌肉力量表现增益效果。 值得注意的是,也有研究表明加压闭塞压力并非越大越好。李卓倩等[11]依次对受试者进行4组杠铃深蹲、哑铃屈臂和伸臂加压抗阻训练,对比分析上下肢的低、中、高的不同加压压力下血清激素水平的变化,抗阻训练强度为30%1RM,低加压压力为上肢100 mmHg、下肢140 mmHg,中加压压力为上肢140 mmHg、下肢180 mmHg,高加压压力为上肢180 mmHg、下肢220 mmHg。结果发现,加压抗阻训练在促进肌肉合成相关的生长激素、睾酮等激素分泌的作用中,中加压压力优于低加压压力,低加压压力优于高加压压力。以上结果提示,加压抗阻训练中在一定的加压压力范围内,加压压力越高对机体产生的刺激越大,产生的训练效应越好。然而,伴随加压压力的升高,阻断血流的作用也越来越强,当压力达到某个高度值时加压干预对机体的刺激作用达到最强增益效应最高,而当压力高于临界值时,由于血流阻断过于强烈反而导致加压干预的增益效应下降,加压压力与肌肉力量表现的可能是一种“倒U型”的量效关系。 2.2.2 加压量与肌肉耐力表现的量效关系 ZHAO等[12]以30%1RM的强度对健康男性进行长期高频(持续8周,每周5次)肘关节屈伸抗阻训练,对比分析无加压、低加压(65%AOP)以及高加压(130%AOP)干预对肌肉耐力相关指标的影响,结果发现,相比无加压干预,加压干预可以使肌肉中代表毛细血管增殖的血管内皮生长因子(vascular endothelial growth factor,VEGF)、VEGFR等蛋白表达显著上调,同时使受试者静息心率及心输出量均显著降低,提示加压干预不仅能提高肌肉耐力而且能提高心肺耐力,且低加压组显著优于高加压组。于亮等[51]研究不同的加压压力联合下肢抗阻训练对健康男性身体成分及心血管功能的影响,其中抗阻训练强度为30%1RM,中、高加压压力分别为250,300 mmHg,结果发现,250 mmHg的中等加压压力联合抗阻训练能显著提高受试者骨骼肌含量、左心室射血分数和心输出量,效果优于300 mmHg的高加压压力。MORLEY等[38]对比研究8周不同加压压力联合膝关节屈伸抗阻训练力竭对肌肉耐力和有氧代谢指标的影响,结果发现相比无加压抗阻训练,加压抗阻训练能显著促进受试者的肌肉耐力、O2饱和度(TSL%)以及血乳酸水平,其中低加压抗阻训练组(50%LOP)的累积脱氧应力(TSL%×时间)还显著高于高加压抗阻训练组(100%LOP)。国内学者芦劼明等[49]对不同加压压力联合20%1RM的抗阻强度进行12周加压负重半蹲抗阻训练的研究也发现,加压组的最大摄氧量、心输出量以及射血分数等心肺耐力功能指标均显著大于非加压组,然而高加压组(180 mmHg)和低压组(120 mmHg)以上相关指标并无显著差异,提示在提升心肺耐力的效应中继续较高的加压压力相比低加压压力并未表现出更大的优势。最新的一项研究也发现,当采用15%1RM的较低抗阻强度进行训练,80%AOP和40%AOP的不同加压强度对受试者的耐力影响并无差别[55]。 有证据表明,肌内压力、O2分压以及H+等代谢产物的浓度达到某一阈值时,代谢压力反射会被激活[62]。在加压抗阻训练中,即使中小的加压压力也可能引起肌内压力、O2分压以及H+等代谢产物的浓度的变化,进而激活代谢反射以促进肌肉组织、心血管系统的代谢和应激反应变化。潘颖等[10]研究发现,以60% AOP的加压压力进行训练可明显影响交感神经活性和交感-副交感调控的平衡性,而当加压压力达到 80%AOP时会显著诱发外周疲劳。随着加压压力的增加,由于肌肉内代谢应激和交感神经的过度激活而导致代谢产物以及疲劳积累可能造成高加压压力增益效应降低的原因,所以,在长期的加压抗阻训练中加压压力与训练增益效应并非线性量效关系。值得注意的是,在一次性的加压抗阻训练中,加压压力与训练增益效果的关系跟长期加压抗阻训练存在不同。WILK等[43]以60%1RM的运动强度对受试者进行3组力竭卧推训练,对比150%AOP的高加压压力和100%AOP的低加压压力对肌肉耐力的影响,结果发现,150%AOP的高加压受试者的卧推执行的重复次数、张力下持续时间显著高于100%AOP加压组。研究中一次性和长期性的不同干预模式、受试者不同训练水平、不同的压力表示方式以及不同的抗阻负荷强度等因素可能是导致高、低加压压力对肌肉耐力表现发生研究结果分歧的原因。总体上说,在长期加压抗阻训练中较低的加压压力干预对提升肌肉耐力表现显示出很好的效果。 2.2.3 加压方式与神经肌肉适应的量效关系 研究发现,神经肌肉适应的促进效果对加压方式改变的敏感程度比加压量更高。目前国内外关于加压抗阻训练中的加压方式包括整个抗阻训练期间的持续加压,以及运动时泄压或运动间歇休息期泄压的间歇加压。李志远等[63]研究发现,在50%AOP压力条件下,间歇和持续加压干预均显著提高下肢肌肉激活程度,但在40% AOP以及60%AOP 压力条件下,间歇加压比持续加压对深蹲练习中的下肢部分肌群的激活程度提升效果更佳。车同同等[57]以30%1RM的强度、180 mmHg的压力对受试者进行半蹲加压抗阻训练,结果发现持续加压训练后核心肌群以及下肢肌群肌电振幅更高,肌肉激活程度的也优于间歇加压。上述研究表明,相较于间歇加压,持续加压可通过引发更高程度的代谢压力以及神经肌肉适应,从而产生更好的训练效应。需要注意的是,加压方式的改变需要建立在有效加压范围内:Wilk团队分别对上、下肢采用不同加压干预方式对肌肉的训练效果进行研究[44,54]。 在上肢卧推抗阻训练中,当受试者以70%AOP的压力进行不同加压干预方式的卧推训练后发现,持续加压能够提高17%的卧推峰值速度,间歇加压能够提高12%的卧推峰值速度,持续加压显著高于间歇加压[44]。但在下肢负重深蹲训练中,以80%AOP的压力分别进行持续加压和间歇加压训练,结果发现持续加压和间歇加压干预均未改善下肢的输出功率和功率峰值速度[54]。有证据显示,只有采用极高的加压压力(150%AOP)时,负重深蹲时的运动速度以及输出功率才会明显增加[64]。相比上肢,或许是由于下肢训练需要更大的加压压力才能达到刺激阈值,而以80%AOP的加压干预无论是持续加压还是间歇加压都未取得理想的效果。因此,上述研究表明加压方式的改变应建立在有效加压压力的基础上才能对运动表现产生增益效果。 综上所述,对于肌肉力量表现的强化效果来说,闭塞压力越高对其效应的增益越明显;而对于耐力表现的提升效果来说,采用中低闭塞压力干预能够比高闭塞压力带来更好的调控效果。在有效压力范围内,持续加压对于促进神经肌肉适应的增益效果优于间歇加压。 2.3 加压抗阻训练诱发肌肉训练效应的生理机制 2.3.1 加压抗阻训练强化肌肉力量表现的生理机制 单纯抗阻训练中代谢产物的累积是促进肌肉肥大、提升力量表现的主要诱发因素之一。而在加压干预后,肌肉组织承受更大的代谢压力刺激,更容易导致乳酸、H+等代谢产物累积。LOENNEKE等[65]报道称,抗阻训练中实施加压干预会引起静脉回流降低,当解除加压后能够形成有利于血液流入肌纤维的压力梯度。在梯度压力的作用下细胞外液更容易进入细胞,使积累的代谢物对中枢和外周化学感受器产生更强烈的刺激,从而促进肌细胞蛋白合成。TAKADA等[27]研究发现,4周跖屈抗阻训练后受试者体内无机磷酸盐的增加以及pH值的降低与肌肉肥大程度呈显著正相关,且加压组的变化幅度显著高于非加压组。SUGA团队[26,30,60]进行了有关加压抗阻训练对机体代谢压力以及应激产物累积影响的系列研究。在单次抗阻跖屈训练中发现加压联合低强度(20%1RM)抗阻训练后肌肉内磷酸肌酸的消耗、pH值的降低以及H2PO4-水平的增幅极显著地升高,但仍低于单纯高强度(65%1RM)抗阻训练产生效应[60]。进一步研究发现,当加压训练中的抗阻强度由20%1RM升高到40%1RM[26]、或加压方式由间歇加压改为持续加压[30],均能使加压抗阻训练后机体的代谢压力以及产物累积程度达到近似于65%1RM高强度单纯抗阻训练的水平。最新研究证实,抗阻训练后加压组血乳酸水平显著高于非加压组,且加压压力越大血乳酸提升水平越高[31]。此外,DE LIMA等[4]安排未经训练的受试者进行为期8周、每周3次的臂屈伸训练后还观察到,部分血流阻断的低强度(20% 1RM)抗阻损训练、完全血流阻断分低强度(20% 1RM)抗阻训练和单纯大强度(75% 1RM)的抗阻训练均能增加肌肉力量、降低线粒体膜电位和凋亡蛋白caspase-3的活性。然而,完全阻断血流低强度的加压抗阻训练还能如单纯大强度抗阻训练一样增加血浆脂质过氧化和蛋白质羰基化合物水平,降低还原型谷胱甘肽水平,提示在氧化应激和细胞凋亡激活方面完全血流阻断的低强度的加压抗阻训练如单纯大强度抗阻训练产生了相似的效果。 肌肉肥大及力量的增加还受胰岛素样生长因子1、睾酮、生长激素以及雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)等激素和蛋白的正向调控和肌肉生长抑制素(myostatin,MSTN)的负向调控。加压抗阻训练强化力量表现与上述分子的调控密切相关。大量实验证实,加压抗阻训练能够显著上调生长激素以及胰岛素样生长因子的表达[3,20,29,31-32,66-67],促进其下游效应蛋白p70S6K1激酶(70 kD ribosomal protein S6 kinase)的磷酸化[18, 68-69],进一步激活mTOR信号通路活性,从而显著提升肌肉蛋白合成表现。DAVIDS等[18]进一步研究发现,长期低强度抗阻训练中实施加压刺激能够激活mTOR信号通路,使p70S6KThr389磷酸化水平达到传统高强度抗阻训练相似的程度。上述研究提示加压抗阻训练可通过刺激合成代谢信号反应,提升肌肉蛋白合成及mTOR信号通路活性等分子机制来调控受试者的力量表现。同时,研究还证实加压抗阻训练可提高睾酮水平和热休克蛋白72(HSP-72)的表达,前者能够通过刺激组织摄取氨基酸进而促进蛋白质合成并加速肌纤维生长[3,20,29,31-32,67],后者能够防止蛋白质分解,促进肌肉恢复以及重塑[70]。此外,加压训练还能够降低泛素-蛋白水解酶复合通路中肌肉特异性环脂蛋白1(atrogenes like muscle RING finger1,MuRF1)基因表达以及血清MSTN水平[71-72],提示抗阻训练中加压刺激可通过抑制肌肉生成相关的负向调控通路,降低肌肉蛋白分解进而强化力量表现。 值得注意的是,加压刺激也能通过调控骨骼肌中microRNA的表达来达到增强肌肉力量表现的效应。microRNA-206是肌肉分解的重要调节因子,当骨骼肌中microRNA-206表达上调时肌肉分解增强,而当骨骼肌中microRNA-206表达下调时骨骼肌分解降低。TORMA等[34]以70%RM的高强度对受试者进行深蹲抗阻训练,并在训练间歇期进行加压干预,结果发现相比未加压腿,加压腿骨骼肌中与线粒体和血管增殖、肌肉肥大相关的蛋白表达显著增加,microRNA-206表达水平显著降低,而microRNA-206的靶蛋白Pax7(paired box gene 7) mRNA显著升高,提示加压刺激可通过下调microRNA-206的表达从而抑制microRNA-206对骨骼肌蛋白质的分解作用,从而促进肌纤维肥大、线粒体和血管增殖。 2.3.2 加压抗阻训练提升肌肉耐力表现的生理机制 试验证实,运动可通过促进血液载氧能力、心脏泵血能力的中心机制和促进肌肉的血液充盈量、摄氧能力、氧化酶活性等外周机制促进受训者的运动耐力表现[36]。大量研究发现,加压抗阻训练可提高受试者骨骼肌蛋白激酶活性,促进血管生成因子基因的表达,从而提高肌肉耐力表现[12,40-42,51]。LARKIN等[40]以40%1RM的强度对受试者进行加压抗阻训练,结果发现在训练后4 h时骨骼肌中与肌肉耐力密切相关的因子,如VEGF、缺氧诱导因子(hypoxia-inducible factor-1,HIF-1α)、内皮一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的mRNA含量显著增加,提示加压抗阻训练可通过促进血管生成和增强代谢酶活性提高肌肉耐力。FERGUSON等[41]以20%1RM的强度进行4组加压腿屈伸抗阻训练,结果发现加压组骨骼肌VEGF mRNA、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)磷酸化程度以及过氧化物酶体增殖物激活受体γ共激活因子1α (Peroxisome proliferator-activated receptor-γ coactivator 1-α,PGC-1α) mRNA表达水平均显著高于非加压组。PGC-1α是促进线粒体生成的重要调节因子,上述研究说明加压刺激能够促进与血管生成、线粒体增殖相关蛋白的基因表达。 GROENNEBAEK等[42]对比了加压联合低强度(30%1RM)抗阻训练和单纯高强度抗阻训练(70% 1RM)对骨骼肌线粒体呼吸功能和氧化酶活性的调节,结果发现加压抗阻训练能促进骨骼肌p38MAPK的表达、上调5’-腺苷单磷酸活化蛋白激酶(5′-adenosine monophosphate-activated protein kinase,AMPK)下游靶标乙酰辅酶 A 羧化酶(acetyl-CoA carboxylase,ACC)的磷酸化水平,提高线粒体最大呼吸功能,加压低强度抗阻产生的训练效应达到了单纯高强度阻力训练相似程度。BJ?RNSEN等[33]和PIGNANELLI等[39]两个团队在对受试者进行6周高频(每天一两次)低强度加压训练后发现,加压抗阻训练能使受试者Ⅰ型肌纤维周围的毛细血管密度显著增加,而非加压组无无此变化。以上研究提示,长期抗阻训练中实施加压干预可能主要通过以下2个机制提升肌肉耐力表现:①加压干预通过上调骨骼肌内皮一氧化氮合酶、缺氧诱导因子1、VEGF等基因或蛋白的表达,从而促进骨骼肌中毛细血管生成,进而促进骨骼肌的血液供应产生肌肉耐力提高的效应。②加压干预通过上调蛋白激酶p38MAPK以及AMPK的表达,进而诱发其下游转录因子PGC-1α的磷酸化,促进线粒体生物发生,提高有氧代谢酶活性,进而提高肌肉耐力。 2.3.3 加压抗阻训练促进神经肌肉适应的生理机制 神经肌肉适应与不同类型肌纤维募集有关,运动中肌纤维募集一般遵循“大小原则”,低强度下优先募集抗疲劳的Ⅰ型肌纤维,随运动强度增加Ⅱ型肌纤维逐渐被募集。加压抗阻训练相比于单纯抗阻训练会改变运动单位的募集,因此对神经肌肉适应的促进效果更佳。MANINI等[71]研究发现,在急性低强度抗阻训练中当肌肉经受加压干预时会造成局部缺血导致大量Ⅱ型肌纤维被募集,说明加压刺激能够增加高强度阈值肌纤维的募集。DAVIDS等[18]还发现,以60% AOP进行低强度抗阻训练(30%-40%1RM)可显著增加Ⅱ型肌纤维横截面积,促进肌肉横断面积增加的效应与单纯高强度抗阻(75%-80%1RM)训练相当。也有证据表明长期低强度(20%-30%1RM)加压力竭训练更能选择性地促进Ⅰ型肌纤维产生训练适应[33,70]。研究结果的差异可能与研究中采用的运动强度、运动频率不同,以及是否达到力竭的训练手段不同有关。PAP的产生是训练产生力量增强效应的重要生理原因。研究已证实,单纯抗阻训练中PAP的产生与运动诱导的肌球蛋白调节轻链(regulatory light chain,RLC)磷酸化(P-RLC)有关。P-RLC会增加肌球蛋白-肌动蛋白相互作用,即横桥与位点结合,这促进了骨骼肌中Ca2+的敏感性,继而影响兴奋-收缩偶联,最终产生PAP效应[73]。此外,高强度阈值的运动单位募集也是PAP发生的重要因素,具有高强度阈值的Ⅱ型肌纤维的P-RLC的表达和PAP效应显著大于Ⅰ型肌纤维[74]。加压抗阻训练中,由于加压刺激导致无氧代谢供能比例的增加会加速Ⅰ型肌纤维疲劳,诱发高强度阈值的Ⅱ型肌纤维的募集增加[75],这或许会是加压抗阻训练比单纯抗阻训练更容易产生PAP效应的原因。 图4汇总了加压抗阻训练产生运动适应进而诱发肌肉训练效应的主要生理机制。"

| [1] LOENNEKE JP, THIEBAUD RS, ABE T, et al. Blood flow restriction pressure recommendations: the hormesis hypothesis. Med Hypotheses. 2014;82(5): 623-626. [2] FERGUSON RA, MITCHELL EA, TAYLOR CW, et al. Blood-flow-restricted exercise: Strategies for enhancing muscle adaptation and performance in the endurance-trained athlete. Exp Physiol. 2021;106(4):837-860. [3] BEMBEN DA, SHERK VD, BUCHANAN SR, et al. Acute and Chronic Bone Marker and Endocrine Responses to Resistance Exercise With and Without Blood Flow Restriction in Young Men. Front Physiol. 2022;13:837631. [4] DE LIMA FR, MARIN DP, FERREIRA LT, et al. Effect of Resistance Training With Total and Partial Blood Flow Restriction on Biomarkers of Oxidative Stress and Apoptosis in Untrained Men. Front Physiol. 2021;12:720773. [5] RODRIGO-MALLORCA D, LOAIZA-BETANCUR AF, MONTEAGUDO P, et al. Resistance Training with Blood Flow Restriction Compared to Traditional Resistance Training on Strength and Muscle Mass in Non-Active Older Adults: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2021;18(21):11441. [6] CORRÊA HL, NEVES RVP, DEUS LA, et al. Low-load resistance training with blood flow restriction prevent renal function decline: The role of the redox balance, angiotensin 1-7 and vasopressin(☆,☆☆). Physiol Behav. 2021; 230:113295. [7] DU X, CHEN W, ZHAN N, et al. The effects of low-intensity resistance training with or without blood flow restriction on serum BDNF, VEGF and perception in patients with post-stroke depression. Neuro Endocrinol Lett. 2021;42(4):229-235. [8] JØNSSON AB, JOHANSEN CV, ROLVING N, et al. Feasibility and estimated efficacy of blood flow restricted training in female patients with rheumatoid arthritis: a randomized controlled pilot study. Scand J Rheumatol. 2021; 50(3):169-177. [9] 魏佳,李博,杨威,等.血流限制训练的应用效果与作用机制[J].体育科学,2019,39(4):71-80. [10] 潘颖,赵彦,田宜鑫,等.离心运动伴不同程度的血流限制对外周疲劳及心脏自主神经功能的效应研究[J].中国体育科技,2021,57(2):28-36. [11] 李卓倩,魏文哲,赵之光,等.低强度抗阻运动中不同程度的血流限制对血清生长激素和睾酮分泌量的影响[J].中国体育科技,2020,56(4):38-43. [12] ZHAO Y, LIN A, JIAO L. Eight weeks of resistance training with blood flow restriction improve cardiac function and vascular endothelial function in healthy young Asian males. Int Health. 2021;13(5):471-479. [13] 魏佳,李博,冯连世,等.血流限制训练的方法学因素及潜在安全性问题[J].中国体育科技,2019,55(3):3-12. [14] SUCHOMEL TJ, NIMPHIUS S, BELLON CR, et al. The Importance of Muscular Strength: Training Considerations. Sports Med. 2018;48(4):765-85. [15] SPIERING BA, KRAEMER WJ, ANDERSON JM, et al. Resistance exercise biology: manipulation of resistance exercise programme variables determines the responses of cellular and molecular signalling pathways. Sports Med. 2008;38(7):527-540. [16] YAMANAKA T, FARLEY RS, CAPUTO JL. Occlusion training increases muscular strength in division IA football players. J Strength Cond Res. 2012;26(9): 2523-2529. [17] YASUDA T, FUJITA S, OGASAWARA R, et al. Effects of low-intensity bench press training with restricted arm muscle blood flow on chest muscle hypertrophy: a pilot study. Clin Physiol Funct Imaging. 2010;30(5):338-343. [18] DAVIDS CJ, NÆSS TC, MOEN M, et al. Acute cellular and molecular responses and chronic adaptations to low-load blood flow restriction and high-load resistance exercise in trained individuals. J Appl Physiol (1985). 2021;131(6):1731-1749. [19] 李志远,赵之光,王明波,等.4周加压训练对男子手球运动员身体成分和最大力量的影响[J].中国体育科技,2019,55(5):37-43. [20] 赵之光,程金娜,魏文哲,等.加压训练和传统增肌训练对优秀男子手球运动员部分激素及生物活性因子的影响[J].中国体育科技,2019, 55(5):20-29. [21] 王明波,李志远,魏文哲,等.高水平男子手球运动员下肢加压力量训练效果实证研究[J].中国体育科技,2019,55(5):30-36. [22] BRUMITT J, HUTCHISON MK, KANG D, et al. Blood Flow Restriction Training for the Rotator Cuff: A Randomized Controlled Trial. Int J Sports Physiol Perform. 2020;15(8):1175-1180. [23] BRUMITT J, HUTCHISON MK, KANG D, et al. Rotator cuff strength is not augmented by blood flow restriction training. Phys Ther Sport. 2021;52: 305-311. [24] KATAOKA R, VASENINA E, HAMMERT WB, et al. Muscle growth adaptations to high-load training and low-load training with blood flow restriction in calf muscles. Eur J Appl Physiol. 2022;122(3):623-634. [25] 吴旸,李倩,包大鹏.加压力量训练对下肢骨骼肌影响的Meta分析[J].中国体育科技,2019,55(3):20-26. [26] SUGA T, OKITA K, MORITA N, et al. Dose effect on intramuscular metabolic stress during low-intensity resistance exercise with blood flow restriction. J Appl Physiol (1985). 2010;108(6):1563-1567. [27] TAKADA S, OKITA K, SUGA T, et al. Low-intensity exercise can increase muscle mass and strength proportionally to enhanced metabolic stress under ischemic conditions. J Appl Physiol (1985). 2012;113(2):199-205. [28] 孙科,魏文哲,赵之光.下肢低强度加压训练中血流受限部位和未受限部位肌肉活动的差异[J].中国体育科技,2019,55(5):14-19. [29] 郑兵,张舟.不同加压抗阻训练模式对运动后人体生理及生物力学特征的影响研究[J].西南师范大学学报(自然科学版),2021,46(2):126-134. [30] SUGA T, OKITA K, TAKADA S, et al. Effect of multiple set on intramuscular metabolic stress during low-intensity resistance exercise with blood flow restriction. Eur J Appl Physiol. 2012;112(11):3915-3920. [31] YINGHAO L, JING Y, YONGQI W, et al. Effects of a blood flow restriction exercise under different pressures on testosterone, growth hormone, and insulin-like growth factor levels. J Int Med Res. 2021;49(9): 3000605211039564. [32] 袁文涛.下肢加压结合不同阻力训练对人体机能的影响研究[J].基因组学与应用生物学,2018,37(11):5017-5024. [33] BJØRNSEN T, WERNBOM M, KIRKETEIG A, et al. Type 1 Muscle Fiber Hypertrophy after Blood Flow-restricted Training in Powerlifters. Med Sci Sports Exerc. 2019;51(2):288-298. [34] TORMA F, GOMBOS Z, FRIDVALSZKI M, et al. Blood flow restriction in human skeletal muscle during rest periods after high-load resistance training down-regulates miR-206 and induces Pax7. J Sport Health Sci. 2021;10(4): 470-477. [35] DOMA K, LEICHT AS, BOULLOSA D, et al. Lunge exercises with blood-flow restriction induces post-activation potentiation and improves vertical jump performance. Eur J Appl Physiol. 2020;120(3):687-695. [36] HUGHES DC, ELLEFSEN S, BAAR K. Adaptations to Endurance and Strength Training. Cold Spring Harb Perspect Med. 2018;8(6):a029769. [37] TAI YL, MARSHALL EM, PARKS JC, et al. Hemodynamic response and pulse wave analysis after upper- and lower-body resistance exercise with and without blood flow restriction. Eur J Sport Sci. 2021:1-10. doi: 10.1080/17461391.2021.1982018. [38] MORLEY W N, FERTH S, DEBENHAM MIB, et al. Training response to 8 weeks of blood flow restricted training is not improved by preferentially altering tissue hypoxia or lactate accumulation when training to repetition failure. Appl Physiol Nutr Metab. 2021;46(10):1257-1264. [39] PIGNANELLI C, PETRICK HL, KEYVANI F, et al. Low-load resistance training to task failure with and without blood flow restriction: muscular functional and structural adaptations. Am J Physiol Regul Integr Comp Physiol. 2020; 318(2):R284-R295. [40] LARKIN KA, MACNEIL RG, DIRAIN M, et al. Blood flow restriction enhances post-resistance exercise angiogenic gene expression. Med Sci Sports Exerc. 2012;44(11):2077-2083. [41] FERGUSON RA, HUNT JEA, LEWIS MP, et al. The acute angiogenic signalling response to low-load resistance exercise with blood flow restriction. Eur J Sport Sci. 2018;18(3):397-406. [42] GROENNEBAEK T, JESPERSEN NR, JAKOBSGAARD JE, et al. Skeletal Muscle Mitochondrial Protein Synthesis and Respiration Increase With Low-Load Blood Flow Restricted as Well as High-Load Resistance Training. Front Physiol. 2018;9:1796. [43] WILK M, KRZYSZTOFIK M, FILIP A, et al. The Acute Effects of External Compression With Blood Flow Restriction on Maximal Strength and Strength-Endurance Performance of the Upper Limbs. Front Physiol. 2020; 11:567. [44] WILK M, GEPFERT M, KRZYSZTOFIK M, et al. Acute Effects of Continuous and Intermittent Blood Flow Restriction on Movement Velocity During Bench Press Exercise Against Different Loads. Front Physiol. 2020;11:569915. [45] RAWSKA M, GEPFERT M, MOSTOWIK A, et al. Does blood flow restriction influence the maximal number of repetitions performed during the bench press? A pilot study article details. Baltic J Health Physical Activity. 2019. doi:10.29359/BJHPA.11.4.02 [46] WILK M, KRZYSZTOFIK M, FILIP A, et al. Does Post-Activation Performance Enhancement Occur During the Bench Press Exercise under Blood Flow Restriction? Int J Environ Res Public Health. 2020;17(11):3752. [47] GEPFERT M, JAROSZ J, WOJDALA G, et al. Acute impact of blood flow restriction on strength-endurance performance during the bench press exercise. Biol Sport. 2021;38(4):653-658. [48] WILK M, KRZYSZTOFIK M, FILIP A, et al. Short-Term Blood Flow Restriction Increases Power Output and Bar Velocity During the Bench Press. J Strength Cond Res. 2022;36(8):2082-2088. [49] 芦劼明,刘善云,孙鹏,等.不同压力血流限制结合低强度抗阻训练对大学生下肢肌肉及心肺功能影响[J].中国应用生理学杂志,2020,36(6): 595-599. [50] 潘颖,赵彦,马晓缓,等.血流限制伴小强度抗阻运动对低体重女性骨骼肌微循环,神经肌肉激活及主观疲劳的影响[J].中国运动医学杂志, 2019,38(8):677-684. [51] 于亮,赵泽铭,王政淞,等.短期加压力量训练对成年男性身体成分及心血管功能的影响[J].北京体育大学学报,2020,43(6):132-139. [52] KAMBIC T, NOVAKOVIC M, TOMAZIN K, et al. Hemodynamic and Hemostatic Response to Blood Flow Restriction Resistance Exercise in Coronary Artery Disease A Pilot Randomized Controlled Trial. J Cardiovasc Nurs. 2021;36(5): 507-516. [53] KOLIND MI, GAM S, PHILLIP JG, et al. Effects of low load exercise with and without blood-flow restriction on microvascular oxygenation, muscle excitability and perceived pain. Eur J Sport Sci. 2022:1-10. doi: 10.1080/17461391.2022.2039781. [54] WILK M, TRYBULSKI R, KRZYSZTOFIK M, et al. Acute Effects of Different Blood Flow Restriction Protocols on Bar Velocity During the Squat Exercise. Front Physiol. 2021;12:652896. [55] CHATLAONG MA, BENTLEY JP, BUCKNER SL, et al. Mechanisms mediating increased endurance following high-and low-load training with and without blood flow restriction. J Trainology. 2022;11(1):7-11. [56] LAMBERT B, HEDT C, DAUM J, et al. Blood Flow Restriction Training for the Shoulder: A Case for Proximal Benefit. Am J Sports Med. 2021;49(10): 2716-2728. [57] 车同同,杨铁黎,梁永杰,等.下肢低强度加压半蹲起训练对核心区肌群肌肉激活程度和主观疲劳度的影响[J].体育科学,2021,41(7):59-66. [58] MOORE DR, BURGOMASTER KA, SCHOFIELD LM, et al. Neuromuscular adaptations in human muscle following low intensity resistance training with vascular occlusion. Eur J Appl Physiol. 2004;92(4-5):399-406. [59] 魏宏文,向镜.快速伸缩复合练习伴随血流限制的激活后增强效应研究[J].河南师范大学学报(自然科学版),2022,50(1):144-149. [60] SUGA T, OKITA K, MORITA N, et al. Intramuscular metabolism during low-intensity resistance exercise with blood flow restriction. J Appl Physiol (1985). 2009;106(4):1119-1124. [61] YASUDA T, OGASAWARA R, SAKAMAKI M, et al. Relationship between limb and trunk muscle hypertrophy following high-intensity resistance training and blood flow-restricted low-intensity resistance training. Clin Physiol Funct Imaging. 2011;31(5):347-351. [62] SPRANGER MD, KRISHNAN AC, LEVY PD, et al. Blood flow restriction training and the exercise pressor reflex: a call for concern. Am J Physiol Heart Circ Physiol. 2015;309(9):H1440-1452. [63] 李志远,虞松坤,李加鹏,等.负重深蹲中施加不同动脉闭塞压和间歇方式对大腿肌肉激活特征的影响[J].中国应用生理学杂志,2021,37(3): 300-305. [64] GEPFERT M, KRZYSZTOFIK M, KOSTRZEWA M, et al. The Acute Impact of External Compression on Back Squat Performance in Competitive Athletes. Int J Environ Res Public Health. 2020;17(13):4674. [65] LOENNEKE JP, FAHS CA, ROSSOW LM, et al. The anabolic benefits of venous blood flow restriction training may be induced by muscle cell swelling. Med Hypotheses. 2012;78(1):151-154. [66] OLIVEIRA J, CAMPOS Y, LEITÃO L, et al. Does Acute Blood Flow Restriction with Pneumatic and Non-Pneumatic Non-Elastic Cuffs Promote Similar Responses in Blood Lactate, Growth Hormone, and Peptide Hormone? J Hum Kinet. 2020;74:85-97. [67] 李卓倩,魏文哲,赵之光,等.低强度抗阻运动中不同程度的血流限制对血清生长激素和睾酮分泌量的影响[J].中国体育科技,2020,56(4):38-43. [68] FRY CS, GLYNN EL, DRUMMOND MJ, et al. Blood flow restriction exercise stimulates mTORC1 signaling and muscle protein synthesis in older men. J Appl Physiol (1985). 2010;108(5):1199-1209. [69] WERNBOM M, APRO W, PAULSEN G, et al. Acute low-load resistance exercise with and without blood flow restriction increased protein signalling and number of satellite cells in human skeletal muscle. Eur J Appl Physiol. 2013;113(12):2953-2965. [70] BJØRNSEN T, WERNBOM M, PAULSEN G, et al. High-frequency blood flow-restricted resistance exercise results in acute and prolonged cellular stress more pronounced in type I than in type II fibers. J Appl Physiol (1985). 2021;131(2):643-660. [71] MANINI TM, VINCENT KR, LEEUWENBURGH CL, et al. Myogenic and proteolytic mRNA expression following blood flow restricted exercise. Acta Physiol (Oxf). 2011;201(2):255-263. [72] LAURENTINO GC, UGRINOWITSCH C, ROSCHEL H, et al. Strength training with blood flow restriction diminishes myostatin gene expression. Med Sci Sports Exerc. 2012;44(3):406-412. [73] BLAZEVICH AJ, BABAULT N. Post-activation Potentiation Versus Post-activation Performance Enhancement in Humans: Historical Perspective, Underlying Mechanisms, and Current Issues. Front Physiol. 2019;10:1359. [74] TILLIN NA, BISHOP D. Factors modulating post-activation potentiation and its effect on performance of subsequent explosive activities. Sports Med. 2009;39(2):147-166. [75] LÜSCHER H, RUENZEL PW, HENNEMAN E. Effects of impulse frequency, PTP, and temperature on responses elicited in large populations of motoneurons by impulses in single Ia-fibers. J Neurophysiol. 1983;50(5):1045-1058. |
| [1] | Pan Weimin, Wang Bing, Han Yabing, Li Ting, Song Jiaqi, Qin Huasheng, Liu Yang. Effects of blood flow restriction training on muscle strength, muscle mass and physical performance in older adults: a Meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(5): 805-812. |
| [2] | Liang Xiao, Zhao Panchao, Li Jiahui, Ji Zhongqiu, Jiang Guiping. Gait and biomechanical characteristics of lower limbs in multi-task walking of 4-6-year-old children [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(4): 505-512. |
| [3] | Li Zhongshan, Bai Shi, Liu Jie, Yang Tieli, Zou Yuqi, Kong Weiqian, Li Wei, Zhang Qinyang, Chen Song, Che Tongtong, Li Zhiyuan, Guan Rongxin, Wang Chunlu. Maintenance and attenuation trajectory of increased muscle strength after exposure to short-term low-frequency pulsed magnetic field via activation of classical transient receptor potential vanilloid-1 [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(23): 3721-3727. |
| [4] | Song Cuirong, Chen Tongzhen, Liu Meixiao, Zhang Haifeng. Simulated analysis of influence of walking step length on lower limb muscle strength in the elderly [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(22): 3486-3491. |
| [5] | Liu Xiuqi, Chen Fang, Zhong Hehe, Xiong Huazhang, Lyu Guoqing, Wu Shuhong, Liu Yi. Partial peroneus longus tendon reconstruction in the treatment of posterolateral complex injury of the knee joint [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(13): 2093-2098. |
| [6] | Li Zhongshan, Wang Chunlu, Liu Jie, Yang Tieli, Kong Weiqian, Li Wei, Zhang Qinyang, Chen Song, Che Tongtong, Li Zhiyuan, Guan Rongxin, Bai Shi. Effects of short-term low-frequency pulsed electrical magnetic field-induced classical transient receptor potential channel 1 on maximum voluntary contraction and strength endurance of the biceps brachii [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(11): 1796-1804. |
| [7] | Zheng Wei, Sun Libing, Xiong Yingzhe, Zhang Yichi, You Jing, Huang Wenqi, Guo Yanhua, Liu Hongjun. Effect of eccentric strengthening on hamstring strength: a Meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(29): 4749-4756. |
| [8] | Hao Zhixin, Wu Yixin, Wang Xin, Xia Zhongliang. Effect of anodal transcranial direct current stimulation on muscle strength and endurance: a Meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(20): 3273-3280. |
| [9] | Wang Yongchao, Wang Baochen, Wei Zhuying, Bao Chunyu, Liu Shijun, Meng Qinghua. Blood flow restriction method for inducing cross-education phenomenon and muscle function reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(17): 2762-2767. |
| [10] | Chen Keyi, Wang Dingxuan, Zhao Sike, Xia Zhangrong. Research hotspots of pressure training in rehabilitation and visualized analysis of relevant literature data in the past 10 years [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(15): 2406-2411. |
| [11] | Chen Rong, Zeng Qing, Gong Ze, Huang Guozhi, . Different modes of blood flow restriction in the treatment of senile sarcopenia: therapeutic effects and safety factors [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(32): 5215-5221. |
| [12] | Wang Feng, Ju Xiaocong, Wang Bing, Sun Haining. Lateral unicompartmental knee arthroplasty and total knee arthroplasty for treating lateral single compartment knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(12): 1836-1841. |
| [13] | Lin Yi, Feng Jierong, Luo Xingwen. Mobilization with movement facilitates early functional recovery after fixed-bearing posterior stabilized total knee arthroplasty [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(12): 1842-1846. |
| [14] | Zhao Jing, Yin Lian, Lei Xuemei, Li Miaomiao, Wang Kun, Zhang Tingran, Luo Jiong. KAASTU training for muscle fitness in the middle-aged and elderly adults: effects and strengths [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(23): 3737-3743. |
| [15] | Hou Xiao, Lü Yifan, Liu Jingmin. Meta-analysis of muscle strength of exercisers undergoing electrical muscle stimulation training [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(23): 3764-3772. |
| Viewed | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
Full text 217
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Abstract 774
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||