其他干细胞
-
图2|各组大鼠海马CA1区突触的超微结构
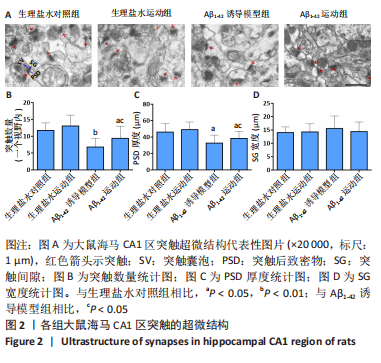
海马CA1区与海马其他部位以及其他皮质区域通过突触紧密相连,不仅在学习与记忆形成过程中发挥关键作用,也是阿尔茨海默病病变过程中累及最早和最严重的区域之一[14-15],因而,此次研究以海马CA1区为关注点,采用电镜技术对其突触超微结构进行了分析(图2)。结果显示,Aβ1-42诱导模型组和Aβ1-42运动组突触数量显著低于生理盐水对照组(P < 0.01,P < 0.05),PSD厚度也较生理盐水对照组下降(P < 0.01,P < 0.05);而与Aβ1-42诱导模型组相比,Aβ1-42运动组突触的数量和PSD厚度均有增加(P < 0.05,P < 0.05)。生理盐水运动组突触数量和PSD厚度虽较生理盐水对照组有所增加,但无统计学差异。尽管突触间隙宽度4组之间未出现显著性差异(P > 0.05),但从数值上来说,Aβ1-42诱导模型组较生理盐水对照组有所增宽,而Aβ1-42运动组则较Aβ1-42诱导模型组有所缩小。以上数据表明5周的有氧运动对正常大鼠的海马突触结构未产生明显影响,但能减轻Aβ1-42引起的海马突触结构受损。
图3|各组大鼠海马突触素(SYP)、突触后致密物95(PSD-95)的表达
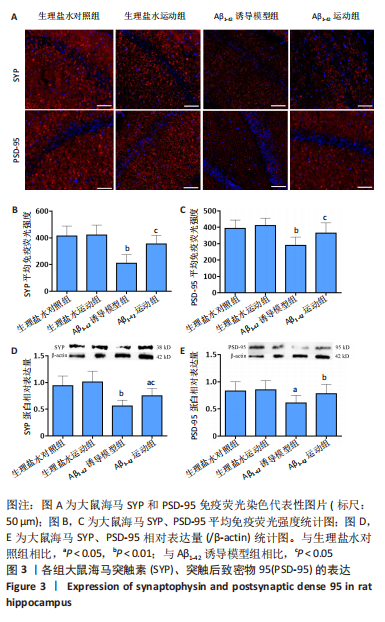
在荧光显微镜下观察,被CY3标记为红色的突触素、PSD-95荧光阳性物质呈点状广泛分布于大鼠海马(图3A)。生理盐水运动组与生理盐水对照组之间,突触素、PSD-95的平均荧光强度差异均无显著性意义(P > 0.05);与生理盐水对照组相比,Aβ1-42诱导模型组的这两种突触蛋白平均荧光强度均显著降低(P < 0.01),而Aβ1-42运动组较Aβ1-42诱导模型组明显增强(P < 0.01,P < 0.05,图3B,C)。Western blot技术对突触素和PSD-95的定量分析也支持这一变化趋势(图3D,E),其中Aβ1-42诱导模型组突触素、PSD-95相对表达量分别较生理盐水对照组降低40.4%(P < 0.01)及26.5%(P < 0.05),Aβ1-42运动组则比Aβ1-42诱导模型组提高33.9%(P < 0.05)及27.9%(P < 0.05)。以上数据说明,Aβ1-42可引起海马突触蛋白突触素、PSD-95水平明显下降,而持续5周的有氧运动在一定程度减轻了这种突触蛋白表达受损。