1.1 设计 材料的制备与表征,体外细胞实验,随机分组动物实验。
1.2 时间及地点 实验于2024年6月至2025年1月在贵州医科大学组织工程与干细胞实验室完成。
1.3 材料
1.3.1 实验动物 实验选用24只健康雄性C57小鼠,6-8周龄,体质量20-30 g,购自天勤(长沙)生物技术有限公司,许可证号:SCXK(湘)2024-0021。小鼠饲养于贵州医科大学北京路校区的清洁级动物房,环境条件为:12 h光照/黑暗循环,温度22 ℃,湿度50%,提供充足饲料和饮用水,并维持SPF级标准。实验前小鼠适应喂养1周。动物实验已获贵州医科大学伦理委员会批准(伦理审批号:2403647)。
1.3.2 实验材料与试剂 聚己内酯(相对分子质量80 000)、聚乙二醇(相对分子质量30 000)、聚乙烯醇(相对分子质量70 000)、六氟异丙醇及红景天苷(纯度99%)(上海麦克林);脐静脉内皮细胞与小鼠单核巨噬细胞白血病细胞系RAW264.7(武汉普诺赛);高糖DMEM培养基、青霉素-链霉素混合液、胎牛血清及胰蛋白酶-EDTA消化液(美国Gibco);Live/Dead试剂盒、Matrix-Gel™基质胶、一氧化氮检测试剂盒(上海碧云天);脂多糖(北京索莱宝);CCK-8试剂(广州美伦);EdU试剂盒(上海雅酶);结晶紫染色液(北京索莱宝);血管内皮生长因子兔一抗和山羊抗兔IgG荧光二抗(杭州华安);DAPI、抗荧光衰减封固剂、2.5%戊二醛固定液、封闭山羊血清(北京索莱宝);RNA提取试剂盒、反转录试剂盒和SYBR试剂盒(广州信天翁);改良Masson三色染色液和苏木精染液(美国Sigma);伊红染液(合肥博美);CD206、血管内皮生长因子免疫组化一抗(美国SantaCruz);二抗鼠抗、兔抗(武汉塞维尔),实验中采用的仪器为倒置免疫荧光显微镜(日本尼康)。
1.3.3 实验仪器 静电纺丝机(北京永康);扫描电镜(德国ZEISS);接触角测试仪(德国Lauda Scientific);傅里叶变换红外光谱仪及紫外分光光度计(美国 Thermo Fisher Scientific);倒置免疫荧光显微镜(日本尼康);正置免疫荧光显微镜(德国蔡司);全景扫描仪(广州光影);CO2培养箱(美国赛默飞);石蜡包埋机及石蜡切片机(德国Leica);冰冻切片机(美国 Thermo Fisher);超纯水过滤系统(韩国Neolab);酶标仪(美国BioTek);万能力学测试仪(上海倾技仪器仪表科技有限公司)。
1.4 方法
1.4.1 静电纺丝膜的制备 将聚己内酯溶于六氟异丙醇中配制100 g/L的聚己内酯溶液;将聚乙二醇溶于去离子水配制200 g/L的聚乙二醇溶液,向1 mL聚乙二醇溶液中分别加入不同质量的红景天苷,使红景天苷的质量浓度分别为12,25,50,100,200 µg/mL;将聚乙烯醇溶于去离子水中配制70 g/L的聚乙烯醇溶液。采用连续3步静电纺丝法制备聚己内酯-聚乙二醇/红景天苷-聚乙烯醇静电纺丝膜(记为PCL-PEG/Sal-PVA静电纺丝膜):①外层膜使用聚己内酯溶液,在10 kV电压、20 cm喷射距离下纺丝2 h;②中间层膜使用含红景天苷的聚乙二醇溶液,在13 kV电压、10 cm喷射距离下纺丝10 h;③内层膜使用聚乙烯醇溶液,在8 kV电压、15 cm喷射距离下纺丝2 h。纺丝完成后将静电纺丝膜置于-40 ℃真空冷冻干燥机中过夜处理,在60 ℃
烘箱中干燥1 h以去除残留溶剂和水分,存放在干燥容器中备用。同理制备不含红景天苷的聚己内酯-聚乙二醇/红景天苷-聚乙烯醇静电纺丝膜(记为PCL-PEG-PVA静电纺丝膜)。在使用前通过紫外灯照射30 min和体积分数70%乙醇浸泡30 min进行消毒处理。
1.4.2 筛选载药量最佳的静电纺丝膜
条件培养基的制备:采用含体积分数10%胎牛血清的DMEM培养基培养RAW264.7细胞,细胞浓度为1×109 L-1,置于37 ℃、体积分数5%CO2培养箱中培养至对数期。弃去原培养基,加入含1 μg/mL脂多糖的新鲜DMEM培养基继续孵育24 h以诱导炎症反应[14]。诱导完成后,在4 ℃下4 000 r/min离心10 min去除细胞碎片,保留无细胞上清液,将细胞上清液与含体积分数10%胎牛血清的DMEM高糖培养基按3∶8体积比混合,作为炎症刺激培养基[15]。
CCK-8实验检测细胞活力:将人脐静脉内皮细胞接种于6孔板中,加入条件培养基,细胞密度为2×10⁵/孔,观察细胞贴壁后(约2 h),将PCL-PEG-PVA静电纺丝膜与含不同质量浓度红景天苷的PCL-PEG/Sal-PVA静电纺丝膜裁剪为6 cm²后加入6孔板中,分别与人脐静脉内皮细胞共培养,以仅加入条件培养基培养的细胞作为对照。培养3 d后去除悬浮在条件培养基中的膜,加入含体积分数10%CCK-8工作液的DMEM培养基继续孵育2 h,在450 nm波长处使用酶标仪测定吸光度(A)值,计算相对细胞活力。根据细胞活力结果选择含100 μg/mL红景天苷的PCL-PEG/Sal-PVA静电纺丝膜进行后续实验。

1.4.3 静电纺丝膜的材料学表征
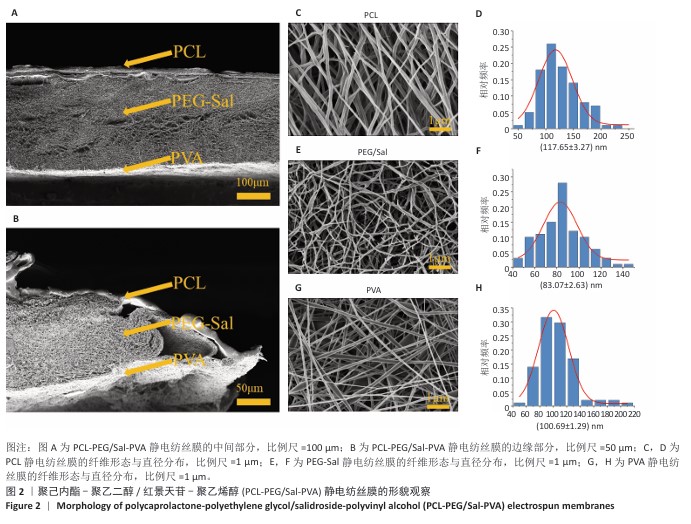
扫描电镜观察:将直径8 mm的PCL-PEG/Sal-PVA静电纺丝膜固定在导电胶上,经Quorum SC7620溅射仪喷金(电流10 mA,45 s),在3 kV下进行扫描电镜观察并拍照,通过Image J软件随机选取纤维计算直径分布。
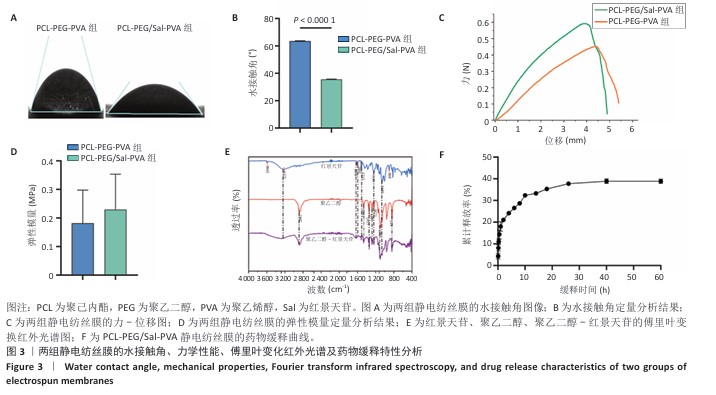
亲水性测试:将去离子水分别滴加至PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜内层聚乙烯醇表面,膜的尺寸为2 cm×2 cm,捕捉水滴沉降后的图像,测量并记录水滴5 s时与膜之间的水接触角,评估膜的亲水性。
膜成分检测:干燥环境下,用ATR附件连接光谱仪先扫描空气背景,再将PCL-PEG/Sal-PVA静电纺丝膜贴合ATR晶体采集傅里叶变换红外光谱,分辨率4 cm-1,扫描32次,波数范围400-4 000 cm-1。
拉伸实验:将PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜分别裁剪成10 mm×10 mm×0.2 mm尺寸,采用力学测试仪进行拉伸实验,设定有效拉伸长度为10 mm,使用100 N传感器,拉伸速度为10 mm/min,记录实验数据并绘制力-位移关系图,计算各组膜的弹性模量。
红景天苷释放检测:将尺寸3 cm×3 cm的PCL-PEG/Sal-PVA静电纺丝膜置于10 mL PBS中,放入恒温摇床(37 ℃、100 r/min)中孵育。按照指定时间间隔(0.5,1,2,4,6,8,10,14,18,26,40,60 h)提取并补充等量的PBS,收集的溶液保存于-20 ℃环境中,使用紫外分光光度计测定吸光度值,根据标准曲线计算各时间点的红景天苷浓度,计算累计释放率。
1.4.4 静电纺丝膜的生物相容性
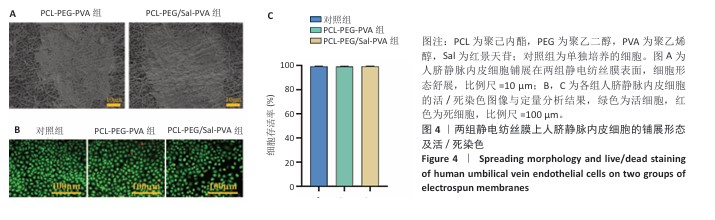
细胞黏附实验:将PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜置于48孔板底部,将第3代人脐静脉内皮细胞分别接种于两组膜的内层聚乙烯醇上,加入含体积分数10%胎牛血清的DMEM高糖培养基,细胞密度为3×10⁴/孔。培养24 h后,2.5%戊二醛固定过夜,经分级乙醇脱水,使用扫描电镜观察细胞在膜上的黏附情况。
活死染色:将第3代人脐静脉内皮细胞接种于6孔板中,加入含体积分数10%胎牛血清的DMEM高糖培养基,细胞密度为5×10⁴/孔,观察贴壁后分别与PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜共培养,以单独培养的细胞为对照。培养5 d后用PBS洗涤2次,加入活死细胞染色试剂避光孵育15 min,使用倒置荧光显微镜观察并拍照,通过Image J软件分析活细胞与死细胞数量,计算细胞存活率。

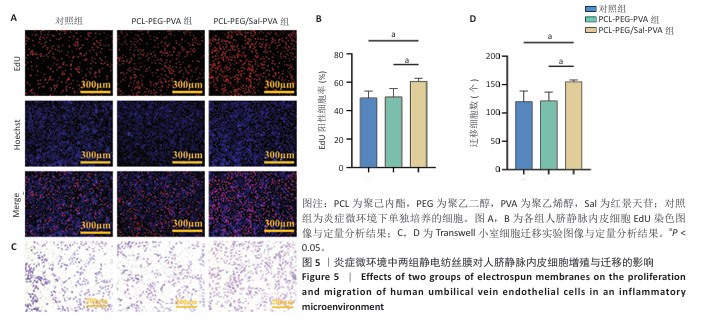
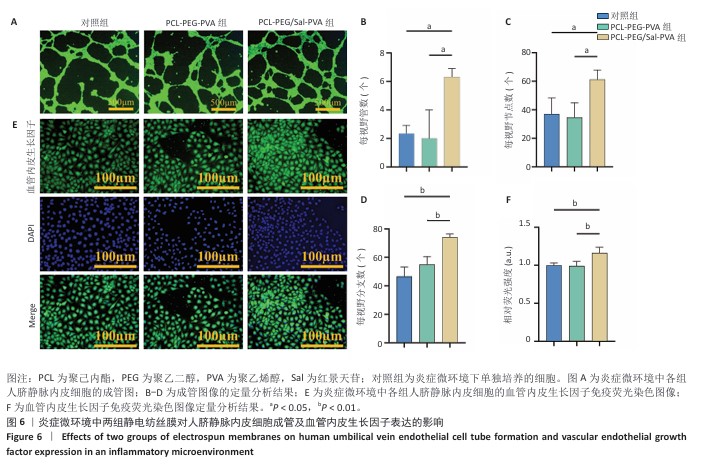
1.4.5 炎症微环境中静电纺丝膜对人脐静脉内皮细胞增殖、迁移与成管能力的影响EdU增殖实验:将第3代人脐静脉内皮细胞接种于6孔板中,加入3 mL条件培养基,细胞密度为5×10⁵/孔,观察细胞贴壁后分别与PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜共培养,以仅加入条件培养基培养的细胞作为对照。培养48 h后,加入EdU工作液孵育2 h,细胞固定后加入Click反应液室温避光孵育30 min,用PBS清洗3次后进行细胞核染色,使用荧光显微镜观察EdU标记的细胞,通过Image J软件统计EdU标记细胞阳性率。
Transwell迁移实验:将第3代人脐静脉内皮细胞用300 μL条件培养基重悬,以4×10⁴/孔的密度接种于24孔板的Transwell小室上层,并于Transwell小室下层分别加入PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜,同时小室下层加600 μL含体积分数1%胎牛血清的条件培养基,以Transwell小室下层仅加600 μL含体积分数1%胎牛血清的条件培养基组别为对照。培养24 h后用40 g/L多聚甲醛固定,结晶紫染色10 min,去除未迁移细胞后拍照,通过Image J软件统计迁移细胞数量。
体外血管生成实验:将第3代人脐静脉内皮细胞接种于6孔板中,加入3 mL条件培养基,细胞密度为5×10⁵/孔,观察细胞贴壁后分别加入PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜,以仅加入条件培养基培养的细胞作为对照。培养48 h后,将基质胶与无血清高糖DMEM培养基按体积比1∶1混合后加入48孔板中,待基质胶凝固后分别接种上述3组细胞,细胞密度为1×10⁵/孔,培养4 h后在倒置显微镜下观察管状结构,通过Image J软件统计成管数、分支数和节点数。
免疫荧光染色:将第3代人脐静脉内皮细胞接种于12孔板爬片上,加入2 mL条件培养基,细胞密度为2×10⁵/孔,观察细胞贴壁后分别加入PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜,以仅加入条件培养基培养的细胞作为对照。培养48 h后,细胞经固定、通透和封闭处理后,滴加血管内皮生长因子一抗于4 ℃过夜,用PBS清洗,滴加二抗(1∶500)室温孵育1 h,DAPI染色10 min,用PBS清洗后封固,用正置荧光显微镜观察并拍照,通过Image J软件统计血管内皮生长子免疫荧光强度。
1.4.6 炎症微环境中静电纺丝膜的抗炎能力
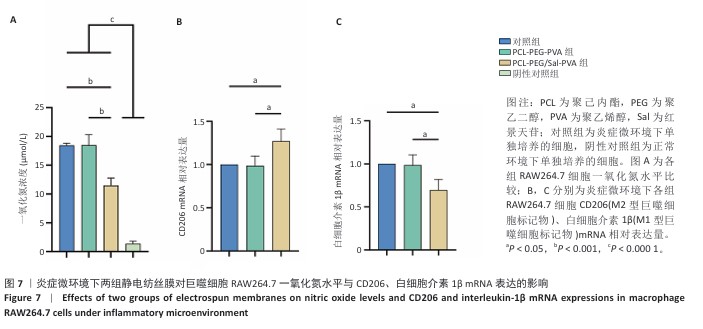
实验分组与干预:将第3代RAW264.7细胞接种于6孔板中,加入含体积分数10%胎牛血清的DMEM培养基,细胞密度为1.5×10⁶/孔,观察细胞贴壁后加入1 µg/mL脂多糖培养24 h诱导炎症反应,分别加入PCL-PEG-PVA、PCL-PEG/Sal-PVA静电纺丝膜,以仅加入1 µg/mL脂多糖培养的细胞为对照。
一氧化氮水平检测:同时设置未加入脂多糖的正常培养细胞作为阴性对照。继续培养24 h后,在4 ℃下2 500 r/min离心10 min去除沉淀,收集上清液加入试剂1和2反应,使用酶标仪在540 nm波长处测量吸光度值,根据标准曲线计算一氧化氮水平。
qPCR检测:继续培养24 h后,提取细胞总RNA并反转录为cDNA,使用SYBR Green法进行实时荧光定量PCR反应,反应体系为20 μL:包括10 μL qPCR SYBR Green Fast Mix、0.4 μL 正向引物(10 μmol/L)、0.4 μL 反向引物(10 μmol/L)、1 μL cDNA和8.2 μL ddH2O。通过2-ΔΔCt 方法计算目标基因的相对表达量,以GAPDH作为内参进行标准化。引物序列见表1。

1.4.7 静电纺丝膜对糖尿病小鼠皮肤创面的修复作用
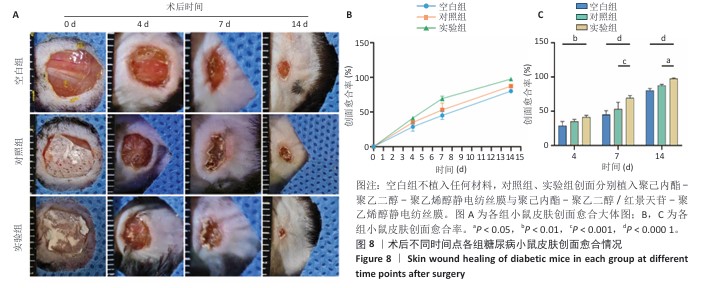
糖尿病小鼠皮肤创面模型的建立与分组干预:取24只C57小鼠,给予高脂高糖饲料(长沙天勤,脂肪60%、碳水化合物20%、蛋白质20%)喂养2周,随后连续2 d腹腔注射链脲佐菌素100 mg/kg,每天1次,以诱导糖尿病模型,通过尾静脉采血检测血糖水平[16]。注射后连续3周监测血糖,空腹血糖>16.8 mmol/L的小鼠确诊为糖尿病。确认糖尿病造模成功后异氟烷吸入麻醉小鼠,局部注射利多卡因后剃除背部毛发并制造1个直径8 mm的圆形全层皮肤缺损创面,随机分为3组干预:空白组(n=8)仅用无菌生理盐水冲洗创面,对照组(n=8)植入无菌PCL-PEG-PCL静电纺丝膜并用生理盐水冲洗创面,实验组(n=8)植入PCL-PEG/Sal-PVA复合膜静电纺丝膜并用生理盐水冲洗创面,膜内层沾水后具有一定黏附性,无需固定。术后第0,4,7,14天,拍摄创面并用软件测量面积,计算创面愈合率。
创面愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%
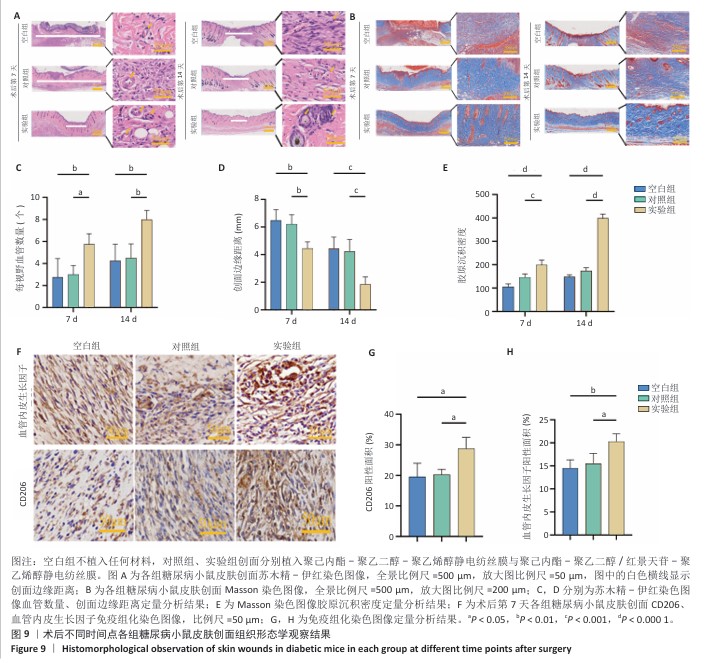
苏木精-伊红染色观察创面皮肤形态结构:术后第7,14天,每组每个时间点取4只小鼠,腹腔注射戊巴比妥钠麻醉后沿着创面新生皮肤周围一圈取材,尽量不损伤新生的皮肤与痂皮,在满足实验要求同时也遵循伦理要求。组织样本经40 g/L多聚甲醛固定48 h,全自动脱水机脱水、二甲苯透明化55 min后石蜡包埋2.5 h,切成5 μm厚切片并在60 ℃下烤片3 h;切片经二甲苯脱蜡、梯度乙醇复水、苏木精染色8 min、盐酸乙醇分化3 s、伊红染色3 min后,中性树胶封固,使用全自动数字扫描仪拍照前,切片需经梯度乙醇脱水和透明剂处理,通过Image J软件测量每张切片4个垂直视野中的血管数量取平均值,定量分析新上皮宽度。
Masson染色观察创面胶原沉积:术后第7,14天,从石蜡包埋的组织块中切取5 μm厚切片,在60 ℃烤箱中烤片2 h,依次用二甲苯脱蜡和梯度乙醇复水;切片经重铬酸钾溶液过夜孵育,进行苏木精分化和返蓝处理,滴加丽春红品红染色液染色10 min,最后用蒸馏水冲洗;用磷钼酸溶液处理30 s,直至胶原纤维褪色,苯胺蓝染色时间2 min,直至胶原纤维充分上色;切片依次经梯度乙醇脱水、二甲苯透明化,中性树胶封固,使用全自动数字玻片扫描仪对切片拍照,通过Image J软件在每张切片4个相互垂直的视野中测量胶原沉积量,取平均值作为最终结果。
免疫组化染色观察创面CD206、血管内皮生长因子表达:将术后第7天的创面皮肤组织样本切片浸入pH=6.0的柠檬酸盐缓冲液,在微波炉中修复20 min,冷却后用pH=7.4的PBS洗涤3次,每次5 min;置于体积分数3%H₂O₂溶液室温避光孵育25 min,以灭活内源性过氧化物酶,用PBS洗涤3次,每次5 min;用3%牛血清白蛋白封闭30 min以上,甩掉封闭液,加入抗血管内皮生长因子(1∶50)和抗CD206(1∶100)抗体于37 ℃孵育60 min,然后置于湿盒内4 ℃孵育过夜;次日滴加HRP标记的二抗室温孵育50 min,并在脱色摇床上用PBS洗涤3次,每次5 min;滴加DAB显色液,室温显色至显微镜下观察到棕黄色阳性信号,蒸馏水洗涤终止显色,苏木精染色3 min,自来水冲洗,使用苏木精分化液处理后再用自来水冲洗,苏木精返蓝液返蓝并流水冲洗;依次用体积分数75%,85%,95%乙醇和无水乙醇脱水各10 min,二甲苯透明化10 min后中性树胶封固,使用全自动数字玻片扫描仪拍照,通过Image J软件测量每张切片4个相互垂直视野中的阳性面积,取平均值。
1.5 主要观察指标 PCL-PEG/Sal-PVA静电纺丝膜的形貌、水接触角、拉伸弹性模量、药物缓释特性、生物相容性、抗炎特性以及炎症微环境下对人脐静脉内皮细胞增殖、迁移、成管能力的影响;PCL-PEG/Sal-PVA静电纺丝膜修复小鼠糖尿病皮肤创面的效果。
1.6 统计学分析 所有实验数据均重复3次,使用GraphPad Prism 10.1.2软件进行统计分析,结果以x±s表示。两组间比较采用独立样本t检验,多组间比较则使用单因素方差分析(ANOVA)或双因素方差分析(Two-Way ANOVA),并结合Tukey’s多重比较检验。P < 0.05表示差异有显著性意义。该统计方法已由贵州医科大学生物统计学专家审核。