Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (6): 1276-1284.doi: 10.12307/2025.307
Previous Articles Next Articles
Improvement of myocardial injury by traditional Chinese medicine: mitochondrial calcium homeostasis mediates macrophage autophagy and pyroptosis pathway
Liu Lingyun1, He Guixin2, Qin Weibin2, Song Hui1, Zhang Liwen1, Tang Weizhi1, Yang Feifei1, Zhu Ziyi1, Ou Yangbin1
- 1Guangxi University of Chinese Medicine, Nanning 530299, Guangxi Zhuang Autonomous Region, China; 2First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530230, Guangxi Zhuang Autonomous Region, China
-
Received:2024-01-29Accepted:2024-04-09Online:2025-02-28Published:2024-06-22 -
Contact:He Guixin, MD, Chief physician, First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530230, Guangxi Zhuang Autonomous Region, China Co-corresponding author: Qin Weibin, Master, Physician, First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530230, Guangxi Zhuang Autonomous Region, China -
About author:Liu Lingyun, Master candidate, Guangxi University of Chinese Medicine, Nanning 530299, Guangxi Zhuang Autonomous Region, China -
Supported by:National Natural Science Foundation of China (Regional Program), No. 81960861 (to HGX); Guangxi Natural Science Foundation Key Project, No. 2020GXNSFDA297020 (to HGX); Natural Science Foundation of Guangxi University of Chinese Medicine (General Project), No. 2023MS023 (to QWB); Guangxi University of Chinese Medicine Gui’s Traditional Chinese Medicine Inheritance and Innovation Team-Chinese Medicine Diagnosis and Treatment Research Team for Difficult and Serious Diseases, No. 2022A001 (to HGX)
CLC Number:
Cite this article
Liu Lingyun, He Guixin, Qin Weibin, Song Hui, Zhang Liwen, Tang Weizhi, Yang Feifei, Zhu Ziyi, Ou Yangbin . Improvement of myocardial injury by traditional Chinese medicine: mitochondrial calcium homeostasis mediates macrophage autophagy and pyroptosis pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1276-1284.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
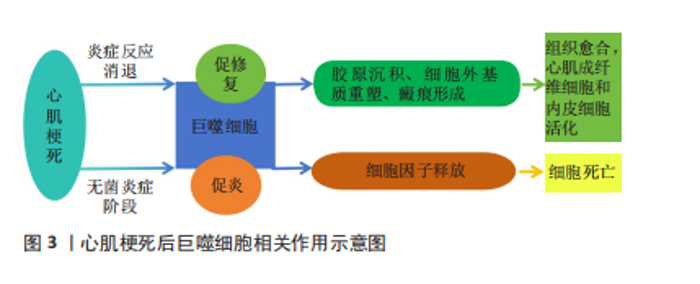
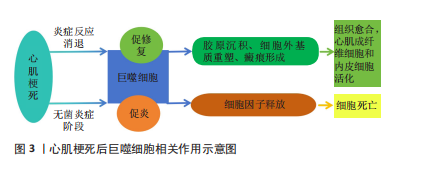
后的心肌组织修复是机体免疫防御作用的效应。巨噬细胞做为机体中最具吞噬作用的一类先天免疫细胞,当组织受伤时,在其固有的免疫中发挥着显著防御作用[10]。巨噬细胞修复作用最初的效应为强烈、短暂的无菌炎症阶段,随后是巨噬细胞、中性粒细胞、单核细胞等免疫细胞的激活,大量的免疫细胞的浸润和激活会导致强烈的炎症反应、细胞因子释放和进一步的细胞死亡。炎症反应消退后,随之而来的是心肌成纤维细胞激活、组织愈合和瘢痕形成。随着组织修复的开始,梗死区的巨噬细胞群从促炎转变为促愈合作用,较好促进了胶原沉积、细胞外基质重塑和瘢痕形成。巨噬细胞可以降解细胞外基质成分,并通过吞噬细胞清除心肌凋亡细胞;在炎症消退阶段,巨噬细胞从促炎性转变为修复性表型,促进心肌成纤维细胞和内皮细胞的活化;巨噬细胞对细胞外基质重塑和修复后血管生成均至关重要[11]。明确心肌梗死后巨噬细胞表型转变的相关机制,可为临床治疗中,改善梗死后心肌细胞的修复及消除其他炎症状况的干预措施提供理论依据。心肌梗死后巨噬细胞相关作用示意图见图3。"
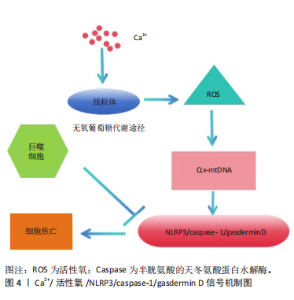
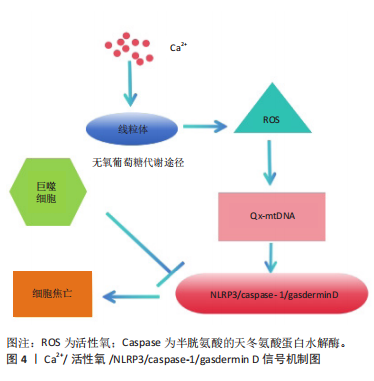
研究证实,巨噬细胞表型与不同的代谢特征有关。在促炎巨噬细胞中糖酵解会上调,而线粒体氧化磷酸化会被抑制。在心肌损伤的情况下,线粒体的功能以及活性氧产生线粒体的完整性是巨噬细胞效应器功能的中心[12]。线粒体对ATP生产(通过线粒体氧化磷酸化)至关重要,且线粒体区域是巨噬细胞中活性氧的主要来源。心肌梗死区巨噬细胞的转录组分析还显示其免疫功能的效应与线粒体自身功能密切相关,这与心肌梗死后重塑过程中巨噬细胞功能的变化相似。 2.2 线粒体钙稳态失衡-巨噬细胞焦亡途径的心肌保护机制 焦亡是由固有免疫所导致的细胞死亡,焦亡的同时伴有炎症因子的释放,这种死亡属于程序性过程,焦亡后细胞的形态变化具有凋亡和坏死两者的特征,此时大量的炎性因子和细胞内容物会由于细胞质膜孔的产生以及肿胀的细胞破裂而释放。焦亡主要发生于巨噬细胞,在分子水平上通常依赖于一个或多个含有半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)激活,包括CASP1、CASP3、 CASP4、CASP5、CASP11,具体依赖于刺激启动[13]。Caspase-1可被氨基酸残基衔接蛋白和各种模式识别受体,形成的炎症小体水解后被激活,通过诱导白细胞介素18和白细胞介素1β的分泌,最终诱导细胞焦亡。 细胞焦亡也被认为是一种攻击性反应,由内在的免疫系统对病原体或损伤组织发起,有保护机体的作用。科学研究表明巨噬细胞焦亡与机体白细胞介素1β、白细胞介素18等炎症分子水平密切相关,影响固有免疫系统功能,并参与多种免疫相关疾病调控。当巨噬细胞处于氧化应激时,效应蛋白Gasdermin D(GSDMD)的4个氨基酸残基会被氧化,NLRP3炎症小体也会激活诱导线粒体膜电位下降以及活性氧的生成。发生急性心肌梗死时,干扰素调节因子2是其关键调节因子,可以触发GSDMD的激活[14]。此外,GSDMD能通过调节细胞焦亡导致心肌再灌注损伤,其也会破坏细胞膜的完整性并改变细胞渗透压,从而影响钙离子转运[15]。但巨噬细胞衍生的细胞外囊泡中会富集miR-378a-3p,可以阻断 NLRP3/Caspase-1/GSDMD 通路的激活,从而减轻心肌细胞的焦亡[16]。WANG等[17]的研究表明,GSDMD氧化修饰是线粒体活性氧促进NLRP3炎症体依赖性焦亡的新机制。NLRP3 炎症小体作为心肌梗死无菌性炎症的关键介质[18],另一项研究通过检测 PI(碘化丙啶)染色、白细胞介素1β和白细胞介素18在体外和体内的释放发现,蒜素可能通过促进线粒体自噬来减少细胞内活性氧的产生,以此减少NLRP3炎性小体活化的生成,从而减轻由脂多糖所诱导的巨噬细胞焦亡[19]。体外实验表明,在钙离子处于稳态时,钙离子进入线粒体,导致同时产生活性氧,活性氧导致线粒体跨膜电位改变,促进线粒体活性氧的产生,并氧化线粒体DNA。线粒体通透性转换孔打开,随后由于氧化还原失衡,更多的氧化线粒体DNA从线粒体释放到细胞质溶胶中,随之激活NLRP3/caspase-1/gasdermin D依赖性细胞焦亡,其相关机制见图4。"
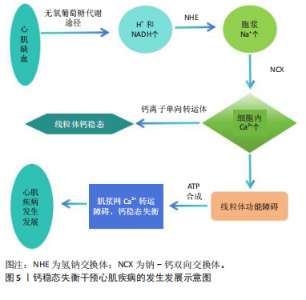
细胞的焦亡和与之相关的炎性因子一同在心血管疾病的进程中发挥着重要作用。综上所述,线粒体钙稳态失衡-巨噬细胞焦亡途径与急性心肌梗死后心肌保护有着密切关系。 2.3 线粒体功能障碍与钙稳态调控的主要途径 作为除细胞核以外细胞中唯一含有遗传物质的细胞器,线粒体是目前已知的真核细胞中最重要的细胞器之一。线粒体具有对脂肪、糖类、蛋白质等物质进行氧化及能量转换并最终为机体细胞提供能量的功能,在这一系列功能活动中涉及线粒体活性氧的产生及消亡,而活性氧的增减直接影响着线粒体功能,并最终干预疾病的发生发展[20]。现有研究表明线粒体的能量代谢、氧化应激等功能都参与了钙稳态的调控,且与心肌缺血再灌注损伤、心力衰竭等疾病的发生发展密切相关[21]。线粒体功能障碍主要有以下几个方面:细胞钙稳态的失衡、线粒体自身合成ATP的能力下降、程序性细胞死亡加重、细胞活性氧增加等。在心肌细胞活动中,心肌的收缩活动会消耗掉绝大部分ATP,细胞膜与肌浆网的各种离子泵也会消耗掉约1/3的ATP,通过上述举动来维持其正常的生理功能,从而实现心肌细胞电活动的运作。 钙离子浓度在心肌细胞内外存在较大的差距,静息状态下,钙离子在细胞内浓度是10-7 mol/L,在细胞外液的浓度大约为10-3 mol /L。而当机体细胞受到刺激时,细胞胞浆内钙离子浓度发生明显变化,进而引发兴奋-收缩偶联等一系列信号传导程。当机体心肌组织缺血时,血供减少区域细胞产生ATP会转为无氧葡萄糖代谢途径,使得H+和还原型辅酶Ⅰ(nicotinamide adenine dinucleotide, NADH)在细胞内迅速积累。此时,为恢复机体内的酸碱平衡则将开始作用位于细胞膜上的氢钠交换体( H+/Na+ exchanger,NHE) ,随之会导致胞浆钠离子的持续升高,继而将会激活钠-钙双向交换体(Na+ /Ca2+ exchanger,NCX),通过反向转运钙离子进入细胞内。已有的研究表明线粒体内存有少量的钙离子,线粒体钙稳态的维持主要通过摄取和排出的方式,国外的相关研究已证实线粒体自身具有转运钙离子的能力,这种能力主要通过钙离子单向转运体完成[22]。当心肌细胞线粒体功能发生障碍时,线粒体的氧化磷酸化能力会明显降低,ATP合成的减少最终会直接影响肌浆网钙离子的转运,钙稳态失衡干预心肌疾病的发生发展,其相关流程如图5。故可以初步认为,在机体发生心肌缺血时,线粒体功能障碍的发生可导致钙稳态失衡,最终影响心肌缺血的病理改变。 2.4 中药改善心肌损伤的研究现状 2.4.1 中药调控线粒体钙稳态机制 中医药是延续中华民族的伟大创造的瑰宝,也是一个有待开发的巨大宝库,随着现代科学技术在中医药上的不断深入,研究成果也愈发增多。 黄芪甲苷作为中药黄芪中的一种代表性皂苷,具有多种药理活性,在动物实验中显示出降低线粒体膜电位的作用,通过抑制细胞色素C来实现,同时可降低内质网Ca2+,升高胞浆及线粒体Ca2+浓度,调节细胞钙稳态并抑制细胞凋亡[23]。同样具有调节线粒体钙稳态作用的淫羊藿苷是中药淫羊藿中的一种活性成分,其作用机制是减"

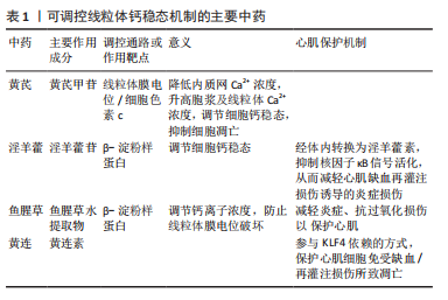
少β-淀粉样蛋白的沉积[24]。当这种活性成分在体内进行转化后,就形成了能减轻心肌缺血再灌注损伤诱导炎症损伤的淫羊藿素,这种心肌保护作用通过抑制核因子κB信号的活化实现[25]。对于β-淀粉样蛋白的调控,中药鱼腥草也具有一定的抑制作用,可调节钙离子浓度防止线粒体膜电位被破坏[26];小鼠实验进一步表明鱼腥草具有减轻炎症、抗过氧化损伤的功能,可发挥心肌缺血再灌注损伤的保护作用[27]。另一项研究表明,中成药双黄连可以作用于线粒体钙单向转运体来增强线粒体钙摄取,将有利于加强对钙稳态的调节[28]。黄连中的黄连素可通过参与Kruppel 样转录因子4(Kruppel-like factor 4,KLF4)依赖的方式,发挥保护心肌细胞免受缺血/再灌注损伤所致凋亡的作用[29]。 可调控线粒体钙稳态机制的主要中药见表1。 "
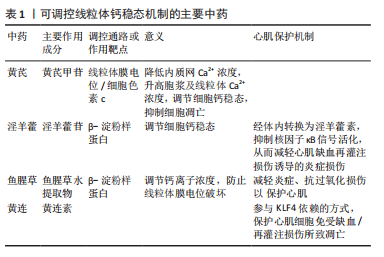
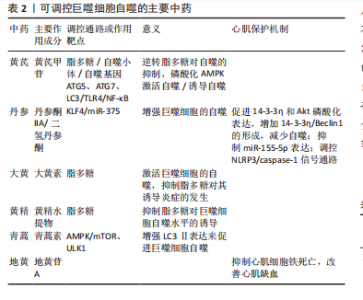
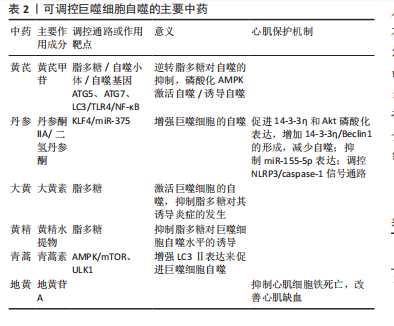
2.4.2 巨噬细胞自噬途径在中药的研究 中医药复方和单味药物均可对巨噬细胞的自噬途径有一定的影响,不同的药物可作用于不同的靶点产生不同的效果。脂多糖作为一个重要的生物学靶点,可以激活Akt/mTOR通路抑制巨噬细胞自噬;同时作为一个具有潜力的药物开发靶点,黄芪可作用于脂多糖,逆转其对自噬的抑制,还可通过磷酸化AMPK激活自噬[30]。除此之外,脂多糖还具有诱导巨噬细胞炎症的作用,而中药大黄中的大黄素可以激活巨噬细胞的自噬,抑制脂多糖对其诱导炎症的发生[31]。在对黄精水提物的研究中发现,其也能够抑制脂多糖对巨噬细胞自噬水平的诱导[32]。自噬的开始往往由自噬小体的形成标志,黄芪甲苷可以激活它的形成,也能提高自噬基因ATG5、ATG7、LC3的mRNA表达促进自噬[33]、抑制Toll样受体4(toll-Like Receptor 4,TLR4)/核因子κB信号通路诱导自噬[34]。在对从中草药丹参根中提取的主要成分丹参酮ⅡA的研究发现,其可通过激活KLF4,抑制miR-375增强巨噬细胞的自噬[35]。 又可促进14-3-3η和Akt磷酸化表达,增加14-3-3η/Beclin1的形成,减少心肌缺血后的细胞自噬发生,达到保护心肌缺血再灌注损伤的作用[36]。不仅如此,其也可通过抑制miR-155-5p表达减轻心肌缺血再灌注损伤[37]。在小鼠实验中,嵇成锋等[38]发现,丹参中的另一主要成分二氢丹参酮可通过参与NLRP3/caspase-1信号通路的调控,改善心肌缺血再灌注损伤引起的细胞损伤,抑制心肌细胞凋亡。青蒿素不仅有抗疟疾的作用,曹乾[39]通过实验研究表明中药青蒿中的青蒿素还能活化腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),通过促进mTOR、UNC-51样激酶1(UNC-51-like kinase 1,ULK1)磷酸化,增强LC3Ⅱ表达来促进巨噬细胞自噬。在中药复方的研究上,犀角地黄汤表现出能够显著降低Atg-5、Beclin-1 mRNA的能力,还能明显抑制LC-3的表达,通过这两条途径均可抑制细胞自噬[40]。此方中臣药地黄的主要成分地黄苷A,可改善心肌缺血造成的心肌组织损伤,其作用机制可通过抑制心肌细胞铁死亡实现[41]。复方补阳还五汤可以通过降低PI3K、P-62、P-mTOR的蛋白表达能力,增加P-Beclin1、ULK的表达,使炎症因子的释放减少,以此调节巨噬细胞的自噬水平[42],在通过调控细胞沉默调节蛋白1(polyclonal antibody to sirtuin 1,SIRT1)/FoxO1信号通路时,可发挥减轻心肌缺血再灌注损伤的作用[43],也可通过调节CD36-SRC-ERK5信号通路促进抗血小板活化,产生抗心肌缺血再灌注损伤作用[44]。通过减轻炎症反应改善心肌缺血再灌注损伤,清热化瘀方也可通过减少促炎因子白细胞介素17和白细胞介素6的释放来实现[45]。 可调控巨噬细胞自噬的主要中药见表2。 2.4.3 巨噬细胞焦亡途径在中药的研究 焦亡是一种由细菌感染诱导巨噬细胞中caspase-1依赖性细胞死亡的特殊形式,常伴有大量促炎症因子的释放。葛根作为复方葛根芩连汤中的君药,也是起主要疗效作用的一味中药,其中的关键活性成分葛根素与巨噬细胞NLRP3/Caspase-1焦亡信号通路有紧密联系[46],可抑制由氧化低密度脂蛋白诱导的焦亡活化并下调炎症细胞因子表达[47]。在对葛根素的研究中,SUN等[48]发现其可有效阻断巨噬细胞中NLRP3-Caspase-1-GSDMD介导的细胞焦亡,缓解细胞炎症,并通过实验证明葛根素的保护作用与P2X7受体密切相关,分子对接结果也证实了这一点。更进一步,张春艳等[49]利用分子对接和动态模拟揭示了葛根素缓"

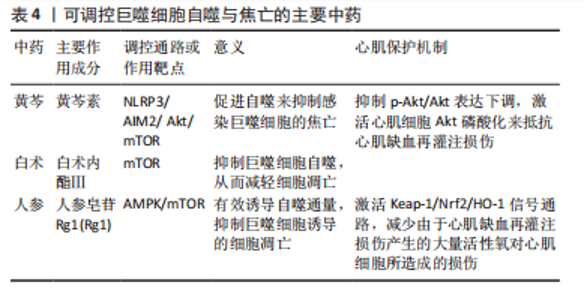
解心肌缺血再灌注损的具体作用机制,通过激活SIRT1通路抑制铁死亡从而缓解心肌缺血再灌注损伤,为葛根素充当心肌保护剂的临床使用提供了理论依据。在焦亡的启动中,脂多糖可通过激活炎症小体和caspase-1直接参与,而ATP则可能通过激活P2X7R等受体间接参与其中。胡椒碱作为胡椒等中医药用植物中的主要活性成分,可抑制巨噬细胞内被诱导的炎症小体活化和细胞焦亡,主要路径便是通过影响脂多糖和ATP实现[50]。有实验表明,在调控脂多糖/ATP诱导的巨噬细胞焦亡方面,中药红景天中红景天苷能通过够降低乳酸脱氢酶和白细胞介素1β的释放、NLRP3、caspase-1和GSDMD p30的蛋白水平参与[51]。此外,红景天可调控miR-378a-3p, 发挥心肌缺血再灌注损伤时保护心肌细胞的作用[52]。NLRP3炎症小体不仅可以被红景天苷作用,姜黄、莪术等中药姜科植物中的天然酚类抗氧化剂姜黄素,也可通过抑制核因子κB和NLRP3炎症小体抑制巨噬细胞焦亡[53],并可在此基础上发挥心肌缺血再灌注损伤时的保护作用[54],也可抑制GRP78/Caspase-12通路激活改善心肌缺血再灌注损伤造成的心肌细胞凋亡[55]。环黄芪醇,一种黄芪中分离出的天然活性小化合物,亦能显著抑制NLRP3炎症小体介导的细胞焦亡[56];其另一种活性物质黄芪多糖,则与激活NRG-1/ErbB信号通路密切相关,并可由此减轻心肌缺血再灌注损伤引发的心肌细胞损伤[57]。ZHANG等[58] 在动物实验研究中发现黄芪甲苷也有同样作用,抑制NLRP3炎症小体,可通过减少活性氧的释放达到并抑制心肌细胞焦亡的激活,同时可减少由于心肌缺血所诱导的心肌纤维化和心脏重塑;并能抑制心肌心肌缺血再灌注损伤和细胞凋亡,也可通过上调NRF2/HO-1信号通路的表达实现[59]。作为穿心莲中活性成分的穿心莲内酯,可下调促炎性 miR-155-5p的表达,进而促进Nrf2的表达,以抑制感染巨噬细胞中的细胞焦亡[60]。穿心莲内酯还可作用于AIM2炎症小体,抑制由其介导的巨噬细胞焦亡[61]。在预防心肌缺血再灌注损伤上,穿心莲内酯可通过抑制HMGB1、TLR4和核因子κB蛋白及mRNA表达,减轻炎症反应预防心肌损伤[62]。部分中药复方对巨噬细胞焦亡也有作用关系密切的靶点。实验研究发现,复方加味苇茎汤与Caspase-1/GSDMD通路密切相关,可减少炎症因子的释放,抑制巨噬细胞焦亡[63]。复方四妙勇安汤也表现出具有抑制巨噬细胞焦亡的作用,可作用于活性氧,通过抑制作用减少焦亡信号通路NLRP3、Caspase-1、GSDMD蛋白表达,对线粒体也有较强的保护作用进而抑制巨噬细胞焦亡[64]。 可调控巨噬细胞焦亡的主要中药见表3。"

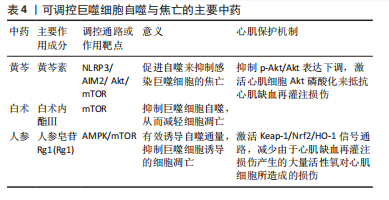
2.4.4 巨噬细胞自噬与焦亡途径在中药的研究 焦亡是调节性细胞死亡的促炎形式,在某些情况下,自噬和焦亡可以相互作用、相互影响。在对中药黄芩中黄芩素作用的分子机制研究中,结果表明黄芩素能下调AIM2和NLRP3炎症小体的组装,促进自噬来抑制感染巨噬细胞的焦亡。进一步的研究还表明,黄芩素这一作用是通过抑制Akt/mTOR通路激活,以及对AIM2蛋白的抑制实现的,这也说明了其对细胞自噬的影响[65]。动物实验也表明,黄芩素可抑制p-Akt/Akt表达下调,激活心肌细胞Akt磷酸化来抵抗心肌缺血再灌注损伤[66]。自噬与焦亡之间的关系,自噬往往对细胞凋亡具有双向作用,白术内酯Ⅲ是白术的主要活性成分,CHEN等[67]研究发现,其可通过mTOR依赖性方式抑制巨噬细胞自噬,从而减轻细胞凋亡。中药人参中的人参皂苷Rg1,也可抑制巨噬细胞诱导的细胞凋亡,这在YANG等[68]的分子机制研究中得到了证实,其作用途径是通过激活 AMPK/mTOR信号通路,从而有效诱导自噬通量。人参皂苷Rg1还可通过激活Keap-1/Nrf2/HO-1信号通路,减少由于心肌缺血再灌注损伤产生的大量活性氧对心肌细胞所造成的损伤[69]。 可调控巨噬细胞自噬与焦亡的主要中药见表4。"
| [1] 马丽媛, 王增武, 樊静, 等.《中国心血管健康与疾病报告2021》要点解读[J]. 中国全科医学,2022,25(27):3331-3346. [2] GAO N, QI X, DANG Y, et al. Association between total ischemic time and in-hospital mortality after emergency PCI in patients with acute ST-segment elevation myocardial infarction: a retrospective study. BMC Cardiovasc Disord. 2022;22(1):80. [3] LUONGO TS, LAMBERT JP, GROSS P, et al. The mitochondrial Na+/Ca2+ exchanger is essential for Ca2+ homeostasis and viability. Nature. 2017;545(7652):93-97. [4] QUAN C, LI M, DU Q, et al. SPEG Controls Calcium Reuptake Into the Sarcoplasmic Reticulum Through Regulating SERCA2a by Its Second Kinase-Domain. Circ Res. 2019;124(5):712-726. [5] YU H, ZHANG F, YAN P, et al. LARP7 Protects Against Heart Failure by Enhancing Mitochondrial Biogenesis. Circulation. 2021;143(20): 2007-2022. [6] KRYLOVA IB, SELINA EN, BULION VV, et al. Uridine treatment prevents myocardial injury in rat models of acute ischemia and ischemia/reperfusion by activating the mitochondrial ATP-dependent potassium channel. Sci Rep. 2021;11(1):16999. [7] 何贵新,秦伟彬,林琳,等.芪参益气滴丸联合间充质干细胞移植改善小鼠心功能与巨噬细胞表型的相关性研究[J].中华中医药学刊,2019,37(7):1554-1557. [8] 何贵新,肖婷,秦伟彬,等.基于PI3K/AKT信号通路探讨芪参益气滴丸改善心肌缺血再灌注损伤的实验研究[J].北京中医药大学学报,2020,43(9):762-768. [9] 詹玲君,秦伟彬,何贵新,等. 基于mitoKATP/PI3K/mTOR探讨芪参益气滴丸影响H9C2心肌细胞损伤后钙稳态及炎性环境的机制[J].时珍国医国药,2023,34(9):2087-2090. [10] VAN OSCH T, STEUTEN J, NOUTA J, et al. Phagocytosis of platelets opsonized with differently glycosylated anti-HLA hIgG1 by monocyte-derived macrophages. Platelets. 2023;34(1):2129604. [11] ZHANG Q, CHIU Y, CHEN Y, et al. Harnessing the synergy of perfusable muscle flap matrix and adipose-derived stem cells for prevascularization and macrophage polarization to reconstruct volumetric muscle loss.Bioact Mater. 2023;22:588-614. [12] CAI S, ZHAO M, ZHOU B, et al. Mitochondrial dysfunction in macrophages promotes inflammation and suppresses repair after myocardial infarction. J Clin Invest. 2023;133(4):e159498. [13] ROBINSON N, GANESAN R, HEGEDUS C, et al. Programmed necrotic cell death of macrophages: Focus on pyroptosis, necroptosis, and parthanatos. Redox Biol. 2019;26:101239. [14] LI Y, WANG Y, GUO H, et al. IRF2 contributes to myocardial infarction via regulation of GSDMD induced pyroptosis. Mol Med Rep. 2022; 25(2):40. [15] YE X, ZHANG P, ZHANG Y, et al. GSDMD contributes to myocardial reperfusion injury by regulating pyroptosis. Front Immunol. 2022;13: 893914. [16] YUAN W, LIANG X, LIU Y, et al. Mechanism of miR-378a-3p enriched in M2 macrophage-derived extracellular vesicles in cardiomyocyte pyroptosis after MI. Hypertens Res. 2022;45(4):650-664. [17] WANG Y, SHI P, CHEN Q, et al. Mitochondrial ROS promote macrophage pyroptosis by inducing GSDMD oxidation. J Mol Cell Biol.2019;11(12):1069-1082. [18] TAKAHASHI M. Role of NLRP3 Inflammasome in Cardiac Inflammation and Remodeling after Myocardial Infarction. Biol Pharm Bull. 2019; 42(4):518-523. [19] LIU M, LU J, YANG S, et al. Alliin alleviates LPS-induced pyroptosis via promoting mitophagy in THP-1 macrophages and mice. Food Chem Toxicol. 2022;160:112811. [20] ZHANG T, HUANG D, HOU J, et al. High-concentration homocysteine inhibits mitochondrial respiration function and production of reactive oxygen species in neuron cells. J Stroke Cerebrovasc Dis. 2020;29(10): 105109. [21] LIU ZF, WANG HM, JIANG M, et al. Mitochondrial Oxidative Stress Enhances Vasoconstriction by Altering Calcium Homeostasis in Cerebrovascular Smooth Muscle Cells under Simulated Microgravity.Biomed Environ Sci. 2021;34(3):203-212. [22] KLISHIN A, SEDOVA M, BLATTER LA. Time-dependent modulation of capacitative Ca2+ entry signals by plasma membrane Ca2+ pump in endothelium. Am J Physiol. 1998;274(4):C1117-C1128. [23] Zang Y, Liu S, Cao A, et al. Astragaloside IV inhibits palmitic acid-induced apoptosis through regulation of calcium homeostasis in mice podocytes. Mol Biol Rep. 2021;48(2):1453-1464. [24] 王冉冉,朱天瑞,张凤,等.长期淫羊藿苷治疗对APP/PS1小鼠神经炎症的影响[J].山东大学学报(医学版),2020,58(4):71-77. [25] 陈浩,吴彬,袁萍,等.淫羊藿素调控NF-κB信号活性干预心肌缺血再灌注损伤大鼠的初步研究[J].赣南医学院学报,2020,40(9): 881-885. [26] PARK H, OH MS. Houttuyniae Herba protects rat primary cortical cells from Abeta(25-35)-induced neurotoxicity via regulation of calcium influx and mitochondria-mediated apoptosis. Hum Exp Toxicol. 2012; 31(7):698-709. [27] 李少金,方婉仙,肖水秀,等.鱼腥草挥发油对小鼠脑缺血再灌注损伤的保护作用及机制研究[J]. 天津中医药,2018,35(4):297-301. [28] GAO Y, HOU R, FEI Q, et al. The Three-Herb Formula Shuang-Huang-Lian stabilizes mast cells through activation of mitochondrial calcium uniporter. Sci Rep. 2017;7:38736. [29] 陈晨,林科,王恺婧,等.黄连素通过KLF4减轻缺血/再灌注损伤所致的大鼠心肌细胞凋亡的作用机制研究[J].心电与循环,2023, 42(3):213-217+222+303. [30] 张晓延.黄芪注射液通过调控细胞自噬发挥抗炎作用的分子机制研究[D].太原:山西医科大学,2020. [31] TU Y J, TAN B, JIANG L, et al. Emodin Inhibits Lipopolysaccharide-Induced Inflammation by Activating Autophagy in RAW 264.7 Cells. Chin J Integr Med. 2021;27(5):345-352. [32] 李九九,汪光军,刘政祥,等.黄精水提物干预脂多糖诱导的巨噬细胞极化与自噬研究[J].食品安全质量检测学报,2021,12(19): 7772-7777. [33] 赖琦.黄芪甲苷通过诱导自噬抗炎的作用及机制研究[D].昆明:云南中医学院,2018. [34] YING Y, SUN CB, ZHANG SQ, et al. Induction of autophagy via the TLR4/NF-kappaB signaling pathway by astragaloside Ⅳ contributes to the amelioration of inflammation in RAW264.7 cells. Biomed Pharmacother. 2021;137:111271. [35] CHEN W, LI X, GUO S, et al. Tanshinone IIA harmonizes the crosstalk of autophagy and polarization in macrophages via miR-375/KLF4 pathway to attenuate atherosclerosis. Int Immunopharmacol. 2019;70:486-497.
[36] 文琳.丹参酮ⅡA介导的14-3-3η通过调节自噬减轻心脏缺血/再灌注损伤[D].南昌:南昌大学,2022. [37] 张磊磊,谢周良,权晓强,等.丹参酮ⅡA通过miR-155-5p激活SIRT1-AMPK通路改善H9c2心肌细胞缺血/再灌注损伤[J].中国免疫学杂志,2023,39(12):2507-2512. [38] 嵇成锋,王琛,张和香,等.二氢丹参酮对心肌细胞缺血再灌注损伤的保护作用[J].西北药学杂志,2023,38(6):77-82. [39] 曹乾.在ApoE-/-小鼠中青蒿素通过AMPK/mTOR/ULK1促进巨噬细胞自噬减轻动脉粥样硬化机制研究[D].沈阳:中国医科大学,2020. [40] 刘红权,王玉,郭立中,等.犀角地黄汤对脑缺血大鼠的自噬相关蛋白Atg-5、Be-clin-1表达的研究[J].南京中医药大学学报,2014, 30(1):61-64. [41] 刘盼,王晓英,韩丹.地黄苷A通过调节AKT/Nrf2/GPX4信号通路介导的铁死亡改善大鼠心肌缺血再灌注损伤[J].中西医结合心脑血管病杂志,2023,21(22):4112-4119. [42] 游宇,李林,侯贝贝,等.补阳还五汤抗ApoE-/-小鼠动脉粥样硬化作用与调控巨噬细胞自噬的机制研究[J].中药药理与临床,2018, 34(4):2-6. [43] 张国鑫.补阳还五汤通过SIRT1/FoxO1信号减轻心肌缺血/再灌注损伤的机制研究[D].沈阳:辽宁中医药大学,2023. [44] 李苓顼.补阳还五汤改善血小板功能抗MI/RI的作用研究[D].桂林:桂林医学院,2023. [45] 林文勇,施雪斐,张春伶,等.清热化瘀方调控Th17对小鼠心肌缺血再灌注损伤的影响[J].中成药,2024,46(2):595-600. [46] 郑一,郭鹤,包永睿,等.基于NF-κB/NLRP3/Caspase-1通路介导的巨噬细胞焦亡探究葛根芩连汤对动脉粥样硬化易损斑块的干预机制[J].中国实验方剂学杂志,2022,28(11):70-78. [47] 章平衡,李春燕,刘永源,等.葛根素通过抑制ox-LDL诱导巨噬细胞焦亡通路活化稳定AS易损斑块[J].中国免疫学杂志,2021,37(18): 2212-2216. [48] SUN S, GONG D, LIU R, et al. Puerarin Inhibits NLRP3-Caspase-1-GSDMD-Mediated Pyroptosis via P2X7 Receptor in Cardiomyocytes and Macrophages. Int J Mol Sci. 2023;24(17):13169. [49] 张春艳,曹晓璐,刘嵩,等.基于分子对接和分子动态模拟探讨葛根素缓解大鼠心肌缺血再灌注损伤的作用机制[J].华中科技大学学报(医学版),2024,53(1):26-32. [50] 梁译丹.胡椒碱抑制ATP诱导的巨噬细胞焦亡及抗败血症的机制研究[D].广州:暨南大学,2017. [51] LIU X, ZHOU M, DAI Z, et al. Salidroside alleviates ulcerative colitis via inhibiting macrophage pyroptosis and repairing the dysbacteriosis-associated Th17/Treg imbalance. Phytother Res. 2023;37(2):367-382. [52] 张悦,彭景,杨云方,等.大株红景天调控miR-378a-3p抗心肌细胞缺氧/复氧损伤的作用机制研究[J].中国药学杂志,2023,58(18): 1693-1698. [53] RAN Y, SU W, GAO F, et al.Curcumin Ameliorates White Matter Injury after Ischemic Stroke by Inhibiting Microglia/Macrophage Pyroptosis through NF-kappaB Suppression and NLRP3 Inflammasome Inhibition.Oxid Med Cell Longev. 2021;2021:1552127. [54] 王琛,赵小建,孟哲,等.姜黄素通过调节HMGB1/NF-κB通路对大鼠心肌缺血再灌注损伤的保护作用研究[J].中西医结合心脑血管病杂志,2023,21(11):1977-1983. [55] 曾石秀,陈艳,韩巧秀,等.姜黄素经内质网应激对缺血再灌注损伤大鼠心肌凋亡的保护作用及机制研究[J].赣南医学院学报,2023, 43(9):943-949. [56] DENG G, CHEN W, WANG P, et al. Inhibition of NLRP3 inflammasome-mediated pyroptosis in macrophage by cycloastragenol contributes to amelioration of imiquimod-induced psoriasis-like skin inflammation in mice. Int Immunopharmacol. 2019;74:105682. [57] 黄莉芳,刘超权.基于NRG-1/ErbB信号通路探讨黄芪多糖对心肌缺血再灌注损伤大鼠的影响[J].中西医结合心脑血管病杂志,2023, 21(18):3351-3356. [58] ZHANG X, QU H, YANG T, et al. Astragaloside IV attenuate MI-induced myocardial fibrosis and cardiac remodeling by inhibiting ROS/caspase-1/ GSDMD signaling pathway. Cell Cycle. 2022;21(21):2309-2322. [59] 李泽华,关贤颂,蒋路平.黄芪甲苷通过NRF2/HO-1信号通路减轻小鼠心肌缺血再灌注损伤[J]. 中国病理生理杂志,2021,37(12): 2147-2153. [60] FU Y, SHEN J, LIU F, et al.Andrographolide Suppresses Pyroptosis in Mycobacterium tuberculosis-Infected Macrophages via the microRNA-155/Nrf2 Axis.Oxid Med Cell Longev. 2022;2022:1885066. [61] Gao J, Peng S, Shan X, et al. Inhibition of AIM2 inflammasome-mediated pyroptosis by Andrographolide contributes to amelioration of radiation-induced lung inflammation and fibrosis. Cell Death Dis. 2019;10(12):957. [62] 吕俊林,吕建瑞,贺进进,等.穿心莲内酯对心肌缺血再灌注损伤大鼠炎症的影响[J].湖北中医药大学学报,2020,22(2):21-25. [63] 尚东方,赵晨露,王思颖,等.基于Caspase-1/GSDMD通路探讨加味苇茎汤对巨噬细胞焦亡模型干预作用[J].中国实验方剂学杂志, 2024,30(11):27-33. [64] 赵一璇.从ROS-NLRP3炎性体途径探讨活血解毒法干预巨噬细胞焦亡的实验研究[D].天津:天津中医药大学,2021. [65] Ning B, Shen J, Liu F, et al. Baicalein Suppresses NLRP3 and AIM2 Inflammasome-Mediated Pyroptosis in Macrophages Infected by Mycobacterium tuberculosis via Induced Autophagy. Microbiol Spectr. 2023;11(3):e471122. [66] 吴萌,李祥平,项艳.黄芩素脂质聚合物纳米粒对大鼠心肌缺血再灌注损伤的作用机制研究[J]. 实用药物与临床,2024,27(1):1-5. [67] Chen S, Tang K, Hu P, et al. Atractylenolide III alleviates the apoptosis through inhibition of autophagy by the mTOR-dependent pathway in alveolar macrophages of human silicosis. Mol Cell Biochem. 2021; 476(2):809-818. [68] Yang P, Ling L, Sun W, et al. Ginsenoside Rg1 inhibits apoptosis by increasing autophagy via the AMPK/mTOR signaling in serum deprivation macrophages. Acta Biochim Biophys Sin (Shanghai). 2018; 50(2):144-155. [69] 杨春昆,潘清泉,吉奎,等.人参皂苷对心肌缺血/再灌注损伤的保护机制[J].世界中西医结合杂志, 2023,18(3):631-636. |
| [1] | Li Yiwen, Liu Feixiang, Zhang Yunke. Regulation of lysosome function by stem cells in treatment of lysosomal storage diseases [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(1): 145-152. |
| [2] | Zhou Panpan, Cui Yinglin, Zhang Wentao, Wang Shurui, Chen Jiahui, Yang Tong . Role of cellular autophagy in cerebral ischemic injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1650-1658. |
| [3] | Jiang Qiyu, Zeng Huiyan. A novel analysis and prediction method for potential mechanisms of traditional Chinese medicine based on artificial intelligence and omics data-driven approach [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7552-7561. |
| [4] | Zhu Chuanxi, Qiu Long, Li Lingxu, Ji Guangcheng. Chinese herbal prescription combined with head acupuncture exercise therapy improves limb spasticity in rats with ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7571-7577. |
| [5] | Zhu Jiaping, Gao Bo, Lou Chunbiao, Yang Fengyong, Yang Kun. Monomeric traditional Chinese medicine in the treatment of rheumatoid arthritis: regulation of T cell balance [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6955-6962. |
| [6] | Xu Zhenhua, Li Yanjie, Qin Hewei, Liu Haoyuan, Zhu Bochao, Wang Yupu. Traditional Chinese medicine monomer in treatment of neuroinflammation after spinal cord injury: effects of nuclear transcription factor kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 590-598. |
| [7] | Liu Yuan, Qu Yuan, Wan Yakun, Guo Jingyu, Jiang Ping. Transcriptomic analysis and drug prediction of basement membrane-related genes in different traditional Chinese medicine patterns of rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(25): 5486-5500. |
| [8] | Fang Yuting, Peng Hong, Pang Yujie. Inflammatory signaling pathways in traditional Chinese medicine for treating fever after lumbar interbody fusion surgery [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(21): 4568-4575. |
| [9] | Zhang Shuo, Cui Yinglin, Zhou Panpan, Li Yile, Wang Lei, Zou Qianqian. Role of endoplasmic reticulum stress-autophagy in cerebral ischemia-reperfusion injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(20): 4325-4332. |
| [10] | Shen Xiaoqiu, Wang Zhentao, Qiu Yueqing, Song Chenghao. Traditional Chinese medicine monomers regulate ferroptosis to combat myocardial ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(20): 4333-4340. |
| [11] | Cao Panxia, Peng Zining, Liu Shanshan, Fei Tiantian, Liang Tengyun, Zhang Mengwen, Wu Hong. AMP-activated protein kinase mediates macrophage fatty acid oxidation: an approach to prevent and treat atherosclerosis with traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(18): 3906-3914. |
| [12] | Zhou Panpan, Yang Tong, Wang Shurui, Cui Yinglin . Role of ferroptosis in ischemic brain injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3675-3683. |
| [13] | Lai Yue, Lin Xuan, Xu Miao, Liu Huan, Shen Jianlin, Huang Wenhua. Medication pattern and mechanism of marine traditional Chinese medicine in the treatment of osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3713-3723. |
| [14] | Zhou Chao, Yu Guangyu, Yang Shaohua, Gao Leilei, Jin Zhen, Jiang Yueyuan, Li Huan. Prediction model and verification of sperm DNA fragments based on traditional Chinese medicine syndrome and semen quality-related parameters [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(13): 2661-2668. |
| [15] | Zhou Wenyang, Liao Yehui, Tian Minghao, He Baoqiang, Zhong Dejun. Effect of NLRP3 inflammasome in microglia after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(13): 2849-2860. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||