Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (6): 1265-1275.doi: 10.12307/2025.310
Previous Articles Next Articles
Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise
Zhang Wenhua1, Li Xun2, Zhang Weichao1, Li Xinying1, Ma Guoao1, Wang Xiaoqiang2
- 1School of Postgraduate Education, 2School of Sports and Health, Shandong Sport University, Jinan 250102, Shandong Province, China
-
Received:2024-02-27Accepted:2024-03-25Online:2025-02-28Published:2024-06-22 -
Contact:Wang Xiaoqiang, PhD, Associate professor, School of Sports and Health, Shandong Sport University, Jinan 250102, Shandong Province, China -
About author:Zhang Wenhua, Master candidate, School of Postgraduate Education, Shandong Sport University, Jinan 250102, Shandong Province, China Li Xun, PhD, Associate professor, School of Sports and Health, Shandong Sport University, Jinan 250102, Shandong Province, China Zhang Wenhua and Li Xun contributed equally to this work. -
Supported by:Science and Technology Program for Higher Education Institutions in Shandong Province, No. J18KA179 (to LX)
CLC Number:
Cite this article
Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
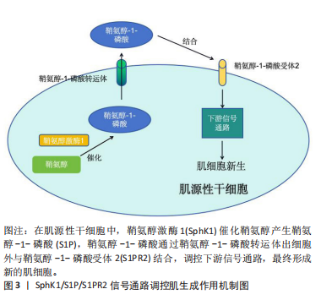
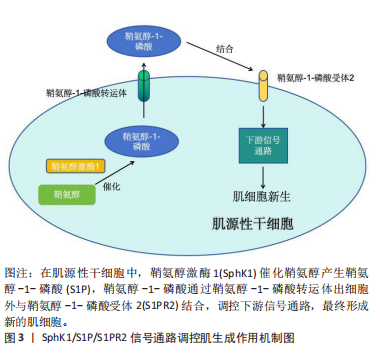
2.1 SphK1/S1P/S1PR2信号通路 2.1.1 SphK1/S1P/S1PR2信号通路概述 SphK1/S1P/S1PR2信号通路在人体中发挥着极为重要的作用,从机体到分子层面都扮演着调控生长发育、病理过程和细胞功能的角色。在机体层面,其介导的细胞传导途径参与各种生理病理过程,调节人体生长发育[12];在系统层面,SphK1/S1P/S1PR2信号通路能从不同方面参与调控消化、心血管、肌骨系统的发病机制,该通路可能在系统疾病的治疗中具有潜在价值[13-16];在组织层面,S1P广泛存在与肌肉组织中,对骨骼肌的正常收缩功能很重要,可以防止肌肉过早疲劳[10];在细胞层面,SphK1/S1P/S1PR2信号通路是一条关乎细胞的存亡与增殖调控的信号传递路径;在分子层面,S1P作为一种脂质信号分子,既是细胞外递质,通过细胞膜表面上的受体作用于细胞外,与S1PR2受体结合,产生“由内向外”的信号通路,发挥生物学效应,也是细胞内信号传导的第二信使,直接作用于细胞内的不同信号靶点介导多种生物学效应[17]。 2.1.2 SphK1/S1P/S1PR2信号通路核心分子 SphK1:鞘氨醇激酶是一种广泛存在的脂类激酶。目前发现它有两种亚型,根据它们被发现的顺序和自身的特性分别命名为鞘氨醇激酶1(SphK1)和鞘氨醇激酶2,它们在生化特性、亚细胞定位和组织表达模式上存在差异[18]。有研究显示SphK1和鞘氨醇激酶2在体内可能发挥相反的生物学效应,推测这两种激酶可能在功能上互补[19]。它们催化相同的生化反应,但底物亲和力和亚细胞定位不同,从而对细胞功能产生不同的影响[20]。SphK1主要促进细胞增殖并抑制细胞凋亡,而鞘氨醇激酶2则具有促进凋亡的作用[18]。SphK1主要位于细胞质中,其被磷酸化激活后转移到细胞质膜上,催化S1P生成,其产生的S1P通过质膜上的转运蛋白转移到细胞外以发出信号[18],其在脉管、神经、肌肉及免疫系统中发挥关键作用[21]。鞘氨醇激酶2主要分布在细胞核、内质网和线粒体上,其催化产生的S1P可以调节基因的表达及线粒体呼吸[18]。 S1P:是鞘氨醇在鞘氨醇激酶作用下产生的磷脂信号分子,是骨骼肌系统中常见的第一或第二信使[22-23]。鞘氨醇脂质是真核生物中的特异性细胞脂质,其特征是一种特殊的脂族氨基醇,称为鞘氨醇[24]。S1P特异性磷酸酶可以使S1P去磷酸化以形成鞘氨醇,或者鞘氨醇-1-磷酸裂解酶不可逆地降解S1P以形成脂肪醛和磷酸乙醇胺[25],从而保证了人体生理环境中S1P的动态平衡。在血液循环中发现S1P水平较高,而在大多数其他组织中S1P水平非常低。S1P通过结合5种G蛋白偶联受体激活下游的一系列信号途径,来调节细胞的生长、增殖、迁移及骨架构建等多种生物功能[26]。 S1PR2:配体激活后,鞘氨醇-1-磷酸受体与不同的异源三聚体G蛋白亚基偶联,激活不同的下游信号通路[27]。有3种S1P受体亚型在成人骨骼肌中表达。鞘氨醇-1-磷酸受体1和鞘氨醇-1-磷酸受体3定位在成纤维的细胞和核膜中[28]。鞘氨醇-1-磷酸受体1和鞘氨醇-1-磷酸受体3在静止卫星细胞表达,而S1PR2仅在激活的卫星细胞中短暂表达。鞘氨醇-1-磷酸受体1负调控再生大鼠比目鱼肌纤维的生长,而鞘氨醇-1-磷酸受体3具有相反的积极作用[29]。然而,有研究证明,在没有鞘氨醇-1-磷酸受体3的情况下,胫骨前肌小鼠在单次和重复的肌肉损伤周期后,急性再生都会增强[29]。因此,通过鞘氨醇-1-磷酸受体3发出的信号可能有助于控制卫星细胞的静止[29],而通过S1PR2的信号传导则可能驱动成肌细胞中S1P介导的增殖和/或分化[29]。最后,缺乏S1PR2导致肌纤维生长延迟[29]。 2.2 激活SphK1/S1P/S1PR2信号通路促进肌生成 骨骼肌的生长发育涉及到多个环节,包括成肌细胞的增殖、迁移、分化、融合、形成新的肌纤维[30]。SphK1/S1P/S1PR2信号通路使改善人体健康的作用更加细化,其在改善骨骼肌健康方面,能够促进肌源性分化,进而保证骨骼肌的生长发育。卫星细胞位于肌纤维膜与基底膜之间,具备肌源性干细胞的特性,展现出显著的增殖与分化潜能[31]。成肌细胞是被激活的卫星细胞,也是骨骼肌的前体细胞,具有自我更新和生成新的肌纤维的能力,对维持和改善运动能力非常重要[3]。SphK1起到促肌源性分化的作用,这种激酶在细胞中的过度表达会减少成肌细胞的增殖,并增加成肌分化标志物的表达[32]。而抑制SphK1的表达则会增加成肌细胞增殖并延迟肌肉分化的开始。由SphK1/2催化的鞘氨醇磷酸化产生具有生物活性的鞘脂S1P,其在骨骼肌生物学中起着重要作用[33-34]。有研究结果证实了S1P在维持肌肉纤维营养方面的关键作用,并表明S1P信号传导有助于减轻杜氏肌营养不良症小鼠比目鱼的病理状态,该研究验证了S1P信号通路是肌肉萎缩症的潜在治疗靶点[35]。S1P信号传导还可以作为帮助预测预防和治疗新型冠状病毒感染的急性和长期骨骼肌功能障碍的新靶点[36]。S1P受体的表达变化发生在成肌细胞向肌管分化的过程中[32]。S1P通过与S1PR2结合,可以抑制血清诱导的肌肉干细胞增殖并促进肌肉分化[32]。S1PR2通过维持新形成的肌纤维的分化和生长是肌肉再生早期阶段的关键[37]。SphK1/S1P/S1PR2信号通路调控肌生成作用机制见图3。 "

2.2.1 SphK1/S1P/S1PR2信号通路调控卫星细胞增殖 SphK1/S1P/S1PR2信号通路可通过调控骨骼肌卫星细胞增殖促进肌生成。LOH等[7]证明SphK1/S1P/S1PR2信号通路刺激骨骼肌卫星细胞的细胞周期,静止卫星细胞的激活并增殖主要依靠SphK1/S1P/S1PR2信号通路以及信号转导和转录激活因子3的共同作用,其机制涉及Ras相关C3肉毒毒素亚基1和Ras同源基因家族成员A。卫星细胞激活的机制包括S1P水平的增加(通过SphK1活性的增加和鞘氨醇-1-磷酸裂解酶活性的降低)和S1PR2激活,S1P通过与S1PR2结合负向调节Ras相关C3肉毒毒素亚基1,激活Ras同源基因家族成员A并导致信号转导和转录激活因子3酪氨酸磷酸化,下游p21基因和p27基因(细胞周期蛋白依靠性激酶抑制剂)表达的减少,最终,卫星细胞重新进入细胞周期并促进肌肉生长[7]。信号转导和转录激活因子3的激活仅出现在再生肌肉中激活的卫星细胞、增殖的成肌细胞与存活的肌细胞。因此,信号转导和转录激活因子3是调节骨骼肌早期再生的重要信号分子[38]。DE LA GARZA-RODEA等[39]将鞘氨醇-1-磷酸裂解酶抑制剂递送至肌营养不良小鼠可提高肌肉S1P水平和增加卫星细胞的数量,减少外周血和骨骼肌中的白细胞,并减轻肌肉炎症和退化。 2.2.2 SphK1/S1P/S1PR2信号通路调控成肌细胞分化 SphK1/S1P/S1PR2信号通路可通过调控成肌细胞的分化促进肌生成。鞘氨醇-1-磷酸转运体是一种S1P转运蛋白,可输出S1P以启动脂质信号级联反应[40]。通过阻断鞘氨醇-1-磷酸裂解酶激活了SphK1/S1P/S1PR2信号通路,导致鞘氨醇-1-磷酸转运体上调,进而诱导成肌细胞的肌源性分化[41]。BRUNO等[42]研究发现激肽/激肽释放酶系统的主要成员缓激肽也能够通过鞘氨醇-1-磷酸转运体和SphK1/S1P/S1PR2信号通路在成肌细胞中诱导肌原性分化。此外,运动对肌肉的影响之一是通过旁分泌/自分泌胰岛素样生长因子1和鸢尾素介导的,运动干预能够刺激胰岛素样生长因子1和鸢尾素分泌,可有效缓解肌肉萎缩和肌肉质量流失[43]。一项研究显示,胰岛素样生长因子1引发的SphK1激活和S1PR2的反式激活是促肌作用所必需的[44],而另一项研究则确定了SphK1/S1P/S1PR轴在鸢尾素形成和释放中的关键作用以及鸢尾素对成肌细胞增殖和肌源性分化的自分泌和旁分泌作用[9]。关于成肌细胞的增殖,它是细胞数量的增加,但这并不直接等同于细胞的分化,在促肌源性分化的过程中,常需要在某一阶段抑制成肌细胞的增殖,以便为分化创造更有利的环境。这是因为,如果成肌细胞持续增殖而不分化,那么它们可能无法有效地转化为成熟的肌细胞,从而影响了整个分化过程的效率,并且在肌肉再生过程中,正常细胞周期结束后会诱导成肌分化开始[45]。DONATI等[45]发现,在由S1P/S1PR2信号通路激活下游各种信号通路中,细胞外调节蛋白激酶1/2信号通路和p38丝裂原活化蛋白激酶信号通路的激活分别是抑制细胞增殖和刺激肌源性分化所必需的,此研究为探索S1P在肌营养不良治疗中的作用机制提供了重要的实验基础。 综上所述,SphK1/S1P/S1PR2信号通路在肌生成中扮演着重要角色,它通过激活卫星细胞增殖,促进成肌细胞分化,从而有效改善肌肉的生长与修复过程。这一信号通路的调控不仅有助于肌肉损伤后的再生,还能提升肌肉质量,对于肌肉相关疾病的治疗具有重要意义。SphK1/S1P/S1PR2信号通路对卫星细胞和成肌细胞的调控作用及意义汇总见表1。"


2.3 运动对SphK1/S1P/S1PR2信号通路的影响 运动作为一种生理刺激,可以对机体产生广泛的影响,包括改善心血管功能、增强免疫力和调节代谢等。这些效应部分是通过调节细胞内信号通路来实现的。关于运动对SphK1/S1P/S1PR2信号通路的影响,目前已有一些研究报道。运动可能通过激活SphK1酶,增加S1P的生成。S1P随后与其受体S1PR2结合,触发下游信号转导事件[7,41,46-48]。这些事件可能包括激活或抑制特定的转录因子、调节基因表达、改变细胞骨架结构等,最终影响细胞的生物学行为和功能。具体来说,运动可能通过SphK1/S1P/S1PR2信号通路参与调节肌肉生长和修复。在运动过程中,肌肉受到机械刺激和代谢应激,这可能导致肌肉损伤和炎症。SphK1/S1P/S1PR2信号通路的激活可能有助于促进肌肉卫星细胞的增殖和分化,加速肌肉修复过程。运动作为一种应激性的刺激,一次剧烈的运动就能触发机体产生一连串的生理反应,而长时间的运动则有可能触发机体在骨骼肌结构重塑和血糖管理等方面的适应性改变[30]。 2.3.1 急性运动对SphK1/S1P/S1PR2信号通路的影响 一次性运动以时间和强度依赖的方式增加血液和骨骼肌中S1P的水平,推测S1P可能在骨骼肌适应运动中发挥重要作用。在跑台实验中,大鼠分别进行了30 min、90 min和力竭运动,随着运动时间的推移,比目鱼、腓肠肌红色部分和腓肠肌白色部分的丝氨酸棕榈酰转移酶在各个肌肉组织中的活性和表达逐步上升,而酸性鞘磷脂酶的活性则逐步下降;在进行了力竭运动之后,神经酰胺酶的两个亚型在每一块肌肉里的活跃度都有所下降;神经酰胺的水平是由运动的持续时间和肌肉的种类所决定的。经过30 min的运动后,比目鱼和腓肠肌的白色区域的神经酰胺水平会有所降低,而在进行力竭运动之后,红色腓肠肌和比目鱼肌的水平则会上升;30 min的跑步不会对肌肉中的S1P含量产生影响,但在90 min的跑步时,腓肠肌的红色区域会有所增长;在进行了力竭运动之后,比目鱼肌和腓肠肌红色区域的S1P水平都有了显著的提升[49]。该实验结论是运动强烈影响参与神经酰胺代谢的关键酶的活性,从而影响骨骼肌中S1P的水平[49]。 男子耐力运动员静息血浆中S1P浓度高于未经训练的受试者,红细胞中鞘氨醇、S1P、二氢鞘氨醇-1-磷酸和神经酰胺含量降低;受试者分别进行30 min(未训练组)或60 min(训练组)70%VO2max(最大摄氧量)强度的自行车运动,在未经训练的个体中,血浆S1P浓度在运动30 min后保持稳定,恢复30 min后,血浆中S1P和二氢鞘氨醇-1-磷酸的水平明显提高,而耐力运动员在运动期间和运动后都保持稳定[50]。推测,运动诱导血浆S1P浓度升高可能是体力活动对心血管健康和胰岛素敏感性有益作用的机制之一[50]。 健康男青年运动员进行不同强度和不同运动时间的单腿功率自行车运动时,受试者在55%的最大功率下进行120 min的单腿运动,股外侧肌S1P水平随锻炼时间成正比地提高,其影响程度还取决于锻炼强度,因30 min锻炼时S1P水平提高发生在55%及85%的最大功率锻炼时,而不是25%最大功率的运动中[51];运动员们在赛艇功率计上进行65%VO2max强度、60 min的运动,二氢鞘氨醇-1-磷酸水平升高40%,这种效应在运动停止后至少持续30 min,24 h后,血浆二氢鞘氨醇-1-磷酸浓度恢复到基线水平[51];运动至精疲力竭时血浆鞘氨醇、S1P和二氢鞘氨醇-1-磷酸水平均显著升高[51];在两种运动中或运动后,神经酰胺总浓度或单个神经酰胺种类水平均无显著变化[51]。综上,只有高强度运动才能提高血浆S1P浓度,运动显著影响整个腿部的S1P动态。推测S1P可能在骨骼肌适应运动中发挥重要作用。 中年肥胖者久坐、肥胖2型糖尿病患者及长期耐力训练的运动员3组受试者之间,以50%VO2max的强度在功率自行车上锻炼90 min后和恢复2 h后立即进行人体活检肌肉中,碱性神经酰胺酶和SphK1的信使核糖核酸的水平升高,这一结果支持了运动剧烈刺激神经酰胺降解为鞘氨醇,并随后在骨骼肌中转化为S1P的观点[46,52]。 相较于典型持续时间的运动,超耐力运动能够显著降低血浆S1P浓度。在一项为期48 h的超级马拉松比赛中,参与的业余男子跑步者血浆S1P逐渐下降,明显低于赛前水平,并在接下来的48 h恢复期中保持稳定。值得注意的是,红细胞中S1P含量在恢复24 h前保持稳定,在恢复48 h后突然上升,达到峰值;血浆二氢鞘氨醇-1-磷酸水平在比赛过程中逐渐下降,在恢复过程中保持不变;在红细胞中,二氢鞘氨醇-1-磷酸水平在24 h后升高,之后恢复正常。血浆和红细胞中的神经酰胺水平并未受到超耐力跑的显著影响[53]。 2.3.2 长期运动对SphK1/S1P/S1PR2信号通路的影响 在长期运动期间,运动可以诱导肌肉和血浆中S1P含量的增加和S1PR2表达水平的提高,从而增强这些组织中的S1P信号传导。首先,在动物实验中,经过5周的有氧运动训练后,大鼠的比目鱼肌和腓肠肌中的红色和白色部分鞘氨醇和S1P的含量并未发生显著变化;然而,值得注意的是,比目鱼肌的二氢鞘氨醇水平上升了52%,而腓肠肌的二氢鞘氨醇水平则上升了41%;此外,腓肠肌红色和白色部分中二氢鞘氨醇-1-磷酸的含量都出现了显著的增加;不过,在训练组的肌肉中,神经酰胺和二羟基神经酰胺的含量并未发生变化[54]。尽管神经酰胺水平没有变化,但文章注意到受过训练动物的胰岛素敏感性增加了,得出的结论是,训练会影响神经酰胺代谢关键酶的活性,但也会激活影响骨骼肌中神经酰胺代谢的其他代谢途径[54]。8周爬梯抗阻训练可提高大鼠血浆S1P浓度,提高其受体鞘氨醇-1-磷酸受体1-3在拇长屈肌、比目鱼肌中的基因表达[47]。根据此以往研究推测,8周爬梯抗阻训练促进了血浆中的S1P与拇长屈肌、比目鱼肌中鞘氨醇-1-磷酸受体1-3受体结合,进而增强激活下游一系列信号通路,调控相关生物学功能[47]。其次,在人体研究中,经过为期8周的划船训练后,未受过训练的健康男性受试者的血浆总S1P浓度显著升高;对血浆不同组分的深入分析表明,训练有选择性地增强了高密度脂蛋白与S1P的结合能力[55]。因为高密度脂蛋白结合的S1P具有心脏保护和抗动脉粥样硬化特性[56]。所以高密度脂蛋白结合S1P水平的增加是定期体育锻炼对心血管疾病产生有益影响的潜在机制之一[55]。经过24周的高强度抗阻训练后,多发性硬化症患者的血浆S1P水平并没有发生显著变化[57]。在为期3个月的有氧高强度运动干预后,健康绝经前晚期和近期绝经后的妇女血浆S1P和载脂蛋白M水平均显著升高。然而,值得注意的是,尽管两组妇女的血浆S1P水平相似,但绝经后妇女的血浆S1P/载脂蛋白M比值比绝经前妇女低26%。这一结果表明,绝经后妇女在训练前的血浆S1P与载脂蛋白M比例存在差异。有趣的是,尽管有氧高强度运动干预对血浆S1P和载脂蛋白M水平产生了显著影响,但血浆S1P/载脂蛋白M比值并未受到训练的直接影响[58]。由于载脂蛋白M/S1P信号轴参与维持健康的血管内皮屏障功能,所以通过运动干预可以增强载脂蛋白M/S1P信号传导通路,进而降低更年期期间的血脂异常和动脉粥样硬化的风险。 综上所述,在运动对SphK1/S1P/S1PR2信号通路的影响方面,急性有氧运动能够显著提高骨骼肌中SphK1的表达,这一提升有助于增强骨骼肌在运动过程中的能量供应和应激。值得注意的是,并非所有研究都得出了一致的结果。部分实验结果显示,急性和长期运动对肌肉或血液中S1P水平并无显著影响,这种差异可能源于研究对象、运动方式、运动强度以及运动频率的不同[59-64]。此外,具体的机制也尚未完全明确,可能需要进一步深入研究以揭示运动对SphK1/S1P/S1PR2信号通路影响的复杂性和多样性,关于急性运动和长期运动对人体组织和动物组织SphK1/S1P/S1PR2信号通路调控具体影响见表2,3。 2.4 SphK1/S1P/S1PR2信号通路对相关骨骼肌疾病的作用 肌肉衰减症是一种以与年龄相关的肌肉损失和肌肉力量下降为特征的疾病,与个体独立性和生活质量下降以及死亡风险高有关[65]。肌肉衰减症的发病机制是复杂和多样的,其中与骨骼肌卫星细胞的数量减少和功能下降有关[64]。很多研究表明,SphK1/S1P/S1PR2信号通路能够激活卫星细胞,促进卫星细胞的增殖,从而增加了卫星细胞的数量[7,39,65]。另外,在杜氏肌营养不良症小鼠模型中,减少循环S1P会使小鼠比目鱼肌营养不良表型恶化[35],并且研究表明小鼠缺乏S1P,表现出骨骼肌中的鞘氨醇-1-磷酸裂解酶上调,这表明营养不良的肌肉中S1P分解代谢增强。因此,抑制鞘氨醇-1-磷酸裂解酶,提高S1P水平,激活SphK1/S1P/S1PR2通路信号传导,进而激活作为炎症信号传导的核心参与者的信号转导和转录激活因子3,抑制细胞周期抑制剂,从而促进卫星细胞增殖[7]。上述研究结果揭示了SphK1/S1P/S1PR2信号通路在诱导炎症因子激活方面的作用,进而调控早期损伤后的骨骼肌组织再生过程,从而为治疗肌肉衰减症和肌营养不良症提供策略。 骨骼肌萎缩的特征是肌肉量减少,导致敏捷性降低、易疲劳性和骨折风险增加[33]。肿瘤坏死因子α是骨骼肌萎缩的强诱导剂,肿瘤坏死因子α诱导骨骼肌C2C12(小鼠成肌细胞)肌管萎缩和自噬[33],具有生物活性的鞘脂S1P在骨骼肌生物学中起着重要作用。虽然在成肌细胞中,SphK1/S1P/S1PR2接合是实现成肌细胞分化的生理要求,但活化的SphK1被证明是肿瘤坏死因子α在成肌细胞中促纤维化效应的媒介,肿瘤坏死因子α具有激活位于细胞质中的SphK1的能力[33,66]。当SphK1被活化后,它会发生易位,从细胞质转移到质膜上,SphK1将鞘氨醇磷催化生成S1P[66]。然而,当S1P被异常激活时,它可能促进炎症和纤维化等病理过程的发生,从而对机体的健康产生不良影响[66]。鞘氨醇-1-磷酸受体3在骨骼肌、肺脏和 "

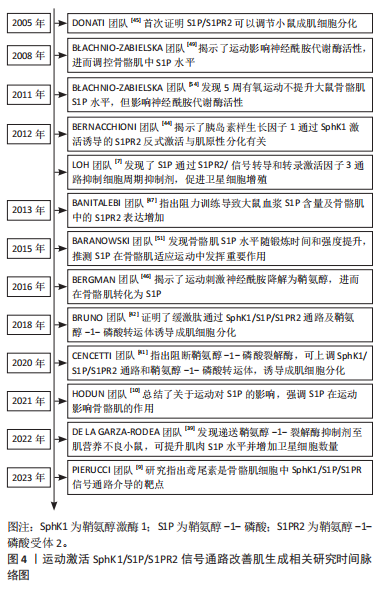
肝脏等多种组织的纤维化进程中扮演着重要角色[67]。鉴于其在成肌细胞分化为肌成纤维细胞过程中的关键作用,鞘氨醇-1-磷酸受体3及其下游信号转导通路被认为是调控这一分化过程的潜在靶点[67]。肌成纤维细胞在纤维化的发展中占据主导地位,SphK1的药理抑制和鞘氨醇-1-磷酸受体3的特异性拮抗作用阻止了自噬标志物的增加和C2C12肌管电生理特性的变化[33]。因此,通过调控鞘氨醇-1-磷酸受体3及其信号通路,可能为实现骨骼肌萎缩、肌肉纤维化疾病的治疗提供新的策略。在带有肿瘤的动物骨骼肌中,用地塞米松治疗的C2C12肌管中,观察到活性SphK1的下调,而鞘氨醇-1-磷酸转运体和S1PR2上调[68]。因此,为了促进骨骼肌健康发展,需要抑制肿瘤坏死因子α参与的SphK1/S1P/鞘氨醇-1-磷酸受体3信号通路,强化SphK1/S1P/S1PR2信号通路引起的促肌源性分化作用,这也为研发针对骨骼肌萎缩、肌肉纤维化等疾病的治疗药物提供了新的思路和方向。 综上所述,SphK1/S1P/S1PR2信号通路在骨骼肌疾病中发挥着重要作用。通过调控卫星细胞的增殖和成肌细胞的分化,该通路有助于改善肌生成过程,促进肌肉损伤后的修复和再生,进而提升肌肉质量。因此,针对这一信号通路的研究可能为骨骼肌疾病的治疗提供新的策略和方法。 2.5 运动激活SphK1/S1P/S1PR2信号通路促进骨骼肌健康 运动激活SphK1/S1P/S1PR2信号通路改善肌生成的研究,历经多年的探索与深入,已形成较为完整的时间脉络。自DONATI团队[45]首次证明S1P/S1PR2可以调节小鼠成肌细胞分化,并确定细胞外调节蛋白激酶1/2和p38丝裂原活化蛋白激酶为S1PR2的下游效应因子后,相关领域的研究者逐步开始探索SphK1/S1P/S1PR2信号通路促进肌生成的具体机制。随着研究的深入,S1P作为鞘氨醇经SphK1催化而来的产物,其在运动中对肌肉生成的促进作用逐渐显现。近年来,S1PR2受体作为S1P的重要靶点,其在运动激活信号通路、促进肌生成方面的作用机制得到广泛研究。这一系列研究不仅揭示了运动对肌肉生成的分子机制,也为运动康复及体能训练等领域提供了新的理论依据和实践指导。文章总结了近年来运动激活SphK1/S1P/S1PR2信号通路改善肌生成相关研究时间脉络图,见图4。"

研究发现,SphK1/S1P/S1PR2信号通路、运动和骨骼肌3者关系密切。SphK1/S1P/S1PR2信号通路的抑制和持续激活与肌肉衰减症、肌营养不良等骨骼肌疾病的发生发展有关,适当且短暂的激活此通路能够维持机体的正常生理功能。并且有规律的体育锻炼可以介导此通路,调节机体的适应性和提升骨骼肌的健康水平。并且,运动引起的S1P代谢变化可以影响骨骼肌收缩-舒张偶联作用从而缓解肌肉疲劳[10]。 胰岛素样生长因子1主产于肝脏,肌肉亦为主要分泌组织。它核心作用于肌肉生长、分化及再生,对维持肌肉健康与功能至关重要[43]。胰岛素样生长因子1提高了SphK1活性,并且胰岛素样生长因子1通过SphK1的激活反式激活S1PR2与肌原性分化有关[44],或 S1PR2被下调时,胰岛素样生长因子1在成肌细胞中的促分化作用会受损[44]。由于运动干预能够刺激胰岛素样生长因子1分泌[43],运动可能强化SphK1/S1P/S1PR2信号通路促肌分化的作用。p38丝裂原活化蛋白激酶作为促肌源性分化的SphK1/S1P/S1PR2信号通路下游效应分子,在抗阻运动、有氧运动和高强度间歇运动干预下均可提高p38丝裂原活化蛋白激酶的磷酸化水平。另外,信号转导和转录激活因子3亦作为骨骼肌SphK1/S1P/S1PR2信号通路下游效应分子,抑制鞘氨醇-1-磷酸裂解酶,激活SphK1/S1P/S1PR2通路信号传导,进而激活作为炎症信号传导的核心参与者的信号转导和转录激活因子3[7]。研究表明,间歇运动和抗阻运动可以提升骨骼肌中信号转导和转录激活因子3的磷酸化水平,信号转导和转录激活因子3磷酸化可通过下游信号分子调节卫星细胞增殖[68-69]。以上研究表明,运动可能加强胰岛素样生长因子1、p38丝裂原活化蛋白激酶和信号转导和转录激活因子3与SphK1/S1P/S1PR2信号通路在改善骨骼肌健康中的关系。 过去的研究清楚的表明,运动能够显著提高神经酰胺酶和SphK1水平,刺激神经酰胺降解为鞘氨醇,从而增加骨骼肌细胞S1P的释放。细胞外的S1P可作用于肌源性干细胞上的S1PR2受体,激活卫星细胞使其增殖,进而刺激成肌细胞的分化[7,41,46-48]。总之,这些效应都有助于维持骨骼肌细胞的健康状态,提高骨骼肌的功能和耐力,运动激活SphK1/S1P/S1PR2信号通路是促进骨骼肌健康的重要途径之一。通过深入了解这一信号通路的机制和作用,有望为预防和治疗骨骼肌相关疾病提供新的思路和方法。SphK1/S1P/S1PR2信号通路主要调节卫星细胞活性改善骨骼肌健康。SphK1/S1P/S1PR2信号通路在运动改善肌生成中作用见图5。"

| [1] BOYER JG, HUO J, HAN S, et al. Depletion of skeletal muscle satellite cells attenuates pathology in muscular dystrophy. Nat Commun. 2022; 13(1):2940. [2] 王震,蔺海旗,何霏,等.运动激活骨骼肌卫星细胞:增龄性肌衰减症及肌肉损伤修复的运动预防和治疗[J].中国组织工程研究, 2021,25(23):3752-3759. [3] 赵婷,郭欣雨,郑雨林,等.雌激素对骨骼肌成肌细胞增殖、分化及迁移的影响[J].中国老年学杂志,2022,42(14):3554-3558. [4] 王素素,李丽凤,张一民.运动干预老年人肌少症近10年研究进展及国际热点可视化分析[J].中国组织工程研究,2022,26(14): 2223-2230. [5] 王燕,肖雄,郭峰,等.和血柔肝方对肝纤维化大鼠SphK1/S1P/S1PR信号通路的影响[J].中国中医药信息杂志,2022,29(3):85-91. [6] LI J, HUANG Y, ZHANG Y, et al. S1P/S1PR signaling pathway advancements in autoimmune diseases. Biomol Biomed. 2023;23(6): 922-935. [7] LOH KC, LEONG WI, CARLSON ME, et al. Sphingosine-1-phosphate enhances satellite cell activation in dystrophic muscles through a S1PR2/STAT3 signaling pathway. PLoS One. 2012;7(5):e37218. [8] HOU L, ZHANG Z, YANG L, et al. NLRP3 inflammasome priming and activation in cholestatic liver injury via the sphingosine 1-phosphate/S1P receptor 2/Gα((12/13))/MAPK signaling pathway. J Mol Med (Berl). 2021;99(2):273-288. [9] PIERUCCI F, CHIRCO A, MEACCI E. Irisin is target of sphingosine-1-phosphate/sphingosine-1-phosphate receptor-mediated signaling in skeletal muscle cells. Int J Mol Sci. 2023;24(13):10548. [10] HODUN K, CHABOWSKI A, BARANOWSKI M. Sphingosine-1-phosphate in acute exercise and training. Scand J Med Sci Sports. 2021;31(5): 945-955. [11] CORDEIRO AV, SILVA VRR, PAULI JR, et al. The role of sphingosine-1-phosphate in skeletal muscle: physiology, mechanisms, and clinical perspectives. J Cell Physiol. 2019;234(7):10047-10059. [12] CHEN H, CHEN K, HUANG W, et al. Structure of S1PR2-heterotrimeric G 13 signaling complex. Sci Adv. 2022;8(13):eabn0067. [13] GREWE JM, KNAPSTEIN PR, DONAT A, et al. The role of sphingosine-1-phosphate in bone remodeling and osteoporosis. Bone Res. 2022; 10(1):34. [14] EL JAMAL A, BOUGAULT C, MEBAREK S, et al. The role of sphingosine 1-phosphate metabolism in bone and joint pathologies and ectopic calcification. Bone. 2020;130:115087. [15] CHEN T, GU K, LIN R, et al. The function of sphingosine-1-phosphate receptor 2 (S1PR2) in maintaining intestinal barrier and inducing ulcerative colitis. Bioengineered. 2022;13(5):13703-13717. [16] WANG N, LI J, ZENG B, et al. Sphingosine-1-phosphate signaling in cardiovascular diseases. Biomolecules. 2023;13(5):818. [17] TIAN J, MA S, XIE WQ, et al. Sphingosine 1-phosphate and osteoporosis: pathophysiology and therapeutic aspects-a narrative review. Ann Palliat Med. 2021;10(4):4799-4805. [18] 韦曦华,王泽群,陈靖京,等.鞘氨醇激酶和1-磷酸鞘氨醇及其受体信号在肿瘤微环境中的研究进展[J].药学学报,2023,58(3):571-580. [19] ISHAY Y, ROTNEMER-GOLINKIN D, ILAN Y. The role of the sphingosine axis in immune regulation: a dichotomy in the anti-inflammatory effects between sphingosine kinase 1 and sphingosine kinase 2-dependent pathways. Int J Immunopathol Pharmacol. 2021;35: 20587384211053274. [20] GUPTA P, TAIYAB A, HUSSAIN A, et al. Targeting the sphingosine kinase/sphingosine-1-phosphate signaling axis in drug discovery for cancer therapy. Cancers. 2021;13(8):1898. [21] NG ML, YARLA NS, MENSCHIKOWSKI M, et al. Regulatory role of sphingosine kinase and sphingosine-1-phosphate receptor signaling in progenitor/stem cells. World J Stem Cells. 2018;10(9):119-133. [22] ZHANG L, DONG Y, WANG Y, et al. Sphingosine-1-phosphate (S1P) receptors: promising drug targets for treating bone-related diseases. J Cell Mol Med. 2020;24(8):4389-4401. [23] 刘慧,陈慧鸿,廖红兵.破骨细胞衍生的偶联因子鞘氨醇-1-磷酸及血小板衍生生长因子BB对成骨细胞的调节作用[J].中国组织工程研究,2019,23(23):3739-3745. [24] CRUNKHORN S. Understanding sphingosine-1-phosphate transport. Nat Rev Drug Discov. 2023;22(7):538. [25] CZUBOWICZ K, JĘŚKO H, WENCEL P, et al. The role of ceramide and sphingosine-1-phosphate in alzheimer’s disease and other neurodegenerative disorders. Mol Neurobiol. 2019;56(8):5436-5455. [26] CHEN H, WANG J, ZHANG C, et al. Sphingosine 1-phosphate receptor, a new therapeutic direction in different diseases. Biomed Pharmacother. 2022;153:113341. [27] XU X, HAN Y, ZHU T, et al. The role of SphK/S1P/S1PR signaling pathway in bone metabolism. Biomed Pharmacother. 2023;169:115838. [28] ZANIN M, GERMINARIO E, DALLA LIBERA L, et al. Trophic action of sphingosine 1-phosphate in denervated rat soleus muscle. Am J Physiol Cell Physiol. 2008;294(1):C36-C46. [29] BONDì M, GERMINARIO E, PIRAZZINI M, et al. Ablation of S1P3 receptor protects mouse soleus from age-related drop in muscle mass, force, and regenerative capacity. Am J Physiol Cell Physiol. 2017; 313(1):C54-C67. [30] 任翔宇,沈飞,金玲,等.运动促进骨骼肌健康的新视角:基于Rac1/PAK1/p38 MAPK信号通路改善肌生成和糖代谢的研究进展与展望[J].中国体育科技,2023,59(5):79-87. [31] 陈昱圻,郭昌龙,袁国红,等.衰老个体骨骼肌卫星细胞的研究进展[J].中国老年学杂志,2022,42(17):4354-4360. [32] TAN-CHEN S, GUITTON J, BOURRON O, et al. Sphingolipid metabolism and signaling in skeletal muscle: from physiology to physiopathology. Front Endocrinol (Lausanne). 2020;11:491. [33] BERNACCHIONI C, GHINI V, SQUECCO R, et al. Role of sphingosine 1-phosphate signalling axis in muscle atrophy induced by TNFα in C2C12 myotubes. Int J Mol Sci. 2021;22(3):1280. [34] BERNACCHIONI C, SQUECCO R, GAMBERI T, et al. S1P signalling axis is necessary for adiponectin-directed regulation of electrophysiological properties and oxidative metabolism in C2C12 myotubes. Cells. 2022; 11(4):713. [35] GERMINARIO E, BONDÌ M, BLAAUW B, et al. Reduction of circulating sphingosine-1-phosphate worsens mdx soleus muscle dystrophic phenotype. Exp Physiol. 2020;105(11):1895-1906.
[36] MEACCI E, PIERUCCI F, GARCIA-GIL M. Skeletal muscle and COVID-19: the potential involvement of bioactive sphingolipids. Biomedicines. 2022;10(5):1068. [37] GERMINARIO E, PERON S, TONIOLO L, et al. S1P2 receptor promotes mouse skeletal muscle regeneration. J Appl Physiol (1985). 2012; 113(5):707-713. [38] SONG ZW , JIN CL , YE M , GAO CQ , et al. Lysine inhibits apoptosis in satellite cells to govern skeletal muscle growth via the JAK2-STAT3 pathway. Food Funct. 2020;11(5):3941-3951. [39] DE LA GARZA-RODEA AS, MOORE SA, ZAMORA-PINEDA J, et al. Sphingosine phosphate lyase is upregulated in duchenne muscular dystrophy, and its inhibition early in life attenuates inflammation and dystrophy in mdx mice. Int J Mol Sci. 2022;23(14):7579. [40] CHEN H, AHMED S, ZHAO H, et al. Structural and functional insights into Spns2-mediated transport of sphingosine-1-phosphate. Cell. 2023;186(12):2644-2655.e16. [41] CENCETTI F, BRUNO G, BERNACCHIONI C, et al. Sphingosine 1-phosphate lyase blockade elicits myogenic differentiation of murine myoblasts acting via Spns2/S1P2 receptor axis. Biochim Biophys Acta Mol Cell Biol Lipids. 2020;1865(9):158759. [42] BRUNO G, CENCETTI F, BERNACCHIONI C, et al. Bradykinin mediates myogenic differentiation in murine myoblasts through the involvement of SK1/Spns2/S1P2 axis. Cell Signal. 2018;45:110-121. [43] 徐帅,徐道明,沈飞.肌骨系统中运动干预肌肉与骨骼交互功能的机制研究进展[J].山东体育学院学报,2022,38(2):91-99. [44] BERNACCHIONI C, CENCETTI F, BLESCIA S, et al. Sphingosine kinase/sphingosine 1-phosphate axis: a new player for insulin-like growth factor-1-induced myoblast differentiation. Skelet Muscle. 2012;2(1):15. [45] DONATI C, MEACCI E, NUTI F, et al. Sphingosine 1-phosphate regulates myogenic differentiation: a major role for S1P2 receptor. FASEB J. 2005;19(3):449-451. [46] BERGMAN BC, BROZINICK JT, STRAUSS A, et al. Muscle sphingolipids during rest and exercise: a C18:0 signature for insulin resistance in humans. Diabetologia. 2016;59(4):785-798. [47] BANITALEBI E, GHARAKHANLOU R, GHATREHSAMANI K, et al. The effect of resistance training on plasma S1P level and gene expression of S1P1, 2, 3 receptors in male Wistar rats. Minerva Endocrinol. 2013;38(4): 395-400. [48] 王倩,傅力.鞘氨醇激酶——运动改善胰岛素抵抗的新靶点[J].中国运动医学杂志,2016,35(12):1162-1164. [49] BŁACHNIO-ZABIELSKA A, BARANOWSKI M, ZABIELSKI P, et al. Effect of exercise duration on the key pathways of ceramide metabolism in rat skeletal muscles. J Cell Biochem. 2008;105(3):776-784. [50] BARANOWSKI M, CHARMAS M, DŁUGOŁĘCKA B, et al. Exercise increases plasma levels of sphingoid base-1 phosphates in humans. Acta Physiol (Oxf). 2011;203(3):373-380. [51] BARANOWSKI M, BŁACHNIO-ZABIELSKA AU, Charmas M, et al. Exercise increases sphingoid base-1-phosphate levels in human blood and skeletal muscle in a time- and intensity-dependent manner. Eur J Appl Physiol. 2015;115(5):993-1003. [52] BERGMAN BC, BROZINICK JT, STRAUSS A, et al. Serum sphingolipids: relationships to insulin sensitivity and changes with exercise in humans. Am J Physiol Endocrinol Metab. 2015;309(4):E398-E408. [53] BARANOWSKI M, GÓRSKI J, KLAPCINSKA B, et al. Ultramarathon run markedly reduces plasma sphingosine-1-phosphate concentration. Int J Sport Nutr Exerc Metab. 2014;24(2):148-156. [54] BŁACHNIO-ZABIELSKA A, ZABIELSKI P, BARANOWSKI M, et al. Aerobic training in rats increases skeletal muscle sphingomyelinase and serine palmitoyltransferase activity, while decreasing ceramidase activity. Lipids. 2011;46(3):229-238. [55] KSIĄŻEK M, CHARMAS M, KLUSIEWICZ A, et al. Endurance training selectively increases high-density lipoprotein-bound sphingosine-1-phosphate in the plasma. Scand J Med Sci Sports. 2018;28(1):57-64. [56] LIU M, FREJ C, LANGEFELD CD, et al. Plasma apoM and S1P levels are inversely associated with mortality in African Americans with type 2 diabetes mellitus. J Lipid Res. 2019;60(8):1425-1431. [57] JØRGENSEN MLK, KjØLHEDE T, DALGAS U, et al. Plasma brain-derived neurotrophic factor (BDNF) and sphingosine-1-phosphat (S1P) are NOT the main mediators of neuroprotection induced by resistance training in persons with multiple sclerosis-A randomized controlled trial. Mult Scler Relat Disord. 2019;31:106-111. [58] YAFASOVA A, MANDRUP CM, EGELUND J, et al. Effect of menopause and exercise training on plasma apolipoprotein M and sphingosine-1-phosphate. J Appl Physiol (1985). 2019;126(1):214-220. [59] LIU X, HOENE M, YIN P, et al. Quality control of serum and plasma by quantification of (4E,14Z)-sphingadienine-C18-1-phosphate uncovers common preanalytical errors during handling of whole blood. Clin Chem. 2018;64(5):810-819. [60] DUBÉ JJ, AMATI F, TOLEDO FG, et al. Effects of weight loss and exercise on insulin resistance, and intramyocellular triacylglycerol, diacylglycerol and ceramide. Diabetologia. 2011;54(5):1147-1156. [61] BARANOWSKI M, ZABIELSKI P, BLACHNIO A, et al. Effect of exercise duration on ceramide metabolism in the rat heart. Acta Physiol (Oxf). 2008;192(4):519-529. [62] SILVA VR, KATASHIMA CK, BUENO SILVA CG, et al. Hypothalamic S1P/S1PR1 axis controls energy homeostasis in middle-aged rodents: the reversal effects of physical exercise [published correction appears in Aging (Albany NY). 2020 May 30;12(10):10000]. Aging (Albany NY). 2016;9(1):142-155. [63] LEE J, SAVAGE H, MAEGAWA S, et al. Exercise promotes pro-apoptotic ceramide signaling in a mouse melanoma model. Cancers (Basel). 2022;14(17):4306. [64] HUO F, LIU Q, LIU H. Contribution of muscle satellite cells to sarcopenia. Front Physiol. 2022;13:892749. [65] SABA JD, DE LA GARZA-RODEA AS. S1P lyase in skeletal muscle regeneration and satellite cell activation: exposing the hidden lyase. Biochim Biophys Acta. 2013;1831(1):167-175. [66] 王兰兰,薛惠天,孙梦龙,等.推拿?法对兔骨骼肌急性钝挫伤组织TNF-α及SphK1、S1PR3表达的影响[J].中国中医药信息杂志, 2023,30(6):129-134. [67] PIERUCCI F, FRATI A, BATTISTINI C, et al. Involvement of released sphingosine 1-phosphate/sphingosine 1-phosphate receptor axis in skeletal muscle atrophy. Biochim Biophys Acta Mol Basis Dis. 2018; 1864(12):3598-3614. [68] 贾单单, 田振军, DU S. 8周间歇运动激活LIF-LIFR-STAT3信号和诱导骨骼肌细胞增殖[J].北京体育大学学报,2017,40(10):44-49. [69] TRENERRY MK, DELLA GATTA PA, LARSEN AE, et al. Impact of resistance exercise training on interleukin-6 and JAK/STAT in young men. Muscle Nerve. 2011;43(3):385-392. |
| [1] | Hou Chaowen, Li Zhaojin, Kong Jianda, Zhang Shuli. Main physiological changes in skeletal muscle aging and the multimechanism regulatory role of exercise [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1464-1475. |
| [2] | Sun Yaotian, Xu Kai, Wang Peiyun. Potential mechanisms by which exercise regulates iron metabolism in immune inflammatory diseases [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1486-1498. |
| [3] | Liu Yu, Lei Senlin, Zhou Jintao, Liu Hui, Li Xianhui. Mechanisms by which aerobic and resistance exercises improve obesity-related cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1171-1183. |
| [4] | Wen Fan, Xiang Yang, Zhu Huan, Tuo Yanfang, Li Feng. Exercise improves microvascular function in patients with type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1225-1235. |
| [5] | Chen Qiang, Wu Wenjuan, Jiang Shuhua, Huang Da. Physical exercise improves physical function in burn patients: a systematic review and meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1269-1281. |
| [6] | Yang Zhijie, Zhao Rui, Yang Haolin, Li Xiaoyun, Li Yangbo, Huang Jiachun, Lin Yanping, Wan Lei, HuangHongxing. Postmenopausal osteoporosis: predictive values of muscle mass, grip strength, and appendicular skeletal muscle index [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1073-1080. |
| [7] | Huang Liuyan, Zhang Wenxi, Chen Shuwen, Yu Shimei, Dai Zhong, Zuo Changqing. Forskolin promotes C2C12 myoblast differentiation via regulating the ERK and Akt signaling pathways [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1114-1121. |
| [8] | Jiang Yang, Peng Hao, Song Yanping, Yao Na, Song Yueyu, Yin Xingxiao, Li Yanqi, Chen Qigang. Isometric exercise reduces resting blood pressure: a meta-analysis of moderating factors and dose effects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 975-986. |
| [9] | Li Hanyue, Li Yini, Xiang Linmei, Li Sen. Effects of resistance exercise therapy on pain and function in patients with cervical spondylotic radiculopathy: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 987-996. |
| [10] | Sun Jiahe, Shi Jipeng, Zhu Tianrui, Quan Helong, Xu Hongqi. Effect of exercise intervention in elderly individuals with sarcopenia and its comorbidities: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 997-1007. |
| [11] | Dong Chao, Zhao Mohan, Liu Yunan, Yang Zeli, Chen Leqin, Wang Lanfang. Effects of magnetic nano-drug carriers on exercise-induced muscle injury and inflammatory response in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 345-353. |
| [12] | Sun Yundi, Cheng Lulu, Wan Haili, Chang Ying, Xiong Wenjuan, Xia Yuan. Effect of neuromuscular exercise for knee osteoarthritis pain and function: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1945-1952. |
| [13] | Li Kaiying, Wei Xiaoge, Song Fei, Yang Nan, Zhao Zhenning, Wang Yan, Mu Jing, Ma Huisheng. Mechanism of Lijin manipulation regulating scar formation in skeletal muscle injury repair in rabbits [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1600-1608. |
| [14] | Li Huayuan, Li Chun, Liu Junwei, Wang Ting, Li Long, Wu Yongli. Effect of warm acupuncture on PINK1/Parkin pathway in the skeletal muscle of rats with chronic fatigue syndrome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1618-1625. |
| [15] | Wang Xuanqiang, Zhang Wenyang, Li Yang, Kong Weiqian, Li Wei, Wang Le, Li Zhongshan, Bai Shi. Effects of chronic exposure to low-frequency pulsed magnetic fields on contractility and morphology of the quadriceps muscle in healthy adults [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1634-1642. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||



