Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (20): 4325-4332.doi: 10.12307/2025.696
Previous Articles Next Articles
Role of endoplasmic reticulum stress-autophagy in cerebral ischemia-reperfusion injury and the regulatory mechanism of traditional Chinese medicine
Zhang Shuo1, Cui Yinglin2, Zhou Panpan1, Li Yile1, Wang Lei1, Zou Qianqian1
- 1The Second Clinical Medical College, Henan University of Chinese Medicine, Zhengzhou 450002, Henan Province, China; 2Famous Doctor Hall, Henan Provincial Hospital of Traditional Chinese Medicine, Zhengzhou 450002, Henan Province, China
-
Received:2024-07-01Accepted:2024-09-06Online:2025-07-18Published:2024-12-23 -
Contact:Cui Yinglin, MS, Chief physician, Doctoral supervisor, Famous Doctor Hall, Henan Provincial Hospital of Traditional Chinese Medicine, Zhengzhou 450002, Henan Province, China -
About author:Zhang Shuo, Master candidate, The Second Clinical Medical College, Henan University of Chinese Medicine, Zhengzhou 450002, Henan Province, China -
Supported by:2022 Second National Famous Traditional Chinese Medicine Practitioners Inheritance Studio Construction Project, State Administration of Traditional Chinese Medicine, No. [2022]245 (to CYL); the Construction of Chinese Medicine Yuanqi Doctrine System and Its Prevention and Treatment of Immune-related Diseases, No. GZY-KJS-2021-017 (to CYL); Henan Province Key Research and Development Special Project, No. 221111310500 (to CYL)
CLC Number:
Cite this article
Zhang Shuo, Cui Yinglin, Zhou Panpan, Li Yile, Wang Lei, Zou Qianqian. Role of endoplasmic reticulum stress-autophagy in cerebral ischemia-reperfusion injury and the regulatory mechanism of traditional Chinese medicine[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(20): 4325-4332.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

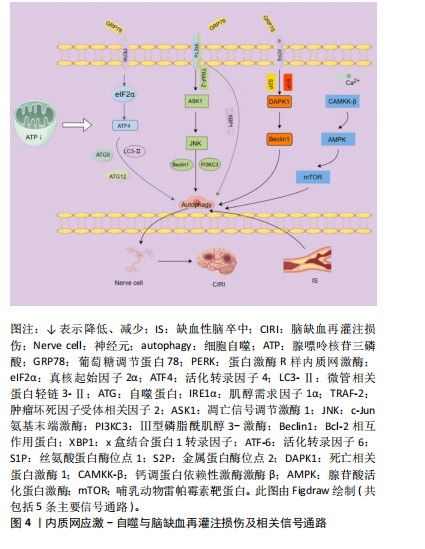
和反应等方面都具有极其重要的作用[10]。由于内外环境的变化,如缺血缺氧、营养物质缺乏及药物毒素等均可导致内质网功能失调、结构破坏,进而导致大量未折叠或错误折叠的蛋白质蓄积引发内质网应激[11]。起初,未折叠蛋白反应是对内质网应激的适应性反应,试图通过降低内质网未折叠或错误折叠蛋白质的负荷减轻其应激反应,恢复蛋白质稳态,但在长期和严重的内质网应激下细胞会进入内质网相关蛋白降解途径,进而诱导自噬产生[12]。因此在长时间内质网应激过程中,未折叠蛋白反应的激活促进了自噬活性并恢复内质网稳态,从而促使细胞存活[13]。 自噬是一种程序性细胞死亡机制,可在自噬相关基因的调控下通过溶酶体降解、清除、回收利用受损细胞器和蛋白以维持细胞内稳态[14]。自噬可大体分为3种:巨自噬、微自噬和分子伴侣介导型自噬。巨自噬首先在蛋白质和细胞器周围形成一种具有双层膜结构的吞噬胞体,然后不断扩大形成自噬体,对胞内物质进行包裹,进而与溶酶体融合,最终使细胞质物质降解[15];微自噬主要是通过溶酶体膜内陷将细胞溶质成分直接吞噬降解[16];而分子伴侣蛋白介导型自噬是分子伴侣蛋白HSC70和溶酶体膜上的溶酶体相关膜蛋白Lamp2A结合,进而被溶酶体降解[17]。细胞自噬是一把双刃剑,适度激活可加速细胞内蛋白降解,有效阻止错误蛋白沉积,调节细胞内环境稳定;倘若自噬过度激活,便可触发细胞凋亡程序,导致细胞自噬性死亡[18]。因此,自噬的缺乏和过度都能导致细胞死亡。 相关研究结果提示,一方面内质网应激作为一种常见的细胞应激反应,由多种破坏细胞内稳态的条件导致,与自噬激活密切相关;另一方面自噬也可以对内质网应激进行负反馈,抑制内质网应激相关蛋白表达,消除累积的错误折叠蛋白质以缓解内质网应激,促进细胞存活,二者在维持细胞稳态方面均发挥重要作用[19-20]。 2.2 内质网应激-自噬信号通路 2.2.1 PERK-eIF2α-ATF4信号通路 蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)是位于内质网的一种内质网应激跨膜感受蛋白,其二聚化结构域能够感知内质网应激信号[21]。内质网应激时,其与葡萄糖调节蛋白/免疫球蛋白结合蛋白(GRP78/BIP)解离并活化,使其下游信号因子-真核起始因子2α(eukaryotic initiation factor 2 alpha,eIF2α)磷酸化。eIF2α磷酸化一般会抑制绝大多数蛋白质翻译起始活性从而减少合成,但能特异性激活活化转录因子4(activating transcription factor 2,ATF4),促进微管相关蛋白轻链3-Ⅱ(microtubule-associated protein 1 light chain 3- Ⅱ,LC3-Ⅱ)和自噬蛋白5、自噬蛋白12等自噬相关蛋白的表达,导致自噬发生[22]。 2.2.2 IRE1α-ASK1-JNK信号通路 肌醇需求因子1α(inositol-requiring enzyme 1α,IRE1α)亦属于内质网应激跨膜感受蛋白的一种,内质网应激发生时,其与GRP78/BIP解离并发生二聚化和自磷酸化[23]。被激活后与肿瘤坏死因子受体相关因子2(tumor necrosis factor receptor associated factor 2,TRAF-2)以及凋亡信号调节激酶1 (apoptosissignal-regulating kinase-1,ASK1)相结合形成IRE1α-TRAF-2-ASK1复合物并可进一步激活c-Jun氨基末端激酶(c-Jun N-terminal kinas,JNK),进而导致Bcl-2磷酸化,破坏Beclin-1/Bcl-2复合物,释放Beclin-1,与Ⅲ型磷脂酰肌醇3-激酶(class Ⅲ phosphatidylinositol-3-kinase,PI3KC3)结合构成激酶复合物促进吞噬体成核而诱发自噬[24]。而在缺失IRE1α或JNK抑制剂处理的细胞中,自噬被抑制[21]。 2.2.3 活化转录因子6(activating transcription factor 6,ATF6)介导的信号通路 ATF6是一种具有大的内质网腔结构域的单通道2型跨膜蛋白,可分为ATF6α与ATF6β两种同源蛋白,但活化的ATF6α能更有效激活内质网应激反应元件[25]。内质网应激时ATF6与GRP78解离,后以囊泡形式被运往高尔基体内,由丝氨酸蛋白酶位点1和金属蛋白酶位点2两种蛋白酶裂解后激活,进而上调死亡相关蛋白激酶1表达,磷酸化Beclin-1,使其与Bcl-2解离,诱发自噬[26-27]。 2.2.4 CaMKK-β-AMPK-mTOR信号通路 哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)作为一种诱导自噬的重要调控因子,其被激活时自噬受到抑制,相反,抑制其活性可促进自噬[28]。内质网作为Ca2+的重要储存部位,内质网应激时,大量Ca2+从内质网中释放出来,可通过激活钙调蛋白依赖性激酶激酶β(calcium/calmodulin-dependent protein kinase β,CAMKK-β)进一步直接激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK),进而抑制mTOR活性,诱发细胞自噬[29-30]。 2.2.5 IRE1α-XBP1 肌醇需求因子1α在内质网应激被活化后便具有核酸内切酶活性,可剪切x盒结合蛋白1转录因子(X-box binding protein1,XBP1)前体mRNA,激活其活性,可上调多种未折叠蛋白反应相关基因的转录,进而降低未折叠或错误折叠蛋白质的持续产生,减轻内质网应激。此外,通过此信号通路,也可进一步激活Beclin-1引发自噬[31]。 此外,调节内质网应激-自噬的信号通路还包括PERK/ATF4/CCAAT增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)[32],长链非编码RNA LOC103692885/miR-187-3p/Seipin轴等[33]。 2.3 内质网应激-自噬与脑缺血再灌注损伤 长期以来,多数研究认为脑缺血再灌注损伤的主要病理机制是炎症反应、氧化应激、兴奋性氨基酸毒性等引起的缺血半暗带神经细胞凋亡,但近年来越来越多研究表明,内质网应激引起的缺血半暗带区的神经元自噬是脑缺血再灌注损伤的关键环节[34]。脑缺血再灌注期间无氧代谢增强,ATP释放减少,钙离子跨膜转运失调,加之内质网内的钙离子持续释放,导致钙离子超载,内质网功能受到影响,致使内质网中蛋白质二硫键形成降低,蛋白质折叠错误,进而引起内质网应激。内质网膜上的GRP78/BIP与内质网跨膜蛋白(PERK、IRE1α、ATF6)解离,3种跨膜蛋白被激活后通过PERK-eIF2α-ATF4、IRE1α-ASK1-JNK、IRE1α-XBP1以及ATF6等介导的信号通路并进一步激活或者上调自噬关键分子,导致神经细胞发生自噬[35]。杨楠等[36]研究发现,远隔缺血预适应通过抑制PERK/p-eIF2α通路,减少自噬相关蛋白表达,从而抑制神经元自噬,发挥脑保护作用。LV等[37]应用氯丙嗪联合异丙嗪治疗大脑中动脉闭塞模型大鼠的研究发现,其可增加大鼠脑组织Bcl-XL表达,减少凋亡因子Bax、PERK及eIF2α表达,减少缺血再灌注损伤,保护神经元。此外,给予PERK抑制剂GSK2656157阻断了这种保护作用,提示其通过抑制PERK-eIF2α信号通路抑制细胞自噬和凋亡,发挥脑保护作用。见图4。 2.4 中药对内质网应激-自噬的调控作用 2.4.1 中药单体有效成分 (1)皂苷类:人参皂苷Rg1是中药人参的主要活性成分,具有抗炎、抗氧化、抗肿瘤等多种药理作用[38]。李雨晴等[39]研究发现,人参皂苷Rg1(10 μmol/L)干预氧糖剥夺/复氧损伤大鼠嗜铬细胞瘤PC12细胞,可降低细胞内Beclin1、LC3-Ⅱ、p-IRE1、p-JNK、GRP78、CHOP表达,上调p62表达,降低细胞凋亡,表明人参皂苷Rg1通过抑制IRE1-JNK-CHOP通路,抑制细胞自噬,发挥神经保护作用。 黄芪甲苷是中药黄芪的有效活性成分,具有抗炎、抗氧化、调节能量代谢等药理作用[40]。蔡建航[41]研究证实黄芪甲苷能够降低葡萄糖调节蛋白94(glucose-regulated protein,GRP94)、GRP78、p-PERK及IRE1表达,增加糖原合成酶激酶3β表达,升高线粒体膜电位,阻止线粒体通透性转移孔的开放,从而抑制内质网应激,保护PC12细胞。龙佳欣等[42]就黄芪甲苷对氧糖剥夺/复氧PC12细胞自噬的研究发现,黄芪甲苷可激活Akt/mTOR信号通路,下调Beclin1、缺氧诱导因子1α、LC3-Ⅱ/LC3-Ⅰ表达,上调p-Akt/Akt和p-mTOR/mTOR表达,抑制细胞自噬,保护神经元。此外,张怡等[43]研究发现,黄芪甲苷可减"

小局灶性脑缺血大鼠脑梗死面积,上调脑组织Beclin1、LC3-Ⅱ/LC3-Ⅰ表达,降低P62表达,诱导保护性自噬,减轻再灌注损伤。 (2)生物碱类:黄连素是从黄连、黄柏等中药中提取的生物碱,具有抗菌、抗炎、抗病毒及降血糖等作用[44]。谢鹏[45]发现,黄连素100 mmol/L预处理氧糖剥夺/复氧PC12细胞,可增加细胞活力,减少细胞损伤及凋亡,下调GRP78、CHOP、Beclin-1、P62、C-caspase3、Bax表达及LC3-Ⅱ/LC3-Ⅰ比值,上调p-mTOR表达,从而抑制内质网应激-自噬,保护神经元。 (3)多酚类:白藜芦醇(resveratrol)主要来源于藜芦、决明子、虎杖等,具有抗凋亡、抗氧化及抗炎等多种药理作用[46]。郭静洁等[47]发现,白藜芦醇预处理能够降低大脑中动脉闭塞大鼠的神经功能评分及脑梗死面积,其机制与下调脑组织CHOP表达、增加GRP78表达、抑制内质网应激及减轻缺血再灌注损伤有关。何琪[48]通过实验证实,白藜芦醇可减小局灶性脑缺血大鼠脑梗死灶体积、上调Sirt-1表达,提高LC3B-Ⅱ/Ⅰ比值,降低p62表达,提示其通过增强自噬活性而发挥神经保护作用。 姜黄素(Curcumin)是从姜黄科植物中提取的一种天然多酚,具有抗炎、抗氧化等药理作用[49]。朱海英等[50]在姜黄素对大脑中动脉闭塞大鼠内质网应激的研究中发现,造模前2 h予以姜黄素150 mg/kg腹腔注射,能够明显减少GADD153、Caspase-12表达,提示其通过减轻内质网应激发挥神经保护作用。侯杨[51]研究证实,姜黄素能够通过下调缺氧诱导因子1α以及LC3-Ⅱ/Ⅰ,上调P62表达,抑制细胞自噬,保护PC12细胞。 羟基红花黄色素A是从中药红花中提取的一种查尔酮类化合物,具有抗氧化、抗凋亡、调节自噬等作用[52]。 张云[53]研究发现,羟基红花黄色素A能够通过下调大脑中动脉闭塞大鼠脑组织内GRP78、PERK、p-PERK、CHOP、Bax表达,上调Bcl-2的表达,减轻内质网应激,减小脑梗死面积,发挥脑保护作用。此外,体外实验亦证实,羟基红花黄色素A可下调HT22细胞内Bax、PERK、p-PERK、GRP78、CHOP、cleaved-caspase 9、cleaved-caspase 3表达,上调Bcl-2表达,提示其通过抑制GRP78/PERK/CHOP通路,抑制内质网应激,保护HT22细胞。杨光[54]通过羟基红花黄色素A对氧糖剥夺/复氧损伤大鼠脑微血管内皮细胞的实验研究发现,其可通过降低LC3、Beclin-1表达,升高p-AKT和p-mTOR表达,进而激活PI3K/AKT/mTOR信号通路,抑制自噬,发挥脑保护作用。 (4)其他:尿石酸A是鞣花单宁经肠道微生物群代谢产生的一种活性物质,具有抗炎、神经保护等多种功效[55]。AHSAN[56]研究发现尿石酸A可通过上调LC3-Ⅱ,下调p62表达,激活自噬,同时还可降低ATF-6和CHOP表达,减轻内质网应激,进而减轻大脑中动脉闭塞模型大鼠神经元损伤。此外,若加入自噬抑制剂(3-甲基腺嘌呤)后,能升高ATF6、CHOP mRNA水平,从而减弱尿石酸A的神经保护作用,提示尿石酸A能够通过激活自噬进而抑制内质网应激发挥脑保护作用。 中药单体有效成分调控内质网应激-自噬治疗脑缺血再灌注损伤的机制汇总,见表1。 2.4.2 中药复方 (1)脑泰方:葛金文教授基于气血理论,认为缺血性脑卒中以元气亏虚为始动环节,气虚、痰凝、血瘀交织发病,自拟脑泰方(黄芪、僵蚕、地龙、川芎),具有补气活血、化痰通络之功[57]。宋洋等[58]予大脑中动脉闭塞大鼠脑泰方0.45,0.9,1.8 g/(kg·d),连续灌胃14 d,可改善大鼠神经肌肉及前庭运动功能,减小脑梗死面积,降低GRP78、CHOP、PERK、Beclin-1、LC3-Ⅱ表达和LC3-Ⅱ/LC3-Ⅰ比值,提示脑泰方通过调控内质网应激-自噬相关因子,进而发挥神经保护作用。同时,体外实验亦证实,脑泰方可通过调控GRP78/PERK/CHOP信号通路,降低氧糖剥夺/复氧PC12细胞内PERK、CHOP、GRP78、Beclin-1、LC3-Ⅱ表达,增加LC3-Ⅰ表达,从而减轻内质网应激-自噬,减少细胞损伤和死亡[59]。 (2)补阳还五汤:补阳还五汤(黄芪、川芎、赤芍、当归、桃仁、红花、地龙)出自《医林改错》,具有益气活血通络之功[60]。侯晓婵[61]研究发现,给予脑缺血再灌注损伤大鼠补阳还五汤14.3 g/kg灌胃,连续3 d,可减小脑梗死体积,降低 GRP78、Caspase-3、Bax/Bcl-2蛋白表达水平,提示其可通过抑制内质网应激介导的细胞凋亡减轻脑缺血再灌注损伤。单玉栋等[62]通过实验证实,补阳还五汤冻干粉3.02 g/(kg·d)灌胃大脑中动脉闭塞模型大鼠,可改善大鼠神经功能缺损症状,降低脑梗死体积,"


上调PI3K、p-AKT/AKT、p62表达,降低LC3-Ⅱ/Ⅰ表达,表明补阳还五汤可激活PI3K/AKT信号通路进而抑制自噬发挥神经保护作用。 (3)龙蛭汤:龙蛭汤是陈永斌教授的经验方,在补阳还五汤基础上增加了川牛膝、水蛭两味药而成,具有益气活血、祛瘀通络之功[63]。李南方[64]发现,龙蛭汤13.6 g/(kg·d),可降低大脑中动脉闭塞大鼠神经功能缺损评分,减小脑梗死体积,降低内质网应激相关因子GRP78和CHOP表达,减轻再灌注损伤。邹玲[65]研究发现龙蛭汤可通过上调大脑中动脉闭塞大鼠的自噬水平,增加LC3和Beclin-1表达,促进血管新生,进而发挥脑保护作用。 (4)芪归通络方:芪归通络方(黄芪、当归、赤芍、桃仁、红花、川芎、鸡血藤、地龙、全蝎、天麻、钩藤、生地、玄参、牛膝、伸筋草、桑枝、石菖蒲、瓜蒌)具有祛瘀通络、益气活血、补肾强骨等功效。周围等[66]通过芪归通络方联合针刺治疗缺血性脑卒中患者,可下调患者血清GRP78、CHOP、LC3-Ⅱ、Caspase-12、Beclin1表达水平,上调Bcl-2表达水平,提示该方可通过抑制内质网应激及过度自噬,减少神经元凋亡,从而改善患者的神经功能损伤及运动障碍。 (5)银杏内酯注射液:银杏内酯注射液具有通经活络、活血化瘀的功效,临床常用于瘀血内阻所导致的缺血性脑卒中的治疗[67]。兰新新等[68]予银杏内酯注射液2.5 mg/(kg·d)干预大脑中动脉闭塞大鼠,发现银杏内酯注射液可有效减轻大鼠脑水肿,减小梗死面积,改善神经功能障碍,降低CHOP、Caspase-12表达及LC3-Ⅱ/LC3-Ⅰ比值,提高P62表达,提示其通过抑制内质网应激和过度自噬来减轻再灌注损伤。 (6)痰热清注射液:痰热清注射液由黄芩、熊胆粉、山羊角、金银花及连翘组成,具有清热解毒化痰之功[69]。李莎莎[70]通过观察痰热清注射液对局灶性脑缺血大鼠的治疗机制,发现痰热清注射液可通过上调Bcl-2和NeuN表达,下调ATF4、PERK、CHOP、BIP、Bax、Caspase-8表达,抑制过度内质网应激,减小脑梗死面积及细胞凋亡率,发挥脑保护作用。李中浩[71]研究发现,痰热清注射液可减小大脑中动脉闭塞大鼠脑梗死面积,上调脑组织内APJ、PI3K、AKT、mTOR、NeuN和BAX表达及BCL2/BAX比例,下调Caspase-8、GFAP表达及LC3-Ⅱ/LC3-Ⅰ比例,提示痰热清注射液可通过激活PI3K/AKT/mTOR通道,抑制细胞自噬和凋亡,进而发挥脑保护作用。中药复方调控内质网应激-自噬治疗脑缺血再灌注损伤的机制汇总,见表2。"

| [1] SUN L, ZHAO Z, GUO J, et al. Mitochondrial transplantation confers protection against the effects of isc hemic stroke by repressing microglial pyroptosis and promoting neurogenesis. Neural Regen Res. 2024;19(6):1325-1335. [2] 《中国脑卒中防治报告2021》编写组, 王陇德. 《中国脑卒中防治报告2021》概要[J]. 中国脑血管病杂志,2023,20(11):783-793. [3] MA Q, LI R, WANG L, et al. Temporal trend and attributable risk factors of stroke burden in China, 1990–2019: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 2021;6(12): e897-e906. [4] ZHAO Y, ZHANG X, CHEN X, et al. Neuronal injuries in cerebral infarction and ischemic stroke: From mechanisms to treatment (Review). Int J Mol Med. 2022;49(2):15. [5] 曹晓慧,赵敏菡,霍瑞卿,等.化浊解毒活血通络方对脑缺血再灌注损伤大鼠氧化损伤和炎症因子的影响[J]. 中华中医药杂志,2024, 39(4):1979-1984. [6] 丁元庆,陈哲,唐赛雪.《内经》对构建中风病机理论的作用与影响[J].山东中医药大学学报,2020,44(4):344-349+343. [7] 刘向哲,宋艳芳,冉春龙,等.基于八纲虚实辨证分期序贯治疗缺血性中风探讨[J].中国实验方剂学杂志,2024,30(9):186-192. [8] LI XH, YIN FT, ZHOU XH, et al. The Signaling Pathways and Targets of Natural Compounds from Traditional Chinese Medicine in Treating Ischemic Stroke. Molecules. 2022;27(10):3099. [9] CHEN X, SHI C, HE M, et al. Endoplasmic reticulum stress: molecular mechanism and therapeutic targets. Signal Transduct Target Ther. 2023;8(1):352. [10] KAPUY O. Mechanism of Decision Making between Autophagy and Apoptosis Induction upon Endoplasmic Reticulum Stress. Int J Mol Sci. 2024;25(8):4368. [11] 季禾,栗延伟,谭军,等. 腺苷预处理对脑缺血再灌注损伤大鼠脑组织中CCAAT/增强子结合蛋白同源蛋白表达的影响[J]. 新乡医学院学报,2023,40(2):101-106. [12] XUE X, LI F, CAI M, et al. Interactions between Endoplasmic Reticulum Stress and Autophagy: Implications for Apoptosis and Neuroplasticity-Related Proteins in Palmitic Acid-Treated Prefrontal Cells. Neural Plast. 2021;2021:8851327. [13] 赵千增,赵振群,刘万林. 激素性股骨头缺血坏死过程中内质网应激调控自噬与凋亡的作用 [J]. 中国组织工程研究,2021,25(29): 4685-4690. [14] CAO W, LI J, YANG K, et al. An overview of autophagy: Mechanism, regulation and research progress. Bull Cancer. 2021;108(3):304-322. [15] 石晓花,莽靖,徐忠信. 脑缺血再灌注损伤细胞死亡模式的研究进展[J]. 吉林大学学报(医学版),2022,48(6):1635-1643. [16] WANG L, KLIONSKY DJ, SHEN HM. The emerging mechanisms and functions of microautophagy. Nat Rev Mol Cell Biol. 2023;24(3): 186-203. [17] WANG L, DAI M, GE Y, et al. EGCG protects the mouse brain against cerebral ischemia/reperfusion injury by suppressing autophagy via the AKT/AMPK/mTOR phosphorylation pathway. Front Pharmacol. 2022;13:921394. [18] YANG Z, WANG L, HU Y, et al. Butorphanol protects PC12 cells against OGD/R-induced inflammation and apoptosis. Mol Med Rep. 2020; 22(3):1969-1975. [19] 赵楠,肖雪,曹兰秀. 内质网应激在细胞自噬调控中的作用及其分子机制[J]. 生理科学进展,2023,54(5):426-432. [20] QI Z, CHEN L. Endoplasmic Reticulum Stress and Autophagy. Adv Exp Med Biol. 2019;1206:167-177. [21] 徐倩,许银丰,杨杰杰,等. 内质网应激与细胞自噬的关系[J]. 中国细胞生物学学报,2020,42(8):1489-1500. [22] MONCAN M, MNICH K, BLOMME A, et al. Regulation of lipid metabolism by the unfolded protein response. J Cell Mol Med. 2021; 25(3):1359-1370. [23] CYBULSKY AV. Endoplasmic reticulum stress, the unfolded protein response and autophagy in kidney diseases. Nat Rev Nephrol. 2017; 13(11):681-696. [24] YU C, ZHANG Z, XIAO L, et al. IRE1alpha pathway: A potential bone metabolism mediator. Cell Prolif. 2024;57(10):e13654. [25] 马炜祥,张婷婷,崔凤针,等. 内质网应激关键分子ATF6α在癌症中作用的研究进展[J]. 华中科技大学学报(医学版),2022,51(2): 241-246+253. [26] ZHANG Q, LIU G, LIU R, et al. Dual role of endoplasmic reticulum stress-ATF-6 activation in autophagy and apoptosis induced by cyclic stretch in myoblast. Apoptosis. 2023;28(5-6):796-809. [27] 庞欣欣,邢玉凤,彭紫凝,等.内质网应激与自噬交互作用在糖尿病肾病发病中的作用[J]. 生理科学进展,2020,51(6):464-468. [28] NUNEZ-OLVERA SI, GALLARDO-RINCON D, PUENTE-RIVERA J, et al. Autophagy Machinery as a Promising Therapeutic Target in Endometrial Cancer. Front Oncol. 2019;9:1326. [29] Di FAZIO P, MATROOD S. Targeting autophagy in liver cancer. Transl Gastroenterol Hepatol. 2018;3:39. [30] DIAO F, JIANG C, SUN Y, et al. Porcine reproductive and respiratory syndrome virus infection triggers autophagy via ER stress-induced calcium signaling to facilitate virus replication. PLoS Pathog. 2023; 19(3):e1011295. [31] 刘前程,刘鑫,邓湘雨,等. 健脾益气方干预内质网应激IRE1α-XBP1通路诱导腹膜间皮细胞自噬防治PF的机制[J]. 中国老年学杂志,2024,44(7):1642-1647. [32] 王笠. 钒通过内质网应激介导的PERK/ATF4/CHOP信号通路诱导鸭肾小管上皮细胞自噬[D]. 南昌:江西农业大学,2023. [33] 任真奎. LncRNA LOC103692885/miR-187-3p/Seipin轴调控内质网应激、自噬在脑缺血再灌注损伤中的分子机制研究[D]. 贵阳:贵州医科大学,2021. [34] AHSAN A, ZHENG YR, WU XL, et al. Urolithin A-activated autophagy but not mitophagy protects against ischemic neuronal injury by inhibiting ER stress in vitro and in vivo. CNS Neurosci Ther. 2019;25(9):976-986. [35] ZHANG T, LU D, YANG W, et al. HMG-CoA Reductase Inhibitors Relieve Endoplasmic Reticulum Stress by Autophagy Inhibition in Rats With Permanent Brain Ischemia. Front Neurosci. 2018;12:405. [36] 杨楠,丁锚,闫峰,等.远隔缺血预适应对脑缺血再灌注损伤大鼠缺血半暗带区PERK/p-eIF2α通路及自噬的影响[J]. 首都医科大学学报,2021,42(2):225-231. [37] LV S, GENG X, YUN HJ, et al. Phenothiazines reduced autophagy in ischemic stroke through endoplasmic reticulum (ER) stress-associated PERK-eIF2alpha pathway. Exp Neurol. 2023;369:114524. [38] TIAN G, LI J, ZHOU L. Ginsenoside Rg1 regulates autophagy and endoplasmic reticulum stress via the AMPK/mTOR and PERK/ATF4/CHOP pathways to alleviate alcohol‑induced myocardial injury. Int J Mol Med. 2023;52(1):56. [39] 李雨晴,魏梁丽,袁雨琪,等. 人参皂苷Rg_1通过IRE1-JNK-CHOP通路抑制自噬改善OGD/R诱导的PC12细胞损伤[J]. 中国中药杂志, 2024,49(10):2745-2753. [40] ZHANG X, QU H, YANG T, et al. Astragaloside IV attenuate MI-induced myocardial fibrosis and cardiac remodeling by inhibiting ROS/caspase-1/GSDMD signaling pathway. Cell Cycle. 2022;21(21):2309-2322.
[41] 蔡建航. 黄芪甲苷通过抑制内质网应激阻止mPTP开放保护PC12细胞[D]. 唐山:华北理工大学,2018. [42] 龙佳欣,田梦芝,陈笑一,等. 黄芪甲苷介导Akt/mTOR/HIF-1α通路调控氧糖剥夺PC12细胞自噬的机制研究[J]. 中国中药杂志, 2023,48(19):5271-5277. [43] 张怡,张彐宁,周晓红,等. 黄芪甲苷缓解大脑中动脉阻塞/再灌注大鼠脑组织损伤的作用及机制[J]. 时珍国医国药,2021,32(11): 2636-2639. [44] ZHU C, LI K, PENG XX, et al. Berberine a traditional Chinese drug repurposing: Its actions in inflammation-associated ulcerative colitis and cancer therapy. Front Immunol. 2022;13:1083788. [45] 谢鹏. 黄连素通过抑制内质网应激和自噬对PC12细胞OGD/R损伤的保护作用及机制研究[D]. 贵阳:贵州医科大学,2020. [46] KATILA N, DUWA R, BHURTEL S, et al. Enhancement of blood-brain barrier penetration and the neuroprotective effect of resveratrol. J Control Release. 2022;346:1-19. [47] 郭静洁,张引红. 运动和白藜芦醇预处理对脑缺血再灌注大鼠脑损伤及内质网应激的影响[J]. 护理研究,2023,37(16):2965-2970. [48] 何琪. 白藜芦醇通过增强Sirt-1诱导的自噬活性抑制NLRP3炎性复合体活化减轻脑缺血再灌注损伤[D]. 重庆:重庆医科大学,2018. [49] FAN F, LEI M. Mechanisms Underlying Curcumin-Induced Neuroprotection in Cerebral Ischemia. Front Pharmacol. 2022;13: 893118. [50] 朱海英,孙红玉,冯光坤,等. 姜黄素抑制大鼠脑缺血再灌注损伤内质网应激的研究[J]. 中华老年心脑血管病杂志,2015,17(4):416-420. [51] 侯杨. 姜黄素对缺血再灌注损伤神经元细胞的保护机制研究[D]. 沈阳:中国医科大学,2019. [52] YU L, JIN Z, LI M, et al. Protective potential of hydroxysafflor yellow A in cerebral ischemia and reperfusion injury:An overview of evidence from experimental studies. Front Pharmacol. 2022;13:1063035. [53] 张云. 羟基红花黄色素A抑制GRP78/PERK/CHOP信号通路保护脑缺血再灌注损伤模型大鼠[D]. 合肥:安徽中医药大学,2023. [54] 杨光. 羟基红花黄色素A保护氧糖剥夺/复糖复氧损伤大鼠脑微血管内皮细胞的自噬途径研究[D]. 合肥:安徽中医药大学,2017. [55] LIN IC, WU JY, FANG CY, et al. Absorption and Metabolism of Urolithin A and Ellagic Acid in Mice and Their Cytotoxicity in Human Colorectal Cancer Cells. Evid Based Complement Alternat Med. 2023; 2023:8264716. [56] AHSAN A . 尿石酸A及番茄碱的抗缺血性神经损伤作用及自噬相关机制研究[D]. 杭州:浙江大学,2020. [57] 宋洋. 基于内质网应激介导的细胞自噬探究脑泰方对脑缺血再灌注损伤的神经保护机制[D]. 长沙:湖南中医药大学,2023. [58] 宋洋,葛金文,陈瑶. 脑泰方对脑缺血/再灌注大鼠的神经保护作用 [J]. 中成药,2023,45(3):924-929. [59] 宋洋,陈瑶,胡立娟,等. 脑泰方含药血清对缺氧缺糖/复氧PC12细胞损伤的保护作用 [J]. 湖南中医药大学学报,2023,43(5):814-821. [60] 叶才博,陈祥宇,杜杰勇,等. 基于miR-665/DRAM1信号介导的自噬探讨补阳还五汤延缓血管衰老的作用[J]. 南京中医药大学学报, 2024,40(4):369-378. [61] 侯晓婵. 基于PERK通路探讨补阳还五汤抑制内质网应激介导的细胞凋亡减轻脑缺血再灌注损伤[D]. 承德:承德医学院,2021. [62] 单玉栋,赵艳萌,靳晓飞,等. 补阳还五汤通过PI3K/AKT通路调控自噬抗大鼠脑缺血/再灌注损伤的作用[J]. 中国药理学通报,2023, 39(2):386-391. [63] 李南方,陈永斌,刘启华,等. 龙蛭汤对脑缺血再灌注损伤大鼠血管新生的促进作用[J]. 辽宁中医杂志,2022,49(9):195-198+227. [64] 李南方. 基于内质网应激探讨龙蛭汤促进脑缺血再灌注损伤大鼠血管新生的作用机制[D]. 南宁:广西医科大学,2020. [65] 邹玲. 基于细胞自噬探讨龙蛭汤促进脑缺血再灌注损伤大鼠血管新生的作用机制[D]. 南宁:广西医科大学, 2019. [66] 周围,胡立丹,孔凡盛,等. 芪归通络方联合针刺改善卒中后偏瘫的临床观察及对内质网应激-自噬的影响 [J]. 中华中医药学刊, 2023,41(7):89-93. [67] 赵乐,陈琳,蒋美玲,等.活络效灵丹方剂联合银杏内酯注射液治疗缺血性脑卒中恢复期瘀血阻络证疗效研究[J].中国药师,2024, 27(1):125-134. [68] 兰新新,曹磊,王林晓,等. 银杏内酯注射液抑制脑缺血再灌注模型大鼠内质网应激和自噬 [J]. 中国临床药理学与治疗学,2015, 20(6):634-639. [69] 杨万枝. 基于属性层次模型的痰热清注射液用药合理性评价[J].中国新药与临床杂志,2024,43(1):70-74.. [70] 李莎莎. 基于内质网应激通路研究痰热清注射液对急性脑梗死大鼠的治疗机制[D]. 北京:北京中医药大学,2021. [71] 李中浩. 痰热清注射液对脑梗死后apelin信号通路及细胞凋亡和自噬的影响[D].北京:北京中医药大学,2021. |
| [1] | Li Huayuan, Li Chun, Liu Junwei, Wang Ting, Li Long, Wu Yongli. Effect of warm acupuncture on PINK1/Parkin pathway in the skeletal muscle of rats with chronic fatigue syndrome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1618-1625. |
| [2] | Zhou Panpan, Cui Yinglin, Zhang Wentao, Wang Shurui, Chen Jiahui, Yang Tong . Role of cellular autophagy in cerebral ischemic injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1650-1658. |
| [3] | Zhu Hanmin, Wang Song, Xiao Wenlin, Zhang Wenjing, Zhou Xi, He Ye, Li Wei, . Mitophagy regulates bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1676-1683. |
| [4] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [5] | Chen Yuning, Jiang Ying, Liao Xiangyu, Chen Qiongjun, Xiong Liang, Liu Yue, Liu Tong. Buqi Huoxue Compounds intervene with the expression of related factors and autophagy related proteins in a rat model of cerebral ischemia/reperfusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1152-1158. |
| [6] | Liu Lingyun, He Guixin, Qin Weibin, Song Hui, Zhang Liwen, Tang Weizhi, Yang Feifei, Zhu Ziyi, Ou Yangbin . Improvement of myocardial injury by traditional Chinese medicine: mitochondrial calcium homeostasis mediates macrophage autophagy and pyroptosis pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1276-1284. |
| [7] | Xu Tianjie, Fan Jiaxin, Guo Xiaoling, Jia Xiang, Zhao Xingwang, Liu kainan, Wang Qian. Metformin exerts a protective effect on articular cartilage in osteoarthritis rats by inhibiting the PI3K/AKT/mTOR pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1003-1012. |
| [8] | Zhang Fei, Zuo Jun. Inhibition of hypertrophic scar in rats by beta-sitosterol-laden mesoporous silica nanoparticles [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7301-7309. |
| [9] | Zhou Ying, Tian Yong, Zhong Zhimei, Gu Yongxiang, Fang Hao. Inhibition of tumor necrosis factor receptor associated factor 6 regulates mTORC1/ULK1 signaling and promotes autophagy to improve myocardial injury in sepsis mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6434-6440. |
| [10] | Wang Wanchun, , Yi Jun, Yan Zhangren, Yang Yue, Dong Degang, Li Yumei. 717 Jiedu Decoction remodels homeostasis of extracellular matrix and promotes repair of local injured tissues in rats after Agkistrodon halys bite [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6457-6465. |
| [11] | Hu Shujuan, Liu Dang, Ding Yiting, Liu Xuan, Xia Ruohan, Wang Xianwang. Ameliorative effect of walnut oil and peanut oil on atherosclerosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6482-6488. |
| [12] | Xu Zhi, Chen Yundong, Sun Yujie, Gong Xiaonan, Li Yuwan. Data of spinal osteosarcoma patients in United States based on SEER database: construction and validation of a prediction model for treatment outcomes and prognosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6583-6590. |
| [13] | Yang Cheng, Li Weimin, Ran Dongcheng, Xu Jiamu, Wu Wangxiang, Xu Jiafu, Chen Jingjing, Jiang Guangfu, Wang Chunqing. Ferroptosis and osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 554-562. |
| [14] | Xu Zhenhua, Li Yanjie, Qin Hewei, Liu Haoyuan, Zhu Bochao, Wang Yupu. Traditional Chinese medicine monomer in treatment of neuroinflammation after spinal cord injury: effects of nuclear transcription factor kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 590-598. |
| [15] | Chen Jiayong, Tang Meiling, Lu Jianqi, Pang Yan, Yang Shangbing, Mao Meiling, Luo Wenkuan, Lu Wei. Causal association between metabolites and sarcopenia: a big data analysis of genome-wide association studies in the European population [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(29): 6369-6380. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||