Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (20): 4333-4340.doi: 10.12307/2025.711
Previous Articles Next Articles
Traditional Chinese medicine monomers regulate ferroptosis to combat myocardial ischemia-reperfusion injury
Shen Xiaoqiu1, Wang Zhentao2, Qiu Yueqing1, Song Chenghao1
- 1The Second Clinical Medical College of Henan University of Chinese Medicine, Zhengzhou 450002, Henan Province, China; 2Henan Provincial Hospital of Traditional Chinese Medicine, Zhengzhou 450002, Henan Province, China
-
Received:2024-07-11Accepted:2024-09-24Online:2025-07-18Published:2024-12-23 -
Contact:Wang Zhentao, Doctoral supervisor, Professor, Chief physician, Henan Provincial Hospital of Traditional Chinese Medicine, Zhengzhou 450002, Henan Province, China -
About author:Shen Xiaoqiu, MS, The Second Clinical Medical College of Henan University of Chinese Medicine, Zhengzhou 450002, Henan Province, China -
Supported by:the National Natural Science Foundation of China, No. 81573920 (to WZT)
CLC Number:
Cite this article
Shen Xiaoqiu, Wang Zhentao, Qiu Yueqing, Song Chenghao. Traditional Chinese medicine monomers regulate ferroptosis to combat myocardial ischemia-reperfusion injury[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(20): 4333-4340.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
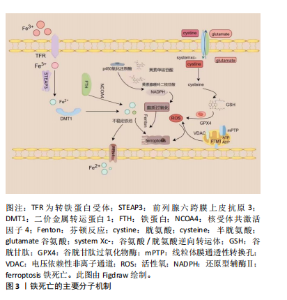
2.1 铁死亡概述 铁死亡是一种铁依赖性脂质过氧化引起的程序性细胞死亡方式,其主要机制是Fe2+和脂氧合酶催化细胞膜上的不饱和脂肪酸,引起脂质过氧化,损伤细胞结构和功能,导致细胞死亡。铁死亡的发生与铁超载、脂质过氧化、抗氧化体系受损及内质网应激等有关[7]。 2.1.1 铁超载 铁超载是铁死亡发生、发展的关键。正常情况下,细胞外的Fe3+与转铁蛋白形成复合物,之后与细胞膜上的转铁蛋白受体结合进入细胞内,经前列腺六跨膜上皮抗原3还原成Fe2+,在二价金属转运蛋白1介导下,储存在不稳定的铁池或铁蛋白中。此外,细胞内多余的Fe2+可经膜铁转运蛋白1转运到细胞外,以维持细胞内铁稳态[8]。当组织缺血缺氧时,铁代谢失衡,过量的Fe2+聚集在细胞内发生芬顿反应,产生大量的活性氧,破坏细胞结构和功能,从而导致细胞损伤或死亡。活性氧主要来源于线粒体,当活性氧增多,抗氧化功能下降,氧化还原稳态失衡会促进铁死亡的发生[9]。 2.1.2 脂质过氧化 脂质过氧化是铁死亡的主要特征。其中含有多不饱和脂肪酸 (polyunsaturated fatty acid,PUFA)的磷脂酰乙醇胺(PE)为脂质过氧化的主要底物,酰辅酶A合成酶长链家族成员4能催化PUFA,酰基化产生PUFA-CoA,在溶血磷脂酰胆碱酰基转移酶3和PE的作用下酯化成PL-PUFAs,PL-PUFAs在内质网上通过脂氧合酶介导酶促反应,产生脂质氢过氧化物(PL-PUFA-OOH),其堆积在细胞中,损伤细胞结构和功能,导致细胞铁死亡[10-12]。 2.1.3 抗氧化体系受损 谷胱甘肽、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是铁死亡抗氧化系统重要的调节因子。谷胱甘肽是机体主要的抗氧化剂,由谷氨酸、甘氨酸、半胱氨酸合成,其中半胱氨酸是谷胱甘肽合成的限速前体。溶质载体家族7成员11(solute carrier family 7,membrane 11,SLC7A11)是谷氨酸/胱氨酸逆向转运体(cystine/glutamate cystine antiporter,system Xc-)的主要亚基,通过促进胱氨酸向细胞内转入,从而促进谷胱甘肽的合成[13]。GPX4是细胞内重要的抗氧化酶,在谷胱甘肽的作用下将脂质过氧化物还原为脂醇,若谷胱甘肽耗竭,则GPX4活性降低,可诱发铁死亡[14-15]。 2.1.4 线粒体膜损伤 线粒体是细胞内能量储存和供给的细胞器,与信号传导、细胞稳态等密切相关。线粒体膜由外膜和内膜组成。电压依赖性非离子通道是线粒体外膜上的一种调节阴离子的膜蛋白,受微管蛋白的调控,可调控线粒体的代谢和降低线粒体膜电位[16]。缺血缺氧时,可抑制线粒体膜通透性转换孔开放[17],再灌注期间,电子传递链重新激活产生大量活性氧,膜电位增加,诱发氧化应激反应,进而导致细胞铁死亡[18]。 2.1.5 内质网应激 内质网是维持细胞稳态的重要细胞器之一,主要参与脂质合成、Ca2+稳态、蛋白折叠等。当缺血、缺氧刺激时,会导致内质网蛋白折叠功能受损,引起内质网应激[19]。长时间持续的内质网应激使内质网腔过度氧化,导致H2O2泄漏到细胞质中。细胞内活性氧大量积累,会激活蛋白激酶R样内质网激酶,从而活化下游转录因子4-C/EBP同源蛋白信号通路,在还原型辅酶Ⅱ氧化酶介导下,产生氧化反应,损伤细胞,诱发铁死亡[20]。 2.1.6 其他途径 细胞中的色素P450氧化还原酶可与黄素单核苷酸和黄素腺嘌呤二核苷酸结合,直接从还原型辅酶Ⅱ获取电子供给P450酶,导致细胞内PUFAs发生过氧化,诱发铁死亡[21]。此外,肿瘤抑制因子p53在MIRI时表达上调,可抑制SLC7A11表达,降低细胞抗氧化能力,促进细胞铁死亡[22]。铁死亡的主要分子机制见图3。"

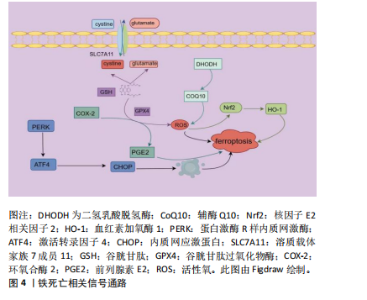
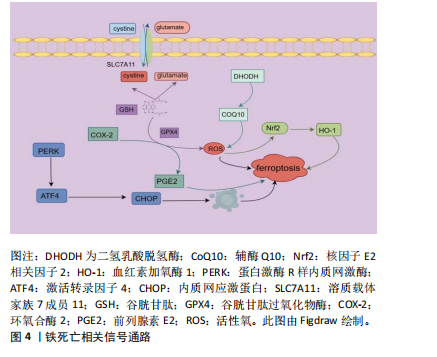
2.2 铁死亡相关信号通路 2.2.1 SLC7A11/GPX4信号通路 SLC7A11/GPX4是细胞内抗氧化体系的重要组成部分[23]。GPX4是一种谷胱甘肽依赖性酶,在还原型谷胱甘肽作用下,可清除细胞内有毒脂质过氧化物及活性氧,保护细胞。当谷胱甘肽缺乏时,可导致GPX4活性降低、膜脂过氧化、活性氧堆积,诱发铁死亡[24]。SLC7A11是System Xc-的主要亚基,下调System Xc-表达,可导致细胞内胱氨酸水平下降,进而导致谷胱甘肽耗竭,诱发氧化损伤及铁死亡。 2.2.2 Nrf2/HO-1信号通路 核因子E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)是一种亮氨酸拉链转录激活因子,可激活血红素加氧酶1 (heme oxygenase-1,HO-1)和铁蛋白重链1转录[25]。氧化应激时,Nrf2通过激活下游HO-1表达,从而促进谷胱甘肽、GPX4表达,发挥抗氧化作用[26]。此外,Nrf2激活时可上调铁蛋白重链1、膜铁转运蛋白1及SLC7A11,以促进Fe2+的排出或储存,从而抑制铁死亡。 2.2.3 二氢乳酸脱氢酶/辅酶Q10(CoQ10)信号通路 二氢乳酸脱氢酶是一种位于线粒体嵴的黄素依赖酶。COQ10在细胞内以氧化型COQ10和还原型COQ10H2两种形式存在[27]。二氢乳酸脱氢酶可将线粒体内膜中的氧化型COQ10还原成COQ10H2,以抑制线粒体内活性氧的产生并促进活性氧的清除[28]。 2.2.4 COX-2/PGE2信号通路 环氧合酶(cyclooxgenase,COX)又称为前列腺素合成酶,可作为一种限速酶催化花生四烯酸形成前列腺素E2(prostaglandin E2,PGE2)[29]。PGE2是一种在炎症、细胞凋亡、增殖等多种生理病理过程中起重要作用的脂质活性物质,通过与EP1、EP2、EP3及EP4不同受体结合,产生不同的生理效应[30]。COX-2是一种铁死亡标志基因,其升高是铁死亡发生的标志[31],PGE2可通过降低Fe2+、脂质过氧化及谷胱甘肽氧化等,从而抑制铁死亡[32]。 此外,抑制铁死亡的相关信号通路还包括Janus激酶2/信号传导与转录激活子3信号通路[33]、单磷酸腺苷活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)信号通路[34]、蛋白激酶R样内质网激酶/激活转录因子4/C/EBP同源蛋白信号通路等[35]。铁死亡相关信号通路,见图4。 2.3 铁死亡与MIRI 铁死亡是心肌细胞死亡的一种重要方式,是MIRI发生发展的关键。研究发现,在心肌缺血再灌注模型小鼠中,结扎左前降冠状动脉30 min后,小鼠心肌细胞可见大量的铁蛋白沿瘢痕区积累[36],给予铁螯合剂可减轻MIRI大鼠心肌损伤症状[37]。另有研究表明,长时间心肌缺血后,在冠状动脉血流附近发现较高浓度的铁[38]。此外,临床研究发现,在慢性冠心病和ST段抬高型心肌梗死患者中,再灌注前对患者应用铁螯合剂去铁胺,可显著减轻心肌氧化损伤,改善心肌功能[39]。由此可见,铁死亡与MIRI密切相关,通过合理干预铁死亡,可保护心肌组织,减轻再灌注损伤。 心肌缺血后,会产生大量的活性氧和自由基,诱发心肌细胞坏死和铁死亡。活性氧产生机制如下:①心肌"
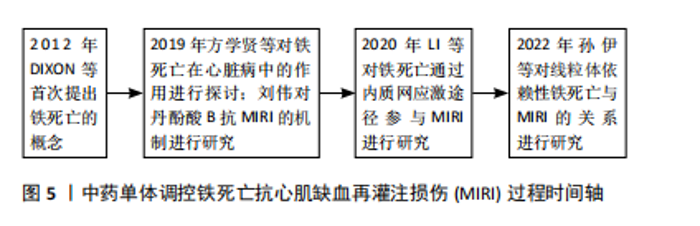
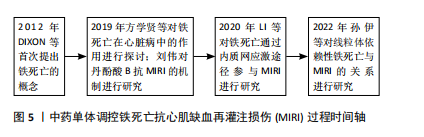
缺血、缺氧时,内源性抗氧化系统酶活性降低,线粒体呼吸链复合物Ⅰ、Ⅲ减少,电子传递链受损,电子泄露,使活性氧大量堆积[40];②缺血、缺氧刺激时,内质网未折叠或错误折叠的蛋白质过度积累,破坏内质网Ca2+稳态,导致钙超载,引起活性氧急剧增加[41];③缺血时,产生的自由基作用于细胞膜上,生成白三烯、趋化因子等,吸引大量中性粒细胞聚集并激活,再灌注后,激活的中性粒细胞耗氧量显著增加,产生大量自由基,即氧爆发[42];④缺血刺激时,交感-肾上腺髓质系统被激活,释放大量儿茶酚胺,儿茶酚胺自身氧化,产生具有细胞毒性的氧自由基;⑤缺血、缺氧时,ATP代谢障碍,产生大量次黄嘌呤,再灌注后,次黄嘌呤在黄嘌呤氧化酶的催化下,产生大量活性氧[43]。抑制活性氧产生,可减轻MIRI损伤,在MIRI大鼠模型中,抑制酰基辅酶A合成酶长链家族4表达,可增强抗氧化能力,进而抑制心肌细胞铁死亡[44]。 2.4 中药单体调控铁死亡抗MIRI研究进展 近年来,大量的细胞及动物实验研究发现,中药单体有效成分可通过调控铁死亡相关信号通路和靶点,减少铁沉积、抗氧化损伤、改善线粒体功能等抗MIRI,保护心肌细胞,主要包括黄酮类、多酚类、生物碱、皂苷类、多糖等。中药单体调控铁死亡抗心肌缺血再灌注损伤过程时间轴见图5。"

2.4.1 黄酮类化合物 葛根素(Puerarin)是葛根的主要活性成分之一,具有抗炎、调节免疫、抗氧化、清除自由基的作用[45]。DING等[46]研究发现,葛根素100 mg/kg预处理,可减轻缺血/再灌注小鼠心肌梗死面积,降低血清肌酸激酶同工酶、乳酸脱氢酶、髓过氧化物酶活性,结合体外H9C2细胞糖氧剥夺/复氧模型实验显示,葛根素可抑制H9C2细胞内活性氧、丙二醛和4-羟壬二酸酯产生,降低谷胱甘肽、ATP水平,上调GPX4表达,减少Fe2+沉积,抑制环加氧酶2表达,提示葛根素通过抑制铁死亡减轻心肌再灌注损伤。 黄芩苷(Baicalin)是从黄芩根部提取的一种黄酮类化合物,具有抗炎、抗氧化、调节免疫等作用[47]。FAN等[48]研究发现,给予心肌缺血/再灌注模型大鼠灌胃黄芩苷100,200 mg/kg,连续灌胃6 d,可减少心肌梗死面积及心肌病理损伤,改善ST段提高,其机制为降低心肌组织中Fe2+、活性氧、丙二醛含量,增加超氧化物歧化酶含量及GPX4表达,减少酰基辅酶A合成酶长链家族4、转铁蛋白受体1、核受体共激活因子4表达。 丹参素是从丹参中提取的一种黄酮类化合物,具有抗炎、抗氧化、改善循环等药理作用[49]。ZHANG等[50]研究发现,丹参素可增强谷胱甘肽过氧化物酶及超氧化物歧化酶活性,降低二价金属转运蛋白1、转铁蛋白及L型钙通道α1C亚基表达,从而减轻氧化应激损伤,减少铁积聚,抑制铁死亡。 牡荆素是从山楂、金莲花等植物中提取的一种黄酮类化合物,具有抗炎、清除自由基、改善循环等多种药理作用[51]。XUE等[52]研究发现,牡荆素可减轻MIRI大鼠心肌梗死面积,改善其心功能,减少线粒体损伤。同时,体外H9C2细胞缺氧/复氧研究证实,牡荆素可降低细胞内活性氧水平,提高线粒体活性及膜电位,增加线粒体融合蛋白2表达,减少动力相关蛋白1募集,从而改善线粒体功能,减少再灌注损伤。 2.4.2 多酚类化合物 白藜芦醇是虎杖、决明子的主要活性成分,具有抗炎、抗氧化、抗癌等作用[53]。LI等[54]的体外实验研究发现,白藜芦醇10 μmol/L可降低糖氧剥夺/复氧 H9C2细胞内Fe2+、丙二醛水平,增强超氧化物歧化酶活性,促进GPX4、铁蛋白重链1表达,抑制铁死亡,保护细胞。 白皮杉醇是从大黄中提取的一种多酚类化合物,具有抗炎、抗氧化、调节免疫、抗癌等多种药理作用[55]。赵天昊[56]研究发现,白皮杉醇可激活Nrf2通路,增强糖氧剥夺/复氧 AC16细胞活力,抑制过氧化产物及活性氧产生,减少细胞内Fe2+沉积,从而调控心肌细胞铁代谢,减轻缺血/再灌注损伤。 槲皮素是一种常见的黄酮类化合物,具有抗炎、抗氧化、抗自由基等作用[57]。宣学习等[58]研究发现,槲皮素25,50 mg/kg可减轻MIRI大鼠心肌梗死面积,减少心肌细胞凋亡,改善心肌组织病理损伤,减少心肌组织活性氧、丙二醛水平,下调磷酸化腺苷酸活化蛋白激酶、磷酸化结节性脑硬化复合物表达,增加超氧化物歧化酶含量及磷酸化雷帕霉素靶蛋白表达,提示槲皮素通过抑制AMPK/TSC2/mTOR通路抗氧化应激,保护心肌细胞。 2.4.3 生物碱类 川芎嗪是从川芎根部提取的一种生物碱,具有清除自由基、抗炎、抗氧化、抗凋亡等作用[59]。QIAN等[60]研究发现,川芎嗪预处理缺血/再灌注小鼠,可减少小鼠心肌梗死面积及细胞凋亡率,减少活性氧生成,抑制脂质过氧化,降低心肌细胞Fe2+含量,减轻Ca2+超载,从而抑制铁死亡,保护心肌组织。 石蒜碱是从石蒜鳞茎中提取的一种生物碱,具有抗肿瘤、抗炎、抗病毒、抗心肌纤维化等生物活性[61]。研究发现,石蒜碱0.014,0.028 g/L预处理缺氧/复氧H9C2细胞,可增强H9C2心肌细胞活力及超氧化物歧化酶、谷胱甘肽过氧化物酶活性,减少细胞凋亡,降低丙二醛、乳酸脱氢酶、活性氧产生,促进缺口受体1、Split多毛增强子1、发状分裂相关增强子5表达,从而减轻H9C2细胞损伤[62]。 2.4.4 皂苷类 黄芪甲苷Ⅳ是黄芪的主要活性成分之一,具有抗炎、抗氧化、调节免疫、改善心功能等作用[63]。JIANG等[64]研究发现,黄芪甲苷Ⅳ可减少缺血/再灌注大鼠心肌梗死面积,改善心功能,能通过激活Keap1/Nrf2/HO-1通路,减少糖氧剥夺/复氧 H9C2细胞内丙二醛、活性氧生成,降低Fe2+水平,从而抑制铁死亡、保护细胞。 红景天苷是红景天的主要活性成分,具有抗氧化、抗炎、改善心功能、调节免疫等多种作用[65]。王明燕等[66]研究发现,红景天苷可抑制p38丝裂原蛋白激酶通路,提高脂多糖诱导的H9C2心肌细胞活力,增加细胞内超氧化物歧化酶含量及细胞周期素D1表达,降低丙二醛含量,下调磷酸化-p38丝裂原蛋白激酶、半胱氨酸蛋白酶1表达,从而减轻氧化损伤。 2.4.5 萜类 二氢丹参酮Ⅰ是从丹参根部提取的一种亲脂性二萜类化合物,具有抗炎、抗氧化、抗肿瘤、抗凝等作用[67]。JIANG等[68]研究发现,二氢丹参酮Ⅰ预处理心肌缺血/再灌注大鼠可改善其心功能,减小梗死面积,激活抗氧化酶,促进活性氧清除,上调Nrf2表达,从而抗氧化应激,减轻心肌再灌注损伤。 黄柏酮是从白鲜皮中提取的一种柠檬苦素类三萜化合物,具有抗炎、抗氧化、调节血糖等作用[69]。范志能等[70]研究发现,黄柏酮6,1.5 mg/kg可激活Nrf2通路,减轻MIRI大鼠心肌损伤,降低心肌组织中Fe2+、活性氧含量,上调GPX4、溶质载体家族7成员11表达,从而抑制心肌细胞铁死亡。 2.4.6 醌类 芦荟苷是芦荟的主要活性成分之一,具有抗氧化、抗菌、降血糖、抗癌等作用[71]。王哲[72]研究发现,芦荟苷50 μmol/L可增加心肌缺氧复氧损伤模型细胞活力及存活率,其机制为增加超氧化物歧化酶活性,减少活性氧、丙二醛生成,上调Nrf2、HO-1表达,此外,给予si-Nrf2后,可部分逆转芦荟苷的保护作用,证实了芦荟苷通过介导Nrf2/HO-1通路发挥抗氧化应激和抗铁死亡的作用。 2.4.7 多糖类 天麻多糖是天麻的主要活性成分,具有抗氧化、调节免疫、保护心肌等作用[73]。CHEN等[74]研究发现,天麻多糖500 μg/mL预处理,可激活Nrf2/HO-1通路,上调细胞内GPX4表达,降低活性氧、丙二醛及Fe2+含量,从而抑制铁死亡,减轻再灌注损伤。 海藻多糖(seaweed polysaccharide)是海藻的主要活性成分,具有抗氧化、抗病毒、调节免疫等药理活性[75]。张联标等[76]的体外研究发现,海藻多糖呈剂量依赖性抑制Nrf2/GPX4/HO-1通路,减少H2O2诱导的H9C2心肌细胞损伤及凋亡,提高细胞内谷胱甘肽水平,促进GPX4表达,降低Fe2+、活性氧、丙二醛、4-羟壬二酸酯水平,抑制铁死亡,保护H9C2细胞。 由上可知,黄酮类、多酚类、皂苷类等中药单体有效成分,可通过调控铁死亡相关信号通路及蛋白表达,减轻铁过载、减少活性氧生成、调节脂质过氧化,减少心肌梗死面积,改善心功能,保护心肌细胞。上述中药单体有效成分及调控机制见表1。"

| [1] 周唯敏,万兵.硫酸氢氯吡格雷对老年急性ST段抬高型心肌梗死急诊介入术后患者心功能、血管内皮功能和血脂的影响[J].中国老年学杂志,2020,40(12):2474-2477. [2] ANDERSON JL, MORROW DA. Acute myocardial infarction. N Engl J Med. 2017;376(21):2053-2064. [3] 《中国心血管健康与疾病报告》2021(冠心病部分内容)[J].心肺血管病杂志,2023,42(12):1191-1198. [4] 吴纲,李雪冬,曹超,等.新活素前置应用对急性心肌梗死急诊PCI病人预后影响的临床研究[J].蚌埠医学院学报,2023,48(9):1211-1214. [5] PREM PN, SIVAKUMAR B, BOOVARAHAN SR, et al. Recent advances in potential of Fisetin in the management of myocardial ischemia-reperfusion injury-A systematic review. Phytomedicine. 2022;101: 154123. [6] 曹蛟,张杼惠,刘建和.从中医“阳气亏虚,痰瘀内阻”理论探讨中医药防治心肌缺血再灌注损伤的机制[J].世界科学技术-中医药现代化,2021,23(2):510-515. [7] QIU Y, CAO Y, CAO W, et al. The Application of Ferroptosis in Diseases. Pharmacol Res. 2020;159:104919. [8] TANG D, CHEN X, KANG R, et al. Ferroptosis: molecular mechanisms and health implications. Cell Res. 2021;31(2):107-125. [9] SU LJ, ZHANG JH, GOMEZ H, et al. Reactive Oxygen Species-Induced Lipid Peroxidation in Apoptosis, Autophagy, and Ferroptosis. Oxid Med Cell Longev. 2019;2019:5080843. [10] 王梅芳,李德冠.铁死亡及其在心脑血管疾病中的研究进展[J].生命科学,2019,31(9):886-893. [11] SHA W, HU F, XI Y, et al. Mechanism of Ferroptosis and Its Role in Type 2 Diabetes Mellitus.J Diabetes Res. 2021;2021:9999612. [12] LIANG D, FENG Y, ZANDKARIMI F, et al. Ferroptosis surveillance independent of GPX4 and differentially regulated by sex hormones. Cell.2023;186(13):2748-2764.e22. [13] LIANG C, ZHANG X, YANG M, et al. Recent Progress in Ferroptosis Inducers for Cancer Therapy. Adv Mater. 2019;31(51):e1904197. [14] URSINI F, MAIORINO M. Lipid peroxidation and ferroptosis: The role of GSH and GPx4. Free Radic Biol Med. 2020;152:175-185. [15] 张一楠,任彩佩,吴亚俐,等.白藜芦醇通过调节铁死亡通路抑制小鼠溃疡性结肠炎相关性结肠癌实验研究[J].陕西医学杂志, 2023,52(6):671-675+682. [16] 李浩然,曹策,李磊,等.心肌细胞铁死亡的机制及中药的保护作用[J].中国实验方剂学杂志,2024,30(4):260-270. [17] MARZILLI M, CREA F, MORRONE D, et al. Myocardial ischemia: From disease to syndrome. Int J Cardiol. 2020;314:32-35. [18] MARTINS-MARQUES T, RODRIGUEZ-SINOVAS A, GIRAO H. Cellular crosstalk in cardioprotection: Where and when do reactive oxygen species play a role? Free Radic Biol Med. 2021;169:397-409. [19] 翟天宇,张灿,赵琳.内质网应激的调节方式及其在脊髓损伤中的靶向作用[J].中国生物化学与分子生物学报,2023,39(11):1534-1542. [20] YAO RQ, XIA ZF, YAO YM, et al. Organelle-specific autophagy in inflammatory diseases: a potential therapeutic target underlying the quality control of multiple organelles. Autophagy. 2021;17(2):385-401. [21] LEI G, KOPPULA P, LIU X, et al. The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression. Cell Res. 2020; 30(2):146-162. [22] CHU B, CHEN D, LI T, et al. ALOX12 is required for p53-mediated tumour suppression through a distinct ferroptosis pathway. Nat Cell Biol. 2019;21(5):579-591. [23] JIANG X, STOCKWELL BR, CONRAD M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol. 2021;22(4):266-282. [24] FUJII J, HOMMA T, KOBAYASHI S. Ferroptosis caused by cysteine insufficiency and oxidative insult. Free Radic Res. 2020;54(11-12): 969-980. [25] LI J, LU K, SUN F, et al. Panaxydol attenuates ferroptosis against LPS-induced acute lung injury in mice by Keap1-Nrf2/HO-1 pathway. J Transl Med. 2021;19(1):96. [26] WU CT, DENG JS, HUANG WC, et al. Salvianolic Acid C against Acetaminophen-Induced Acute Liver Injury by Attenuating Inflammation, Oxidative Stress, and Apoptosis through Inhibition of the Keap1/Nrf2/HO-1 Signaling. Oxid Med Cell Longev. 2019;2019:9056845. [27] MURPHY MP, CHOUCHANI ET. Why succinate? Physiological regulation by a mitochondrial coenzyme Q sentinel. Nat Chem Biol. 2022;18(5): 461-469. [28] HARGREAVES I, HEATON RA, MANTLE D. Disorders of Human Coenzyme Q10 Metabolism: An Overview. Int J Mol Sci. 2020;21(18):6695. [29] KAWAHARA K, INAZUMI T, SUGIMOTO Y, et al. Prostaglandin E2-induced inflammation: Relevance of prostaglandin E receptors. Biochim Biophys Acta. 2015;1851(4):414-421. [30] 亓燕,方芸,王峰,等.COX-2/PGE2在肿瘤发生发展中的研究进展[J].药学与临床研究,2023,31(4):342-346. [31] CHEN B, CHEN Z, LIU M, et al. Inhibition of neuronal ferroptosis in the acute phase of intracerebral hemorrhage shows long-term cerebroprotective effects. Brain Res Bull. 2019;153:122-132. [32] LI Y, WANG J, CHEN S, et al. miR-137 boosts the neuroprotective effect of endothelial progenitor cell-derived exosomes in oxyhemoglobin-treated SH-SY5Y cells partially via COX2/PGE2 pathway. Stem Cell Res Ther. 2020;11(1):330. [33] 黄海燕,翁嘉灏,陆萍,等.参附汤抑制铁死亡缓解化疗药物心脏毒性研究[J].世界中医药,2024,5(19):1-11. [34] 王锋,秦文秀,王琪,等.AMPK调控铁死亡相关信号通路的研究现状[J].中国药理学通报,2023,39(10):1801-1805.
[35] 洪莉莉,吴玲娟,何海刚.青蒿琥酯调节PERK/ATF4/CHOP信号通路对OGD/R诱导的心肌细胞铁死亡的影响[J].微循环学杂志, 2023,33(1):24-32. [36] BABA Y, HIGA JK, SHIMADA BK, et al. Protective effects of the mechanistic target of rapamycin against excess iron and ferroptosis in cardiomyocytes. Am J Physiol Heart Circ Physiol. 2018;314(3): H659-H668. [37] ZHAO WK, ZHOU Y, XU TT, et al. Ferroptosis: Opportunities and Challenges in Myocardial Ischemia-Reperfusion Injury.Oxid Med Cell Longev. 2021;2021:9929687. [38] SHENG H, XIONG J, YANG D. Protective Effect of Sevoflurane Preconditioning on Cardiomyocytes Against Hypoxia/Reoxygenation Injury by Modulating Iron Homeostasis and Ferroptosis. Cardiovasc Toxicol. 2023;23(2):86-92. [39] YAN HF, ZOU T, TUO QZ, et al. Ferroptosis: mechanisms and links with diseases. Signal Transduct Target Ther. 2021;6(1):49. [40] BILLINGHAM LK, STOOLMAN JS, VASAN K, et al. Mitochondrial electron transport chain is necessary for NLRP3 inflammasome activation. Nat Immunol. 2022;23(5):692-704. [41] 李云曌,吴辉,刘滴.内质网应激与心肌缺血再灌注损伤的研究进展[J].生命的化学,2020,40(6):919-924. [42] ZHANG XJ, CHENG X, YAN ZZ, et al. An ALOX12-12-HETE-GPR31 signaling axis is a key mediator of hepatic ischemia-reperfusion injury. Nat Med. 2018;24(1):73-83. [43] LIN Y, CHEN F, ZHANG J, et al.Neuroprotective effect of resveratrol on ischemia/reperfusion injury in rats through TRPC6/CREB pathways. J Mol Neurosci. 2013;50(3):504-513. [44] FAN Z, CAI L, WANG S, et al. Baicalin Prevents Myocardial Ischemia/Reperfusion Injury Through Inhibiting ACSL4 Mediated Ferroptosis. Front Pharmacol. 2021;12:628988. [45] 李兰,杨一秋,解继胜,等.基于Wnt/β-catenin信号通路的葛根素对骨质疏松症作用的研究进展[J].解剖科学进展,2024,6(7):1-6. [46] DING Y, LI W, PENG S, et al. Puerarin Protects against Myocardial Ischemia/Reperfusion Injury by Inhibiting Ferroptosis. Biol Pharm Bull. 2023;46(4):524-532. [47] 于欢,马晓昀.黄芩苷和黄芩素干预眼部疾病的基础研究进展[J].中国中医眼科杂志,2024,34(6):581-584+596. [48] FAN Z, CAI L, WANG S, et al. Baicalin Prevents Myocardial Ischemia/Reperfusion Injury Through Inhibiting ACSL4 Mediated Ferroptosis. Front Pharmacol. 2021;12:628988. [49] 刘海平,康敏,申娜.丹参素介导Wnt-β-catenin通路增强丙泊酚对小鼠缺血再灌注肾组织损伤的保护作用机制[J].特产研究,2024, 46(2):93-98. [50] ZHANG Y, ZHANG G, LIANG Y, et al. Potential Mechanisms Underlying the Hepatic-Protective Effects of Danshensu on Iron Overload Mice. Biol Pharm Bull. 2020;43(6):968-975. [51] 盛亚男,王长远.牡荆素预防和治疗疾病作用机制研究进展[J].中国现代应用药学,2021,38(17):2156-2161. [52] XUE W, TANG H, ZHU H, et al. Vitexin attenuates myocardial ischemia/reperfusion injury in rats by regulating mitochondrial dysfunction induced by mitochondrial dynamics imbalance. Biomed Pharmacother. 2020;124:109849. [53] INCHINGOLO AD, INCHINGOLO AM, MALCANGI G, et al. Effects of Resveratrol, Curcumin and Quercetin Supplementation on Bone Metabolism-A Systematic Review. Nutrients. 2022;14(17):3519. [54] LI T, TAN Y, OUYANG S, et al. Resveratrol protects against myocardial ischemia-reperfusion injury via attenuating ferroptosis. Gene. 2022; 808:145968. [55] 汪丽娜,任若瑜,何富乐.白皮杉醇对卵巢癌细胞增殖、迁移、侵袭的影响及其诱导凋亡作用的实验研究[J].中国中医药科技, 2023,30(5):866-870. [56] 赵天昊.白皮杉醇通过Nrf-2信号介导铁代谢抑制铁死亡保护心肌缺血/再灌注损伤[D].合肥:安徽医科大学,2024. [57] 白心语,王显鹤.槲皮素治疗新生儿缺氧缺血性脑病中的研究进展[J].广东工业大学学报,2024,51(12):88-90. [58] 宣学习,张宇,张华,等.槲皮素对心肌缺血再灌注大鼠氧化应激反应及心电图的影响[J].中西医结合心脑血管病杂志,2022, 20(5):848-853. [59] 张维书,李强,王洪权.中药川芎嗪在阿尔茨海默病中的神经保护作用机制研究进展[J/OL].中药药理与临床,1-10[2024-10-12].https://doi.org/10.13412/j.cnki.zyyl.20240412.010. [60] QIAN W, XIONG X, FANG Z, et al. Protective effect of tetramethylpyrazine on myocardial ischemia-reperfusion injury. Evid Based Complement Alternat Med. 2018;2014:107501. [61] 韩明磊,刘振,侯永兰,等.石蒜碱对缺氧条件下心肌细胞损伤和心肌成纤维细胞活化与胶原合成的影响及其生物学机制[J].中国老年学杂志,2024,44(5):1165-1172. [62] 陈文明,陈嘉敏,蹇明辉.石蒜碱上调Notch1信号通路并减轻心肌细胞缺氧/复氧诱导的损伤[J].心脏杂志,2023,35(6):637-642. [63] ZHANG J, WU C, GAO L, et al. Astragaloside IV derived from Astragalus membranaceus: A research review on the pharmacological effects.Adv Pharmacol. 2020;87:89-112. [64] Jiang M, Ni J, Cao Y, et al. Astragaloside IV Attenuates Myocardial Ischemia-Reperfusion Injury from Oxidative Stress by Regulating Succinate, Lysophospholipid Metabolism, and ROS Scavenging System. Oxid Med Cell Longev. 2019;2019:9137654. [65] 刘艳,尧俊涵,梅瑀,等.红景天化学成分研究[J].中草药,2024, 55(9):2875-2886. [66] 王明燕,宣清清,许玲.红景天苷介导p38 MAPK信号通路抑制脂多糖诱导的心肌细胞焦亡及氧化损伤[J].广东医学,2023,44(10):1216-1222. [67] 冯科冉,李伟霞,王晓艳,等.丹参化学成分、药理作用及其质量标志物(Q-Marker)的预测分析[J].中草药,2022,53(2):609-618. [68] JIANG L, ZENG H, NI L, et al. HIF-1α Preconditioning Potentiates Antioxidant Activity in Ischemic Injury: The Role of Sequential Administration of Dihydrotanshinone I and Protocatechuic Aldehyde in Cardioprotection. Antioxid Redox Signal. 2019;31(3):227-242. [69] 杨妞妞,邵海峰,邓嘉林,等.白鲜皮主要药效成分白鲜碱、黄柏酮、梣酮的抗皮炎作用比较及机制研究[J].南京医科大学学报(自然科学版),2023,43(12):1636-1642+1649. [70] 范志能,周厚清.黄柏酮通过调控铁死亡途径对心肌缺血/再灌注大鼠心肌损伤的保护作用研究[J].中国医院药学杂志,2023,43(17): 1932-1938. [71] 张小妮,陈由强,陈建楠.芦荟苷及其水解产物芦荟大黄素的研究进展[J].生物技术通讯, 2020,31(2):227-231. [72] 王哲.芦荟苷在心肌缺血再灌注损伤中的保护作用及机制研究[D].长春:吉林大学,2023. [73] 尚玉杰,张强,韩彦斌,等.天麻化学成分、药理作用及其产品开发分析[J].中医药学报,2024,52(8):115-121. [74] CHEN Q, ZHOU B, XIONG X. Neutral polysaccharide from Gastrodia elata alleviates cerebral ischemia-reperfusion injury by inhibiting ferroptosis-mediated neuroinflammation via the NRF2/HO-1 signaling pathway. CNS Neurosci Ther. 2024;30(3):e14456. [75] 杜国丰,陈红漫,刘凤翊,等.海藻多糖的提取、生物活性及其应用研究进展[J].食品科技,2023,48(2):188-195. [76] 张联标,杨荧,王东升.海藻多糖调节Nrf2通路对过氧化氢诱导的心肌细胞损伤及铁死亡的抑制作用[J].中国循证心血管医学杂志, 2023,15(6):712-715+720. |
| [1] | Yin Lu, Jiang Chuanfeng, Chen Junjie, Yi Ming, Wang Zihe, Shi Houyin, Wang Guoyou, Shen Huarui. Effect of Complanatoside A on the apoptosis of articular chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1541-1547. |
| [2] | Zhou Panpan, Cui Yinglin, Zhang Wentao, Wang Shurui, Chen Jiahui, Yang Tong . Role of cellular autophagy in cerebral ischemic injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1650-1658. |
| [3] | Yu Ting, Lyu Dongmei, Deng Hao, Sun Tao, Cheng Qian. Icariin pretreatment enhances effect of human periodontal stem cells on M1-type macrophages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1328-1335. |
| [4] | Aikepaer · Aierken, Chen Xiaotao, Wufanbieke · Baheti. Osteogenesis-induced exosomes derived from human periodontal ligament stem cells promote osteogenic differentiation of human periodontal ligament stem cells in an inflammatory microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1388-1394. |
| [5] | Zhang Haojun, Li Hongyi, Zhang Hui, Chen Haoran, Zhang Lizhong, Geng Jie, Hou Chuandong, Yu Qi, He Peifeng, Jia Jinpeng, Lu Xuechun. Identification and drug sensitivity analysis of key molecular markers in mesenchymal cell-derived osteosarcoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1448-1456. |
| [6] | Sun Yuting, Wu Jiayuan, Zhang Jian. Physical factors and action mechanisms affecting osteogenic/odontogenic differentiation of dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1531-1540. |
| [7] | Zhao Ruihua, Chen Sixian, Guo Yang, Shi Lei, Wu Chengjie, Wu Mao, Yang Guanglu, Zhang Haoheng, Ma Yong. Wen-Shen-Tong-Du Decoction promoting spinal cord injury repair in mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1118-1126. |
| [8] | Zheng Lin, Jin Wenjun, Luo Shanshan, Huang Rui, Wang Jie, Cheng Yuting, An Zheqing, Xiong Yue, Gong Zipeng, Liao Jian. Eucommia ulmoides promotes alveolar bone formation in ovariectomized rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1159-1167. |
| [9] | Zhang Debao, Wang Peng, Li Kun, Zhang Shaojie, Li Zhijun, Li Shuwen, Wu Yimin. Epidural fibrous scar formation in rabbits following autologous ligamentum flavum intervention [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1168-1175. |
| [10] | Ji Huihui, Jiang Xu, Zhang Zhimin, Xing Yunhong, Wang Liangliang, Li Na, Song Yuting, Luo Xuguang, Cui Huilin, Cao Ximei. SR9009 combined with indolepropionic acid alleviates inflammation in C2C12 myoblasts through the nuclear factor-kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1220-1229. |
| [11] | He Bo, Chen Wen, Ma Suilu, He Zhijun, Song Yuan, Li Jinpeng, Liu Tao, Wei Xiaotao, Wang Weiwei, Xie Jing . Pathogenesis and treatment progress of flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1230-1238. |
| [12] | Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275. |
| [13] | Xu Tianjie, Fan Jiaxin, Guo Xiaoling, Jia Xiang, Zhao Xingwang, Liu kainan, Wang Qian. Metformin exerts a protective effect on articular cartilage in osteoarthritis rats by inhibiting the PI3K/AKT/mTOR pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1003-1012. |
| [14] | Lan Shuangli, Xiang Feifan, Deng Guanghui, Xiao Yukun, Yang Yunkang, Liang Jie. Naringin inhibits iron deposition and cell apoptosis in bone tissue of osteoporotic rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 888-898. |
| [15] | Lang Mecuo, Zhang Yilin, Wang Li. MiR-338-3p affects proliferation and apoptosis of alveolar bone osteoblasts by targeting receptor activator of nuclear factor-kappaB ligand [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 899-907. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||