Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (31): 5048-5054.doi: 10.12307/2024.715
Previous Articles Next Articles
Interleukin-1beta enhances migration and adhesion of mesenchymal stem cells in inflammatory environments
Wu Qixiang, Fang Chenyu, Zhang Lei
- Medical School, Kunming University of Science and Technology, Kunming 650500, Yunnan Province, China
-
Received:2023-09-14Accepted:2023-10-16Online:2024-11-08Published:2024-01-22 -
Contact:Zhang Lei, PhD, MD, Professor, Medical School, Kunming University of Science and Technology, Kunming 650500, Yunnan Province, China -
About author:Wu Qixiang, Medical School, Kunming University of Science and Technology, Kunming 650500, Yunnan Province, China -
Supported by:National Natural Science Foundation of China, No. 81660303 (to ZL); Innovation and Entrepreneurship Training Program for College Students in Yunnan Province, No. S202210674078 (to WQX)
CLC Number:
Cite this article
Wu Qixiang, Fang Chenyu, Zhang Lei. Interleukin-1beta enhances migration and adhesion of mesenchymal stem cells in inflammatory environments[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5048-5054.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
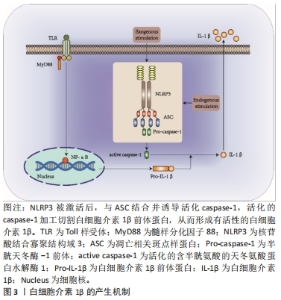
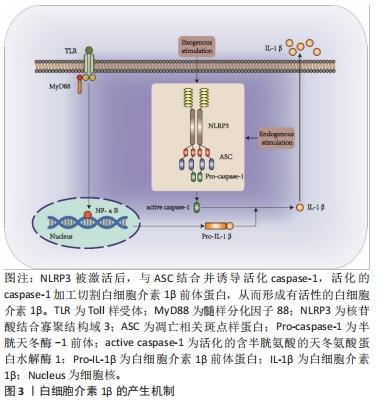
2.1 白细胞介素1β概述 白细胞介素1是第一个被发现的白细胞介素。作为白细胞介素家族的开创性细胞因子,白细胞介素1家族的影响力也超过其他家族。白细胞介素1β作为白细胞介素1家族的典型成员之一,是一种促炎细胞因子,可由多种细胞表达,包括巨噬细胞、单核细胞、淋巴细胞、中性粒细胞和成纤维细胞等[5],其参与多种免疫反应,包括先天性免疫和适应性免疫,通过诱导趋化因子合成、上调促炎基因表达、募集白细胞等途径发挥作用。因此,白细胞介素1β的分泌是机体对病原体的防御反应,但高浓度的白细胞介素1β将直接导致重度炎症,是心血管疾病、神经障碍和骨性关节炎等疾病的危险信号[6-8]。 2.1.1 白细胞介素1β产生的机制 大量研究表明,白细胞介素1β的产生主要与核苷酸结合寡聚结构域(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体信号通路有关[9-11],而白细胞介素1β发挥作用的前提是其自身必须以前体形式加工成为白细胞介素1β信号转导中的活性激动剂[12]。当Toll样受体(Toll-like receptors,TLR)识别病原体相关分子模式(pathogen-associated molecular pattern,PAMP)或细胞因子后,白细胞介素1β mRNA才能由单核细胞、巨噬细胞和树突状细胞中被翻译,合成白细胞介素1β前体蛋白[13]。同时,NLRP3炎症小体被激活,它与胱天蛋白酶募集结构域(caspase recruitment domain,CARD)和pyrin结构域的衔接蛋白凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)结合,然后NLRP3-ASC复合物募集并结合含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase-1,caspase-1)并诱导其活化,活化的caspase-1便可对无活性的白细胞介素1β前体蛋白进行切割、加工,从而形成有活性的白细胞介素1β[14]。此后,有活性的白细胞介素1β便可在炎症组织内发挥介导细胞信号转导的作用,其产生机制如图3所示。"
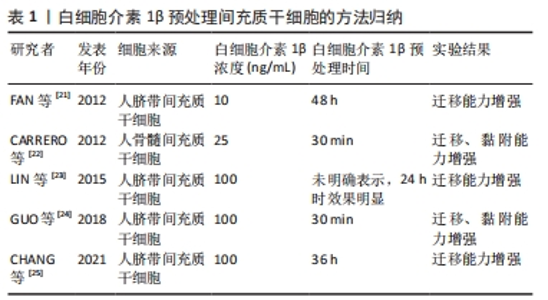
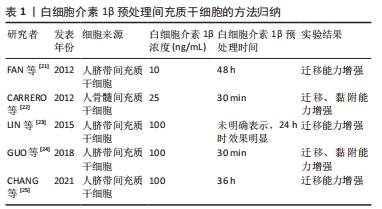
2.1.2 现有白细胞介素1β的跨膜信号转导机制 细胞表面存在白细胞介素1β受体,其属于TLR中的白细胞介素1受体超家族,由细胞内启动级联信号的TIR(Toll/interleukin-1 receptor,TIR)结构域定义,分为白细胞介素1RI和白细胞介素1RII两类受体,白细胞介素1β主要通过与白细胞介素1RI结合发挥信号转导的作用[15]。白细胞介素1RI的胞外结构域由319个氨基酸组成,其负责与配体结合[5]。同时,当白细胞介素1β与间充质干细胞表面的白细胞介素1RI结合时,白细胞介素1受体辅助蛋白(Interleukin-1 receptor accessory protein,IL-1RAcP)聚集[16],而白细胞介素1RAcP通常通过募集包括髓样分化因子88(myeloid differentiation factor 88,MyD88)及白细胞介素1受体相关激酶1(IL-1 receptor associated kinase,IRAK)等细胞质内的信号介质来启动炎症信号通路[17]。因此,白细胞介素1RAcP的聚集为白细胞介素1β信号转导的必要条件,完成白细胞介素1β的跨膜信号转到需要白细胞介素1β、白细胞介素1RI和白细胞介素1RAcP这一组分子。 2.2 体外研究中白细胞介素1β预处理间充质干细胞的可行性探讨 大量研究表明,在体外,细胞生活的环境影响细胞的分化表型、基因表达以及生物学功能。因此,改变细胞生长生活环境的一两个条件如营养物质、氧气浓度和压力等[18-20],会对细胞表型和功能产生影响。白细胞介素1β在绝大多数炎性状态下高表达,因此间充质干细胞在炎症环境中不可避免地暴露于高浓度的白细胞介素1β环境中。因此,体外模拟白细胞介素1β高表达环境是研究间充质干细胞在炎症状态下的行为及功能的方法之一。 2.2.1 白细胞介素1β预处理间充质干细胞的方法归纳 大量研究表明,白细胞介素1β预处理能够增强不同来源的间充质干细胞迁移、黏附的能力,但是研究者们并未设置白细胞介素1β的浓度梯度,而是各研究团队采用一个各自选取的白细胞介素1β浓度,采用的浓度分别为10 ng/mL,25 ng/mL和100 ng/mL,现有研究大多数采用了100 ng/mL的浓度。在时间点的选择上,有30 min,24 h,36 h和48 h,且实验所用间充质干细胞来源不同,因此难以横向对比不同研究团队的结果。后续需要一个就不同浓度和时间对特定间充质干细胞作用的系统性结果。为便于后续研究参考,将现有的研究中预处理间充质干细胞的白细胞介素1β浓度和作用时间进行归纳[21-25],见表1。"

2.2.2 临床前研究中白细胞介素1β预处理间充质干细胞的可行性探讨 通过人工方法趋化间充质干细胞的最终目的是期望更多的间充质干细胞能够在病灶部位发挥抵抗炎症、组织修复的功能,所以对该方法应用价值的探讨至关重要。 在体外使用白细胞介素1β预处理间充质干细胞,改变间充质干细胞的生存环境,从而使其向更具抗炎功能方向发展,并能够迁移、黏附至炎症部位。另外,通过对体内白细胞介素1β浓度的调控,使得炎症部位能够募集更多的内源性间充质干细胞。与体内募集内源性间充质干细胞相比,输注外源性预处理间充质干细胞存在种子细胞的来源受限、体外扩增容易失去细胞表型和病原体传播风险高等缺点。目前开展的研究大多以体外诱导为主,通过体外预处理模拟白细胞介素1β高表达的环境,其目的是通过白细胞介素1β与间充质干细胞预先相互作用,使间充质干细胞提前进入炎症应对的状态,以期减少间充质干细胞在体内炎症环境下的反应时间,该方法是提高细胞移植治疗效率的探索,也是研究这一过程中分子作用机制的手段。 以往研究通过体外预处理的方法,能够达到以下效果,文章就该方法进行归纳[21,26-27],见表2。"


此外,也有研究者通过病毒转染和基因敲除等技术改变间充质干细胞的表型[28-29],但是白细胞介素1β预处理更加便捷、易于操作且成本较低。以上研究突出并证实了白细胞介素1β预处理改变间充质干细胞表型的可能性,通过该种手段能够达到抑制炎症和促进组织再生目的,从另一维度表明了更多的具有抗炎表型的间充质干细胞被白细胞介素1β趋化至炎症部位具有十分重要的意义,在一定程度上可以减少实验成本和增强效果。通过白细胞介素1β预处理是否既能促进间充质干细胞迁移,又能使间充质干细胞发挥抗炎功能,FAN等[21]的研究中已初步探索,但此类研究较少,有待进一步挖掘。 2.3 白细胞介素1β影响间充质干细胞迁移及黏附的机制 目前已有的研究成果表明,白细胞介素1β主要通过核转录因子κB经典激活通路、MAPK通路(ERK1/2和p38途径)增强间充质干细胞迁移、黏附作用。虽然存在其他相关机制,例如整合素聚集介导的细胞黏附[30],但是主要以核转录因子κB和MAPK两种通路更为典型,文章汇总了几例围绕白细胞介素1β影响间充质干细胞的典型研究[22-25,30-32],见表3,并在下文对核转录因子κB和MAPK两种通路做了详细阐述。"
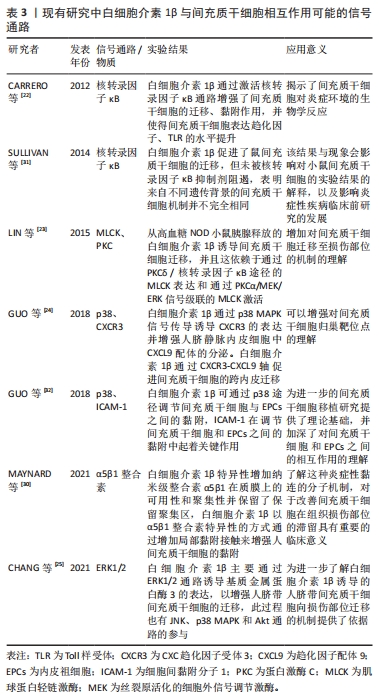
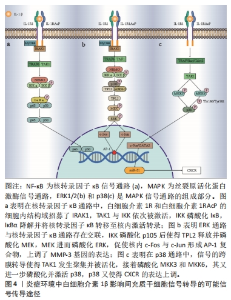
2.3.1 核转录因子κB经典激活通路对间充质干细胞的影响 CARRERO等[22]通过Transwell实验,在上腔培养人骨髓来源的间充质干细胞,并在下腔中添加基质细胞衍生因子1α(stromal cell-derived factor-1α,SDF-1α)、白细胞介素1β或10% FBS来观察它们对间充质干细胞迁移的影响,结果显示,间充质干细胞对白细胞介素1β的迁移反应比对SDF-1α的迁移反应更明显[(1.68±0.21)倍和(1.35±0.16)倍],这表明白细胞介素1β具有很强的促进迁移作用,最大迁移率达到FBS的(1.87±0.12)倍。理论上,SDF-1α是间充质干细胞的营养因子[33-34],而体积分数为10%的FBS富含细胞因子和生长因子,它们应该对间充质干细胞的迁移产生更大影响。研究者认为,这一实验证明了白细胞介素1β是间充质干细胞的强趋化因子。CARRERO等[22]还测量了间充质干细胞对细胞外基质主要成分的黏附作用,结果表明,白细胞介素1β预处理增加了间充质干细胞对胶原蛋白[(3.03±0.29)倍]、纤维连接蛋白[(1.75±0.11)倍]和层粘连蛋白[(2.79±0.15)倍]的黏附能力。生物信息学分析和RT-PCR研究发现多种趋化因子、Toll样受体表达上调。同时,利用Western blot分析白细胞介素1β处理的间充质干细胞中的激酶磷酸化情况,以及SDS-PAGE分离细胞总裂解物,并采用Anti-GAPDH作为对照,均观察到核转录因子κB的表达增加,但以上现象能够被慢病毒载体中构建的IKKβ shRNA阻断。因此,证明核转录因子κB通路的激活增强了间充质干细胞的迁移、黏附作用。但是核转录因子κB自身并不是趋化性物质,而是通过激活多种基因转录,表达趋化因子、黏附分子、生长因子等发挥作用[35],其表达谱有待进一步完善。 核转录因子κB经典激活通路机制如图4a所示,在白细胞介素1β和白细胞介素1RI结合的同时,白细胞介素1RAcP发生聚合,接着才能募集接合蛋白MyD88和肿瘤坏死因子受体相关因子(tumor necrosis factor receptor-associated factors,TRAF),其中MyD88通过其羧基端TIR结构域与白细胞介素1RAcP相互作用[36]。在MyD88与TIR相互作用时,白细胞介素1RI和白细胞介素1RAcP的细胞内结构域也招募了IRAK1,这是参与该信号传导的另一种蛋白质[16],这一步将导致IRAK1磷酸化并与白细胞介素1R分离。游离的IRAK1与泛素连接酶TRAF6相互作用,进而引发转化生长因子β活化激酶1 (TGF-β Activated Kinase 1,TAK1)的聚集和激活[37]。接着,IκB激酶(inhibitor κB kinase,IKK)即IKKα/IKKβ/NEMO复合物被激活,IKK负责磷酸化κB抑制剂(Inhibitor of NF-κB,IκB),使得 IκBα变得多聚泛素化,最后被降解[38]。随着核转录因子κB抑制剂IκBα的降解,原先细胞质中的核转录因子κB(p65和p50)从IκBα结合中释放出来,转移到细胞核以激活转录,表达相关产物,从而促进间充质干细胞的迁移和黏附[39]。"
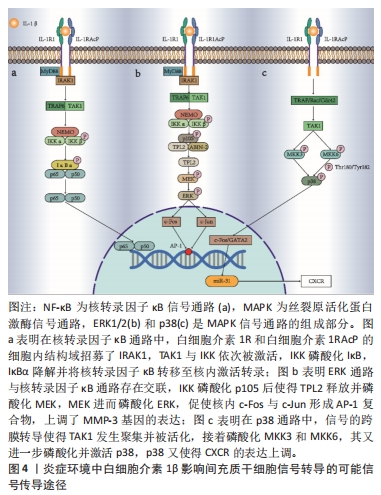

值得注意的是,虽然当前很多研究表明白细胞介素1β对间充质干细胞的强趋化作用主要依靠核转录因子κB经典激活途径,但白细胞介素1β对不同遗传背景来源间充质干细胞的作用可能通过不同途径产生影响。在CARRERO等[22]的研究中,其研究对象是人骨髓来源的间充质干细胞,核转录因子κB通路的激活增强了间充质干细胞的迁移能力。而在SULLIVAN等[31]的研究中,研究对象是不同遗传背景的小鼠间充质干细胞,使用表达核转录因子κB超级阻遏物的腺病毒载体转导间充质干细胞,或在培养基中添加姜黄素,以抑制核转录因子κB信号通路,与阴性对照组相比,白细胞介素1β预处理对迁移的增强作用未被逆转。结果显示,有些小鼠来源的间充质干细胞,在白细胞介素1β预处理下迁移作用的增强是不依赖核转录因子κB经典激活途径的,这一研究结果将直接影响基础研究和临床前研究对体内外实验结果的解释说明。因此,有研究者做了其他信号途径的研究。 2.3.2 ERK1/2 MAPK通路对间充质干细胞的影响 有研究表明,白细胞介素1β诱导细胞表达的不同类型的基质金属蛋白酶(Matrix metalloproteinases,MMP)与细胞迁移有关[40],但具体机制有待进一步研究。为此,在探索MMP对间充质干细胞迁移与侵袭影响的研究中,CHANG等[25] 使用100 ng/mL的白细胞介素1β处理人脐带间充质干细胞,24 h后,干细胞的迁移能力显著增强;同时,通过cDNA微阵列和ELISA分析,发现迁移能力的增强与MMP-3基因表达上调有关,而增强迁移的效果能够被siRNA-MMP-3转染操作抑制。为了进一步确定白细胞介素1β是否通过ERK1/2通路诱导间充质干细胞中MMP-3蛋白的表达,研究者使用ERK1/2抑制剂U0126处理白细胞介素1β处理的人脐带间充质干细胞。通过蛋白质印迹分析,36 h后白细胞介素1β处理的细胞中MMP-3蛋白的表达水平显著高于未处理的细胞,而用ERK1/2抑制剂U0126处理的细胞显示白细胞介素1β诱导的MMP-3蛋白表达被显著抑制。p38抑制剂、Akt抑制剂和JNK抑制剂也在一定程度上降低了白细胞介素1β诱导的MMP-3 mRNA和蛋白表达。因此推测,白细胞介素1β可能通过MAPK中的ERK1/2途径上调间充质干细胞中MMP-3的表达,促进间充质干细胞的迁移与侵袭。在该项研究中,研究者主要围绕ERK1/2通路展开细致研究,而p38,Akt和JNK通路有待进一步深入探索。 ERK1/2通路途径机制如图4b所示,ERK1/2通路与核转录因子κB经典激活通路存在交联。IKK除了磷酸化IκB外,还可以磷酸化p105[41]。p105是核转录因子κB的抑制蛋白,其与肿瘤进展位点2(tumor progression locus 2,TPL2)、泛素结合蛋白ABIN-2(A20 binding inhibitors of NF-kappa B)组成复合物以维持TPL2的稳定[42]。而TPL2是丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK/MAPKK)的激活剂。IKK磷酸化p105后,p105-TPL2-ABIN-2复合物释放TPL2,这一步将核转录因子κB通路的激活与MAPK信号传导耦合[43]。从复合物中释放后,TPL2直接磷酸化MEK,MEK进一步激活ERK[44],ERK传导信号至细胞核内,使c-Fos与c-Jun形成异质二聚体,然后形成AP-1复合物,该二聚体调控mRNA表达,从而调节c-Jun/c-Fos的表达[45]。而MMP的启动子在DNA链大约-70 bp处有一个AP-1位点[46]。AP-1进一步活化了MMP启动子,启动并上调了MMP基因的表达。 白细胞介素1β能够诱导间充质干细胞表达MMP和CXC趋化因子受体(chemokine receptor,CXCR)等物质,并且这些表达产物又可分为不同的亚型[47-48]。因此,具体哪些表达产物能够促进间充质干细胞的迁移或黏附,有待进一步探索。同时,白细胞介素1β促进间充质干细胞迁移、黏附的过程有多条通路参与,但不能排除信号通路相互串扰的可能。在MAO等[49]的一项研究中发现低剂量白细胞介素1β通过激活骨形态发生蛋白/Smad通路以促进牙周膜干细胞的成骨效应,但高剂量白细胞介素1β通过激活核转录因子κB和MAPK信号抑制骨形态发生蛋白/Smad信号通路,进而抑制成骨。白细胞介素1β影响间充质干细胞的双刃剑效应已在牙周膜干细胞成骨效应中体现,而在CHANG等[25]的研究中仅设置了100 ng/mL这一浓度,所以白细胞介素1β对间充质干细胞迁移、黏附、分泌的剂量依赖性以及是否存在双重效应,依然有待探索。 2.3.3 p38 MAPK通路对间充质干细胞的影响 有研究还表明,白细胞介素1β在不同类型的细胞中诱导CXCR表达上调[50-51]。以CXCR3为例,CXCR3是一种G蛋白偶联的趋化因子受体,在各种免疫反应、细胞跨内皮迁移中发挥重要作用。CXCR可以特异性地结合5种CXCL,其诱导的趋化因子包括CXCL4,CXCL4L1,CXCL9,CXCL10和CXCL11,5种配体与CXCR3的结合会触发细胞的趋化性迁移[52]。在GUO等[24]的一项研究中,使用白细胞介素1β处理人脐静脉内皮细胞,18 h和24 h时均检测到CXCL9高表达;另外,通过免疫荧光染色、蛋白质印迹、细胞活力测定以及环己酰亚胺(蛋白质合成抑制剂)处理等实验手段,证明了白细胞介素1β诱导骨髓间充质干细胞表面CXCR3的快速表达;通过共培养方法进一步研究了间充质干细胞和人脐静脉内皮细胞之间的相互作用,60 min后细胞形态发生变化,间充质干细胞变得更加扁平并黏附在人脐静脉内皮细胞单层上。当用白细胞介素1β刺激间充质干细胞 30 min时,发现间充质干细胞在更短的时间内附着和黏附在人脐静脉内皮细胞上,且该作用被CXCL9增强。同时,白细胞介素1β处理增强了间充质干细胞从人脐静脉内皮细胞上腔向下腔的跨内皮迁移能力。以上效应可通过在白细胞介素1β刺激处理间充质干细胞 30 min之前,用p38 MAPK抑制剂SB203580预处理间充质干细胞 2 h阻断,使得间充质干细胞的侵袭能力与跨内皮细胞迁移能力减弱。因此证明p38 MAPK信号传导与白细胞介素1β诱导的CXCR3介导的间充质干细胞趋化性侵袭相关,白细胞介素1β通过CXCR3-CXCL9轴发挥趋化间充质干细胞的作用。 p38 MAPK通路机制如图4c所示,白细胞介素1β与膜受体结合,其信号的传递由衔接蛋白TRAF或其他小分子蛋白Rac、Cdc42等介 导[53]。接着,TAK1发生聚集并被活化,TAK1的活化又引发了MKK的磷酸化[54]。MKK又在p38磷酸化的过程中发挥重要作用,主要包括MKK3和MKK6[55]。MKK3和MKK6通过磷酸化p38的氨基酸序列Thr-Gly-Tyr中的残基Thr180和Tyr182激活p38[56]。p38途径能够激活细胞核内的c-Fos与c-Jun,形成AP-1复合物[57]。同时,激活的p38也能激活细胞核内的c-Fos和GATA2,从而调控miR-31的转录[58]。研究表明,miR-31能够上调CXCR的表达,促进间充质干细胞的迁移[59]。 在张玉娟等[59]的研究中,证实了miR-31能够促进CXCR4的表达,而CXCR4的配体是CXCL12[60],它与CXCR3并不匹配,miR-31与CXCR3的表达上调是否有关还未有报道。因此,p38如何进一步增加CXCR3或其他CXCR表达的具体机制依然有待探索。同时,p38途径能够激活AP-1复合物[61],AP-1在细胞的生长、分化中发挥重要作用[62]。正如上文CHANG等[25]的研究中白细胞介素1β诱导AP-1参与的MMP-3蛋白表达也被p38抑制剂阻遏。因此,AP-1在p38途径中调控哪些基因的转录,有待进一步研究。 2.4 在炎症环境中间充质干细胞的潜在作用和可能作用途径 尽管炎症自身能够帮助消灭病原体、产生免疫反应等,但是过度的炎症反应并不利于组织的再生与修复,带来的负面效应包括压迫、阻塞和纤维化等。白细胞介素1β信号传导通路能进一步增强间充质干细胞向炎症部位的迁移黏附,而当更多间充质干细胞被趋化至炎症部位时,便期望间充质干细胞能够发挥抗炎功能和免疫抑制特性。 REDONDO-CASTRO等[27]使用1,10,50 和100 ng/mL 白细胞介素1β分别加入已接种间充质干细胞的培养基中处理24 h,以模拟间充质干细胞在炎性状态下的生存环境,处理24 h后通过ELISA分析被白细胞介素1β处理的间充质干细胞分泌组的变化,发现与对照组相比,间充质干细胞分泌的集落细胞刺激因子(granulocyte colony-stimulating factor,G-CSF)、抗炎因子白细胞介素10和血管内皮生长因子增加。他们将细菌脂多糖处理的永生化小鼠小神经胶质的BV2细胞培养于白细胞介素1β预处理后的间充质干细胞条件培养基中,培养24 h后,ELISA分析得出BV2细胞中抗炎因子白细胞介素10分泌增加,促炎因子白细胞介素6和肿瘤坏死因子α分泌减少,相较于对照组,白细胞介素1β显著放大了间充质干细胞的这一作用。结果表明,白细胞介素1β预处理增加了间充质干细胞抗炎递质和营养因子的分泌,从而介导其周围细胞再生,提高细胞抗炎的能力。这一结果支持了干细胞预处理在未来治疗中的潜在用途。 在大鼠心肌缺血再灌注模型中,LUO等[26]使用12.5 ng/mL的白细胞介素1β或转化生长因子β1处理间充质干细胞 24 h,ELISA分析得到白细胞介素1β处理后的间充质干细胞分泌血管内皮生长因子的量增加,将这种间充质干细胞注射入不同程度的缺血再灌注损伤的大鼠心脏内,极大地改善了大鼠损伤心肌的功能,两种细胞因子联合处理效果更佳,但当p38 MAPK和SMAD3通路被阻遏后,以上效果不再出现。结果表明,用白细胞介素1β或两种因子的联合运用预处理间充质干细胞有助于缺血性组织损伤治疗。但是,该项研究重点检测了血管内皮生长因子的表达,但并不能排除其他生长因子在白细胞介素1β预处理的间充质干细胞介导的心肌功能恢复中可能发挥的重要作用。 在右旋糖酐硫酸钠诱导的小鼠结肠炎模型中,FAN等[21]使用10 ng/mL的白细胞介素1β预处理间充质干细胞 48 h,同时另设实验组用siRNA下调白细胞介素1RI表达来抑制间充质干细胞中的白细胞介素1β 信号传导,转染后再使用白细胞介素1β预处理间充质干细胞,在使用或不使用白细胞介素 1β 培养间充质干细胞 2 d 后,均观察到细胞保持良好的细胞形态。此外,白细胞介素1β不影响间充质干细胞的生存能力,但当不存在或存在白细胞介素1β的情况时,白细胞介素1RI siRNA都显著降低了间充质干细胞的生存力,这表明,一定程度上白细胞介素1β信号传导对维持间充质干细胞的生存能力很重要。将预处理的间充质干细胞注射入右旋糖酐硫酸钠诱导的结肠炎小鼠模型后,采用体内荧光成像定位间充质干细胞,并使用Q-PCR检测特定mRNA的水平,结果表明,白细胞介素1β通过上调间充质干细胞 CXCR4的表达,增强了间充质干细胞迁移到右旋糖酐硫酸钠诱导的结肠炎小鼠发炎的脾脏和结肠的能力。白细胞介素1β到达炎症部位后,可以促进间充质干细胞分泌白细胞介素8,进而又募集了中性粒细胞和巨噬细胞;同时白细胞介素1β预处理的间充质干细胞可以通过细胞与细胞接触或分泌前列腺素E2有效抑制过度的炎症免疫反应。这一研究结果,部分阐述了白细胞介素1β对间充质干细胞在炎症环境中发挥抑制或促进炎症的机制。当两种作用相反的途径同时发挥作用时,两者的作用关系是如何平衡的?哪种情况下其中的一个途径发挥主导作用?该研究尚未有解释。 研究表明,间充质干细胞发挥旁分泌功能的关键介质是外泌体[63]。使用白细胞介素1β预处理间充质干细胞后,细胞分泌组发生改变并朝着抗炎的表型转变,其外泌体的内容物也会随之发生改变。近些年,越来越多的研究者聚焦于间充质干细胞的外泌体,在各类疾病的动物模型治疗中效果显著。值得注意的是,白细胞介素1β预处理的间充质干细胞后并不一定完全朝着抗炎表型发展,而是在抗炎和促炎反应中找到一个平衡,间充质干细胞外泌体的有效治疗时间也有待进一步探索。"

| [1] CAI H, GUO H. Mesenchymal stem cells and their exocytotic vesicles. Int J Mol Sci. 2023;24(3):2085. [2] ADELIPOUR M, LUBMAN DM, KIM J. Potential applications of mesenchymal stem cells and their derived exosomes in regenerative medicine. Expert Opin Biol Ther. 2023;23(6):491-507. [3] YANG G, FAN X, LIU Y, et al. Immunomodulatory mechanisms and therapeutic potential of mesenchymal stem cells. Stem Cell Rev Rep. 2023;19(5):1214-1231. [4] BROWN M, WORRELL C, PARIANTE CM. Inflammation and early life stress: an updated review of childhood trauma and inflammatory markers in adulthood. Pharmacol Biochem Behav. 2021;211:173291. [5] AKDIS M, BURGLER S, CRAMERI R, et al. Interleukins, from 1 to 37, and interferon-γ: receptors, functions, and roles in diseases. J Allergy Clin Immunol. 2011;127(3):701-721, e1-e70. [6] KITAGAWA T, HATTORI T, SENTANI K, et al. Relationship between interleukin-1β gene expression in epicardial adipose tissue and coronary atherosclerosis based on computed tomographic analysis. J Cardiovasc Comput Tomogr. 2021; 15(2):175-179. [7] STRENN N, PÅLSSON E, LIBERG B, et al. Influence of genetic variations in IL-1B on brain region volumes in bipolar patients and controls. Psychiatry Res. 2021;296: 113606. [8] LU J, MIAO Z, JIANG Y, et al. Chrysophanol prevents IL-1β-Induced inflammation and ECM degradation in osteoarthritis via the Sirt6/NF-κB and Nrf2/NF-κB axis. Biochem Pharmacol. 2023;208:115402. [9] ZHANG J, LIU X, WAN C, et al. NLRP3 inflammasome mediates M1 macrophage polarization and IL-1β production in inflammatory root resorption. J Clin Periodontol. 2020;47(4):451-460. [10] CRISTINA DE BRITO TOSCANO E, LEANDRO MARCIANO VIEIRA É, BONI ROCHA DIAS B, et al. NLRP3 and NLRP1 inflammasomes are up-regulated in patients with mesial temporal lobe epilepsy and may contribute to overexpression of caspase-1 and IL-β in sclerotic hippocampi. Brain Res. 2021;1752:147230. [11] LI Z, HU J, BAO C, et al. Activation of the NLRP3 inflammasome and elevation of interleukin-1β secretion in infection by sever fever with thrombocytopenia syndrome virus. Sci Rep. 2022;12(1):2573. [12] SCHRODER K, TSCHOPP J. The inflammasomes. Cell. 2010;140(6):821-832. [13] WAN P, ZHANG S, RUAN Z, et al. AP-1 signaling pathway promotes pro-IL-1β transcription to facilitate NLRP3 inflammasome activation upon influenza A virus infection. Virulence. 2022;13(1):502-513. [14] LATZ E, XIAO TS, STUTZ A. Activation and regulation of the inflammasomes. Nat Rev Immunol. 2013;13(6):397-411. [15] NOURI BARKESTANI M, NASERIAN S, KHODDAM F, et al. Optimization of IL-1RA structure to achieve a smaller protein with a higher affinity to its receptor. Sci Rep. 2022;12(1):7483. [16] ZAREZADEH MEHRABADI A, AGHAMOHAMADI N, KHOSHMIRSAFA M, et al. The roles of interleukin-1 receptor accessory protein in certain inflammatory conditions. Immunology. 2022;166(1):38-46. [17] JEFFERIES C, BOWIE A, BRADY G, et al. Transactivation by the p65 subunit of NF-kappaB in response to interleukin-1 (IL-1) involves MyD88, IL-1 receptor-associated kinase 1, TRAF-6, and Rac1. Mol Cell Biol. 2001;21(14):4544-4552. [18] TIAN S, LI YL, WANG J, et al. Chinese Ecliptae herba (Eclipta prostrata (L.) L.) extract and its component wedelolactone enhances osteoblastogenesis of bone marrow mesenchymal stem cells via targeting METTL3-mediated m6A RNA methylation. J Ethnopharmacol. 2023;312:116433. [19] TSENG WC, LEE PY, TSAI MT, et al. Hypoxic mesenchymal stem cells ameliorate acute kidney ischemia-reperfusion injury via enhancing renal tubular autophagy. Stem Cell Res Ther. 2021;12(1):367. [20] ZHANG S, XIE Y, YAN F, et al. Negative pressure wound therapy improves bone regeneration by promoting osteogenic differentiation via the AMPK-ULK1-autophagy axis. Autophagy. 2022;18(9):2229-2245. [21] FAN H, ZHAO G, LIU L, et al. Pre-treatment with IL-1β enhances the efficacy of MSC transplantation in DSS-induced colitis. Cell Mol Immunol. 2012;9(6):473-481. [22] CARRERO R, CERRADA I, LLEDÓ E, et al. IL1β induces mesenchymal stem cells migration and leucocyte chemotaxis through NF-κB. Stem Cell Rev Rep. 2012;8(3): 905-916. [23] LIN CY, ZU CH, YANG CC, et al. IL-1β-induced mesenchymal stem cell migration involves MLCK activation via PKC signaling. Cell Transplant. 2015;24(10):2011-2028. [24] GUO YC, CHIU YH, CHEN CP, et al. Interleukin-1β induces CXCR3-mediated chemotaxis to promote umbilical cord mesenchymal stem cell transendothelial migration. Stem Cell Res Ther. 2018;9(1):281. [25] CHANG CH, LIN YL, TYAN YS, et al. Interleukin-1β-induced matrix metalloproteinase-3 via ERK1/2 pathway to promote mesenchymal stem cell migration. PLoS One. 2021;16(5):e0252163. [26] LUO Y, WANG Y, POYNTER JA, et al. Pretreating mesenchymal stem cells with interleukin-1β and transforming growth factor-β synergistically increases vascular endothelial growth factor production and improves mesenchymal stem cell-mediated myocardial protection after acute ischemia. Surgery. 2012;151(3):353-363. [27] REDONDO-CASTRO E, CUNNINGHAM C, MILLER J, et al. Interleukin-1 primes human mesenchymal stem cells towards an anti-inflammatory and pro-trophic phenotype in vitro. Stem Cell Res Ther. 2017;8(1):79. [28] XIE F, TENG L, LU J, et al. Interleukin-10-modified adipose-derived mesenchymal stem cells prevent hypertrophic scar formation via regulating the biological characteristics of fibroblasts and inflammation. Mediators Inflamm. 2022;2022:6368311. [29] LI Y, LU L, XIE Y, et al. Interleukin-6 knockout inhibits senescence of bone mesenchymal stem cells in high-fat diet-induced bone loss. Front Endocrinol (Lausanne). 2021;11:622950. [30] MAYNARD SA, PCHELINTSEVA E, ZWI-DANTSIS L, et al. IL-1β mediated nanoscale surface clustering of integrin α5β1 regulates the adhesion of mesenchymal stem cells. Sci Rep. 2021;11(1):6890. [31] SULLIVAN CB, PORTER RM, EVANS CH, et al. TNFα and IL-1β influence the differentiation and migration of murine MSCs independently of the NF-κB pathway. Stem Cell Res Ther. 2014;5(4):104. [32] GUO J, ZHANG H, XIA J, et al. Interleukin-1β induces intercellular adhesion molecule-1 expression, thus enhancing the adhesion between mesenchymal stem cells and endothelial progenitor cells via the p38 MAPK signaling pathway. Int J Mol Med. 2018;41(4):1976-1982. [33] SADRI F, REZAEI Z, FEREIDOUNI M. The significance of the SDF-1/CXCR4 signaling pathway in the normal development. Mol Biol Rep. 2022;49(4):3307-3320. [34] WANG R, WEI W, RONG S, et al. Intravenous injection of SDF-1α-overexpressing bone marrow mesenchymal stem cells has a potential protective effect on myocardial ischemia in mice. Curr Stem Cell Res Ther. 2022;17(4):348-360. [35] CAPECE D, VERZELLA D, FLATI I, et al. NF-κB: blending metabolism, immunity, and inflammation. Trends Immunol. 2022;43(9):757-775. [36] BRIKOS C, WAIT R, BEGUM S, et al. Mass spectrometric analysis of the endogenous type I interleukin-1 (IL-1) receptor signaling complex formed after IL-1 binding identifies IL-1RAcP, MyD88, and IRAK-4 as the stable components. Mol Cell Proteomics. 2007;6(9):1551-1559. [37] WESCHE H, KORHERR C, KRACHT M, et al. The interleukin-1 receptor accessory protein (IL-1RAcP) is essential for IL-1-induced activation of interleukin-1 receptor-associated kinase (IRAK) and stress-activated protein kinases (SAP kinases). J Biol Chem. 1997;272(12):7727-7731. [38] DIEP S, MADDUKURI M, YAMAUCHI S, et al. Interleukin-1 and nuclear factor kappa B signaling promote breast cancer progression and treatment resistance. Cells. 2022;11(10):1673. [39] BARNABEI L, LAPLANTINE E, MBONGO W, et al. NF-κB: at the borders of autoimmunity and inflammation. Front Immunol. 2021;12:716469. [40] TSENG HC, LEE IT, LIN CC, et al. IL-1β promotes corneal epithelial cell migration by increasing MMP-9 expression through NF-κB- and AP-1-dependent pathways. PLoS One. 2013;8(3):e57955. [41] YU JS, HUANG T, ZHANG Y, et al. Substrate-specific recognition of IKKs mediated by USP16 facilitates autoimmune inflammation. Sci Adv. 2021;7(3):eabc4009. [42] LANG V, SYMONS A, WATTON SJ, et al. ABIN-2 forms a ternary complex with TPL-2 and NF-kappa B1 p105 and is essential for TPL-2 protein stability. Mol Cell Biol. 2004;24(12):5235-5248. [43] GANTKE T, SRISKANTHARAJAH S, LEY SC. Regulation and function of TPL-2, an IκB kinase-regulated MAP kinase kinase kinase. Cell Res. 2011;21(1):131-145. [44] SENGER K, PHAM VC, VARFOLOMEEV E, et al. The kinase TPL2 activates ERK and p38 signaling to promote neutrophilic inflammation. Sci Signal. 2017;10(475):eaah4273. [45] WON KJ, PARK JS, JEONG HY. Repression of hepatocyte nuclear factor 4 alpha by AP-1 underlies dyslipidemia associated with retinoic acid. J Lipid Res. 2019;60(4): 794-804. [46] BENBOW U, BRINCKERHOFF CE. The AP-1 site and MMP gene regulation: what is all the fuss about? Matrix Biol. 1997;15(8-9):519-526. [47] NISSINEN L, KÄHÄRI VM. Matrix metalloproteinases in inflammation. Biochim Biophys Acta. 2014;1840(8):2571-2580. [48] HUGHES CE, NIBBS RJB. A guide to chemokines and their receptors. FEBS J. 2018; 285(16):2944-2971. [49] MAO CY, WANG YG, ZHANG X, et al. Double-edged-sword effect of IL-1β on the osteogenesis of periodontal ligament stem cells via crosstalk between the NF-κB, MAPK and BMP/Smad signaling pathways. Cell Death Dis. 2016;7(7):e2296. [50] KAMMERER T, FAIHS V, HULDE N, et al. Hypoxic-inflammatory responses under acute hypoxia: In Vitro experiments and prospective observational expedition trial. Int J Mol Sci. 2020;21(3):1034. [51] DUHEN T, CAMPBELL DJ. IL-1β promotes the differentiation of polyfunctional human CCR6+CXCR3+ Th1/17 cells that are specific for pathogenic and commensal microbes. J Immunol. 2014;193(1):120-129. [52] CANNON A, THOMPSON CM, BHATIA R, et al. Contribution of CXCR3-mediated signaling in the metastatic cascade of solid malignancies. Biochim Biophys Acta Rev Cancer. 2021;1876(2):188628. [53] GARCÍA-HERNÁNDEZ L, GARCÍA-ORTEGA MB, RUIZ-ALCALÁ G, et al. The p38 MAPK components and modulators as biomarkers and molecular targets in cancer. Int J Mol Sci. 2021;23(1):370. [54] YUAN L, BU S, DU M, et al. RNF207 exacerbates pathological cardiac hypertrophy via post-translational modification of TAB1. Cardiovasc Res. 2023;119(1):183-194. [55] RAINGEAUD J, WHITMARSH AJ, BARRETT T, et al. MKK3- and MKK6-regulated gene expression is mediated by the p38 mitogen-activated protein kinase signal transduction pathway. Mol Cell Biol. 1996;16(3):1247-1255. [56] CUADRADO A, NEBREDA AR. Mechanisms and functions of p38 MAPK signalling. Biochem J. 2010;429(3):403-417. [57] KIM E, AHUJA A, KIM MY, et al. DNA or protein methylation-dependent regulation of activator protein-1 function. Cells. 2021;10(2):461. [58] ZHONG L, SIMONEAU B, HUOT J, et al. p38 and JNK pathways control E-selectin-dependent extravasation of colon cancer cells by modulating miR-31 transcription. Oncotarget. 2017;8(1):1678-1687. [59] 张玉娟,原一桐,杜若琛,等. miR-31促进骨髓MSCs的增殖和迁移[J].中国组织工程研究,2023,27(1):66-71. [60] HONG JM, LEE JW, SEEN DS, et al. LPA1-mediated inhibition of CXCR4 attenuates CXCL12-induced signaling and cell migration. Cell Commun Signal. 2023;21(1):257. [61] WANG CC, LU JW, CHIANG KH, et al. Anti-inflammatory and chondro-protective effects of acidic polysaccharide from enteromorpha prolifera in experimental models of osteoarthritis in-vitro and in-vivo. Cartilage. 2022;13(4):157-170. [62] KIM E, AHUJA A, KIM MY, et al. DNA or protein methylation-dependent regulation of activator protein-1 function. cells. 2021;10(2):461. [63] WANG C, XU M, FAN Q, et al. Therapeutic potential of exosome-based personalized delivery platform in chronic inflammatory diseases. Asian J Pharm Sci. 2023;18(1):100772. [64] LIU W, SUN Y, HE Y, et al. IL-1β impedes the chondrogenic differentiation of synovial fluid mesenchymal stem cells in the human temporomandibular joint. Int J Mol Med. 2017;39(2):317-326. [65] DING J, GHALI O, LENCEL P, et al. TNF-alpha and IL-1beta inhibit RUNX2 and collagen expression but increase alkaline phosphatase activity and mineralization in human mesenchymal stem cells. Life Sci. 2009;84(15-16):499-504. |
| [1] | Chen Kaijia, Liu Jingyun, Cao Ning, Sun Jianbo, Zhou Yan, Mei Jianguo, Ren Qiang. Application and prospect of tissue engineering in treatment of osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1450-1456. |
| [2] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [3] | Wei Juan, Li Ting, Huan Mengting, Xie Ying, Xie Zhouyu, Wei Qingbo, Wu Yunchuan. Mechanism by which static exercise improves insulin resistance in skeletal muscle of type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1271-1276. |
| [4] | Wang Weiqing, Zhou Yue. Chronic inflammation regulates adipose tissue fibrosis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1307-1312. |
| [5] | Huang Haoran, Fan Yinuo, Wei-Yang Wenxiang, Jiang Mengyu, Fang Hanjun, Wang Haibin, Chen Zhenqiu, Liu Yuhao, Zhou Chi. Urolithin A mediates p38/MAPK pathway to inhibit osteoclast activity [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1149-1154. |
| [6] | Cheng Jie, Wang Jihong, Zhang Pei. Functional exercise for tendon adhesion in a model of deep flexor tendon II injury of the third toe [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1161-1167. |
| [7] | Yue Yun, Wang Peipei, Yuan Zhaohe, He Shengcun, Jia Xusheng, Liu Qian, Li Zhantao, Fu Huiling, Song Fei, Jia Menghui. Effects of croton cream on JNK/p38 MAPK signaling pathway and neuronal apoptosis in cerebral ischemia-reperfusion injury rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1186-1192. |
| [8] | Wang Ji, Zhang Min, Li Wenbo, Yang Zhongya, Zhang Long. Effect of aerobic exercise on glycolipid metabolism, skeletal muscle inflammation and autophagy in type 2 diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1200-1205. |
| [9] | Liu Xin, Hu Man, Zhao Wenjie, Zhang Yu, Meng Bo, Yang Sheng, Peng Qing, Zhang Liang, Wang Jingcheng. Cadmium promotes senescence of annulus fibrosus cells via activation of PI3K/Akt signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1217-1222. |
| [10] | Zuo Xinwei, Liu Gang, Bai Huizhong, Xu Lin, Zhao Yi, Ren Jingpei, Hu Chuanyu, Mu Xiaohong. Relationship between lumbar spine development and hip development in children with spastic cerebral palsy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1247-1252. |
| [11] | Mu Bingtao, Yu Jingwen, Liu Chunyun, Guo Minfang, Meng Tao, Yang Pengwei, Wei Wenyue, Song Lijuan, Yu Jiezhong, Ma Cungen. Immunomodulatory effect of astragaloside IV on T cells of experimental autoimmune encephalomyelitis mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1057-1062. |
| [12] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [13] | Ma Shuwei, He Sheng, Han Bing, Zhang Liaoyun. Exosomes derived from mesenchymal stem cells in treatment of animals with acute liver failure: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1137-1142. |
| [14] | Feng Ruiqin, Han Na, Zhang Meng, Gu Xinyi, Zhang Fengshi. Combination of 1% platelet-rich plasma and bone marrow mesenchymal stem cells improves the recovery of peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 985-992. |
| [15] | Qiu Xiaoyan, Li Bixin, Li Jingdi, Fan Chuiqin, Ma Lian, Wang Hongwu. Differentiation of insulin-producing cells from human umbilical cord mesenchymal stem cells infected by MAFA-PDX1 overexpressed lentivirus [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1000-1006. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||