Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (35): 7578-7588.doi: 10.12307/2026.526
Previous Articles Next Articles
Exercise prevention and treatment of insulin resistance: role and molecular mechanism of Keap1/nuclear factor erythroid2-related factor 2 signaling pathway
Liu Xuan1, Ding Yuqing1, Xia Ruohan2, Wang Xianwang2, Hu Shujuan1
- 1School of Education and Physical Education, 2Department of Medicine, Yangtze University, Jingzhou 423000, Hubei Province, China
-
Received:2024-12-23Accepted:2025-02-20Online:2025-12-18Published:2025-05-06 -
Contact:Hu Shujuan, PhD, Associate professor, School of Education and Physical Education, Yangtze University, Jingzhou 423000, Hubei Province, China -
About author:Liu Xuan, Master, School of Education and Physical Education, Yangtze University, Jingzhou 423000, Hubei Province, China Ding Yuqing, Master, School of Education and Physical Education, Yangtze University, Jingzhou 423000, Hubei Province, China Liu Xuan and Ding Yuqing contributed equally to this work. -
Supported by:National Natural Science Foundation of China, No. 81974115 (to XRH); Shannan Municipal Science and Technology Plan Project, No. SNSBJKJJHXM2024023 (to WXW); Hubei Natural Science Foundation (General Program), No. JCZRYB202501311 (to HSJ); Yangtze University College Students Innovation and Entrepreneurship Training Program, No. Yz2023165 (to HSJ)
CLC Number:
Cite this article
Liu Xuan, Ding Yuqing, Xia Ruohan, Wang Xianwang, Hu Shujuan. Exercise prevention and treatment of insulin resistance: role and molecular mechanism of Keap1/nuclear factor erythroid2-related factor 2 signaling pathway[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7578-7588.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

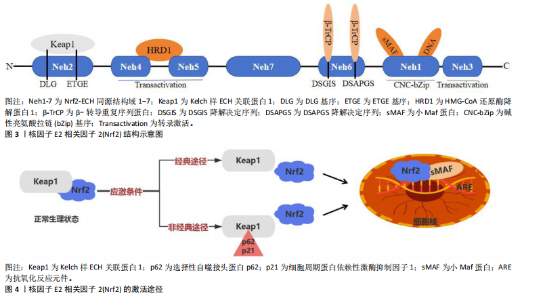
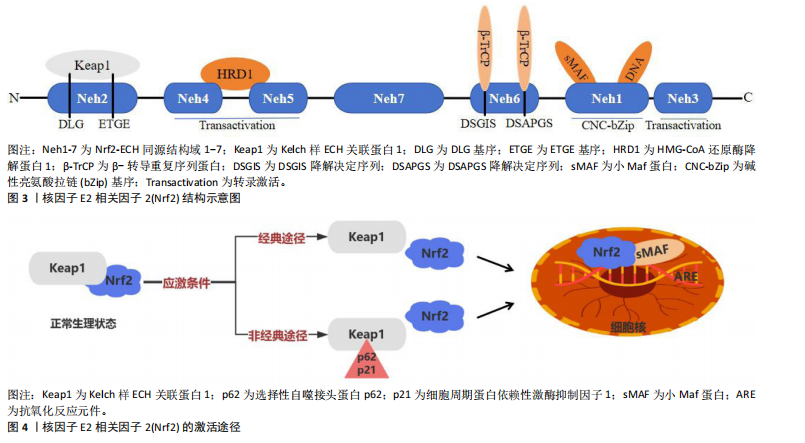
2.1 Nrf2的结构及激活 2.1.1 Nrf2的结构 Nrf2最初在1994年由MOI等[6]发现,在调控代谢平衡和氧化还原反应中发挥重要作用,有助于维持心血管疾病和慢性代谢性疾病的细胞稳态[14-15]。Nrf2由7个Nrf2-ECH同源结构域所构成,分别命名为Nrf2-ECH同源结构域1至Nrf2-ECH同源结构域7 [16],见图3。其中,Nrf2-ECH同源结构域1含有碱性亮氨酸拉链(bZip)基序,其中碱性区域负责与DNA结合,而亮氨酸拉链区域则用于与其他蛋白相互作用,特别是与小Maf蛋白形成异源二聚体,以实现对DNA的识别和结合。Nrf2-ECH同源结构域2是Nrf2蛋白中的关键区域,内含ETGE和DLG两个重要的基序,这些基序对于Nrf2与Keap1蛋白之间的相互作用至关重要。Nrf2-ECH同源结构域3/4/5共同构成了Nrf2的转录激活区域,其中Nrf2-ECH同源结构域4/5还与3-羟基-3-甲基古咽辅酶A还原酶降解蛋白1相互作用,后者参与调控Nrf2的蛋白稳定性。Nrf2-ECH同源结构域6含有2个β-转导重复序列蛋白识别的降解决定序列(DSGIS降解决定序列和DSAPGS降解决定序列),这些序列是Nrf2通过β-转导重复序列依赖的蛋白酶体途径进行降解的关键位点[17]。 2.1.2 Nrf2的激活 Nrf2的激活途径见图4。 经典激活机制:Keap1是Nrf2的细胞质抑制因子[18],能够与库林蛋白3以及环框蛋白1结合成为功能性E3泛素连接酶复合物,进而促使Nrf2降解,使Nrf2保持在较低水平[19]。在氧化应激等激活信号的作用下,Keap1蛋白中特定的半胱氨酸残基被修饰,导致E3泛素连接酶复合物结构发生变化,从而阻断了Nrf2正常的泛素化和降解过程[17],导致Nrf2在细胞核内积累,与小Maf蛋白形成异二聚体并结合到抗氧化反应元件上,促进抗氧化相关基因的转录,增强细胞的抗氧化能力[20]。 非经典激活途径:Nrf2的非经典激活途径也被称为自噬-溶酶体途径,是由自噬功能障碍所驱动的。自噬是细胞清除机体受损细胞器和蛋白质的重要机制,而自噬功能障碍可能导致选择性自噬接头蛋白p62和细胞周期蛋白依赖性激酶抑制因子1等蛋白累积,这些蛋白能够和Keap1相互作用,阻断Nrf2的泛素化和降解过程[21-22]。 当p62累积过多时会引起Keap1等许多结合蛋白的隔离和功能丧失,从而降低Keap1对Nrf2的抑制作用[23]。研究表明,p62可以促进Keap1与自噬体的关联,进而阻止Keap1介导的Nrf2降解,激活Nrf2信号通路[24-25],见图4。 2.2 Nrf2和胰岛素抵抗 胰岛素抵抗是目前公认的多种代谢性疾病(如2型糖尿病、非酒精性脂肪肝病、动脉粥样硬化等)的共同发病基础[26]。Keap1/Nrf2信号通路作为近年被广泛认可的关键内源性抗氧化应激途径,在胰岛素抵抗的防治过程中扮演重要角色[27],上调Nrf2蛋白表达可以恢复机体的氧化还原状态,进而防治以炎症和氧化应激为主要特征的慢性疾病[14]。在胰岛素抵抗的病理状态下,Nrf2的表达水平降低,导致机体对胰岛素抵抗的反应受损[28];而增强Nrf2的蛋白表达,可以缓解氧化应激损伤并减少促炎细胞因子的生成,从而有助于改善胰岛素敏感性、促使糖脂代谢恢复,缓解胰岛素抵抗[29]。另外,Nrf2在脂质和葡萄糖代谢中扮演重要角色,Nrf2活化有助于提升运动训练对葡萄糖稳态的改善效果[30]。相反,长期缺乏Nrf2会减弱由运动引起抗氧化基因增加,加剧由代谢应激引起的胰岛素抵抗[30]。这些发现强调了Nrf2信号通路在胰岛素抵抗中的关键作用,主要是通过增强细胞的抗氧化能力、抑制氧化应激和炎症反应、改善胰岛素信号传导等途径对胰岛素抵抗起到保护作用。由此可见,调节Nrf2活性的机制对于胰岛素抵抗具有重要的生理和治疗意义。因此,通过运动训练等方式增强Nrf2信号通路的活性可能成为改善胰岛素抵抗和促进葡萄糖稳态的新策略。 Nrf2和胰岛素抵抗研究的时间脉络见表1。此时间脉络表展示了Nrf2和胰岛素抵抗的研究进展。从早期发现的Nrf2、氧化应激以及胰岛素抵抗三者之间的联系,到后来对Nrf2在氧化应激和胰岛素抵抗中的作用进行深入研究,逐步证实了Nrf2能够缓解氧化应激并改善胰岛素抵抗的关键作用。这些发现为理解Nrf2在胰岛素抵抗中的作用提供了重要的科学依据,并为未来防治胰岛素抵抗提供了潜在的靶点。"

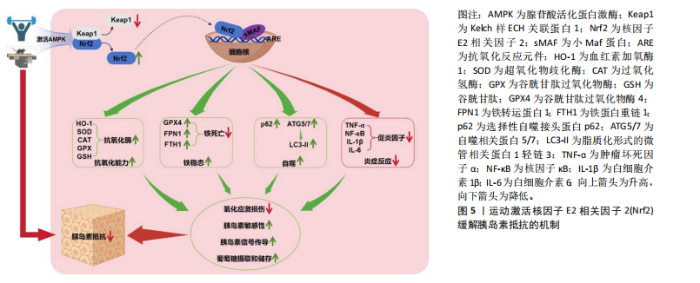
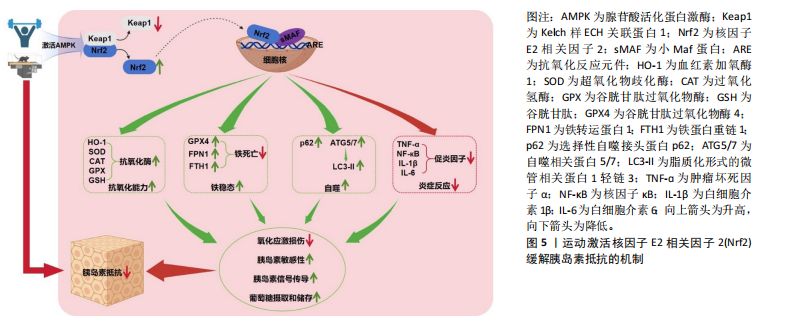
2.3 运动与Nrf2 2.3.1 运动激活Nrf2的机制 运动可以适度增加体内活性氧的产生,这种适度的氧化应激被视作一种生理性信号,可以激发细胞内的抗氧化应激反应,特别是激活Keap1/Nrf2信号通路,这种激活有助于增强细胞的抗氧化能力。适量的活性氧通过修饰Keap1中的半胱氨酸残基,导致E3泛素连接酶复合物结构发生变化,阻断Nrf2的泛素化过程并易位至细胞核,随后与小Maf蛋白形成异二聚体结合在抗氧化反应元件上,诱导一系列细胞保护性基因的表达[17]。除了直接对Keap1修饰外,运动还可激活腺苷酸活化蛋白激酶,来实现对Nrf2的激活[38]。腺苷酸活化蛋白激酶作为Nrf2的上游调节因子,活化后可以增强Nrf2的蛋白表达,进一步诱导血红素加氧酶1等抗氧化酶的表达[39],这种调节作用增强了细胞的抗氧化和抗炎能力,对于维持细胞的健康状态和预防慢性疾病具有重要意义。运动激活Nrf2的机制见图5。 2.3.2 不同运动方式对Nrf2的影响 有氧运动:具有持续、低强度的特点,被认为对人体有多方面的积极影响。有氧运动已被证实能够激活Nrf2信号通路,提高抗氧化酶活性,增强细胞抗氧化能力,同时有效减少细胞凋亡,缓解氧化应激损伤[40-41]。糖尿病动物模型研究发现,进行有氧运动(游泳或跑台)干预能够有效降低血糖水平,并防止糖尿病小鼠病症恶化,主要体现在8-12周的有氧运动明显提高Nrf2蛋白表达,增加下游因子血红素加氧酶1和超氧化物歧化酶水平,进而增强细胞的抗氧化能力,改善血糖代谢[42-43]。另外,游泳运动干预通过调控Nrf2-血红素加氧酶1通路活性可有效抑制细胞凋亡和炎症反应[44]。在对心肌细胞和肝功能的研究的过程中发现,不同形式的有氧运动均能有效激活小鼠Nrf2的活性,促进血红素加氧酶1和超氧化物歧化酶蛋白表达,进而降低氧化应激、细胞凋亡和炎症,表明有氧运动对于增强心肌抗氧化能力、逆转肝功能障碍具有积极作用[11,45]。更为深入的研究表明,有氧运动可以激活腺苷酸活化蛋白激酶信号介导的脂质代谢和炎症反应,增强Nrf2的蛋白表达,上调下游抗氧化酶水平,进而减少活性氧的过量生成,抑制氧化应激[46]。综上所述,有氧运动可以有效激活Nrf2信号通路,提高下游抗氧化酶的表达、缓解氧化应激损伤,为糖尿病、肥胖、肝功能障碍等疾病提供了新的治疗策略。 抗阻运动:作为一种有效的身体锻炼方式,抗阻运动对Nrf2的影响日益受到科研领域的关注。有研究表明,慢性肾病患者在进行为期3个月的抗阻运动后Nrf2表达显著上调,显著改善了慢性肾病患者的生活质量[47]。这一发现与Nrf2在维持细胞稳态中的关键作用相呼应,慢性肾病与炎症反应和氧化应激增加密切相关,而Nrf2信号通路对于抵抗炎症、氧化应激状态至关重要[14]。在糖尿病状态下,氧化应激损伤加剧,而阻力训练能够改变糖尿病大鼠Keap1/Nrf2信号通路中相关基因的表达水平,减轻氧化应激损伤。税晓平等[48]研究发现,糖尿病大鼠可能会出现氧化应激、糖代谢失调及胰岛素抵抗,而抗阻运动干预后能够激活Nrf2抗氧化应激信号通路并上调其下游蛋白血红素加氧酶1的表达,进而有效改善糖尿病大鼠糖代谢失调和胰岛素抵抗,减轻氧化应激。这一结果与Keap1/Nrf2信号通路的抗氧化应激作用及其调控机制的研究相一致,该信号通路能够调节机体1%-10%的基因,包括多种抗氧化应激功能的酶和蛋白质[49-50]。总之,抗阻运动通过增强Nrf2及其下游抗氧化酶的表达,在调节糖代谢紊乱和胰岛素抵抗方面具有重要作用。 高强度间歇运动:作为一种高效的运动方式,通过交替高强度运动和短暂休息能够有效提升个体的体能和健康指标。Nrf2信号通路是细胞内重要的抗氧化防御机制,能够调节多种抗氧化酶的基因表达,对于防治氧化应激相关疾病具有重要意义。王蒙等[51]通过动物实验发现,经4周高强度间歇运动干预后大鼠骨骼肌组织中Nrf2及抗氧化酶如超氧化物歧化酶、谷胱甘肽和过氧化氢酶的蛋白水平显著升高,这一发现表明高强度间歇运动能够激活Nrf2信号通路,对于增强机体的抗氧化能力、改善"
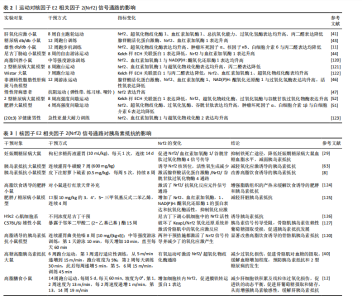
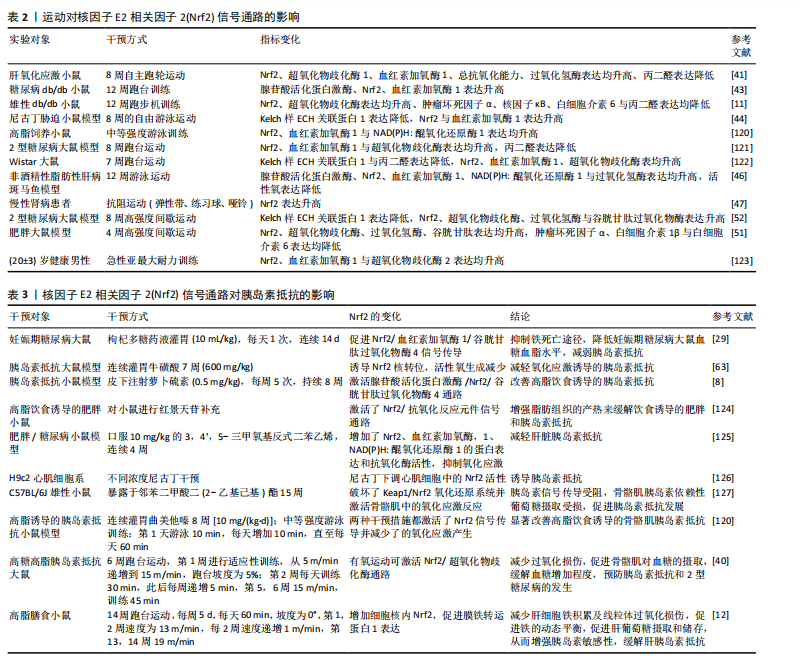
胰岛素抵抗具有积极影响。EBRAHIMNEZHAD等[52]研究进一步探讨了8周高强度间歇运动对2型糖尿病雄性大鼠海马区氧化应激和细胞凋亡的影响,发现高强度间歇运动能够激活过氧化物酶体增殖物激活受体γ辅激活子1α/ Keap1/Nrf2信号通路增加抗氧化酶的蛋白表达,减少了由2型糖尿病引起的海马区凋亡和氧化应激。郭新明等[53]研究发现,急性大强度运动显著降低了大鼠骨骼肌中Nrf2的蛋白表达并诱发了氧化应激损伤,这种效应可能是由于急性大强度运动引发骨骼肌内的氧自由基急剧增加,进而破坏了机体的氧化还原平衡,触发氧化应激反应。该研究结果表明,运动类型、强度及持续时间可能对Nrf2信号通路的激活具有不同影响,提示需要进一步探究不同运动模式对Nrf2信号通路的具体影响机制,深入分析运动参数与Nrf2信号通路之间的相互作用,明确其在调节机体抗氧化反应中的作用,为制定个性化的运动干预策略提供科学依据。 2.4 运动激活Nrf2缓解胰岛素抵抗的机制 在胰岛素抵抗预防和治疗过程中,一种公认且安全性较高的策略是改变生活方式。运动是简便经济、健康有效的生活干预方式之一,能够有效改善肥胖者机体的糖脂代谢紊乱,是防治胰岛素抵抗、2型糖尿病等代谢性相关疾病的有效手段[54-55]。Nrf2能够在运动的刺激下活化,增强细胞的抗氧化能力、抑制炎症反应,进而改善胰岛素信号传导并提高胰岛素敏感性,缓解胰岛素抵抗[56]。 2.4.1 运动激活Nrf2调控抗氧化酶基因表达缓解胰岛素抵抗 正常生理状态下,胰岛素或运动刺激会产生微量活性氧,通过氧化作用抑制蛋白酪氨酸磷酸酶1B的表达,能够增强胰岛素信号级联反应,从而提高机体对胰岛素的敏感性[57]。然而,长期高血糖或胰岛素抵抗状态能够使细胞内活性氧水平持续升高,当活性氧持续或过量生成时会导致氧化应激,进而对胰岛素信号传导通路中的多个元件产生负面影响,主要包括胰岛素受体底物、磷脂酰肌醇3-激酶、蛋白激酶B以及葡萄糖转运蛋白等,进而导致胰岛素抵抗[58-59];此外,氧化应激还可诱发细胞内的炎症反应,导致产生大量的活性氧化物质和促炎细胞因子,进一步干扰胰岛素信号传导,引发胰岛素抵抗[60]。Nrf2是细胞内主要的抗氧化转录因子,能够激活超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶等多种抗氧化酶基因的表达[61],清除过量的活性氧,对于维持细胞内氧化还原平衡具有积极作用[62],这种作用有助于保护胰岛素信号传导通路,提高胰岛素敏感性,进而缓解胰岛素抵抗。曾梦莹等[63]研究证实了通过促进Nrf2的激活能够有效减少活性氧的过量生成,进而减轻氧化应激引起的胰岛素抵抗。这些发现强调了Nrf2介导的抗氧化酶基因表达在胰岛素抵抗中的关键作用,当Nrf2激活后可上调抗氧化酶的基因表达,增强细胞的抗氧化能力、减轻氧化应激损伤、改善胰岛素信号传导,从而对胰岛素抵抗起到保护作用。 运动作为一种有效的生理刺激已被广泛研究证实能够激活Nrf2信号通路,进而调控抗氧化酶基因的表达,缓解氧化应激和胰岛素抵抗。正常生理状态下,Nrf2被其抑制因子Keap1所降解保持在较低的活性水平,而在运动的刺激下,Keap1对Nrf2的抑制作用被消除,Nrf2转位入核,增强其下游超氧化物歧化酶、谷胱甘肽过氧化物酶和血红素加氧酶1等抗氧化酶的活性,进而抑制活性氧的过度生成,减轻由氧化应激所引起的胰岛素抵抗[64]。EBRAHIMNEZHAD等[52]研究表明,8周高强度间歇训练通过增加过氧化物酶体增殖物激活受体γ辅激活子1α水平抑制Keap1蛋白表达,进而导致Nrf2通路激活,提高了超氧化物歧化酶、过氧化氢酶及谷胱甘肽过氧化物酶等抗氧化酶的水平,抵抗氧化应激。刘玉倩等[40]通过动物模型实验揭示了有氧运动对Nrf2/超氧化物歧化酶通路的积极影响,具体来说,有氧运动能够激活Nrf2/超氧化物歧化酶通路,减少因高脂高糖引起的氧化应激损伤。血红素加氧酶1是抗氧化系统中的关键酶,在血红素的代谢过程中发挥重要作用,能够将血红素分解转化为胆绿素、一氧化碳和铁,这些产物在机体抗氧化反应中扮演着重要角色;此外,血红素加氧酶1还能产生具有抗氧化和抗炎特性的代谢产物,对于维持细胞内环境的稳定和保护细胞免受氧化应激损伤具有重要作用[65]。研究表明,血红素加氧酶1过表达能够减少活性氧的生成,提高超氧化物歧化酶和谷胱甘肽的蛋白表达,对抗氧化应激损伤[66]。长期的有氧运动可以激活Nrf2信号通路,促进血红素加氧酶1等抗氧化酶的表达,增强细胞抗氧化系统的功能[67-68],从而在胰岛素抵抗的防治过程中发挥重要作用。 综上所述,活性氧过量生成所诱发的氧化应激在胰岛素抵抗发生发展过程中起重要作用,运动作为一种有效的生理刺激能够激活Nrf2信号通路,调控血红素加氧酶1、超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶、谷胱甘肽等抗氧化酶的基因表达,增强细胞的抗氧化能力、减少氧化应激、保护胰岛素信号传导通路,从而在胰岛素抵抗状态下发挥关键的保护作用。 2.4.2 运动激活Nrf2调控铁代谢缓解胰岛素抵抗 维持铁的代谢平衡对于维持机体的正常生理功能至关重要。铁超载会导致肝、胰腺细胞发生铁死亡,引发氧化应激损伤,从而在胰岛素抵抗的发生发展过程中发挥关键的调控作用[69-70];此外,铁积累会导致氧化应激和局部炎症增加,损害胰岛素信号传导并扰乱葡萄糖代谢[71]。一项对多囊卵巢综合征合并妊娠期糖尿病患者的研究发现,铁沉积会加剧机体氧化应激损伤,加重炎症反应,从而加重胰岛素抵抗[72]。随着对铁代谢调控机制的深入研究,Nrf2已经被确认是调控铁信号的关键转录因子。在铁死亡途径中,大多数级联或相互作用的酶和蛋白质,包括血红素加氧酶1、谷胱甘肽过氧化物酶4和膜铁转运蛋白1等均受到Nrf2的转录调节。Nrf2基因失活时细胞铁死亡增加,相反Nrf2基因活化时则能减少铁死亡[73]。早期研究表明,激活Keap1/Nrf2/血红素加氧酶1信号传导路径能够抑制脂多糖诱导的炎症反应和铁死亡[74],这一发现揭示了Nrf2可能在调控铁死亡过程中发挥负向调节作用。近期研究揭示,增强Nrf2/血红素加氧酶1/谷胱甘肽过氧化物酶4信号通路的蛋白表达对于减轻炎症和氧化应激具有重要作用,同时能够抑制铁死亡过程、提高胰岛素敏感性,从而对胰岛素抵抗产生缓解作用[29]。膜铁转运蛋白1主要负责将细胞内储存的铁释放进入血液,以维持细胞正常的糖脂代谢和铁稳态,是哺乳类动物细胞膜上主要的铁释放通路[75]。张知宜等[76]在观察活血地龟汤对糖尿病肾病小鼠细胞铁积累及铁死亡的影响中发现,活血地龟汤可能通过Nrf2调节膜铁转运蛋白1的表达,促进细胞内铁离子外运,进而抑制铁死亡。运动作为一种经济安全的非药物干预手段能够有效激活Nrf2信号通路,调控血红素加氧酶1、谷胱甘肽过氧化物酶4及膜铁转运蛋白1等蛋白活性,进而抑制铁死亡途径,缓解氧化应激和炎症反应,改善胰岛素抵抗。研究表明,有氧运动能够增强心肌细胞质中Nrf2转位入核,促使铁蛋白重链1储存部分铁,降低心肌中游离铁含量,抑制心肌细胞发生铁死亡[64]。动物模型研究发现,14周高脂饲料喂养后小鼠出现了严重的胰岛素抵抗和糖脂代谢紊乱,同时铁含量明显增加,而14周的跑台运动干预能够促进Nrf2从Keap1的抑制中解离并增加细胞核内Nrf2含量,这种变化促进了膜铁转运蛋白1表达,从而减少肝细胞铁累积,促进铁代谢平衡,增强胰岛素敏感性,缓解胰岛素抵抗[12]。 总的来说,铁超载会诱发铁死亡,进而导致氧化应激损伤和炎症反应,干扰胰岛素信号传导,加剧胰岛素抵抗。Nrf2作为细胞铁死亡的重要负调节因子能够在运动的刺激下激活,调控铁死亡途径中级联或相互作用的酶和蛋白质,对于抑制铁死亡途径并促进铁代谢平衡具有重要作用,从而进一步缓解胰岛素抵抗。 2.4.3 运动激活Nrf2调控自噬缓解胰岛素抵抗 自噬是细胞内一种重要的降解和循环利用自身组分的过程,对于维持胰岛素敏感性具有至关重要的作用[77]。研究表明,自噬功能的失调与胰岛素抵抗的发生密切相关,自噬活性降低会加剧胰岛素抵抗,而增加自噬有助于恢复受损的胰岛素信号,维持胰岛素敏感性和葡萄糖代谢,缓解胰岛素抵抗[78]。自噬功能减弱会导致胰岛素信号传导通路中的核心分子,包括胰岛素受体底物和蛋白激酶B等,无法有效清除受损的细胞器和蛋白质,导致有害物质在细胞内积累,进而干扰胰岛素信号的正常传导[79]。 在调控自噬的过程中Nrf2扮演着核心角色[80]。Nrf2的非经典激活途径涉及p62依赖性激活,一方面,p62可以直接与Keap1结合,释放Nrf2入核,导致Nrf2激活;另一方面,而Nrf2也可以诱导p62、自噬相关蛋白5/7等自噬基因的表达,进而增强自噬[81]。在氧化应激条件下,Nrf2活化后能够驱动自噬相关基因的表达,特别是p62的上调[81]。在对阿尔茨海默病双转基因APP/PS1小鼠的研究中发现,脑内p62水平升高增强了p62驱动的自噬活动,这有助于清除异常积累的蛋白,并可能对改善认知功能产生积极影响[82]。而Nrf2缺乏的阿尔茨海默病模型小鼠炎症反应显著增加,自噬功能障碍增强[83]。脂质化形式的微管相关蛋白1轻链3是自噬体的关键结构蛋白,通过脂质化修饰后锚定在自噬体膜上,其表达水平和自噬体数量呈正比,是自噬活性评估中的关键生物标志物[84]。自噬相关蛋白5/7是自噬体形成过程中的关键蛋白,不仅参与自噬体的形成和延伸,还与微管相关蛋白1轻链3的脂质化过程密切相关,从而在自噬过程中发挥至关重要的作用[85]。TANG等[86]研究发现,Nrf2缺乏会促使自噬相关蛋白5/7等自噬相关基因的表达降低。在Nrf2激活剂的相关研究中,观察到特定的Nrf2激活剂(如RS9)可以促进p62和脂质化形式的微管相关蛋白1轻链3的表达[87],仓术素能够下调Keap1活性、促进Nrf2激活入核,上调下游蛋白血红素加氧酶1和NAD(P)H:醌氧化还原酶1的表达,进而诱导自噬抑制肺癌细胞的生长[88]。这些发现揭示了激活Nrf2信号通路对于增强自噬,进而缓解胰岛素抵抗的重要作用。 运动作为一种消耗能量的关键手段,被认为是激活自噬的主要方式[89];此外,运动在疾病防治中的积极作用与它对自噬的调节密不可分[90]。运动能够直接增强自噬,在胰岛素抵抗的防治过程中发挥重要作用。CHENG等[91]通过动物实验发现,8周中等强度的有氧运动能够增强高脂饮食小鼠腺苷酸活化蛋白激酶/过氧化物酶体增殖物激活受体γ辅激活子1α信号传导,逆转骨骼肌中自噬标志物脂质化形式的微管相关蛋白1轻链3水平的降低,促进自噬,从而提高胰岛素敏感性,缓解胰岛素抵抗。最新的研究也证明了经过8周高强度训练干预后,2型糖尿病大鼠自噬相关蛋白7和脂质化形式的微管相关蛋白1轻链3水平升高,自噬增强,从而改善胰岛素抵抗并降低血糖[92]。运动可能通过调控腺苷酸活化蛋白激酶/Nrf2信号通路来促进自噬,缓解胰岛素抵抗。当Nrf2表达水平处于较低状态时,自噬相关蛋白5/7等自噬相关基因的表达也随之减少;相反,激活Nrf2信号通路后,自噬相关基因的表达显著上调,自噬增强[93]。而运动作为一种有效的生理刺激能够激活Nrf2信号通路,从而发挥增强自噬的作用[94]。贾绍辉等[95]发现长期运动能够提高抗氧化因子Nrf2的表达,增强心肌细胞自噬的激活,进而加强心肌的保护功能。这些研究结果提示,Nrf2可能在运动诱导的自噬激活及其对胰岛素抵抗改善的过程中发挥重要作用。 2.4.4 运动激活Nrf2调控炎症反应缓解胰岛素抵抗 炎症被认为是肥胖和胰岛素抵抗等代谢性疾病的核心病理特征[96]。当炎症细胞因子过量时会导致胰岛素抵抗,而降低炎症细胞因子活性、抑制炎症反应,则会改善胰岛素抵抗[97]。有研究显示,肿瘤坏死因子α和白细胞介素6等促炎细胞因子在胰岛素抵抗动物模型中高表达[98],而降低肿瘤坏死因子α和白细胞介素6的蛋白表达后胰岛素敏感性提高[99]。胰岛素抵抗与肿瘤坏死因子α诱导的核因子κB激活密切相关[100]。肿瘤坏死因子α是炎症反应的核心递质[101],能够激活核因子κB信号通路诱导炎症反应,从而下调葡萄糖转运蛋白4的基因表达,抑制胰岛素受体底物1的酪氨酸磷酸化,导致胰岛素抵抗的发生[102-103]。另外,白细胞介素1β通过核因子κB途径参与胰岛素抵抗,在高血糖生理状态下白细胞介素1β水平升高,白细胞介素1β升高已被证明可以增加2型糖尿病的风险[104]。白细胞介素1β会损害外周组织中的胰岛素信号传导、降低β细胞中胰岛素的敏感性和分泌,进而引发胰岛素抵抗[105]。白细胞介素6是慢性炎症标志物之一,在调节新陈代谢和免疫方面发挥关键作用,与胰岛素抵抗的发展呈正相关[106]。白细胞介素6能够抑制激活细胞因子转导信号抑制因子3蛋白来抑制酪氨酸激酶活性,阻断胰岛素转录因子的激活,导致胰岛素抵抗[107]。相反,通过降低血清肿瘤坏死因子α、白细胞介素6和核因子κB等炎症因子的释放,能够抑制炎症反应,进而改善胰岛素抵抗[108]。Nrf2是一个关键的转录因子,能够调控抗氧化基因的表达并抑制促炎细胞因子的转录,从而在炎症反应中发挥关键作用[109]。运动诱导的Nrf2激活后引发血红素加氧酶1蛋白水平上升,并伴随细胞内肿瘤坏死因子α、白细胞介素1β、白细胞介素6等炎症递表达水平的下调,从而抑制炎症反应[110]。后续研究揭示,木犀草素等Nrf2激活剂能够促进Nrf2入核并增强血红素加氧酶1蛋白的合成,进而调节核因子κB所诱导的炎症反应,减少促炎细胞因子的释放[111-112]。另外,Nrf2活化后能够直接阻断促炎细胞因子的基因转录,减少由肿瘤坏死因子α、核因子κB所诱导的单核细胞趋化蛋白1分泌,减轻内皮细胞的炎症反应[113]。动物模型实验显示,缺乏Nrf2的小鼠表现出核因子κB异常激活,炎症反应增加[114],而活化Nrf2信号通路可以下调肿瘤坏死因子α和白细胞介素6等促炎因子的表达、降低核因子κB的活性,抑制炎症反应[115-117]。进一步的研究表明,调节Keap1/Nrf2信号通路能减轻肿瘤坏死因子α引发的氧化损伤,抑制炎症及细胞凋亡过程[118]。这些结果强调了Nrf2激活在减轻炎症反应和改善胰岛素抵抗中的关键作用。 运动干预作为一种有效的治疗手段已被证实在改善胰岛素抵抗和相关炎症反应中的重要作用,并且Nrf2信号通路在其中发挥关键的调控作用。SUN等[11]研究显示,运动干预能够显著增强糖尿病小鼠肝脏中Nrf2表达,并伴随着超氧化物歧化酶活性的提高和血清中肿瘤坏死因子α、核因子κB、白细胞介素6等炎症细胞因子活性的降低。这一结果表明运动通过激活Nrf2,能够增强细胞抗氧化能力,减少氧化应激和炎症反应,从而缓解糖尿病和胰岛素抵抗的病程进展。赵格等[14]在研究Nrf2对非酒精性脂肪性肝病的影响中进一步支持运动可以通过激活Nrf2通路控制促炎反应、减轻肝脏炎症的观点。这些发现强调了Nrf2在运动干预中调控炎症反应、缓解胰岛素抵抗的关键作用。韩延歌等[119]研究发现,与单独治疗相比,柴胡皂苷A联合有氧运动干预能显著激活Nrf2通路,通过上调抗氧化酶活性并下调核因子κB等促炎细胞因子水平发挥抗氧化和抗炎作用,这种效应最终导致肥胖大鼠的体质量和肝脏脂肪积累的降低以及血脂参数的改善。综合这些研究以得出结论,运动通过激活Nrf2信号通路能够有效地调控炎症反应,进而改善胰岛素抵抗(表2,3)。"
| [1] MAILLARD F, PEREIRA B, BOISSEAU N. Effect of High-Intensity Interval Training on Total, Abdominal and Visceral Fat Mass: A Meta-Analysis. Sports Med. 2018;48(2):269-288. [2] 苏青,臧丽.胰岛素抵抗的历史、机制和管理[J].中华糖尿病杂志, 2023,15(1):6-13. [3] PARCHA V, HEINDL B, KALRA R, et al. Insulin Resistance and Cardiometabolic Risk Profile Among Nondiabetic American Young Adults: Insights From NHANES. J Clin Endocrinol Metab. 2022;107(1): e25-e37. [4] 中华医学会糖尿病学分会.胰岛素抵抗相关临床问题专家共识(2022版)[J].中华糖尿病杂志,2022,14(12):1368-1379. [5] ZHAO M, ZHANG X, TAO X, et al. Sirt2 in the Spinal Cord Regulates Chronic Neuropathic Pain Through Nrf2-Mediated Oxidative Stress Pathway in Rats. Front Pharmacol. 2021;12:646477. [6] MOI P, CHAN K, ASUNIS I, et al. Isolation of NF-E2-related factor 2 (Nrf2), a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region. Proc Natl Acad Sci U S A. 1994;91(21):9926-9930. [7] LI S, EGUCHI N, LAU H, et al. The Role of the Nrf2 Signaling in Obesity and Insulin Resistance. Int J Mol Sci. 2020;21(18):6973. [8] ZHANG Y, WU Q, LIU J, et al. Sulforaphane alleviates high fat diet-induced insulin resistance via AMPK/Nrf2/GPx4 axis. Biomed Pharmacother. 2022;152:113273. [9] BIRD SR, HAWLEY JA. Update on the effects of physical activity on insulin sensitivity in humans. BMJ Open Sport Exerc Med. 2016;2(1): e000143. [10] LI N, SHI H, GUO Q, et al. Aerobic Exercise Prevents Chronic Inflammation and Insulin Resistance in Skeletal Muscle of High-Fat Diet Mice. Nutrients. 2022;14(18):3730. [11] SUN M, ZHAO X, LI X, et al. Aerobic Exercise Ameliorates Liver Injury in Db/Db Mice by Attenuating Oxidative Stress, Apoptosis and Inflammation Through the Nrf2 and JAK2/STAT3 Signalling Pathways. J Inflamm Res. 2023;16:4805-4819. [12] 刘玉倩,杨雯茜,王海涛.Nrf2/FPN1介导的铁稳态通路在有氧运动预防小鼠肝胰岛素抵抗中的作用[J].中国运动医学杂志,2023, 42(4):294-302. [13] YU Q, XIA Z, LIONG EC, et al. Chronic aerobic exercise improves insulin sensitivity and modulates Nrf2 and NF‑κB/IκBα pathways in the skeletal muscle of rats fed with a high fat diet. Mol Med Rep. 2019;20(6):4963-4972. [14] 赵格,骆远,李亚平,等.核因子E2相关因子2在运动改善非酒精性脂肪性肝病中的作用[J].生物化学与生物物理进展,2024,51(5): 1079-1089. [15] 席回林,吴佳俊,王青燕,等.核因子E2相关因子2在脊髓损伤后氧化应激中的研究进展[J].中国比较医学杂志,2024,34(12):136-142. [16] LIN L, WU Q, LU F, et al. Nrf2 signaling pathway: current status and potential therapeutic targetable role in human cancers. Front Oncol. 2023;13:1184079. [17] HE F, RU X, WEN T. NRF2, a Transcription Factor for Stress Response and Beyond. Int J Mol Sci. 2020;21(13):4777. [18] KO Y, HONG M, LEE S, et al. S-lactoyl modification of KEAP1 by a reactive glycolytic metabolite activates NRF2 signaling. Proc Natl Acad Sci U S A. 2023;120(20):e2300763120. [19] BELLEZZA I, GIAMBANCO I, MINELLI A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress. Biochim Biophys Acta Mol Cell Res. 2018;1865(5):721-733. [20] LI W, YU S, LIU T, et al. Heterodimerization with small Maf proteins enhances nuclear retention of Nrf2 via masking the NESzip motif. Biochim Biophys Acta. 2008;1783(10):1847-1856. [21] QIAN H, CHAO X, WILLIAMS J, et al. Autophagy in liver diseases: A review. Mol Aspects Med. 2021;82:100973. [22] 杨帆,张晓云,娄菲菲,等.加减补阳还五汤通过激活自噬促进Nrf2核转移改善糖尿病肾病足细胞损伤[J/OL].中药药理与临床,1-12[2025-02-21].https://doi.org/10.13412/j.cnki.zyyl.20241022.001. [23] 丁美灵,高铭,包懿文,等.基于p62-Keap1-Nrf2信号通路探讨荆防颗粒对酒精性肝损伤小鼠的保护作用[J].中草药,2024,55(19): 6588-6598. [24] DONG W, LIU G, ZHANG K, et al. Cadmium exposure induces rat proximal tubular cells injury via p62-dependent Nrf2 nucleus translocation mediated activation of AMPK/AKT/mTOR pathway. Ecotoxicol Environ Saf. 2021;214:112058. [25] SUN Y, HE L, WANG T, et al. Activation of p62-Keap1-Nrf2 Pathway Protects 6-Hydroxydopamine-Induced Ferroptosis in Dopaminergic Cells. Mol Neurobiol. 2020;57(11):4628-4641. [26] BO T, GAO L, YAO Z, et al. Hepatic selective insulin resistance at the intersection of insulin signaling and metabolic dysfunction-associated steatotic liver disease. Cell Metab. 2024;36(5):947-968. [27] ZHANG S, ZHANG S, ZHANG Y, et al. Activation of NRF2 by epiberberine improves oxidative stress and insulin resistance in T2DM mice and IR-HepG2 cells in an AMPK dependent manner. J Ethnopharmacol. 2024;327:117931.
[28] AZZIMATO V, JAGER J, CHEN P, et al. Liver macrophages inhibit the endogenous antioxidant response in obesity-associated insulin resistance. Sci Transl Med. 2020;12(532):eaaw9709. [29] 张翠翠,谢玲,孙文萍.枸杞多糖调节Nrf2/HO-1/GPX4铁死亡途径对妊娠期糖尿病大鼠胰岛素抵抗的改善作用[J].中成药,2024, 46(2):626-630. [30] MERRY TL, MACRAE C, PHAM T, et al. Deficiency in ROS-sensing nuclear factor erythroid 2-like 2 causes altered glucose and lipid homeostasis following exercise training. Am J Physiol Cell Physiol. 2020;318(2):C337-C345. [31] YALOW RS, BERSON SA. Immunoassay of endogenous plasma insulin in man. J Clin Invest. 1960;39(7):1157-1175. [32] HUANG HC, NGUYEN T, PICKETT CB. Phosphorylation of Nrf2 at Ser-40 by protein kinase C regulates antioxidant response element-mediated transcription. J Biol Chem. 2002;277(45):42769-42774. [33] EVANS JL, GOLDFINE ID, MADDUX BA, et al. Oxidative Stress and Stress-Activated Signaling Pathways: A Unifying Hypothesis of Type 2 Diabetes. Endocr Rev. 2002;23(5):599-622. [34] HOUSTIS N, ROSEN ED, LANDER ES. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature. 2006; 440(7086):944-948. [35] BEYER TA, WERNER S. The cytoprotective Nrf2 transcription factor controls insulin receptor signaling in the regenerating liver. Cell Cycle. 2008;7(7):874-878. [36] YU Z, SHAO W, CHIANG Y, et al. Oltipraz upregulates the nuclear factor (erythroid-derived 2)-like 2 [corrected](NRF2) antioxidant system and prevents insulin resistance and obesity induced by a high-fat diet in C57BL/6J mice. Diabetologia. 2011;54(4):922-934. [37] 宁梦丽,丁文军,张芳.Nrf2抵抗胰岛β细胞氧化损伤的作用机制[J].中国科学院大学学报,2015, 32(3):301-308. [38] 罗琳,张缨.AMPK与氧化应激及其与运动关系的研究进展[J].中国体育科技,2017,53(4):125-130. [39] PARK SY, CHOI MH, LI M, et al. AMPK/Nrf2 signaling is involved in the anti-neuroinflammatory action of Petatewalide B from Petasites japonicus against lipopolysaccharides in microglia. Immunopharmacol Immunotoxicol. 2018;40(3):232-241. [40] 刘玉倩,张静,高丽娜,等.有氧运动对高糖高脂膳食大鼠腓肠肌Nrf2-SOD的影响[J].中国应用生理学杂志,2020,36(5):481-485. [41] 平烨,张珮雯,袁馨梦,等.运动调节Nrf2/HO-1通路改善HFFC膳食诱导肝细胞氧化应激的作用研究[J].中国实验动物学报,2024, 32(5):566-575. [42] 李俊,冯丽洁,刘一平.有氧运动对2型糖尿病大鼠血管炎症及Nrf2/ARE信号通路的影响[J].免疫学杂志,2019,35(2):179-184. [43] LIU Y, CHENG Y, XIANG N, et al. Aerobic exercise improves BKCa channel-mediated vasodilation in diabetic vascular smooth muscle via AMPK/Nrf2/HO-1 pathway. Acta Diabetol. 2024;61(4):425-434. [44] 孔海军,张亮,熊伟,等.游泳运动可能通过调控Nrf2/HO-1/Keap1通路改善尼古丁胁迫大鼠肝损伤 [J].山东体育学院学报,2023, 39(6):110-118. [45] 张磊,严玉,刘崟,等.8周有氧运动改善肥胖诱导心肌纤维化过程中核因子E2相关因子2通路的作用[J].中国组织工程研究,2021, 25(17):2650-2656. [46] ZOU Y, CHEN Z, SUN C, et al. Exercise Intervention Mitigates Pathological Liver Changes in NAFLD Zebrafish by Activating SIRT1/AMPK/NRF2 Signaling. Int J Mol Sci. 2021;22(20):10940. [47] ABREU CC, CARDOZO LFMF, STOCKLER-PINTO MB, et al. Does resistance exercise performed during dialysis modulate Nrf2 and NF-κB in patients with chronic kidney disease? Life Sci. 2017;188:192-197. [48] 税晓平,李春莹,李明娟,等.有氧和抗阻运动干预2型糖尿病模型大鼠海马抗氧化应激指标和脑源性神经营养因子表达的变化[J].中国组织工程研究,2023,27(2):264-269. [49] TKACHEV VO, MENSHCHIKOVA EB, ZENKOV NK. Mechanism of the Nrf2/Keap1/ARE signaling system. Biochemistry (Mosc). 2011;76(4):407-422. [50] 姚娟,吴平安,李芸,等.Keap1-Nrf2-ARE信号通路及其激活剂的研究进展[J].中国药理学通报,2019,35(10):1342-1346. [51] 王蒙,张海峰.高强度间歇运动通过调控Nrf2/ARE和NF-κB信号通路调节高脂饮食诱导肥胖大鼠的氧化应激和炎症反应[J].基因组学与应用生物学,2020,39(5):2324-2331. [52] EBRAHIMNEZHAD N, NAYEBIFAR S, SOLTANI Z, et al. High-intensity interval training reduced oxidative stress and apoptosis in the hippocampus of male rats with type 2 diabetes: The role of the PGC1α-Keap1-Nrf2 signaling pathway. Iran J Basic Med Sci. 2023;26(11): 1313-1319. [53] 郭新明,吴丽君,赵静,等.虾青素补充与急性大强度运动对机体Nrf2抗氧化通路影响的研究[J]. 山东体育学院学报,2020,36(6): 111-118. [54] 吴毅.不同运动模式训练对糖调节受损老年人胰岛素敏感性和体能的影响[J].西南师范大学学报(自然科学版),2018,43(8):83-91. [55] LI J, CHENG W, MA H. A Comparative Study of Health Efficacy Indicators in Subjects with T2DM Applying Power Cycling to 12 Weeks of Low-Volume High-Intensity Interval Training and Moderate-Intensity Continuous Training. J Diabetes Res. 2022;2022:9273830. [56] FISHER G, GOWER BA, OVALLE F, et al. Acute Effects of Exercise Intensity on Insulin Sensitivity under Energy Balance. Med Sci Sports Exerc. 2019;51(5):988-994. [57] GOLDSTEIN BJ, MAHADEV K, WU X. Redox paradox: insulin action is facilitated by insulin-stimulated reactive oxygen species with multiple potential signaling targets. Diabetes. 2005;54(2):311-321. [58] RAINS JL, JAIN SK. Oxidative stress, insulin signaling, and diabetes. Free Radic Biol Med. 2011;50(5):567-575. [59] 宋林阳,胡依萌,徐焱成,等.胰岛素抵抗的再认识[J].中华糖尿病杂志,2022,14(12):1341-1347. [60] KEVIN NOEL K, VINICIUS FERNANDES C, RODRIGO C, et al. Molecular Events Linking Oxidative Stress and Inflammation to Insulin Resistance and β-Cell Dysfunction. Oxid Med Cell Longev. 2015;2015:181643. [61] 熊款款,谭磊,王爱兵,等.Keap1-Nrf2/ARE信号通路抗氧化机制及抗氧化剂的研究进展[J].动物医学进展,2021,42(4):89-94. [62] 鄂晓迪,赵晓南,赵金标,等.黄酮类化合物调控Keap1-Nrf2/ARE信号通路的抗氧化机制及其在畜禽生产中应用的研究进展[J].中国畜牧兽医,2024,51(7):2880-2889. [63] 曾梦莹,马晓丽.基于Keap1-Nrf2/ARE信号通路研究牛磺酸对胰岛素抵抗模型大鼠氧化应激的影响[J].中国现代应用药学,2020, 37(22):2703-2707. [64] 王海涛,杨雯茜,刘玉倩.有氧运动对高脂膳食小鼠心肌损伤中Nrf2/GPX4/Ferroptosis通路的作用 [J].中国应用生理学杂志,2022, 38(2):143-148. [65] O’ROURKE SA, SHANLEY LC, DUNNE A. The Nrf2-HO-1 system and inflammaging. Front Immunol. 2024;15:1457010. [66] DRUMMOND GS, BAUM J, GREENBERG M, et al. HO-1 overexpression and underexpression: Clinical implications. Arch Biochem Biophys. 2019;673:108073. [67] FATHI R, NASIRI K, AKBARI A, et al. Exercise protects against ethanol-induced damage in rat heart and liver through the inhibition of apoptosis and activation of Nrf2/Keap-1/HO-1 pathway. Life Sci. 2020; 256:117958. [68] MALLARD AR, SPATHIS JG, COOMBES JS. Nuclear factor (erythroid-derived 2)-like 2 (Nrf2) and exercise. Free Radic Biol Med. 2020;160: 471-479. [69] FANG X, WANG H, HAN D, et al. Ferroptosis as a target for protection against cardiomyopathy. Proc Natl Acad Sci U S A. 2019;116(7):2672-2680. [70] LI D, JIANG C, MEI G, et al. Quercetin Alleviates Ferroptosis of Pancreatic β Cells in Type 2 Diabetes. Nutrients. 2020;12(10):2954. [71] MAYNERIS-PERXACHS J, MORENO-NAVARRETE JM, FERNÁNDEZ-REAL JM. The role of iron in host-microbiota crosstalk and its effects on systemic glucose metabolism. Nat Rev Endocrinol. 2022;18(11):683-698. [72] 冯艳,于泉,宋新娜,等.多囊卵巢综合征合并妊娠期糖尿病患者铁代谢与胰岛素抵抗的关系[J]. 中华内分泌外科杂志,2020,14(2): 161-165. [73] GAO G, XIE Z, LI EW, et al. Dehydroabietic acid improves nonalcoholic fatty liver disease through activating the Keap1/Nrf2-ARE signaling pathway to reduce ferroptosis. J Nat Med. 2021;75(3):540-552. [74] LI J, LU K, SUN F, et al. Panaxydol attenuates ferroptosis against LPS-induced acute lung injury in mice by Keap1-Nrf2/HO-1 pathway. J Transl Med. 2021;19(1):96. [75] ZHANG DL, WU J, SHAH BN, et al. Erythrocytic ferroportin reduces intracellular iron accumulation, hemolysis, and malaria risk. Science (New York, NY). 2018;359(6383):1520-1523. [76] 张知宜,王学艺,李冰,等.基于Nrf2/FPN1信号通路探究活血地龟汤对糖尿病肾病小鼠肾脏足细胞铁积累和铁死亡的影响[J].中国中医药信息杂志,2024,31(12):105-111. [77] FRENDO-CUMBO S, TOKARZ VL, BILAN PJ, et al. Communication Between Autophagy and Insulin Action: At the Crux of Insulin Action-Insulin Resistance? Front Cell Dev Biol. 2021;9:708431. [78] LI H, LIU S, YUAN H, et al. Sestrin 2 induces autophagy and attenuates insulin resistance by regulating AMPK signaling in C2C12 myotubes. Exp Cell Res. 2017;354(1):18-24. [79] LI H, ZHOU B, XU L, et al. The reciprocal interaction between autophagic dysfunction and ER stress in adipose insulin resistance. Cell Cycle. 2014;13(4):565-579. [80] LU Z, REN Y, YANG L, et al. Inhibiting autophagy enhances sulforaphane-induced apoptosis via targeting NRF2 in esophageal squamous cell carcinoma. Acta Pharm Sin B. 2021;11(5):1246-1260.
[81] 梁佳,彭辉,宗尤佳,等.Nrf2与自噬在皮肤损伤中的调控作用[J].中国皮肤性病学杂志,2024,38(9):1047-1052.
[82] CACCAMO A, FERREIRA E, BRANCA C, et al. Retraction Note: p62 improves AD-like pathology by increasing autophagy. Mol Psychiatry. 2021;26(7):3664. [83] JOSHI G, GAN KA, JOHNSON DA, et al. Increased Alzheimer’s disease-like pathology in the APP/ PS1ΔE9 mouse model lacking Nrf2 through modulation of autophagy. Neurobiol Aging. 2015; 36(2):664-679. [84] 谢昆,李密杰,蒋成砚,等.自噬相关蛋白ATG5/BECLIN-1调控细胞自噬和凋亡的分子机理研究进展[J].中国人兽共患病学报, 2018,34(3):272-275,85. [85] 林品捷,林晨晗,龚瑾,等.自噬相关蛋白5对氧-糖剥夺/复氧损伤的心肌细胞线粒体自噬的影响 [J].中华高血压杂志(中英文), 2024,32(8):737-745. [86] TANG Z, HU B, ZANG F, et al. Nrf2 drives oxidative stress-induced autophagy in nucleus pulposus cells via a Keap1/Nrf2/p62 feedback loop to protect intervertebral disc from degeneration. Cell Death Dis. 2019;10(7):510. [87] SAITO Y, YAKO T, OTSU W, et al. A triterpenoid Nrf2 activator, RS9, promotes LC3-associated phagocytosis of photoreceptor outer segments in a p62-independent manner. Free Radic Biol Med. 2020; 152:235-247. [88] 吴贞慧,王鸿苗,李静怡,等.苍术素通过ROS/Nrf2/HO-1信号通路诱导肺癌细胞凋亡和自噬[J]. 中国病理生理杂志,2024,40(11): 2050-2058. [89] SHEN J, WANG X, WANG M, et al. Potential molecular mechanism of exercise reversing insulin resistance and improving neurodegenerative diseases. Front Physiol. 2024;15:1337442. [90] SUJKOWSKI A, HONG L, WESSELLS RJ, et al. The protective role of exercise against age-related neurodegeneration. Ageing Res Rev. 2022; 74:101543. [91] CHENG F, DUN Y, CHENG J, et al. Exercise activates autophagy and regulates endoplasmic reticulum stress in muscle of high-fat diet mice to alleviate insulin resistance. Biochem Biophys Res Commun. 2022;601:45-51. [92] PIRANI H, SOLTANY A, HOSSEIN REZAEI M, et al. Lactate-induced autophagy activation: unraveling the therapeutic impact of high-intensity interval training on insulin resistance in type 2 diabetic rats. Sci Rep. 2024;14(1):1108. [93] SHEN B, WANG Y, CHENG J, et al. Pterostilbene alleviated NAFLD via AMPK/mTOR signaling pathways and autophagy by promoting Nrf2. Phytomedicine. 2023;109:154561. [94] LIU Y, CHENG Y, XIANG N, et al. Aerobic exercise improves BK(Ca) channel-mediated vasodilation in diabetic vascular smooth muscle via AMPK/Nrf2/HO-1 pathway. Acta Diabetol. 2024;61(4):425-434. [95] 贾绍辉,刘君,寇现娟,等.运动诱导的细胞自噬对小鼠心肌的保护作用[J].武汉体育学院学报,2014,48(10):53-56. [96] LI H, MENG Y, HE S, et al. Macrophages, Chronic Inflammation, and Insulin Resistance. Cells. 2022;11(19):3001. [97] 庞雅芬,黄明,李琳,等.丹蒌片降低db/db小鼠肝脏脂肪生成及炎症反应改善胰岛素抵抗的作用研究[J].中国中药杂志,2022, 47(12):3320-3327. [98] DING YY, FANG Y, PAN Y, et al. Orally administered octacosanol improves liver insulin resistance in high-fat diet-fed mice through the reconstruction of the gut microbiota structure and inhibition of the TLR4/NF-κB inflammatory pathway. Food Funct. 2023;14(2):769-786. [99] AKASH MSH, REHMAN K, LIAQAT A. Tumor Necrosis Factor-Alpha: Role in Development of Insulin Resistance and Pathogenesis of Type 2 Diabetes Mellitus. J Cell Biochem. 2018;119(1):105-110. [100] CHEN L, CHEN R, WANG H, et al. Mechanisms Linking Inflammation to Insulin Resistance. Int J Endocrinol. 2015;2015:508409. [101] THOMAS MS, CALLE M, FERNANDEZ ML. Healthy plant-based diets improve dyslipidemias, insulin resistance, and inflammation in metabolic syndrome. A narrative review. Adv Nutr. 2023;14(1):44-54. [102] YARIBEYGI H, FARROKHI FR, BUTLER AE, et al. Insulin resistance: Review of the underlying molecular mechanisms. J Cell Physiol. 2019;234(6): 8152-8161. [103] BAGHERNIYA M, MAHDAVI A, ABBASI E, et al. The effects of phytochemicals and herbal bio-active compounds on tumour necrosis factor-α in overweight and obese individuals: a clinical review. Inflammopharmacology. 2022;30(1):91-110. [104] KOENEN TB, STIENSTRA R, VAN TITS LJ, et al. Hyperglycemia activates caspase-1 and TXNIP-mediated IL-1beta transcription in human adipose tissue. Diabetes. 2011;60(2):517-524. [105] BÖNI-SCHNETZLER M, DONATH MY. How biologics targeting the IL-1 system are being considered for the treatment of type 2 diabetes. Br J Clin Pharmacol. 2013;76(2):263-268. [106] HIRANO T. IL-6 in inflammation, autoimmunity and cancer. Int Immunol. 2021;33(3):127-148. [107] MARTINEZ D, PALMER C, SIMAR D, et al. Characterisation of the cytokine milieu associated with the up-regulation of IL-6 and suppressor of cytokine 3 in chronic hepatitis C treatment non-responders. Liver Int. 2015;35(2):463-472. [108] 许光远,张晓明,贾春玲.桑叶黄酮对糖尿病小鼠胰岛素抵抗及炎症反应的作用机制[J].中国实验方剂学杂志,2023,29(16):52-57. [109] GASPARRINI M, AFRIN S, FORBES-HERNÁNDEZ TY, et al. Protective effects of Manuka honey on LPS-treated RAW 264.7 macrophages. Part 2: Control of oxidative stress induced damage, increase of antioxidant enzyme activities and attenuation of inflammation. Food Chem Toxicol. 2018;120: 578-587. [110] AHMED SM, LUO L, NAMANI A, et al. Nrf2 signaling pathway: Pivotal roles in inflammation. Biochim Biophys Acta Mol Basis Dis. 2017; 1863(2):585-597. [111] 陶艺文,许利荣,胡友,等.木犀草素通过激活GSK3β/Nrf2通路抑制感染性炎症反应的研究[J]. 上海中医药杂志,2024,58(9):61-69. [112] WANG Z, WANG L, LUO J, et al. Protection against acute renal injury by naturally occurring medicines which act through Nrf2 signaling pathway. J Food Biochem. 2021;45(1):e13556. [113] CUADRADO A, ROJO AI, WELLS G, et al. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases. Nat Rev Drug Discov. 2019;18(4):295-317. [114] SAHIN K, PALA R, TUZCU M, et al. Curcumin prevents muscle damage by regulating NF-κB and Nrf2 pathways and improves performance: an in vivo model. J Inflamm Res. 2016;9:147-154. [115] CHEN Y, MIAO Z, SHENG X, et al. Sesquiterpene lactones-rich fraction from Aucklandia lappa Decne. alleviates dextran sulfate sodium induced ulcerative colitis through co-regulating MAPK and Nrf2/Hmox-1 signaling pathway. J Ethnopharmacol. 2022;295:115401. [116] 仲启明,仝立国,赵华杰,等.异虎耳草素通过调控Nrf2-NF-κB通路轴减轻松果体损伤大鼠氧化应激和炎症反应[J].免疫学杂志, 2024,40(3):234-241. [117] 赵娜,沈梦迪,赵睿,等.血根碱通过调控Nrf2/NF-κB通路缓解小鼠溃疡性结肠炎[J].南方医科大学学报,2024,44(8):1467-1475. [118] 王春淼,李玉洁,李晶晶,等.参莲提取物通过调控Nrf2/Keap1信号通路减轻TNF-α诱导的ECV304损伤[J].中国中药杂志,2021, 46(13):3402-3409. [119] 韩延歌,孟宇竹,王丽娜.柴胡活性物质联合有氧运动对肥胖大鼠的治疗作用及其机制[J].分子植物育种,2024,22(16):5501-5509. [120] ZHANG W, DUN Y, YOU B, et al. Trimetazidine and exercise offer analogous improvements to the skeletal muscle insulin resistance of mice through Nrf2 signaling. BMJ Open Diabetes Res Care. 2022; 10(2):e002699. [121] 雷槟恺,李顺昌,高德润,等.Nrf2/HO-1通路在有氧运动干预2型糖尿病大鼠骨骼肌氧化应激中的作用[J].中国康复医学杂志, 2022,37(3):289-295. [122] 陈晓勇,李洁华,赵丽花,等.有氧运动通过Keap1Nrf2HO-1通路对睡眠障碍老年大鼠认知的改善机制[J].医学研究与战创伤救治, 2024,37(2):125-129. [123] ISLAM H, BONAFIGLIA JT, TURNBULL PC, et al. The impact of acute and chronic exercise on Nrf2 expression in relation to markers of mitochondrial biogenesis in human skeletal muscle. Eur J Appl Physiol. 2020;120(1):149-160. [124] ZHU X, REN T, XIONG Q, et al. Salidroside alleviates diet-induced obesity and insulin resistance by activating Nrf2/ARE pathway and enhancing the thermogenesis of adipose tissues. Food Sci Nutr. 2023;11(8):4735-4744. [125] TAN Y, ZHOU C, MIAO L, et al. 3,4’,5-Trimethoxy-trans-stilbene ameliorates hepatic insulin resistance and oxidative stress in diabetic obese mice through insulin and Nrf2 signaling pathways. Food Funct. 2024;15(6):2996-3007. [126] LI Z, XU W, SU Y, et al. Nicotine induces insulin resistance via downregulation of Nrf2 in cardiomyocyte. Mol Cell Endocrinol. 2019; 495:110507. [127] WEI J, HAO Q, CHEN C, et al. Epigenetic repression of miR-17 contributed to di(2-ethylhexyl) phthalate-triggered insulin resistance by targeting Keap1-Nrf2/miR-200a axis in skeletal muscle. Theranostics. 2020;10(20):9230-9248. |
| [1] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [2] | Sun Yundi, Cheng Lulu, Wan Haili, Chang Ying, Xiong Wenjuan, Xia Yuan. Effect of neuromuscular exercise for knee osteoarthritis pain and function: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1945-1952. |
| [3] | Li Huayuan, Li Chun, Liu Junwei, Wang Ting, Li Long, Wu Yongli. Effect of warm acupuncture on PINK1/Parkin pathway in the skeletal muscle of rats with chronic fatigue syndrome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1618-1625. |
| [4] | Zhou Panpan, Cui Yinglin, Zhang Wentao, Wang Shurui, Chen Jiahui, Yang Tong . Role of cellular autophagy in cerebral ischemic injury and the regulatory mechanism of traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1650-1658. |
| [5] | Wang Qiuyue, Jin Pan, Pu Rui . Exercise intervention and the role of pyroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1667-1675. |
| [6] | Zhu Hanmin, Wang Song, Xiao Wenlin, Zhang Wenjing, Zhou Xi, He Ye, Li Wei, . Mitophagy regulates bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1676-1683. |
| [7] | Wang Juan, Wang Guanglan, Zuo Huiwu. Efficacy of exercise therapy in the treatment of anterior cruciate ligament reconstruction patients: #br# a network meta-analysis #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1714-1726. |
| [8] | Zheng Huakun, Yin Mingyue, Liu Qian. Effects of interval and continuous training on the quality of life in physically inactive adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1727-1740. |
| [9] | Lou Guo, Zhang Min, Fu Changxi. Exercise preconditioning for eight weeks enhances therapeutic effect of adipose-derived stem cells in rats with myocardial infarction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1363-1370. |
| [10] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [11] | Chen Yuning, Jiang Ying, Liao Xiangyu, Chen Qiongjun, Xiong Liang, Liu Yue, Liu Tong. Buqi Huoxue Compounds intervene with the expression of related factors and autophagy related proteins in a rat model of cerebral ischemia/reperfusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1152-1158. |
| [12] | He Guanghui, Yuan Jie, Ke Yanqin, Qiu Xiaoting, Zhang Xiaoling. Hemin regulates mitochondrial pathway of oxidative stress in mouse chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1183-1191. |
| [13] | He Bo, Chen Wen, Ma Suilu, He Zhijun, Song Yuan, Li Jinpeng, Liu Tao, Wei Xiaotao, Wang Weiwei, Xie Jing . Pathogenesis and treatment progress of flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1230-1238. |
| [14] | Zhao Xiaoxuan, Liu Shuaiyi, Li Qi, Xing Zheng, Li Qingwen, Chu Xiaolei. Different exercise modalities promote functional recovery after peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1248-1256. |
| [15] | Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||