Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (23): 5906-5914.doi: 10.12307/2026.348
Previous Articles Next Articles
Roles and mechanisms of mitochondrial dynamics in bone defect repair
Zhou Fada1, 2, Long Zhisheng2
- 1Jiangxi University of Chinese Medicine, Nanchang 330006, Jiangxi Province, China; 2Department of Orthopedics, Jiangxi Provincial People’s Hospital, The First Affiliated Hospital of Nanchang Medical College, Nanchang 330006, Jiangxi Province, China
-
Received:2025-04-24Accepted:2025-08-14Online:2026-08-18Published:2025-12-30 -
Contact:Zhou Fada, MS candidate, Jiangxi University of Chinese Medicine, Nanchang 330006, Jiangxi Province, China; Department of Orthopedics, Jiangxi Provincial People’s Hospital, The First Affiliated Hospital of Nanchang Medical College, Nanchang 330006, Jiangxi Province, China -
About author:Long Zhisheng, PhD, Associate chief physician, Department of Orthopedics, Jiangxi Provincial People’s Hospital, The First Affiliated Hospital of Nanchang Medical College, Nanchang 330006, Jiangxi Province, China -
Supported by:National Natural Science Foundation of China, No. 32060222 (to LZS); Jiangxi Provincial Health and Family Planning Commission, No. 202310014 (to LZS)
CLC Number:
Cite this article
Zhou Fada, Long Zhisheng. Roles and mechanisms of mitochondrial dynamics in bone defect repair[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(23): 5906-5914.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
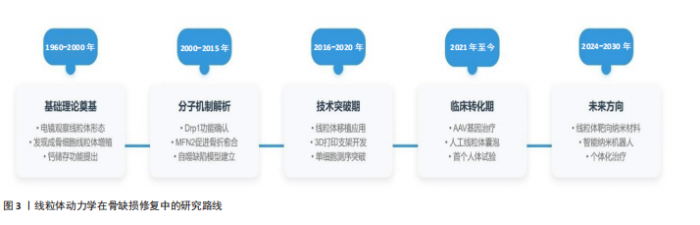
2.1 线粒体动力学的概述 线粒体是细胞内重要的细胞器,会经过分裂、融合、自噬和运输等过程,这些过程较为关键,能维持线粒体的稳定状态,线粒体在细胞内的形态、质量和数量分布会影响其功能[1]。线粒体有自己的DNA,它们需要定期更新和修复才能保持正常工作。建议深入研究线粒体动力学,了解线粒体的形态变化与排列情况,观察线粒体与其他细胞器之间怎样互动,从而找出线粒体如何调控细胞功能的原理。 越来越多的研究发现,线粒体动力学失衡与很多疾病有关,如神经退行性疾病、代谢性疾病、心血管疾病、感染和炎症等[2],研究线粒体动力学能更快地弄清这些疾病的发病原因,对线粒体疾病的临床诊断和治疗有很大的帮助:比如通过线粒体质量控制来维持它的正常功能,加快线粒体的融合与自噬,清除环境内受损或功能不好的线粒体,可以抑制线粒体裂变,减少碎片化的线粒体。 2.1.1 线粒体结构和功能 线粒体是由外膜、内膜、膜间隙和基质组成的双膜包围的细胞器[3]。线粒体的外膜由磷脂双层构成,外膜上的孔蛋白允许小分子自由通过,而大分子则需要借助线粒体膜上的转运蛋白进行主动运输[4]。此外,线粒体外膜与内质网膜通过特定的蛋白质相互连接,形成“线粒体-内质网接触位点”,这一结构在脂质交换和钙离子信号传递等过程中扮演着关键角色[5]。 内膜具有许多褶皱,它们极大增加了膜的表面积[6],膜表面积的增加意味着参与ATP合成的蛋白质和酶的空间变大,从而提高其能量代谢效率。内膜不同于外膜,对大多数分子都表现出高度的选择性和不渗透性,内膜的特殊转运蛋白控制着特定分子的方向,例如ADP、ATP以及磷酸盐离子,而这些分子参与了能量的产生,内膜的特殊转运蛋白还促进了ATP、ADP和磷酸等关键代谢物的运输,确保了线粒体与细胞其他部分之间的能量交换。线粒体膜间隙是位于线粒体内膜与外膜之间的狭窄区域,这一区域十分关键,是细胞能量生成与调控的重要场所[7],ATP合成和细胞信号传导也是依赖于这一结构。膜间隙不仅是细胞能量代谢的关键场所,还在细胞信号传导、凋亡调控以及代谢物储存等方面有着极为重要的影响,更是细胞维持正常生理功能的重要结构基础。膜间隙内富含多种蛋白质,其中细胞色素C是关键的,其在凋亡过程中不可替代[8]。膜间隙还能储存线粒体和细胞功能所需的关键小分子、离子以及其他代谢物,ADP与ATP这两种能量分子能在基质与膜间隙之间交换,为细胞提供能量支持,确保细胞各项生命活动进行。 2.1.2 线粒体分裂 线粒体分裂是指单个线粒体分裂成2个更小的线粒体[9],这种动态过程对维持线粒体健康、调节线粒体数量以及各种细胞功能有很大的帮助。动力蛋白相关蛋白1(Dynamin-related protein 1,Drp1)是细胞质内调控线粒体分裂的核心蛋白[10],线粒体分裂过程一旦开始,Drp1就会被带到外膜指定位置,该过程依靠Drp1与线粒体外膜上特定适配蛋白两者的作用[11],到达分裂位点后,Drp1会聚集形成一种较大的同源多聚体复合物,这些复合物会绕着线粒体排列并形成螺旋样的结构,这些螺旋结构以能量驱动的方式收缩,促使线粒体外膜发生分裂[10]。 线粒体分裂是一种细胞机制,它能把细胞内非正常的线粒体分开,有效找出有问题的线粒体片段,并在线粒体自噬的过程中把它们降解[12],这对于维护细胞内线粒体群体的健康十分重要。线粒体分裂还让线粒体在细胞内分布更广,特别是在那些能量需求特别多的地方,如神经元的突触附近,或是细胞分裂活跃的区域,这种分布能保证细胞内的能量供应和代谢需求。面对细胞应激压力或环境变化时,线粒体分裂表现出很高的灵活性,细胞会调整线粒体的大小和分布,快速改变能量生产和代谢策略。线粒体分裂还与细胞凋亡关系密切,凋亡过程中线粒体分裂通常会加强,这有助于释放促凋亡因子并推动细胞死亡过程[13]。线粒体分裂有助于维持线粒体的健康和功能,也提高了细胞在能量供应、代谢需求以及应对外界压力的灵活性和适应性,它在程序性细胞死亡过程中作用重大[14]。 2.1.3 线粒体的融合 线粒体融合是细胞生物学中的一个很重要过程,由2个或多个线粒体一起组成一个更大的线粒体[15],这有助于确保线粒体网络的动态平衡、维持线粒体正常功能,增强细胞对外界环境的适应[16]。有两组蛋白质家族参与这一复杂化的过程:一组是位于线粒体内膜的视神经萎缩蛋白1(optic atrophy type1,OPA1),另一组是位于线粒体外膜的融合蛋白1(mitofusin 1,Mfn1)和线粒体融合蛋白2(mitofusin 2,Mfn2)[17],这些蛋白质能极大程度加快线粒体膜的靠近与融合。 线粒体融合的第一步是线粒体之间的靠近,这个过程可能依靠细胞内的微管结构和马达蛋白来协助,如Kinesins和Dyneins[18],这些蛋白能让线粒体在细胞里移动并找到合适的位置来融合。线粒体靠近后,位于外膜的Mfn1和Mfn2蛋白开始起作用,它们互相配合,形成连接2个线粒体外膜的桥梁,内膜上的OPA1蛋白也加入进来,用它的特殊功能促进内膜融合[19]。这些蛋白质之间的共同合作让线粒体两层膜完全融合。 线粒体融合与分裂之间有一种微妙的平衡,这种平衡调控线粒体的大小、形状和功能,细胞能够灵活应对各种能量需求和外界刺激,确保功能的稳定。线粒体融合是一个线粒体质量控制过程,它通过融合健康的线粒体、清除受损的部分,来维持线粒体整个网络的健康。线粒体融合还影响细胞信号传导,调节细胞的生长、分化甚至参与凋亡过程[20]。 2.1.4 线粒体自噬 线粒体自噬是细胞内一个特殊的过程,会有选择地清除非正常的线粒体[12],参与维持细胞功能稳定[21]。线粒体自噬包括经典的同源性磷酸酶-张力蛋白诱导激酶1 (phosphatase and tensin homologue-induced putative kinase 1,PINK1)/帕金蛋白(PARKIN)通路、E1B-19kDa相互作用蛋白3(BCL2 Interacting Protein 3 Like,Bnip3L)、FUN14结构域蛋白1(FUN14 domain-containing 1,FUNDC1)等其他介导的自噬路线[22],它们能够感应到不同的细胞内外信号,如线粒体去极化、缺氧条件[23]。线粒体自噬与线粒体的动态平衡有重要联系,线粒体自噬不单单能参加细胞质量控制,还维护了机体健康。当线粒体自噬过程异常时,将会伴随心血管疾病和神经退行性疾病等产生。 2.1.5 线粒体运输 线粒体运输是细胞内物质和能量代谢的关键步骤,其负责让线粒体在细胞空间里精确分布、有效移动,并保持正常功能[24]。线粒体运输过中,动态管化现象特别重要,驱动蛋白家族成员5B沿微管牵引线粒体,形成一条又细又长的动态管道,该过程对线粒体的有序运输和合理布局起到了很大的作用[25]。线粒体运输涉及多种蛋白质和分子机制的共同作用,例如皮质蛋白能把线粒体固定在细胞膜上,它们精确调控线粒体的位置和分配[26];线粒体运输对于神经元也很重要,它关系到神经元的能量供应及信号传导效率,当神经元开始兴奋时,Ca2+浓度会上升,这一变化会增强线粒体转运,确保神经元区域能够得到各自所需的能量[27]。 2.2 线粒体动力学在骨缺损修复中的作用 线粒体是细胞能量代谢的核心,在骨修复中起着重要作用,它能促进骨组织修复和再生。骨骼修复过程中,成骨细胞、破骨细胞以及其他参与修复的细胞都需要很多能量来完成增殖、分化和迁移等活动,恰好线粒体能提供这些能量[28]。 线粒体可以调节细胞内活性氧浓度,让细胞的氧化平衡得以保持。骨缺损修复中,活性氧的浓度必须保持在一个恰当范围内,因为过高或过低的活性氧水平都可能损伤细胞,影响骨修复。线粒体靠它的抗氧化系统,比如超氧化物歧化酶、过氧化氢酶等,来清除多余的活性氧,进而保护细胞免受氧化应激的伤害[29]。随着线粒体在骨修复中研究的深入,它在骨修复领域的应用前景也在不断扩大和加深。比如可以专门开发针对线粒体的药物和生物材料,以及探索推进线粒体移植技术,在临床治疗中发挥更多的作用,这也为治疗骨缺损等骨骼疾病带来了新的治疗策略。研究线粒体与其他细胞器、信号通路的关系,也有助于更多地了解骨骼修复中更为复杂的调控机制。关于线粒体动力学在骨缺损修复的研究路线见图3。 2.2.1 线粒体动力学与能量代谢重构 线粒体作为细胞的“能量工厂”, 在骨修复中起着特殊的作用,骨缺损修复这一复杂生物过程需要大量能量,像成骨细胞前体细胞的募集、增殖、迁移、分化以及细胞外基质的合成和矿化等环节都需要持续的ATP供应[30],而线粒体动态调节能量代谢网络、维持氧化还原平衡和信号通路,成为骨缺损修复所需的能量和分子基础[31]。 成骨细胞前体细胞增殖时,细胞对ATP的需求大增,DNA复制时解旋酶和聚合酶的活性以及染色体分离时微管动力蛋白都要消耗大量能量,这期间线粒体靠氧化磷酸化高效产生ATP,效率比糖酵解高18倍还多[32]。在成骨细胞分化的早期阶段,细胞代谢模式从以糖酵解为主的“Warburg效应”慢慢转变成以氧化磷酸化为主,这个过程里,线粒体融合蛋白构建线粒体网络,使嵴表面积增大,从而让电子传递链复合体的组装效率得以提升,高效产生ATP[33],相关研究表明,Mfn2过表达可使ATP水平提高30%-50%[34]。 2.2.2 线粒体动力学中钙信号调控 成骨细胞矿化过程中细胞内钙离子的动态平衡受线粒体调控使其成为“钙信号枢纽”,包括线粒体对钙的摄取、储存、释放以及与细胞外基质矿化的精细耦合[35]。线粒体融合可提升钙缓冲能力与空间协调性直接推动羟基磷灰石定向沉积促使成骨细胞矿化[36],像Mfn2和OPA1使线粒体相互融合形成高度互联的管状网络,网络优化线粒体形态结构扩大线粒体基质总体积并增强钙储存能力[37]。线粒体基质内积累的钙离子能够激活三羧酸循环中的关键酶,比如α-酮戊二酸脱氢酶,加速还原型辅酶Ⅰ的生成,提高ATP合成效率形成“钙-能量”正反馈循环[38]。 2.2.3 线粒体动力学与骨髓间充质干细胞的成骨分化 骨髓间充质干细胞是结缔组织的祖先,由于它在各种细胞类型中的分化潜力,骨组织已成为组织工程的重要工具[39]。在骨髓间充质干细胞向成骨细胞分化的过程中,线粒体的形态经历了显著的转变:最初由椭圆形逐渐变为长梭形,最终呈现为网格状。与此同时,线粒体的数量明显增多,并且在细胞质内的分布也变得更加均匀,这些变化与线粒体生物相关基因的表达上调密切相关,特别是过氧化物酶体增殖物激活受体γ共激活因子1α[40]。跨膜蛋白135是一种线粒体动力学的调控因子,能够维持脂肪生成与成骨分化之间的平衡,跨膜蛋白 135的缺乏会阻碍线粒体的裂变过程,严重干扰成骨分化期间线粒体能量代谢[41]。线粒体动力学在骨髓间充质干细胞的成骨分化过程中扮演着重要的角色,它通过调节线粒体的功能和能量代谢对骨髓间充质干细胞的分化方向以及骨组织形成产生深远影响。 2.2.4 抑制炎症反应 骨缺损后的炎症对于愈合至关重要,线粒体动力学在这一调节过程中起到了核心作用,线粒体是细胞内活性氧的主要制造者,在调控细胞能量代谢和氧化应激状态方面发挥着关键作用[42]。适度的活性氧水平可以作为促进细胞修复和适应的信号分子,而过高活性氧水平则可能对细胞造成损伤。"
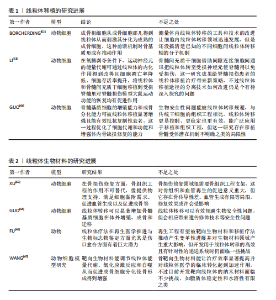
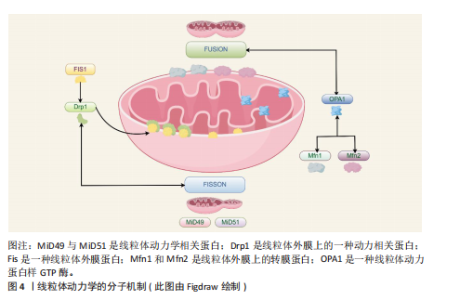
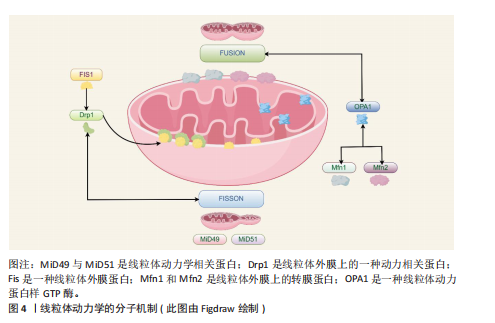
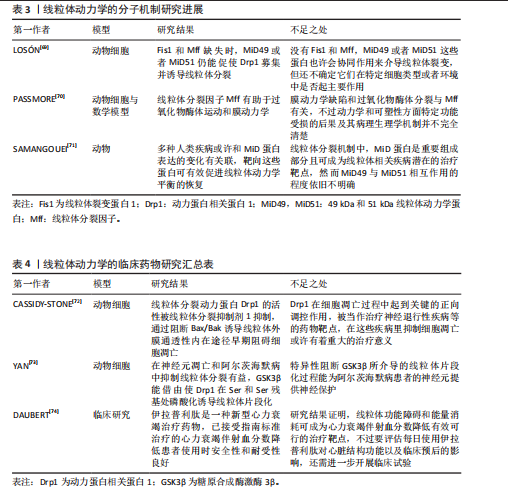
线粒体内部的成分及其代谢产物可能成为损伤相关分子模式,一旦释放至细胞溶胶或细胞外部环境,便能触发炎症反应[43],这些线粒体损伤相关分子模式涵盖了线粒体DNA和线粒体产生的活性氧,它们有能力激活细胞内部的信号传导路径,诱导炎症细胞因子的生成,从而加剧炎症的发展[44]。线粒体在分裂过程会将受损的部分隔离开,借助线粒体自噬来清除这些受损的线粒体,减少炎症因子的释放,线粒体自噬降解和清除受损或异常的线粒体可以极大程度上维持线粒体的质量和功能。线粒体自噬也可以清除线粒体中异常的损伤相关分子模式和活性氧来间接抑制炎症小体的激活[45],例如白细胞介素10抗炎因子通过线粒体自噬明显减轻了结肠炎巨噬细胞中功能性线粒体的负担,降低了NOD样受体热蛋白结构域相关蛋白3的活性[46],有效抑制了炎症小体的活化,达到减轻炎症并预防炎症性疾病等目的。 2.2.5 细胞凋亡的调控 线粒体是细胞能量转换的核心场所,它还参与了细胞凋亡的调控,在凋亡过程中线粒体可释放细胞色素C等凋亡相关因子参与到凋亡信号的传递与放大机制中[47]。线粒体膜电位的变化成为凋亡过程中的一个重要标志:当细胞接收到凋亡信号时,线粒体的形态会立即发生变化,线粒体膜通透性会明显增加,这也会导致细胞色素C凋亡相关因子被释放到细胞质中[48],这些因子的释放会更进一步激活下游的凋亡执行者,如半胱天冬酶等并触发细胞凋亡的程序。 线粒体还与其他细胞器(例如内质网)以及信号通路(如磷脂酰肌醇3-激酶/蛋白激酶B通路)进行复杂的交互作用,共同协调与衰老相关的细胞凋亡过程[49]。这些交互作用构成了一个精细的调控网络,使细胞能够精确地根据内部和外部环境的变化调整其凋亡反应。Drp1是线粒体分裂机制中的核心调控因子[50],调控线粒体动态平衡,作为GTPase动力蛋白家族的一员,Drp1专门负责在线粒体外膜上集结,触发线粒体的分裂过程,这对于保持线粒体的正常运作形态与功能极为重要[51] 。然而当Drp1过度活化时会促使线粒体分裂过度,这可能导致成骨细胞和骨细胞遭受损害乃至死亡,进而影响骨再生的生理过程。 2.2.6 线粒体动力学中的信号通路 线粒体动力学通过调节多条信号通路,将能量代谢、机械信号和细胞代谢整合在一起,在骨修复过程中构建了一个复杂的调控网络。具体而言腺苷酸活化蛋白激酶/哺乳动物雷帕霉素靶蛋白(AMP-activated protein kinase/mammalian target of rapamycin,AMPK/mTOR)通路作为能量感知与代谢稳态的调控中枢在骨缺损修复中扮演了一个极为重要的角色。AMPK的激活能够促进骨髓间充质干细胞向成骨细胞的分化,相反,mTORC1的过度激活(通常出现在高营养状态下)则会促使细胞向脂肪细胞方向分化。例如,使用AMPK激动剂阿卡地新处理后,成骨标志物碱性磷酸酶的活性可显著提高2倍[52]。 Hippo-Yes相关蛋白/转录共激活因子PDZ结合基序(Yes-associated protein/transcriptional co-activator with PDZ-binding motif,YAP/TAZ)信号通路同样在骨修复过程中特别关键,该通路能调控成骨细胞与破骨细胞之间的平衡,引导间充质干细胞的分化方向,加速骨组织的修复和再生。Hippo-YAP/TAZ通路可通过响应外界信号刺激,如机械应力或生长因子,来推动间充质干细胞向成骨细胞谱系分化,从而加速新骨形成并促进受损骨组织的恢复[53]。YAP/TAZ与转录增强相关结构域转录因子结合,直接上调Runt相关转录因子2、Osterix表达[54],而且YAP/TAZ还能激活血管内皮生长因子表达,促进缺损区血管新生,为骨修复提供营养支持[55]。在骨修复过程中,YAP/TAZ还能通过与Wnt/β-catenin通路等信号通路交互作用,调节成骨相关基因的表达,进而促进骨组织的形成[56]。例如,YAP/TAZ可以协同Wnt信号通路促进β-catenin的核移位,加强其激活下游靶基因的能力[57]。Wnt/β-catenin与转化生长因子β信号的相互作用则有助于维持间充质干细胞的干性并指导其向成骨谱系分化[58],这种复杂的信号网络共同作用可以加速新骨组织的生成,并在一定程度上促进骨骼的修复。 2.2.7 线粒体移植 线粒体移植是一种新兴的治疗策略,通过向受损细胞引入健康的线粒体,以恢复线粒体功能及细胞整体活力,健康线粒体的引入能有效降低受损细胞内活性氧的生成,进而提升ATP产生效率和钙离子的缓冲能力,维持受损细胞的存活状态与功能修复[59] 。 相关研究表明,骨髓间充质干细胞能通过隧道纳米管、直接接触以及旁分泌等方式将线粒体传递给受损的运动神经元,受损的运动神经元具有从骨髓间充质干细胞中摄取更多线粒体的能力,且这一过程受到间隙连接细胞间通信的调控:抑制间隙连接细胞间通信会减少线粒体的转移,增强其活性则会促进线粒体的传递,进一步增加神经元ATP含量,促进细胞生存[60]。线粒体移植作为一种有效技术,能够通过提升需氧代谢来增强骨髓间充质干细胞功能,促进体内骨缺损的原位修复[61]。线粒体移植相关研究见表1[62-64]。 2.2.8 线粒体生物材料 线粒体生物材料是一类具有独特设计的材料,能有效维持线粒体的功能与质量稳定,它们在再生工程领域内展现出了广阔的应用前景,尤其是在加速组织修复进程以及优化生物材料与宿主组织之间的相互作用领域[65],线粒体生物材料具备通过调节线粒体代谢来加快组织再生的能力。线粒体动力学涵盖了融合、分裂、自噬及运输等多个方面,对于保持线粒体正常功能、合理分配能量以及促进细胞间的信号传递起着决定性作用[66]。 从骨支架材料中整合线粒体促进剂,例如辅酶Q10或NAD+的前体物质,能够有效提升局部的能量代谢水平及成骨活性[61],这些线粒体促进剂通过维护线粒体的动态稳定,显著增强了骨移植的治疗效果。线粒体功能障碍对免疫微环境的改变及干细胞分化具有负面效应,这会抑制骨组织的再生能力,而线粒体新型生物材料能够通过调控微环境来影响成骨细胞和免疫细胞的活动来促进骨组织的有效修复[67]。有关线粒体生物材料的研究可见表2。 2.3 线粒体动力学的研究展望 线粒体动力学的研究是个相对复杂的领域,它主要关注线粒体的形状变化、分布,还有它和其他细胞器的互动,近年来,该领域的研究进步很大、前景广阔。线粒体动力学的调控机制也很复杂,它牵涉到很多蛋白质和信号传导路径,未来的研究需更加精确地探索这些蛋白质和信号传导途径的作用,以及它们是如何共同合作的,来调控线粒体动力学。 线粒体动力学失常与很多种疾病有关,在这些疾病中,线粒体常会变得形状异常、功能减弱,或跟其他细胞器的互动也有障碍,通过调节线粒体动力学可恢复线粒体的正常功能,以后要开展更多的研究,更多地了解线粒体动力学,以及它如何在疾病治疗中发挥作用[68] 。 2.3.1 线粒体动力学的分子机制研究 未来可以进一步研究线粒体动力学重要分子和信号通路的作用机制,以及对成骨细胞功能及分化的确切影响,评估其与成骨信号传导之间的相互作用机制,探讨是否能够通过提升线粒体生物合成的水平,来有效促进或优化骨骼修复的过程,开创新型的临床治疗方案。 线粒体裂变蛋白1(Fission,Mitochondrial 1,Fis1),一种位于线粒体外膜的关键蛋白,密切参与调节线粒体分裂过程[69],它作为Drp1的受体能够引导Drp1至线粒体外膜,触发线粒体分裂。同样定位于线粒体外膜的还有另一重要分裂因子——线粒体分裂因子(mitochondrial fission factor,Mff),它不仅能促进Drp1的聚集与寡聚化,还具备调节线粒体抗病毒反应的能力[70]。49 kDa和51 kDa线粒体动力学蛋白(mitochondrial dynamics proteins of 49 kDa and 51 kDa,MiD49 and MiD51)是线粒体动力学蛋白家族成员,也位于线粒体外膜上[71]。它们作为Drp1的受体,参与调控线粒体的分裂过程(图4)。与Fis1和Mff相比,MiD49和MiD51在线粒体分裂中的具体作用机制可能更为复杂,但仍需进一步深入研究。线粒体动力学的分子机制的相关研究见表3。"

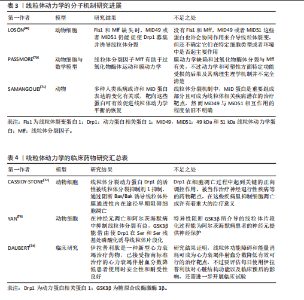
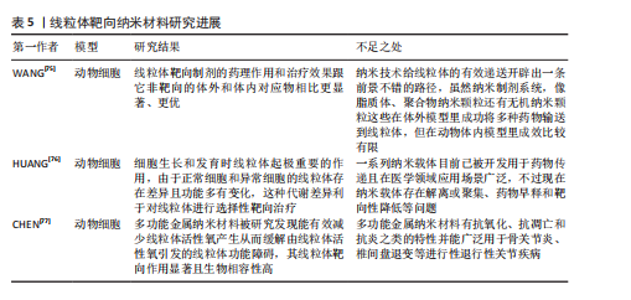
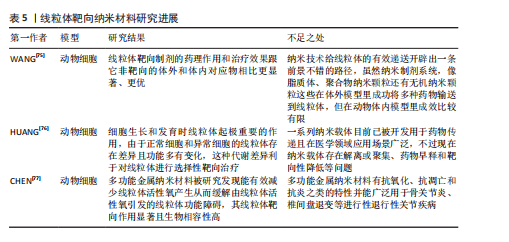
2.3.2 线粒体动力学的临床药物研究 线粒体动力学的临床药物创新研发领域有着很大的研究前景,可以着重于开发一系列能够精准干预Drp1与Fis1之间相互作用的新型药物,如线粒体分裂抑制剂1通过抑制Drp1的活性来发挥作用[72];TAT-Drp1-SpS这类人工设计的多肽能够有效阻断由糖原合成酶激酶3β诱导的Drp1磷酸化过程[73],为调节线粒体功能提供了新的思路。 靶向线粒体抗氧化剂结合药物的研究也有较大的应用价值,例如线粒体靶向抗氧化剂Elamipretide TFA(MTP-131)是一个心磷脂过氧化物酶抑制剂和线粒体靶向的肽[74],这种抗氧化剂展现出降低Drp1蛋白水平的能力,能够上调MFN2和OPA1的蛋白水平,有效改善线粒体功能。这些创新药物与治疗策略的开发能精准调节线粒体的动态平衡,在骨缺损愈合等生物医学问题上开创新型的治疗思路。有关线粒体动力学的临床药物研究见表4。 2.3.3 线粒体靶向纳米颗粒 线粒体导向型纳米载体是一种特殊的纳米级输送系统,有着高精确度的靶向系统,能较为精确地将药物或其他治疗性分子输送至细胞内部的线粒体中[75],线粒体靶向纳米颗粒递送体系能巧妙的通过调控能量代谢过程与维持细胞内的氧化还原平衡状态,影响细胞增殖与分化并诱导线粒体自噬等机制,一定程度上影响细胞凋亡过程。 线粒体靶向策略相较于传统的纳米材料等递送方法有更高的治疗潜力与效率[76]。有研究团队开发了一种针对线粒体的多酚与氨基酸自组装形成的纳米颗粒(EC Nanoparticles),工程化碳纳米颗粒具备清除活性氧的能力,可以维持线粒体的稳态,促进骨缺损修复[77]。未来应多加开展线粒体调节功能的靶向纳米颗粒的创新研究,增强线粒体功能和调控线粒体自噬等过程,从而明显提升骨组织再生的能力,加快骨缺损的修复过程。这些创新方法为骨生长与损伤修复领域带来了新颖的治疗策略,也为开创新型治疗药物的开发提供了新的研究方向。有关线粒体靶向纳米材料见表5。"
| [1] CHEN W, ZHAO H, LI Y. Mitochondrial dynamics in health and disease: mechanisms and potential targets. Signal Transduct Target Ther. 2023;8:333. [2] 张华菁, 赵孟楠, 付琛, 等. 线粒体治疗在线粒体相关疾病治疗中的应用及展望[J]. 中国药理学通报,2018,34(4):459-463. [3] KÜHLBRANDT W. Structure and function of mitochondrial membrane protein complexes. BMC Biol. 2015;13:89. [4] XIAN H, LIOU YC. Functions of outer mitochondrial membrane proteins: mediating the crosstalk between mitochondrial dynamics and mitophagy. Cell Death Differ. 2021;28:827-842. [5] 黄梦玲, 张丽红, 顾昌宇, 等. 粒体相关内质网膜系链蛋白互作对脑缺血/再灌注的作用研究进展[J]. 生理学报,2024, 76(5):801-808. [6] 陈丽, 董君, 闫朝君, 等. 线粒体嵴重构及其调控[J]. 生理科学进展,2018,49(1): 3-13. [7] HERRMANN JM, RIEMER J. The intermembrane space of mitochondria. Antioxid Redox Signal. 2010;13:1341-1358. [8] HABICH M, SALSCHEIDER SL, RIEMER J. Cysteine residues in mitochondrial intermembrane space proteins: more than just import. Br J Pharmacol. 2019;176:514-531. [9] AL OJAIMI M, SALAH A, EL-HATTAB AW. Mitochondrial Fission and Fusion: Molecular Mechanisms, Biological Functions, and Related Disorders. Membranes. 2022;12(9): 893. [10] SCOTT I, YOULE RJ. Mitochondrial fission and fusion. Essays Biochem. 2010;47: 85. [11] ZHAO J, LIU T, JIN S, et al. Human MIEF1 recruits Drp1 to mitochondrial outer membranes and promotes mitochondrial fusion rather than fission. EMBO J. 2011; 30:2762-2778. [12] PALIKARAS K, LIONAKI E, TAVERNARAKIS N. Mechanisms of mitophagy in cellular homeostasis, physiology and pathology. Nat Cell Biol. 2018;20(9):1013-1022. [13] 常青, 王晓良. 细胞色素C、线粒体与凋亡[J]. 中国药理学通报,2003,19(3):241-244. [14] 蒋春笋, 肖伟明, 陈佺. 线粒体分裂、融合与细胞凋亡[J]. 生物物理学报,2007, 23(4):256-264. [15] CHAN DC. Dissecting mitochondrial fusion. Dev Cell. 2006;11(5):592-594. [16] GAO S, HU J. Mitochondrial Fusion: The Machineries In and Out. Trends Cell Biol. 2021;31(1):62-74. [17] VAN DER BLIEK AM, SHEN Q, KAWAJIRI S. Mechanisms of mitochondrial fission and fusion. Cold Spring Harb Perspect Biol. 2013;5(6):a011072. [18] CONSORTIUM P. Pan-cancer analysis of whole genomes. Nature. 2020; 578(7793):82-93. [19] 王天爽, 常杏芝. 线粒体融合蛋白2在骨骼肌线粒体稳态中的调节作用[J]. 国际儿科学杂志,2018,45(5):393-396. [20] ZHAO Y, GAO C, PAN X, et al. Emerging roles of mitochondria in animal regeneration. Cell Regen. 2023;12:14. [21] CAO Y, ZHENG J, WAN H, et al. A mitochondrial SCF-FBXL4 ubiquitin E3 ligase complex degrades BNIP3 and NIX to restrain mitophagy and prevent mitochondrial disease. EMBO J. 2023;42:e113033. [22] LI Y, ZHENG W, LU Y, et al. BNIP3L/NIX-mediated mitophagy: molecular mechanisms and implications for human disease. Cell Death Dis. 2021;13(1):1-11. [23] LI A, GAO M, LIU B, et al. Mitochondrial autophagy: molecular mechanisms and implications for cardiovascular disease. Cell Death Dis. 2022;13(5):444. [24] KUMAR SHARMA R, CHAFIK A, BERTOLIN G. Mitochondrial transport, partitioning, and quality control at the heart of cell proliferation and fate acquisition. American Journal of Physiology-Cell Physiology. 2022; 322(2):C311-C325. [25] WANG C, DU W, SU QP, et al. Dynamic tubulation of mitochondria drives mitochondrial network formation. Cell Res. 2015;25:1108-1120. [26] WON J, CHOI Y, YUN Y, et al. Biochemical Characterization of the Num1-Mdm36 Complex at the Mitochondria-Plasma Membrane Contact Site. Mol Cells. 2021; 44(4):207-213. [27] KITTLER J. Regulation of mitochondrial trafficking, function and quality control by the mitochondrial GTPases Miro1 and Miro2. Springer Plus. 2015;4(Suppl 1):L33. [28] MAIN EN, CRUZ TM, BOWLIN GL. Mitochondria as a therapeutic: a potential new frontier in driving the shift from tissue repair to regeneration. Regen Biomater. 2023:10:rbad070. [29] JOMOVA K, ALOMAR SY, ALWASEL SH, et al. Several lines of antioxidant defense against oxidative stress: antioxidant enzymes, nanomaterials with multiple enzyme-mimicking activities, and low-molecular-weight antioxidants. Arch Toxicol. 2024;98: 1323-1367. [30] 叶嘉鹏, 王建伟, 马勇, 等. 成骨过程中细胞内能量代谢研究进展[J]. 中国骨质疏松杂志,2021,27(12):1838-1843. [31] LI BH, XU CZ, LIU Y, et al. Mitochondrial quality control in human health and disease. Mil Med Res. 2024;11(1):32. [32] 薛蕊, 江小霞, 张宇, 等. 颌骨骨髓间充质干细胞成骨分化过程中线粒体功能变化的研究[J]. 解放军医学院学报,2024, 45(6):666-672. [33] JIANG G, ZHANG L, ZHENG S, et al. Cryo-EM structure of the mammalian ATP synthase tetramer bound with inhibitory protein IF1. Science. 2019;364(6445):1068-1075. [34] OFFICE FE. Retraction: Mfn2 overexpression attenuates cardio-cerebrovascular ischemia-reperfusion injury through mitochondrial fusion and activation of the AMPK/Sirt3 signaling. Front Cell Dev Biol. 2022;10: 1006496. [35] KIPNIS RJ, MELDOLESI JD. Calcium trafficking integrates endoplasmic reticulum function with mitochondrial bioenergetics. Biochim Biophys Acta. 2014;1843(10):2233-2239. [36] SUH J, LEE YS. The multifaceted roles of mitochondria in osteoblasts: from energy production to mitochondrial-derived vesicle secretion. J Bone Miner Res. 2024;39: 1205-1214. [37] 应岚, 卢中秋, 姚咏明. 线粒体融合蛋白2的结构与功能研究进展[J]. 生理科学进展,2016,47(2):108-112. [38] GIORGI G, MARCHI S, RIMESSI R, et al. The Mitochondrial Ca2+ Uptake and the Fine-Tuning of Aerobic Metabolism. Front Physiol. 2020;11:554904. [39] CHEN CT, SHIH YRV, KUO TK, et al. Coordinated changes of mitochondrial biogenesis and antioxidant enzymes during osteogenic differentiation of human mesenchymal stem cells. Stem Cells. 2008; 26(4):960-968. [40] NING K, LIU S, YANG B, et al. Update on the effects of energy metabolism in bone marrow mesenchymal stem cells differentiation. Mol Metab. 2022;58: 101450. [41] LIU J, BAO X, HUANG J, et al. TMEM135 maintains the equilibrium of osteogenesis and adipogenesis by regulating mitochondrial dynamics. Metab Clin Exp. 2024;152:155767. [42] JANDA J, NFONSAM V, CALIENES F, et al. Modulation of ROS levels in fibroblasts by altering mitochondria regulates the process of wound healing. Arch Dermatol Res. 2016; 308:239-248. [43] MISSIROLI S, GENOVESE I, PERRONE M, et al. The Role of Mitochondria in Inflammation: From Cancer to Neurodegenerative Disorders. J Clin Med. 2020;9(3):740. [44] KUZNETSOV AV, MARGREITER R, AUSSERLECHNER MJ, et al. The complex interplay between mitochondria, ROS and entire cellular metabolism. Antioxidants (Basel). 2022;11(10):1995. [45] WEBB M, SIDERIS DP, BIDDLE M. Modulation of mitochondrial dysfunction for treatment of disease. Bioorg Med Chem Lett. 2019; 29:1270-1277. [46] DERETIC V. Autophagy in inflammation, infection, and immunometabolism. Immunity. 2021;54(3):437-453. [47] 唐惠玲. 线粒体介导的细胞凋亡的研究进展[J]. 安徽医药,2012,16(11):1696-1699. [48] DABRAVOLSKI SA, NIKIFOROV NG, ZHURAVLEV AD, et al. The role of altered mitochondrial metabolism in thyroid cancer development and mitochondria-targeted thyroid cancer treatment. Int J Mol Sci. 2021;23(1):460. [49] SHAO CS, ZHOU XH, MIAO YH, et al. In situ observation of mitochondrial biogenesis as the early event of apoptosis. IScience. 2021; 24:103038. [50] DUAN C, KUANG L, XIANG X, et al. Drp1 regulates mitochondrial dysfunction and dysregulated metabolism in ischemic injury via Clec16a-, BAX-, and GSH- pathways. Cell Death Dis. 2020;11(4):251. [51] 卢志伟, 朱新永, 徐恩. 发动蛋白相关蛋白1介导的线粒体分裂与脑缺血[J]. 国际脑血管病杂志,2015,23(4):306-310. [52] 王钰钢, 范启明, 汤亭亭. AMPK信号通路对骨代谢的调节作用[J]. 中国骨质疏松杂志,2014,20(3):322-326. [53] CHEN X, JI X, LAO Z, et al. Role of YAP/TAZ in bone diseases: a transductor from mechanics to biology. J Orthop Transl. 2025; 51:13-23. [54] 韩明媛, 王振波. Hippo-YAP/TAZ通路在肿瘤免疫调节中的作用研究进展[J]. 中国医药科学,2021,11(22):49-52. [55] KIM J, KIM YH, KWON J, et al. YAP/TAZ regulates sprouting angiogenesis and vascular barrier maturation. J Clin Invest. 2017;127(9):3441-3461. [56] HUANG J, ZHANG J, ZHU X, et al. Emerging role and function of Hippo-YAP/TAZ signaling pathway in musculoskeletal disorders. Stem Cell Res Ther. 2024;15(1):386. [57] 王莹, 任欣欣, 赵铁军. Hippo/YAP途径在肿瘤细胞信号通路交互调控中的作用[J]. 生物医学,2023,13(1):93-102. [58] QIANG YW, HU B, CHEN Y, et al. Bortezomib induces osteoblast differentiation via Wnt-independent activation of beta-catenin/TCF signaling. Blood. 2009;113(18):4319-4330. [59] ZONG Y, LI H, LIAO P, et al. Mitochondrial dysfunction: mechanisms and advances in therapy. Signal Transduct Target Ther. 2024;9(1):124. [60] BOBKOVA NV, ZHDANOVA DY, BELOSLUDTSEVA NV, et al. Intranasal administration of mitochondria improves spatial memory in olfactory bulbectomized mice. Exp Biol Med. 2022;247(5):416-425. [61] LIAO HT, CHEN CT. Osteogenic potential: Comparison between bone marrow and adipose-derived mesenchymal stem cells. World J Stem Cells. 2014;6(3):288-295. [62] BORCHERDING N, BRESTOFF JR. The power and potential of mitochondria transfer. Nature. 2023;623(7986):283-291. [63] LI H, WANG C, HE T, et al. Mitochondrial Transfer from Bone Marrow Mesenchymal Stem Cells to Motor Neurons in Spinal Cord Injury Rats via Gap Junction. Theranostics. 2019;9(7):2017-2035. [64] GUO Y, CHI X, WANG Y, et al. Mitochondria transfer enhances proliferation, migration, and osteogenic differentiation of bone marrow mesenchymal stem cell and promotes bone defect healing. Stem Cell Res Ther. 2020;11(1):245. [65] XU C, LIU Z, CHEN X, et al. Bone tissue engineering scaffold materials: Fundamentals, advances, and challenges. Chin Chem Lett. 2024;35(2):109197. [66] FU H, CHENG J, HU L, et al. Mitochondria-targeting materials and therapies for regenerative engineering. Biomaterials. 2025;316:123023. [67] WANG S, LIU J, ZHOU L, et al. Research progresses on mitochondrial-targeted biomaterials for bone defect repair. Regen Biomat. 2024;11:rbae082. [68] 程婧, 魏林, 李苗. 线粒体动力学及线粒体自噬调控机制的研究进展[J]. 生理学报,2020,72(4):475-487. [69] LOSÓN OC, SONG Z, CHEN H, et al. Fis1, Mff, MiD49, and MiD51 mediate Drp1 recruitment in mitochondrial fission. Mol Biol Cell. 2013;24(5):659-667. [70] PASSMORE JB, CARMICHAEL RE, SCHRADER TA, et al. Mitochondrial fission factor (MFF) is a critical regulator of peroxisome maturation. Biochim Biophys Acta Mol Cell Res. 2020;1867:118709. [71] SAMANGOUEI P, CRESPO-AVILAN GE, CABRERA-FUENTES H, et al. MiD49 and MiD51: New mediators of mitochondrial fission and novel targets for cardioprotection. Condition Med. 2018;1(5):239-246. [72] CASSIDY-STONE A, CHIPUK JE, INGERMAN E, et al. Chemical inhibition of the mitochondrial division dynamin reveals its role in Bax/Bak-dependent mitochondrial outer membrane permeabilization. Dev Cell. 2008;14(2):193-204. [73] YAN J, LIU XH, HAN MZ, et al. Blockage of GSK3β-mediated Drp1 phosphorylation provides neuroprotection in neuronal and mouse models of Alzheimer’s disease. Neurobiol Aging. 2015;36(1):211-227. [74] DAUBERT MA, YOW E, DUNN G, et al. Novel Mitochondria-Targeting Peptide in Heart Failure Treatment: A Randomized, Placebo-Controlled Trial of Elamipretide. Circulation. Heart Fail. 2017;10(12):e004389. [75] WANG Z, GUO W, KUANG X, et al. Nanopreparations for mitochondria targeting drug delivery system: current strategies and future prospective. Asian J Pharm Sci, 2017;12:498-508. [76] HUANG L, SUN Z, SHEN Q, et al. Rational design of nanocarriers for mitochondria-targeted drug delivery. Chinese Chemical Letters, 2022;33(9):4146-4156. [77] CHEN Z, CHEN L, LYU TD, et al. Targeted mitochondrial nanomaterials in biomedicine: Advances in therapeutic strategies and imaging modalities. Acta Biomaterialia. 2024;186:1-29 |
| [1] | Zhang Xianxu, Ma Zhong, Liu Xin, Huang Lei, Shen Wenxiang, Luo Zhiqiang . Lumbar fusion combined with unilateral fixation for lumbar degenerative diseases: biomechanics, technical evolution, and clinical applications [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(9): 2334-2342. |
| [2] | Wu Yanting, Li Yu, Liao Jinfeng. Magnesium oxide nanoparticles regulate osteogenesis- and angiogenesis-related gene expressions to promote bone defect healing [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1885-1895. |
| [3] | Zou Rongji, Yu Fangfang, Wang Maolin, Jia Zhuopeng. Triptolide inhibits ferroptosis and improves cerebral ischemia-reperfusion injury in a rat model of cerebral artery occlusion/reperfusion [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 873-881. |
| [4] | Wang Yalei, Wang Xuezhi, Zhou Tao, Shen Xinxin, Fang Ding, Chen Hongliang. Effect of sacroiliac joint ankylosis on outcomes of L5/S1 transforminal lumbar interbody fusion and lumbar sagittal parameters [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 634-641. |
| [5] | Zhao Jingang, Liu Liping, Chen Jianwei, . Finite element analysis comparing lumbar fusion and artificial intervertebral disc replacement [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 553-560. |
| [6] | Abudusalamu·Tuoheti, Xiao Yang, Wang Yixi, Musitapa·Mijiti, Chen Qihao, Maimaitiming·Saiyiti, Guo Hailong, Paerhati·Rexiti. Effects of three internal fixation techniques on biomechanics of adjacent segment degeneration in lumbar interbody fusion [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 586-595. |
| [7] | Jia Yingao, Gao Shitao, Wang Fei. Application of 3D printed titanium cage cutting model in anterior cervical vertebrae subtotal decompression and bone graft fusion [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 604-611. |
| [8] | Li Zijing, Chen Xuwu, Ouyang Xinye, Wang Maoyuan. Mitophagy impairment mediated muscular atrophy: insights from the Drosophila model [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(23): 5897-5905. |
| [9] | Gao Jiabin, Li Tianqi, Xu Kun, Zhu Hanmin, Zhou Xi, Li Wei. Mitophagy regulates osteoclasts: a new perspective for osteoporosis treatment [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(23): 5982-5991. |
| [10] | Yang Zijiang, Guo Chenggen, Deng Ziao, Xue Xinxuan. Postbiotic targeting muscle aging: mechanistic insights and application prospects of urolithin A [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(22): 5804-5813. |
| [11] | Ji Long, Gong Guopan, Kong Xiangkui, Jin Pan, Chen Ziyang, Pu Rui. The role of exercise-regulated mitophagy in cardiovascular diseases [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(22): 5832-5843. |
| [12] | Huang Yushan, Wang Rongrong, Li Xiangmiao, Bai Jinzhu. Prostaglandin E1 pretreatment inhibits ferroptosis in endothelial cells in a rat model of spinal cord ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(22): 5716-5727. |
| [13] | Wang Liang, Zhang Xin, He Wei, Wang Jian. Clinical application and prospects of MXene-based materials for the repair of bone defects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(20): 5282-5294. |
| [14] | Tang Hao, Zhong Qian, Wu Honghan, Wu Hengpeng, Wu Xingkai, Wa Qingde. 3D-printed biodegradable polyester-based scaffolds in bone regeneration therapy [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(20): 5304-5311. |
| [15] | Yuan Qian, Zhang Hao, Pang Jie. Characterization and biological properties of naringin-loaded chitosan/beta-tricalcium phosphate scaffold [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 424-432. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||