Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (5): 1247-1259.doi: 10.12307/2026.011
Previous Articles Next Articles
Regeneration and repair of oral alveolar bone defects
Liu Xinyue, Li Chunnian, Li Yizhuo, Xu Shifang
- School of Stomatology and Hospital of Stomatology, Hebei Medical University (Key Laboratory of Stomatology of Hebei Province), Shijiazhuang 050017, Hebei Province, China
-
Received:2024-12-03Accepted:2025-01-24Online:2026-02-18Published:2025-06-26 -
Contact:Li Chunnian, Master, Chief physician, School of Stomatology and Hospital of Stomatology, Hebei Medical University (Key Laboratory of Stomatology of Hebei Province), Shijiazhuang 050017, Hebei Province, China -
About author:Liu Xinyue, Master, Physician, School of Stomatology and Hospital of Stomatology, Hebei Medical University (Key Laboratory of Stomatology of Hebei Province), Shijiazhuang 050017, Hebei Province, China -
Supported by:Key Research Program Project of Medical Science Subjects in Hebei Province, No. 20241080 (to LCN)
CLC Number:
Cite this article
Liu Xinyue, Li Chunnian, Li Yizhuo, Xu Shifang. Regeneration and repair of oral alveolar bone defects[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1247-1259.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
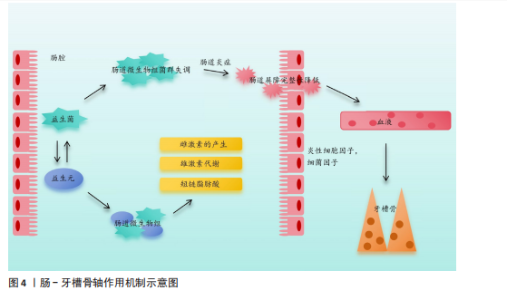
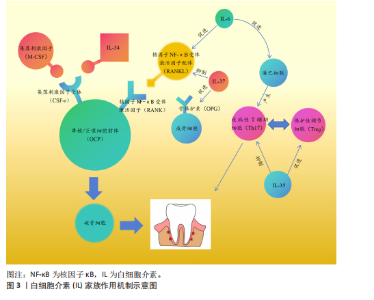
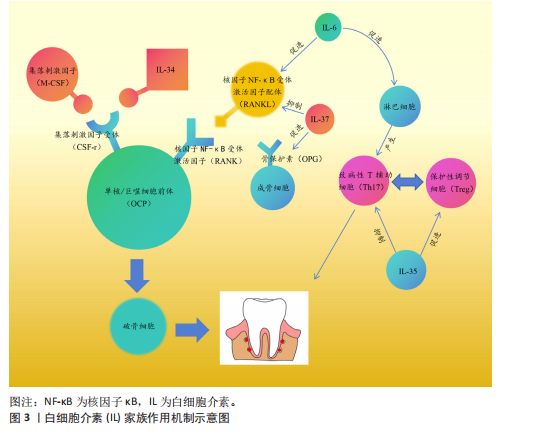
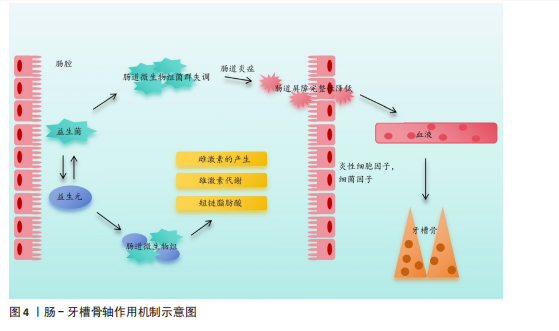
受体的配体结合可以促进单核/巨噬细胞前体向破骨细胞分化,白细胞介素34也可以与集落刺激因子1受体结合,从而达到同样的效果。研究发现,白细胞介素34蛋白可以增加酒石酸耐药酸性磷酸酶阳性破骨细胞的数量,促进牙周炎病变中的牙槽骨吸收[11]。白细胞介素37可以抑制核因子κB受体激活因子配体与其受体结合,增加骨保护素的表达,减少破骨细胞数量,对牙周炎小鼠的牙槽骨吸收具有抑制作用[12]。白细胞介素6主要通过免疫调节增强组织破坏的级联反应,而白细胞介素6受体可以阻断抑制白细胞介素6介导的促炎活性,减少辅助性T细胞17牙周反应,调节牙槽骨吸收和附着丧失[13]。另外,白细胞介素35可以通过调节牙周炎期间的辅助性T细胞17/调节性T细胞失衡来抑制牙槽骨吸收[14]。总而言之,白细胞介素家族通过影响破骨细胞和成骨细胞的数目来影响牙槽骨的破坏。 2.2.2 转录因子 转录因子FOXO1是胰岛β细胞团的调控因子,可以维持胰岛β细胞正常应对急剧的氧胁迫。研究发现FOXO1的缺乏可以抑制老年小鼠牙槽骨吸收,其中MCC950是NLRP3炎性小体的特异性抑制剂,在氧化应激下极大地促进了成骨细胞的分化[15]。缺氧诱导因子1是一种在低氧环境下被激活的转录因子,QI等[16]研究发现,缺氧诱导因子1受体可以通过血管生成素样蛋白4调节破骨细胞生成并参与牙周炎的骨吸收。信号传导及转录激活蛋白3介导的信号通路与白细胞介素6、白细胞介素23、白细胞介素17A等相关。研究发现,牙周炎患者上皮细胞和T细胞中的信号传导及转录激活蛋白3活化增加,因此,该因子的激活有可能与炎性骨缺损有关[17]。了解影响骨缺损的转录因子对临床药物研究具有指导意义,可以使用特定转录因子的靶向药物来抑制骨缺损,但目前很少有针对该方面的相关研究,其机制有待进一步探索。 2.2.3 信号通路 牙槽骨缺损与不同的信号通路有关,骨发生蛋白信号通路可以调控间充质干细胞在骨形成中的分化,其中骨发生蛋白2具有强大的成骨能力,是目前已知成骨能力最强的生长因子之一。有研究发现,含重组人骨发生蛋白2的活性骨颗粒具有促进牙槽骨再生功能[18]。核因子κB受体激活因子/核因子κB受体激活因子配体信号通路已被证实作用于牙槽骨缺损,以下介绍几种最新研究的信号通路:细胞因子信号传导抑制因子2在伴放线聚集杆菌诱导的牙槽骨丢失中起着重要的作用,细胞因子信号传导抑制因子2可以通过控制骨细胞的分化和活性以及牙周微环境中促炎细胞因子的可用性来调节伴放线聚集杆菌诱导的牙槽骨缺损,并且是新治疗策略的重要靶点[19];Notch信号通路参与不同形式状况下(如根尖周炎、牙周病和种植体周围炎)牙槽骨缺损的发病机制[20];沉默调节蛋白6被称为长寿基因,存在于细胞核中,它的主要职责是调节DNA的修复。LEE等[21]研究发现,沉默调节蛋白6激活可以减少破骨细胞数量,但是全身炎性细胞因子没有改变,这为抑制炎症、促进骨修复提供了新思路。 2.2.4 炎性小体 关于牙槽骨缺损机制的研究,一般认为炎性小体起着关键作用,它可以提高破骨细胞活性,或者通过降低成骨细胞的成骨能力、增殖和分化以及诱导成骨细胞凋亡来降低成骨细胞活性,导致破骨细胞分化和激活[22]。另外,炎性小体可以创造一种促炎环境,通过引起凋亡、M1样巨噬细胞极化、中性粒细胞浸润和适应性免疫反应来促进骨吸收,也可以通过影响牙周韧带细胞引起牙周炎,从而导致牙槽骨缺损[23]。NLRP3炎症小体是先天免疫系统的重要组成部分。CHEN等[24]的研究表明,NLRP3可以通过促进破骨细胞分化来调节结扎诱导的牙周炎牙槽骨缺损。 2.2.5 肠-牙槽骨轴 肠道微生物群通过肠-牙槽骨轴对骨骼健康有着一定影响。肠道病原体或代谢物可以通过循环系统转移到远处的牙槽骨并调节骨稳态[25-26],其影响机制如图4所示。 2.2.6 miRNA miRNA可以参与多种炎症病变,通过靶基因的转录后调控来调节骨代谢。研究发现,一些miRNA在炎性牙槽骨缺损的发展中起着重要作用[27]。REMY等[28]通过编码CaCO3纳米颗粒递送miR-"
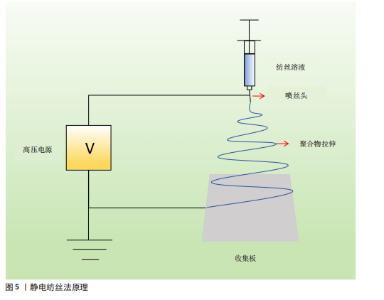
200c的质粒DNA来提高转染效率和miR-200c诱导的牙槽骨缺损骨形成,发现CaCO3纳米颗粒显著增强编码miR-200c质粒DNA的转染,无炎症作用,并且miR-200c表达持续。另外,雌激素水平也会影响牙槽骨的吸收与修复,女性怀孕期间雌激素水平升高会促进牙龈炎、牙周炎的发展,而绝经期雌激素水平降低会使颞下颌关节易变性并增加牙槽骨的吸收[29]。研究发现,内源性大麻素信号系统存在于骨骼中且参与调节骨骼稳态,而内源性大麻素系统中的大麻素受体2受体可以强烈影响小鼠牙槽骨的表型[30],因此,大麻素受体2受体有希望作为调节口腔骨表型的靶点在促进骨修复领域起到一定作用。以上机制主要针对炎症性牙槽骨缺损,根据以上分析,白细胞介素家族成员、转录因子、信号通路、炎性小体、miRNA等可以作为潜在的治疗靶点,其机制主要是破骨细胞产生增多与成骨细胞生成受到抑制。对于白细胞介素家族,可以通过促进白细胞介素37、白细胞介素35以及抑制白细胞介素34、白细胞介素6进而影响破骨细胞的数量,抑制牙槽骨的吸收。敲除具有促进骨吸收作用的转录因子(如缺氧诱导因子1α)、诱导沉默调节蛋白6的激活来抑制骨吸收。使用具有成骨功能的重组蛋白,如骨形态发生蛋白2,将其与其他成分植入缺损部位可以达到成骨的效果。 临床上,除了炎症引起的牙槽骨缺损外,创伤、肿瘤术后也会造成牙槽骨缺损,针对以上情况,控制炎症与感染具有重要意义。如果炎症控制不佳,极有可能造成后续炎症性牙槽骨缺损,而了解炎性骨缺损的机制对以上情况具有一定的意义。 2.3 用于牙槽骨再生的方法 临床上,多种因素都可能导致牙槽骨缺损,该病损为不可逆的,可能导致牙齿松动、脱落等。目前,研究促进牙槽骨缺损修复再生的方法仍然是热点问题,包括生物材料、细胞因子、中西药、干细胞等,当前研究则更倾向于将以上2种或2种以上方法结合应用,能更好地促进牙槽骨再生与修复。 2.3.1 生物材料 天然聚合物和合成聚合物是骨组织工程中生物医学材料开发不可或缺的一部分。天然聚合物包括壳聚糖、藻酸盐、明胶、糖胺聚糖、胶原蛋白、纤维蛋白和透明质酸,它们可以通过骨组织工程来促进骨修复[31]。 (1)纳米支架:随着材料学的发展,纳米支架材料被应用于临床,常见的纳米材料有羟基磷灰石、壳聚糖、钛网等,羟基磷灰石具有良好的生物相容性,能够诱导新骨形成,但是抗压强度较低且溶解性较差,植入体内后吸收较慢。壳聚糖具有可塑性、抗菌活性、低毒性等优点,但其机械性能差、在体内降解速度慢。钛网具有质量轻、强度高、稳定性好、无毒等优点,但由于它是金属材料,部分患者会有排斥反应。磷酸钙是天然来源的材料,含量高,但其溶解度较低,难以被机体吸收。将纳米材料应用于口腔组织工程有着巨大潜力[32]。 羟基磷灰石是人体和动物骨骼的主要无机成分。QIAO等[33]研究了糖基化纳米羟基磷灰石对牙周炎骨再生的影响,发现糖基化纳米羟基磷灰石可以促进结扎诱导的实验性牙周炎牙槽骨的修复和再生,这可能与调节巨噬细胞M2转化有关。 壳聚糖是一种天然高分子材料,可用于药物控释、组织工程等。有研究在柠檬酸盐接枝硫化铜纳米颗粒表面涂覆中孔氧化硅,通过静电相互作用在硫酸化壳聚糖表面进行修饰,以减轻炎症反应、促进牙槽骨再生[34]。HE等[35]开发了一种程序化的核壳纳米纤维,用来承载茶多酚和一种新型小分子脂联素受体激动剂,该系统可以作为缓释系统用来修复牙周炎相关的牙槽骨缺损。因此,在局部用药的缓释系统中,壳聚糖具有良好的前景。采用β-磷酸铁钙和5%镁掺杂硅酸钙制备的核壳型多孔支架,可以调控离子释放、促进牙槽骨缺损的修复,该材料具有良好的生物降解能力[36]。 静电纺丝技术也被应用于组织工程中,其原理如图5所示。HE等[37]通过聚ε-己内酯鞘和骨形态发生蛋白2/聚乙烯醇核的同轴静电纺丝工程化,通过表面定向外延结晶在鞘上产生环状纳米层状凸起,这种分层结构的纳米纤维支架可以承载各种因子及药物,达到缓释的效果。LIU等[38]采用静电纺丝法制备了临床应用抗生素负载的聚L-丙交酯-co-ε-己内酯/聚(L-丙交酯-co-ε-己内酯)(聚乳酸-羟基乙酸共聚物)纤维网,用于预防和重建牙周炎骨缺损,这种加入了抗生素的支架具有缓慢释放抗生素的优势且可以维持21 d左右,通过抗生素控制炎症,进而抑制牙槽骨的吸收。 钛网在牙槽骨缺损中有着广泛应"
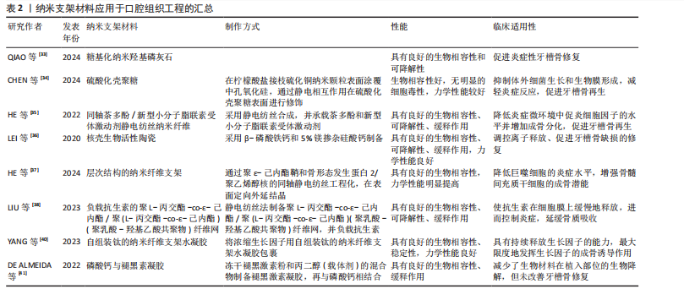
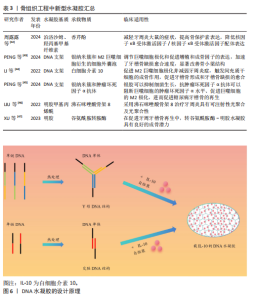
用,通过热处理和电场与流场协同处理技术可以提高钛网的力学性能[39]。利用钛网可以承载细胞因子,有研究将浓缩生长因子用自组装钛的纳米纤维支架水凝胶包裹,用于治疗牙槽骨缺损[40]。磷酸钙已被广泛用作骨替代品,磷酸钙与骨诱导生物活性分子的结合已被用作再生医学中的一种策略。褪黑激素与纳米结构磷酸钙均能改善牙槽骨修复,磷酸钙与褪黑激素凝胶的结合减少了生物材料在植入部位的生物降解,但未改善牙槽骨修复[41]。因此,纳米支架可以作为承载结构起到缓释的作用,而与其他因子(如药物或生长因子等)是否有协同作用仍然需要进一步的研究。 纳米支架材料应用于口腔组织工程的汇总,见表2。 (2)水凝胶:水凝胶具有可注射性、流动性能好等优点,在骨组织工程中得到广泛研究(表3)。温敏性水凝胶可以随着温度的不同呈现不同状态,这为局部用药提供了帮助。泊洛沙姆具有良好的生物相容性、溶解性、生物降解性,还具有低毒性、稳定性等优点,但在高浓度下可能对某些物质的溶解性较差。羟丙基甲基纤维素水凝胶具有良好的化学稳定性,但对某些药物比较敏感。DNA水凝胶具有高灵敏性、良好的化学稳定性,越来越多被应用于科研与临床。 以泊洛沙姆、羟丙基甲基纤维素为基质制备的温敏型水凝胶,可以用来负载各种药物,例如香芹酚,这种载药水凝胶可以减轻牙周炎大鼠的症状、提高骨保护素表达、降低核因子κB受体激活因子/核因子κB受体激活因子配体表达[42]。基于DNA水凝胶具有抗菌、抗炎、免疫调节和成骨特性,整合了银纳米簇和M2巨噬细胞衍生细胞外囊泡而制作的DNA水凝胶,可以调节巨噬细胞极化,促进细胞增殖和成骨因子的表达,加速牙槽骨缺损愈合速度,明显改善骨小梁结构[43]。LI等[44]采用物理交联法研究了一种可生物降解、抗炎和成骨的DNA水凝胶,其中包封着白细胞介素10,如图6所示,由于该水凝胶具有多孔显微结构,有利于白细胞介素10的包封,可以维持白细胞介素10的生物活性至少7 d。通过将银纳米簇和肿瘤坏死因子α抗体整合到DNA水凝胶中,借助于银胶抑制细菌生长的作用来促进糖尿病牙槽骨的再生[45]。 LIU等[46]研究了一种可注射的光聚合性沸石咪唑骨架8/明胶甲基丙"

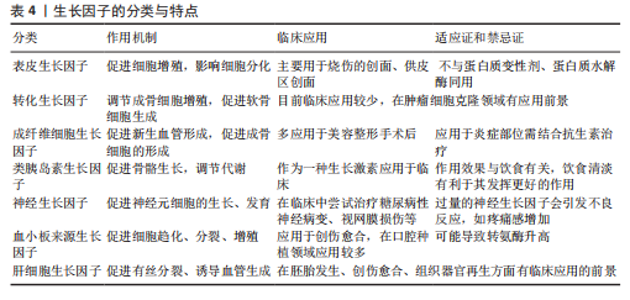
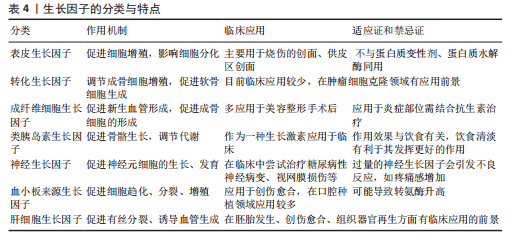
用;同时,这种复合水凝胶能促进大鼠牙槽骨再生。不同水凝胶的成分比例不同,其性能也不同[47]。 基于水凝胶的性能,制备的新型材料主要是通过将机械性能良好的支架与水凝胶结合,再负载药物或生长因子,既能达到缓释作用,又能提高力学性能、生物相容性,将材料降解速率控制在需要的范围。在制备和应用水凝胶进行实验时,首先应检验其性能,包括缓释时间、生物相容性、细胞毒性等,找出符合要求的最佳配置浓度。 (3)骨水泥:也叫骨粘接剂,主要用于治疗骨质疏松引起的骨折,在口腔领域也被用于牙槽骨的修复。脱蛋白牛骨矿物质是新骨生成及愈合牙槽骨周围血管生成的合适支架,在血管形成和骨形成中发挥关键作用[48]。在重建性牙周加速成骨正畸手术中应用时,与脱蛋白牛骨矿物质相比,磷酸钙水泥能够诱导良好的骨再生和骨重塑模式,同时伴有活跃的破骨细胞生成和优化的生物材料吸收[49]。 2.3.2 药物治疗 药物治疗牙槽骨缺损已相对成熟,科学家仍在在不断寻找更好的药物来治疗牙槽骨缺损。 (1)治疗慢性病的药物:研究发现,一些治疗慢性病的常规药物(如辛伐他汀、二甲双胍等)可能通过某些途径诱导细胞归巢,从而促进骨再生,因此,研究药物治疗对牙槽骨缺损修复再生的影响可以为临床治疗提供新思路。辛伐他汀是3-羟基-2-甲基戊二酰辅酶A还原酶的特异性竞争性抑制剂,最初开发用于降低血清胆固醇,现已显示具有抗炎和骨合成代谢特性。将辛伐他汀全身应用于高胆固醇血症牙周炎大鼠,发现辛伐他汀可以显著减轻大鼠牙槽骨丢失和核因子κB受体激活因子配体mRNA转录,这与辛伐他汀下调核因子κB表达有关[50]。对于没有系统性疾病的患者,辛伐他汀的全身应用就不再合适,因此,局部应用成为了研究难点。由于辛伐他汀的水溶性差且缺乏向骨性,将辛伐他汀局部输送到骨缺损区非常困难。CHEN等[51]研究了负载辛伐他汀制剂的焦磷酸化普卢兰尼克F127可注射水凝胶,该载药水凝胶具有优良的特性,并且具有一定的骨诱导潜力。 二甲双胍是一种安全、低成本、应用广泛的双胍类药物,已经被用于治疗2型糖尿病,以降低血糖水平[52]。二甲双胍联合二肽基肽酶4抑制剂可提高2型糖尿病和慢性牙周炎患者的牙槽骨密度,有效改善牙周临床和血清生化指标,减轻牙周炎症[53]。与辛伐他汀同理,二甲双胍全身应用仅适用于糖尿病患者,对于正常患者,局部应用更容易被接受。FANG等[54]制备了明胶/纳米羟基磷灰石/二甲双胍支架,将支架应用于大鼠牙槽骨缺损模型中,发现该支架表现出良好的生物相容性,可促进组织非特异性碱性磷酸酶、骨钙素、富含半胱氨酸的酸性分泌蛋白和α-1型胶原蛋白基因的表达,上调成骨蛋白的合成,包括骨连接蛋白、骨钙素和I型胶原蛋白,有助于直接成骨。 硝苯地平用于各种类型高血压的治疗,它在改善诱发牙周炎小鼠的骨质流失方面也具有良好效果[55]。由于此类药物具有治疗系统性疾病的作用,更适用于患有系统性疾病患者的牙槽骨缺损,但对于没有系统性疾病的患者,局部使用更有临床意义。 (2)抗炎作用的药物:吡非尼酮是一种具有广谱抗纤维化作用的吡啶酮类化合物,具有抗纤维化和抗炎作用。ZHANG等[56]研究发现,吡非尼酮治疗可显著抑制结扎引起的小鼠牙槽骨丢失,减少抗酒石酸酸性磷酸酶阳性破骨细胞和炎症细胞因子的表达。吡非尼酮还通过抑制核因子κB信号通路抑制核因子κB受体激活因子配体诱导的破骨细胞分化。 吡咯喹啉醌是一种营养物质,具有促进新陈代谢、提高免疫力、抗氧化、促进线粒体生长发育等作用。研究发现,吡咯喹啉醌通过提升抗氧化酶和Bmi-1蛋白表达、抑制细胞衰老相关蛋白的表达,从而抑制牙周组织的损伤[57]。 雷维霉素A是一种独特的破骨细胞活性抑制剂。MIYAZAWA等[58]制备了一种新型含雷维霉素A的软膏用于口腔局部非侵入性给药,发现其可抑制小鼠的牙槽骨吸收。这种现象可能依赖以下几种机制:雷帕霉素通过上调核因子E2相关因子2/谷氨酸-半胱氨酸连接酶催化亚基信号通路来抑制破骨细胞的形成,从而抑制细胞内氧化还原状态;雷帕霉素可以增加自噬体的形成,增加破骨细胞形成过程中的自噬通量;雷帕霉素的抗氧化作用受到自噬通量增加的调节[59]。纳帕霉素B4通过抑制破骨细胞活性抑制牙槽骨吸收[60]。 四辛基衣康酸酯是一种可渗透细胞的衣康酸盐衍生物,已被用于治疗炎症性疾病。XIN等[61]首次将四辛基衣康酸酯应用于牙周炎症领域,发现四辛基衣康酸酯治疗可改善牙周微环境中脂多糖诱导的炎症,还可以通过核因子E2相关因子2激活来缓解炎症和牙槽骨丢失。综上所述,四辛基衣康酸酯的局部给药具有抑制牙周破坏、改善局部炎症的作用。 3,4,5-三羟基苯甲酸(又称没食子酸)是一种抗炎药,可以预防牙周炎症。没食子酸可以降低牙周炎小鼠的破骨细胞数目、提高成骨细胞活性,进而降低牙槽骨丢失和胶原酶活性[62]。研究发现,硼酸可能通过抑制破骨细胞的形成而减少骨吸收,并且可以促进成骨细胞的形成[63]。TIAN等[64]开发了葡萄糖和过氧化氢双响应硼硅酸盐玻璃支架并负载茶素没食子酸酯,发现该结构释放的没食子酸可以通过促进自噬和减轻对自噬通量的抑制,直接调节巨噬细胞从M1向M2表型的转变;此外,没食子酸还可以通过减少干细胞中核因子κB的活化并恢复其免疫调节能力来间接调节巨噬细胞的极化表型,从而促进糖尿病牙槽骨缺损的修复。 生物链蛋白A是一种有机化合物,由红三叶和花生产生,具有抗炎和抗氧化作用。研究发现,生物链蛋白A可以抑制白细胞介素1β、肿瘤坏死因子α水平,降低白细胞酸性磷酸酶阳性细胞,增加骨钙素和核因子相关因子2表达,对大鼠实验性牙周炎有一定治疗作用[65]。 (3)其他药物:双膦酸盐可以通过降低破骨细胞的活性和数量来抑制骨吸收,但双膦酸盐可能是化学性颌骨坏死的诱因之一,所以在使用过程中要考虑多方面因素,谨慎用药[66]。唑来膦酸是经典的双膦酸盐类骨吸收抑制剂,将其应用于骨质疏松大鼠牙槽骨可以抑制牙槽骨吸收[67]。无机焦磷酸盐是羟基磷灰石晶体生长的强效生理抑制剂,而进行性强直蛋白和外核苷酸焦磷酸酶/磷酸二酯酶1可增加局部细胞外无机焦磷酸盐水平,从而抑制矿化;降低无机焦磷酸盐水平可以在一定程度上促进牙槽骨的再生,也可以促进牙骨质的再生[68]。GU等[69]通过交联将聚磷酸盐共价键合到胶原蛋白支架上,促进了大鼠牙槽骨缺损模型中的原位骨再生。 刺激新骨形成的药物——特立帕肽已被用于牙槽骨缺损的修复。特立帕肽是一种全身性骨合成代谢剂,可以刺激新骨形成,从而增加骨矿物质密度并降低骨折风险,可用于药物相关性颌骨坏死中的牙槽骨再生、严重的慢性牙周炎、种植牙和正畸牙齿移动,但相关研究仅停留在动物实验阶段,临床效果仍需要进一步验证[70]。 地昔帕明是一种具有免疫调节活性的三环抗抑郁药,将其应用于结扎引起的牙周炎大鼠可降低基质金属蛋白酶9活性,说明地昔帕明对骨重塑和炎症递质有调节作用[71]。 甲氨蝶呤是一种抗肿瘤药,在炎症微环境下可以促进人牙髓干细胞的成骨,可通过将巨噬细胞表型从炎性M1转化为抗炎性M2来抑制炎症并修复牙槽骨[72]。 PF-3845是一种神经类药物,能够显著减轻疼痛感、炎症及焦虑、抑郁症状。IHN等[73]发现PF-3845可以抑制破骨细胞的分化和破骨细胞特异性标志物的表达,PF-3845可抑制肌动蛋白环的形成和破骨细胞介导的骨吸收,该作用可能通过抑制快速加速纤维肉瘤、促分裂原活化蛋白激酶、细胞外信号调节激酶和核因子κB抑制剂的磷酸化来完成的;此外,PF-3845减少了实验性牙周炎大鼠牙槽骨的破坏。 益生菌也能影响牙槽骨骨质变化。牙周病导致牙槽骨丢失,可能受雌激素缺乏的影响,而这种机制与全身菌群失衡密切相关。LUCATELI等[74]研究发现,益生菌疗法可见卵巢切除大鼠的牙槽骨破坏和肠道通透性,增加雌二醇水平。另外,补充外源性的1,25-二羟基维生素D可以减轻结扎诱导的牙周炎牙槽骨吸收和牙龈炎症[75]。 2.3.3 中药促进骨修复 (1)黄酮类或苷类:黄岑苷是从双子叶唇形科植物黄岑的干燥根中提取分离出来的一种黄酮类化合物,常温下为淡黄色粉末,味苦,具有抗炎、抑菌、降胆固醇等作用。有研究以泊洛沙姆407和188混合制备的复合水凝胶作为热敏凝胶基质,负载黄岑苷,发现该水凝胶可促进牙周炎大鼠牙槽骨缺损的修复[76]。 橙皮苷和淫羊藿苷也具有促进骨生成作用,前者通过抑制破骨细胞的生成来促进成骨[77],后者通过促进成骨细胞的分化来促进成骨[78]。栀子苷可以缓解牙槽骨吸收,该作用可能是通过抑制丝氨酸/苏氨酸激酶表达来实现的[79]。但是,促成骨效果并不是随着药物浓度的增高而升高,例如,口服高浓度膳食橙皮苷会增加破骨细胞数量并促进炎症引起的牙槽骨缺损[77]。 槲皮素是一种单体黄酮类化合物,具有促再生、抗炎和免疫调节等多种药理作用[80]。在牙周炎微环境下,槲皮素可以恢复牙周膜干细胞的骨/血管生成能力、诱导巨噬细胞的免疫调节,发挥骨免疫调节作用;此外,槲皮素还可以通过抑制程序性细胞死亡因子4的表达和激活核因子κB信号传导途径发挥作用[81]。也有研究认为槲皮素具有活性氧清除能力,使M1型巨噬细胞向M2型巨噬细胞转化,而巨噬细胞的表型改变导致白细胞介素6和肿瘤坏死因子α的表达降低,最终降低白细胞介素17水平,加速牙槽骨再生[82]。槲皮素可以降低血糖值和血清晚期糖基化终末产物,对糖尿病牙周炎大鼠的牙周组织具有保护作用[83]。 另外,异巴豆素[84]、大豆异黄酮和棉子素对破骨细胞的分化和骨吸收起抑制作用[85-86],其机制与核因子κB受体激活剂配体有关。木犀草素是一种天然黄酮类化合物,它可以抑制牙龈卟啉单胞菌的浮游生长和生物膜形成。口服木犀草素可缓解牙龈卟啉单胞菌感染诱导的小鼠牙周炎的上颌牙槽骨吸收[87]。葛根素可以促进血清中白细胞介素4和白细胞介素10表达、降低白细胞介素6和干扰素γ表达水平,进而抑制牙槽骨的缺损、缓解牙周炎症[88]。 (2)生物碱类:小檗碱是一种活性植物生物碱,具有抗氧化、降血糖、降血脂等多种药理作用。MING等[89]建立了一种基于乳液静电纺丝的小檗碱纳米载体,这种纤维膜具有优良的理化性能和良好的生物安全性,可促进2型糖尿病大鼠的牙槽骨重建。QIN等[90]提出小檗碱处理的人骨髓间充质干细胞对牙槽骨再生有积极作用。 (3)皂苷类:皂苷类药物具有多种生物活性和药理作用。人参皂苷是中药人参的提取物,适用于心血管疾病、免疫力低下等疾病。人参皂苷Rb3是一种天然三萜皂苷,可通过细胞外信号调节激酶信号通路与核因子κB信号通路抑制核因子κB受体激活因子配体诱导的破骨细胞生成,进而抑制牙周炎大鼠牙槽骨的吸收[91]。薯蓣皂苷元是生产类固醇激素类药物的重要基础原料,其可以促进牙槽骨的形成,促进牙周的愈合[92]。 (4)酚类或挥发油类:姜黄素又称姜黄色素、酸性黄,是从姜科植物姜黄、芥末、咖喱、郁金香的根茎中提取的一种天然的酚类抗氧化剂,具有良好的抗炎和抗癌特性。研究发现,载有姜黄素的原位凝胶具有良好的生物活性,将其局部应用于牙周炎大鼠的牙周膜可以有效控制炎症、抑制牙槽骨吸收,这种机制可能与姜黄素能有效抑制牙周病原菌[93]、调节血液中核因子κB受体激活因子配体和白细胞介素1β标志物的水平有关[94]。其他酚类化合物也具有促进牙槽骨修复的功效,扁柏油酚是柏科植物中的精油成分之一,它可以通过增加成骨细胞如碱性磷酸酶的表达来促进牙槽骨的再生[95];原花青素可以通过抑制磷脂酰肌醇-3-激酶/蛋白激酶B/丝、苏氨酸激酶信号通路激活自噬,促进牙周韧带干细胞成骨、增强内源性牙槽骨再生[96]。 2.3.4 载有生长因子的材料 生长因子是一类调节微生物正常生长代谢所必需的有机物,其分类与特点如表4所示。研究者不断探索可以促进牙槽骨生成的生长因子,并研究其机制,以下将介绍几种最新研究的促进牙槽骨再生的生长因子。 血小板衍生生长因子:富血小板纤维蛋白作为一种自体血液制剂在牙槽骨再生中具有重要作用,其作用机制涉及Smad蛋白、细胞外调节蛋白激酶、磷酸肌醇3-激酶-蛋白激酶和Wnt/β-catenin等,目前也应用于口腔领域[97]。 成纤维细胞生长因子:成纤维细胞生长因子信号通路对颌面骨的发育至关重要。Klotho是一种Ⅰ型跨膜蛋白,是成纤维细胞生长因子受体复合物的重要组成部分。在Osx阳性间充质祖细胞中Klotho的缺失会导致生理和病理条件下的成骨显著减少。FAN等[98]研究表明Klotho存在于人类牙槽骨中,Klotho介导的信号传导是牙槽骨修复和再生的重要组成部分,它"

也可能是未来治疗的靶点。 转化生长因子:激活素a是转化生长因子β超家族的成员,参与调节细胞分化并促进组织愈合,然而,激活素a在牙槽骨中的生物学功能很少被研究。SUGII等[99]分析了激活素a诱导的前成骨细胞的生物学功能,发现激活素a可以促进前成骨细胞向成骨细胞分化,也可以促进Smad1/5/9的磷酸化,进而促进牙槽骨缺损组织的愈合。 神经生长因子:神经损伤后施万细胞的可塑性是周围神经及周围组织再生的重要特征。ZHANG等[100]通过特异性消融表达蛋白脂蛋白1的施万细胞发现,细胞可以迁移到损伤的牙槽骨缺损区并去分化为具有修复功能的细胞,这种机制可能与下游细胞外信号调节激酶/丝裂原活化蛋白激酶途径和磷酸肌醇3-激酶-蛋白激酶B途径上调细胞外间质受体和受体酪氨酸激酶信号有关。 白细胞介素:白细胞介素6是控制组织反应和牙槽骨组织重塑的关键细胞因子之一,对人类牙周膜干细胞的成骨分化具有有益作用,这种作用与Wnt通路有关[101]。 生长因子受体:Ephrins家族是受体酪氨酸激酶亚家族Eph配体,也是迄今所知的最大的生长因子受体家族,是血管发生的关键基因之一,参与骨稳态和成骨过程。体内研究发现,受体酪氨酸激酶亚家族Eph配体可以显著改善小梁骨体积和小梁厚度,有效促进牙槽骨缺损的修复[102]。有研究用低浓度甲基丙烯酸明胶水凝胶将过表达受体酪氨酸激酶亚家族Eph配体的牙髓干细胞生物打印成三维构建体,应用于牙槽骨再生取得了理想效果[103]。促红细胞生成素受体可以调节间充质干细胞功能,进而改善牙周炎引起的牙槽骨吸收[104]。 玻璃体连接蛋白衍生肽:是一种合成肽段。有研究将玻璃体连接蛋白衍生肽(100 μg/10 μL)通过球囊内注射局部施加牙周炎大鼠的牙龈沟中,发现其可以促进牙周膜细胞的成骨分化,抑制牙龈成纤维细胞炎症介质的产生,通过抑制核因子κB受体激活因子配体和白细胞介素17A产生来调节宿主免疫应答;此外,玻璃体连接蛋白衍生肽在体内可以促进成骨细胞生成,同时抑制破骨细胞生成,抑制核因子κB受体激活因子配体和白细胞介素17A的表达[105]。 2.3.5 干细胞 由于手术、创伤导致的牙槽骨缺损如果达到临界尺寸,机体不能自愈。对于牙槽骨缺损的修复,采用干细胞诱导组织再生是当前的研究热点。骨髓间充质干细胞具有多向分化潜能和免疫调节能力,已成为再生医学的有希望的候选细胞。作为颌骨组织工程的种子细胞,口腔来源干细胞已被广泛探索和使用,其中以牙周膜干细胞、牙髓干细胞研究为主。 骨髓间充质干细胞:局部缺氧微环境诱导移植的骨髓间充质干细胞分泌大量细胞外囊泡介导的调节蛋白,从而上调宿主干细胞的迁移功能,促进牙槽骨缺损再生,这可能与骨髓间充质干细胞的自噬作用有关[106]。骨髓间充质干细胞外囊泡已被公认为细胞间通讯的重要介质,研究发现它可以诱导骨质疏松症大鼠牙槽骨的骨再生[107]。 脂肪干细胞:含量丰富、易于制备。PUTRI等[108]建立5 mm×5 mm牙槽骨缺损大鼠,分别在骨缺损区植入自体骨、松质骨冻干移植物+脂肪干细胞和β-磷酸三钙+脂肪干细胞,发现外源性人脂肪干细胞增强了绒毛膜促性腺激素和β-痕迹蛋白加速成骨、骨传导和骨诱导的效果。 牙周膜干细胞:与经典的骨髓间充质干细胞和脂肪间充质干细胞相比,牙源性骨髓间充质干细胞具有较高的可塑性、可获得性和适用性。因此,它们被认为是再生药物的替代来源[109]。牙周膜干细胞和牙周膜干细胞来源外泌体可以明显促进骨髓间充质干细胞的成骨分化,这种机制可能与神经元来源孤儿受体1有关。神经元来源孤儿受体1可以激活转化生长因子β/Smad信号通路,通过靶向转化生长因子β受体正调节牙周膜干细胞向成骨细胞分化[110]。水凝胶可以递送牙周膜干细胞及其来源外泌体用于修复大鼠牙槽骨缺损[111]。ZONG等[112]开发了一种新型仿生牙周韧带移植物,该移植物由金纳米复合物预处理Ⅰ型胶原水凝胶支架与嵌入其中的人牙周韧带干细胞组成,这种结构可以模拟天然生理生态位,将仿生牙周韧带移植物移植于牙槽骨缺损部位具有一定促进骨再生的作用。 牙髓干细胞:是从牙髓中分离出来的一种成体干细胞,可分化为如神经细胞、脂肪细胞、成骨和软骨细胞、血管细胞和牙本质细胞等[113]。有研究表明,牙髓干细胞具有一定的成骨功能,为牙槽骨再生提供种子细胞[114]。 其他口腔来源干细胞:LIU等[115]采用3D打印聚D,L-乳酸对人类牙槽骨来源间叶干细胞进行干预,发现3D打印聚D,L-乳酸具有良好的细胞相容性,可促进人类牙槽骨来源间叶干细胞的增殖和分化。除此之外,Hertwig上皮根鞘及牙囊细胞均具有成骨作用[116-117],也有相关研究用他们来促进牙槽骨的再生。 通过以上分析可知,对于牙周膜干细胞促进骨再生的研究相对较多,并且有充分的证据证明牙周膜干细胞具有成骨作用,所以在今后的研究中要把侧重点放在干细胞与其他药物或材料的结合方面;牙髓干细胞等其他口腔来源干细胞仍需要更多的实验研究,因此具有一定的研究前景。 越来越多的研究证明干细胞在促进骨再生方面有着显著效果,干细胞来源决定着它的安全性,如果来源于自体移植,其免疫排斥的概率较小,因此,在选择干细胞时首选自体移植,其次选择同血缘异体移植,但要重视预防免疫排斥反应。目前,干细胞主要来源于胚胎和成体,来源于胚胎的干细胞存在伦理争议,在临床应用上具有一定的限制,所以,在干细胞的研究方面,不仅需要科研工作者遵循人道主义原则,将干细胞研究应用于对人类医学有益的方面,同时也需要相关法律法规,在保证合法的前提下给予更多的权利,保证医学事业的发展。"

| [1] AL MD, GHOSH YA, XIN H, et al. Hydrogel: A Potential Material for Bone Tissue Engineering Repairing the Segmental Mandibular Defect. Polymers (Basel). 2022;14(19):4186. [2] HOLLY D, KLEIN M, MAZREKU M, et al. Stem Cells and Their Derivatives-Implications for Alveolar Bone Regeneration: A Comprehensive Review. Int J Mol Sci. 2021;22(21):11746. [3] RANTA R, YLIPAAVALNIEMI P, ALTONEN M, et al. Transplantation of free tibial periosteal graft on alveolar bone defect in adult rabbit. Int J Oral Surg. 1981;10(2):122-127. [4] SUWA F, YANG L, OHTA Y, et al. Ability of hydroxyapatite-bone morphogenetic (corrected from morphologenetic) protein (BMP) complex to induce dentin formation in dogs. Okajimas Folia Anat Jpn. 1993;70(5):195-201. [5] YOSHIKAWA M, TODA T. Reconstruction of alveolar bone defect by calcium phosphate compounds. J Biomed Mater Res. 2000; 53(4):430-437. [6] ZHAO S, WANG Q, CHENG Z. [The induction of transforming growth factor-beta 1 in reparative process of mouse experimental alveolar bone defect]. Zhonghua Kou Qiang Yi Xue Za Zhi. 2000;35(4):292-293. [7] NAKAHARA T, NAKAMURA T, KOBAYASHI E, et al. Novel approach to regeneration of periodontal tissues based on in situ tissue engineering: effects of controlled release of basic fibroblast growth factor from a sandwich membrane. Tissue Eng. 2003;9(1):153-162. [8] WANG M, WENG YL, HU XJ, et al. [Repair of alveolar bone defect with tissue engineered bone: an experimental study of dogs]. Zhonghua Yi Xue Za Zhi. 2003;83(15):1339-1344. [9] KAWATA T, YUKI M, MIYAMOTO Y, et al. Guided bone regeneration to repair an alveolar bone defect in a girl whose cleft lip and palate had been repaired. Br J Oral Maxillofac Surg. 2005;43(5):420-422. [10] KIM SK, CHO TH, HAN JJ, et al. Comparative study of BMP-2 alone and combined with VEGF carried by hydrogel for maxillary alveolar bone regeneration. Tissue Eng Regen Med. 2016;13(2):171-181. [11] DUARTE C, YAMADA C, NGALA B, et al. Effects of IL-34 and anti-IL-34 neutralizing mAb on alveolar bone loss in a ligature-induced model of periodontitis. Mol Oral Microbiol. 2024;39(3):93-102. [12] LI L, LI J, LI S, et al. IL-37 alleviates alveolar bone resorption and inflammatory response through the NF-kappaB/NLRP3 signaling pathway in male mice with periodontitis. Arch Oral Biol. 2023; 147:105629. [13] APOLINARIO VG, APARECIDA RA, FIGUEIREDO CK, et al. Specific inhibition of IL-6 receptor attenuates inflammatory bone loss in experimental periodontitis. J Periodontol. 2021;92(10):1460-1469. [14] CAFFERATA EA, TERRAZA-AGUIRRE C, BARRERA R, et al. Interleukin-35 inhibits alveolar bone resorption by modulating the Th17/Treg imbalance during periodontitis. J Clin Periodontol. 2020;47(6):676-688. [15] WANG Z, ZHOU F, FENG X, et al. FoxO1/NLRP3 Inflammasome Promotes Age-Related Alveolar Bone Resorption. J Dent Res. 2023;102(8):919-928. [16] QI X, BIE M, JIANG R, et al. HIF-1alpha regulates osteoclastogenesis and alveolar bone resorption in periodontitis via ANGPTL4. Arch Oral Biol. 2023;153:105736. [17] ARCE M, RODRIGUEZ-PENA M, ESPINOZA-ARRUE J, et al. Increased STAT3 Activation in Periodontitis Drives Inflammatory Bone Loss. J Dent Res. 2023;102(12):1366-1375. [18] ZHANG D, SUN XC, WANG H, et al. Repair of alveolar cleft bone defects in rabbits by active bone particles containing modified rhBMP-2. Regen Med. 2021;16(9):833-846. [19] SANTOS M, CHAVES IM, QUEIROZ-JUNIOR CM, et al. SOCS2 regulates alveolar bone loss in Aggregatibacter actinomycetemcomitans-induced periodontal disease. Inflamm Res. 2023; 72(4):859-873. [20] JAKOVLJEVIC A, NIKOLIC N, PATERNO HL, et al. Involvement of the Notch signaling system in alveolar bone resorption. Jpn Dent Sci Rev. 2023;59:38-47. [21] LEE MJ, RYU HH, HWANG JW, et al. Sirt6 Activation Ameliorates Inflammatory Bone Loss in Ligature-Induced Periodontitis in Mice. Int J Mol Sci. 2023;24(13):10714. [22] USUI M, ONIZUKA S, SATO T, et al. Mechanism of alveolar bone destruction in periodontitis - Periodontal bacteria and inflammation. Jpn Dent Sci Rev. 2021;57: 201-208. [23] LI Y, LING J, JIANG Q. Inflammasomes in Alveolar Bone Loss. Front Immunol. 2021;12:691013. [24] CHEN Y, YANG Q, LV C, et al. NLRP3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 2021;54(2):e12973. [25] JIA X, YANG R, LI J, et al. Gut-Bone Axis: A Non-Negligible Contributor to Periodontitis. Front Cell Infect Microbiol. 2021;11:752708. [26] HAN N, LI X, DU J, et al. The impacts of oral and gut microbiota on alveolar bone loss in periodontitis. J Periodontal Res. 2023;58(6): 1139-1147. [27] YUAN Y, ZHANG H, HUANG H. microRNAs in inflammatory alveolar bone defect: A review. J Periodontal Res. 2021;56(2): 219-225. [28] REMY MT, DING Q, KRONGBARAMEE T, et al. Plasmid encoding miRNA-200c delivered by CaCO(3)-based nanoparticles enhances rat alveolar bone formation. Nanomedicine (Lond). 2022;17(19):1339-1354. [29] ROBINSON JL, JOHNSON PM, KISTER K, et al. Estrogen signaling impacts temporomandibular joint and periodontal disease pathology. Odontology. 2020; 108(2):153-165. [30] SETIAWAN M, JAGER A, DARATSIANOS N, et al. Impact of the endocannabinoid system on murine cranial and alveolar bone phenotype. Ann Anat. 2020;230: 151516. [31] LI N, WANG J, FENG G, et al. Advances in biomaterials for oral-maxillofacial bone regeneration: spotlight on periodontal and alveolar bone strategies. Regen Biomater. 2024;11:rbae78. [32] FUNDA G, TASCHIERI S, BRUNO GA, et al. Nanotechnology Scaffolds for Alveolar Bone Regeneration. Materials (Basel). 2020;13(1): 201. [33] QIAO D, CHENG S, SONG S, et al. Polarized M2 macrophages induced by glycosylated nano-hydroxyapatites activate bone regeneration in periodontitis therapy. J Clin Periodontol. 2024;51(8):1054-1065. [34] CHEN X, HUANG N, WANG D, et al. Sulfated Chitosan-Modified CuS Nanocluster: A Versatile Nanoformulation for Simultaneous Antibacterial and Bone Regenerative Therapy in Periodontitis. ACS Nano. 2024; 18(22):14312-14326. [35] HE Z, LIU S, LI Z, et al. Coaxial TP/APR electrospun nanofibers for programmed controlling inflammation and promoting bone regeneration in periodontitis-related alveolar bone defect models. Mater Today Bio. 2022;16:100438. [36] LEI L, WEI Y, WANG Z, et al. Core-Shell Bioactive Ceramic Robocasting: Tuning Component Distribution Beneficial for Highly Efficient Alveolar Bone Regeneration and Repair. ACS Biomater Sci Eng. 2020;6(4):2376-2387. [37] HE Z, LV JC, ZHENG ZL, et al. Hierarchically structured nanofibrous scaffolds spatiotemporally mediate the osteoimmune micro-environment and promote osteogenesis for periodontitis-related alveolar bone regeneration. Acta Biomater. 2024;189:323-336. [38] LIU Y, ZHAO Y, ZHU W, et al. Comprehensive reparative effects of bacteriostatic poly(L-lactide-co-glycolide)/poly(L-lactide-co-epsilon-caprolactone) electrospinning membrane on alveolar bone defects in progressive periodontitis. J Biomed Mater Res B Appl Biomater. 2023;111(3):513-525. [39] WANG L, WANG F, AYISEN S, et al. Enhancing the mechanical properties and surface morphology of individualized Ti-mesh fabricated through additive manufacturing for the treatment of alveolar bone defects. Front Bioeng Biotechnol. 2023;11:1284359. [40] YANG R, CHEN J, WANG D, et al. Self-Assembling Peptide RADA16 Nanofiber Scaffold Hydrogel-Wrapped Concentrated Growth Factors in Osteogenesis of MC3T3. J Funct Biomater. 2023;14(5):260. [41] DE ALMEIDA CD, SARTORETTO SC, ALVES A, et al. Does Melatonin Associated with Nanostructured Calcium Phosphate Improve Alveolar Bone Repair? Medicina (Kaunas). 2022;58(12):1720. [42] 周露露,滕念,高甜甜,等.香芹酚水凝胶对牙周炎大鼠牙槽骨保护作用研究[J].华西口腔医学杂志,2024,42(5):593-608. [43] PENG G, LI W, PENG L, et al. Multifunctional DNA-Based Hydrogel Promotes Diabetic Alveolar Bone Defect Reconstruction. Small. 2024;20(10):e2305594. [44] LI W, WANG C, WANG Z, et al. Physically Cross-Linked DNA Hydrogel-Based Sustained Cytokine Delivery for In Situ Diabetic Alveolar Bone Rebuilding. ACS Appl Mater Interfaces. 2022;14(22):25173-25182. [45] PENG L, LI W, PENG G, et al. Antibacterial and DNA-Based Hydrogels In Situ Block TNF-alpha to Promote Diabetic Alveolar Bone Rebuilding. Macromol Rapid Commun. 2024;45(5):e2300559. [46] LIU Y, LI T, SUN M, et al. ZIF-8 modified multifunctional injectable photopolymerizable GelMA hydrogel for the treatment of periodontitis. Acta Biomater. 2022;146:37-48. [47] XU X, LI X, QIU S, et al. Concentration Selection of Biofriendly Enzyme-Modified Gelatin Hydrogels for Periodontal Bone Regeneration. ACS Biomater Sci Eng. 2023; 9(7):4341-4355. [48] OGASAWARA K, TO M, LIU YH, et al. Application of deproteinized bovine bone mineral as proangiogenic scaffold for alveolar bone formation in beagle dogs. Microscopy (Oxf). 2021;70(4):382-387. [49] SHEN H, ZHUANG Y, ZHANG C, et al. Osteoclast-Driven Osteogenesis, Bone Remodeling and Biomaterial Resorption: A New Profile of BMP2-CPC-Induced Alveolar Bone Regeneration. Int J Mol Sci. 2022;23(20):12204. [50] GAO X, ZHOU J, BIAN Y, et al. Simvastatin intervention mitigates hypercholesterolemia-induced alveolar bone resorption in rats. Exp Ther Med. 2021;21(6):628. [51] CHEN N, REN R, WEI X, et al. Thermoresponsive Hydrogel-Based Local Delivery of Simvastatin for the Treatment of Periodontitis. Mol Pharm. 2021;18(5):1992-2003. [52] LV Z, GUO Y. Metformin and Its Benefits for Various Diseases. Front Endocrinol (Lausanne). 2020;11:191. [53] LIU K, AHEMAITI A, TUERNISAGULI K, et al. [Effect of metformin combined with DPP-4 inhibitor on alveolar bone density in patients with type 2 diabetes mellitus and chronic periodontitis]. Shanghai Kou Qiang Yi Xue. 2023;32(4):410-416. [54] FANG CH, SUN CK, LIN YW, et al. Metformin-Incorporated Gelatin/Nano-Hydroxyapatite Scaffolds Promotes Bone Regeneration in Critical Size Rat Alveolar Bone Defect Model. Int J Mol Sci. 2022;23(1):558. [55] LEE Y, LEE JE, LEE AR, et al. Nifedipine attenuates alveolar bone destruction and improves trabecular microarchitectures in mice with experimental periodontitis. Naunyn Schmiedebergs Arch Pharmacol. 2023;396(12):3627-3633. [56] ZHANG Z, SONG J, KWON SH, et al. Pirfenidone Inhibits Alveolar Bone Loss in Ligature-Induced Periodontitis by Suppressing the NF-kappaB Signaling Pathway in Mice. Int J Mol Sci. 2023; 24(10):8682. [57] TANG G, MA H, LIU S, et al. Pyrroloquinoline quinone inhibits ligature-induced alveolar bone loss through regulation of redox balance and cell senescence. Am J Transl Res. 2022;14(1):582-593. [58] MIYAZAWA K, ASANO Y, TABUCHI M, et al. Local administration of ReveromycinA ointment suppressed alveolar bone loss in mice. J Pharmacol Sci. 2021;147(1):40-47. [59] FENG C, LIU Y, ZHANG BY, et al. Rapamycin Inhibits Osteoclastogenesis and Prevents LPS-Induced Alveolar Bone Loss by Oxidative Stress Suppression. ACS Omega. 2023;8(23):20739-20754. [60] KIM JA, LIM S, KIM GJ, et al. Napyradiomycin B4 Suppresses RANKL-Induced Osteoclastogenesis and Prevents Alveolar Bone Destruction in Experimental Periodontitis. ACS Pharmacol Transl Sci. 2024; 7(4):1023-1031. [61] XIN L, ZHOU F, ZHANG C, et al. Four-Octyl itaconate ameliorates periodontal destruction via Nrf2-dependent antioxidant system. Int J Oral Sci. 2022;14(1):27. [62] KARATAS O, GEVREK F. 3,4,5-Trihydroxybenzoic Acid Attenuates Ligature-Induced Periodontal Disease in Wistar Rats. Antiinflamm Antiallergy Agents Med Chem. 2021;20(1):51-60. [63] SHALEHIN N, HOSOYA A, TAKEBE H, et al. Boric acid inhibits alveolar bone loss in rat experimental periodontitis through diminished bone resorption and enhanced osteoblast formation. J Dent Sci. 2020;15(4):437-444. [64] TIAN P, ZHAO L, KIM J, et al. Dual stimulus responsive borosilicate glass (BSG) scaffolds promote diabetic alveolar bone defectsrepair by modulating macrophage phenotype. Bioact Mater. 2023;26:231-248. [65] ZHANG S, NIU Y, YANG Z, et al. Biochanin A alleviates gingival inflammation and alveolar bone loss in rats with experimental periodontitis. Exp Ther Med. 2020;20(6):251. [66] BHAT SR, SHWETHA R, BOLOOR VA, et al. Bone Sparing Effects of Bisphosphonates in Cyclosporine-induced Alveolar Bone Loss: An Animal Study. J Pharm Bioallied Sci. 2020;12(Suppl 1):S560-S563. [67] 霍花,刘官娟,宋娜,等.唑来膦酸干预去势大鼠牙槽骨骨代谢及核苷酸结合寡聚化结构域样受体蛋白3炎症小体表达的变化[J].中国组织工程研究,2022, 26(17):2660-2666. [68] NAGASAKI A, NAGASAKI K, CHU EY, et al. Ablation of Pyrophosphate Regulators Promotes Periodontal Regeneration. J Dent Res. 2021;100(6):639-647. [69] GU JT, JIAO K, LI J, et al. Polyphosphate-crosslinked collagen scaffolds for hemostasis and alveolar bone regeneration after tooth extraction. Bioact Mater. 2022;15:68-81. [70] AGNIHOTRI R, GAUR S. Applications of Teriparatide for Alveolar Bone Regeneration: A Systematic Review. J Int Soc Prev Community Dent. 2021;11(6):639-643. [71] BRANCO-DE-ALMEIDA LS, FRANCO G, CASTRO ML, et al. Protective effects of desipramine on alveolar bone in experimental periodontitis. J Periodontol. 2020;91(12):1694-1703. [72] CHEN H, LIU N, HU S, et al. Yeast beta-glucan-based nanoparticles loading methotrexate promotes osteogenesis of hDPSCs and periodontal bone regeneration under the inflammatory microenvironment. Carbohydr Polym. 2024;342:122401. [73] IHN HJ, KIM YS, LIM S, et al. PF-3845, a Fatty Acid Amide Hydrolase Inhibitor, Directly Suppresses Osteoclastogenesis through ERK and NF-kappaB Pathways In Vitro and Alveolar Bone Loss In Vivo. Int J Mol Sci. 2021;22(4):1915. [74] LUCATELI RL, SILVA P, SALVADOR SL, et al. Probiotics enhance alveolar bone microarchitecture, intestinal morphology and estradiol levels in osteoporotic animals. J Periodontal Res. 2024;59(4):758-770. [75] GONG A, LIU Y, XU F, et al. Role of 1,25-dihydroxyvitamin D in alleviating alveolar bone loss and gingival inflammation in ligature-induced periodontitis. Am J Transl Res. 2022;14(5): 3079-3091. [76] DING Y, WANG Y, LI J, et al. Microemulsion-thermosensitive gel composites as in situ-forming drug reservoir for periodontitis tissue repair through alveolar bone and collagen regeneration strategy. Pharm Dev Technol. 2023;28(1):30-39. [77] GONCALVES VP, MUSSKOPF ML, RIVERA-CONCEPCION A, et al. Systemic Dietary Hesperidin Modulation of Osteoclastogenesis, Bone Homeostasis and Periodontal Disease in Mice. Int J Mol Sci. 2022;23(13):7100. [78] XU H, ZHOU S, QU R, et al. Icariin prevents oestrogen deficiency-induced alveolar bone loss through promoting osteogenesis via STAT3. Cell Prolif. 2020;53(2):e12743. [79] 山玲莉,王振宇,高永红.栀子苷对牙周病大鼠GSK3β/Nrf2通路及牙槽骨丢失的影响[J].中国老年学杂志,2023,43(7): 1711-1715. [80] TASKAN MM, GEVREK F. Quercetin Decreased Alveolar Bone Loss and Apoptosis in Experimentally Induced Periodontitis Model in Wistar Rats. Antiinflamm Antiallergy Agents Med Chem. 2020;19(4):436-448. [81] YANG SY, HU Y, ZHAO R, et al. Quercetin-loaded mesoporous nano-delivery system remodels osteoimmune microenvironment to regenerate alveolar bone in periodontitis via the miR-21a-5p/PDCD4/NF-kappaB pathway. J Nanobiotechnology. 2024; 22(1):94. [82] LI J, LI M, ZHANG C, et al. Active targeting microemulsion-based thermosensitive hydrogel against periodontitis by reconstructing Th17/Treg homeostasis via regulating ROS-macrophages polarization cascade. Int J Pharm. 2024;659:124263. [83] 郭晓雨,李淑娟,梁向阳,等.槲皮素脂质体对糖尿病牙周炎大鼠牙周组织的作用及血清AGEs的影响[J].口腔医学研究, 2021,37(7):628-631. [84] LI T, DU Y, YAO H, et al. Isobavachin attenuates osteoclastogenesis and periodontitis-induced bone loss by inhibiting cellular iron accumulation and mitochondrial biogenesis. Biochem Pharmacol. 2024;224: 116202. [85] 代喆颖,郭怡,刘阳,等.大豆异黄酮抑制Slit2/MAPK信号通路对牙周炎大鼠牙槽骨吸收和炎症反应的影响[J].中国免疫学杂志,2024,40(6):1131-1136. [86] SEOK J, KIM MO, KIM SH, et al. Flavonoid gossypetin protects alveolar bone and limits inflammation in ligature-induced periodontitis in mice. J Periodontol. 2024. doi: 10.1002/JPER.23-0541. [87] KARIU T, HAMADA N, LAKSHMYYA K. Luteolin inhibits Porphyromonas gingivalis growth and alleviates alveolar bone destruction in experimental murine periodontitis. Biosci Biotechnol Biochem. 2023;88(1):37-43. [88] 万妮,莫礼文,詹乐,等.葛根素对实验性大鼠牙周炎炎症反应和骨吸收的影响[J].海南医学院学报,2023,29(8):575-580. [89] MING Y, HE X, ZHAO Z, et al. Nanocarrier-Assisted Delivery of Berberine Promotes Diabetic Alveolar Bone Regeneration by Scavenging ROS and Improving Mitochondrial Dysfunction. Int J Nanomedicine. 2024;19:10263-10282. [90] QIN Z, HAN Y, DU Y, et al. Bioactive materials from berberine-treated human bone marrow mesenchymal stem cells promote alveolar bone regeneration by regulating macrophage polarization. Sci China Life Sci. 2024;67(5):1010-1026. [91] SUN M, JI Y, ZHOU S, et al. Ginsenoside Rb3 inhibits osteoclastogenesis via ERK/NF-kappaB signaling pathway in vitro and in vivo. Oral Dis. 2023;29(8):3460-3471. [92] KIZILDAGA A, ALPANB AL, OZDEDEC M, et al. Therapeutic effects of diosgenin on alveolar bone loss and apoptosis in diabetic rats with experimental periodontitis. Iran J Basic Med Sci. 2023;26(7):785-790. [93] LIU C, CHEN Y, BAI H, et al. Characterization and application of in situ curcumin/ZNP hydrogels for periodontitis treatment. BMC Oral Health. 2024;24(1):395. [94] SHA AM, GARIB BT, AZEEZ SH, et al. Effects of curcumin gel on osteoclastogenic bone markers in experimental periodontitis and alveolar bone loss in wistar rats. J Dent Sci. 2021;16(3):905-914. [95] KIM TY, KIM EN, JEONG GS. Therapeutic Effects of Hinokitiol through Regulating the SIRT1/NOX4 against Ligature-Induced Experimental Periodontitis. Antioxidants (Basel). 2024;13(5): 550. [96] LIU Z, LI Q, WANG X, et al. Proanthocyanidin enhances the endogenous regeneration of alveolar bone by elevating the autophagy of PDLSCs. J Periodontal Res. 2023;58(6):1300-1314. [97] LIU M, LIU Y, LUO F. The role and mechanism of platelet-rich fibrin in alveolar bone regeneration. Biomed Pharmacother. 2023; 168:115795. [98] FAN Y, CUI C, ROSEN CJ, et al. Klotho in Osx(+)-mesenchymal progenitors exerts pro-osteogenic and anti-inflammatory effects during mandibular alveolar bone formation and repair. Signal Transduct Target Ther. 2022; 7(1):155. [99] SUGII H, ALBOUGHA MS, ADACHI O, et al. Activin A Promotes Osteoblastic Differentiation of Human Preosteoblasts through the ALK1-Smad1/5/9 Pathway. Int J Mol Sci. 2021; 22(24):13491. [100] ZHANG X, XIONG Q, LIN W, et al. Schwann Cells Contribute to Alveolar Bone Regeneration by Promoting Cell Proliferation. J Bone Miner Res. 2023;38(1):119-130. [101] PURWANINGRUM M, GIACHELLI CM, OSATHANON T, et al. Dissecting specific Wnt components governing osteogenic differentiation potential by human periodontal ligament stem cells through interleukin-6. Sci Rep. 2023;13(1):9055. [102] WANG W, YUAN C, GENG T, et al. EphrinB2 overexpression enhances osteogenic differentiation of dental pulp stem cells partially through ephrinB2-mediated reverse signaling. Stem Cell Res Ther. 2020; 11(1):40. [103] WANG W, ZHU Y, LI J, et al. Bioprinting EphrinB2-Modified Dental Pulp Stem Cells with Enhanced Osteogenic Capacity for Alveolar Bone Engineering. Tissue Eng Part A. 2023;29(7-8):244-255. [104] ZAKARIA MF, SONODA S, KATO H, et al. Erythropoietin receptor signal is crucial for periodontal ligament stem cell-based tissue reconstruction in periodontal disease. Sci Rep. 2024;14(1):6719. [105] LEE J, MIN HK, PARK CY, et al. A vitronectin-derived peptide prevents and restores alveolar bone loss by modulating bone re-modelling and expression of RANKL and IL-17A. J Clin Periodontol. 2022;49(8):799-813. [106] LIU Y, ZHANG Z, MA C, et al. Transplanted MSCs promote alveolar bone repair via hypoxia-induced extracellular vesicle secretion. Oral Dis. 2024;30(8):5221-5231. [107] SEDIK AS, KAWANA KY, KOURA AS, et al. Biological effect of bone marrow mesenchymal stem cell- derived extracellular vesicles on the structure of alveolar bone in rats with glucocorticoid-induced osteoporosis. BMC Musculoskelet Disord. 2023;24(1):205. [108] PUTRI IL, FATCHIYAH, PRAMONO C, et al. Alveolar Repair Using Cancellous Bone and Beta Tricalcium Phosphate Seeded With Adipose-Derived Stem Cell. Cleft Palate Craniofac J. 2024;61(4):555-565. [109] QU G, LI Y, CHEN L, et al. Comparison of Osteogenic Differentiation Potential of Human Dental-Derived Stem Cells Isolated from Dental Pulp, Periodontal Ligament, Dental Follicle, and Alveolar Bone. Stem Cells Int. 2021;2021:6631905. [110] WU Y, JING H, LI Y, et al. NOR1 promotes the osteoblastic differentiation of human periodontal ligament stem cells via TGF-beta signaling pathway. Cell Mol Life Sci. 2024;81(1):338. [111] ZHAO Y, GONG Y, LIU X, et al. The Experimental Study of Periodontal Ligament Stem Cells Derived Exosomes with Hydrogel Accelerating Bone Regeneration on Alveolar Bone Defect. Pharmaceutics. 2022;14(10):2189. [112] ZONG C, VAN HOLM W, BRONCKAERS A, et al. Biomimetic Periodontal Ligament Transplantation Activated by Gold Nanoparticles Protects Alveolar Bone. Adv Healthc Mater. 2023;12(15):e2300328. [113] SHI X, MAO J, LIU Y. Pulp stem cells derived from human permanent and deciduous teeth: Biological characteristics and therapeutic applications. Stem Cells Transl Med. 2020;9(4): 445-464. [114] ZHAO J, ZHOU YH, ZHAO YQ, et al. Oral cavity-derived stem cells and preclinical models of jaw-bone defects for bone tissue engineering. Stem Cell Res Ther. 2023;14(1):39. [115] LIU X, LV S, KAN W, et al. Human alveolar bone-derived mesenchymal stem cell cultivation on a 3D-printed PDLLA scaffold for bone formation. Br J Oral Maxillofac Surg. 2023;61(8):527-533. [116] TANG H, BI F, CHEN G, et al. 3D-bioprinted Recombination Structure of Hertwig’s Epithelial Root Sheath Cells and Dental Papilla Cells for Alveolar Bone Regeneration. Int J Bioprint. 2022;8(3):512. [117] YI G, ZHANG S, MA Y, et al. Matrix vesicles from dental follicle cells improve alveolar bone regeneration via activation of the PLC/PKC/MAPK pathway. Stem Cell Res Ther. 2022;13(1):41. |
| [1] | Sun Yajie, Zhao Xinchen, Bo Shuangling. Spatiotemporal expression of bone morphologic protein 7 in mouse kidney development [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1156-1161. |
| [2] | Li Haojing, Wang Xin, Song Chenglin, Zhang Shengnan, Chen Yunxin. Therapeutic efficacy of extracorporeal shock wave therapy in the upper trapezius muscle area combined with exercise control training in patients with chronic non-specific neck pain [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1162-1170. |
| [3] | Liu Yu, Lei Senlin, Zhou Jintao, Liu Hui, Li Xianhui. Mechanisms by which aerobic and resistance exercises improve obesity-related cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1171-1183. |
| [4] | Yu Huifen, Mo Licun, Cheng Leping. The position and role of 5-hydroxytryptamine in the repair of tissue injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1196-1206. |
| [5] | Wang Zhengye, Liu Wanlin, Zhao Zhenqun. Advance in the mechanisms underlying miRNAs in steroid-induced osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1207-1214. |
| [6] | Bu Yangyang, Ning Xinli, Zhao Chen. Intra-articular injections for the treatment of osteoarthritis of the temporomandibular joint: different drugs with multiple combined treatment options [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1215-1224. |
| [7] | Wen Fan, Xiang Yang, Zhu Huan, Tuo Yanfang, Li Feng. Exercise improves microvascular function in patients with type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1225-1235. |
| [8] | Leng Xiaoxuan, Zhao Yuxin, Liu Xihua. Effects of different neuromodulatory stimulation modalities on non-motor symptoms in Parkinson’s patients: a network meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1282-1293. |
| [9] | Wen Xiaolong, Weng Xiquan, Feng Yao, Cao Wenyan, Liu Yuqian, Wang Haitao. Effects of inflammation on serum hepcidin and iron metabolism related parameters in patients with type 2 diabetes mellitus: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1294-1301. |
| [10] | Yang Zeyu, Zhi Liang, Wang Jia, Zhang Jingyi, Zhang Qingfang, Wang Yulong, Long Jianjun. A visualized analysis of research hotspots in high-frequency repetitive transcranial magnetic stimulation from the macroscopic perspective [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1320-1330. |
| [11] | Yang Zhijie, Zhao Rui, Yang Haolin, Li Xiaoyun, Li Yangbo, Huang Jiachun, Lin Yanping, Wan Lei, HuangHongxing. Postmenopausal osteoporosis: predictive values of muscle mass, grip strength, and appendicular skeletal muscle index [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1073-1080. |
| [12] | Yin Yongcheng, Zhao Xiangrui, Yang Zhijie, Li Zheng, Li Fang, Ning Bin. Effect and mechanism of peroxiredoxin 1 in microglial inflammation after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1106-1113. |
| [13] | Zhang Jiuxuan, Zhang Jinnan, Sui Xiaofan, Pei Xiaxia, Wei Jianhong, Su Qiang, Li Tian. Effects of ammonia poisoning on cognitive behavior and hippocampal synaptic damage in mice [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1122-1128. |
| [14] | Chen Yixian, Chen Chen, Lu Liheng, Tang Jinpeng, Yu Xiaowei. Triptolide in the treatment of osteoarthritis: network pharmacology analysis and animal model validation [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 805-815. |
| [15] | Yan Chengbo, Luo Qiuchi, Fan Jiabing, Gu Yeting, Deng Qian, Zhang Junmei. Effect of type 2 diabetes mellitus on orthodontic tooth movement and bone microstructure parameters on the tension side in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 824-831. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||