Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (10): 2141-2150.doi: 10.12307/2025.404
Previous Articles Next Articles
Combination of effective ingredients of traditional Chinese medicine and bone tissue engineering materials for bone repair
Wu Yaokun, Liu Chenglin, Fu Jiahao, Song Wei, Chen Hao, Xi Hongzhong, Liu Xin, Du Bin, Sun Guangquan
- Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China
-
Received:2024-02-08Accepted:2024-04-03Online:2025-04-08Published:2024-08-23 -
Contact:Corresponding author: Sun Guangquan, MD, Associate chief physician, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China Co-corresponding author: Du Bin, MD, Professor, Chief physician, Doctoral supervisor, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China -
About author:Wu Yaokun, Master candidate, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China -
Supported by:National Natural Science Foundation of China (General Program), No. 82074471 (to DB); Jiangsu Province Traditional Chinese Medicine Management Situation Project, No. MS2023023 (to SGQ)
CLC Number:
Cite this article
Wu Yaokun, Liu Chenglin, Fu Jiahao, Song Wei, Chen Hao, Xi Hongzhong, Liu Xin, Du Bin, Sun Guangquan. Combination of effective ingredients of traditional Chinese medicine and bone tissue engineering materials for bone repair[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2141-2150.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
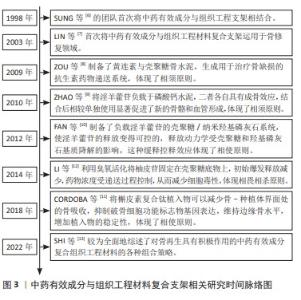
自1998年SUNG等[6]的团队首次将中药有效成分与组织工程支架相结合,中药有效成分便作为组织工程支架三要素中的生长因子被广泛研究用于骨修复领域[7],二者的作用关系涉及成骨、血管修复、靶向递送、减毒等多个方面。为了根据作用关系理清脉络,方便后续研究者的参考查询与选材搭配,文章列举出了涉及“相须”“相使”和“相畏相杀”的多个较早的典型例子。ZOU等[8]制备了黄连素与壳聚糖骨水泥,二者分别具有独特的抗菌机制与广泛的抗菌谱,组合成复合支架后形成了有效的抗生素药物递送系统;ZHAO等[9]将淫羊藿苷负载于磷酸钙水泥,二者结合后相较单独使用更加明显的促进了新骨的形成,以上两例共同体现了“相须”配伍原则。FAN等[10]将淫羊藿苷负载于壳聚糖/纳米羟基磷灰石支架,通过支架材料降解实现了药物的缓释控释,最终提高了成骨相关因子的活性,促进了矿化结节的形成;CORDOBA等[11]将槲皮素与钛植入物制备为复合支架,减少骨-种植体界面处的骨吸收,抑制破骨细胞功能标志物基因表达,维持边缘骨水平,增加植入物的稳定性。以上两例体现了药物与支架的单方面促进作用,共同体现了“相使”的配伍原则。LI等[12]将柚皮苷经过臭氧处理固定在壳聚糖膜上,并底物浸入磷酸盐缓冲盐水中以量化柚皮苷释放量,通过递送过程控制药物的释放浓度,最终消除药物的细胞毒性,增强了成骨效应。这种通过阻止药物爆裂释放以阻止毒性作用的效应体现了“相畏相杀”配伍原则。SHI等[13]以多种中药有效成分为纲,分别总结了各个药物的成骨效应与常见的支架选材搭配策略,总结较为全面清晰。以上具体时间脉络见图3。"

2.1 组织工程材料 2.1.1 人工合成无机材料 主要包括羟基磷灰石、磷酸三钙、磷酸钙水泥及硅酸钙基陶瓷等。羟基磷灰石是占人体骨骼组织主要成分的物质,是目前应用和研究最广泛的人工合成无机材料之一,磷酸三钙和羟基磷灰石均为磷酸钙陶瓷,区别在于钙和磷的比例不同。不同种的人工合成无机材料间经常通过组合的方式进行互补。以上两种材料复合时具有更好的生物相容性、力学强度、溶解性能及骨传导骨诱导性[14],并且其宽大的多孔隙结构能为骨髓间充质干细胞及基质提供宽大表面积和内部空间[15]。羟基磷灰石与硅的结合可以在保留体外生物活性的同时赋予支架高强度优势[16]。 2.1.2 医用金属材料 金属材料同样广泛应用于骨修复领域,例如镁合金支架与钛合金支架,它们在拥有高强度的同时又有较为宽松的空隙,但是其本身生物活性低,骨诱导不足。若使用生物分子涂层进行表面改性则效果有限且费用高昂。一些研究者将钛合金支架进行紫外光功能化表面处理,发现这种做法在保持原有的力学性能的情况下,能够增强细胞相容性,提高亲水性,增强抗菌和防锈能力[17]。 2.1.3 人工合成高分子有机聚合物材料 聚乳酸与聚乙醇酸是常见聚合物支架材料,二者的降解可为组织细胞的长入提供空间,同时也具有可塑形强及孔隙率高的特点,可单独应用,也可与生物因子复合应用[18]。聚己内酯也是一种常见的人工合成聚合物材料,其具有良好的生物相容性、力学强度与可塑性,降解速度相对较慢,酸性产物较少,但纯聚己内酯支架生物活性低、亲水性差并且缺乏骨诱导性[19]。 2.1.4 天然高分子生物材料 分为胶原、蛋白质和多糖3大类。应用较多材料的有胶原蛋白、明胶、蚕丝、壳聚糖等,其具有众多优点,例如多孔性、良好的生物相容性、生物可降解性以及缓释和控释作用,像壳聚糖还具有良好的广谱抗菌性,可以促进伤口愈合和组织修复,作为良好的抗菌止血材料应用[20]。 文章总结了组织工程材料常见分类及其特点[17-25],见表1。"

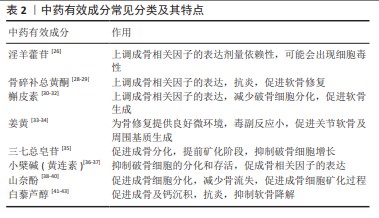
2.2 中药有效成分 由于中药有效成为制备简便、取材广泛以及促进成骨的特点在骨组织工程支架领域具有显著的优势,但仍具有诸多缺陷,例如浓度的变化会导致作用的改变,一些中药有效成分稳定性较差,还有一些药物对骨形成以及骨吸收的作用机制尚不明确,在一定浓度下可能会出现细胞毒性。文章对一些常见的中药有效成分在骨修复领域的优势劣势进行了总结。 淫羊藿苷是最常用于组织工程领域的中药有效成分之一,有研究表明,淫羊藿苷能促进Wnt经典通路中关键因子β-catenin表达上调,激活下游靶基因的表达,增加碱性磷酸酶活性和钙化结节形成,并且上调成骨分化相关基因矮小相关转录因子2的表达[26]。陈花英等[27]发现淫羊藿苷能在高糖环境下上调骨钙素、骨桥蛋白和Ⅰ型胶原的基因表达,进而促进成骨细胞的分化。 骨碎补总黄酮对Wnt/β-catenin、BMP信号通路有调控作用,也能调控骨保护素、核转录因子κB受体活化因子配体及核转录因子κB受体激活因子等关键因子,以此来加快骨损伤愈合,促进钙磷沉积,增强成骨活动[28]。骨碎补总黄酮还能够抑制毛细血管渗透性的升高,拥有一定程度的抗炎作用,并且通过改变滑膜组织形态学修复软骨[29]。 另外一些中药有效成分也有一定程度的研究进展,有报道表明槲皮素能通过上调特异AT序列结合蛋白基因表达,增加碱性磷酸酶活性,促进矮小相关转录因子2、骨钙素的表达来增强骨髓间充质干细胞的增殖分化,并能够通过核转录因子κB受体活化因子配体减少破骨细胞分化[30-31]。此外,槲皮素还能以剂量依赖性方式激活细胞外调节蛋白激酶和蛋白激酶B信号通路,显著上调软骨生成基因的表达,刺激糖胺聚糖的分泌[32]。提取自中药姜黄根茎的有效成分姜黄素,在合理药物浓度下的毒副反应小,可通过调节幼稚CD4+T细胞与巨噬细胞,发挥抗凋亡、抗炎、免疫调节作用,为局部骨修复提供良好微环境[33],并且能增强软骨细胞增殖和迁移的功能,提高细胞外基质的合成代谢基因表达[34]。三七总皂苷能通过影响蛋白激酶B、成骨细胞特异性转录因子、骨形态发生蛋白2、骨粘连蛋白及Ⅰ型胶原和骨钙蛋白等因子的表达,进而启动成骨分化,并且在后期使矿化过程提前发生[35]。小檗碱是一种具有很强抗菌能力的天然抗菌素,其通过抑制蛋白激酶B和核转录因子κB的活化,直接抑制核转录因子κB受体激活因子介导的破骨细胞分化和存活[36],与此同时,小檗碱还能增加与成骨细胞分化相关的蛋白质的表达,包括碱性磷酸酶和成骨细胞特异性转录因子[37]。 山奈酚是一种广泛存在于植物和草药中的天然类黄酮,能够通过激活信号通路、抑制成骨细胞凋亡以及调节参与成骨细胞矿化的蛋白质来促进成骨[38],还能减少糖皮质激素诱导的骨质流失[39]。此外,山奈酚可以激活雌激素反应元件调控的报告基因质粒的转录活性和诱导成骨细胞中的雌激素受体α磷酸化,通过激活与成骨细胞分化生物标志物相关的雌激素,促进了成骨细胞的矿化过程[40]。白藜芦醇能够通过上调矮小相关转录因子2表达来促进成骨以及钙沉积[41],减少局部炎症反应[42],并且通过Toll 样受体4介导的核转录因子κB信号通路来减少软骨组织凋亡,增加骨小梁比例和软骨比例,抑制细胞外基质的降解[43]。 中药有效成分常见分类及其特点见表2。"

2.3 七情配伍分类视角下的中药有效成分与支架相互关系 以上的论述对于各种常见的支架和中药有效成分的优劣势及临床应用进行了分类阐述,文章的目的是总结这些材料各自的特点,并结合当下热门的对于二者结合产生相互作用的研究进行分析,然后将这些置入中药七情的视角,以此为纲进行分类,总结出中药与支架间的作用关系并举例论证。 2.3.1 相须 “相须者,同类不可离也”,相须在原本的中药配伍关系中是指两种药物搭配使用,能增强原有的效果,不仅仅是简单相加的效果,在组织工程领域则相应的理解为支架材料和中药有效成分的结合能产生协同作用,共同发挥或增强原有的功效。 共同促进骨髓间充质干细胞的分化:一些中药有效成分与支架材料本身具有一定的成骨作用,二者在协同使用时能增强这一作用,而不仅仅是简单的优势相加。例如:淫羊藿苷能促进成骨相关因子与信号通路的表达,抑制间充质干细胞往其他方向的分化[44];羟基磷灰石通过自身的降解产生适宜环境来提高成骨细胞活性,并且提供成骨相关的原材料,同时具备良好的骨传导和骨诱导性[45]; 二者在成骨方面的机制不尽相同,但是组合起来时能实现一加一大于二的作用。二者能共同促进细胞因子表达,羟基磷灰石为淫羊藿苷提供良好的成骨环境,同时提供骨传导效应,淫羊藿苷能够直接增强信号通路以进一步加强成骨;同时二者在其他特性方面能够辅助增强成骨效应,例如支架经过对应的结构设计与制作工艺后能营造特定的空间结构,通过缓释控释效果延长药物的成骨效应发挥时间。这样的特性与中药间的相须配伍较为相似。在一些实际研究中,管明强等[18]制备了淫羊藿苷/纳米羟基磷灰石/聚乳酸复合支架,羟基磷灰石支架降解产生钙离子促进成骨细胞增殖与分化,淫羊藿苷则提高了碱性磷酸酶的表达,二者最终共同促进骨髓间充质干细胞的增殖分化。宁钰等[46]制备了淫羊藿苷/凹凸棒石/Ⅰ型胶原/聚己内酯支架,特定含量的凹凸棒石能明显促进矮小相关转录因子2和重组蛋白的表达,并且上调成骨细胞标志分子,和其上负载的淫羊藿苷具有类似作用,二者产生了协同效果,同时这个支架复合体能通过缓释作用与结构效应协同作用加强这一效果。OPRITA等[47]的研究结果表明透明质酸-胶原水凝胶在与淫羊藿苷化学偶联后,共同对接种在水凝胶中的种子细胞产生作用,使其表现出成骨细胞形态,促进钙盐沉积,显著增加骨相关基因和蛋白的表达,增加软骨基质的分泌。CHEN等[48]的研究表明,人参皂苷与硅酸钙/硫酸钙支架混合对体外细胞生长具有相加作用,复合支架提供了良好的生物活性环境,提高了矿化效率,并且通过增强碱性磷酸酶、骨桥蛋白和骨钙蛋白的表达促进干细胞的增殖反应。MADANI等[49]研究研制的槲皮素/明胶/黄蓍胶/纳米羟基磷灰石高度多孔支架具有生物活性与生物可降解性,因为它在模拟体液中具有磷灰石形成的能力,该支架可以负载槲皮素,并通过Fickian扩散机制在120 h后将负载的药物释放93%,碱性磷酸酶活性的水平取决于负载槲皮素的浓度。槲皮素和纳米羟基磷灰石的协同作用使骨髓间充质干细胞的碱性磷酸酶活性和成骨基因表达达到最大值。 共同增强原有的抗菌作用:壳聚糖与黄连素的组合能很好地体现这一方面。壳聚糖能通过吸附于细菌表面阻止营养物质吸收或进入细菌产生凝絮作用而产生抗菌作用,其抗菌谱较为广泛[50],黄连素也是比较常见的天然抗生素,它可以抑制参与细胞分裂的细菌蛋白来达到抗菌效果,其抗菌谱同样广泛[51],二者结合后可增强原有的抗菌作用。同时壳聚糖在输送药物方面十分高效,能够将药物保持在局部区域靶位点,使药物的效果持续发挥[52]。此外,壳聚糖和黄连素解离均带正电荷,对具有阴离子特性的红细胞具有吸附作用而产生良好的止血效果。一些研究表明壳聚糖与姜黄素的结合可以通过机制的互补、时间的延长等方式进一步提高原有的抗菌能力,体现了“相须”的特点。汪芳等[53]制备了壳聚糖/黄连素干凝胶,并通过实验验证了其是一种高效安全的抗菌止血材料。在另一项实验中,JI等[54]通过3D打印构建了载姜黄素的树枝状介孔有机二氧化硅纳米颗粒的药物递送支架,研究组将羟基磷灰石和壳聚糖的支架由单宁酸桥接,然后通过静电相互作用与海藻酸钠结合,支架中的单宁酸与壳聚糖本身具有一定的抗菌特性,在负载姜黄素后,支架的抑菌效果随着姜黄素负载药物含量的增加而显著增加。 提高局部血管的生成速度:除了成骨细胞与破骨细胞的相互平衡关系,新生血管的生长也在骨修复的过程中发挥重要的作用。曾志奎等[55-57]的研究将二元作用视角拓宽为三元作用视角,重视对骨缺损区域新生血管的研究,其团队试验发现骨碎补总黄酮能促进Masquelet诱导膜中血管新生因子的表达,包括血小板内皮细胞黏附分子、内皮粘连蛋白、高迁移率族蛋白B1、血管内皮生长因子和人血小板衍生生长因子BB等,显著提高血管形成的数量,继而改善骨缺损局部的骨痂密度和矿化程度。该组的进一步研究发现,在骨移植的生长期,骨碎补总黄酮能以剂量依赖性方式促进骨移植的生长和矿化,这与BMP-SMAD信号通路的激活和磷酸化部分有关。JING等[58]发现大鼠脂肪干细胞分泌的血管内皮生长因子可明显促进大鼠内皮祖细胞的血管新生,淫羊藿苷显著促进了大鼠脂肪干细胞的血管内皮生长因子蛋白表达,研究组制备的淫羊藿苷/45S5生物玻璃/大鼠脂肪干细胞支架表现出优异的成骨和成血管潜能,为大段骨缺损的再生提供了一种新的选择。FAN等[59]制备了含有白藜芦醇和血管生成素2的血管内皮生长因子/硫醇化壳聚糖小孔径水凝胶,白藜芦醇通过增加内皮细胞局部自噬水平帮助支架中的血管生成素促进血管生成,与单独使用血管紧张素2相比,二者联合使用可显著提高这一效果。 2.3.2 相使 “相使者,我之佐使也”,相使在原本的中药配伍关系中是指两种药物搭配使用,一药为主,一药为辅,辅药能提升主药的疗效,在组织工程领域则相应的理解为支架材料和中药有效成分在协同运用时,一方能增强另一方的作用效果。 中药有效成分对支架的提升:提高支架的机械性能。中药有效成分常通过改变形态、调节孔隙率、维持植入物边缘骨水平以及促进表面磷灰石沉积等方式提高支架的机械性能和稳定性。CHEN等[48]的研究表明,人参皂苷负载于硅酸钙/硫酸钙支架上,能增强应力和应变水平的叠加效应,以此增强支架的机械性能。SONG等[60]发现,不同水飞蓟素浓度制备的水飞蓟素/鸭脚胶原/羟基磷灰石海绵的抗压强度随着水飞蓟素含量的增加而提高,这种趋势可以用水飞蓟素存在引起的形态变化来解释,海绵孔隙几何形状和总孔隙率的改变直接影响材料的抗压强度。同时水飞蓟素还能诱使成骨细胞开始分泌细胞外基质以建立连接网络,进一步增加了支架及周围区域的强度。有研究发现,槲皮素负载于鸭脚胶原/羟基磷灰石海绵时,各海绵的强度随着槲皮素含量的增加而降低,但是其孔隙率却与负载有效成分的量呈正比[61],因此实验者能可控地通过调节负载的药物来使得支架适应不同的人体内环境。此外,一项研究表明,槲皮素复合纳米涂层植入物可以减少骨-种植体界面处的骨吸收,抑制破骨细胞功能标志物基因表达,维持边缘骨水平,增加植入物的稳定性[11]。而当槲皮素与硅酸钙/硫酸钙/聚ε己内酯支架结合时,其具有良好的磷灰石形成性,能够提高支架溶解速率,并且催化晶体的形成,在支架表面形成加快磷灰石的沉淀,使支架表现出较高的机械强度[62]。 支架对中药有效成分的提升: (1)对负载药物的缓释或者控释效果:药物的释放应与骨组织再生速率同步,当下的许多研究通过调节支架降解速率、利用药物支架间的特殊理化作用、设计不同的支架结构等方式达到缓释和控释的效果。在MA等[63]的研究中,小檗碱/聚己内酯/胶原支架可以持续释放药物长达27 d,小檗碱从部分结晶的聚己内酯中的有限扩散及胶原的参与共同维持了初始突释后的缓慢释放速率,随着聚合物纳米纤维的降解,支架结构随时间动态变化,药物进一步释放;此外还可以通过调节静电纺丝溶液中聚已内酯和胶原的比例来控制支架的降解时间。LAMA等[64]制备了白藜芦醇/聚己内酯支架,聚己内酯纤维负载的药物释放缓慢且可控,是由于分子和聚合物之间建立的亲水-疏水相互作用。此外,有实验表明载白藜芦醇固体脂质纳米粒/甲基丙烯酸明胶水凝胶支架具有良好的药物缓释性能,这主要和特定的药物负载途径有关[24]。固体脂质纳米粒的载药能力可以通过考虑3个不同的位置来描述:表面吸附、嵌入壳层和内核富集,处于表面的药物分子是突释的主要来源,而最初突释后的平滑和持续释放源于深层扩散通过固体脂质纳米粒的脂质基质,而将药物包裹在水凝胶中也同样有助于药物的缓慢释放。同样通过营造合适的空间结构来达到控释效果的还有FENG等[65]设计的一种顺序释放的聚左旋乳酸支架,其内层加载三七总皂苷而外层加载骨碎补总黄酮,在发挥功效时,支架最初释放骨碎补总黄酮,然后释放三七总皂苷,和同时释放相比,复合支架能顺序性上调血管生成蛋白和成骨蛋白表达而促进血管形成和新生骨形成。YUAN等[66]研究制备了一种金属离子和淫羊藿苷复合的微球,在这种复合支架中,适当的镁离子浓度可以上调细胞活性,而镁离子的释放受氧化镁和淫羊藿苷载药量的控制,这是由药物的疏水性导致的。与此同时,淫羊藿苷的释放取决于其载药量,并由于氧化镁的亲水性受镁离子释放的影响,这种药物和生物活性离子的双重控制释放策略对类似的研究有很大的启发作用。 (2)提供稳定、宽大的空间结构,提高载药量:ZHAO等[67]将负载淫羊藿苷的壳聚糖微球掺入Ⅰ型胶原蛋白中作为核心支架,并使用聚己内酯/胶原/羟基磷灰石复合材料通过静电纺丝制备壳支架,发现基于电纺的支架具有纳米纤维结构、大的表面积和体积比以及互连的孔隙,研究组开发了几种策略来增加电纺支架的平均孔径,以此来负载更多的细胞与药物。LEI等[68]将淫羊藿苷与不易降解的3D打印多孔钛六铝四钒重建棒结合,金属重建棒提供了结构支撑,为新骨的生长提供了空间,在机体和种植体之间形成了有效的界面整合,与淫羊藿苷协同作用,共同构建了适合新骨生长的结构牢固的立体框架。 (3)提升负载药物的稳定性:支架通过对药物进行化学修饰、包裹覆盖或是提供适宜的制备环境等方式来保证药物的稳定性。PREETHI等[69]的研究表明,槲皮素具有抗菌活性、抑制破骨细胞及增强血管生成等作用,但其化学稳定性较低,水溶性差,作用的发挥取决于pH值、温度、光照、氧化环境等诸多因素。实验组设计的支架提供了稳定的环境,将其与金属离子进行络合,对其进行化学修饰以提高其抗菌性能。淫羊藿苷完全暴露于体内流体环境会导致生物活性的大幅损失,XIE等[70]设计了淫羊藿苷/羟基磷灰石/海藻酸盐多孔复合支架,支架中的海藻盐酸包裹着药物有效成分,能起到一定的保护作用并维持其生物活性。XU等[31]使用聚乙烯醇、β-磷酸三钙和淫羊藿苷制备印刷油墨,聚乙烯醇就像胶水一样,将其他组件黏合在一起,在这种情况下墨水可以在不加热的情况下堆叠到脚手架中。整个打印过程在室温下完成,同时不使用溶剂,可以保持生物活性分子淫羊藿苷的活性,且不会引起潜在的炎症反应。NEGRESCU等[71]制备了用淫羊藿苷功能化的氧化钛纳米管,通过物理吸附法确保负载淫羊藿苷的化学结构和生物特性,此外,裸露的氧化钛与淫羊藿苷的结合基底的接触角较低,试验以这种负载方式保障了药物的完全释放。 (4)对药物的靶向递送作用:药物递送作用在骨组织工程支架的研究中有不可忽视的地位,许多药物通过口服途径的吸收效果较差,或是易产生全身副反应,因此许多具有独特化学、物理和生物特性的纳米材料,如水凝胶、脂质体等材料已被设计用于局部靶向递送药物,这种递送过程是持续和精确的[72],因此在骨科领域有着很广阔的应用前景。WANG等[73]开发了一种代谢驱动的生物反应性水凝胶负载补骨脂素,补骨脂素具有优异的抗炎抗风湿、改善骨稳态的作用。但是补骨脂素显示出全身副反应,且溶解度不令人满意。因此,研究组开发了一种可降解水凝胶平台作为递送系统,将补骨脂素和过氧化钙输送到关节炎关节,并根据炎症刺激控制补骨脂素和氧气的释放,以调节缺氧性关节炎微环境的稳态和代谢紊乱。研究表明,白藜芦醇的临床应用主要受到其水溶性低、代谢快、化学稳定性差的限制[74],导致生物利用度低,同时其具有轻微的细胞毒性[75]。WEI等[76]制备了聚乳酸-羟基乙酸共聚物纳米颗粒,纳米颗粒可以改善关节中的生物分布、延长药物停留时间,并具有穿透细胞外基质和细胞屏障的能力,从而实现递送作用。纳米颗粒所携带的电荷能够促进它们与细胞和黏膜的长时间相互作用,从而使药物能够很好地渗透到关节软骨中;而颗粒的包封作用可以形成稳定的纳米复合物,有效防止药物降解和失活,延长药物的半衰期。姜黄素由于血清浓度低、组织吸收有限、代谢率高、从体内快速排出等原因导致生物利用度低,阻碍了其实际应用,BOSE等[77]制备了一种聚乙二醇、聚己内酯和聚丙交酯乙交酯的复合材料来搭载姜黄素,材料形成了保护性、致密、亲水的长柔性链云,从而降低药物分子的表面疏水性;增加表面亲水性还可以通过防止蛋白质吸附来允许细胞黏附和增殖在生物材料支架上,最终实现在靶标区域内的持续递送。SARKAR等[78]对脂质体包裹姜黄素的3D打印支架进行了研究。3D打印技术能够精确制备具有相互连通孔隙的几何结构,由生物可吸收陶瓷制成的支架随着界面和孔隙内新骨组织的形成而逐渐降解,这一点将允许药物在适当的时间内以适当的剂量局部递送,同时负载药物的脂质体也具有良好的生物相容性、生物降解性,为球形囊泡结构,具有有效的药物递送能力。 2.3.3 相畏相杀 “相畏者,受彼之制也”“相杀者,制彼之毒也”,相畏相杀在原本的中药配伍关系中是指两种药物搭配使用,一种药物的毒副反应能被另一种药物所抑制,在组织工程领域则相应的理解为支架材料和中药有效成分的结合能消除另一方对于人体的不利影响,防止副反应的产生。 (1)直接减轻或消除副反应:一些支架与药物由于其本身的性质在运用于组织工程领域时不可避免的带有一定的副反应,有研究表明,淫羊藿苷拥有较低的安全阈值,若其浓度超过10 μmol/L,则可能会产生细胞毒性。李慧娟等[79]制备了负载淫羊藿苷的壳聚糖仿生支架,并通过染色结果观察发现复合支架消除了这种细胞毒作用。SARKAR等[80]的研究表明,钛及其合金具有良好的生物相容性、较高的机械强度、断裂韧性和耐腐蚀性,然而,钛合金表面的强氧化层会产生生物惰性,阻碍了植入物与骨组织的直接相互作用。支架表面负载的姜黄素成功地减少了钛植入物中的纤维包裹,而不影响骨整合。此外,姜黄素还有助于减少钛颗粒诱导的炎症,从而减少无菌性松动的出现。 (2)减少因爆裂释放而产生的毒副反应:柚皮苷是一种黄酮类化合物,可促进骨形成、抑制骨吸收,但是其在高浓度下具有细胞毒性[13],在低浓度下又可能无效[81],柚皮苷从支架中高初始爆发释放可能导致药物以毒性剂量释放,并损失大量无法用于后续释放的药物,降低后续的成骨效应。释放动力学分析表明,初级爆发释放阶段和次要缓释阶段的协同效应对性能起着关键作用。受到七情配伍关系中相畏相杀的启发,文章总结了一些能够通过缓释实现柚皮苷减毒增效作用的复合支架研究。YANG等[82]制备了负载柚皮苷的蔗糖醋酸异丁酸酯的杂交库,载体能够有效控制柚皮苷的释放并防止爆裂释放,增强了新骨形成率。ZHAO等[83]将丝素蛋白-纳米羟基磷灰石与负载药物的聚乳酸-羟基乙酸共聚物微球相结合,以此作为有效的柚皮苷载体,能提供扩散控制的释放曲线来阻止毒性反应的发生。ELKHOURY等[84]制备了一种纳米复合水凝胶,该水凝胶由负载柚皮苷的鲑鱼衍生卵磷脂的脂质体构建单元和明胶甲基丙烯酰大粒水凝胶组成,其通过防止药物的初始爆发释放,并提供封装的类黄酮的受控延长释放来提高柚皮苷的体内生物利用度和稳定性。YU等[85]借助金属有机框架纳米晶体在钛上设计了一种多功能矿化胶原涂层,通过材料和柚皮苷的相对浓度来控制柚皮苷的释放。此外,还有研究团队研发制备了负载柚皮苷的明胶-微球/纳米羟基磷灰石/丝素蛋白复合支架[86], 当支架植入骨缺损时,由于浸泡作用,支架降解较少,从而维持了柚皮苷的更长释放时间。KARIMI-SOFLOU等[87]在研究搭载白藜芦醇的支架时发现,在聚乳酸电纺纳米纤维中加入有机蒙脱土,可以在更长的时间内使药物更缓慢和更可控的释放,从而阻止白藜芦醇释放到其毒性极限。 文章总结了基于七情配伍关系的复合支架材料信息,见表3。"

| [1] RAVOOR J, SR E. A study on retention of MWCNT in robocasted MWCNT-HAP scaffold structures using vacuum sintering technique and their characteristics. Ceramics Int. 2022;48(21):31289-31298. [2] 熊伟,袁灵梅,钱国文,等.“补肾壮骨”中药应用于骨组织工程支架修复节段性骨缺损[J].中国组织工程研究,2023,27(21): 3438-3444. [3] 董心雨,董馨月,王婉婷,等.中药有效成分结合支架材料促进骨组织再生[J].中国组织工程研究,2024,28(20):3240-3245. [4] 王攀红,王倩,任杰.浅议方剂配伍理论[J].四川中医,2018,36(7): 57-58. [5] 袁冰.中医方剂配伍理论的历史研究[D].北京:中国中医科学院, 2009. [6] SUNG HW, HUANG RN, HUANG LL, et al. Feasibility study of a natural crosslinking reagent for biological tissue fixation. J Biomed Mater Res. 1998;42(4):560-567. [7] LIN FH, DONG GC, CHEN KS, et al. Immobilization of Chinese herbal medicine onto the surface-modified calcium hydrogenphosphate. Biomaterials. 2003;24(13):2413-2422. [8] ZOU Q, LI Y, ZHANG L, et al. Antibiotic delivery system using nano-hydroxyapatite/chitosan bone cement consisting of berberine. J Biomed Mater Res A. 2009;89(4):1108-1117. [9] ZHAO J, OHBA S, KOMIYAMA Y, et al. Icariin: a potential osteoinductive compound for bone tissue engineering. Tissue Eng Part A. 2010;16(1): 233-243. [10] FAN J, BI L, WU T, et al. A combined chitosan/nano-size hydroxyapatite system for the controlled release of icariin. J Mater Sci Mater Med. 2012;23(2):399-407. [11] CORDOBA A, MANZANARO-MORENO N, COLOM C, et al. Quercitrin nanocoated implant surfaces reduce osteoclast activity in vitro and in vivo. Int J Mol Sci. 2018;19(11):3319. [12] LI CH, WANG JW, HO MH, et al. Immobilization of naringin onto chitosan substrates by using ozone activation. Colloids Surf B Biointerfaces. 2014;115:1-7. [13] SHI G, YANG C, WANG Q, et al. Traditional Chinese medicine compound-loaded materials in bone regeneration. Front Bioeng Biotechnol. 2022;10:851561. [14] 杨为中,周大利,尹光福,等.骨组织工程支架材料磷酸钙双相生物陶瓷的研究进展[J].硅酸盐学报,2004,32(9):1143-1149. [15] 程志琳,秦豪,许林.治疗骨缺损的组织工程支架研究进展[J].微创医学,2022,17(6):780-783. [16] ZHANG C, YUAN Y, ZENG Y, et al. DLP 3D printed silica-doped HAp ceramic scaffolds inspired by the trabecular bone structure. Ceramics Int. 2022;48(19 Pt1):27765-27773. [17] YIN C, ZHANG T, WEI Q, et al. Surface treatment of 3D printed porous Ti6Al4V implants by ultraviolet photofunctionalization for improved osseointegration. Bioact Mater. 2022;7:26-38. [18] 管明强,朱志霞,周观明.淫羊藿苷对聚乳酸/纳米羟基磷灰石支架上成骨细胞增殖与分化的影响[J].包头医学院学报,2018,34(1): 92-94. [19] 杨湘俊,陈俊宇,朱舟,等.PCL基复合骨组织工程支架研究现状及发展[J].中国生物医学工程学报,2021,40(4):485-492. [20] BROVOLD M, ALMEIDA J I, PLA-PALACIN I, et al. Naturally-derived biomaterials for tissue engineering applications. Adv Exp Med Biol. 2018;1077:421-449. [21] 潘依雯,倪昕晔,王车礼.羟基磷灰石作为药物载体在骨修复领域的研究进展[J].药品评价,2022,19(17):1079-1083. [22] 李忠杰,李绍波.磷酸钙人工骨修复骨缺损的研究进展[J].生物骨科材料与临床研究,2021,18(4):87-91. [23] JIA G, HUANG H, NIU J, et al. Exploring the interconnectivity of biomimetic hierarchical porous Mg scaffolds for bone tissue engineering: effects of pore size distribution on mechanical properties,degradation behavior and cell migration ability. Journal of Magnesium and Alloys. 2021;9(6):1993-2004. [24] WEI B, WANG W, LIU X, et al. Gelatin methacrylate hydrogel scaffold carrying resveratrol-loaded solid lipid nanoparticles for enhancement of osteogenic differentiation of BMSCs and effective bone regeneration. Regen Biomater. 2021;8(5):rbab44. [25] 于玛丽,李丽梅,郭家智,等.壳聚糖在组织工程的应用[J].中国高新科技,2019(3):103-105. [26] 周先进,张延芳.淫羊藿苷对成骨细胞中β-catenin、ALP和RUNX2表达的影响[J].中国医药导报,2017,14(36):57-59. [27] 陈花英,周娟,吴焕成,等.淫羊藿苷对高糖环境下骨髓间充质干细胞凋亡及成骨分化的影响[J].兰州大学学报(医学版),2019, 45(4):37-42. [28] 招文华,沈耿杨,任辉,等.骨碎补活性单体成分调控骨质疏松症相关信号通路的研究进展[J].中国骨质疏松杂志,2017,23(1):122-129. [29] 孙丙银.骨碎补总黄酮促进股骨缺损牵张成骨新骨形成的实验研究[D].广州:广州中医药大学,2013. [30] 张波,胡凌云,苟林,等.槲皮素对人骨髓间充质干细胞增殖和成骨分化的影响及分子机制[J].中国骨质疏松杂志,2022,28(12):1765-1769. [31] XU Z, SUN Y, DAI H, et al. Engineered 3D-printed polyvinyl alcohol scaffolds incorporating beta-tricalcium phosphate and icariin induce bone regeneration in rat skull defect model. Molecules. 2022;27(14): 4535. [32] GUI ZP, HU Y, ZHOU YN, et al. Effect of quercetin on chondrocyte phenotype and extracellular matrix expression. Chin J Nat Med. 2020; 18(12):922-933. [33] 王海英, 张宇琪, 孙昊天,等.姜黄素及其衍生物的作用及机制[J].生理科学进展,2022,53(4):271-275. [34] ZHANG R, ZHANG Q, ZOU Z, et al. Curcumin supplementation enhances bone marrow mesenchymal stem cells to promote the anabolism of articular chondrocytes and cartilage repair. Cell Transplant. 2021; 30:2139986480. [35] 柳毅,陈建治.三七总皂苷及其诱导成骨的试验和机制[J].国际口腔医学杂志,2015,42(1):75-78. [36] HU JP, NISHISHITA K, SAKAI E, et al. Berberine inhibits RANKL-induced osteoclast formation and survival through suppressing the NF-kappaB and Akt pathways. Eur J Pharmacol. 2008;580(1-2):70-79. [37] CUI Y, XIE J, CAI L, et al. Berberine regulates bone metabolism in apical periodontitis by remodelling the extracellular matrix. Oral Dis. 2023;29(3):1184-1196. [38] WONG SK, CHIN KY, IMA-NIRWANA S. The osteoprotective effects of kaempferol: the evidence from in vivo and in vitro studies. Drug Des Devel Ther. 2019;13:3497-3514. [39] VIMALRAJ S, SARAVANAN S, HARIPRABU G, et al. Kaempferol-zinc (II) complex synthesis and evaluation of bone formation using zebrafish model. Life Sci. 2020;256:117993. [40] GUO AJ, CHOI RC, ZHENG KY, et al. Kaempferol as a flavonoid induces osteoblastic differentiation via estrogen receptor signaling. Chin Med. 2012;7:10. [41] WANG CC, WANG CH, CHEN HC, et al. Combination of resveratrol-containing collagen with adipose stem cells for craniofacial tissue-engineering applications. Int Wound J. 2018;15(4):660-672. [42] HAN X, SHEN J, CHEN S, et al. Ultrasonic-controlled “explosive” hydrogels to precisely regulate spatiotemporal osteoimmune disturbance. Biomaterials. 2023;295:122057. [43] LONG Z, XIANG W, LI J, et al. Exploring the mechanism of resveratrol in reducing the soft tissue damage of osteoarthritis based on network pharmacology and experimental pharmacology. Evid Based Complement Alternat Med. 2021;2021:9931957. [44] RAMESH P, JAGADEESAN R, SEKARAN S, et al. Flavonoids: classification, function, and molecular mechanisms involved in bone remodelling. Front Endocrinol (Lausanne). 2021;12:779638. [45] BUDIRAHARJO R, NEOH KG, KANG ET. Hydroxyapatite-coated carboxymethyl chitosan scaffolds for promoting osteoblast and stem cell differentiation. J Colloid Interface Sci. 2012;366(1):224-232. [46] 宁钰,秦文,任亚辉,等.载淫羊藿苷/凹凸棒石/Ⅰ型胶原/聚己内酯复合支架修复兔胫骨缺损的实验研究[J].中国修复重建外科杂志,2019,33(9):1181-1189. [47] OPRITA EI, IOSAGEANU A, CRACIUNESCU O. Progress in composite hydrogels and scaffolds enriched with icariin for osteochondral defect healing. Gels. 2022;8(10):648. [48] CHEN CY, SHIE MY, LEE AK, et al. 3D-printed ginsenoside rb1-loaded mesoporous calcium silicate/calcium sulfate scaffolds for inflammation inhibition and bone regeneration. Biomedicines. 2021;9(8):907. [49] MADANI P, HESARAKI S, SAEEDIFAR M, et al. The controlled release, bioactivity and osteogenic gene expression of Quercetin-loaded gelatin/tragacanth/nano-hydroxyapatite bone tissue engineering scaffold. J Biomater Sci Polym Ed. 2023;34(2):217-242. [50] SHRESTHA R, THENISSERY A, KHUPSE R, et al. Strategies for the preparation of chitosan derivatives for antimicrobial, drug delivery, and agricultural applications: a review. Molecules. 2023;28(22):7659. [51] MILANI G, CAVALLUZZI MM, SOLIDORO R, et al. Molecular simplification of natural products: synthesis, antibacterial activity, and molecular docking studies of berberine open models. Biomedicines. 2021;9(5):452. [52] RASHKI S, ASGARPOUR K, TARRAHIMOFRAD H, et al. Chitosan-based nanoparticles against bacterial infections. Carbohydr Polym. 2021;251: 117108. [53] 汪芳,陈云平,苏香萍.抗菌止血壳聚糖/黄连素多孔干凝胶的制备及其表征[J].中国组织工程研究,2017,21(6):899-905. [54] JI C, ZHANG C, XU Z, et al. Mussel-inspired HA@TA-CS/SA biomimetic 3D printed scaffolds with antibacterial activity for bone repair. Front Bioeng Biotechnol. 2023;11:1193605. [55] 曾志奎,黄枫,李悦,等.骨碎补总黄酮对大鼠Masquelet诱导膜血管新生因子表达的影响[J]中华中医药学刊,2019,37(10): 2345-2348. [56] 李定,李悦,黄枫,等.骨碎补总黄酮在诱导膜技术中对骨缺损区域血管形成和成骨质量的影响[J].中华中医药杂志,2019,34(11): 5086-5089. [57] LI S, LI Y, JIANG Z, et al. Efficacy of total flavonoids of rhizoma drynariae on the blood vessels and the bone graft in the induced membrane. Phytomedicine. 2022;99:153995. [58] JING X, YIN W, TIAN H, et al. Icariin doped bioactive glasses seeded with rat adipose-derived stem cells to promote bone repair via enhanced osteogenic and angiogenic activities. Life Sci. 2018;202:52-60. [59] FAN D, LIU H, ZHANG Z, et al. Resveratrol and angiogenin-2 combined with PEGDA/TCS hydrogel for the targeted therapy of hypoxic bone defects via activation of the autophagy pathway. Front Pharmacol. 2021;12:618724. [60] SONG JE, JEON YS, TIAN J, et al. Evaluation of silymarin/duck’s feet-derived collagen/hydroxyapatite sponges for bone tissue regeneration. Mater Sci Eng C Mater Biol Appl. 2019;97:347-355. [61] SONG JE, TIAN J, KOOK YJ, et al. A BMSCs-laden quercetin/duck’s feet collagen/hydroxyapatite sponge for enhanced bone regeneration. J Biomed Mater Res A. 2020;108(3):784-794. [62] HUANG KH, CHEN CY, CHANG CY, et al. The synergistic effects of quercetin-containing 3D-printed mesoporous calcium silicate/calcium sulfate/poly-epsilon-caprolactone scaffolds for the promotion of osteogenesis in mesenchymal stem cells. J Formos Med Assoc. 2021;120(8):1627-1634. [63] MA L, YU Y, LIU H, et al. Berberine-releasing electrospun scaffold induces osteogenic differentiation of DPSCs and accelerates bone repair. Sci Rep. 2021;11(1):1027. [64] LAMA S, LUCE A, BITTI G, et al. Polydatin incorporated in polycaprolactone nanofibers improves osteogenic differentiation. Pharmaceuticals (Basel). 2022;15(6):727. [65] FENG G, ZHANG P, HUANG J, et al. Sequential release of panax notoginseng saponins and osteopractic total flavone from poly ((L)-Lactic Acid) scaffold for treating glucocorticoid-associated osteonecrosis of femoral head. J Funct Biomater. 2023;14(1):31. [66] YUAN Z, WAN Z, WEI P, et al. Dual-controlled release of icariin/Mg(2+) from biodegradable microspheres and their synergistic upregulation effect on bone regeneration. Adv Healthc Mater. 2020;9(11):e2000211. [67] ZHAO H, TANG J, ZHOU D, et al. Electrospun icariin-loaded core-shell collagen, polycaprolactone, hydroxyapatite composite scaffolds for the repair of rabbit tibia bone defects. Int J Nanomedicine. 2020;15:3039-3056. [68] LEI H, ZHOU Z, LIU L, et al. Icariin-loaded 3D-printed porous Ti6Al4V reconstruction rods for the treatment of necrotic femoral heads. Acta Biomater. 2023;169:625-640. [69] PREETHI A M, BELLARE J R. Concomitant effect of quercetin- and magnesium-doped calcium silicate on the osteogenic and antibacterial activity of scaffolds for bone regeneration. Antibiotics (Basel). 2021; 10(10):1170. [70] XIE Y, SUN W, YAN F, et al. Icariin-loaded porous scaffolds for bone regeneration through the regulation of the coupling process of osteogenesis and osteoclastic activity. Int J Nanomedicine. 2019;14: 6019-6033. [71] NEGRESCU A M, MITRAN V, DRAGHICESCU W, et al. TiO(2) Nanotubes functionalized with icariin for an attenuated in vitro immune response and improved in vivo osseointegration. J Funct Biomater. 2022;13(2):43. [72] SHANG J, ZHOU C, JIANG C, et al. Recent developments in nanomaterials for upgrading treatment of orthopedics diseases. Front Bioeng Biotechnol. 2023;11:1221365. [73] WANG K, YIN C, YE X, et al. A metabolic driven bio-responsive hydrogel loading psoralen for therapy of rheumatoid arthritis. Small. 2023;19(21):e2207319. [74] WANG W, SUN L, ZHANG P, et al. An anti-inflammatory cell-free collagen/resveratrol scaffold for repairing osteochondral defects in rabbits. Acta Biomater. 2014;10(12):4983-4995. [75] TESKAC K, KRISTL J. The evidence for solid lipid nanoparticles mediated cell uptake of resveratrol. Int J Pharm. 2010;390(1):61-69. [76] WEI L, PAN Q, TENG J, et al. Intra-articular administration of PLGA resveratrol sustained-release nanoparticles attenuates the development of rat osteoarthritis. Mater Today Bio. 2024;24:100884. [77] BOSE S, SARKAR N, BANERJEE D. Effects of PCL, PEG and PLGA polymers on curcumin release from calcium phosphate matrix for in vitro and in vivo bone regeneration. Mater Today Chem. 2018;8: 110-120. [78] SARKAR N, BOSE S. Liposome-encapsulated curcumin-loaded 3D printed scaffold for bone tissue engineering. ACS Appl Mater Interfaces. 2019;11(19):17184-17192. [79] 李慧娟,王先流,沈炎冰,等.负载淫羊藿苷的壳聚糖基仿生支架的促软骨形成和炎症缓解作用[J].生物工程学报,2022,38(6): 2308-2321. [80] SARKAR N, BOSE S. Controlled delivery of curcumin and vitamin k2 from hydroxyapatite-coated titanium implant for enhanced in vitro chemoprevention, osteogenesis, and in vivo osseointegration. ACS Appl Mater Interfaces. 2020;12(12):13644-13656. [81] GAN J, DENG X, LE Y, et al. The development of naringin for use against bone and cartilage disorders. Molecules. 2023;28(9):3716. [82] YANG X, ALMASSRI H, ZHANG Q, et al. Electrosprayed naringin-loaded microsphere/SAIB hybrid depots enhance bone formation in a mouse calvarial defect model. Drug Deliv. 2019;26(1):137-146. [83] ZHAO ZH, MA XL, MA JX, et al. Sustained release of naringin from silk-fibroin-nanohydroxyapatite scaffold for the enhancement of bone regeneration. Mater Today Bio. 2022;13:100206. [84] ELKHOURY K, SANCHEZ-GONZALEZ L, LAVRADOR P, et al. Gelatin methacryloyl (GelMA) nanocomposite hydrogels embedding bioactive naringin liposomes. Polymers (Basel). 2020;12(12):2944. [85] YU M, YOU D, ZHUANG J, et al. Controlled release of naringin in metal-organic framework-loaded mineralized collagen coating to simultaneously enhance osseointegration and antibacterial activity. ACS Appl Mater Interfaces. 2017;9(23):19698-19705. [86] YU X, SHEN G, SHANG Q, et al. A Naringin-loaded gelatin-microsphere/nano-hydroxyapatite/silk fibroin composite scaffold promoted healing of critical-size vertebral defects in ovariectomised rat. Int J Biol Macromol. 2021;193(Pt A):510-518. [87] KARIMI-SOFLOU R, MOHSENI-VADEGHANI E, KARKHANEH A. Controlled release of resveratrol from a composite nanofibrous scaffold: effect of resveratrol on antioxidant activity and osteogenic differentiation. J Biomed Mater Res A. 2022;110(1):21-30. [88] ZHANG Y, WANG T, LI J, et al. Bilayer membrane composed of mineralized collagen and chitosan cast film coated with berberine-loaded PCL/PVP electrospun nanofiber promotes bone regeneration. Front Bioeng Biotechnol. 2021;9:684335. |
| [1] | Liu Haoyang, Xie Qiang, Shen Mengran, Ren Yansong, Ma Jinhui, Wang Bailiang, Yue Debo, Wang Weiguo . Application, research hotspots, and shortcomings of degradable zinc-based alloys in bone defect repair and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 839-845. |
| [2] | Zhang Yu, Xu Ruian, Fang Lei, Li Longfei, Liu Shuyan, Ding Lingxue, Wang Yuexi, Guo Ziyan, Tian Feng, Xue Jiajia. Gradient artificial bone repair scaffold regulates skeletal system tissue repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 846-855. |
| [3] | Xu Zhenhua, Li Yanjie, Qin Hewei, Liu Haoyuan, Zhu Bochao, Wang Yupu. Traditional Chinese medicine monomer in treatment of neuroinflammation after spinal cord injury: effects of nuclear transcription factor kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 590-598. |
| [4] | Jiang Zhixiu, Ji Yuchen, Liu Danyu, Cao Yilin, Jiang Tingting, Song Yihan, Wang Lei, Wang Xinyu. Biomechanical properties of Gyroid structured titanium bionic bone scaffolds for repairing segmental mandibular defects [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4621-4628. |
| [5] | Li Yonghang, Li Wenming, Yan Caiping, Wang Xingkuan, Xiang Chao, Zhang Yuan, Jiang Ke, Chen Lu. Critical bone defect repaired with anti-fibrosis and “H”-type core-shell bionic scaffold [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3420-3431. |
| [6] | Wang Renzhi, Chen Yuanfen, Li Jinwei. 3D printed hollow pipe double-crosslinked hydrogel tissue engineering scaffold [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3432-3439. |
| [7] | Zhao Yue, Xu Yan, Zhou Jianping, Zhang Xujing, Chen Yutong, Jin Zhengyang, Yin Zhitao. Differences in structural design between traditional and bionic scaffolds in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3458-3468. |
| [8] | Feng Shuqi, Zhang Shiyong, Yao Keyi, Tang Yufei, Wang Kai, Zhou Xuemei, Xiang Lin. Application of photoresponsive nanomaterials in bone tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3469-3475. |
| [9] | Liu Zilue, Wang Zhi, Song Wenshang, Li Suna, Cai Shixin. Autogenous bone and platelet-rich fibrin in repair of severe alveolar bone defects [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2044-2051. |
| [10] | Liu Yunxiang, Zhang Xiaoyu, Li Hao, Zhang Rong, Li Liping, Chen Chongwei. Multiple applications of metal-organic framework materials in bone tissue engineering and orthopedic disease treatment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2151-2161. |
| [11] | Wang Wenhong, Li Yanjun, Cui Caiyun. Factors influencing differentiation of stem cells from the apical papilla into odontoblasts [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(31): 5071-5078. |
| [12] | Liu Xiaoyin, , Zhong Lin, Zheng Bo, Wei Pan, Dai Chen, Hu Liangcong, Wang Tiantian, Liang Xiaolong, Zhang Sai, Wang Xiaoli. Diffusion tensor imaging predicting locomotor function recovery with 3D printing scaffold after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(28): 4547-4554. |
| [13] |
Ji Hangyu, Gu Jun, Xie Linghan, Wu Xiaotao.
Application of stem cells, tissue engineering scaffolds and neurotrophic factors in the treatment of spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(25): 4088-4093. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||