Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (10): 2132-2140.doi: 10.12307/2025.260
Previous Articles Next Articles
Mechanisms by which microgravity causes osteoporosis
Xiang Dejian1, Liang Xiaoyuan1, Wang Shenghong1, Chen Changshun1, Tian Cong1, Yan Zhenxing1, Geng Bin2, 3, 4, Xia Yayi2, 3, 4
- 1The Second Clinical Medical College, Lanzhou University, Lanzhou 730000, Gansu Province, China; 2Department of Orthopedics, The Second Hospital of Lanzhou University, Lanzhou 730000, Gansu Province, China; 3Gansu Provincial Orthopedic Clinical Research Center, Lanzhou 730000, Gansu Province, China; 4Gansu Intelligent Orthopedics Industry Technology Center, Lanzhou 730000, Gansu Province, China
-
Received:2023-12-01Accepted:2024-03-05Online:2025-04-08Published:2024-08-23 -
Contact:GCorresponding author: Xia Yayi, MD, Professor, Chief physician, Doctoral supervisor, Department of Orthopedics, The Second Hospital of Lanzhou University, Lanzhou 730000, Gansu Province, China; Gansu Provincial Orthopedic Clinical Research Center, Lanzhou 730000, Gansu Province, China; Gansu Intelligent Orthopedics Industry Technology Center, Lanzhou 730000, Gansu Province, China Co-corresponding author: Geng Bin, MD, Associate professor, Associate chief physician, Master’s supervisor, Department of Orthopedics, The Second Hospital of Lanzhou University, Lanzhou 730000, Gansu Province, China; Gansu Provincial Orthopedic Clinical Research Center, Lanzhou 730000, Gansu Province, China; Gansu Intelligent Orthopedics Industry Technology Center, Lanzhou 730000, Gansu Province, China -
About author:Xiang Dejian, Master candidate, The Second Clinical Medical College, Lanzhou University, Lanzhou 730000, Gansu Province, China -
Supported by:National Natural Science Foundation of China, No. 81960403 (to GB); National Natural Science Foundation of China, Nos. 82060405, 82360436 (to XYY); Natural Science Foundation of Gansu Province, No. 22JR5RA943 (to GB); Cuiying Scientific and Technological Innovation Program of Lanzhou University Second Hospital, No. CY2021-MS-A07 (to GB)
CLC Number:
Cite this article
Xiang Dejian, Liang Xiaoyuan, Wang Shenghong, Chen Changshun, Tian Cong, Yan Zhenxing, Geng Bin, Xia Yayi . Mechanisms by which microgravity causes osteoporosis[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2132-2140.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
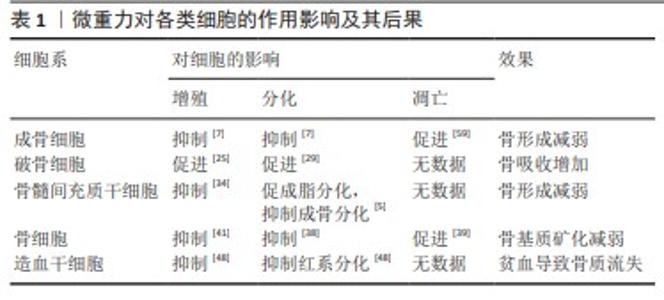
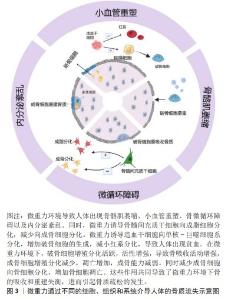
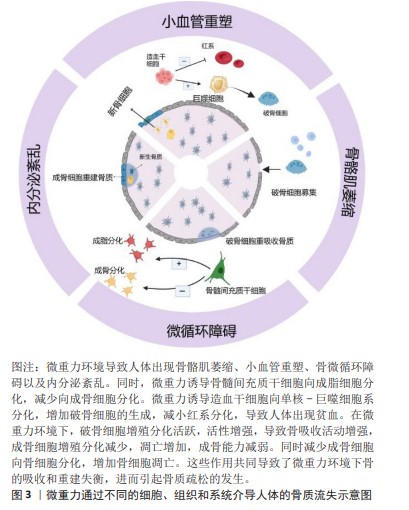
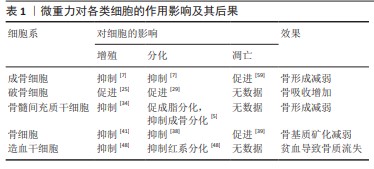
2.1 微重力对成骨细胞的影响 成骨细胞源自骨膜和骨髓的间充质干细胞,是构建骨骼的主要细胞类型。在成骨细胞的分化和成熟过程中,成骨细胞会沉积细胞外基质,推动骨基质的矿化过程。成骨细胞被其产生的矿化细胞外基质所包围时,将经历终末分化,最终分化成为骨细胞。成骨细胞具有感知重力变化并适应这些变化的能力。在微重力条件下,载荷环境的改变会引起成骨细胞增殖、成熟和活性的变化,从而影响新骨形成的过程[3-4]。研究表明,微重力暴露也会导致成骨细胞在基因表达、细胞形态和矿化能力等多方面的改变。在模拟微重力条件下,观察到成骨细胞内AKT的磷酸化水平降低[5],与成骨分化相关的基因,如碱性磷酸酶、Runt相关转录因子2(Runt-related transcription factor,RUNX2)、骨钙素、Ⅰ型胶原蛋白alpha 1链(collagen type I alpha 1,COL1A1)以及编码骨形态发生蛋白2 (bone morphogenetic protein-2,BMP-2)和各种整合素的基因,均呈现显著下调[6],这表明微重力环境显著影响并下调了与成骨细胞分化和骨形成相关的基因。另外,多项研究已明确指出,模拟微重力对成骨细胞的分化功能具有抑制效应[3,7]。除了关键成骨基因的下调外,HU等[8]观察到暴露于模拟微重力的细胞呈现出矿化减少,这表明微重力暴露导致骨密度总体下降,部分原因是微重力条件下成骨细胞数量和分化减少,导致骨形成和骨吸收失衡[9]。另有研究表明机械加载环境的改变导致细胞骨架的改变,Ras同系物家族成员A(Ras homolog gene family,member A,RhoA)通过上调Rho相关蛋白激酶(Rho-associated kinase,ROCK)和促使肌动蛋白纤维形成来调节细胞骨架的排列[10]。 骨细胞之间通过缝隙连接传递力学信号[11]。作为跨膜通道,缝隙连接允许分子质量小于1 kD的信号分子通过以在细胞之间进行相互交流[12]。间隙连接蛋白43(connexin 43,Cx43)是骨组织中最主要的间隙连接蛋白。细胞间隙连接通讯(gap junction intercellular communication,GJIC)有助于成骨细胞和骨细胞在骨中进行机械传导。部分研究证明,力学信号可以调节骨细胞间的Cx43水平和GJIC[13]。骨细胞网络通过GJIC对不同的细胞外信号敏感[14]。最近的研究发现,Cx43在成骨细胞中同时影响Wnt依赖和非Wnt依赖的β-catenin激活[11]。在小鼠中,缺乏Cx43的骨骼对后肢卸载诱导的骨丢失不敏感[15]。这些研究表明,Cx43的缺失可能对微重力诱导的骨丢失产生保护作用,因此Cx43有望成为预防微重力导致骨丢失的新型对抗靶点。Nabavi等[16]研究人员将从CD1小鼠分离的原代成骨细胞在微重力环境中暴露5 d,发现微重力暴露下的成骨细胞的细胞核更大,形状更为不规则,这可能预示着失巢凋亡的发生。这种机械刺激引起的细胞凋亡可能解释了在微重力环境中观察到的骨形成减少。在一项后肢卸载的实验中,组织学定量观察发现成骨细胞凋亡增加,成骨细胞总数减少[17]。除了微重力暴露期间导致成骨细胞凋亡增加外,后肢卸载处理28 d后观察到小鼠的胫骨骨矿化表面的减少表明成骨细胞活性降低[18]。这些数据表明微重力破坏了成骨细胞的生物学功能,这可能是导致骨丢失的部分原因。 微重力通过多种途径影响成骨细胞分化、功能和凋亡,进而减少骨形成。通过研究微重力对成骨细胞的影响,能够深入理解骨质疏松的发病机制,并为预防和治疗提供新的思路和策略,这对于维护骨骼健康、提高生活质量以及解决太空探索中的健康问题都具有重要价值。 2.2 微重力对破骨细胞的影响 与骨细胞和成骨细胞不同,破骨细胞源自造血干细胞[19]。微重力暴露显著地调节了破骨细胞的数量、活性、基因表达和功能。在正常的生理条件下,破骨细胞通过分泌特定的因子来吸收骨并抑制成骨细胞的生成。当暴露于机械卸载的条件下,这种效应被加强,导致破骨细胞的活性和整体骨吸收能力增加,同时抑制骨形成[16,19]。与正常重力环境下的对照组相比,破骨细胞在微重力环境下表现出更高的吸收活性[20-21]。在牛骨切片上培养的成熟破骨细胞在太空飞行1周后形成的吸收坑数量相对增加[16,22],这一过程伴随着骨吸收相关基因的显著上调[22]。破骨细胞在微重力诱导的骨质流失中发挥关键作用,参与的基因,如整合素β3、组织蛋白酶K及基质金属蛋白酶9在微重力条件下显著上调[20,23]。目前的文献一致认为模拟微重力促进破骨细胞生成和破骨细胞功能[24-25],这一过程可能受到成骨细胞和骨细胞分泌的骨保护素和核转录因子κB受体活化因子配体(receptor activator of nuclear factor-κB Ligand,RANKL)的影响。RANKL是一种促进破骨细胞生成的因子,结合破骨细胞表面的核转录因子κB受体(receptor activator for nuclear factor-κ,RANK)进行分化和成熟,而骨保护素通过结合RANKL,起到负调节因子的作用[8]。在微重力条件下,成骨细胞减少骨保护素的产生,增加RANKL/骨保护素比率,从而加强破骨细胞生成[26]。后肢卸载处理28 d后小鼠中RANKL刺激的破骨细胞生成增加,尤其是在后肢和椎骨部位,最终导致脊柱骨密度和强度的降低[27-28]。自噬体的产生增强了破骨细胞的分化,而旋转壁容器处理则增强了自噬基因的表达,从而促进破骨细胞的分化[29]。旋转壁容器培养的破骨细胞相较于正常重力对照组表现出细胞因子、生长因子、蛋白酶、信号蛋白和转录因子的上调,证明了模拟微重力对破骨细胞生成的积极作用[30]。 目前,在地面和太空实验中都可观察到微重力刺激对破骨细胞生成和破骨细胞活性的积极影响,这打破了成骨和破骨之间的平衡,引发了溶骨性破坏。破骨细胞在骨代谢过程中发挥着不可替代的功能,对于维持骨环境的稳态至关重要。因此,研究破骨细胞在骨质疏松的形成这一关键节点具有重要意义。深入了解破骨细胞的生物学机制,有助于为临床上治疗相关的骨代谢疾病提供有力的治疗策略。 2.3 微重力对间充质干细胞的影响 骨髓间充质干细胞是存在于成年人骨髓中的一类多能干细胞,它们具备能够朝多个方向分化的潜能。微重力所引起骨髓间充质干细胞的功能紊乱会影响骨形成[31]。微重力暴露导致骨髓间充质干细胞更倾向于向成脂谱系细胞分化,而不是向成骨或成肌谱系细胞分化[5]。在微重力暴露后,培养于促进骨形成的条件下的细胞无法有效促进成骨分化,因为与骨形成相关的基因,如碱性磷酸酶、Ⅰ型胶原蛋白α1链、Runt相关转录因子2和骨连接蛋白的表达均下降[32-33]。同时,成脂相关基因,如过氧化物酶体增殖物激活受体γ、补体因子D、瘦素和葡萄糖转运蛋白4的表达上调[5]。这减弱了它们维持骨骼健康的能力和对力学环境变化的反应和适应能力。骨髓间充质干细胞对成脂谱系的分化增加也降低了骨和骨骼肌组织的再生和损伤恢复的能力。此外,微重力可以降低骨髓间充质干细胞的数量和功能[34]。这些效应类似于衰老的影响,因此,研究微重力暴露的效应有助于理解衰老的效应。模拟微重力降低了骨髓间充质干细胞向成骨细胞分化的趋势,对骨形成和骨密度维持产生了负面影响[32]。模拟微重力还减少了骨髓间充质干细胞的细胞增殖,改变了细胞核大小,降低了细胞骨架蛋白的表达[35]。航天员结束航天飞行任务后返回标准重力可以恢复骨量,然而,大多数航天员骨密度恢复时间是飞行任务时间的6倍[36]。这表明微重力骨髓间充质干细胞向成骨细胞分化的能力具有长期影响。 近年来,对于微重力对骨髓间充质干细胞功能调控研究不断深入,由于干细胞具有多向分化的潜能,如何促进骨髓间充质干细胞在微重力环境中向成骨方向分化,对预防和治疗机械卸载导致的骨质疏松,具有至关重要的意义。 2.4 微重力对骨细胞的影响 骨细胞是作为成熟骨组织中数量最丰富的细胞类型,占据骨骼所有细胞数量的90%-95%。骨细胞是骨组织感知和响应力学刺激的细胞学基础[37]。骨细胞定居在矿化骨基质的腔隙中,在那里它们合成有助于骨矿化的蛋白质,如胶原蛋白和糖胺聚糖[38]。研究发现,微重力环境会阻碍成骨细胞分化为骨细胞[38]。同时导致负责分泌基质蛋白的骨细胞高尔基复合体发育不全,造成骨基质矿化减缓[38]。一些研究表明,骨细胞在微重力环境中暴露3 d便会发生细胞凋亡,形成更多的空骨陷窝[38-39],或者骨陷窝的形状改变[39]。地面试验中,后肢卸载大鼠的骨细胞凋亡与对照组相比增加了66%[40]。骨细胞的死亡与破骨细胞活性的增加有关[41]。在模拟微重力的条件下,骨细胞可以通过分泌硬化蛋白和RANKL来促进破骨细胞介导的骨质流失[42],表明骨细胞在微重力诱导的骨吸收中发挥关键作用。即使在后肢卸载模型中的同一动物体内,也证明了骨细胞对破骨细胞的机械敏感性的影响。与同一后肢卸载大鼠的负重前肢相比,空载股骨中的硬化蛋白升高,与负载前肢相比,空载后肢的骨细胞数量减少和破骨细胞活性增加一致[43]。骨细胞分泌的硬化蛋白通过拮抗BMP/Wnt信号传导来负向调节成骨细胞介导的骨形成[44]。模拟微重力可以抑制Wnt信号通路并下调细胞周期相关基因,例如骨细胞样细胞中的细胞周期蛋白D1,这可以通过施用抗硬化蛋白[45]抗体来部分恢复。在后肢卸载小鼠模型中,硬化蛋白或RANKL的消减似乎可以保护卸载引起的骨质流失[46]。骨细胞在机械卸载或微重力暴露时促进破骨细胞生成和骨吸收中发挥着至关重要的作用。未来的研究在探索针对骨质流失的治疗干预措施时,可以利用骨细胞影响成骨细胞和破骨细胞的独特能力。然而,尽管骨细胞是骨组织中最丰富的细胞类型,但由于目前的培养条件下它们无法嵌入骨基质中,因此对骨细胞的研究较少。此外,分离培养的骨细胞由于培养环境与体内的骨细胞生长环境相差较大,导致实验结果可能存在一定偏差。因此,需要建立更接近原生的骨细胞培养方案。 2.5 微重力对造血干细胞的影响 因为在体外对造血干细胞进行的研究相对较少,关于造血干细胞如何响应微重力的数据有限。已有的研究表明,机械应力加载有助于造血干细胞的分化和成熟,提示在微重力环境中的机械卸载可能会阻止这些效应[47]。实际上,当造血干细胞在微重力中暴露11 d或模拟微重力2 d时,造血干细胞抗原34+(CD34+)细胞的增殖和分化减少[48]。微重力还破坏了这些细胞的迁移潜能和细胞周期进程[49]。微重力条件下,髓系祖细胞数量增加而红系祖细胞数量减少,向巨噬细胞谱系细胞分化增加,造血干细胞向红细胞的分化减少[50]。微重力环境同时降低了红细胞的增殖,这可能对组织氧水平产生负面影响[51]。对航天员和暴露于模拟微重力环境中的动物的研究表明,微重力暴露可能导致一种称为空间贫血的疾病[50],其特征是红细胞质量和血红蛋白含量的减少。既往的研究发现,在老年男性和女性中发现骨密度与血红蛋白水平呈正相关[52]。一项回顾性队列研究发现,贫血与老年男性骨折风险增加有关,而在老年女性中,贫血的影响虽然较小但仍然非常显著[53]。一项荟萃分析也显示男性贫血患者的骨折风险增加1.51倍,而女性贫血患者的骨折风险增加1.09倍[54]。JORGENSEN等[55]的研究表明,血红蛋白值越低,男性发生非椎体骨折的风险增加1.27倍,女性发生非椎体骨折的风险增加1.08倍。LOOKER [56]的研究表明,在校正年龄和性别后,低血红蛋白与65岁及以上非西班牙裔白人的髋部骨折风险增加有关。此外,航天飞行中骨小梁的丢失也可能影响造血干细胞,因为造血通常发生在骨小梁体积最大的位置[57]。根据先前的文献报道,微重力暴露后骨髓中脂肪细胞的积累和脂肪生成的增加可能对造血干细胞的功能产生负面影响[58],这可能进一步危害到航天员的身体健康。 基于目前的认识,文章总结了贫血对骨骼的负面影响。微重力环境下导致的贫血和骨小梁丢失导致的造血能力下降,进一步促进了骨质流失,这导致了贫血与骨质流失的恶性循环。推动对骨代谢和血液学领域的基础医学研究,增进对这些疾病背后生物学机制的理解。如何解决微重力环境对造血干细胞和骨的不利影响,关系的航天员的身体健康和整体健康状态,也为研究者们治疗贫血相关的骨质流失提供了思路[58-59]。 通过对现有文献的分析,文章总结了微重力对导致骨质疏松相关的各类细胞的影响,见表1。 "
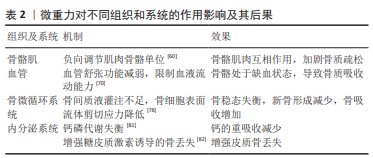
2.6 微重力对骨骼肌的影响 肌肉和骨骼与关节和韧带结构协同作用,为肌肉骨骼功能单位,这些组成部分的形成、维持和重塑之间存在强烈的相互作用。失用等机械卸载问题导致的骨质疏松被认为是现代社会中非常严重的健康问题之一,尽管在年轻人群中,这种影响尚不突出。但是在年轻的受试者中,肌肉和骨骼的机械卸载也会导致肌肉萎缩和骨质流失[60]。肌肉和骨骼的生理相互作用,重点是机械力。在模拟微重力过程中可以观察到肌肉和骨量的持续损失。在超过90 d的长期卧床实验中,6°头低倾斜卧位导致肌纤维横截面积减少了26% [61];这一过程伴随着骨吸收标记物的增加以及硬化蛋白和肌肉生长抑制素的增加,这种作用在机械应力重新加载后是可逆的[62]。肌肉和骨骼之间细胞因子的相互作用在近年来不断得到证实。例如,一些促进骨形成的因子以及促进骨吸收的因子,如前列腺素E2和RANKL,对肌肉的合成代谢和分解代谢产生作用[63-64]。相反,许多在卸载过程中增加的对肌肉作用的细胞因子,如白细胞介素6和肌肉生长抑制素,通过促进破骨细胞形成和抑制成骨细胞活性对骨骼产生不良影响[65]。这些结果表明,有针对性地干预骨骼肌和骨之间共享的生化途径可能有效改善与机械卸载相关的肌肉骨骼流失。 骨骼和肌肉能够感知机械应变,随之转导生化信号,并通过相互影响彼此的组织结构来平衡肌肉力量和抗骨折能力。当前正在进行的研究活动致力于研究物理学变化转化为生物化学和细胞生物学的分子机制,这有助于研究者们从更高的维度对人体进行更整体的研究。研究肌肉骨骼间的相互作用,对于维护骨骼健康、提高生活质量以及解决太空探索中的健康问题都具有重要价值。 2.7 微重力对血管的影响 体内血管在维持氧气、养分和激素传递、清除废物、支持免疫系统、维持体温以及维持酸碱平衡等方面发挥着关键作用。在正常站立状态下,地球上的重力势能推动着血液自上向下分布。在微重力环境中,原有的重力势能驱动的血液流动模式消失,促使血液更多向头部分布,这导致不同部位骨骼的血流量发生变化,尤其是下肢血流减少最为显著。在微重力环境下,下肢血流减少的同时,股骨和胫骨的骨密度显著下降。与下肢骨不同,航天员的颅骨在微重力下血流灌注增加,骨质密度也显著提高[66]。研究还发现,在下肢动脉粥样硬化疾病模型中,血管阻塞是导致骨质流失的主要原因,进一步表明外周血流量和血压的变化可能是调节骨重塑的重要因素[67]。 在正常生理状态下,血管内皮细胞富含一氧化氮合酶,通过生成一氧化氮来调节血管平滑肌张力,从而调控血管的舒张功能[68]。以往的研究发现,一氧化氮介导的骨阻力动脉血管舒张与骨小梁骨量的增加密切相关[69]。PRISBY等[70]的研究表明,在微重力动物模型中,骨骼血管系统中一氧化氮的合成减少,导致内皮依赖性血管舒张功能减弱,这种减少主要是由于血流量减少和血管内剪切力的改变引起的内皮一氧化氮合酶信号通路下调所致[70]。此外,微重力条件下小鼠血管平滑肌细胞对一氧化氮的反应性下降,减少了一氧化氮的利用[71]。微重力环境下骨血管阻力动脉的内皮依赖性血管舒张功能受损,强化了骨血管阻力,限制了微重力下血管充血和血液流动的能力[72],可能导致了骨量生成减少。正常生理状态下,机械载荷通过调节骨骼血管生成来影响骨骼血管的数量。适度的运动训练能够增加血液流向骨骼区域,促进骨骼内血管的生成[73]。然而,在骨骼失用状态下,血管重塑发生,动脉毛细血管数量减少,导致血流减少,进而降低骨形成[74]。 在太空航行中,航天员通常通过适度的运动来减轻骨质丢失,但受到失重和空间限制,其运动量无法达到地面上的平均水平。因此,长时间无法进行正常运动可能是导致血管数量减少的一个重要原因。VEERIAH等[75]的研究发现,在微重力环境下,成骨细胞可以响应机械载荷,过度分泌血管内皮生长因子,通过成骨细胞与内皮细胞之间的串扰促进血管生成。然而,这种作用对血管生成的程度是有限的,无法对冲微重力环境下下肢皮质骨内血管生成减少的趋势。 在微重力作用下,骨血管重塑是导致骨质丢失的一个关键因素。这包括骨血管网络结构的改变和动脉的内皮依赖性血管舒张功能受损,这些变化增加了骨血管阻力,限制了再充血和血液流动的能力。此外,缺乏运动和太空辐射也是导致血管重塑的重要原因。在经历血管重塑后,骨骼长时间处于缺血状态,这可能导致骨细胞凋亡和成骨细胞活性下降。此过程还可能在一定程度上刺激破骨细胞的活性,通过骨吸收导致骨量的丢失,使下肢骨骼无法维持正常的稳态。 2.8 微重力对骨微循环的影响 骨的微循环包括骨的微血管网络和骨陷窝-小管系统,骨膜动脉通过分支毛细血管对骨组织进行供血,并与骨营养动脉通过穿骨质的毛细血管相互偶联,组成了骨的微血管网络。骨细胞位于矿化骨基质的陷窝中,其胞体具有很多细长的树突结构,这些树突结构则位于小管内,骨细胞通过树突结构构成细胞网络,其外部的细胞陷窝和突出的小管相互连接,形成了骨陷窝-小管系统,骨陷窝-小管系统内充满了骨间质液。骨的微血管网络是骨陷窝-小管系统内间质液的来源,微循环通过压力梯度驱动骨间质液灌注,以维持骨组织细胞周围的营养和代谢微环境[76]。当骨髓腔内的骨微循环灌注不足时,会导致骨形成能力下降和骨量减少[77]。 骨的营养动脉通过在骨的微血管循环中保持间质液压力以及液体流动来调节骨髓内压[76]。当骨间质液流动时,骨细胞表面的流体剪切力激活了感受机械负载的骨细胞,进而激活了骨的合成代谢反应[76]。 在微重力环境中,骨血管的血流量减少和体液的重新分布,导致骨营养动脉的充盈不足,血流动力减弱,增加了血管阻力,影响了骨微循环的正常生理状态。骨细胞分布在骨陷窝-小管系统内,是骨组织的重要力学感受器。骨细胞通过感受骨间质液的流体剪切应力,将力学刺激转化到Notch和Wnt/β-catenin等信号通路,通过对成骨细胞及破骨细胞的调控来调整骨重塑过程[78]。血管重塑后的间质液流动变化可能会降低骨细胞感受到的流体剪切力,这种变化可能改变骨细胞的下游信号通路传导,进而打破骨稳态的平衡状态。导致新骨形成减少,同时增加骨骼的吸收过程[79]。此外,微血管灌注不足导致骨间质液流动减少,降低了骨细胞吸收氧气和养分、排除废物的能力,同时引起骨细胞凋亡并导致成骨细胞的活性降低,增加破骨细胞的吸收活性。这一过程导致骨稳态失衡,从而导致骨吸收和骨量丢失。 微重力环境下由于骨血管重塑和舒张功能受限,导致骨间质液灌注不足,进而影响了骨细胞周围的组织液流体剪切力,导致骨细胞通过感受流体剪切应力调节骨的重建过程失衡。同时,骨间质液灌注不足导致物质交换受阻,引起了骨细胞凋亡,破骨细胞活性增加。改善微重力导致的血管重塑,改善骨的微循环,增强骨陷窝-小管系统内的流体剪切应力,是对抗微重力环境导致骨质疏松的重要方法。 2.9 微重力对内分泌系统的影响 在正常生理条件下,体内的钙磷代谢由甲状旁腺主细胞分泌的甲状旁腺激素进行调节。甲状旁腺激素的影响涉及骨转换、肾脏稳态以及通过刺激活性维生素D产生的肠道Ca2+吸收。当在失重状态下,身体的低负载增加了骨吸收,使得大量的钙从骨骼中释放出来[80]。骨组织过度释放钙会抑制甲状旁腺激素和循环1,25-二羟基维生素 D,从而导致肠道钙吸收减少,从而导致肌肉萎缩和骨质疏松症的发生[81]。YANG等[82]研究者通过后肢卸载小鼠模型研究发现机械卸载通过增强成骨细胞和骨细胞中的糖皮质激素信号传导而导致皮质骨丢失。接受后肢卸载 治疗的雄性小鼠不仅导致全身糖皮质激素水平增加,而且同时导致胫骨骨量减少。相比之下,成骨细胞和骨细胞中糖皮质激素信号的破坏完全阻止了后肢卸载诱导的皮质骨中的骨丢失,但不能阻止松质骨中的骨丢失。因此,后肢卸载诱导的糖皮质激素水平升高似乎会以特定部位的方式导致骨质流失[82]。文章总结了微重力通过不同的组织和系统产生不同作用诱导骨质疏松,见表2。 "
| [1] LAMBERS FM, SCHULTE FA, KUHN G, et al. Mouse tail vertebrae adapt to cyclic mechanical loading by increasing bone formation rate and decreasing bone resorption rate as shown by time-lapsed in vivo imaging of dynamic bone morphometry. Bone. 2011;49(6):1340-1350. [2] SIDDIQUI JA, PARTRIDGE NC. Physiological bone remodeling: systemic regulation and growth factor involvement. Physiology (Bethesda). 2016;31(3):233-245. [3] LI L, ZHANG C, CHEN J, et al. Effects of simulated microgravity on the expression profiles of RNA during osteogenic differentiation of human bone marrow mesenchymal stem cells. Cell Prolif. 2019;52(2):e12539. [4] PAN Z, YANG J, GUO C, et al. Effects of hindlimb unloading on ex vivo growth and osteogenic/adipogenic potentials of bone marrow-derived mesenchymal stem cells in rats. Stem Cells Dev. 2008;17(4):795-804. [5] ZHANG C, LI L, JIANG Y, et al. Space microgravity drives transdifferentiation of human bone marrow-derived mesenchymal stem cells from osteogenesis to adipogenesis. FASEB J. 2018;32(8):4444-4458. [6] PARDO SJ, PATEL MJ, SYKES MC, et al. Simulated microgravity using the random positioning machine inhibits differentiation and alters gene expression profiles of 2T3 preosteoblasts. Am J Physiol Cell Physiol. 2005;288(6):C1211-C1221. [7] BRAVEBOY-WAGNER J, LELKES PI. Impairment of 7F2 osteoblast function by simulated partial gravity in a random positioning machine. NPJ Microgravity. 2022;8(1):20. [8] HU L, LI R, SU P, et al. Response and adaptation of bone cells to simulated microgravity. Acta Astronautica. 2014;104(1):396-408. [9] XU LH, SHAO H, MA YV, et al. OCY454 Osteocytes as an in vitro cell model for bone remodeling under mechanical loading. J Orthop Res. 2019;37(8):1681-1689. [10] PROWSE PDH, ELLIOTT CG, HUTTER J, et al. Inhibition of Rac and ROCK signalling influence osteoblast adhesion, differentiation and mineralization on titanium topographies. PLoS One. 2013;8(3):e58898. [11] GUPTA A, ANDERSON H, BUO AM, et al. Communication of cAMP by connexin43 gap junctions regulates osteoblast signaling and gene expression. Cell Signal. 2016;28(8):1048-1057. [12] DONAHUE HJ, QU RW, GENETOS DC. Joint diseases: from connexins to gap junctions. Nat Rev Rheumatol. 2017;14(1):42-51. [13] LI X, LIU C, LI P, et al. Connexin 43 is a potential regulator in fluid shear stress‐induced signal transduction in osteocytes. J Orthop Res. 2013;31(12):1959-1965. [14] CHUNG DJ, CASTRO CHM, WATKINS M, et al. Low peak bone mass and attenuated anabolic response to parathyroid hormone in mice with an osteoblast-specific deletion of connexin43. J Cell Sci. 2006;119(20):4187-4198. [15] LLOYD SA, LOISELLE AE, ZHANG Y, et al. Evidence for the role of connexin 43-mediated intercellular communication in the process of intracortical bone resorption via osteocytic osteolysis. BMC Musculoskelet Disord. 2014;15:122-122. [16] NABAVI N, KHANDANI A, CAMIRAND A, et al. Effects of microgravity on osteoclast bone resorption and osteoblast cytoskeletal organization and adhesion. Bone. 2011;49(5):965-974. [17] DUFOUR C, HOLY X, MARIE PJ. Skeletal unloading induces osteoblast apoptosis and targets α5β1-PI3K-Bcl-2 signaling in rat bone. Exp Cell Res. 2007;313(2):394-403. [18] ALLEN MR, BLOOMFIELD SA. Hindlimb unloading has a greater effect on cortical compared with cancellous bone in mature female rats. J App Physiol. 2003;94(2):642-650. [19] IKEDA K, TAKESHITA S. The role of osteoclast differentiation and function in skeletal homeostasis. J Biochem. 2016;159(1):1-8. [20] IKEGAME M, HATTORI A, TABATA MJ, et al. Melatonin is a potential drug for the prevention of bone loss during space flight. J Pineal Res. 2019;67(3):e12594. [21] YAMAMOTO T, IKEGAME M, HIRAYAMA J, et al. Expression of sclerostin in the regenerating scales of goldfish and its increase under microgravity during space flight. Biomed Res. 2020;41(6):279-288. [22] TAMMA R, COLAIANNI G, CAMERINO C, et al. Microgravity during spaceflight directly affects in vitro osteoclastogenesis and bone resorption. FASEB J. 2009;23(8):2549-2554. [23] COLUCCI S, COLAIANNI G, BRUNETTI G, et al. Irisin prevents microgravity-induced impairment of osteoblast differentiation in vitro during the space flight CRS-14 mission. FASEB J. 2020;34(8): 10096-10106. [24] ETHIRAJ P, LINK J, SINKWAY J, et al. Microgravity modulation of syncytin-A expression enhance osteoclast formation. J Cell Biochem. 2018;119(7):5696-5703. [25] LI Y, GAO X, LING S, et al. Knockdown of CD44 inhibits the alteration of osteoclast function induced by simulated microgravity. Acta Astronautica. 2020;166:607-612. [26] RUCCI N, RUFO A, ALAMANOU M, et al. Modeled microgravity stimulates osteoclastogenesis and bone resorption by increasing osteoblast RANKL/OPG ratio. J Cell Biochem. 2007;100(2):464-473. [27] METZGER C, NARAYANAN S, PHAN P, et al. Hindlimb unloading causes regional loading-dependent changes in osteocyte inflammatory cytokines that are modulated by exogenous irisin treatment. NPJ Microgravity. 2020;6(1):28. [28] SAXENA R, PAN G, DOHM ED, et al. Modeled microgravity and hindlimb unloading sensitize osteoclast precursors to RANKL-mediated osteoclastogenesis. J Bone Miner Metab. 2011;29(1):111-122. [29] SAMBANDAM Y, TOWNSEND M, PIERCE J, et al. Microgravity control of autophagy modulates osteoclastogenesis. Bone. 2014;61:125-131. [30] SAMBANDAM Y, BLANCHARD JJ, DAUGHTRIDGE G, et al. Microarray profile of gene expression during osteoclast differentiation in modelled microgravity. J. Cell. Biochem. 2010;111(5):1179-1187. [31] BLABER EA, DVOROCHKIN N, TORRES ML, et al. Mechanical unloading of bone in microgravity reduces mesenchymal and hematopoietic stem cell-mediated tissue regeneration. Stem Cell Res. 2014;13(2):181-201. [32] BASSO N, JIA Y, BELLOWS CG, et al. The effect of reloading on bone volume, osteoblast number, and osteoprogenitor characteristics: studies in hind limb unloaded rats. Bone. 2005;37(3):370-378. [33] ZAYZAFOON M, GATHINGS WE, MCDONALD JM. Modeled microgravity inhibits osteogenic differentiation of human mesenchymal stem cells and increases adipogenesis. Endocrinology. 2004;145(5):2421-2432. [34] BASSO N, BELLOWS CG, HEERSCHE JNM. Effect of simulated weightlessness on osteoprogenitor cell number and proliferation in young and adult rats. Bone. 2005;36(1):173-183. [35] GERSHOVICH PM, GERSHOVICH JG, ZHAMBALOVA AP, et al. Cytoskeletal proteins and stem cell markers gene expression in human bone marrow mesenchymal stromal cells after different periods of simulated microgravity. Acta Astronautica. 2012;70:36-42. [36] SIBONGA JD, EVANS HJ, SUNG HG, et al. Recovery of spaceflight-induced bone loss: bone mineral density after long-duration missions as fitted with an exponential function. Bone. 2007;41(6):973-978. [37] ROBLING AG, BONEWALD LF. The osteocyte: new insights. Annu Rev Physiol. 2020;82:485-506. [38] RODIONOVA NV, OGANOV VS, ZOLOTOVA NV. Ultrastructural changes in osteocytes in microgravity conditions. Adv Space Res. 2002;30(4): 765-770. [39] GERBAIX M, GNYUBKIN V, FARLAY D, et al. One-month spaceflight compromises the bone microstructure, tissue-level mechanical properties, osteocyte survival and lacunae volume in mature mice skeletons. Sci Rep. 2017;7(1):2659. [40] BASSO N, HEERSCHE J. Effects of hind limb unloading and reloading on nitric oxide synthase expression and apoptosis of osteocytes and chondrocytes. Bone. 2006;39(4):807-814. [41] ANDREEV D, LIU M, WEIDNER D, et al. Osteocyte necrosis triggers osteoclast-mediated bone loss through macrophage-inducible C-type lectin. J Clin Invest. 2020;130(9):4811-4830. [42] SPATZ JM, WEIN MN, GOOI JH, et al. The wnt inhibitor sclerostin is up-regulated by mechanical unloading in osteocytes in vitro. J Biol Chem. 2015;290(27):16744-16758. [43] METZGER C, BREZICHA J, ELIZONDO J, et al. Differential responses of mechanosensitive osteocyte proteins in fore- and hindlimbs of hindlimb-unloaded rats. Bone. 2017;105:26-34. [44] LI X, ZHANG Y, KANG H, et al. Sclerostin binds to LRP5/6 and antagonizes canonical Wnt signaling. J Biol Chem. 2005;280(20):19883-19887. [45] YANG X, SUN L W, LIANG M, et al. The response of wnt/β-catenin signaling pathway in osteocytes under simulated microgravity. Microgravity Sci Technol. 2015;27(6):473-483. [46] XIONG J, ONAL M, JILKA R, et al. Matrix-embedded cells control osteoclast formation. Nat Med. 2011;17(10):1235-1241. [47] ADAMO L, NAVEIRAS O, WENZEL PL, et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 2009;459(7250): 1131-1135. [48] JUHL OJ, BUETTMANN EG, FRIEDMAN MA, et al. Update on the effects of microgravity on the musculoskeletal system. NPJ Microgravity. 2021;7(1):28. [49] ULBRICH C, WEHLAND M, PIETSCH J, et al. The impact of simulated and real microgravity on bone cells and mesenchymal stem cells. Biomed Res Int. 2014;2014:928507. [50] DE SANTO NG, CIRILLO M, KIRSCH KA, et al. Anemia and erythropoietin in space flights. Semin Nephrol. 2005;25(6):379-387. [51] ZOU L, CUI S, ZHONG J, et al. Simulated microgravity induce apoptosis and down-regulation of erythropoietin receptor of UT-7/EPO cells. Adv Space Res. 2010;46(10):1237-1244. [52] LAUDISIO A, MARZETTI E, PAGANO F, et al. Haemoglobin levels are associated with bone mineral density in the elderly:a population-based study. Clin Rheumatol. 2009;28(2):145-151. [53] LEE E, SHIN D, YOO J, et al. Anemia and risk of fractures in older korean adults:a nationwide population-based study. J Bone Miner Res. 2019;34(6):1049-1057. [54] POTTIE K, GREENAWAY C, FEIGHTNER J, et al. Evidence-based clinical guidelines for immigrants and refugees. CMAJ. 2011;183(12): E824-E925. [55] JORGENSEN L, SKJELBAKKEN T, LOCHEN M, et al. Anemia and the risk of non-vertebral fractures: the Tromso Study. Osteoporos Int. 2010; 21(10):1761-1768. [56] LOOKER A. Hemoglobin and hip fracture risk in older non-Hispanic white adults. Osteoporos Int. 2014;25(10):2389-2398. [57] ÖZÇIVICI E. Effects of spaceflight on cells of bone marrow origin. Turk J Hematol. 2013;30(1):1-7. [58] NAVEIRAS O, NARDI V, WENZEL PL, et al. Bone-marrow adipocytes as negative regulators of the haematopoietic microenvironment. Nature. 2009;460(7252):259-263. [59] BLABER EA, DVOROCHKIN N, LEE C, et al. Microgravity induces pelvic bone loss through osteoclastic activity, osteocytic osteolysis, and osteoblastic cell cycle inhibition by CDKN1a/p21. PLoS One. 2013; 8(4):e61372. [60] PAGNOTTI G, STYNER M, UZER G, et al. Combating osteoporosis and obesity with exercise: leveraging cell mechanosensitivity. Nat Rev Endocrinol. 2019;15(6):339-355. [61] RITTWEGER J, FROST H, SCHIESSL H, et al. Muscle atrophy and bone loss after 90 days’ bed rest and the effects of flywheel resistive exercise and pamidronate: results from the LTBR study. Bone. 2005;36(6): 1019-1029. [62] BELAVY D, BAECKER N, ARMBRECHT G, et al. Serum sclerostin and DKK1 in relation to exercise against bone loss in experimental bed rest. J Bone Miner Metab. 2016;34(3):354-365. [63] TOMINARI T, ICHIMARU R, TANIGUCHI K, et al. Hypergravity and microgravity exhibited reversal effects on the bone and muscle mass in mice. Sci Rep. 2019;9(1):6614-6614. [64] BONNET N, BOURGOIN L, BIVER E, et al. RANKL inhibition improves muscle strength and insulin sensitivity and restores bone mass. J Clin Invest. 2019;129(8):3214-3223. [65] WU Q, ZHOU X, HUANG D, et al. IL-6 enhances osteocyte-mediated osteoclastogenesis by promoting JAK2 and RANKL activity in vitro. Cell Physiol Biochem. 2017;41(4):1360-1369. [66] GHOSH P, STABLEY JN, BEHNKE BJ, et al. Effects of spaceflight on the murine mandible:Possible factors mediating skeletal changes in non-weight bearing bones of the head. Bone. 2016;83:156-161. [67] GAUDIO A, XOURAFA A, RAPISARDA R, et al. Peripheral artery disease and osteoporosis: not only age‑related (Review). Mol Med Report. 2018;18(6):4787-4792. [68] GODO S, SHIMOKAWA H. Divergent roles of endothelial nitric oxide synthases system in maintaining cardiovascular homeostasis. Free Radic Biol Med. 2017;109:4-10. [69] DOMINGUEZ JM 2ND, PRISBY RD, MULLER-DELP JM, et al. Increased nitric oxide-mediated vasodilation of bone resistance arteries is associated with increased trabecular bone volume after endurance training in rats. Bone. 2010;46(3):813-819. [70] PRISBY D, BEHNKE BJ, ALLEN MR, et al. Effects of skeletal unloading on the vasomotor properties of the rat femur principal nutrient artery. J Appl Physiol (1985). 2015;118(8):980-988. [71] PRISBY RD, ALWOOD JS, BEHNKE BJ, et al. Effects of hindlimb unloading and ionizing radiation on skeletal muscle resistance artery vasodilation and its relation to cancellous bone in mice. J Appl Physiol (1985). 2016;120(2):97-106. [72] STABLEY JN, PRISBY RD, BEHNKE BJ, et al. Chronic skeletal unloading of the rat femur:mechanisms and functional consequences of vascular remodeling. Bone. 2013;57(2):355-360. [73] TOMLINSON RE, SILVA MJ. Skeletal blood flow in bone repair and maintenance. Bone Res. 2013;1(4):311-322. [74] TONG X, CHEN X, ZHANG S, et al. The effect of exercise on the prevention of osteoporosis and bone angiogenesis. Biomed Res Int. 2019;2019:8171897. [75] VEERIAH V, PAONE R, CHATTERJEE S, et al. Osteoblasts regulate angiogenesis in response to mechanical unloading. Calcif Tissue Int. 2018;104(3):344-354. [76] PRISBY RD. Mechanical, hormonal and metabolic influences on blood vessels, blood flow and bone. J Endocrinol. 2017;235(3):R77-R100. [77] BIFFAR A, SCHMIDT GP, SOURBRON S, et al. Quantitative analysis of vertebral bone marrow perfusion using dynamic contrast‐enhanced MRI:initial results in osteoporotic patients with acute vertebral fracture. J Magn Reson Imaging. 2011;33(3):676-683. [78] CANALIS E, ADAMS DJ, BOSKEY A, et al. Notch signaling in osteocytes differentially regulates cancellous and cortical bone remodeling. J Biol Chem. 2013;288(35):25614-25625. [79] PRICE C, ZHOU X, LI W, et al. Real-time measurement of solute transport within the lacunar-canalicular system of mechanically loaded bone:direct evidence for load-induced fluid flow. J Bone Miner Res. 2011;26(2):277-285. [80] SMITH SM, WASTNEY ME, O’BRIEN KO, et al. Bone markers, calcium metabolism, and calcium kinetics during extended‐duration space flight on the mir space station. J Bone Miner Res. 2005;20(2):208-218. [81] GRIMM D, GROSSE J, WEHLAND M, et al. The impact of microgravity on bone in humans. Bone. 2016;87:44-56. [82] YANG J, LI J, CUI X, et al. Blocking glucocorticoid signaling in osteoblasts and osteocytes prevents mechanical unloading-induced cortical bone loss. Bone. 2020;130:115108. [83] TOMILOVSKAYA E, SHIGUEVA T, SAYENKO D, et al. Dry immersion as a ground-based model of microgravity physiological effects. Front Physiol. 2019;10:284. [84] BRUNGS S, HAUSLAGE J, HEMMERSBACH R. Validation of random positioning versus clinorotation using a macrophage model system. Microgravity Sci Technol. 2019;31(2):223-230. [85] TESCH P, LUNDBERG T, FERNANDEZ-GONZALO R. Unilateral lower limb suspension: from subject selection to “omic” responses. J App Physiol. 2016;120(10):1207-1214. |
| No related articles found! |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||