Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (10): 2151-2161.doi: 10.12307/2025.261
Previous Articles Next Articles
Multiple applications of metal-organic framework materials in bone tissue engineering and orthopedic disease treatment
Liu Yunxiang1, Zhang Xiaoyu2, Li Hao1, Zhang Rong3, Li Liping3, Chen Chongwei1
- 1Department of Orthopedics, Second Hospital of Shanxi Medical University, Taiyuan 030001, Shanxi Province, China; 2College of Medical Imaging, Shanxi Medical University, Taiyuan 030001, Shanxi Province, China; 3Shanxi Bethune Hospital (Tongji Shanxi Hospital, Shanxi Academy of Medical Sciences), Third Hospital of Shanxi Medical University, Taiyuan 030032, Shanxi Province, China
-
Received:2024-01-18Accepted:2024-03-05Online:2025-04-08Published:2024-08-23 -
Contact:Corresponding author: Chen Chongwei, Chief physician, Professor, Master’s supervisor, Department of Orthopedics, Second Hospital of Shanxi Medical University, Taiyuan 030001, Shanxi Province, China Co-corresponding author: Li Liping, Professor, Doctoral supervisor, Shanxi Bethune Hospital (Tongji Shanxi Hospital, Shanxi Academy of Medical Sciences), Third Hospital of Shanxi Medical University, Taiyuan 030032, Shanxi Province, China Co-corresponding author: Zhang Rong, Associate researcher, Shanxi Bethune Hospital (Tongji Shanxi Hospital, Shanxi Academy of Medical Sciences), Third Hospital of Shanxi Medical University, Taiyuan 030032, Shanxi Province, China -
About author:Liu Yunxiang, Master candidate, Department of Orthopedics, Second Hospital of Shanxi Medical University, Taiyuan 030001, Shanxi Province, China -
Supported by:Shanxi Provincial Natural Science Foundation, No. 202103021223414 (to ZR)
CLC Number:
Cite this article
Liu Yunxiang, Zhang Xiaoyu, Li Hao, Zhang Rong, Li Liping, Chen Chongwei. Multiple applications of metal-organic framework materials in bone tissue engineering and orthopedic disease treatment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2151-2161.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 金属有机框架材料的性质 金属有机框架材料由金属离子或团簇形成的无限晶格和通过强配位键连接的有机配体组成,通常表现为二维或三维结构[3]。在过去几十年中,金属有机框架材料的制备、表征及应用的研究显著增长[2],多个研究团队相继开发出1,3,5-均苯三羧酸铜、沸石咪唑酯框架ZIF系列、和拉瓦锡框架材料系列等不同结构的金属有机框架材料。 金属有机框架材料最显著的特征是高孔隙率和高比表面积,通常金属有机框架材料的孔隙率超过其晶体体积的50%,其高孔隙率主要得益于次级和三级结构的组装。次级结构单元是由金属和多配位点有机配体连接构成[4],而三级结构单元则是由金属有机多面体组成的周期性网络,决定了金属有机框架的整体形态和孔隙分布。金属有机框架材料比表面积在1 000-10 000 m2/g[5],远超传统的多孔材料。结构的可调性是金属有机框架的重要性质之一,能够根据特定药物分子的大小定制金属有机框架孔隙结构。如,通过延长有机配体的链长可以获得孔道尺寸更大的金属有机框架[6]。此外,通过控制金属有机框架的成核和生长速率,可以调整晶体的大小,以适应不同给药剂量和目的:较大尺寸的金属有机框架能装载更多药物,适用于高剂量药物释放,而小尺寸的金属有机框架则更易于穿过生物屏障,实现靶向递送[7-9],见图4。在功能上,不同类型的金属中心是影响金属有机框架性质的重要因素[10-16]。根据金属离子类型可分为过渡金属、碱金属、碱土金属及稀土金属。铜(Cu)、锌(Zn)、钴(Co)、镍(Ni)、铁(Fe)、锆(Zr)等过渡金属具有独特的电子性质,使金属有机框架在催化、气体存储和分离方面表现出色;碱金属和碱土金属,如钠(Na)、钾(K)、钙(Ca)、镁(Mg)、钡(Ba)等金属中心易于发生离子交换反应;镧(La)、铈(Ce)、钕(Nd)等稀土金属在光学、电子性质方面的特殊性,使其在生物成像领域应用广泛。此外,两种或多种不同金属离子组成的金属有机框架结构,为设计具有特定功能的金属有机框架提供了更广泛的可能性,见表1。"


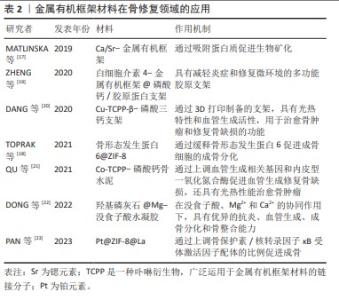
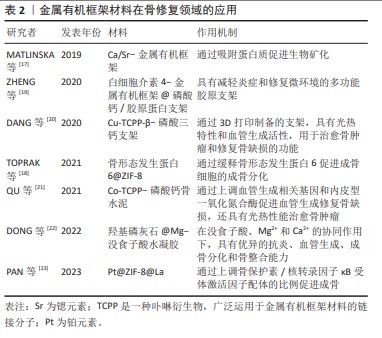
2.2.1 金属有机框架材料促进成骨基因的表达 成骨细胞的增殖和分化在骨修复过程中起着关键作用。在成骨的早期阶段,金属有机框架通过调控成骨细胞表型的核心基因Runx2的转录活性来促进成骨过程[24]。研究证明,1,3,5-均苯三羧酸铜上装载的Sr2+能显著增加Runx2的转录活性和磷酸化,且多种金属有机框架均能有效促进Runx2基因的表达[25]。在成骨中期,金属有机框架通过增强碱性磷酸酶的表达和活性进一步促进成骨。碱性磷酸酶作为一种关键蛋白,通过水解磷酸盐化合物产生磷酸盐,从而助力骨形态的形成。此外,骨形态发生蛋白对骨骼和软骨的形成至关重要。TOPRAK等[18]通过一锅法合成了含骨形态发生蛋白6的ZIF-8纳米晶体,在骨缺损修复中显示出卓越的成骨能力。同时,ZHENG等[19]利用Ⅰ型胶原蛋白自身具有机械支持能力和促进细胞附着的特性,采用胶原支架与白细胞介素4-金属有机框架@CaP结合,形成一个多功能、可生物降解的支架系统,该系统为骨再生多细胞单元提供了多个成骨性成核位点,实现了体内功能性骨再生。在成骨后期,骨桥蛋白和骨钙素等非胶原性蛋白发挥着重要作用。骨桥蛋白在骨组织的矿化和成熟过程中,通过干预细胞的黏附和迁移发挥作用;而骨钙素可以与Ca2+结合,调节钙离子稳态,参与骨矿化过程。金属有机框架则能够通过转录和翻译过程提高这些蛋白的表达水平,从而促进成骨[13]。 2.2.2 金属有机框架材料抑制破骨细胞 成骨细胞和破骨细胞在骨再生和重塑过程中扮演着至关重要的角色,二者相互制约。成骨细胞的减少或破骨细胞的过度增多,均会破坏骨组织结构,极大地增加了由骨缺损引发的骨质疏松和骨不连等疾病的风险。骨保护素是在骨代谢中发挥关键作用的蛋白质,它通过与核转录因子κB受体激活因子配体结合,从而抑制了破骨细胞的形成和活性。抗酒石酸酸性磷酸酶是代表破骨细胞活性的标志性指标。因此,通过增加骨保护素的分泌和减少抗酒石酸酸性磷酸酶的分泌,可以有效地抑制骨吸收过程。PAN等[23]将铂包裹在ZIF-8中,并通过离子交换引入镧,从而构建了多金属金属有机框架(Pt@ZIF-8@La),该体系可以上调骨保护素/核因子κB受体激活因子配体的比例,从而促进成骨。此外,TAO等[7]合成了唑来膦酸功能化的矿化金属有机框架,用以抵抗类风湿关节炎中破骨细胞的过度激活。唑来膦酸是第三代双膦酸盐,能够阻止破骨细胞与骨基质的结合,从而干扰核转录因子κB受体激活因子配体/核转录因子κB受体激活因子信号通路,抑制破骨细胞分化,并诱导破骨细胞凋亡,以对抗破骨细胞介导的骨吸收。 2.2.3 金属有机框架材料促进血管生成 在骨骼再生过程中,通常由血管系统提供营养和氧气以促进骨骼发育和再生,因此,血管生成和成骨是紧密结合的,丰富的血供对于骨再生与修复至关重要。例如,旋股内侧动脉的损伤是导致股骨颈骨折后股骨头坏死的主要原因之一,而由于血供相对不足,胫腓骨远端骨折术后常延迟愈合甚至不愈合,凸显了血运对于骨组织修复的重要性。上调血管内皮生长因子α能够增加血管的通透性,并刺激人脐静脉内皮细胞中血管生成相关基因和内皮型一氧化氮合酶的表达。血管生成相关基因VE-cadherin和内皮型一氧化氮合酶是血管新生的关键分子,QU等[21]利用Co和四(4-羧酸苯基)卟啉(TCPP)制备了一种钴基有机金属框架(Co-TCPP)改性的磷酸钙骨水泥,验证了Co-TCPP-磷酸钙骨水泥通过上调血管生成相关基因VE-cadherin和内皮型一氧化氮合酶含量促进血管再生在治疗肿瘤性骨缺损方面的巨大潜力,此外,Cu2+同样具有促血管生成活性[20],而Mg2+已被证明在通过镁转运蛋白1流入细胞后,也可激活缺氧诱导因子1a,从而刺激血管内皮生长因子的转录并诱导血管生成[21-26]。除上述3种金属中心的金属有机框架材料外,其他金属有机框架材料也可以作为载体,负载促血管生成的小分子药物以促进血管生成[27]。 2.2.4 金属有机框架材料诱导骨矿化 在骨修复过程中,骨矿化为新生骨组织提供了必要的支撑和稳定性,是骨修复的关键步骤。骨矿化是指羟基磷灰石等骨矿物质在有机胶原蛋白支架上沉淀的过程,最终形成骨基质,这一过程动态且复杂,其中骨矿物质和胶原蛋白的结合至关重要。金属有机框架材料中的金属离子,如Mg2+,Zn2+,Mn2+,Sr2+和Ba2+等可以通过离子交换的方式影响羟基磷灰石的组成,同时离子交换引起的键长变化会导致羟基磷灰石晶体结构的变形,从而影响骨矿化进程[28]。此外,Sr2+对骨组织有较高的亲和力,ZHANG等[29]构建的Sr-羟基磷灰石-金属有机框架74复合涂层能显著提升早期成骨和骨植入物的整合,在碱性磷酸酶活性及骨矿化方面表现出色。MATLINSKA等[17]将Sr2+,Ca2+与二甲苯基双膦酸酯连接合成了Ca/Sr-金属有机框架,通过吸附牛血清蛋白实验模拟Ca/Sr-金属有机框架与体内蛋白质相互作用,验证了金属有机框架材料促进骨矿化的潜力,并发现通过改变Sr2+/Ca2+比值可以控制Ca/Sr-金属有机框架降解的速率,对后续装载药物的可控释放具有重要意义。其中,Sr2+对骨组织有较高的亲和力,利用这一特性构建Sr-羟基磷灰石-金属有机框架74复合涂层表现出骨整合生物活性,并促进了植入物-骨界面的生物矿化[29]。此外,部分金属有机框架材料中金属离子与Ca2+的离子半径相接近,同样可以通过离子交换促进磷酸盐的沉积[23],如La3+,已经证实掺杂La之后,La-羟基磷灰石涂层界面结合强度显著增强[30]。"


2.3 金属有机框架材料在骨感染中的应用 骨科植入物在固定病变部位方面发挥着关键作用。除了促进骨修复外,防止感染也是骨科植入物的一个重要目标[31-38],见表3。感染会抑制损伤区域正常组织的形成和骨再生过程。通常,感染是由细菌首先附着在植入物表面引起的,继而通过与丝氨酸内酯酰化分子的相互作用聚集;细菌中的某些基因在内酯浓度增加时被激活,促使蛋白质合成,形成细胞外基质,最终导致细菌生物膜的形成[39]。尽管全身性抗生素的使用可以抑制细菌生长,但它们往往无法根除细菌生物膜。此外,过度使用抗生素可能导致细菌产生耐药性,这是当前骨植入物发展面临的重要挑战。2.3.1 金属有机框架材料作为抗菌药物的载体 极高的孔隙率及不饱和的金属位点和有机配体使金属有机框架材料表现出较强的分子吸附能力,故金属有机框架材料可以用于负载各类抗菌药物,再配合以pH响应型金属有机框架材料,能够实现抗菌药物在骨感染区域的定点释放。感染发生时,微环境的pH值从7.4降至5.5。沸石咪唑框架8(ZIF-8)金属有机框架结构在酸性体系中由于配位分解而解离,KARAKE?ILI等[33]将装载万古霉素的ZIF-8负载在3D壳聚糖支架上,ZIF-8结构响应性降解,释放出高浓度的万古霉素,对严重的骨感染具有显著抑制效果。在钛合金植入物表面修饰装载左氧氟沙星的ZIF-8后,植入物的亲水性、成骨细胞附着性显著提升,左氧氟沙星和Zn2+的响应性释放提高了植入物表面对大肠杆菌和金黄色葡萄球菌的抑菌活性[35]。同理,将磷霉素引入UiO-66金属有机框架中后,材料同样对金黄色葡萄球菌表现出杀菌活性[37]。 除了抗生素,部分植物提取物也具有抗菌性能,且生物相容性较好,利用金属有机框架装载这些生物活性物质在抗菌领域同样有显著的效果。Si等[40]将装载香草酸甲酯的ZIF-8固定在改性钛上,Zn2+和香草酸甲酯的持续释放引起脂质膜的氧化应激,造成DNA损伤,有效抑制了钛种植体表面细菌生物膜的形成。利用纳米金属有机框架结构控制柚皮苷的释放,不仅可以促进骨整合同时能够防止细菌感染[32]。此外,将阴离子抗菌肽MH5C引入ZIF-8结构中,并利用赤藓糖醇粉进行空气抛光后能够完全清除细菌生物膜[38]。 2.3.2 金属有机框架材料自带抗菌性能 金属离子与有机配体间配位键不稳定的性质使部分金属有机框架结构在酸性条件下表现出响应性降解的特性,释放的金属离子,如Ag+,Mg2+和Zn2+等本身具备一定的杀菌能力,因此赋予了金属有机框架材料一定的抗菌性能[41]。如多功能骨粘合水凝胶经ZIF-8修饰后,ZIF-8降解释放出的Zn2+使水凝胶实现了抗菌功能[42]。同时向金属有机框架结构中引入两种不同的金属离子后,二者的协同效应可以显著提高金属有机框架对细菌的抑制能力。例如,钛合金表面修饰镁-锌双金属金属有机框架涂层(Mg/Zn-金属有机框架74)后,释放出的Zn2+和Mg2+表现出较强的抗菌能力[34]。此外,由于铜离子自身具有抗菌功能和抑制生物膜形成的功能,镁-铜双金属金属有机框架体系的抗菌能力更优于镁基金属有机框架 [16]。 2.3.3 金属有机框架材料表面构筑抗菌微结构 除了作为药物载体及自身具有抗菌活性外,金属有机框架材料还能通过其他机制杀灭细菌:①Cu(Ⅱ)和Co(Ⅱ)金属有机框架表面的活性位点能够降解细菌膜上的蛋白质和脂肪酸,从而起到杀菌作用[41];②金属有机框架材料接触细菌细胞膜后,通过静电、疏水及受体-配体相互作用,可能破坏细胞膜并导致细胞关键成分失活[43];③表面锋利的纳米金属有机框架结构与细菌细胞壁接触后,坚硬的尖端能够通过机械力直接破坏细菌的结构[31];④Ag对细菌膜上的含硫蛋白具有高亲和力,将银基金属有机框架蚀刻在钛合金植入物表面后,植入物附着细菌膜的倾向强烈,抗菌实验结果表明这种结合作用可以破坏细菌的组织结构[44];⑤此外,碘是临床中常用的无耐药风险的物理消毒剂,可以卤化微生物蛋白质,使微生物的代谢功能障碍导致死亡,利用金属有机框架结构作为碘的载体,并进一步利用羟乙基纤维素凝胶构建水凝胶,形成的复合材料能有效灭菌[36]。 2.3.4 金属有机框架材料光催化的氧化应激放大策略 光催化基于特定波长照射半导体催化剂,电子从价带激发至导带,光诱导的电子空穴对迁移到半导体表面,与表面物质反应,产生活性氧[45]。这些光诱导产生的活性氧具有强氧化能力,能破坏细菌细胞壁和细胞膜的部分结构,细胞壁和细胞膜的破坏导致细胞质渗漏,破坏细胞的正常代谢,从而达到杀菌效果。此外,氧化应激状态下,过量的活性氧物种会破坏细胞蛋白、脂质和DNA,引发细胞死亡。TENG等[46]利用金属有机框架固有的光催化活性,将碘负载在金属有机框架结构中,在近红外光照射下实现了响应性的碘释放以及细胞内活性氧的氧化暴露,实现了协同抗菌。DENG等[47]在聚醚醚酮植入物上构建了ZIF-8和聚多巴胺组成的异质结构涂层,在近红外光照射下,通过产生的活性氧、局部热疗以及光响应加速释放的Zn2+离子协同根除细菌,证明了金属有机框架材料结合光疗在骨植入物上的巨大潜力。"


2.4 金属有机框架材料在关节炎中的应用 炎症是一种对抗感染和创伤的关键的防御机制,主要通过清除有害因素和受损组织,帮助机体恢复正常功能,从而避免病情进一步恶化。但是,当炎症失控时,长期的促炎过程可能会导致骨修复功能受阻或进展缓慢。 2.4.1 金属有机框架材料清除促炎细胞因子和活性氧物种 骨关节炎的主要特征是过量的促炎细胞因子和活性氧物种所形成的炎症性关节病微环境,这会加剧骨缺损并阻碍骨组织及软骨组织的再生。因此,清除致炎因子是一种直接而有效的骨关节炎治疗策略。SHU等[15]开发的一种基于Zn/Co-金属有机框架的生物陶瓷支架展示了这一点,这种Zn/Co-金属有机框架具有类过氧化物酶、过氧化氢酶和超氧化物歧化酶的催化活性,能够有效保护细胞免受活性氧的侵害,并促进软骨及软骨下骨的整合再生。此外,没食子酸和富马酸作为常用的抗氧化剂,能够有效清除活性氧。KANG等[48]制备的外泌体功能化的聚乳酸-羟基乙酸共聚物/Mg-没食子酸金属有机框架支架通过释放外泌体和没食子酸,显著降低了促炎细胞因子诱导性一氧化氮合成酶、环加氧酶2及活性氧水平,有效抑制了成骨过程中的有害免疫反应。LAO等[49]针对高血糖环境下持续的炎症和过量的活性氧这一问题,构建了一种能够释放二甲双胍和Zn2+的二甲双胍@ZIF-8改性纳米水凝胶,二甲双胍和Zn2+的协同作用有效抑制了活性氧炎症级联的产生,促进了糖尿病骨缺损的修复进程。 2.4.2 金属有机框架材料促进免疫调节 巨噬细胞作为炎症反应的关键调节者和先天免疫系统的重要组成部分,根据功能不同分为M1和M2两种亚型,在炎症反应早期阶段,M1巨噬细胞通过增强免疫活动消灭病原体,但如果这种促炎反应持续过长,会抑制组织再生。随着炎症过程的进展,M1型巨噬细胞转化为M2型,并分泌如白细胞介素4、白细胞介素10、转化生长因子β和精氨酸酶1等抗炎细胞因子以减轻过度炎症。有研究设计了一种在SrCO3表面原位生成ZIF-8的核壳结构(SrCO3@ZIF-8),利用ZIF-8的有机配体与聚左旋乳酸形成了结构稳固的复合支架。该支架不仅表现出优良的机械性能,而且通过释放Sr2+和Zn2?,促进M0型巨噬细胞向M2型巨噬细胞转化,降低肿瘤坏死因子的表达,同时提高了白细胞介素10和精氨酸酶1的表达水平,从而优化了修复微环境并显著促进小鼠间充质干细胞的成骨分化[50]。CHEN等[51]利用AHT-Ce/Sr金属有机框架的免疫调节作用,实现了巨噬细胞中白细胞介素1β和肿瘤坏死因子α的表达降低,以及M2巨噬细胞相关标记物CD206的升高。YAN等[52]在钛基植入物上构建了掺氟的多功能锆基金属有机骨架薄膜,该薄膜以富马酸作为配体,氟掺杂锆基金属有机骨架能够刺激富马酸的释放,诱导巨噬细胞极化为M2型。 类风湿性关节炎的重要病理特征是炎症浸润和骨破坏,这一现象起源于巨噬细胞生态位的紊乱。有研究发现,V-set和含免疫球蛋白结构域蛋白4的屏障功能内层巨噬细胞被破坏,介导关节内炎症浸润,从而激活过度的破骨细胞生成和骨吸收。针对这一发现,他们开发了一种唑来膦酸修饰的矿化金属?有机框架(ZIF-8@V-set和含免疫球蛋白结构域蛋白4-CD59@羟基磷灰石@唑来膦酸),唑来膦酸作为表面矿化剂抑制了破骨细胞介导的骨吸收,并通过V-set和含免疫球蛋白结构域蛋白4-CD59这一补体抑制剂阻止补体膜攻击复合物的形成,保护V-set和含免疫球蛋白结构域蛋白4衬里巨噬细胞屏障,实现顺序生态位重塑,为类风湿性关节炎治疗提供了新的策略[7]。 2.4.3 金属有机框架材料靶向递送抗炎药物 金属有机框架材料作为高效的药物载体,其优势在于能够精确控制药物的释放,这主要得益于金属有机框架材料在接受外界刺激响应信号时,自身的拓扑结构、尺寸和孔径会发生改变,从而实现对药物释放速率的精准控制。这种精准控制不仅显著提高了治疗效率,而且大幅减少了系统性不良反应。氟比洛芬、酮洛芬和双氯芬酸钠是临床上常用的非类固醇抗炎药物,尤其是酮洛芬,常用于治疗骨质疏松相关的疼痛,但长期口服可能引发不良反应。将酮洛芬负载于Mg-金属有机框架-74中显著降低了环氧化酶等疼痛相关基因的表达,并明显上调了成骨细胞因子,同时下调了促炎因子的分泌[53]。JIANG等[54]利用ZIF-8递送新木薯异黄酮,构建了具有抗炎效果的新木薯异黄酮@ZIF-8复合物。此外,金属有机框架不仅能够作为载体携带抗炎药物,还能通过按需设计改善药物的治疗效果。XUE等[55]基于负载雷帕霉素和胆红素的金属有机框架-介孔多巴胺开发了双药物递送纳米平台,同时该系统缀合了胶原蛋白Ⅱ靶向肽于其表面,对软骨的靶向性显著提升。"


2.5 金属有机框架材料在骨肿瘤中的应用 骨肿瘤,包括多种类型的恶性和良性肿瘤,是影响骨骼健康的主要疾病之一。其中,骨肉瘤作为原发性骨肿瘤中最常见的恶性肿瘤,主要影响骨骼生长发育较快的青少年[56]。骨肉瘤的标准治疗策略通常是术前新辅助化疗、广泛的手术切除和术后辅助化疗的综合治疗模式。然而,手术并不能完全根除肿瘤细胞,且手术引起的大块骨缺损也需要进行有效修复。抗癌药物虽然在一定程度上能够抑制肿瘤的生长和转移,但治疗效果仍然有限。这一局限性主要是由于化疗药物通常需要大剂量使用,从而对正常身体器官造成损害。为了克服这些问题,开发具有局部抗肿瘤能力的生物材料,如颗粒和支架,对于骨肿瘤治疗至关重要。此外,通过结合内源性和外源性刺激来触发抗肿瘤特性,如光热疗法、声动力学治疗、光动力学治疗以及联合疗法,为抗肿瘤生物材料的设计提供了更多的选择[57]。 2.5.1 金属有机框架材料介导的化疗药物递送 利用肿瘤细胞表面叶酸受体高表达的特性,整合叶酸和金属有机框架,开发出新型的阿霉素药物递送系统(叶酸/金属有机框架/阿霉素),该系统显著提高了阿霉素递送的特异性和效率[58]。阿培利司是一种α选择性磷酸肌醇3-激酶抑制剂,它通过抑制肿瘤细胞的PI3K-Akt-mTOR信号通路来发挥作用,同时也干扰破骨细胞的活性。MA等[59]利用金属有机框架结构装载阿培利司形成阿培利司@Au@金属有机框架,进一步通过介孔硅结构,成功装载了光敏剂吲哚菁绿和化疗药物顺铂,形成了阿培利司&顺铂@Au@金属有机框架@介孔硅-吲哚菁绿双壳纳米粒子,靶向肽和高渗透长滞留效应作用下纳米粒子能够在脊柱肿瘤处集聚,从而精准释放阿培利司和顺铂,实现对肿瘤细胞的有效杀灭,并减少了肿瘤转移引起的骨破坏。此外,吲哚菁绿和金纳米球的结合赋予材料光热效应和光声成像功能。 2.5.2 金属有机框架材料诱导活性氧的产生 DENG等[60]利用声增敏剂TCPP构建了卟啉-锌基金属有机框架(二茂铁苯甲酸-ZnTCPP),该金属有机框架在超声波刺激下能够释放活性氧,同时二茂铁苯甲酸可以将过氧化氢催化转化为氧气,从而避免了肿瘤微环境中乏氧可能削弱声动力治疗效果的问题。LI等[61]先用唑来膦酸修饰金属有机框架材料ZIF-90,使之具有骨靶向性,然后将光敏剂二氢卟吩e6装载上去,构造二氢卟吩e6@ZIF-90-聚乙二醇-唑来膦酸,在近红外光的照射下释放活性氧,通过光动力学杀灭肿瘤细胞,同时协同糖酵解剂2-脱氧-D-葡萄糖通过瓦伯格效应抑制肿瘤生长,强化光动力治疗效果。化学动力治疗是一种新兴的肿瘤治疗方法,它的工作原理主要基于芬顿反应或类芬顿反应,由过渡金属离子(如Fe2+)将体内的过氧化氢转化为活性氧来杀死癌细胞或抑制肿瘤生长。WANG等[62]基于这个原理,构建了聚多巴胺包裹的铁基金属有机框架并通过聚多巴胺涂层进行改性,接枝叶酸牛血清白蛋白,实现了靶向肿瘤部位,同时具有磁共振成像对比剂的功能。并通过装载能转化为一氧化氮的D-精氨酸和能阻断肿瘤细胞供能的葡萄糖氧化酶以及化疗药物替拉扎明,实现了多种治疗手段协同治疗的效果。 2.5.3 金属有机框架材料在光热疗法中的应用 光热疗法已广泛用于肿瘤治疗。将钴-卟啉组成的金属有机框架装载于磷酸钙骨水泥中,从而赋予骨水泥一定的光热转换性能,能够针对性地杀灭骨肉瘤术后残留的肿瘤细胞,避免肿瘤的复发[21]。但高温会导致热休克蛋白的增加,增加肿瘤的耐热性,从而使光热治疗效果不佳。DENG等[63]开发了一种核壳型MAZG纳米复合材料(介孔多巴胺/偶氮二咪唑丙烷盐酸盐@ZIF-8/藤黄酸),其内核装载了偶氮二咪唑丙烷盐酸盐的介孔多巴胺,外壳则由装载藤黄酸的ZIF-8组成;藤黄酸作为特异性靶向热休克蛋白90的抑制剂被封装到金属有机框架ZIF-8中,该研究中实现的温和光热效果为骨肉瘤的治疗提供了新的思路[63]。 2.5.4 金属有机框架材料增强放疗效果 放射治疗是一种直接利用电离辐射(如X射线和γ射线)来诱导DNA损伤的治疗方法,这种治疗方式不仅可以直接损伤癌细胞,还会诱导活性氧的产生并释放肿瘤相关抗原来激发免疫反应,进而诱导免疫原性细胞死亡。骨肉瘤对放疗并不敏感,需要高剂量辐射(高达80 Gy),但这可能引发严重的不良反应。因此,开发低剂量放疗策略成为临床上的一大挑战。 金属有机框架材料具有疏松孔道的超小型3D阵列结构纳米金属有机框架,有利于次级光子和电子的散射,从而增强高能射线的增敏效果。其次,纳米金属有机框架是由有机配体和高相对原子质量金属原子节点组装而成的高度有序结构,表现出较大的质量衰减系数和强烈的剂量增强效应。最后,纳米金属有机框架的孔道结构可用于封装药物或对比剂,以进行多模式成像引导的协同肿瘤治疗。DU等[64]将D-精氨酸装载于MIL-100(Fe)纳米载体中,低剂量X射线照射下,精氨酸释放的一氧化氮可以下调缺氧诱导因子1α,缓解肿瘤缺氧;Fe3+催化过氧化氢产生的活性氧与一氧化氮反应,生成过氧亚硝酸盐阴离子和其他活性氮物种。因此,羟基磷灰石@金属有机框架/D-精氨酸可有效抑制肿瘤生长,防止骨肉瘤复发和肺转移。LI等[65]利用钽(Ta)和锆(Zr)作为金属节点,TCPP作为光敏配体,开发了TZM放疗增敏剂,Ta-Zr共掺杂有助于将能量传递到TCPP,从而产生单线态氧,实现放射性动力学治疗;同时TZM也会诱导免疫原性细胞死亡和促进树突状细胞成熟,还通过cGAS-STING通路上调程序性细胞死亡蛋白1的表达,从而引发强大的抗肿瘤免疫反应。 2.6 金属有机框架材料在骨科领域中应用的优缺点 金属有机框架材料在骨科的应用是当前研究的焦点之一,其独特的性质为骨科疾病的治疗提供了新的途径。对于传统的治疗方法,如使用生长因子进行骨修复、抗生素预防骨感染、抗炎药物及化疗药物治疗骨关节炎和骨肉瘤,金属有机框架材料展现出以下显著优势:①相较于直接使用药物,金属有机框架材料具有基于炎症或肿瘤微环境实现靶向输送释放药物的能力。通过这种方式,可以实现药物的精准投递,降低药物的使用剂量,从而减小对周围组织的损伤。②金属有机框架材料由特定金属离子及有机配体组成,使其本身就具有治疗骨科疾病的潜在作用。通过选择合适的金属离子及配体,金属有机框架材料可以针对性地影响骨组织,提供更加定制化的治疗方案。③金属有机框架材料还可以通过装载一些特殊性质的材料,如光敏剂、纳米酶等,实现响应性治疗。这种智能药物释放的策略有助于减小治疗过程中的不良反应,同时将新兴治疗方法协同运用,提高治疗效果。④金属有机框架材料在室温下相对稳定,可用于装载一些昂贵易失活的药物,具有保护药物、易于长期保存的优势,这为高效、可持续的治疗提供了可能性。⑤金属有机框架材料在植入物涂层或负载到骨支架的应用方面也表现出潜在的优势,有助于增加植入物与宿主骨的整合程度,促进治疗效果的持久性。 然而,当前的研究也揭示了金属有机框架材料在骨科应用中的一些局限性:①金属有机框架材料的制备通常需要特殊的合成条件和较高的制备成本,这限制了其在大规模应用中的可行性。未来的研究需要致力于提高制备方法的效率和降低成本。②作为药物载体时,金属有机框架材料释放药物的可控性面临挑战。过快或过慢的释放可能对机体造成损伤或影响治疗效果,需要更精准的药物释放控制。③金属有机框架材料释放的金属离子可能具有细胞毒性,但目前缺乏对安全剂量的详尽实验数据。对于其生物相容性和毒性的深入研究是必要的。④金属有机框架材料在能量转化效率方面可能存在问题,尤其在深部组织的光动力或光热疗法中,其能量转化效率不够高,可能影响治疗效果。因此,需要进一步开发更加高效、安全的材料,以满足骨科治疗的需求。这些优缺点的全面了解将有助于指导未来金属有机框架材料在骨科领域的研究和应用,促进其更广泛的临床应用。"

| [1] JANMOHAMMADI M, NAZEMI Z, SALEHI AOM, et al. Cellulose-based composite scaffolds for bone tissue engineering and localized drug delivery. Bioact Mater. 2023;20:137-163. [2] ZHANG Q, YAN S, YAN X, et al. Recent advances in metal-organic frameworks: synthesis, application and toxicity. Sci Total Environ. 2023; 902:165944. [3] LI B, WEN HM, CUI Y, et al. Emerging multifunctional metal–organic framework materials. Adv Mater. 2016;28(40):8819-8860. [4] BAI Y, DOU Y, XIE LH, et al. Zr-based metal–organic frameworks: design, synthesis, structure, and applications. Chem Soc Rev. 2016;45(8): 2327-2367. [5] FURUKAWA H, CORDOVA KE, O’KEEFFE M, et al. The chemistry and applications of metal-organic frameworks. Science. 2013;341(6149): 1230444. [6] DENG H, GRUNDER S, CORDOVA KE, et al. Large-pore apertures in a series of metal-organic frameworks. Science. 2012;336(6084):1018-1023. [7] TAO SY, YU H, YOU T, et al. A Dual-targeted metal–organic framework based nanoplatform for the treatment of rheumatoid arthritis by restoring the macrophage niche. ACS Nano. 2023;17(14):13917-13937. [8] ZHANG SQ, CAI JH, YAO Y, et al. Mitochondrial-targeting Mn(3)O(4)/UIO-TPP nanozyme scavenge ROS to restore mitochondrial function for osteoarthritis therapy. Regen Biomater. 2023;10:rbad078. [9] ALSAIKHAN F, MAHMOUD MZ, SULIMAN M. Synthesis and characterization of novel denosumab/magnesium-based metal organic frameworks nanocomposite prepared by ultrasonic route as drug delivery system for the treatment of osteoporosis. Front Bioeng Biotechnol. 2023;11:1153969. [10] LIN S, LIU X, TAN L, et al.. Porous iron-carboxylate metal-organic framework: a novel bioplatform with sustained antibacterial efficacy and nontoxicity. ACS Appl Mater Interfaces. 2017;9(22):19248-19257. [11] TAO BL, LIN CC, HE Y, et al. Osteoimmunomodulation mediating improved osteointegration by OGP-loaded cobalt-metal organic framework on titanium implants with antibacterial property. Chem Eng J. 2021;423:130176. [12] XU C, KANG Y, DONG X, et al. Integration exosomes with MOF-modified multifunctional scaffold for accelerating vascularized bone regeneration. Chin Chem Lett. 2022;34(2):107528. [13] WANG B, CHEN H, PENG S, et al. Multifunctional magnesium-organic framework doped biodegradable bone cement for antibacterial growth, inflammatory regulation and osteogenic differentiation. J Mater Chem B. 2023;11(13):2872-2885. [14] MOHAMMAD MEHDI S, MAHMOOD K. Microstructure and anti-corrosion properties of acrylic bone cement-based with MOF nanostructured hybrid coatings on AZ31 Mg alloy. Mater Chem Phys. 2023;307:128147. [15] SHU CQ, QIN C, CHEN L, et al. Metal-organic framework functionalized bioceramic scaffolds with antioxidative activity for enhanced osteochondral regeneration. Adv Sci. 2023;10(13):e2206875. [16] LIU J, TAN Y, SHEN E, et al. Highly water-stable bimetallic organic framework MgCu-MOF74 for inhibiting bacterial infection and promoting bone regeneration. Biomed Mater. 2022;17(6):065026. [17] MATLINSKA MA, HA M, HUGHTON B, et al. Alkaline earth metal-organic frameworks with tailorable ion release: a path for supporting biomineralization. ACS Appl Mater Interfaces. 2019;11(36):32739-32745. [18] TOPRAK Ö, TOPUZ B, MONSEF YA, et al. BMP-6 carrying metal organic framework-embedded in bioresorbable electrospun fibers for enhanced bone regeneration. Mater Sci Eng C. 2021;120:111738. [19] ZHENG ZW, CHEN YH, GUO B, et al. Magnesium-organic framework-based stimuli-responsive systems that optimize the bone microenvironment for enhanced bone regeneration. Chem Eng J. 2020;396:125241. [20] DANG WT, MA B, LI B, et al. 3D printing of metal-organic framework nanosheets-structured scaffolds with tumor therapy and bone construction. Biofabrication. 2020;12(2):025005. [21] QU Y, ZHUANG H, ZHANG M, et al. Bone cements for therapy and regeneration for minimally invasive treatment of neoplastic bone defects. J Mater Chem B. 2021;9(21):4355-4364. [22] DONG WY, ZHAO SS, WANG YL, et al. Stimuli-responsive metal–organic framework hydrogels endow long carbon fiber reinforced polyetheretherketone with enhanced anti-inflammatory and angiogenesis and osteogenesis. Mater Des. 2022;225:111485. [23] PAN HJ, MIAO X, DENG J, et al. Bimetallic metal-organic framework for mitigating aseptic osteolysis. ACS Appl Mater Interfaces. 2023; 15(4):4935-4946. [24] WANG HF, CHEN S, HE Z, et al. Synthesis and potential osteogenic applications of Wnt3a‐loaded ZIF‐8 nanoparticles. Chin Chem Lett. 2023;35(3):108597. [25] FAR BF, NAIMI-JAMAL MR, AHMADI S, et al. Enhancing bone tissue engineering with calcium and strontium nanoparticles immobilized on HKUST-1. Alex Eng J. 2023;76:221-235. [26] XIAO TH, FAN L, LIU RT, et al. Fabrication of dexamethasone-loaded dual-metal-organic frameworks on polyetheretherketone implants with bacteriostasis and angiogenesis properties for promoting bone regeneration. ACS Appl Mater Interfaces. 2021;13(43):50836-50850. [27] XU C, KANG Y, GUAN S, et al. Iron-based metal–organic framework as a dual cooperative release system for enhanced vascularization and bone regeneration. Chin Chem Lett. 2022;34(5):107825. [28] GUTOWSKA I, MACHOY Z, MACHALIŃSKI B. The role of bivalent metals in hydroxyapatite structures as revealed by molecular modeling with the HyperChem software. J Biomed Mater Res A. 2005;75(4):788-793. [29] ZHANG YY, SHEN XK, MA. PP, et al. Composite coatings of Mg-MOF74 and Sr-substituted hydroxyapatite on titanium substrates for local antibacterial, anti-osteosarcoma and pro-osteogenesis applications. Mater Lett. 2019;241:18-22. [30] LOU W, DONG Y, ZHANG H, et al. Preparation and characterization of lanthanum-Incorporated hydroxyapatite coatings on titanium substrates. Int J Mol Sci. 2015;16(9):21070-21086. [31] YUAN Y, ZHANG Y. Enhanced biomimic bactericidal surfaces by coating with positively-charged ZIF nano-dagger arrays. Nanomedicine. 2017; 13(7):2199-2207. [32] YU MF, YOU DQ, ZHUANG JJ, et al. Controlled release of naringin in metal-organic framework-loaded mineralized collagen coating to simultaneously enhance osseointegration and antibacterial activity. ACS Appl. Mater. Interfaces. 2017;9(23):19698-19705. [33] KARAKEÇILI A, TOPUZ B, KORPAYEV S, et al. Metal-organic frameworks for on-demand pH controlled delivery of vancomycin from chitosan scaffolds. Mater Sci Eng C. 2019;105:110098. [34] SHEN XK, ZHANG Y, MA P, et al. Fabrication of magnesium/zinc-metal organic framework on titanium implants to inhibit bacterial infection and promote bone regeneration. Biomaterials. 2019;212:1-16. [35] TAO BL, ZHAO WK, LIN CC, et al. Surface modification of titanium implants by ZIF-8@Levo/LBL coating for inhibition of bacterial-associated infection and enhancement of osseointegration. Chem Eng J. 2020;390:124621. [36] LU S, REN X, GUO T, et al. Controlled release of iodine from cross-linked cyclodextrin metal-organic frameworks for prolonged periodontal pocket therapy. Carbohydr Polym. 2021;267:118187. [37] KARAKEÇILI A, TOPUZ B, ERSOY FŞ, et al. UiO-66 metal-organic framework as a double actor in chitosan scaffolds: antibiotic carrier and osteogenesis promoter. Mater Sci Eng C. 2022;136:212757. [38] ZHU Y, ZHI Q, ZHANG C, et al. Debridement of contaminated implants using air-polishing coupled with pH-responsive maximin H5-embedded metal-organic. Front Bioeng Biotechnol. 2023;11:1124107. [39] PACHECO T, GOMES AÉI, SIQUEIRA NMG, et al. SdiA, a quorum-sensing regulator, suppresses fimbriae expression, biofilm formation, and quorum-sensing signaling molecules. Production in Klebsiella pneumoniae Front Microbiol. 2021;12:597735. [40] SI YH, LIU HY, LI MS, et al. An efficient metal–organic framework-based drug delivery platform for synergistic antibacterial activity and osteogenesis J Colloid Interface Sci. 2023;640:521-539. [41] CLAUDIO P, RICCARDO P, CORRADO DIN, et al. Antimicrobial MOFs Coord Chem Rev. 2021;446:214121. [42] LIU YH, ZHU Z, PEI XB, et al. ZIF-8-modified multifunctional bone-adhesive hydrogels. promoting angiogenesis and osteogenesis for bone regeneration. ACS Appl Mater Interfaces. 2020;12(33):36978-36995. [43] KUNDU B, REIS RL, KUNDU SC. Biomimetic antibacterial pro-osteogenic cu-sericin mofs for osteomyelitis treatment. Biomimetics. 2022;7(2):64. [44] DEHNAVI SM, BARJASTEH M, AHMADI SEYEDKHANI S, et al. A novel silver-based metal-organic framework incorporated into nanofibrous chitosan coatings for bone tissue implants. Int J Pharm. 2023;640:123047. [45] MUTALIK C, HSIAO YC, CHANG YH, et al. High UV-Vis-NIR light-induced antibacterial activity by heterostructured TiO(2)-FeS(2) nanocomposites. Int J Nanomedicine. 2020;15:8911-8920. [46] TENG WSY, ZHANG ZJ, WANG YK, et al. Iodine immobilized metal-organic framework for NIR-triggered antibacterial therapy on orthopedic implants. Small. 2021;17(35):e2102315. [47] DENG Y, SHI J, CHAN YK, et al. Heterostructured metal-organic frameworks/polydopamine coating endows. Polyetheretherketone implants with multimodal osteogenicity and photoswitchable disinfection. Adv Healthc Mater. 2022;11(14):e2200641. [48] KANG Y, XU C, MENG LA, et al. Exosome-functionalized magnesium-organic framework-based scaffolds with osteogenic, angiogenic and anti-inflammatory properties for accelerated bone regeneration. Bioact Mater. 2022;18:26-41. [49] LAO A, WU J, LI D, et al. Functionalized metal–organic framework-modified hydrogel that breaks the vicious cycle of inflammation and ROS for repairing of diabetic bone defects. Small. 2023;19(36): e2206919. [50] QIAN GW, MAO YQ, SHUAI Y, et al. Enhancing bone scaffold interfacial reinforcement through in situ growth of metal-organic frameworks (MOFs) on strontium carbonate: achieving high strength and osteoimmunomodulation. J Colloid Interface Sci. 2023;655:43-57. [51] CHEN M, WANG D, LI M, et al. Nanocatalytic biofunctional MOF coating on titanium implants promotes osteoporotic bone regeneration through cooperative pro-osteoblastogenesis MSC reprogramming. ACS Nano. 2022;16(9):15397-15412. [52] YAN BC, TAN J, ZHANG HF, et al. Constructing fluorine-doped Zr-MOF films on titanium for antibacteria, anti-inflammation, and osteogenesis. Mater Sci Eng C. 2022;134:112699. [53] GE Y, WANG K, LI H, et al. An Mg-MOFs based multifunctional medicine for the treatment of osteoporotic pain. Mater Sci Eng C. 2021;129:112386. [54] JIANG YN, LIAO HX, YAN LW, et al. A metal–organic framework-incorporated hydrogel for delivery of immunomodulatory neobavaisoflavone to promote cartilage regeneration in osteoarthritis. ACS Appl Mater Interfaces. 2023;15(40):46598-46612. [55] XUE S, ZHOU X, SANG W, et al. Cartilage-targeting peptide-modified dual-drug delivery nanoplatform with NIR laser response for osteoarthritis therapy. Bioact Mater. 2021;6(8):2372-2389. [56] ZHAO X, WU Q, GONG X, et al. Osteosarcoma:a review of current and future therapeutic approaches. Biomed Eng Online. 2021;20(1):24. [57] GAO P, CHEN Y, PAN W, et al. Antitumor agents based on metal-organic frameworks angew. Chem Int Ed Engl. 2021;60(31):16763-16776. [58] XU WF, LOU Y, CHEN WSJ, et al. Folic acid decorated metal-organic frameworks loaded with doxorubicin for tumor-targeted chemotherapy of osteosarcoma. Biomed Tech (Berl). 2020;65(2):229-236. [59] MA YQ, CHEN L, LI XL, et al. Rationally integrating peptide-induced targeting and multimodal therapies in a dual-shell theranostic platform for orthotopic metastatic spinal tumors. Biomaterials. 2021; 275:120917. [60] DENG XY, GUO Y, ZHANG XD, et al. Film-facilitated formation of ferrocenecarboxylic acid-embedded metal-organic framework nanoparticles for sonodynamic osteosarcoma treatment. Mater Today Chem. 2022;24:100842. [61] LI W, YANG Y, WANG J, et al. Establishment of bone-targeted nano-platform and the study of its combination with 2-deoxy-d-glucose enhanced photodynamic therapy to inhibit bone metastasis J Mech Behav Biomed Mater. 2024;150:106306. [62] WANG Y, WILLIAMS GR, ZHENG Y, et al. Polydopamine-cloaked Fe-based metal organic frameworks enable synergistic multidimensional treatment of osteosarcoma. J Colloid Interface Sci. 2023;651:76-92. [63] DENG XT, ZHAO RL, TANG YF, et al. NIR laser-activated multifunctional nanocomposites for cascade low-temperature photothermal and oxygen-irrelevant thermodynamic therapy. Mater Des. 2023;233: 112206. [64] DU CC, ZHOU MX, JIA F, et al. D-arginine-loaded metal-organic frameworks nanoparticles sensitize osteosarcoma to radiotherapy. Biomaterials. 2021;269:120642. [65] LI T, GAO MQ, WU ZF, et al. Tantalum–zirconium co-doped metal–organic frameworks sequentially sensitize radio–radiodynamic–immunotherapy for metastatic osteosarcoma. Adv Sci. 2023;10(10): e2206779. [66] TAN LL, SONG N, ZHANG SX, et al. Ca(2+), pH and thermo triple-responsive mechanized Zr-based MOFs for on-command drug release in bone diseases. J Mater Chem B. 2016;4(1):135-140. [67] CHEN J, ZHANG X, HUANG C, et al. Osteogenic activity and antibacterial effect of porous titanium modified with metal-organic framework films. J Biomed Mater Res A. 2017;105(3):834-846. [68] ZHONG L, CHEN J, MA Z, et al. 3D printing of metal-organic framework incorporated porous scaffolds to promote osteogenic differentiation and bone regeneration. Nanoscale. 2020;12(48):24437-24449. [69] LIU W, YAN Z, MA X, et al. Mg-MOF-74/MgF₂ Composite coating for improving the. properties of magnesium alloy implants: hydrophilicity and corrosion resistance. Materials. 2018;11(3):396. [70] JIANG Y, PAN X, YAO M, et al. Bioinspired adhesive and tumor microenvironment responsive nanoMOFs assembled 3D-printed scaffold for anti-tumor therapy and bone regeneration. Nano Today. 2021;39:101182. [71] NIU Y, YANG H, YU Z, et al. Intervention with the bone-associated tumor vicious cycle through dual-protein therapeutics for treatment of skeletal-related events and bone metastases. ACS nano. 2022;16(2): 2209-2223. [72] LI S, XU F, REN X, et al. H(2)S-reactivating antitumor immune response after microwave thermal therapy for long-term tumor suppression. ACS Nano. 2023;17(19):19242-19253. |
| [1] | Yu Lei, Zhang Wei, Qin Yi, Ge Gaoran, Bai Jiaxiang, Geng Dechun. Repair of femoral condyle defects using mesoporous bioactive glass grafted with bone morphogenetic protein 2 osteogenic peptide inspired by mussel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4629-4638. |
| [2] | Zhao Yue, Xu Yan, Zhou Jianping, Zhang Xujing, Chen Yutong, Jin Zhengyang, Yin Zhitao. Differences in structural design between traditional and bionic scaffolds in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3458-3468. |
| [3] | Chen Mingwei, Yu Wenli, Xia Suhang, Chen Bin, Chen Wenzhong, Li Fengzhen, Zhou Yu, Si Wenteng. rticular cartilage injury repaired with microRNA-140 exosomes/sodium alginate/collagen hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3326-3334. |
| [4] | hang Zining, Deng Ronghui, Yu Jiakuo. Alleviation of oxidative stress damage in chondrocytes by a new Mn-containing bioceramic powder [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3335-3342. |
| [5] | Chen Jiahan, Feng Chao, Huang Xiaoxia, Niu Minghui, Wang Xin, Teng Yong. Two-dimensional black phosphorus materials for bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2124-2131. |
| [6] | Wu Yaokun, Liu Chenglin, Fu Jiahao, Song Wei, Chen Hao, Xi Hongzhong, Liu Xin, Du Bin, Sun Guangquan. Combination of effective ingredients of traditional Chinese medicine and bone tissue engineering materials for bone repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2141-2150. |
| [7] | Wu Zhixin, Jiang Wenwen, Zhan Jianhui, Li Yangshurun, Ren Wenyan, Wang Yiyu. Hydrogels: role and problems in the repair of oral and maxillofacial defects [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2178-2188. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||