Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (10): 2162-2170.doi: 10.12307/2025.403
Previous Articles Next Articles
Action mechanisms and application pathways of biomaterials in promoting corneal alkali burn repair
Xiao Hui, Li Dongyan, Ji Jing, Wang Lizhen
- Beijing Advanced Innovation Center for Biomedical Engineering, Key Laboratory of Biomechanics and Mechanobiology, Ministry of Education, School of Biological Science and Medical Engineering, Beihang University, Beijing 100083, China
-
Received:2024-01-18Accepted:2024-04-03Online:2025-04-08Published:2024-08-26 -
Contact:Ji Jing, Associate professor, MD, Master’s supervisor, Beijing Advanced Innovation Center for Biomedical Engineering, Key Laboratory of Biomechanics and Mechanobiology, Ministry of Education, School of Biological Science and Medical Engineering, Beihang University, Beijing 100083, China -
About author:Xiao Hui, Master candidate, Beijing Advanced Innovation Center for Biomedical Engineering, Key Laboratory of Biomechanics and Mechanobiology, Ministry of Education, School of Biological Science and Medical Engineering, Beihang University, Beijing 100083, China -
Supported by:National Key Research and Development Program of China, No. 2023YFC2410404 (to WLZ); National Natural Science Foundation of China, No. 12232019 (to JJ)
CLC Number:
Cite this article
Xiao Hui, Li Dongyan, Ji Jing, Wang Lizhen. Action mechanisms and application pathways of biomaterials in promoting corneal alkali burn repair[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2162-2170.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
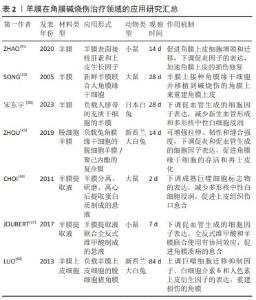
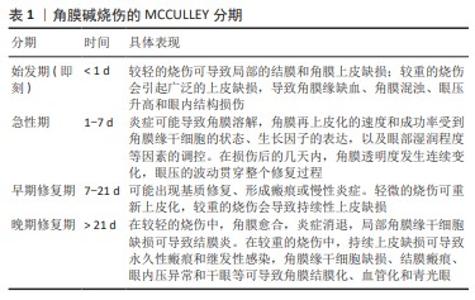
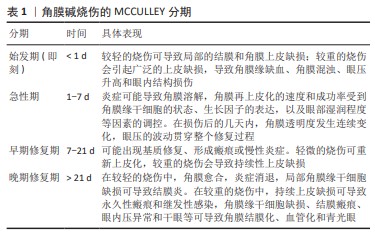
在角膜碱烧伤的始发期,碱烧伤会导致受损和坏死的组织立即释放活性氧、损伤相关模式分子和细胞因子,活性氧水平在损伤后2-6 h升高并激活核转录因子κB[10-11]。核转录因子κB是一种氧化还原敏感因子,既可以诱导大量免疫分子的基因表达,又具有启动和维持角膜碱烧伤后免疫反应的作用[12]。 在角膜碱烧伤的急性期和早期修复期,角膜炎症、纤维化和新生血管形成呈现连续动态变化。首先,中性粒细胞和巨噬细胞等炎症细胞从角膜缘区域开始向损伤部位迁移,前者的细胞数量多于后者;中性粒细胞数量在碱性物质刺激后开始上升,第4天达到最大值,在第7天后迅速减少。同时,受损区域内巨噬细胞的数量在损伤后的第一两周内逐渐增加,随后逐渐减少[13-14]。角膜碱烧伤通过p38丝裂原活化蛋白激酶、信号转导与转录激活因子3、磷脂酰肌醇3激酶/蛋白激酶B、核转录因子κB及细胞外信号调节激酶等信号通路参与角膜炎症的发展,通过有选择性地抑制信号传导,可以降低相关生物活性因子的表达,减轻炎症反应[3]。其次,炎症反应可破坏促血管生成与抗血管生成之间的动态平衡[15-17]。碱烧伤诱导的角膜新生血管直接或间接受到炎症反应所触发的分子信号级联反应调控,例如通过抑制核转录因子κB信号通路可以减轻炎症反应,从而减少新生血管形成[18]。新生血管通常在碱烧伤后的第3天开始从角巩膜缘延伸,新形成的血管主要分布在基质的前层和中间层,随后几周内逐渐向角膜中央扩展,最终覆盖原本无血管的角膜。碱烧伤诱导的新生血管主要受巨噬细胞产生的血管内皮生长因子调控[13]。血管内皮生长因子通过调控血管内皮细胞的增殖、分化、迁移和管腔形成,促进血管和淋巴管新生,其中,血管内皮生长因子A和B与血管内皮细胞的血管内皮生长因子受体1/2结合,促进血管生成;血管内皮生长因子C和D与淋巴管内皮细胞的血管内皮生长因子受体2/3结合,促进淋巴管生成[19]。同时,新生血管形成还依赖于基质金属蛋白酶家族成员,特别是基质金属蛋白酶2和9。基质金属蛋白酶通过降解Ⅳ型胶原为新生血管提供生长的空间[20]。最后,角膜纤维化会破坏正常角膜胶原纤维的排列。在碱烧伤引起角膜上皮细胞和上皮基底膜破坏后,受损和坏死组织释放的转化生长因子β进入角膜基质内,诱导角膜基质细胞转化为更活跃的角膜成纤维细胞,改变角膜基质的成分、结构和水合作用,最终导致角膜混浊[21]。当前,多数研究认为转化生长因子β1和转化生长因子β2促进纤维化发展,而转化生长因子β3抑制纤维化发展[22]。另外,有关角膜成纤维细胞来源的研究认为其可能源自骨髓中的纤维细胞,通过角膜缘脉管系统迁移到角膜后分化形成,但是研究尚未得到充分证明[23]。 在角膜碱烧伤的晚期修复期内,较轻的碱烧伤无需任何药物或手术干预,角膜能完成自我修复,但角膜伤口愈合过程中的细胞变化目前无法科学解释[24]。角膜碱烧伤晚期患者的组织病理学特征检查显示,角膜组织的上皮层显著增厚,主要原因是上皮细胞肥大以及上皮轻度增生。KETHIRI等[25]在兔角膜缘干细胞缺损模型中观察到结膜上皮细胞和杯状细胞在角膜内长期存在,证实晚期修复过程中存在角膜结膜化和角膜上皮的持续缺损。由此可见,角膜碱烧伤的修复是长期过程,但研究大多持续4周以内,4周后的病理变化鲜有研究。 2.2 不同生物材料在治疗角膜碱烧伤中的应用 近年来,生物材料在角膜碱烧伤治疗中的研究取得了显著进展。这些材料不仅在角膜碱烧伤的始发期和急性期治疗中具有重要作用,还为修复期内角膜组织的修复提供有效支持。现有研究通过探索生物材料的设计、制备和应用途径,重点集中在促进角膜上皮恢复、减轻炎症反应、抑制新生血管形成、减缓瘢痕化发展以及恢复角膜基质胶原有序排列等方面,试图将生物材料应用于角膜损伤的修复。羊膜作为天然组织工程支架,具有促进损伤组织修复的作用;透明质酸、胶原和壳聚糖在促进细胞增殖、分化和伤口愈合方面发挥着积极的生物作用;同时,高分子材料的引入也为疾病治疗提供了新的思路。 2.2.1 羊膜 羊膜位于人胎盘的最内层,是单层上皮细胞连接构成的薄膜,具有抗炎、抗纤维化和抗新生血管形成等特性,已经广泛用于治疗各种眼部疾病[26]。尽管羊膜治疗急性碱烧伤已取得一定效果,但直接应用于伤口会增加病毒感染和免疫反应的风险[27-28]。新鲜羊膜获取后建议在第1-7天内使用,避免生物活性因子在制备和储存的过程中丢失或活性丧失[29-30]。 目前,羊膜无法做到既保留其生物活性又长期储存,任何处理方式都存在局限性,因此很多研究将羊膜与其他材料、细胞或生物活性因子结合以弥补生物活性不足的缺陷。ZHAO等[31]将肝素和上皮生长因子接枝在羊膜表面,弥补了羊膜内丢失的生长因子,下调了碱烧伤诱导的白细胞介素1β、白细胞介素6和α肿瘤坏死因子的表达,与新鲜羊膜相比,改性后的羊膜结构上未见明显变化,复水后的机械强度有所提高。同时,羊膜提供丰富的营养成分,有利于细胞的生长繁殖。SONG等[32]将人角膜缘干细胞接种于新鲜羊膜并移植到大鼠碱烧伤角膜上,在修复后的角膜上皮中可检测到大量人源上皮细胞的特异性抗体。宋东宇等[33]使用负载人脐带间充质干细胞的羊膜覆盖碱烧伤诱导的损伤区域,可减少新生血管形成和多形核中性白细胞浸润,下调血管内皮生长因子的表达。 脱细胞羊膜是通过物理、化学及生物方法对新鲜羊膜进行脱细胞后得到的天然支架材料,其主要成分是胶原蛋白,优势是可以避免与新鲜羊膜有关的病毒感染和免疫反应风险[34]。ZHOU等[35]利用静电纺丝技术,在脱细胞羊膜表面接枝聚己内酯纳米纤维网构建聚己内酯-脱细胞羊膜复合膜,既能增加抗菌性,又能保留脱细胞羊膜的生物活性。结果表明,这种复合膜机械拉伸强度上显著优于脱细胞羊膜。在碱诱导的角膜缘干细胞缺损模型中,使用复合膜负载兔角膜缘干细胞进行移植,有效促进了角膜缘干细胞的增殖和角膜再上皮化,同时减轻了急性期和早期修复期的炎症反应和新生血管形成,角膜修复效果良好[35]。 羊膜提取液是新鲜羊膜经分离、研磨、匀浆及离心后获得的上清液,可以替代羊膜移植使用。由于羊膜或脱细胞羊膜移植后的生物学效应不会长期持续,通常在移植后几天内发生降解。CHOI等[36]在无菌条件下将羊膜研磨、离心并制成悬液,滴在角膜碱烧伤处,结果表明羊膜提取液能促进角膜上皮细胞迁移和增殖,减少炎症诱导的角膜混浊和新生血管形成,抑制角膜基质中成熟巨噬细胞标志物的表达,并且羊膜提取液可以用于角膜碱烧伤的长期治疗。JOUBERT等[37]使用全反式维甲酸处理过的羊膜提取液治疗小鼠角膜碱烧伤,该复合羊膜提取液可下调血管内皮生长因子和基质金属蛋白酶9的表达,加速角膜上皮的伤口愈合,两种物质对角膜溃疡的愈合和角膜厚度恢复具有协同作用。 羊膜上皮细胞在体外实验中已被证明能够产生多种抗炎和抗血管生成的细胞因子,同时表现出低免疫原性和促进组织再生的特性,使其在眼组织修复领域得到广泛应用[38-39]。LUO等[40]采用脱细胞猪角膜与羊膜上皮细胞结合制备组织工程角膜替代材料,治疗急性角膜碱烧伤。羊膜上皮细胞在传代6次前具有良好的形态和增殖能力,可分泌大量抗炎和抗血管生成的细胞因子(巨噬细胞迁移抑制因子、白细胞介素6和人色素上皮衍生因子)。板层角膜移植治疗1个月后,羊膜上皮细胞基本被宿主的角膜上皮细胞替代,且未引起明显的免疫排斥反应。治疗3个月后,宿主上皮细胞完全覆盖角膜表面,角膜透明度恢复[40]。 羊膜因含水量高、细胞因子和生长因子丰富,在碱烧伤急性期治疗中发挥关键作用,可以有效修复损伤后的角膜结构,但是存在供体不足和易感染的局限性。而脱细胞羊膜和羊膜提取液去除了细胞成分,分别保留基质的结构和成分,前者可作为组织工程支架用于负载细胞或药物,后者不需要手术并能够为急性期或修复期的抗炎和促进角膜再上皮化提供持续治疗,未来有可能替代羊膜移植治疗。最后,羊膜上皮细胞能分泌具有生物活性的因子,可能为角膜碱烧伤的晚期再上皮化提供解决办法。表2汇总了羊膜在角膜碱烧伤治疗领域的应用进展。"
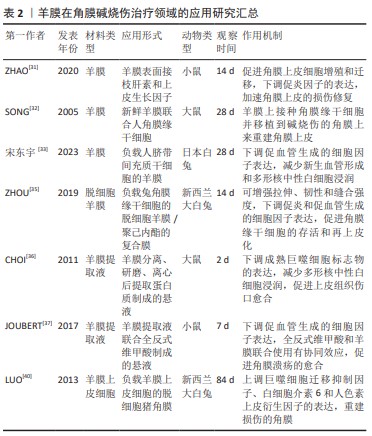
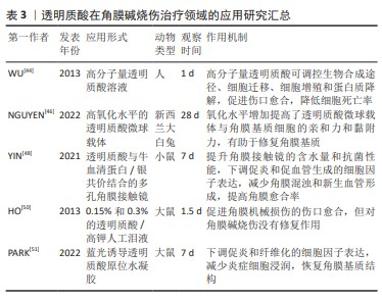
2.2.2 透明质酸 透明质酸是由D-葡萄糖醛酸和N-乙酰氨基葡萄糖胺交替连接组成的双糖单位糖胺聚糖,主要分布于角膜缘区域[41]。细胞初步合成的透明质酸为双糖长链形式,逐渐在细胞外基质中降解为中等大小片段或小片段[42]。研究发现,高分子量透明质酸具有抑制血管生长和抗炎的特性,可抑制血管内皮细胞早期响应基因的表达[43]。WU等[44]使用含有高分子量透明质酸的培养基培养氢氧化钠诱导后的角膜上皮细胞,通过提高透明质酸的分子质量能够显著降低氢氧化钠诱导的细胞毒性,并增加细胞的迁移能力。 透明质酸具有与细胞表面特定受体相互作用的能力,可通过信号通路传导调控黏附和增殖等多种细胞行为。透明质酸的分子质量越大,与细胞表面特定受体的亲和力越高[45]。为利用细胞表面受体的特异性,NGUYEN等[46]研究设计了可基质注射的透明质酸微球载体,旨在促进角膜基质细胞的黏附和生长,研究表明,透明质酸的氧化水平可增加透明质酸的分子质量,减少表面电荷数,有助于提高透明质酸微球载体与角膜基质细胞的亲和力和黏附力,从而促进角膜基质细胞的增殖和胶原的合成。 目前,透明质酸已经作为隐形眼镜保湿剂使用,可提高隐形眼镜的亲水性,减少溶菌酶的吸附、沉积和变性[47]。YIN等[48]将透明质酸与牛血清蛋白/银进行共价结合,制备了具有抑菌和抑制新生血管形成的多孔角膜接触镜。该角膜接触镜不仅能够抑制炎症因子(白细胞介素1β和血管内皮生长因子)的释放,还有助于促进碱烧伤后角膜基质胶原的有序排列,在治疗角膜损伤方面具有潜在的应用前景[48-49]。但是,使用仅含透明质酸的人工泪液可能治疗效果较差。HO等[50]比较了0.15%和0.3%的透明质酸/高钾人工泪液对角膜上皮机械损伤和碱烧伤的治疗效果,结果表明两种不同浓度的人工泪液均能促进角膜机械损伤的修复,但对角膜碱烧伤的上皮损伤修复无效,治疗效果的差异可能是由于透明质酸浓度较低导致其黏性减弱、在眼部停留时间较短所致。 透明质酸水凝胶提高了其在眼部的作用时间。PARK等[51]采用蓝光诱导巯基反应制备透明质酸原位水凝胶并应用于大鼠角膜碱烧伤的治疗,旨在尝试解决透明质酸滴眼液生物利用度低和患者依从性差的问题,与透明质酸滴眼液相比,蓝光诱导巯基反应的水凝胶能在损伤部位发生液态向半固体凝胶态转变,延长其在眼部的停留时间。研究结果显示,透明质酸水凝胶能够促进角膜基质厚度和胶原结构的恢复;同时,该水凝胶还可以下调α平滑肌肌动蛋白、基质金属蛋白酶9、白细胞介素1β等细胞因子的表达,从而减少炎症细胞的浸润。 透明质酸虽然能在眼部形成保护性薄膜,缩短伤口愈合时间,减少睑球粘连的风险,但独立应用透明质酸治疗角膜碱烧伤不能达到理想效果,因此联合生物活性因子、细胞或其他材料共同治疗角膜损伤或许更为有效。表3汇总了透明质酸在角膜碱烧伤治疗领域的应用进展。"
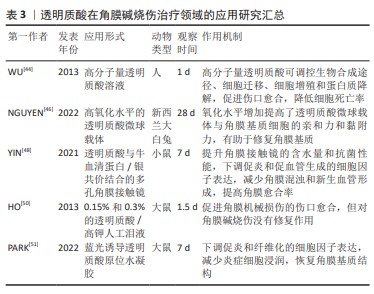
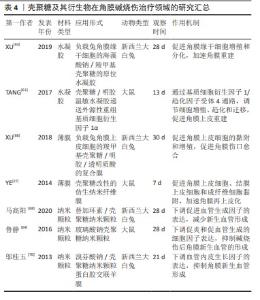
2.2.3 胶原 胶原是人体内含量最丰富的蛋白质,对细胞的黏附、增殖和分化具有促进作用,同时在提升组织的弹性和机械强度方面也发挥着关键作用。胶原以不同的组合方式存在于角膜中,其中含量最丰富的是Ⅰ型和Ⅳ型胶原[52]。 基于胶原的生物材料可分为2类:①保留原组织特性和细胞外基质结构的脱细胞基质;②通过提取、纯化和聚合制备的胶原支架[53]。胶原可以作为干细胞、药物以及细胞因子等载体,递送到角膜损伤部位,原位缓释药物并提供促上皮化的微环境,抑制基质金属蛋白酶降解上皮基底膜,使碱烧伤后的角膜完成再上皮化过程[54-55]。SIMPSON等[56]采用胶原衍生物及抑制炎症的聚合物联合制备了角膜植入材料,植入小型猪角膜碱烧伤模型中12个月,可减轻角膜水肿和角膜混浊,减少新生血管形成,促进角膜神经的再生和角膜知觉的恢复。 此外,提高角膜组织抗胶原酶消化的能力同样有助于促进角膜碱烧伤的修复。由于角膜碱烧伤导致大量多形核中性白细胞的浸润,并伴随胶原酶和基质金属蛋白酶对角膜胶原的降解,以及氧自由基对角膜细胞产生的毒性,这三者协同作用促使了角膜溶解的发生[57]。角膜胶原交联技术主要通过交联改变胶原纤维的结构,阻止蛋白水解酶进入特定的切割位点,从而增加角膜的稳定性[58]。核黄素和紫外线A诱导的胶原交联可显著增强角膜的物理强度,通过下调血管内皮生长因子、基质金属蛋白酶2和基质金属蛋白酶9的表达,显著抑制碱烧伤诱导的新生血管形成,改善角膜上皮缺损和角膜混浊[59]。SUBASI等[60]采用胶原交联联合羊膜移植治疗急性角膜碱烧伤,胶原交联可以预防无菌性角膜基质溃疡,联合羊膜移植后显著下调了脱氧核苷酸末端转移酶和白细胞分化抗原68的表达。因此,胶原交联是急性碱烧伤早期再上皮化的有效辅助治疗。 目前,基于胶原的生物材料可通过负载细胞或药物抑制炎症,也可与其他材料复合使用,通过调整胶原的机械性能达到较好的治疗效果。此外,利用角膜基质胶原进行交联也是治疗角膜碱烧伤的有效辅助手段。 2.2.4 壳聚糖 壳聚糖是从甲壳素中提取的一种天然多糖,具有低毒性、可降解性和生物相容性等优点,在组织再生支架中得到广泛应用[61]。尽管如此,壳聚糖支架在机械性能方面存在一定局限性,并且降解速度较快[62]。因此,研究中常将壳聚糖与其他材料结合使用,以优化支架的整体性能。 壳聚糖是制备水凝胶的理想生物材料之一。壳聚糖水凝胶具有亲水性且含水量高,因此被广泛应用于递送体系和组织工程。XU等[63]采用海藻酸钠和羧甲基壳聚糖制备原位水凝胶,可负载兔角膜缘干细胞用于促进碱烧伤后的角膜上皮重建。研究表明,该原位水凝胶具有高透明度、迅速凝胶化的特点和良好的生物相容性。体内实验证明,该水凝胶可在伤口表面迅速凝胶化,加速损伤角膜的修复。此外,温敏水凝胶可以随温度变化在溶胶-凝胶状态间进行可逆性转换,在体温环境下迅速凝胶化,实现液体药物向凝胶状态的转化,提高药物在眼部的停留时间。TANG等[61]采用壳聚糖/明胶温敏水凝胶递送外源性重组基质细胞衍生因子1α治疗大鼠角膜碱烧伤,研究发现该温敏水凝胶可持续释放外源性重组基质细胞衍生因子1α,并提供角膜上皮细胞生长所需的表皮细胞生长因子、肝细胞生长因子、胰岛素样生长因子和神经生长因子等生长因子,其修复机制可能是通过基质细胞衍生因子1/趋化因子受体4通路持续释放促进干细胞增殖、趋化和迁移的外源性重组基质细胞衍生因子1α,从而促进角膜上皮的重建[61]。 壳聚糖可通过分子内和分子间的氢键连接形成高透明性的薄膜。在角膜高曲率和眨眼等特殊情况下,采用薄膜治疗角膜损伤更具优势。壳聚糖膜是将壳聚糖粉末溶于水溶性溶液中,均匀搅拌后经流延干燥制备而成的薄膜。然而,壳聚糖在生理pH值环境下(6.0以上)的溶解度较低,使壳聚糖负载药物的溶解度和释放药物的速率受到限制。羧甲基化处理可提高壳聚糖在水溶液中的溶解度,从而扩大壳聚糖载药体系的应用范围[64]。水溶性的羧甲基壳聚糖及其衍生物在促进皮肤和角膜伤口愈合方面发挥着重要作用[65]。XU等[66]采用羧甲基壳聚糖、明胶和透明质酸制备复合膜,可促进原代兔角膜上皮细胞的生长和增殖,体内实验中,负载兔角膜上皮细胞的复合膜可显著促进碱烧伤后的兔角膜上皮创面愈合,同时有效恢复角膜的透明度和厚度。YE等[27]设计并制备了包含壳聚糖、胶原和透明质酸的仿生纳米纤维膜,与新鲜的人羊膜相比,改性后的纳米纤维膜具有更好的机械性能和生物学性能,角膜上皮细胞、结膜上皮细胞和成纤维细胞能够较好的黏附。在碱烧伤急性期内,该纳米纤维膜可在一周内显著改善大鼠角膜组织的再上皮化。 纳米颗粒可提高药物在眼部的渗透性、延长药物的停留时间、延缓药物的降解和代谢、提升药物的稳定性,同时,纳米颗粒毒性和不良反应较低,保质期长,因此成为眼科领域新药剂的理想选择[67]。有研究者将替加环素、玻璃酸钠和溴芬酸钠与壳聚糖纳米颗粒结合用于治疗角膜碱烧伤[68-70],以增强药物的生物利用度并降低在眼部给药中可能产生的不良反应。 壳聚糖与其他生物材料、细胞或生物活性因子组成的支架可有效促进角膜组织再生,因此其在角膜碱烧伤修复中具有一定的应用潜力。随着生物材料和药物递送系统研发热度的逐年增加,壳聚糖的应用前景将进一步拓展,表4汇总了壳聚糖及其衍生物在角膜碱烧伤治疗领域的应用进展。"

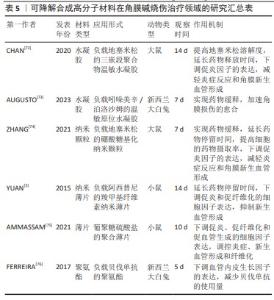
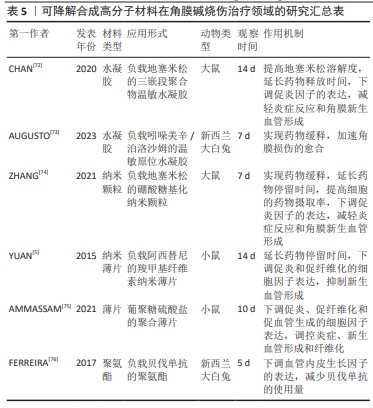
2.2.5 可降解合成高分子材料 可降解合成高分子材料在体内环境中发生分子链的特异性或非特异性断裂,随后逐步降解,降解产物可被人体吸收或经代谢过程排出体外[71]。这些材料,如水凝胶、纳米材料、薄片和聚氨酯等,主要应用于药物递送领域,旨在减轻角膜炎症、抑制角膜纤维化和减少角膜新生血管形成。 高分子水凝胶具有类似于生物组织的三维空间网络,其内部可接枝其他物质。CHAN等[72]用乙交酯、聚乙二醇和丙交酯合成三嵌段聚合物温敏水凝胶,能将地塞米松的溶解度提高5.2倍,通过单次结膜下注射水凝胶可有效减轻大鼠角膜碱烧伤后的急性炎症反应和角膜新生血管形成。此外,水凝胶还可以提高药物在眼部的生物利用度。AUGUSTO等[73]研发了基于泊洛沙姆的原位温敏水凝胶体系,并添加吲哚美辛和透明质酸,通过流变学测试筛选出最佳的凝胶体系,该体系生物相容性良好,并且能够提高兔角膜碱烧伤的愈合速度。 纳米材料可提高细胞对药物的摄取率,ZHANG等[74]开发了基于硼酸的糖基化纳米颗粒用于递送地塞米松,该系统能够有效下调白细胞介素6及α肿瘤坏死因子的表达,从而抑制角膜新生血管形成。YUAN等[5]采用羧甲基纤维素制备了纳米薄片给药体系。研究发现,该纳米薄片与阿西替尼共同作用,延长了阿西替尼在眼部的停留时间,抑制新生血管形成,显著降低了促炎症和促纤维化细胞因子的表达水平,并且该纳米薄片最终可被周围组织降解吸收。 薄片与水凝胶和纳米材料给药体系类似,AMMASSAM等[75]采用静电纺丝技术制备了基于葡聚糖硫酸盐的聚合薄片,应用于小鼠角膜损伤模型和碱烧伤模型可以调控角膜炎症和纤维化的发生,显著下调α平滑肌肌动蛋白、白细胞介素1β、白细胞介素6、α肿瘤坏死因子、血管内皮生长因子A、转化生长因子β1及Ⅰ型胶原蛋白α1链等细胞因子的表达水平,有效减轻角膜混浊和角膜瘢痕的形成。另一项研究中,FERREIRA等[76]比较负载贝伐单抗的聚氨酯和贝伐单抗溶液对碱烧伤兔角膜新生血管的抑制作用,结果显示负载少量贝伐单抗的聚氨酯即可实现与贝伐单抗溶液相似的治疗效果。 当前研究采用多种可降解的合成高分子材料作为载药系统,以延长药物在眼部的停留时间或提高细胞摄取率,有效抑制角膜炎症、纤维化和新生血管形成等病理进程,为制定更为有效的治疗方案提供了新的方式和理念。表5汇总了可降解合成高分子材料在角膜碱烧伤治疗领域的应用进展。 "
| [1] SINGH P, TYAGI M, KUMAR Y, et al. Ocular chemical injuries and their management. Oman J Ophthalmol. 2013;6(2):83-86. [2] SHAYAN ASL N, NEJAT F, MOHAMMADI P, et al. Amniotic membrane extract eye drop promotes limbal stem cell proliferation and corneal epithelium healing. Cell J. 2019;20(4):459-468. [3] SHAHRIARY A, SABZEVARI M, JADIDI K, et al. The role of inflammatory cytokines in neovascularization of chemical ocular injury. Ocul Immunol Inflamm. 2022;30(5):1149-1161. [4] SHARMA N, KAUR M, AGARWAL T, et al. Treatment of acute ocular chemical burns. Surv Ophthalmol. 2018;63(2):214-235. [5] YUAN X, MARCANO DC, SHIN CS, et al. Ocular drug delivery nanowafer with enhanced therapeutic efficacy. ACS Nano. 2015;9(2):1749-1758. [6] CHAUHAN A, FITZHENRY L, SERRO AP. Recent advances in ophthalmic drug delivery. Pharmaceutics. 2022;14(10):2075. [7] GAIN P, JULLIENNE R, HE Z G, et al. Global survey of corneal transplantation and eye banking. JAMA Ophthalmol. 2016;134(2):167-173. [8] AHEARNE M, FERNANDEZ-PEREZ J, MASTERTON S, et al. Designing scaffolds for corneal regeneration. Adv Funct Mater. 2020;30(44):1908996. [9] BIZRAH M, YUSUF A, AHMAD S. An update on chemical eye burns. Eye (Lond). 2019;33(9):1362-1377. [10] OGUIDO A, HOHMANN M S N, PINHO-RIBEIRO F A, et al. Naringenin eye drops inhibit corneal neovascularization by anti-inflammatory and antioxidant mechanisms. Invest Ophthalmol Vis Sci. 2017;58(13):5764-5776. [11] WAN S, YANG W, PAN Y, et al. G9a Suppression alleviates corneal neovascularization through blocking Nox4-mediated oxidative stress. Oxid Med Cell Longev. 2020;2020:6983268. [12] KABE Y, ANDO K, HIRAO S, et al. Redox regulation of NF-kappaB activation: distinct redox regulation between the cytoplasm and the nucleus. Antioxid Redox Signal. 2005;7(3-4):395-403. [13] CHOI H, PHILLIPS C, OH JY, et al. Comprehensive modeling of corneal alkali injury in the rat eye. Curr Eye Res. 2017;42(10):1348-1357. [14] SPROGYTE L, PARK M, DI GIROLAMO N. Pathogenesis of alkali injury-induced limbal stem cell deficiency: a literature survey of animal models. Cells. 2023;12(9):1294. [15] YAN D, YU F, CHEN L, et al. Subconjunctival injection of regulatory t cells potentiates corneal healing via orchestrating inflammation and tissue repair after acute alkali burn. Invest Ophthalmol Vis Sci. 2020;61(14):22. [16] JIANG L, HE W, TANG F, et al. Epigenetic landscape analysis of the long non-coding RNA and messenger RNA in a mouse model of corneal alkali burns. Invest Ophthalmol Vis Sci. 2021;62(4):28. [17] WANG FY, CHENG J, ZHAI HL, et al. Correlation analysis of the clinical features and prognosis of acute ocular burns-exploration of a new classification scheme. Graef Arch Clin Exp. 2020;258(1):147-155. [18] KUBOTA M, SHIMMURA S, KUBOTA S, et al. Hydrogen and N-acetyl-L-cysteine rescue oxidative stress-induced angiogenesis in a mouse corneal alkali-burn model. Invest Ophthalmol Vis Sci. 2011;52(1):427-433. [19] NICHOLAS MP, MYSORE N. Corneal neovascularization. Exp Eye Res. 2021; 202:108363. [20] CUI N, HU M, KHALIL RA. Biochemical and biological attributes of matrix metalloproteinases. Prog Mol Biol Transl Sci. 2017;147:1-73. [21] FUKUDA K. Corneal fibroblasts: function and markers. Exp Eye Res. 2020; 200:108229. [22] WILSON SE. TGF beta -1, -2 and -3 in the modulation of fibrosis in the cornea and other organs. Exp Eye Res. 2021;207:108594. [23] WILSON SE. The yin and yang of mesenchymal cells in the corneal stromal fibrosis response to injury: the cornea as a model of fibrosis in other organs. Biomolecules. 2022;13(1):87. [24] KETHIRI AR, SINGH VK, DAMALA M, et al. Long term observation of ocular surface alkali burn in rabbit models: quantitative analysis of corneal haze, vascularity and self-recovery. Exp Eye Res. 2021;205:108526. [25] KETHIRI AR, RAJU E, BOKARA KK, et al. Inflammation, vascularization and goblet cell differences in LSCD: validating animal models of corneal alkali burns. Exp Eye Res. 2019;185:107665. [26] CLARE G, BUNCE C, TUFT S. Amniotic membrane transplantation for acute ocular burns. Cochrane Database Syst Rev. 2022;9(9):Cd009379. [27] YE J, SHI X, CHEN X, et al. Chitosan-modified, collagen-based biomimetic nanofibrous membranes as selective cell adhering wound dressings in the treatment of chemically burned corneas. J Mater Chem B. 2014;2(27): 4226-4236. [28] THIA ZZ, HO YT, SHIH KC, et al. New developments in the management of persistent corneal epithelial defects. Surv Ophthalmol. 2023;68(6):1093-1114. [29] PALCHESKO RN, CARRASQUILLA SD, FEINBERG AW. Natural biomaterials for corneal tissue engineering, repair, and regeneration. Adv Healthc Mater. 2018;7(16):e1701434. [30] BOMFIM PEREIRA MG, PEREIRA GOMES JA, RIZZO LV, et al. Cytokine dosage in fresh and preserved human amniotic membrane. Cornea. 2016;35(1): 89-94. [31] ZHAO X, ZUO X, ZHONG J, et al. Heparin-modified amniotic membrane combined with growth factors for promoting corneal wound healing after alkali burn. Front Bioeng Biotechnol. 2020;8:599800. [32] SONG E, YANG W, CUI ZH, et al. Transplantation of human limbal cells cultivated on amniotic membrane for reconstruction of rat corneal epithelium after alkaline burn. Chin Med J (Engl). 2005;118(11):927-935. [33] 宋东宇,高明宏,李冬梅.人脐带间充质干细胞移植治疗角膜碱烧伤的实验研究[J].国际眼科杂志,2023,23(5):717-722. [34] WANG MY, LI Y, WANG HQ, et al. Corneal regeneration strategies: from stem cell therapy to tissue engineered stem cell scaffolds. Biomed Pharmacother. 2023;165:115206. [35] ZHOU Z, LONG D, HSU CC, et al. Nanofiber-reinforced decellularized amniotic membrane improves limbal stem cell transplantation in a rabbit model of corneal epithelial defect. Acta Biomaterialia. 2019;97:310-320. [36] CHOI JA, CHOI JS, JOO CK. Effects of amniotic membrane suspension in the rat alkali burn model. Mol Vis. 2011;17:404-412. [37] JOUBERT R, DANIEL E, BONNIN N, et al. Retinoic acid engineered amniotic membrane used as graft or homogenate: positive effects on corneal alkali burns. Invest Ophthalmol Vis Sci. 2017;58(9):3513-3518. [38] FATHI I, MIKI T. Human amniotic epithelial cells secretome: components, bioactivity, and challenges. Front Med (Lausanne). 2022;8:763141. [39] YANG MB, WANG LQ, CHEN ZM, et al. Topical administration of the secretome derived from human amniotic epithelial cells ameliorates psoriasis-like skin lesions in mice. Stem Cell Res Ther. 2022;13(1):393. [40] LUO H, LU Y, WU T, et al. Construction of tissue-engineered cornea composed of amniotic epithelial cells and acellular porcine cornea for treating corneal alkali burn. Biomaterials. 2013;34(28):6748-6759. [41] GESTEIRA TF, SUN M, COULSON-THOMAS YM, et al. Hyaluronan rich microenvironment in the limbal stem cell niche regulates limbal stem cell differentiation. Invest Ophthalmol Vis Sci. 2017;58(11):4407-4421. [42] PAULOIN T, DUTOT M, WARNET JM, et al. In vitro modulation of preservative toxicity: high molecular weight hyaluronan decreases apoptosis and oxidative stress induced by benzalkonium chloride. Eur J Pharm Sci. 2008; 34(4):263-273. [43] BOLLYKY PL, BOGDANI M, BOLLYKY JB, et al. The role of hyaluronan and the extracellular matrix in islet inflammation and immune regulation. Curr Diab Rep. 2012;12(5):471-480. [44] WU CL, CHOU HC, LI JM, et al. Hyaluronic acid-dependent protection against alkali-burned human corneal cells. Electrophoresis. 2013;34(3):388-396. [45] GUPTA RC, LALL R, SRIVASTAVA A, et al. Hyaluronic Acid: Molecular Mechanisms and Therapeutic Trajectory. Front Vet Sci. 2019;6:192. [46] NGUYEN DD, YAO CH, LUO LJ, et al. Oxidation-mediated scaffold engineering of hyaluronic acid-based microcarriers enhances corneal stromal regeneration. Carbohydr Polym. 2022;292:119668. [47] WEEKS A, MORRISON D, ALAUZUN JG, et al. Photocrosslinkable hyaluronic acid as an internal wetting agent in model conventional and silicone hydrogel contact lenses. J Biomed Mater Res A. 2012;100(8):1972-1982. [48] YIN C, QI X, WU J, et al. Therapeutic contact lenses fabricated by hyaluronic acid and silver incorporated bovine serum albumin porous films for the treatment of alkali-burned corneal wound. Int J Biol Macromol. 2021;184:713-720. [49] JOHNSON ME, MURPHY PJ, BOULTON M. Effectiveness of sodium hyaluronate eyedrops in the treatment of dry eye. Graefes Arch Clin Exp Ophthalmol. 2006;244(1):109-112. [50] HO WT, CHIANG TH, CHANG SW, et al. Enhanced corneal wound healing with hyaluronic acid and high-potassium artificial tears. Clin Exp Optom. 2013;96(6):536-541. [51] PARK SK, HA M, KIM EJ, et al. Hyaluronic acid hydrogels crosslinked via blue light-induced thiol-ene reaction for the treatment of rat corneal alkali burn. Regen Ther. 2022;20:51-60. [52] BARATTA RO, SCHLUMPF E, BUONO BJD, et al. Corneal collagen as a potential therapeutic target in dry eye disease. Surv Ophthalmol. 2022;67(1):60-67. [53] SKLENÁROVÁ R, AKLA N, LATORRE MJ, et al. Collagen as a biomaterial for skin and corneal wound healing. J Funct Biomater. 2022;13(4):249. [54] NA KS, FERNANDES-CUNHA GM, VARELA IB, et al. Effect of mesenchymal stromal cells encapsulated within polyethylene glycol-collagen hydrogels formed in situ on alkali-burned corneas in an ex vivo organ culture model. Cytotherapy. 2021;23(6):500-509. [55] LIU J, XU Y, HUANG Y, et al. Collagen membrane loaded with doxycycline through hydroxypropyl chitosan microspheres for the early reconstruction of alkali-burned cornea. Int J Biol Macromol. 2023;244:125188. [56] SIMPSON FC, MCTIERNAN CD, ISLAM MM, et al. Collagen analogs with phosphorylcholine are inflammation-suppressing scaffolds for corneal regeneration from alkali burns in mini-pigs. Commun Biol. 2021;4(1):608. [57] GAO XW, ZHAO XD, LI WJ, et al. Experimental study on the treatment of rabbit corneal melting after alkali burn with Collagen cross-linking. Int J Ophthalmol. 2012;5(2):147-150. [58] KARTI O, ZENGIN MO, CINAR E, et al. Effect of 1- and 6-hour-delayed corneal collagen cross-linking on corneal healing in a rabbit alkali-burn model: clinical and histological observations. Cornea. 2016;35(12):1644-1649. [59] XU X, LIU T, LI H. Effect of collagen cross-linking on alkali burn-induced corneal neovascularization in rabbits. J Ophthalmol. 2018;2018:7325483. [60] SUBASI S, ALTINTAS O, YARDIMOGLU M, et al. Comparison of collagen cross-linking and amniotic membrane transplantation in an experimental Alkali burn rabbit model. Cornea. 2017;36(9):1106-1115. [61] TANG Q, LUO C, LU B, et al. Thermosensitive chitosan-based hydrogels releasing stromal cell derived factor-1 alpha recruit MSC for corneal epithelium regeneration. Acta Biomater. 2017;61:101-113. [62] FU J, YANG F, GUO Z. The chitosan hydrogels: from structure to function. New J Chem. 2018;42(21):17162-17180. [63] XU W, LIU K, LI T, et al. An in situ hydrogel based on carboxymethyl chitosan and sodium alginate dialdehyde for corneal wound healing after alkali burn. J Biomed Mater Res A. 2019;107(4):742-754. [64] ZHOU Y, ZHAI Z, YAO Y, et al. Oxidized hydroxypropyl cellulose/carboxymethyl chitosan hydrogels permit pH-responsive, targeted drug release. Carbohydr Polym. 2023;300:120213. [65] KWON YS, KU SK, LEE DG, et al. Effect of carboxymethyl chitosan on the corneal alkali burn injury in dogs. Invest Ophthalmol Vis Sci. 2014;55(13):5165-5165. [66] XU W, WANG Z, LIU Y, et al. Carboxymethyl chitosan/gelatin/hyaluronic acid blended-membranes as epithelia transplanting scaffold for corneal wound healing. Carbohydr Polym. 2018;192:240-250. [67] YEE KUEN C, MASARUDIN MJ. Chitosan nanoparticle-based system: a new insight into the promising controlled release system for lung cancer treatment. Molecules. 2022;27(2):473. [68] 马高阳,蔡岩,李文静,等.替加环素/壳聚糖纳米粒对碱烧伤角膜新生血管的作用[J].眼科新进展,2020,40(9):831-836. [69] 鲁静,武士科,陈光,等.玻璃酸钠壳聚糖纳米粒对烧伤角膜新生血管生长的影响[J].中国组织工程研究,2016,20(52):7803-7808. [70] 邬桂玉,赵敏,计岩.溴芬酸钠/壳聚糖纳米粒蛋白胶胶联羊膜的制备及其对兔角膜新生血管的影响[J].第三军医大学学报,2013,35(6):495-499. [71] FEIG VR, TRAN H, BAO ZN. Biodegradable polymeric materials in degradable electronic devices. ACS Cent Sci. 2018;4(3):337-348. [72] CHAN PS, LI Q, ZHANG B, et al. In vivo biocompatibility and efficacy of dexamethasone-loaded PLGA-PEG-PLGA thermogel in an alkali-burn induced corneal neovascularization disease model. Eur J Pharm Biopharm. 2020;155:190-198. [73] AUGUSTO DE CASTRO M, HENRIQUE REIS P, FERNANDES C, et al. Thermoresponsive in-situ gel containing hyaluronic acid and indomethacin for the treatment of corneal chemical burn. Int J Pharm. 2023;631:122468. [74] ZHANG Y, YU Y, LI G, et al. Bioadhesive glycosylated nanoformulations for extended trans-corneal drug delivery to suppress corneal neovascularization. J Mater Chem B. 2021;9(20):4190-4200. [75] AMMASSAM VEETTIL R, MARCANO DC, YUAN X, et al. Dextran sulfate polymer wafer promotes corneal wound healing. Pharmaceutics. 2021;13(10):1628. [76] FERREIRA AE, CASTRO BF, VIEIRA LC, et al. Antiangiogenic activity of a bevacizumab-loaded polyurethane device in animal neovascularization models. J Fr Ophtalmol. 2017;40(3):202-208. |
| [1] | Zhao Zengbo, Li Chenxi, Dou Chenlei, Ma Na, Zhou Guanjun. Anti-inflammatory and osteogenic effects of chitosan/sodium glycerophosphate/sodium alginate/leonurine hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 678-685. |
| [2] | Dong Meilin, Du Haiyu, Liu Yuan. Quercetin-loaded carboxymethyl chitosan hydrogel promotes wound healing in diabetic rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 692-699. |
| [3] | Liu Haoyang, Xie Qiang, Shen Mengran, Ren Yansong, Ma Jinhui, Wang Bailiang, Yue Debo, Wang Weiguo . Application, research hotspots, and shortcomings of degradable zinc-based alloys in bone defect repair and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 839-845. |
| [4] | Xin Yuan, Wu Xixi, Quan Liang, Zhang Hengtong, Ao Qiang. REG-augmented decellularized porcine cornea/hydroxyethyl methacrylate in situ integrated composite artificial cornea [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3388-3399. |
| [5] | Feng Shuqi, Zhang Shiyong, Yao Keyi, Tang Yufei, Wang Kai, Zhou Xuemei, Xiang Lin. Application of photoresponsive nanomaterials in bone tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3469-3475. |
| [6] | He Jing, Ao Qiang. Research hotspots in tissue decellularization method for manufacturing extracellular matrices [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(34): 5413-5420. |
| [7] | Jiang Zongrui, Zhang Zhiqi. Treatment of meniscus injury or degeneration: the effect and function of stem cells and artificial polymer scaffolds to form tissue engineering system [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(34): 5421-5427. |
| [8] | Yu Xingge, Lin Kaili. Application of nanocomposite hydrogels in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(34): 5441-5446. |
| [9] |
Zeng Zhaomu, Wen Xichao, Zhang Yuhao, Geng Lianting, Shen Yang, Zheng Kebin.
Role and application of exosomes-mediated miRNAs in the treatment of glioma [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(25): 4073-4080. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||