Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (35): 5727-5733.doi: 10.12307/2023.712
Previous Articles Next Articles
Role and advance of mitophagy in spinal cord injury
Ding Yiqun1, Li Xigong2, Pan Wenming3, Zhang Qin1
- 1Department of Spinal Surgery, Yuncheng Central Hospital Affiliated to Changzhi Medical College, Yuncheng 044000, Shanxi Province, China; 2Department of Spinal Surgery, First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310000, Zhejiang Province, China; 3Department of Spinal Surgery, Changshu No. 2 People’s Hospital, Changshu 215500, Jiangsu Province, China
-
Received:2022-09-21Accepted:2022-11-18Online:2023-12-18Published:2023-06-05 -
Contact:Zhang Qin, MD, Chief physician, Department of Spinal Surgery, Yuncheng Central Hospital Affiliated to Changzhi Medical College, Yuncheng 044000, Shanxi Province, China -
About author:Ding Yiqun, Master candidate, Department of Spinal Surgery, Yuncheng Central Hospital Affiliated to Changzhi Medical College, Yuncheng 044000, Shanxi Province, China -
Supported by:Shanxi Natural Science Foundation, No. 201901D111472 (to ZQ)
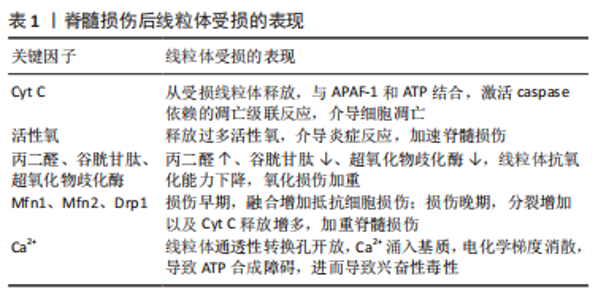
2.1 脊髓损伤后线粒体受损 线粒体作为能量供应的主要来源,在细胞凋亡、坏死、自噬、脂类生成以及Ca2+代谢等方面发挥至关重要的作用。正常情况下,线粒体是双层膜围成的囊状结构,形态规则,嵴清楚,排列整齐。当脊髓损伤导致线粒体受损时,会在损伤节段发现线粒体体积增大,结构不清,嵴断裂、排列紊乱,粗面内质网松散,空泡形成,同时还发现线粒体膜电位下降,影响电子传递和氧化磷酸化[6]。线粒体受损所致的功能障碍包括氧化应激、能量缺乏、线粒体动力学失衡、线粒体运输缺陷和吞噬功能失调等方面,与一些脊髓损伤、心血管疾病以及神经退行性疾病(如阿尔茨海默症、帕金森病、亨廷顿病等)密切相关[7]。脊髓损伤最严重的损害便是线粒体受损导致的轴突变性及细胞凋亡,线粒体受损导致氧化磷酸化作用减弱,通过氧化释放能量并生成ATP的效率显著降低,Ca2+稳态破坏,线粒体中的细胞色素C等促凋亡蛋白释放到细胞质中,诱导细胞凋亡[8]。通过加强线粒体转运、清除活性氧和改善生物能量来修复这些有缺陷的线粒体,可以极大地促进轴突再生,减少细胞凋亡,改善脊髓损伤。 在正常情况下,抗凋亡蛋白Bcl-2和Bcl-xl通常整合在线粒体外膜内,它们通过阻止线粒体释放细胞色素C来调节细胞凋亡。当脊髓损伤线粒体破坏时,细胞色素C通过核编码的促凋亡蛋白Bax和Bak的作用从线粒体释放,与凋亡蛋白酶激活因子1(APAF-1)和ATP结合,激活caspase依赖的凋亡级联反应,介导细胞凋亡[9]。 线粒体是活性氧的主要来源之一。当脊髓损伤时,线粒体受损释放过多的活性氧,与损伤相关分子模式(DAMPs)一起激活炎症小体诱发炎症反应,过度的炎症反应会导致组织损伤,加速细胞损伤[10]。脊髓损伤后引起丙二醛水平升高、谷胱甘肽和超氧化物歧化酶水平降低,表明脊髓损伤可诱导线粒体受损,引起线粒体抗氧化水平下降,自由基氧化反应增强,氧化损伤加重[11]。 脊髓损伤后线粒体会发生结构上的变化,包括融合与分裂,Mfn1、Mfn2是线粒体融合蛋白,Drp1是线粒体分裂蛋白。在脊髓损伤后,Mfn1、Mfn2先增加后减少,Drp1先减少后增加,同时细胞色素C逐渐增加。在损伤早期,线粒体融合的增加可能与产生三磷酸腺苷并提供能量来抵抗细胞损伤发挥自我防御有关;在损伤晚期,随着凋亡应激源的过度激活和放大,这种代偿机制不再能阻止细胞死亡,线粒体分裂增加和细胞色素C释放增加最终导致细胞凋亡[12]。 线粒体在Ca2+的调节上也发挥重要作用,可以通过吸收多余的钙离子以维持胞浆内钙离子的动态平衡水平。线粒体内膜线粒体通透性转换孔(MPTP)开放的主要触发因素是线粒体基质钙离子,脊髓损伤后继发性损伤造成的线粒体功能障碍导致线粒体通透性转换孔开放,线粒体内膜不能作为阻止质子流动的屏障,导致Ca2+释放到膜间隙,并且随着膜间隙中的质子涌入基质,电化学梯度也会消散,最终导致ATP合成停止[13]。ATP合成障碍导致调节离子浓度所需的ATP缺乏和依赖于ATP的离子泵失活,以及兴奋性神经递质谷氨酸的重新摄取,这种功能障碍最终导致兴奋性毒性、钙超载和最终启动细胞死亡级联反应,这些都是脊髓损伤的特征[14]。线粒体受损表现见表1。"
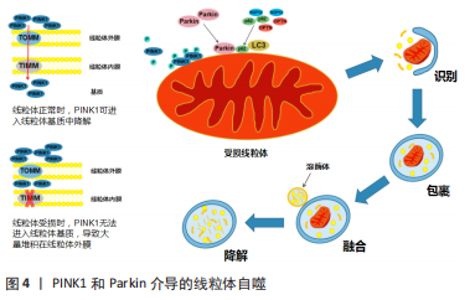
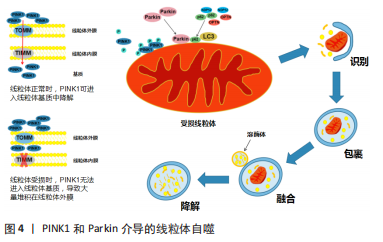
2.2 自噬与线粒体自噬 自噬是一种通过与溶酶体结合降解自身受损细胞器和变性蛋白质的分解代谢途径,是真核生物中保守的细胞内降解系统,在维持细胞的完整性以及细胞的生长代谢等方面具有重要作用[15]。研究发现,自噬在平时的基础水平上会持续发生,但当细胞受到内外环境变化时(如细胞损伤、环境应激、营养缺乏等)会进一步激活自噬,在透射电子显微镜下可看见大量空泡状双膜囊结构,即自噬体[16]。自噬体是检测细胞自噬水平的金指标。自噬的发生大致经过吞噬泡形成、自噬体形成、自噬体与溶酶体结合、自噬体降解这4个阶段,即自噬被激活后首先形成吞噬泡,逐渐延长并融合形成双膜囊结构的自噬体,自噬体与溶酶体相接触,通过骨架微管系统融合形成具有消化降解能力的自噬-溶酶体复合物,降解自噬体内膜以及包裹的受损细胞器和变性蛋白质,降解后生成氨基酸、核苷酸、脂肪酸等降解产物供细胞回收利用,以满足细胞增殖和生长的需要[17]。自噬与自噬蛋白Beclin-1和轻链3-Ⅱ(微管相关蛋白1轻链3-Ⅱ)的表达有关。 自噬标志物:①微管相关蛋白1轻链3,是自噬体的标志性分子,在研究中被广泛使用。在细胞中存在两种形式的微管相关蛋白1轻链3,即微管相关蛋白1轻链3-Ⅰ和微管相关蛋白1轻链3-Ⅱ,这两种形式的微管相关蛋白1轻链3可以在某些特定的条件下相互转化。当自噬处于基础水平时,微管相关蛋白1轻链3被加工修饰并转化为胞质形式的微管相关蛋白1轻链3-Ⅰ,其可在细胞质中表达;当自噬被进一步激活时,细胞质中的微管相关蛋白1轻链3-Ⅰ在泛素样反应酶的作用下,与磷脂酰乙醇胺共价结合(ATG7为微管相关蛋白1轻链3激活酶,ATG3为微管相关蛋白1轻链3结合酶),形成为膜结合形式的微管相关蛋白1轻链3-Ⅱ,在自噬体膜上表达[18]。微管相关蛋白1轻链3-Ⅱ增加表明在脊髓损伤后产生了大量自噬体,自噬水平上升。②Beclin-1,是Ⅲ型磷脂酰肌醇3激酶复合物(PI3KC3)的一部分,介导其他自噬蛋白定位到自噬体前膜,参与构成自噬体前体,是自噬的正性调节因子,通过调节自噬体的形成来调节自噬活性[19]。Beclin-1蛋白表达增加表明在脊髓损伤后有大量的自噬体形成,促使自噬水平上升。③P62,又称SQSTM1,是一种具有高度选择性的自噬接头蛋白,作为连接微管相关蛋白1轻链3和泛素化底物的纽带,与微管相关蛋白1轻链3相互作用并入自噬体,通过自噬将变性的蛋白质转运并降解。p62被认为是研究自噬通量的可靠标志物。自噬激活后p62蛋白在细胞质中被降解,自噬通量处于高水平状态,而当自噬水平被抑制后则会导致p62蛋白的积聚,表明自噬通量受阻。因此,P62蛋白表达的多少可以表示自噬通量的水平,p62水平升高与自噬通量阻断相关,而p62水平降低与自噬通量增强相关[20]。 根据自噬是否具有选择性,自噬又可分为选择性自噬和非选择性自噬。选择性自噬中具有代表性的是线粒体自噬,线粒体自噬是自噬的一种特殊形式,它介导缺陷/多余线粒体的清除,是唯一已知的选择性清除整个线粒体的途径。线粒体自噬负责线粒体的基础更新,从而消除功能失调的线粒体,对控制线粒体的质量和数量、促进细胞存活至关重要。此外,线粒体自噬可以作为一种应激反应机制来抑制线粒体依赖的细胞凋亡[21]。 2.3 脊髓损伤后线粒体自噬发生机制 脊髓损伤后介导线粒体自噬的途径有很多,例如PINK1/Parkin、Nix/BNIP3L、BNIP3、Atg蛋白、FUNDC1、FKBP8/FKBP38、Bcl-2样蛋白13等,现就几个比较常见的通路详细介绍。 2.3.1 PINK1和Parkin介导的线粒体自噬 PTEN诱导激酶1(PTEN-induced kinas 1,PINK1)作为一种丝氨酸/苏氨酸激酶,位于Parkin的上游发挥作用。PINK1通过不断检查线粒体的状态来识别受损线粒体,并为Parkin的招募和激活发出信号[22]。Parkin作为一种E3泛素连接酶,可以促进线粒体膜蛋白的泛素化,与自噬小体蛋白微管相关蛋白1轻链3-Ⅱ结合,诱导线粒体自噬[23]。在正常的线粒体中,线粒体外膜转位酶(translocase of outer mitochondrial membrane,TOMM)可以将PINK1转运至膜间隙,然后再通过线粒体内膜转位酶(translocase of inner mitochondrial membrane,TIMM)将PINK1整合到线粒体内膜[24-25]。 正常情况下,PINK1定位于线粒体内膜,在TOMM和TIMM的协助下进入细胞质,并被低水平降解。当脊髓损伤导致线粒体受损时,线粒体膜通透性改变,线粒体膜电位下降,导致TIMM的整合作用出现异常,PINK1不能进入线粒体,聚集在线粒体外膜,PINK1同型二聚并自磷酸化,成为一个高度活跃的激酶,通过磷酸化线粒体融合蛋白2(Mfn2)使Parkin向线粒体易位并磷酸化UBL结构域的Parkin S65,Parkin被招募到受损线粒体后促进线粒体膜上蛋白质泛素化,招募自噬受体蛋白如P62、OPTN和NDP52与线粒体膜上泛素化蛋白相互作用,微管相关蛋白1轻链3再通过与自噬受体蛋白结合定位于受损线粒体上,使其被自噬体包裹,启动线粒体自噬,见图4[26-27]。"
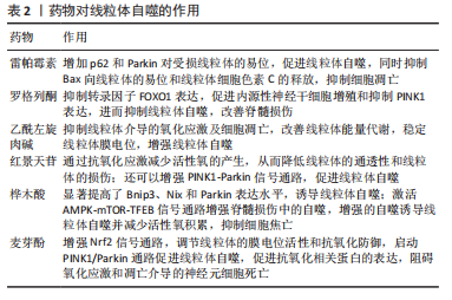
2.3.2 Nix介导的线粒体自噬 Nix,也被称为BNIP3L,是Bcl-2家族的成员,定位于线粒体外膜。研究发现Nix介导的线粒体自噬在红细胞成熟的过程中发挥重要作用,Nix的缺失会阻止成熟红细胞中线粒体的降解,但不影响其他细胞成分的自噬清除[28]。 Nix在丝氨酸81的磷酸化是其诱导线粒体自噬所必需的[29]。Nix通过c端跨膜结构域(TM)与线粒体膜结合,Nix在丝氨酸34和丝氨酸35的磷酸化增强了其与微管相关蛋白1轻链3的相互作用[30]。线粒体结合的Nix与自噬小体定位的微管相关蛋白1轻链3结合后形成线粒体-Nix-LC3自噬体复合物,诱导脊髓损伤后过度的线粒体自噬,导致脊髓损伤后的线粒体变性和神经元细胞死亡[31]。对于脊髓损伤,通过下调Nix来抑制线粒体自噬,可以保护线粒体免受过度损伤并减少神经元坏死。目前,研究发现存在3种依赖于Nix的线粒体自噬模式[31]。首先,Nix可能通过触发线粒体的去极化来诱导线粒体自噬。Nix与Parkin之间存在相互作用,Nix可以通过解偶联剂CCCP增加线粒体内膜的质子渗透性,从而消除跨膜电位,使线粒体去极化,激活Parkin介导的通路,诱导线粒体自噬[32]。其次,Nix可以通过增加细胞中游离Beclin 1的量来激活线粒体自噬。研究发现Nix通过与Beclin 1竞争性结合Bcl-2或Bcl-xL,从而释放Beclin 1,诱导线粒体自噬的发生[33]。最后,Nix能够作为自噬受体募集自噬成分并诱导线粒体自噬。 2.3.3 FUNDC1介导的线粒体自噬 FUNDC1是一种线粒体自噬受体蛋白,在介导线粒体自噬方面发挥重要作用,其n端含有典型的微管相关蛋白1轻链3相互作用区(LIR),LIR暴露在胞浆中,与微管相关蛋白1轻链3结合调节线粒体自噬[34]。正常情况下,蛋白激酶Src和CK2分别磷酸化Tyr18和Ser13,从而抑制了FUNDC1介导线粒体自噬的功能,低氧条件下,unc-51样激酶1(ULK1)在Ser17上磷酸化和磷酸甘油酸变位酶家族蛋白5(phosphoglycerate mutase 5,PGAM5)在Ser13上去磷酸化刺激FUNDC1的活性,促进FUNDC1与微管相关蛋白1轻链3的结合,增强线粒体自噬[35-36]。常氧条件下,Bcl-xL是一种抗凋亡分子,与PGAM5结合并抑制PGAM5的活性,而在缺氧条件下,Bcl-xL的蛋白水平降低,释放更多的PGAM5与FUNDC1结合,导致FUNDC1去磷酸化和线粒体自噬增强[37]。PGAM5还通过对Bcl-xL的Ser62位去磷酸化来调节Bcl-xL的活性,从而激活Bcl-xL,抑制细胞凋亡和FUNDC1依赖的线粒体自噬。相反,在某些氧化应激条件下,PGAM5形成多聚体并从Bcl-xL解离,并使FUNDC1去磷酸化以诱导线粒体自噬[38]。还有研究发现,FUNDC1与线粒体融合蛋白OPA1分离并与线粒体裂变蛋白Drp1结合,导致线粒体裂变和线粒体自噬[39]。 2.3.4 Atg蛋白介导的线粒体自噬 Atg32作为一种线粒体外膜蛋白,与选择性自噬所需的胞质适配器蛋白Atg11相互作用,形成Atg32-Atg11复合体,这种复合体可以借助Atg11将线粒体靶向到前自噬体结构(PAS),在PAS位点上,Atg32与自噬小体膜上的一种蛋白Atg8相互作用,Atg32-Atg8相互作用促进线粒体周围自噬小体的形成,诱导线粒体自噬的发生[40]。此外,还有研究发现Atg32可以不通过Atg11直接与Atg8结合发挥作用,引导线粒体自噬。 除以上比较典型的通路外,研究发现还有一些其他途径也可以诱导线粒体自噬,如GPCR激酶2-相互作用蛋白1[G蛋白偶联受体激酶相互作用蛋白1(G protein-coupled receptor kinase interacting proteins1,GIT1)]通过促进Beclin1-Parkin诱导线粒体自噬。HUANG等[41]研究发现GIT1促进了Thr119结构域上Beclin-1的磷酸化,磷酸化的Beclin-1促进了Parkin的移位,这个过程与PINK1无关,但在没有PINK1的情况下,Parkin无法磷酸化,也就无法启动线粒体自噬。GIT1的过表达增强了线粒体自噬功能,对缺血再灌注损伤具有保护作用。LIU等[42]研究发现,抑制miRNA-124可上调P53家族促凋亡蛋白的抑制性成员(iASPP)在大鼠脊髓中的表达。鞘内注射含antagomiR-124的慢病毒载体后,下调了miRNA-124表达,iASPP表达增强,进而抑制P53的过度表达,诱导线粒体自噬,对抗细胞凋亡。对于上述通路还需进一步研究,这可能为今后脊髓损伤的治疗提供更多方案。 2.4 线粒体自噬作为治疗脊髓损伤的重要靶点 神经细胞具有很高的代谢率,线粒体作为主要的供能亚细胞器,可以产生大量能量供神经细胞代谢。当脊髓受到严重损伤时会导致线粒体功能障碍,导致ATP水平降低、Ca2+稳态损伤、活性氧应激损伤和细胞凋亡。线粒体自噬可以选择性清除受损的线粒体,保护神经细胞,抑制细胞凋亡。影响线粒体自噬的因素有很多,如缺氧、药物等。脊髓损伤后会在损伤部位出现明显的缺血、缺氧以及水肿等情况,在缺氧条件下可以在神经元中检测到线粒体肿胀和自噬体液泡,更高的放大倍数显示自噬体具有双膜结构,含有膨胀和扩张的线粒体。YU等[43]通过实验发现在缺氧条件下,微管相关蛋白1轻链3-Ⅱ/微管相关蛋白1轻链3-Ⅰ比率呈时间依赖性上调,COXIV和TOM20的表达水平逐渐降低。这结果表明,暴露于缺氧后,脊髓神经元中的线粒体自噬被激活。缺氧还可以诱导BNIP3和NIX的表达增加,诱导线粒体自噬的发生。 雷帕霉素(rapamycin,RAPA)作为自噬的特异性诱导剂,抑制损伤脊髓组织中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的表达,上调Beclin 1和磷酸化Akt的表达。雷帕霉素可抑制受损组织Bcl-2表达的下降,降低受损组织Bax、细胞色素C和半胱氨酸天冬氨酸蛋白酶3(Caspase-3)的表达水平,减少脊髓损伤后24 h受损组织中凋亡神经元的数量[44]。此外,还有研究发现雷帕霉素不仅可以激活一般的自噬,还可以激活线粒体自噬,线粒体自噬的激活可以通过清除受损的线粒体以抑制细胞凋亡,促进脊髓损伤的恢复。LI等[45]在小鼠脊髓缺血再灌注损伤(SCIRI)模型中发现,雷帕霉素可以通过增加p62和Parkin对受损线粒体的易位促进线粒体自噬,保护神经元,同时还可以通过抑制Bax向线粒体的易位和线粒体细胞色素C的释放,降低线粒体凋亡相关蛋白(Apaf-1、Caspase-3、Caspase-9)的表达,抑制细胞凋亡。这个研究说明了雷帕霉素通过线粒体自噬途径保护脊髓损伤。随着对雷帕霉素的进一步研究发现,在激活自噬的过程中,雷帕霉素既可发挥保护作用,又会产生损害作用。在创面附近皮下注射雷帕霉素,连续7 d,每天4 mg/kg,可导致脊髓损伤后的不良后果[46]。相反,脊髓损伤后连续7 d,每天1 mg/kg的剂量则会产生神经保护作用[47]。在上述研究中,应用雷帕霉素即便都是激活自噬,但给药剂量不同会导致结果不同,低剂量延缓脊髓损伤,高剂量加重脊髓损伤,这说明自噬在一定区间内才能发挥保护作用,这种效应的出现还有待进一步研究。 罗格列酮(Rosiglitazone)是一种噻唑烷二酮类药物,是过氧化物酶体增殖物激活受体γ(PPAR-γ)激动剂,主要通过增加机体对胰岛素的敏感性来发挥降血糖的作用,被用于治疗2型糖尿病。目前研究发现罗格列酮还在脊髓损伤模型中具有抗炎和抗氧化的作用,并且能够通过抑制自噬水平来改善神经功能。罗格列酮被发现不仅在自噬中起到改善脊髓损伤的作用,还能在线粒体自噬中起作用。在一般的自噬中发现,罗格列酮可显著下调脊髓损伤后自噬相关蛋白(微管相关蛋白1轻链3-Ⅱ、Beclin 1、cathepsin D)的表达,降低脊髓损伤后大鼠的自噬,改善脊髓损伤[48]。在线粒体自噬研究中发现,罗格列酮可以通过抑制转录因子FOXO1表达,促进内源性神经干细胞增殖和抑制PINK1表达,进而抑制线粒体自噬,改善脊髓损伤。同时还发现,罗格列酮通过调节线粒体自噬来调节底物代谢和ATP产生方式,最终加速内源性神经干细胞的增殖[49]。 乙酰左旋肉碱(acetyl-L-carnitine,ALC)是由线粒体中的肉碱乙酰化而产生的一种分子,已被证明在维持线粒体完整性和能量代谢方面发挥着重要作用。现研究发现,ALC不仅可以抑制线粒体介导的氧化应激及细胞凋亡,还可以改善线粒体能量代谢,稳定线粒体膜电位,增强线粒体自噬[50]。孟庆峰等[51]研究发现,与假手术组相比,脊髓损伤组微管相关蛋白1轻链3-Ⅱ蛋白表达增加;在应用ALC后,与脊髓损伤组相比,ALC组微管相关蛋白1轻链3-Ⅱ蛋白表达也增加,表明脊髓损伤后细胞自噬被激活,应用ALC后可以进一步增强自噬水平。同时通过TUNEL免疫荧光发现,ALC组凋亡细胞较脊髓损伤组相比显著降低,表明ALC在增强自噬的同时也抑制细胞凋亡。 红景天苷(Salidroside,SAL)是从肉桂中提取的一种活性成分,具有抗氧化、抗细胞凋亡、神经保护等多种生物学活性[52]。研究发现,在脊髓损伤后,红景天苷可以通过抗氧化应激来减少活性氧的产生,从而降低线粒体的通透性和线粒体的损伤,还可以增强PINK1-Parkin信号通路,促进线粒体自噬来消除受损的线粒体。线粒体受损后,PINK1积聚在受损的线粒体外膜上,使胞质中的Parkin蛋白磷酸化,并促进其向线粒体转移,使线粒体膜蛋白泛素化,与自噬蛋白微管相关蛋白1轻链3-Ⅱ结合,诱导线粒体自噬[53]。 桦木酸(Betulinic acid,BA)是从桦木科树皮分离出来的一种天然化合物,具有抗病毒、抗炎和抗肿瘤活性等作用。近些年发现,桦木酸还有促进脊髓损伤后自噬及线粒体自噬表达等方面的作用,这为脊髓损伤的治疗提出了一个全新的方案。WU等[54]研究发现,桦木酸在脊髓损伤后显著提高了Bnip3、Nix和Parkin的水平,诱导线粒体自噬上调;此外,桦木酸减少了活性氧氧化产物的释放,包括8-OHdG、AOPP和丙二醛,抑制了细胞焦亡。桦木酸通过自噬的上游转录因子EB(TFEB)触发AMPK磷酸化,进而抑制mTOR,激活TFEB核转位,诱导自噬的发生[55];另一方面,还可以通过TRPML1通道促进Ca2+释放,进而激活钙调神经磷酸酶,促进TFEB核转位,诱导自噬的发生;桦木酸激活了AMPK-mTOR-TFEB信号通路,从而增强了脊髓损伤中的自噬[56],增加的自噬诱导线粒体自噬并减少活性氧积累,随后抑制细胞焦亡。最终,桦木酸的这些影响会改善脊髓损伤后的结果。 麦芽酚作为一种食品添加剂,广泛应用于食品、饮料、香精、烟草、日化用品等。麦芽酚具有抗氧化、降血脂、增强免疫等作用,近年来发现除以上作用外,还具有改善脊髓损伤的作用,作用机制可能与线粒体自噬的调节有关。典型的线粒体自噬激活途径有PINK1/Parkin通路。在线粒体损伤过程中,线粒体膜电位降低,PINK1积聚在外膜,促进Parkin的激活和易位,使受损线粒体膜上蛋白泛素化,与自噬相关蛋白结合后促使自噬体包裹受损线粒体[57]。MAO等[58]研究发现麦芽酚可以增强Nrf2信号通路,激活调节线粒体的膜电位活性和抗氧化防御,启动PINK1/Parkin通路显著促进线粒体自噬,同时促进抗氧化相关蛋白如血红素加氧酶1和超氧化物歧化酶2的表达,阻碍氧化应激信号和凋亡介导的神经元细胞死亡,改善脊髓损伤预后。 一些常见药物(如雷帕霉素、罗格列酮、乙酰左旋肉碱等)对线粒体自噬调控机制的研究已广泛深入,现又发现一些新的药物(如红景天苷、桦木酸、麦芽酚等)对线粒体自噬同样存在着调控作用,可能在不久的将来会成为治疗脊髓损伤的新型候选药物,见表2。"

| [1] ZBOGAR D, ENG JJ, MILLER WC, et al. Movement repetitions in physical and occupational therapy during spinal cord injury rehabilitation. Spinal Cord. 2017;55(2):172-179. [2] VENKATESH K, GHOSH SK, MULLICK M, et al. Spinal cord injury: pathophysiology, treatment strategies, associated challenges, and future implications. Cell Tissue Res. 2019;377(2):125-151. [3] HALL ED, WANG JA, BOSKEN JM, et al. Lipid peroxidation in brain or spinal cord mitochondria after injury. J Bioenerg Biomembr. 2016;48(2):169-174. [4] PLEMEL JR, KEOUGH MB, DUNCAN GJ, et al. Remyelination after spinal cord injury: is it a target for repair? Prog Neurobiol. 2014;117:54-72. [5] FAN B, WEI Z, XUE Y, et al. Microenvironment Imbalance of Spinal Cord Injury. Cell Transplant. 2018;27(6):853-866. [6] 贾志强,王岩松,李刚,等.急性脊髓损伤后线粒体形态结构与线粒体膜电位的变化[J]. 解放军医学院学报,2014,35(9):939-941,963. [7] WANG BY, HUANG MH, SHANG DH, et al. Mitochondrial Behavior in Axon Degeneration and Regeneration. Front Aging Neurosci. 2021;13:650038. [8] 周慧宇,崔帆,双卫兵.线粒体功能障碍在脊髓损伤疾病进展中的作用及机制研究[J].中国医学工程,2020,28(9):33-38. [9] RABCHEVSKY AG, MICHAEL FM, PATEL SP. Mitochondria focused neurotherapeutics for spinal cord injury. Exp Neurol. 2020;330:113332. [10] ZHAO Y, HUANG SH, LIU J, et al. Mitophagy Contributes to the Pathogenesis of Inflammatory Diseases. Inflammation. 2018;41(5):1590-1600. [11] LI HT, JIA ZQ, LI G, et al. Neuroprotective effects of exendin-4 in rat model of spinal cord injury via inhibiting mitochondrial apoptotic pathway. Int J Clin Exp Pathol. 2015;8(5):4837-4843. [12] ZHANG ZY, FAN ZK, CAO Y, et al. Acetyl-L-carnitineameliorates mitochondrial damage and apoptosis following spinal cord injury in rats. Neurosci Lett. 2015; 604:18-23. [13] BAUER TM, MURPHY E. Role of Mitochondrial Calcium and the Permeability Transition Pore in Regulating Cell Death. Circ Res. 2020;126(2):280-293. [14] SCHOLPA NE, SCHNELLMANN RG. Mitochondrial-Based Therapeutics for the Treatment of Spinal Cord Injury: Mitochondrial Biogenesis as a Potential Pharmacological Target. J Pharmacol Exp Ther. 2017;363(3):303-313. [15] ZHANG SJ, WEI Y, CHENG W, et al. Autophagy: A double-edged sword in intervertebral disk degeneration. Clin Chim Acta. 2016;457:27-35. [16] LIPINSKI MM, WU J, FADEN AI, et al. Function and Mechanisms of Autophagy in Brain and Spinal Cord Trauma. Antioxid Redox Signal. 2015; 23(6):565-577. [17] OHSUMI Y. Historical landmarks of autophagy research. Cell Res. 2014; 24(1):9-23. [18] DANCOURT J, MELIA TJ. Lipidation of the autophagy proteins LC3 and GABARAP is a membrane-curvature dependent process. Autophagy. 2014; 10(8):1470-1471. [19] FUJITA S, SAKURAI M, BABA H, et al. Autophagy-mediated stress response in motor neurons after hypothermic spinal cord ischemia in rabbits. J Vasc Surg. 2015;62(5):1312-1319. [20] LIU HY, DAI CQ, FAN YL, et al. From autophagy to mitophagy: the roles of P62 in neurodegenerative diseases. J Bioenerg Biomembr. 2017;49(5): 413-422. [21] LOU GF, PALIKARAS K, LAUTRUP S, et al. Mitophagy and Neuroprotection. Trends Mol Med. 2020;26(1):8-20. [22] NGUYEN TN, PADMAN BS, LAZAROU M. Deciphering the Molecular Signals of PINK1/Parkin Mitophagy. Trends Cell Biol. 2016;26(10):733-744. [23] GLADKOVA C, MASLEN SL, SKEHEL JM, et al. Mechanism of parkin activation by PINK1. Nature. 2018;559(7714):410-414. [24] 谢佳佳,孙婷,张丹参.线粒体自噬的调控机制及其在脑缺血再灌注损伤中的作用[J].神经药理学报,2021,11(3):43-49. [25] MAO S, TIAN SN, LUO XH, et al. Overexpression of PLK1 relieved the myocardial ischemia-reperfusion injury of rats through inducing the mitophagy and regulating the p-AMPK/FUNDC1 axis. Bioengineered. 2021; 12(1):2676-2687. [26] EIYAMA A, OKAMOTO K. PINK1/Parkin-mediated mitophagy in mammalian cells. Curr Opin Cell Biol. 2015;33:95-101. [27] OLSZEWSKA DA, FEARON C, LYNCH T. Ubiquitin is phosphorylated by PINK1 to activate parkin. Nature. 2014;510(7503):162-166. [28] ZHANG YJ, WU KL, XIAO XJ, et al. Autophagy as a regulatory component of erythropoiesis. Int J Mol Sci. 2015;16(2):4083-4094. [29] YUAN Y, ZHENG YR, ZHANG XN, et al. BNIP3L/NIX-mediated mitophagy protects against ischemic brain injury independent of PARK2.Autophagy. 2017;13(10):1754-1766. [30] ROGOV VV, SUZUKI H, MARINKOVIĆ M, et al. Phosphorylation of the mitochondrial autophagy receptor Nix enhances its interaction with LC3 proteins. Sci Rep. 2017;7(1):1131. [31] NIE PM, WANG HG, YU DT, et al. NIX Mediates Mitophagy in Spinal Cord Injury in Rats by Interacting with LC3. Cell Mol Neurobiol. 2022;42(6): 1983-1994. [32] KOENTJORO B, PARK JS, SUE CM. Nix restores mitophagy and mitochondrial function to protect against PINK1/Parkin-related Parkinson’s disease. Sci Rep. 2017;7:44373. [33] ZHENG YR, ZHANG XN, CHEN Z. Research progress on mechanism of Nix-mediated mitophagy. Zhejiang Da Xue Xue Bao Yi Xue Ban. 2017;46(1):92-96. [34] LIU L, LI YM, CHEN Q. The Emerging Role of FUNDC1-Mediated Mitophagy in Cardiovascular Diseases. Front Physiol. 2021;12:807654. [35] LIU L, FENG D, CHEN G, et al. Mitochondrial outer-membrane protein FUNDC1 mediates hypoxia-induced mitophagy in mammalian cells.Nat Cell Biol. 2012;14(2):177-185. [36] CHEN G, HAN Z, FENG D, et al. A regulatory signaling loop comprising the PGAM5 phosphatase and CK2 controls receptor-mediated mitophagy. Mol Cell. 2014;54(3):362-377. [37] WU H, XUE D, CHEN G, et al. The BCL2L1 and PGAM5 axis defines hypoxia-induced receptor-mediated mitophagy. Autophagy. 2014;10(10):1712-1725. [38] MA K, ZHANG Z, CHANG R, et al. Dynamic PGAM5 multimers dephosphorylate BCL-xL or FUNDC1 to regulate mitochondrial and cellular fate. Cell Death Differ. 2020;27(3):1036-1051. [39] CHEN M, CHEN ZH, WANG YY, et al.Mitophagy receptor FUNDC1 regulates mitochondrial dynamics and mitophagy.Autophagy. 2016;12(4):689-702. [40] CAMOUGRAND N, VIGIÉ P, GONZALEZ C, et al. The yeast mitophagy receptor Atg32 is ubiquitinated and degraded by the proteasome. PLoS One. 2020; 15(12):e0241576. [41] HUANG YF, GU CJ, WANG Q, et al.The protective effort of GPCR kinase 2–interacting protein-1 in neurons via promoting Beclin1-Parkin induced mitophagy at the early stage of spinal cord ischemia-reperfusion injury.FASEB J. 2020;34(2):2055-2074. [42] LIU K, YAN L, JIANG X, et al. Acquired inhibition of microRNA-124 protects against spinal cord ischemia-reperfusion injury partially through a mitophagy-dependent pathway.Thorac Cardiovasc Surg. 2017;154(5): 1498-1508. [43] YU DT, LI MF, NIE PM, et al. Bcl-2/E1B-19KD-Interacting Protein 3/Light Chain 3 Interaction Induces Mitophagy in Spinal Cord Injury in Rats Both In Vivo and In Vitro. J Neurotrauma. 2018;35(18):2183-2194. [44] LI XG, DU JH, LU Y, et al. Neuroprotective effects of rapamycin on spinal cord injury in rats by increasing autophagy and Akt signaling. Neural Regen Res. 2019;14(4):721-727. [45] LI Q, GAO S, KANG Z, et al. Rapamycin Enhances Mitophagy and Attenuates Apoptosis After Spinal Ischemia-Reperfusion Injury. Front Neurosci. 2018; 12:865. [46] ZHANG HY, WANG ZG, WU FZ, et al. Regulation of autophagy and ubiquitinated protein accumulation by bFGF promotes functional recovery and neural protection in a rat model of spinal cord injury. Mol Neurobiol. 2013;48(3):452-464. [47] ZHOU KL, ZHOU YF, WU K, et al. Stimulation of autophagy promotes functional recovery in diabetic rats with spinal cord injury. Sci Rep. 2015;5: 17130. [48] LI HP, ZHANG Q, YANG XH, et al. PPAR-γ agonist rosiglitazone reduces autophagy and promotes functional recovery in experimental traumaticspinal cord injury. Neurosci Lett. 2017;650:89-96. [49] MENG QQ, CHEN ZT, GAO QY, et al. Rosiglitazone Ameliorates Spinal Cord Injury via Inhibiting Mitophagy and Inflammation of Neural Stem Cells. Oxid Med Cell Longev. 2022;2022:5583512. [50] 崔佳,刘敏丽.乙酰左旋肉碱对脊髓损伤后线粒体的保护作用研究进展[J].陕西医学杂志,2021,50(3):374-376. [51] 孟庆峰,张明超,卢伟,等.乙酰左旋肉碱对急性脊髓损伤大鼠细胞自噬、凋亡及运动功能的影响[J].中国康复理论与实践,2016,22(7):754-758. [52] GU CJ, LI LW, HUANG YF, et al. Salidroside Ameliorates Mitochondria-Dependent Neuronal Apoptosis after Spinal Cord Ischemia-Reperfusion Injury Partially through Inhibiting Oxidative Stress and Promoting Mitophagy. Oxid Med Cell Longev. 2020;2020:3549704. [53] LAZAROU M, SLITER DA, KANE LA, et al. The ubiquitin kinase PINK1 recruits autophagy receptors to induce mitophagy. Nature. 2015;524(7565):309-314. [54] WU C, CHEN H, ZHUANG R, et al. Betulinic acid inhibits pyroptosis in spinal cord injury by augmenting autophagy via the AMPK-mTOR-TFEB signaling pathway. Int J Biol Sci. 2021;17(4):1138-1152. [55] YOUNG NP, KAMIREDDY A, NOSTRAND JV, et al. AMPK governs lineage specification through Tfeb-dependent regulation of lysosomes. Genes Dev. 2016;30(5):535-552. [56] ZHANG L, FANG Y, CHENG X, et al. TRPML1 Participates in the Progression of Alzheimer’s Disease by Regulating the PPARγ/AMPK/Mtor Signalling Pathway. Cell Physiol Biochem. 2017;43(6):2446-2456. [57] KANG TC. Nuclear Factor-Erythroid 2-Related Factor 2 (Nrf2) and Mitochondrial Dynamics/Mitophagy in Neurological Diseases.Antioxidants (Basel). 2020;9(7):617. [58] MAO YQ, DU JQ, CHEN XH, et al. Maltol Promotes Mitophagy and Inhibits Oxidative Stress via the Nrf2/PINK1/Parkin Pathway after Spinal Cord Injury. Oxid Med Cell Longev. 2022;2022:1337630. |
| [1] |
Song Jiating, Chen Jianmin, Wang Kewen, Huang Lanying, Xu Senming, Gui Yuchang, Xu Jianwen.
Metabolomics analysis of serum and urine in patients with traumatic spinal cord injury #br#
#br#
[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(在线): 1-6.
|
| [2] | Zhou Bangyu, Li Jie, Ruan Yushang, Geng Funeng, Li Shaobo. Effects of Periplaneta americana powder on motor function and autophagic protein Beclin-1 in rats undergoing spinal cord hemisection [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1223-1228. |
| [3] | Zeng Fanzhuo, Li Yuxin, Sun Jiachen, Gu Xinyang, Wen Shan, Tian He, Mei Xifan. Efficient strategies for microglia replacement in spinal cord injury models [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1007-1014. |
| [4] | Liu Qiwei, Zhang Junhui, Yang Yuan, Wang Jinjuan. Role and mechanism of umbilical cord mesenchymal stem cells on polycystic ovary syndrome [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1015-1020. |
| [5] | Sun Teng, Han Yu, Wang Shuang, Li Jialei, Cao Jimin. miR-20a regulates pressure overload-induced cardiac hypertrophy [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1021-1028. |
| [6] | Liu Tao, Zhang Wenkai, Ma Ziqian, Zhang Yan, Chen Xueming. Riluzole interferes with the activation of NLRP3 inflammasome in microglia of rats with spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1036-1042. |
| [7] | Mu Bingtao, Yu Jingwen, Liu Chunyun, Guo Minfang, Meng Tao, Yang Pengwei, Wei Wenyue, Song Lijuan, Yu Jiezhong, Ma Cungen. Immunomodulatory effect of astragaloside IV on T cells of experimental autoimmune encephalomyelitis mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1057-1062. |
| [8] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [9] | Zhuge Xiaoxuan, Li Ce, Bao Guangjie, Kang Hong. Potential value of canonical and non-canonical roles of connexin 43 in disease treatment [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1130-1136. |
| [10] | Chen Zepeng, Hou Yonghui, Chen Shudong, Hou Yu, Lin Dingkun. Tauroursodeoxycholic acid treats spinal cord injury by reducing apoptosis of spinal cord neurons under glucose and oxygen deprivation [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(4): 528-534. |
| [11] | Li Xiaorong, Zhong Jiawen, Luo Yuxue, Gao Ting, Qin Ling, Wang Xueyi. The molecular mechanism of Liuwei Dihuang Pill in the treatment of premature ovarian insufficiency in a mouse model [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(26): 4151-4157. |
| [12] | Tao Jingwei, Zhou Jingya, Zhao Yi, Ren Jingpei, Hu Chuanyu, Xu Lin, Mu Xiaohong, Fan Xiao. Effect and mechanism of tetramethylpyrazine regulating ferroptosis in rats with spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(26): 4158-4163. |
| [13] | Ji Weixiu, Bai Yi, Wang Shuo, Zhao Yungang. Protective effect and mechanism of 3-nitro-N-methyl salicylamide on the skeletal muscle of rats with limb ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(20): 3164-3169. |
| [14] | Long Zhisheng, Gong Feipeng, Wen Jiabin, Min Huan, Shu Yang, Lai Zhuoxi, Chen Gang. Bone marrow mesenchymal stem cell exosomes combined with epigallocatechin-3-gallate in treatment of spinal cord ischemia/reperfusion injury in rats [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(19): 2953-2959. |
| [15] | Xie Ting, Liu Tingting, Zeng Xuehui, Li Yamin, Zhou Panghu, Yi Nianhua. Vitamin D3 attenuates high-glucose exposure-induced oxidative stress to promote osteogenic differentiation of human umbilical cord mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(19): 2981-2987. |
| Viewed | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
Full text 2988
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Abstract 675
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||