中国组织工程研究 ›› 2025, Vol. 29 ›› Issue (19): 3968-3975.doi: 10.12307/2025.062
• 骨髓干细胞 bone marrow stem cells • 上一篇 下一篇
罗汉果苷V调控高糖状态巨噬细胞M1极化促进骨髓间充质干细胞的成骨分化
叶枝茂1,2,惠久莹1,2,钟晓霞1,2,麦昱颖1,2,李 昊1,2
- 1广西医科大学口腔医学院/附属口腔医院口腔修复科,广西壮族自治区南宁市 530021;2广西口腔颌面修复与重建研究重点实验室,广西壮族自治区南宁市 530021
Mogroside V promotes osteogenic differentiation of bone marrow mesenchymal stem cells by modulating M1 polarization of macrophages under high glucose condition
Ye Zhimao1, 2, Hui Jiuying1, 2, Zhong Xiaoxia1, 2, Mai Yuying1, 2, Li Hao1, 2
- 1Department of Prosthodontics, College of Stomatology, Guangxi Medical University/Affiliated Stomatological Hospital, Nanning 530021, Guangxi Zhuang Autonomous Region, China; 2Guangxi Key Laboratory of Oral and Maxillofacial Restoration and Reconstruction, Nanning 530021, Guangxi Zhuang Autonomous Region, China
摘要:
文题释义:
罗汉果苷Ⅴ:一种从罗汉果中提取的三萜皂苷,不仅是低热量的天然甜味剂,而且具有多种生物学功能,如降血糖、抗氧化、抗炎、促成骨等。因此,罗汉果苷Ⅴ在治疗糖尿病骨缺损方面具有重大潜力。M1型极化:在不同微环境下,巨噬细胞主要极化为两种表型,一是通过经典激活的M1型(促炎表型),二是通过替代激活的M2型(抗炎表型),两种表型的巨噬细胞相互平衡,抵御病原体以及促进组织愈合。
摘要
背景:糖尿病微环境会造成巨噬细胞过度M1极化,这种高糖炎症状态会抑制骨髓间充质干细胞的成骨分化,从而影响糖尿病骨缺损的愈合。研究表明罗汉果苷Ⅴ具有抗炎、抗氧化、降血糖的作用,但其能否调节高糖炎症状态下巨噬细胞M1极化及骨髓间充质干细胞的成骨分化尚不清楚。
目的:探讨罗汉果苷Ⅴ在高糖炎症状态下调节巨噬细胞M1型极化对骨髓间充质干细胞成骨分化的影响。
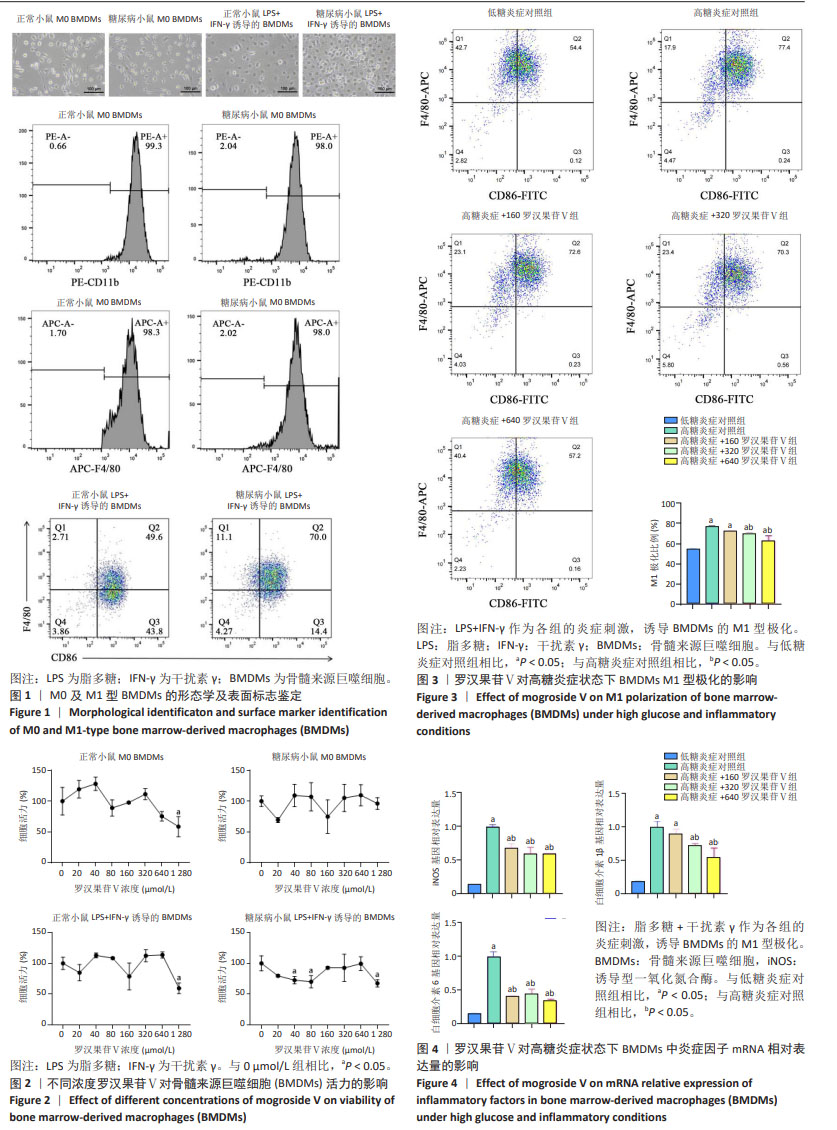
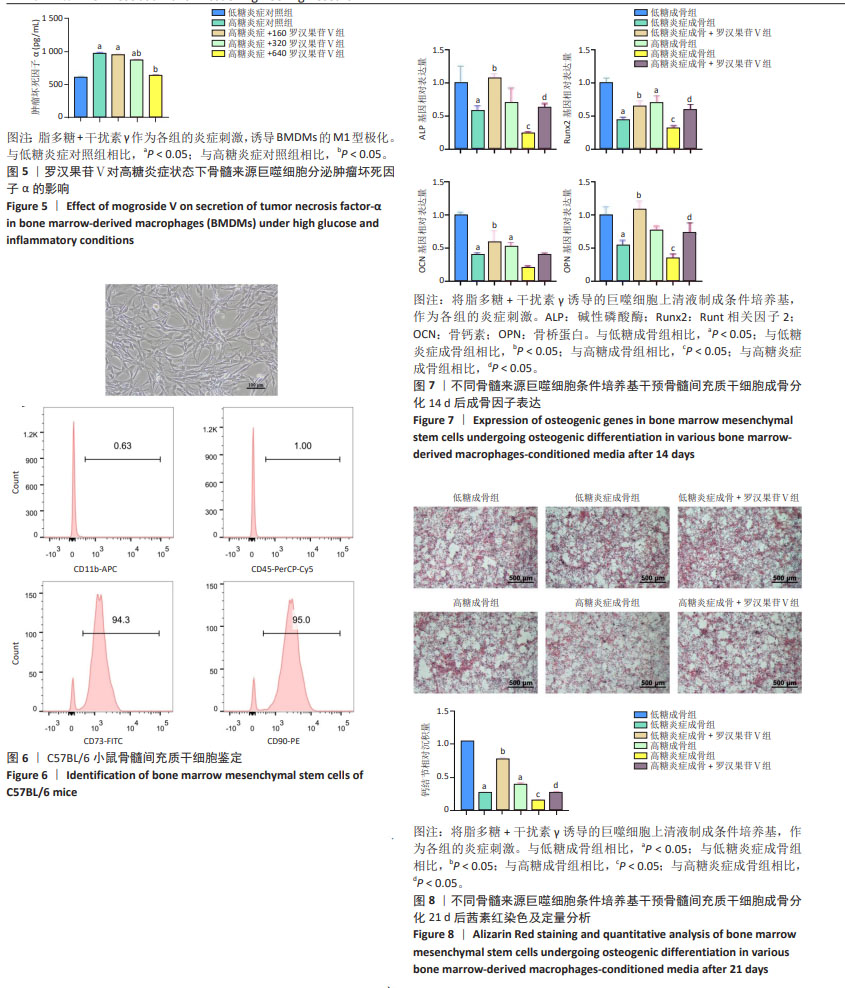
方法:构建糖尿病C57BL/6小鼠模型,从正常和糖尿病小鼠分离骨髓来源巨噬细胞,分别培养于低糖和高糖培养基。使用脂多糖和干扰素γ作为炎症刺激诱导骨髓来源巨噬细胞的M1型极化,同时以160,320,640 μmol/L 罗汉果苷Ⅴ干预,用流式细胞术检测F4/80+CD86+细胞比例,qRT-PCR检测诱导型一氧化氮合酶、白细胞介素1β、白细胞介素6的mRNA表达水平,ELISA检测骨髓来源巨噬细胞上清液中肿瘤坏死因子α水平。分离C57BL/6小鼠骨髓间充质干细胞,分别使用低糖或高糖成骨诱导液诱导成骨分化,添加M1型巨噬细胞条件培养基作为炎症刺激,以及320 μmol/L罗汉果苷Ⅴ干预,成骨诱导14 d后采用qRT-PCR 检测碱性磷酸酶、Runt相关因子2、骨钙素、骨桥蛋白的mRNA表达水平,成骨诱导21 d后进行茜素红染色及定量分析。
结果与结论:①流式细胞术结果显示320,640 μmol/L罗汉果苷Ⅴ组的F4/80+CD86+细胞比例明显低于高糖炎症对照组(P < 0.05);②qRT-PCR结果显示160,320,640 μmol/L 罗汉果苷Ⅴ组的诱导型一氧化氮合酶、白细胞介素6的mRNA相对表达量较高糖炎症对照组显著降低(P < 0.05),320,640 μmol/L罗汉果苷Ⅴ组白细胞介素1β的mRNA相对表达量较高糖炎症对照组显著降低(P < 0.05);③ELISA结果显示160,320,640 μmol/L罗汉果苷Ⅴ组的肿瘤坏死因子α分泌水平较高糖炎症对照组显著降低(P < 0.05);④320 μmol/L罗汉果苷Ⅴ干预后,高糖炎症状态下骨髓间充质干细胞的钙盐沉积增加(P < 0.05),且碱性磷酸酶、Runt相关因子2和骨桥蛋白的mRNA相对表达量增加(P < 0.05)。结果表明,罗汉果苷Ⅴ可通过抑制高糖炎症状态下骨髓来源巨噬细胞的M1型极化及炎症因子表达,促进骨髓间充质干细胞的成骨分化。
https://orcid.org/0000-0001-8208-6255 (叶枝茂)
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程
中图分类号: