1.1 设计 细胞学实验,多组间分析采用单因素方差分析,两组间比较采用t检验。
1.2 时间及地点 实验于2021年3月至2023年4月在湖南省长沙市第三医院中心实验室完成。
1.3 材料
1.3.1 实验动物 4周龄健康雌性SD大鼠10只,体质量(80.25±7.56) g,购自长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2019-0014。将大鼠饲养在室内温度20-26 ℃、日温差≤4 ℃、相对湿度40%-70%的SPF级动物房中。实验方案已通过湖南省长沙市第三医院伦理委员会批准,审批号为:2022-028。
1.3.2 主要试剂 L-DMEM培养基、胎牛血清、胰蛋白酶购自美国Gibco公司;大鼠骨髓间充质干细胞成骨诱导分化试剂盒、大鼠骨髓间充质干细胞成脂诱导分化试剂盒购自广州赛业生物科技有限公司;H2O2溶液购自上海麦克林生化科技股份有限公司;Lipofectamine 2000、Opti-MEM培养基购自美国Thermo公司;细胞衰老β-半乳糖苷酶染色试剂盒、SYBR Green One-Step qRT-PCR试剂盒购自上海碧云天生物技术有限公司;miR-212-3p抑制物(inhibitor)及其对照抑制物(inhibitor NC)、miR-212-3p模拟物(mimic)及其对照模拟物(mimic NC)、丝裂原激活蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)干扰质粒(si-MAPK3)及其阴性对照(si-NC)质粒均由上海汉恒生物科技有限公司提供;双荧光素酶报告基因检测试剂盒购自北京索莱宝科技有限公司;反转录系统试剂盒、SYBR Premix Ex Tag试剂盒购自日本Takara公司;CD90抗体、CD44抗体、CD45抗体和CD31抗体购自美国BioLegend公司;p16抗体、p21抗体、MAPK3抗体、GAPDH抗体和HRP酶标记的山羊抗兔IgG二抗购自美国Affinity公司。
1.3.3 主要仪器 倒置显微镜(XD-202)购自南京江南永新光学有限公司;流式细胞仪(Accuri C6)购自美国BD公司;多功能酶标仪(HH34000000)购自美国Perkinelmer公司;荧光定量PCR仪(ABI 7300)购自美国Thermo公司;化学发光成像系统(ChemiDoc Touch)购自美国Bio-Rad公司。
1.4 方法
1.4.1 骨髓间充质干细胞的分离、培养和鉴定 参考杨春丽等[10]研究中的方法分离培养大鼠骨髓间充质干细胞。取SD大鼠,腹腔注射2%戊巴比妥钠(3 mL/kg)麻醉后处死,取出后肢股骨和胫骨,仔细剔除表面肌肉组织,用1 mL注射器吸取含体积分数10%胎牛血清的L-DMEM培养基(完全培养基)反复冲洗骨髓腔,收集细胞悬液,调整细胞浓度至1×1010 L-1,接种至培养瓶中。24 h后更换新鲜培养基,后每两三天换液1次。待细胞融合度生长至90%以上时,使用胰蛋白酶进行消化传代处理,收集第3代(P3)细胞,采用流式细胞术检测细胞表面抗原(CD90、CD44、CD45和CD31)。
茜素红染色检测细胞成骨分化能力:收集P3代处于对数期的骨髓间充质干细胞,以5×104/孔的密度接种至12孔板中,置于培养箱中培养。待细胞融合度90%以上时,更换为2 mL成骨诱导培养液,每两三天换液1次。诱导培养21 d后,弃培养基,用PBS洗3次,加入体积分数95%乙醇室温固定10 min,用PBS洗3次,加入茜素红染色液37 ℃孵育30 min,蒸馏水洗3次,显微镜下观察并拍照。
油红O染色检测细胞成脂分化能力:收集P3代处于对数期的骨髓间充质干细胞,以5×104/孔的密度接种至12孔板中,置于培养箱中培养。待细胞融合度90%以上时,更换为2 mL成脂诱导培养液,每两三天换液1次。诱导培养14 d后,弃培养基,40 g/L多聚甲醛室温固定10 min,用PBS洗1次,加入染色洗涤液孵育20 s,加入油红O染色液室温孵育20 min,加入染色洗涤液静置30 s,用PBS清洗3次,显微镜下观察并拍照。

1.4.2 建立骨髓间充质干细胞衰老模型 收集P3代处于对数期的骨髓间充质干细胞,以1×105/孔的密度接种至6孔板中,置于培养箱中过夜后分组干预:对照组更换为新的完全培养基培养,模型组更换为含400 μmol/L H2O2的完全培养基培养[11]。干预72 h后,检测各组细胞中β-半乳糖苷酶活性,miR-212-3p和 MAPK3 mRNA表达,MAPK3、p16和p21蛋白表达。每组设置3个重复。
β-半乳糖苷酶染色:干预72 h后取出培养板,弃培养基,加入0.5 mL β-半乳糖苷酶染色固定液室温固定15 min,用PBS洗3次,每孔加入0.5 mL染色工作液37 ℃孵育过夜,显微镜下观察并拍照,记录阳性细胞数。
qRT-PCR检测方法:干预72 h后,收集各组细胞,加入TRIzol裂解液提取细胞中RNA,采用SYBR Green One-Step qRT-PCR试剂盒检测miR-212-3p表达,采用SYBR Premix Ex Tag试剂盒检测MAPK3 mRNA表达。分别以U6和GAPDH为内参,采用2-ΔΔCt计算miR-212-3p和MAPK3 mRNA表达,PCR反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,30个循环,引物序列见表1。

Western blot检测方法: 干预72 h后,收集各组细胞,加入裂解液提取细胞中总蛋白,使用BCA蛋白检测试剂盒测定蛋白浓度,取40 μg蛋白上样,经电泳、转膜和封闭处理后,加入5%脱脂牛奶封闭1 h,分别加入p16抗体(1∶1 000)、p21抗体(1∶1 000)、MAPK3抗体(1∶1 000)和GAPDH抗体(1∶5 000)4 ℃孵育过夜,加入HRP酶标记的二抗(1∶2 000)室温孵育1 h,滴加显影液曝光显影。使用Image J软件分析蛋白条带灰度值,计算目的蛋白表达。目的蛋白表达=目的蛋白条带灰度值/GAPDH条带灰度值。
1.4.3 miR-212-3p抑制物对骨髓间充质干细胞中miR-212-3p的抑制作用 收集P3代处于对数期的骨髓间充质干细胞,以1×105/孔的密度接种至6孔板中,置于培养箱中过夜后分组干预:对照组更换为新的完全培养基培养,抑制物对照组转染对照抑制物,miR-212-3p抑制物组转染miR-212-3p抑制物。转染24 h后,采用qRT-PCR检测细胞中miR-212-3p、MAPK3 mRNA与蛋白表达,检测方法同1.4.2。每组设置3个重复。
1.4.4 分析miR-212-3p靶向基因 收集P3代处于对数期的骨髓间充质干细胞,以1×105/孔的密度接种至6孔板中,置于培养箱中过夜后分组干预:对照模拟物+野生型MAPK3组共转染对照模拟物和野生型MAPK3报告质粒,对照模拟物+突变型MAPK3组共转染对照模拟物和突变型MAPK3报告质粒,miR-212-3p模拟物+野生型MAPK3组共转染miR-212-3p模拟物和野生型MAPK3报告质粒,miR-212-3p模拟物+突变型MAPK3组共转染miR-212-3p模拟物和突变型MAPK3报告质粒。每组设置3个重复。转染48 h后,采用TargetScanHuman 7.1在线数据库预测miR-212-3p与MAPK3基因3’-UTR区域结合位点,将野生型(WT)和突变型(MT)MAPK3序列分别构建入pmiRGlo载体中,在骨髓间充质干细胞中验证miR-212-3p与MAPK3的靶向调控关系。
转染方法:使用Lipofectamine 2000联合Opti-MEM培养基将MAPK3野生型(WT-MAPK3)或突变型(MT-MAPK3)报告质粒与miR-212-3p mimic或mimic NC共转染48 h后,按照双荧光素酶报告系统说明书进行检测,采用多功能酶标仪检测荧光素酶荧光强度。荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性。
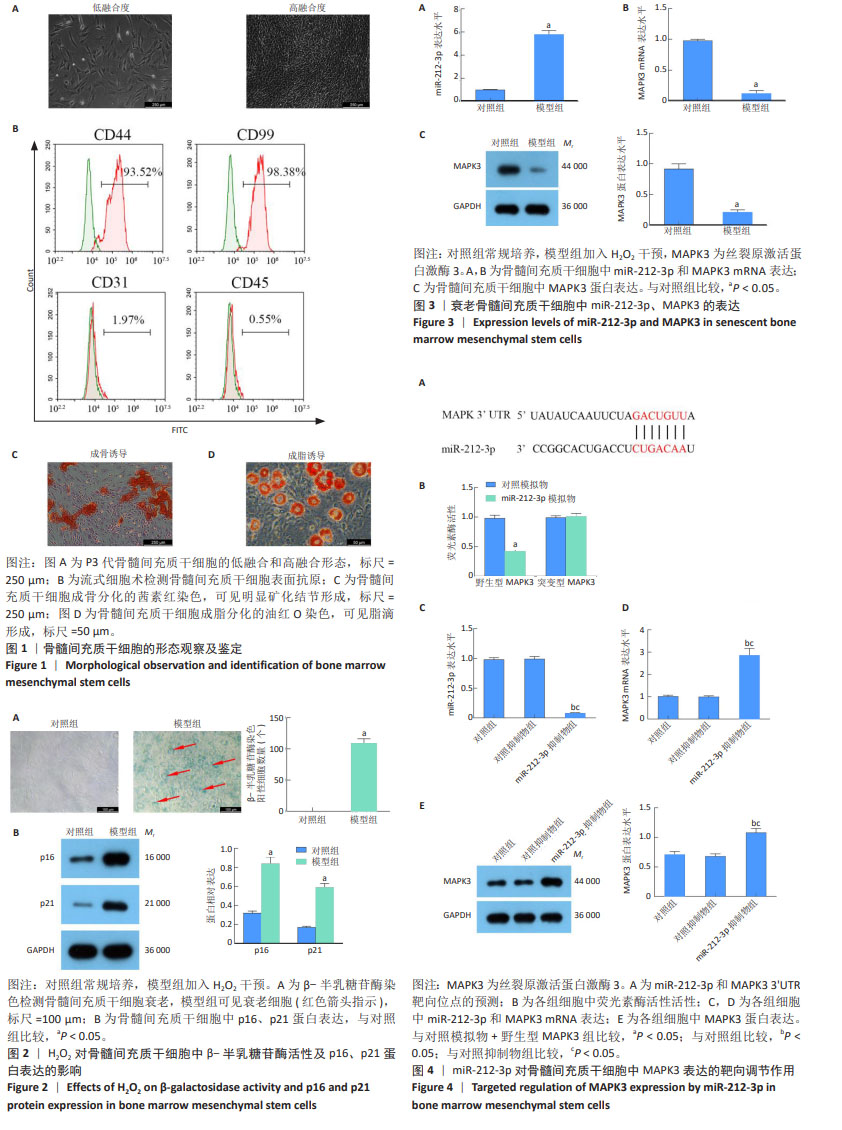
1.4.5 miR-212-3p抑制物和MAPK3干扰质粒共转染对骨髓间充质干细胞及其衰老的影响 收集P3代处于对数期的骨髓间充质干细胞,以1×105/孔的密度接种至6孔板中,置于培养箱中过夜后分组干预:对照抑制物组转染对照抑制物,miR-212-3p抑制物组转染miR-212-3p抑制物,miR-212-3p抑制物+干扰对照组共转染miR-212-3p抑制物+干扰对照质粒,miR-212-3p抑制物+ MAPK3干扰组共转染miR-212-3p抑制物和MAPK3干扰质粒。转染24 h后,检测细胞中MAPK蛋白与mRNA表达,检测方法同1.4.2。
收集P3代处于对数期的骨髓间充质干细胞,以1×105/孔的密度接种至6孔板中,置于培养箱中过夜后分组干预:对照组更换为新的完全培养基培养72 h,H2O2组加入含400 μmol/L H2O2的完全培养基培养72 h,H2O2+对照抑制物组转染对照抑制物24 h后加入含400 μmol/L H2O2的完全培养基培养72 h,H2O2+miR-212-3p抑制物组转染miR-212-3p抑制物24 h后加入含400 μmol/L H2O2的完全培养基培养72 h,H2O2+miR-212-3p抑制物+干扰对照组同时转染miR-212-3p抑制物和干扰对照4 h后加入含400 μmol/L H2O2的完全培养基培养72 h,H2O2+miR-212-3p抑制物+MAPK3干扰组同时转染miR-212-3p抑制物与MAPK3干扰质粒后含400 μmol/L H2O2的完全培养基培养72 h。每组设置3个重复。干预结束后,检测各组细胞中β-半乳糖苷酶活性及p16、p21蛋白表达,检测方法同1.4.2。
1.5 主要观察指标 各组骨髓间充质干细胞的β-半乳糖苷酶活性、miR-212-3p和MAPK3 mRNA表达以及p16、p21和MAPK3蛋白表达。
1.6 统计学分析 通过SPSS 25.0统计软件进行数据整理分析,实验结果以x±s表示。多组间分析采用单因素方差分析,两组间比较采用t检验。以P < 0.05为差异有显著性意义。该文统计学方法已经湖南省长沙市第三医院生物统计学专家审核。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程