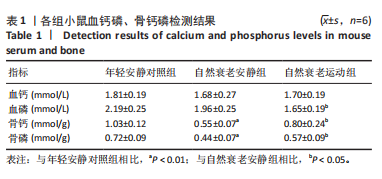
3.1 长期耐力运动对自然衰老小鼠钙磷代谢的影响 此次研究结果显示,自然衰老安静组小鼠与年轻安静对照组相比血钙和血磷值并没有显著性差异(P > 0.05),作者认为这可能是因为自然衰老安静组小鼠有骨质疏松的趋势,骨吸收大于骨形成,骨骼中的钙磷被分解进入血液,以维持正常的血钙和血磷平衡;另外,Klotho蛋白的降低会诱导骨吸收增强,进一步加剧了骨钙磷的释放[6]。为了验证这一假设,于是进一步检查了小鼠股骨中的钙磷含量,发现自然衰老安静组小鼠的骨钙和骨磷含量明显低于年轻安静对照组(P < 0.01),表明自然衰老安静组小鼠骨矿物质减少,可能发生了骨质疏松,骨中钙磷被分解进入血液。
研究表明,血磷含量过高或过低均会影响机体健康,高血磷会导致机体严重的骨质疏松症和继发性甲状旁腺功能亢进,而低血磷则会导致骨软化症[7-8]。血磷还会影响机体葡萄糖代谢和氧化应激,高血磷会抑制糖异生过程,促进糖酵解,并且提高了活性氧的生成,加剧衰老的发生与发展[9]。一项对正常血磷水平冠心病患者的研究发现,血磷水平高(≥1.29 mmol/L,1 mg/dL=0.322 9 mmol/L)的患者死亡率比血磷水平低(< 0.81 mmol/L)的患者高约70%,而适当降低血磷水平可以延长寿命[10]。可见,磷酸盐代谢紊乱会严重影响老年的生命健康,适当降低血磷不仅可以延缓衰老,而且有利于老年人生活质量的提高。此次研究结果显示,经过长期耐力运动后,自然衰老运动组小鼠骨钙和骨磷含量都显著增加(P < 0.05),表明长期耐力运动对骨代谢产生了有益的作用,促进了骨骼的矿化,提高了骨密度。长期耐力运动增加衰老小鼠骨钙和骨磷可能是由以下原因导致的:①长期耐力运动抑制了骨吸收的发生,减少破骨细胞的生成并促进其向成骨细胞的转化;②长期耐力运动提高了成骨细胞的增殖,增加了其活性,促进了骨形成的发生。
总之,长期耐力运动可以调节自然衰老小鼠钙磷代谢,尤其是磷酸盐代谢,降低衰老小鼠血磷的含量,并提高衰老小鼠骨钙和骨磷的含量,这有助于促进骨骼的矿化,增加骨密度。
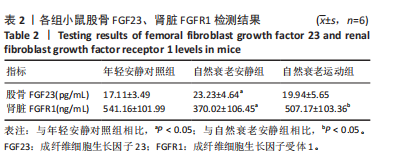
3.2 长期耐力运动对自然衰老小鼠骨中FGF23、肾脏Klotho和FGFR1表达的影响 研究发现,FGF23过表达或者低表达都会影响机体健康,FGF23过高通常会导致低磷酸盐血症和软骨病,而低水平的FGF23会造成1, 25(OH)2 D3增加和高磷血症[11]。在机体中,FGF23与其受体的结合能力较低,需要Klotho蛋白将FGFRs转化为FGF23特异性受体,形成kl/FGFR1复合物,再与FGF23结合发挥作用。研究发现,敲除FGF23后,小鼠会出现血钙磷和1, 25(OH)2 D3的增加,同样结果在敲除Klotho的小鼠中也被观察到,表明二者共同维持了钙磷代谢的平衡,缺一不可[12]。
此次研究结果显示,与年轻安静对照组相比,自然衰老安静组小鼠股骨FGF23的含量增加(P < 0.05)。这可能是因为衰老导致Klotho蛋白的降低诱导FGF23的增加。FGF23主要由骨细胞产生,被认为是调节磷酸盐稳态的主要激素,当机体血磷增加时,会刺激骨细胞产生FGF23增多,通过抑制肾脏重吸收和减少1, 25(OH)2 D3的表达来降低血磷[13]。研究表明,老年慢性肾病患者FGF23表达增高通常先于血磷的增高,提示在肾病早期阶段机体已经开始对磷酸盐进行调节[14]。另外,高FGF23还参与了多种疾病的发生与发展 ,包括促进左心室肥大、诱导肝炎、抑制矿化等[15]。事实上,FGF23水平的增高预测了各种疾病的死亡及死亡率[16]。可见,抑制FGF23的增加对于老年人群是十分必要的。但此次研究发现经过长期耐力运动后小鼠股骨FGF23没有发生明显变化,自然衰老运动组与自然衰老安静组相比虽然有所降低,但没有统计学意义(P > 0.05)。作者认为这可能是小鼠对运动产生了适应,虽然FGF23没有发生变化,但机体在运动后整体趋向良好方面[17]。
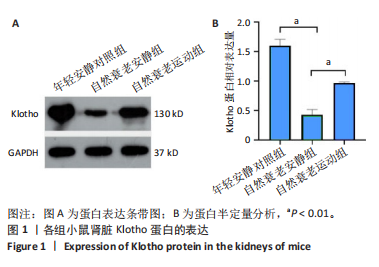
Klotho蛋白的一个重要功能是将FGF受体转化为FGF23特异性受体,通过kl/FGF23轴参与机体钙磷代谢的调节。李洪波[18]的研究发现,衰老大鼠肾脏Klotho蛋白明显降低,同时出现了钙磷代谢的紊乱;LIM等[19]的研究也发现Klotho蛋白的含量在衰老小鼠肾脏组织中的表达会降低,此次研究与前人研究结果相同。另外,此次研究结果显示,长期耐力运动可以提高衰老小鼠肾脏Klotho蛋白的表达。目前,关于运动和Klotho蛋白的研究较多,且几乎所有的研究都表明运动可以提高Klotho蛋白的表达,但仍存在一些未解决的问题[20-22]。首先没有直接的证据表明运动改善某些年龄相关疾病与提高Klotho蛋白有关,只是分析了两者之间的相关性,而且运动方式、强度、频率、时间等对Klotho蛋白的影响仍需进一步研究;其次,尚未有文献报道运动提高Klotho蛋白的可能机制和涉及到的信号通路有哪些,期待将来有研究对这一问题做出解释。
FGF23对磷酸盐的调节主要是与FGFR1相结合,敲除FGFR1基因,小鼠会出现FGF23抵抗[23]。在机体中,当血磷增加时,会激活FGFR1及其下游细胞内信号传导通路并调控GALNT3基因的表达,通过GalNAc3-T3(GALNT3基因的产物)对FGF23蛋白进行翻译后修饰,从而降低血磷[24-25]。此次研究结果显示,随着年龄的增加肾脏FGFR1蛋白表达降低,这可能是因为老年鼠肾脏发生了损伤,功能减退。另外,不同部位FGFR1对钙磷调节不同,特异性敲除近端小管FGFR1会导致高磷血症和FGF23表达增加,而敲除远端小管FGFR1则会引起高钙血症和甲状旁腺激素升高[26]。因此,FGFR1具有直接调节近端小管和远端小管对磷酸盐和钙重吸收的双重功能,表明FGFR1信号通路在维持钙磷代谢稳态中起着重要的作用。此次研究结果显示,经过长期耐力运动后肾脏FGFR1表达增加(P < 0.05),这对于维持机体磷酸盐稳态具有良好的调控。MUNOZ-CASTANEDA等[27]发现,在尿毒症大鼠中,肾脏Klotho和FGFR1表达降低,同时FGF23表达增加,观察到钙磷代谢出现紊乱,通过改善肾脏功能,不仅提高了尿毒症大鼠肾脏Klotho和FGFR1的表达,而且纠正了大鼠钙磷代谢紊乱。詹理睿[28]的研究也发现在糖尿病大鼠中,肾脏Klotho和FGFR1表达降低,通过改善肾脏功能不仅可以提高二者的表达,而且缓解了糖尿病大鼠钙磷代谢异常。可见,此次研究FGFR1的表达增加可能与长期耐力运动改善衰老小鼠肾脏功能有关。
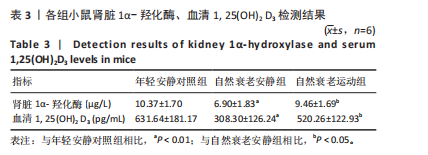
3.3 长期耐力运动对自然衰老对肾脏1α-羟化酶和血清1, 25(OH)2 D3表达的影响 1, 25(OH)2 D3主要由25-羟维生素D3经1α-羟化酶催化产生,具有多种生物学功能,包括调节钙磷代谢,控制骨细胞分化和调节免疫反应等。在机体中,1, 25(OH)2 D3通过激活维生素D受体促进肠道对钙磷的吸收和肾脏对钙的重吸收,并通过骨钙的释放提高血钙磷的浓度。值得注意的是,1, 25(OH)2 D3促进骨骼的矿化主要途径是增强肠道对钙和磷的吸收,通过维持足够的钙磷酸盐产物在胶原基质中结晶,从而导致骨的被动矿化。在kl/FGF23轴中,FGF23调节1, 25(OH)2 D3主要表现在两个方面:①调控CYP24B1基因,抑制1α-羟化酶的表达,减少1, 25(OH)2 D3的生成;②调控基因CYP24A1,诱导24-羟化酶的表达,催化25(OH)2 D3和1, 25(OH)2 D3生成24,25二羟维生素D3[24,25(OH)2 D3]和1,24,25羟基维生素D3[1,24,25(OH)2 D3],降低体内1, 25(OH)2 D3的水平[29-30]。
此次研究结果显示,随着年龄的增加,肾脏1α-羟化酶表达降低,表明肾脏1α-羟化酶受年龄因素的影响。ANDERSON等[31]对比了不同周龄大鼠肾脏1α-羟化酶和24-羟化酶的含量,发现随着年龄的增加,1α-羟化酶表达降低而24-羟化酶表达增加。1α-羟化酶集中表达于肾脏,虽然其他部位如内分泌腺、骨骼、上皮组织等也存在表达,但研究证实循环性的1, 25(OH)2 D3主要由肾脏部位1α-羟化酶催化产生[32]。 所以,肾脏发生衰老和损伤会引起1α-羟化酶表达的减少,进而导致1, 25(OH)2 D3水平的降低。另外,此次研究显示衰老小鼠FGF23表达增加,而FGF23的增加会抑制1α-羟化酶的表达,这也会导致衰老小鼠肾脏1α-羟化酶表达的减少。1α-羟化酶在维生素D3的代谢中起着核心作用,1α-羟化酶的缺乏不仅会导致1, 25(OH)2 D3水平的降低,而且会造成低血钙、甲状旁腺功能亢进、生长迟缓以及骨代谢异常等症状。肾脏1α-羟化酶表达于近端小管和远端小管,研究发现在慢性肾病中,1α-羟化酶表达常常降低,同时血清1, 25(OH)2 D3的水平也降低。通过改善肾脏功能,不仅可以提高肾脏1α-羟化酶的表达,而且提高了血清1, 25(OH)2 D3的水平[33-34]。此次研究结果发现长期耐力运动可以提高衰老小鼠肾脏1α-羟化酶的表达(P > 0.05),这可能是因为长期耐力运动改善了衰老小鼠肾功能;另外,在kl/FGF23轴中,高FGF23会抑制肾脏1α-羟化酶的表达,结果亦表明长期耐力运动调节了kl/FGF23轴,降低了FGF23对1α-羟化酶的抑制作用,这也可能是长期耐力运动后肾脏1α-羟化酶表达增加的原因。
肾脏是调节1, 25(OH)2 D3生成的重要器官,多数研究表明,随着年龄的增加,肾脏发生损伤,功能下降,同时伴随着1, 25(OH)2 D3生成的减少[35-36]。大鼠研究发现,随着年龄的增加,1α-羟化酶表达降低而24-羟化酶表达增加,这可能是1, 25(OH)2 D3随年龄逐渐降低的主要原因,此次研究结果亦发现肾脏1α-羟化酶在老年组中表达降低[31]。1, 25(OH)2 D3的不足会增加多种疾病的发生率,包括癌症、肌无力、糖尿病、高血压、心血管疾病等。外源性补充1, 25(OH)2 D3不仅可以延缓衰老,而且可以改善衰老相关症状[37-38]。此次研究结果显示,长期耐力运动可以提高衰老小鼠血清1, 25(OH)2 D3的水平,表明长期耐力运动可以调节维生素D代谢;1, 25(OH)2 D3主要由25(OH)2 D3经1α-羟化酶催化产生,结果显示长期耐力运动提高了衰老小鼠肾脏1α-羟化酶的表达,所以这可能是运动后衰老小鼠血清1, 25(OH)2 D3水平提高的原因。
结论:长期耐力运动可以通过kl/FGF23轴,对Klotho蛋白和FGF23进行调节,从而影响1α-羟化酶的表达及1, 25(OH)2 D3的水平,进而调节机体的钙磷代谢,尤其是磷酸盐代谢,表明长期耐力运动可以通过 kl/FGF23轴延缓机体自然衰老。
此次实验还存在一定的局限性:运动干预方案相对单一,仅设置了一种运动强度和频率,难以全面评估不同运动参数对研究指标的影响,后期将增加多种运动方式。以期未来的临床研究可以在此基础上,开展针对不同运动方式对自然衰老影响的相关研究,优化运动方案,为抗衰老实践研究提供更具针对性的指导。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程