Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (6): 1476-1485.doi: 10.12307/2026.577
Previous Articles Next Articles
Mitogen-activated protein kinase signaling pathway regulates the development of osteoarthritis: guiding targeted therapy with traditional Chinese medicine
Li Hao1, Tao Hongcheng1, Zeng Ping2, Liu Jinfu2, Ding Qiang1, Niu Chicheng1, Huang Kai1, Kang Hongyu1
- 1Guangxi University of Chinese Medicine, Nanning 530200, Guangxi Zhuang Autonomous Region, China; 2The First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530023, Guangxi Zhuang Autonomous Region, China
-
Received:2024-12-02Accepted:2025-03-05Online:2026-02-28Published:2025-07-17 -
Contact:Zeng Ping, PhD, Chief physician, The First Affiliated Hospital of Guangxi University of Chinese Medicine, Nanning 530023, Guangxi Zhuang Autonomous Region, China -
About author:Li Hao, MS candidate, Physician, Guangxi University of Chinese Medicine, Nanning 530200, Guangxi Zhuang Autonomous Region, China -
Supported by:National Natural Science Foundation of China, No. 82160913 (to ZP); Guangxi Postgraduate Education Innovation Program Project (Master’s District Level), No. YCSW202446 (to LH [project participant])
CLC Number:
Cite this article
Li Hao, Tao Hongcheng, Zeng Ping, Liu Jinfu, Ding Qiang, Niu Chicheng, Huang Kai, Kang Hongyu. Mitogen-activated protein kinase signaling pathway regulates the development of osteoarthritis: guiding targeted therapy with traditional Chinese medicine[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1476-1485.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
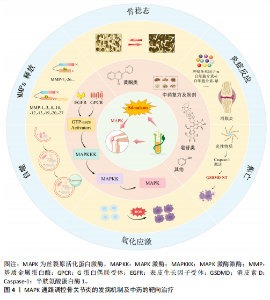
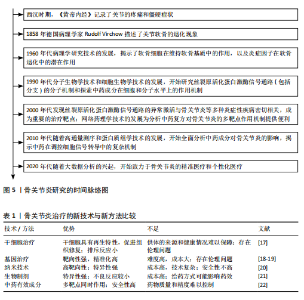
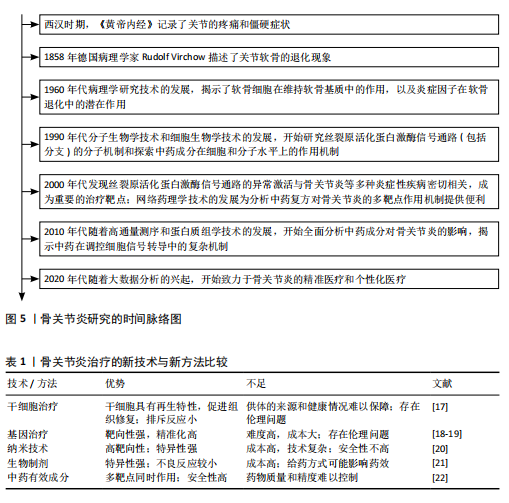
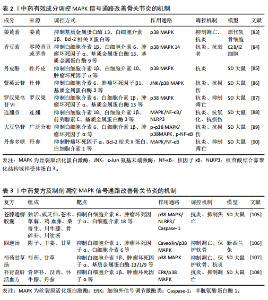
2.1 MAPK 信号通路 MAPK信号通路是一种在真核细胞内广泛存在的丝/苏氨酸蛋白激酶,对调控细胞增殖、分化、凋亡和应激反应等多种细胞过程均有重要作用。有实验研究发现,抑制MAPK通路可以保护软骨细胞以抗骨关节炎[13]。MAPK 通路主要包含3种激酶,即MAPK激酶激酶、MAPK激酶和MAPK,它们可以激活下游蛋白并使其磷酸化[14],而下游蛋白的磷酸化也是MAPK信号通路介导炎症反应的重要标志[15]。MAPK家族主要由细胞外信号调节激酶类(extracellular signal-regulated MAP kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinas,JNK)和p38 MAPK等成员组成,MAPK信号通路在接受细胞内外的刺激后,经多级酶促反应而被激活,激活后的MAPK参与调控基因转录和蛋白质合成,进而影响肿瘤坏死因子α、白细胞介素1β、白细胞介素6等炎症因子的释放[16]。另外,MAPK(包括ERK、JNK和p38 MAPK)已被证实参与骨关节炎的发病机制(图4)。因此,它有望成为治疗骨关节炎的潜在有效靶点。 2.2 MAPK信号通路调控骨关节炎研究的时间历程 1858年德国病理学家RUDOLF VIRCHOW揭示了骨关节炎中关节软骨细胞退化现象。1960年代随着病理学技术的发展,揭示了软骨细胞及炎症因子在骨关节炎发病中的作用。1990年代随着分子生物学技术和细胞生物学技术的进步,开始深入探究MAPK信号通路及其分支的分子机制,并着手研究中药成分在细胞和分子层面的作用方式。此后,对于MAPK信号通路、骨关节炎和中药的研究不断深入,并取得了一定的成果(图5)。 2.3 骨关节炎治疗的新技术与新方法比较 随着医疗科技水平的不断提高,针对骨关节炎的新技术与新方法不断提出,为骨关节炎的治疗方案提供了新的方向。但同时受限于时代等多方面的局限性,不同的方法与技术具有各自的优势与不足[17-22],见表1。 2.4 MAPK信号通路在骨关节炎中的作用 2.4.1 调控软骨细胞和基质金属蛋白酶的表达 骨关节炎的进展会导致关节软骨的退行性改变,同时也会使软骨及关节周围肌肉发生损害[23]。软骨细胞是关节软骨中唯一的细胞种类,占总体积的 2%-5%,剩余部分由胶原蛋白(主要是Ⅱ型)和蛋白多糖(重要的是聚集蛋白聚糖)的水合细胞外基质组成[24]。软骨细胞在胚胎发生过程中就对软骨生长发挥影响,并对维持软骨的完整性终生发挥作用[25]。软骨细胞通过修复基质的轻微或急性损伤来维持软骨的完整性,而软骨的损伤是由基质金属蛋白酶引起组织内蛋白酶活性过剩造成的[11]。其中基质金属蛋白酶1、基质金属蛋白酶3、基质金属蛋白酶13被认为是加速骨关节炎细胞外基质病理性降解的主要蛋白酶,而MAPK信号通路的失调会导致大量基质金属蛋白酶的释放,软骨变性加重,加重骨关节炎[26]。研究发现,当MAPK信号通路表达被抑制时,会降低滑膜白细胞介素1、白细胞介素6等炎症因子和氧化应激水平,抑制基质金属蛋白酶的表达,从而减轻骨关节炎炎症和软骨损伤[27]。动物实验进一步证实,抑制MAPK信号通路可以维持软骨稳态[28]。综上所述,抑制MAPK信号通路介导基质金属蛋白酶的释放以减轻软骨细胞损伤可能是抗骨关节炎的潜在有效治疗方法。 2.4.2 参与调控软骨下骨 软骨下骨是指钙化软骨远端成分,可分为软骨"
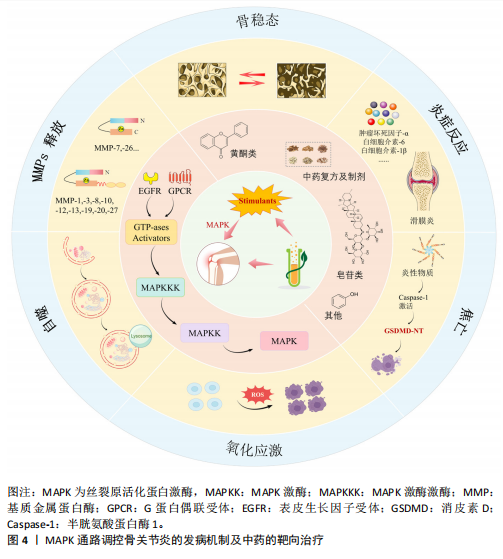
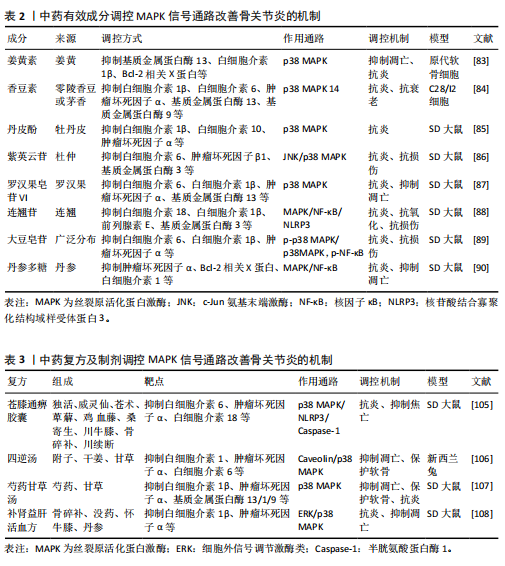
下骨板、软骨下骨小梁两部分,软骨下骨的改变是骨关节炎疾病活跃的表现,且与骨关节炎的严重程度密切相关[29]。软骨下骨,最著名的是位于关节软骨下的骨骼成分,支撑关节软骨,并在关节表面分散机械负荷。因此,软骨下骨的微结构变化可能导致软骨不稳定,并进一步导致软骨变性。MAPK信号通路可能参与了软骨下骨的发育过程。研究证明,MAPK信号通路可调控成骨细胞和破骨细胞分化的过程[30]。ERK、p38 MAPK信号通路通过磷酸化关键转录因子来介导成骨细胞分化过程,同时也能通过调节激活蛋白1作为破骨细胞生成的关键介质来促进破骨细胞分化[31]。并且MAPK信号通路也能通过介导软骨下骨释放降解酶的过程,影响软骨细胞,说明软骨和软骨下骨之间存在相互影响的细胞间通讯[32]。通过正常或骨关节炎软骨与关节软骨的共培养(反之亦然)也阐明了由 MAPK 信号通路介导的两种组织之间的细胞间串扰[33]。尽管近来很多研究表明 MAPK信号通路是关节软骨和软骨下骨之间串扰的介质,但需要进一步的研究和临床层面验证这些发现[34-35]。综上所述,MAPK信号通路参与软骨下骨发育,调控成骨细胞和破骨细胞分化,影响软骨细胞,可能在骨关节炎病理机制中扮演重要角色。 2.4.3 参与调控滑膜 一项临床研究发现,在超过1 000例骨关节炎患者的MRI检查显示60%的患者患有滑膜炎,在滑膜炎患者中有66%存在渗出物[36],这提示滑膜炎症可能是骨关节炎发病机制中的关键组成部分。滑膜炎主要是由滑膜细胞(包括滑膜细胞、成纤维细胞和巨噬细胞)释放的炎症因子和分解代谢产物所引发。这些炎症因子,如白细胞介素1β、白细胞介素6 和肿瘤坏死因子α,扩散到软骨中,进一步刺激软骨细胞分泌损伤介质,进而加剧滑膜炎症和软骨破坏[37]。研究表明,滑膜炎刺激关节软骨细胞参与MAPK和酪氨酸激酶受体信号传导的通路,进而影响骨关节炎进展[38]。此外,在K/BxN血清诱导的关节炎模型实验中进一步发现,抑制MAPK信号通路可有效缓解关节炎小鼠的滑膜炎病情[39]。综上所述,抑制MAPK信号通路表达减轻滑膜炎症,可以发挥抗骨关节炎的作用。然而,滑膜微环境复杂,滑膜包含多种细胞,MAPK信号通路在这些细胞中调节作用的确切机制尚不清楚,需要更多研究。 2.4.4 调控炎症因子及炎症细胞 炎症反应作为人体免疫系统的重要基础,广泛参与各类生理及病理过程,并且对骨关节炎(影响软骨、软骨下骨以及滑膜等多个组织)展现出高度的敏感性[40]。但与其他炎症不同的是,骨关节炎是一种慢性的低度炎症,在骨关节炎的进程中,中性粒细胞、T淋巴细胞等炎症细胞聚集在局部,并伴有多种炎症因子以及组胺等炎症递质的大量释放,继而引起软骨破坏等现象[41-42]。近年来,对炎症因子白细胞介素1和辅助性T细胞17的研究较为广泛。白细胞介素1炎症因子家族由11个成员(7个具有激动剂活性的配体、3个受体拮抗剂和 1个抗炎细胞因子)组成,被认为是多个组织中炎症和纤维化的关键介质,白细胞介素1靶向疗法也被用于治疗骨关节炎等一系列炎症性疾病[43]。越来越多的研究发现,白细胞介素1受体能诱导炎症反应产生,并通过激活MAPK信号通路,导致炎症细胞因子如白细胞介素1、肿瘤坏死因子α等的大量释放[44],进而引发或加重骨关节炎炎症。另外,辅助性T细胞17通过分泌白细胞介素17等促炎因子,引起骨关节炎的炎症反应和软骨破坏[45]。辅助性T细胞17还以可通过分泌白细胞介素1等炎症因子激活MAPK信号通路介导骨组织微环境,导致关节软骨稳态的破坏[46]。此外,辅助性T细胞17与MAPK/ERK、磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(phosphoinositide-3-Kinase/Protein kinase B/mammalian target of rapamycin,PI3K/Akt/mTOR)等信号通路相互作用的研究,证实其参与“炎症-关节破坏”作用,促进骨关节炎的产生和发展。综上所述,炎症反应在骨关节炎中起关键作用,MAPK信号通路的异常激活导致炎症因子大量释放和炎症细胞局部聚集,破坏关节软骨稳态,加重骨关节炎发展。 2.4.5 调控细胞焦亡 焦亡是一种炎症性程序性细胞死亡,其机制是激活半胱氨酸天冬氨酸特异性蛋白酶家族的炎症小体(特别是核苷酸结合寡聚结构域样受体蛋白1/3/5等成员),这一过程导致细胞发生裂解,导致细胞肿胀、质膜裂解、染色质碎裂以及细胞内促炎物质(即炎症小体)的释放[47]。有研究表明,炎症小体的过度产生会营造出一个促炎的微环境,这种环境会对软骨细胞造成损伤,并提升破骨细胞的活性,从而显著增加了罹患骨关节炎的风险[48]。MAPK信号通路作为调控细胞焦亡的重要通路之一,在炎症小体的启动过程中起着关键作用[49]。研究发现在骨关节炎模型中,MAPK信号通路被激活后,可能通过促进核苷酸结合寡聚结构域样受体蛋白3等炎症小体活化,促进软骨细胞焦亡[50-51]。相反,抑制MAPK信号通路降低核苷酸结合寡聚结构域样受体蛋白3活性可以减轻软骨细胞焦亡[52]。因此,调控MAPK信号通路,抑制焦亡减少炎症小体的产生可能是保护软骨细胞抗骨关节炎的重要机制之一。 2.4.6 调控细胞自噬 自噬是一种细胞质细胞器和细胞膜成分降解以保护细胞免受应激的新陈代谢过程[53]。在此过程中,UNC-51样激酶1、Beclin1以及微管相关蛋白1轻链3分别扮演着自噬启动、调节及执行的关键角色,它们各自的表达水平常被用作评估自噬过程的重要生物标志物[54]。自噬被认为是维持软骨正常功能的一种保护机制,而自噬功能受损已被证实会导致骨关节炎的发生[55]。因此,MAPK信号通路作为自噬过程中的上游调节因子对自噬功能的调控作用显得尤为重要[56]。在兔的骨关节炎模型中发现,抑制ERK、JNK或p38 MAPK信号通路可显著提升自噬生物标志物(UNC-51样激酶1、Beclin1以及微管相关蛋白1轻链3)的蛋白表达水平[57]。综上,抑制MAPK信号通路调控自噬以保护软骨细胞影响骨关节炎发展可能是一种很有前景的治疗骨关节炎的方法。 2.4.7 参与氧化应激 氧化应激是一个极为错综复杂的生物学现象,其核心特点是机体内产生的活性氧过度累积,进而引发氧化还原状态的失衡,这种失衡与多种疾病的起始及进展紧密相关[58]。研究发现,氧化应激在骨关节炎的发病及进展过程中具有重要作用,其中活性氧通过调控MAPK信号通路,对骨关节炎的病程有显著影响[59]。另一方面,基于对MAPK家族成员的研究发现,它们在调节软骨细胞存活和氧化应激耐受性方面具有一定作用[60]。在氧化应激状态下,活性氧过量累积会激活MAPK信号通路,促进基质降解和提高炎症因子的表达[61]。这一过程不仅加剧炎症反应,还促进软骨细胞凋亡,从而从多个层面加速骨关节炎患者的病情恶化。综上所述,氧化应激可能在骨关节炎的发病机制中起驱动作用。 2.5 中药调控 MAPK信号通路防治骨关节炎 2.5.1 中药有效成分 (1)丹参酮:丹参酮是从中国传统中药“丹参”的根茎中提取的一种生物活性分子,可通过降低软骨细胞炎症及软骨基质降解,改善大鼠骨关节炎情况[62]。JIA等[63]用丹参酮干预骨关节炎大鼠模型,发现关节软骨细胞的凋亡率从41%下降到2%。现代药理学研究证实,丹参酮可通过MAPK通路抑制肿瘤坏死因子α、干扰素γ等炎症因子分泌,进而促进白细胞介素4等抗炎因子表达[64]。以上结果表明,MAPK信号通路是丹参酮发挥抗炎、抑制凋亡作用干预骨关节炎的关键。 (2)淫羊藿苷:淫羊藿苷是淫羊藿的主要活性成分之一,具有免疫调节、抗炎、抗骨质疏松和促进血管新生等多重药理作用[65]。淫羊藿苷还能通过MAPK信号通路、PI3K/Akt信号通路等多种途径调控成骨分化[66]。此外,淫羊藿苷可通过调控MAPK信号通路抑制肿瘤坏死因子α、白细胞介素1β等炎性因子的释放,降低炎症反应[67]。由此,判定淫羊藿苷调控MAPK信号通路对于骨关节炎治疗是可行的。 (3)黄芪甲苷:黄芪甲苷是中药黄芪中一种具备显著生物活性的单体成分,是一种具有多靶点治疗特性的天然皂苷[68]。现代药理学研究显示,黄芪甲苷具有抗炎、抗凋亡的作用[69]。实验研究显示,黄芪甲苷不仅能够抑制SD骨关节炎大鼠关节内炎症因子(如白细胞介素6和肿瘤坏死因子α)的过度分泌,还能在骨关节炎软骨细胞中通过阻断白细胞介素1β激活的MAPK通路,减轻炎症反应及细胞损伤[70]。这些证据表明,黄芪甲苷能通过抑制MAPK信号通路改善骨关节炎环境,发挥抗炎、抗凋亡作用。 (4)木犀草素:木犀草素是一种源自药用植物的天然黄酮类化合物,具备多方面的药理活性,包括抗氧化、抗炎、神经保护以及对血管功能的积极影响。研究证实,木犀草素能够通过MAPK等信号通路抑制巨噬细胞激活,发挥抗炎作用,延缓骨关节炎进展[71-72]。木犀草素还能抑制骨关节炎软骨细胞的增殖,下调骨关节炎软骨细胞中JNK、p38 MAPK和基质金属蛋白酶3的表达及活性,从而减轻炎症反应、保护软骨细胞并延缓软骨退变[73]。综上所述,木犀草素通过介导MAPK信号通路对抗炎和维持软骨稳态具有重要作用。 (5)柴胡皂苷:柴胡皂苷是中药柴胡中的一种活性成分,已被广泛证明具有抗炎和免疫调节的功能。柴胡皂苷可调控MAPK信号通路,抑制巨噬细胞、表皮细胞等炎症细胞中炎症因子和炎症小体的释放,能有效减轻炎症反应和抑制细胞凋亡[74-75],从而达到抗骨关节炎的作用。提示柴胡皂苷通过介导MAPK信号通路调节炎症因子水平可能是抗骨关节炎的重要手段。 (6)穿山龙总皂苷:穿山龙总皂苷是中药穿山龙的主要活性成分之一,属类固醇皂苷类化合物,有抗炎、抗氧化、免疫调节等多种药理作用[76]。研究表明,在骨关节炎大鼠模型的滑膜组织中发现MAPK家族成员(如MAPK激酶4、磷酸化MAPK激酶1、磷酸化MAPK激酶2)的蛋白表达水平显著升高,使用穿山龙总皂苷治疗后,这些蛋白的表达水平出现显著下降[77]。穿山龙总皂苷还能降低骨关节炎模型血清中肿瘤坏死因子α、白细胞介素1β的表达水平[78]。综上,抑制MAPK信号通路及相关蛋白表达可能是穿山龙总皂苷对骨关节炎产生治疗效果的重要机制。 (7)白芍总苷:白芍总苷是中药白芍的有效成分,具有抗炎、双向免疫调节等药理作用,还可减轻骨关节炎的滑膜细胞损伤[79-80]。研究表明白芍总苷能有效调节骨关节炎软骨细胞的功能,其机制主要包括抑制MAPK信号通路在人骨关节炎软骨细胞中的表达,进而减少基质金属蛋白酶13与组织金属蛋白酶抑制剂1的活性失衡,并降低炎症因子的产生[81-82]。同时还减少与软骨退化相关的蛋白水平,抑制细胞凋亡,促进软骨细胞增殖。这表明白芍总苷治疗骨关节炎的重要机制之一就是抑制MAPK信号通路。 其他通过调控 MAPK 信号通路改善骨关节炎的中药有效成分[83-90],见表2。 综上所述,皂苷类和黄酮类为主的中药有效成分可通过MAPK信号通路发挥抗炎、抗凋亡、抗损伤和维持软骨稳态等作用以防治骨关节炎。 2.5.2 中药复方及制剂 (1)独活寄生汤:“太阳病,关节疼痛而烦,脉沉而细者,此名湿痹”。湿邪犯病则体重身困,病势缠绵不愈,是导致骨关节炎发病的重要原因之一。针对此病《备急千金要方》提出当用独活寄生汤以祛风湿、补肝肾、强筋骨以驱邪外出,组方为独活、细辛、肉桂、防风、秦艽、杜仲、牛膝、桑寄生、地黄、芍药、当归、川芎、人参、茯苓、甘草等15味中药组成。研究发现独活寄生汤能通过调控MAPK信号通路,在胶原诱导性关节炎大鼠模型中能抑制白细胞介素1β、白细胞介素17A和干扰素γ等炎症因子的异常上调,同时还能降低滑膜组织内p-p38 MAPK/p38 MAPK 的表达[91]。此外,在SD大鼠模型中发现,独活寄生汤可以通过抑制p38 MAPK信号通路减轻炎症,起到治疗作用[92]。说明独活寄生汤治疗骨关节炎是有效的。 (2)乌头汤:骨关节炎归属于“痹证”,其病位在骨,病机在于正虚邪实、肝肾失养,治以扶正祛邪、培补肝肾、除痹消痛。在骨痹的早中期阶段使用乌头汤,可有效缓解患者疼痛、改善关节功能,张仲景《金匮·中风历节病脉证并治第五》曰“病历节,不可屈伸,乌头汤主之”,说明其善治历节病,温通经脉、祛寒除湿止痹的功效显著。药理学研究发现,乌头汤组方具有抗炎、镇痛及改善软骨病理变化的作用[93]。乌头汤还能改善骨关节炎大鼠的关节软骨形态,抑制炎症相关信号通路激活,下调p38MAPK、JNK、ERK表达,保护关节软骨并延缓病理进程[94]。YAN等[95]通过数据挖掘发现,乌头汤含有的活性化合物可能通过影响MAPK信号通路调节关节软骨自噬和代谢,从而延缓骨关节炎发展。综上所述,乌头汤可以通过抑制MAPK信号通路保护软骨细胞延缓骨关节炎发展。 (3)补肾通络方:补肾通络方源于《伤科大成》,其组方为熟地、杜仲、当归、防风、山萸肉、怀牛膝、寄生、独活、秦艽、地龙、甘草、细辛,具有补肾活血、通络止痛的功效。研究发现补肾通络方可调控体内多种信号通路,其涉及的生物过程包括凋亡过程、细胞增殖与代谢、信号传导、炎性反应等,也可调控MAPK信号通路促进破骨细胞成熟,且可抑制软骨细胞的凋亡,在骨关节炎大鼠模型中,能明显延缓炎症反应,改善骨形成和骨吸收失衡状态[96-97]。这表明补肾通络方介导MAPK信号通路发挥抗炎、维持骨稳态的作用治疗骨关节炎。 (4)身痛逐瘀汤:身痛逐瘀汤出自《医林改错》,原文记载:“痹证日久,散寒祛风不效,清利湿热亦不效,滋阴补肾更不效,非病入于筋骨,当是瘀血凝滞作梗,法应用逐瘀通痹。”该方由秦艽、羌活、川芎、红花、没药、当归、五灵脂、香附、牛膝、地龙、甘草、桃仁等药味组成,具有活血化瘀、祛风除湿、通痹止痛之功效,与骨关节炎病机符合[98]。通过探究身痛逐瘀汤对骨关节炎大鼠的影响机制,发现其可以通过多种成分、多个靶点、协同调控MAPK信号通路抑制细胞异常增殖,并发挥抗炎作用,延缓骨关节炎进展[99-101]。 (5)补中益气汤:《内经》有言:“邪之所凑,其气必虚” “正气存内,邪不可干”。肝主筋,肾主骨,故骨关节炎可从肝肾论治,以固本培元、补益正气为主。补中益气汤由李东垣所创,具有补中益气、升阳举陷的功效,组方为蜜炙黄芪、人参、炙甘草、炒白术、陈皮、当归、升麻、柴胡、生姜、大枣。故临床上常与补中益气汤合用治疗肝肾不足、脾胃虚弱型骨关节炎[102]。现代研究表明,补中益气汤可能通过参与MAPK信号通路介导炎症反应发挥治疗作用[103]。动物实验研究发现补中益气汤对膝骨关节炎模型大鼠具有治疗作用,可以显著延缓模型大鼠软骨的损伤,降低白细胞介素6、血管内皮生长因子A的表达[104]。综上所述,补中益气汤可能通过调控MAPK信号通路促进软骨修复并减轻炎症损伤,从而治疗骨关节炎。 其他中药复方及制剂通过调控MAPK信号通路改善骨关节炎的中药复方[105-108],见表3。 以上结果表明,中药复方及制剂不仅可通过MAPK信号通路减轻炎症反应、保护软骨细胞、调控自噬等作用来治疗骨关节炎,而且相对于单味的中药具有多成分、多靶点、多种调控作用并行的优点。此外,骨关节炎虽然证型多变、治法不一,但活血化瘀、补益肝肾可以视为总的治疗原则。"
| [1] MAUTNER K, GOTTSCHALK M, BODEN SD, et al. Cell-based versus corticosteroid injections for knee pain in osteoarthritis: a randomized phase 3 trial. Nat Med. 2023; 29(12):3120-3126. [2] LI Z, DAI A, YANG M, et al. p38MAPK Signaling Pathway in Osteoarthritis: Pathological and Therapeutic Aspects. J Inflamm Res. 2022;15:723-734. [3] Allen KD, Thoma LM, Golightly YM. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 2022;30(2):184-195. [4] Li H, Kong W, Liang Y, et al. Burden of osteoarthritis in China, 1990-2019: findings from the Global Burden of Disease Study 2019. Clin Rheumatol. 2024;43(3):1189-1197. [5] Cao F, Xu Z, Li XX, et al. Trends and cross-country inequalities in the global burden of osteoarthritis, 1990-2019: A population-based study. Ageing Res Rev. 2024;99:102382. [6] Patwardhan V, Gil GF, Arrieta A, et al. Differences across the lifespan between females and males in the top 20 causes of disease burden globally: a systematic analysis of the Global Burden of Disease Study 2021. Lancet Public Health. 2024;9(5):e282-e294. [7] 刘康妍, 郑聪, 胡海澜. 骨关节炎流行病学研究 [J]. 中华关节外科杂志(电子版), 2017,11(3):320-323. [8] Hunter DJ, March L, Chew M. Osteoarthritis in 2020 and beyond: a Lancet Commission. Lancet. 2020; 396(10264):1711-1712. [9] 陈跃平,陈锋,彭清林,等. 三七治疗骨关节炎机制:基于UHPLC-QE-MS、网络药理学及分子动力学模拟 [J]. 中国组织工程研究,2025,29(8):1751-1760. [10] 宋霞,赵慧,郑涵,等.基于网络药理学和分子对接探究复方丹参滴丸治疗骨关节炎的作用机制[J].中国医药科学,2024, 14(17):30-33. [11] Wang X, Guo Z, Lin J, et al. Indirubin protects chondrocytes and alleviates OA by inhibiting the MAPK and NF-κB pathways. Int Immunopharmacol. 2023;115:109624. [12] Li Z, Dai A, Yang M, et al. p38MAPK Signaling Pathway in Osteoarthritis: Pathological and Therapeutic Aspects. J Inflamm Res. 2022;15:723-734. [13] Wang X, Guo Z, Lin J, et al. Indirubin protects chondrocytes and alleviates OA by inhibiting the MAPK and NF-κB pathways. Int Immunopharmacol. 2023;115:109624. [14] Davis RJ. Signal transduction by the JNK group of MAP kinases. Cell. 2000;103(2): 239-252. [15] Roy A, Srivastava M, Saqib U, et al. Potential therapeutic targets for inflammation in toll-like receptor 4 (TLR4)-mediated signaling pathways. Int Immunopharmacol. 2016;40:79-89. [16] LEE SH, CHOI SH, LEE IS, et al.Anti-inflammatory effect of Rosa laevigata extract on in vitro and in vivo model of allergic asthma via the suppression of IgE and related cytokines.Molecular & Cellular Toxicology. 2020(2):16. [17] LOO SJQ, WONG NK. Advantages and challenges of stem cell therapy for osteoarthritis (Review). Biomed Rep. 2021; 15(2):67. [18] UEBELHOER M, LAMBERT C, GRISART J, et al. Interleukins, growth factors, and transcription factors are key targets for gene therapy in osteoarthritis: A scoping review. Front Med (Lausanne). 2023;10:1148623. [19] LI X, SHEN L, DENG Z, et al. New treatment for osteoarthritis: Gene therapy. Precis Clin Med. 2023;6(2):016. [20] LAWSON TB, MÄKELÄ JTA, KLEIN T, et al. Nanotechnology and osteoarthritis; part 1: Clinical landscape and opportunities for advanced diagnostics. J Orthop Res. 2021;39(3):465-472. [21] WEBER AE, BOLIA IK, TRASOLINI NA. Biological strategies for osteoarthritis: from early diagnosis to treatment. Int Orthop. 2021;45(2):335-344. [22] 金柱,刘高卿,徐文博,等.骨关节炎疼痛机制及相关中药治疗研究进展[J].新乡医学院学报,2024,41(10):996-1000. [23] SCHIPHOF D, VAN DEN DRIEST JJ, RUNHAAR J. Osteoarthritis year in review 2017: rehabilitation and outcomes. Osteoarthritis Cartilage. 2018;26(3):326-340. [24] CHARLIER E, DEROYER C, CIREGIA F, et al. Chondrocyte dedifferentiation and osteoarthritis (OA). Biochem Pharmacol. 2019;165:49-65. [25] KOMORI T. Cell Death in Chondrocytes, Osteoblasts, and Osteocytes. Int J Mol Sci. 2016;17(12):2045. [26] SHU Z, MIAO X, TANG T, et al. The GSK‑3β/β‑catenin signaling pathway is involved in HMGB1‑induced chondrocyte apoptosis and cartilage matrix degradation. Int J Mol Med. 2020;45(3):769-778. [27] CHEN CP, LIN YC, PENG YH, et al. Rosmarinic Acid Attenuates the Lipopolysaccharide-Provoked Inflammatory Response of Vascular Smooth Muscle Cell via Inhibition of MAPK/NF-κB Cascade. Pharmaceuticals (Basel). 2022;15(4):437. [28] WANG X, GUO Z, LIN J, et al. Indirubin protects chondrocytes and alleviates OA by inhibiting the MAPK and NF-κB pathways. Int Immunopharmacol. 2023;115:109624. [29] 李仪杰,刘亚东,李进敏,等.沉默信息调节因子2相关酶1在骨关节炎中的作用机制[J].风湿病与关节炎,2024, 13(10):58-64. [30] LIU CL, HO TL, FANG SY, et al. Ugonin L inhibits osteoclast formation and promotes osteoclast apoptosis by inhibiting the MAPK and NF-κB pathways. Biomed Pharmacother. 2023;166:115392. [31] SHARMA AR, JAGGA S, LEE SS, et al. Interplay between cartilage and subchondral bone contributing to pathogenesis of osteoarthritis. Int J Mol Sci. 2013;14(10):19805-19830. [32] SONDERGAARD BC, SCHULTZ N, MADSEN SH, et al. MAPKs are essential upstream signaling pathways in proteolytic cartilage degradation--divergence in pathways leading to aggrecanase and MMP-mediated articular cartilage degradation. Osteoarthritis Cartilage. 2010;18(3): 279-288. [33] PRASADAM I, FRIIS T, SHI W, et al. Osteoarthritic cartilage chondrocytes alter subchondral bone osteoblast differentiation via MAPK signalling pathway involving ERK1/2. Bone. 2010;46(1):226-235. [34] ZHOU Z, TANG S, NIE X, et al. Osteoarthritic infrapatellar fat pad aggravates cartilage degradation via activation of p38MAPK and ERK1/2 pathways. Inflamm Res. 2021; 70(10-12):1129-1139. [35] DENNY WA. Inhibitors and Activators of the p38 Mitogen-Activated MAP Kinase (MAPK) Family as Drugs to Treat Cancer and Inflammation. Curr Cancer Drug Targets. 2022;22(3):209-220. [36] NEOGI T, GUERMAZI A, ROEMER F, et al. Association of Joint Inflammation With Pain Sensitization in Knee Osteoarthritis: The Multicenter Osteoarthritis Study. Arthritis Rheumatol. 2016;68(3):654-661. [37] MATHIESSEN A, CONAGHAN PG. Synovitis in osteoarthritis: current understanding with therapeutic implications. Arthritis Res Ther. 2017;19(1):18. [38] LIAO CR, WANG SN, ZHU SY, et al. Advanced oxidation protein products increase TNF-α and IL-1β expression in chondrocytes via NADPH oxidase 4 and accelerate cartilage degeneration in osteoarthritis progression. Redox Biol. 2020;28:101306. [39] MNICH SJ, BLANNER PM, HU LG, et al. Critical role for apoptosis signal-regulating kinase 1 in the development of inflammatory K/BxN serum-induced arthritis. Int Immunopharmacol. 2010; 10(10):1170-1176. [40] ZÚÑIGA-MUÑOZ A, GARCÍA-NIÑO WR, CARBÓ R, et al. The regulation of protein acetylation influences the redox homeostasis to protect the heart. Life Sci. 2021;277:119599. [41] ABRAMOFF B, CALDERA FE. Osteoarthritis: Pathology, Diagnosis, and Treatment Options. Med Clin North Am. 2020;104(2): 293-311. [42] HSUEH MF, ZHANG X, WELLMAN SS, et al. Synergistic Roles of Macrophages and Neutrophils in Osteoarthritis Progression. Arthritis Rheumatol. 2021;73(1):89-99. [43] BORTHWICK LA. The IL-1 cytokine family and its role in inflammation and fibrosis in the lung. Semin Immunopathol. 2016; 38(4):517-534. [44] FIELDS JK, GÜNTHER S, SUNDBERG EJ. Structural Basis of IL-1 Family Cytokine Signaling. Front Immunol. 2019;10:1412. [45] AKHTER S, TASNIM FM, ISLAM MN, et al. Role of Th17 and IL-17 Cytokines on Inflammatory and Auto-immune Diseases. Curr Pharm Des. 2023;29(26):2078-2090. [46] HUANG F, WONG P, LI J, et al. Osteoimmunology: The correlation between osteoclasts and the Th17/Treg balance in osteoporosis. J Cell Mol Med. 2022;26(13):3591-3597. [47] FANG Y, TIAN S, PAN Y, et al. Pyroptosis: A new frontier in cancer. Biomed Pharmacother. 2020;121:109595. [48] JIANG N, AN J, YANG K, et al. NLRP3 Inflammasome: A New Target for Prevention and Control of Osteoporosis?. Front Endocrinol (Lausanne). 2021;12:752546. [49] WANG F, XIAO J, LI M, et al. Picroside II suppresses chondrocyte pyroptosis through MAPK/NF-κB/NLRP3 signaling pathway alleviates osteoarthritis. PLoS One. 2024;19(8):e0308731. [50] ZHOU F, HAN X, WANG L, et al. Associations of osteoclastogenesis and nerve growth in subchondral bone marrow lesions with clinical symptoms in knee osteoarthritis. J Orthop Translat. 2021;32:69-76. [51] LI Z, DAI A, YANG M, et al. p38MAPK Signaling Pathway in Osteoarthritis: Pathological and Therapeutic Aspects. J Inflamm Res. 2022;15:723-734. [52] JIANG T, GONG Y, ZHANG W, et al. PD0325901, an ERK inhibitor, attenuates RANKL-induced osteoclast formation and mitigates cartilage inflammation by inhibiting the NF-κB and MAPK pathways. Bioorg Chem. 2023;132:106321. [53] SAHA S, PANIGRAHI DP, PATIL S, et al. Autophagy in health and disease: A comprehensive review. Biomed Pharmacother. 2018;104:485-495. [54] LEVINE B, KROEMER G. Biological Functions of Autophagy Genes: A Disease Perspective. Cell. 2019;176(1-2):11-42. [55] LI YS, ZHANG FJ, ZENG C, et al. Autophagy in osteoarthritis. Joint Bone Spine. 2016; 83(2):143-148. [56] DUAN R, XIE H, LIU ZZ. The Role of Autophagy in Osteoarthritis. Front Cell Dev Biol. 2020;8:608388. [57] LAN CN, CAI WJ, SHI J, et al. MAPK inhibitors protect against early‑stage osteoarthritis by activating autophagy. Mol Med Rep. 2021;24(6):829. [58] EBRAHIMI S, ALALIKHAN A, AGHAEE-BAKHTIARI SH, et al. The redox modulatory effects of SP/NK1R system: Implications for oxidative stress-associated disorders. Life Sci. 2022;296:120448. [59] PASOLD J, ZANDER K, HESKAMP B, et al. Positive impact of IGF-1-coupled nanoparticles on the differentiation potential of human chondrocytes cultured on collagen scaffolds. Int J Nanomedicine. 2015;10:1131-1143. [60] LIU L, LUO P, YANG M, et al. The role of oxidative stress in the development of knee osteoarthritis: A comprehensive research review. Front Mol Biosci. 2022;9:1001212. [61] 李琳慧,何阳梅,周志刚,等.基于NGF/p38 MAPK/TRPV1信号通路探讨热敏灸治疗膝骨关节炎的外周敏化效应机制[J].中华中医药杂志,2022,37(3):1379-1383. [62] 孙晓娟,侯娜.丹参酮对膝骨关节炎大鼠的抗炎作用[J].现代食品科技,2019, 35(12):14-19+86. [63] JIA PT, ZHANG XL, ZUO HN, et al. Articular cartilage degradation is prevented by tanshinone IIA through inhibiting apoptosis and the expression of inflammatory cytokines. Mol Med Rep. 2017;16(5):6285-6289. [64] 李瑞英,李杰.丹参酮ⅡA磺酸钠联合常规西药治疗不稳定型心绞痛患者的效果[J].中国药物滥用防治杂志,2024, 30(10):1920-1923. [65] 童伍岳,张智辉,叶国庆,等.基于PI3K/Akt信号通路探讨中医药治疗股骨头坏死的研究进展[J].中国医药导报,2024, 21(30):45-49+54. [66] YU Y, KIM SM, PARK K, et al. Therapeutic Nanodiamonds Containing Icariin Ameliorate the Progression of Osteoarthritis in Rats. Int J Mol Sci. 2023;24(21):15977. [67] LUO Z, DONG J, WU J. Impact of Icariin and its derivatives on inflammatory diseases and relevant signaling pathways. Int Immunopharmacol. 2022;108:108861. [68] 王照宇,赵国栋,刘佳,等.中药调控cAMP/PKA/CREB信号通路改善轻度认知障碍研究进展[J/OL].中医学报,1-10[2025-01-17].http://kns.cnki.net/kcms/detail/41.1411.R.20241128.0946.004.html. [69] ZHANG J, WU C, GAO L, et al. Astragaloside IV derived from Astragalus membranaceus: A research review on the pharmacological effects. Adv Pharmacol. 2020;87:89-112. [70] MA Z, PIAO T, WANG Y, et al. Astragalin inhibits IL-1β-induced inflammatory mediators production in human osteoarthritis chondrocyte by inhibiting NF-κB and MAPK activation. Int Immunopharmacol. 2015;25(1):83-87. [71] 于倩,巫冠中.木犀草素抗炎机制的研究进展[J].药学研究,2019,38(2):108-111+119. [72] 曾克非,夏婷婷,吴小兰,等.木犀草素通过TLR4/PI3K/AKT通路对子痫前期大鼠胎盘血管生成及细胞凋亡的影响[J].中国免疫学杂志,2024,40(2):330-336. [73] PETER WF, SWART NM, MEERHOFF GA, et al. Clinical Practice Guideline for Physical Therapist Management of People With Rheumatoid Arthritis. Phys Ther. 2021; 101(8):127. [74] LIAO PC, LAI MH, HSU KP, et al. Identification of β-Sitosterol as in Vitro Anti-Inflammatory Constituent in Moringa oleifera. J Agric Food Chem. 2018;66(41):10748-10759. [75] 宋吉美,房国伟,朱建德,等.柴胡有效成分及其类方治疗桥本甲状腺炎作用机制研究进展[J].山西中医,2020,36(10): 57-59+62. [76] 范晓阳,贾世艳,司瑞花,等.Box-Behnken响应面法优化穿山龙总皂苷的提取工艺及体外抗氧化活性研究[J].中医药信息, 2022,39(9):26-32. [77] CHEN YH, LUO R, LEI SS, et al. Anti-inflammatory effect of Ganluyin, a Chinese classic prescription, in chronic pharyngitis rat model. BMC Complement Med Ther. 2020;20(1):265. [78] ZHOU Q, SUN HJ, ZHANG XW. Total Saponin Fraction of Dioscorea Nipponica Makino Improves Gouty Arthritis Symptoms in Rats via M1/M2 Polarization of Monocytes and Macrophages Mediated by Arachidonic Acid Signaling. Chin J Integr Med. 2023; 29(11):1007-1017. [79] 周强,栗占国.白芍总苷的药理作用及其在自身免疫性疾病中的应用[J].中国新药与临床杂志,2003,22(11):687-691. [80] 陈谱,阮安民,周俊,等.白芍总苷对骨关节炎软骨细胞炎症及退变的影响[J].中国组织工程研究,2021,25(29):4614-4618. [81] 杜旭召,杨豪,邓素玲,等.白芍总苷对骨关节炎软骨细胞增殖及分泌表达的影响[J].中国骨质疏松杂志,2016,22(11): 1375-1379+1385. [82] 董良杰,王勤俭,王单一,等.白芍总苷对人骨关节炎软骨细胞增殖及p38MAPK蛋白表达的影响[J].郑州大学学报(医学版),2019,54(3):431-435. [83] 宋飞,范学菲,刘楠楠,等.姜黄素通过调控DUSP1/p38 MAPK通路减轻IL-1β诱导的软骨细胞损伤[J].安徽医科大学学报,2024,59(11):1903-1910. [84] 刘恺文,叶元兰,郭风劲.香豆素调控SASP抑制细胞衰老缓解骨关节炎的试验研究[J].重庆医科大学学报,2024,49(12): 1556-1565. [85] 杨小四,姚文兵,胡华麟,等.丹皮酚对佐剂性关节炎大鼠继发性炎症的作用[J].中成药,2022,44(9):3000-3004. [86] 杨博辰,付学敬,朱琳.紫云英苷对膝关节骨性关节炎大鼠JNK/p38 MAPK信号通路的影响[J].中国骨质疏松杂志,2022, 28(10):1491-1495+1500. [87] 曾智,李浩,王晓旭,等.罗汉果皂苷Ⅵ对膝骨关节炎大鼠模型的治疗作用及其机制探讨[J].免疫学杂志,2022,38(9): 804-809. [88] 王海滨,李平,张志刚,等.连翘苷调节MAPK/NF-κB/NLRP3信号通路对膝骨性关节炎大鼠软骨损伤的影响[J].国际检验医学杂志,2023,44(15):1902-1907. [89] 张超,张锐,王冶,等.大豆皂苷缓解骨关节炎模型大鼠软骨损伤和关节炎症的机制[J].免疫学杂志,2023,39(3):225-232. [90] 张扬,张宁,玄锋学,等.丹参多糖对碘乙酸钠所致大鼠膝骨性关节炎的治疗作用及机制研究[J].天然产物研究与开发, 2024,36(11):1821-1829. [91] 梁霄,李娅兰,张筠昊,等.基于TLR2/p38 MAPK/NF-κB信号通路探讨独活寄生汤对类风湿性关节炎大鼠的抗炎作用及机制[J].中国实验方剂学杂志,2023, 29(11):43-52. [92] 吴广文,刘淑如,陈俊,等.独活寄生汤治疗膝骨关节炎的作用机制[J].中国组织工程研究,2019,23(19):2965-2971. [93] LIN W, SHEN P, HUANG Y, et al. Wutou decoction attenuates the synovial inflammation of collagen-induced arthritis rats via regulating macrophage M1/M2 type polarization. J Ethnopharmacol. 2023; 301:115802. [94] 付长龙.乌头汤延缓膝骨关节炎大鼠软骨退变的作用与机制研究[D].福州:福建中医药大学,2019. [95] YAN BZ, LUO D, LI JC, et al. Molecular mechanism of Wutou Decoction in the treatment of osteoarthritis: a bioinformatics and molecular docking study. Ann Palliat Med. 2021;10(7):7706-7720. [96] 宋玉成,欧国谊,杨永强,等.补肾通络方治疗膝骨性关节炎机制网络药理学研究[J].中国药业,2023,32(24):61-64. [97] 尤银刚,魏秋芳,滕月鹏,等.补肾通络方对膝骨关节炎大鼠软骨损伤、氧化应激及TGF-β/SMAD2信号通路的影响[J].北方药学,2023,20(12):5-11. [98] 刘学睿,李兴勇,唐兆鹏,等.中药复方调控氧化应激防治骨关节炎研究进展[J].中国骨质疏松杂志,2024,30(12):1820-1825. [99] 张学哲.经方、时方治疗癌痛的理法方药规律及机制探析[D].沈阳:辽宁中医药大学,2021. [100] 崔海舰.身痛逐瘀汤治疗腰椎间盘突出症临床研究及延缓椎间盘退变实验研究[D].沈阳:辽宁中医药大学,2024. [101] 陈子前,马太平,刁虹.身痛逐瘀汤加减联合推拿治疗骨性膝关节炎的疗效及对IL-1和TNF的影响[J].四川中医, 2016,34(8):152-154. [102] 田惠萍,夏娟,陈盼,等.汤小虎教授运用桂枝类方治疗骨关节炎经验总结[J].云南中医中药杂志,2017,38(11):8-11. [103] 黄逸唯,朱玲,卢梓铤,等.基于网络药理学及分子对接的补中益气汤“异病同治”慢性尿路感染、肾性血尿和肾性蛋白尿的作用机制[J].中国医院用药评价与分析,2024,24(10):1190-1195. [104] 于冬冬,李鑫,乔隆.补中益气汤对膝骨关节炎大鼠膝关节及IL-6、VEGFA的影响[J].中华中医药杂志,2022,37(12):7369-7373. [105] 张志猛,袁道通,靳希民,等.苍膝通痹胶囊调控p38 MAPK/NLRP3/Caspase-1通路介导膝关节骨性关节炎软骨细胞焦亡的机制[J].中国实验方剂学杂志,2024, 30(22):61-68. [106] 魏文元,王亭,王鹏,等.四逆汤饼灸对兔膝骨关节炎软骨中Caveolin-1/p38 MAPK信号通路蛋白表达的影响[J].宁夏医科大学学报,2024,46(3):259-264+280. [107] 宋庆慧,李秋月,杨丽平,等.基于免疫印迹实验验证芍药甘草汤治疗骨关节炎关键靶点和通路[J].辽宁中医药大学学报,2022,24(9):10-13. [108] 许骏,谢林.补肾益肝活血方含药血清对ERK/p38MAPK信号通路的影响[J].中国老年学杂志,2019,39(18):4535-4540. |
| [1] | Li Qingbin, Lin Jianhui, Huang Wenjie, Wang Mingshuang, Du Jiankai, Lao Yongqiang. Bone cement filling after enlarged curettage of giant cell tumor around the knee joint: a comparison of subchondral bone grafting and non-grafting [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1896-1902. |
| [2] | Li Linzhen, Jiao Hongzhuo, Chen Weinan, Zhang Mingzhe, Wang Jianlong, Zhang Juntao. Effect of icariin-containing serum on lipopolysaccharide-induced inflammatory damage in human chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1368-1374. |
| [3] | Chen Ju, Zheng Jinchang, Liang Zhen, Huang Chengshuo, Lin Hao, Zeng Li. Effect and mechanism of beta-caryophyllene in mice with osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1341-1347. |
| [4] | Lyu Guoqing, Aizimaitijiang·Rouzi, Xiong Daohai. Irisin inhibits ferroptosis in human articular chondrocytes: roles and mechanisms [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1359-1367. |
| [5] | Zhang Qian, Huang Dongfeng. Weighted gene co-expression network analysis combined with machine learning to screen and validate biomarkers for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1096-1105. |
| [6] | Bu Yangyang, Ning Xinli, Zhao Chen. Intra-articular injections for the treatment of osteoarthritis of the temporomandibular joint: different drugs with multiple combined treatment options [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1215-1224. |
| [7] | Liu Xinyue, Li Chunnian, Li Yizhuo, Xu Shifang. Regeneration and repair of oral alveolar bone defects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1247-1259. |
| [8] | Yang Xiao, Bai Yuehui, Zhao Tiantian, Wang Donghao, Zhao Chen, Yuan Shuo. Cartilage degeneration in temporomandibular joint osteoarthritis: mechanisms and regenerative challenges [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 926-935. |
| [9] | Rong Xiangbin, , Zheng Haibo, Mo Xueshen, Hou Kun, Zeng Ping, . Plasma metabolites, immune cells, and hip osteoarthritis: causal inference based on GWAS data from European populations [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 1028-1035. |
| [10] | Gu Fucheng, Yang Meixin, Wu Weixin, Cai Weijun, Qin Yangyi, Sun Mingyi, Sun Jian, Geng Qiudong, Li Nan. Effects of Guilu Erxian Glue on gut microbiota in rats with knee osteoarthritis: machine learning and 16S rDNA analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 1058-1072. |
| [11] | Chen Yixian, Chen Chen, Lu Liheng, Tang Jinpeng, Yu Xiaowei. Triptolide in the treatment of osteoarthritis: network pharmacology analysis and animal model validation [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 805-815. |
| [12] | Li Xiaomin, Tian Xiangdong, Wang Chaolu. High tibial osteotomy on a single plane: femorofibular angle as a reference marker for mechanical axis correction [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 570-576. |
| [13] | Guo Jingwen, Wang Qingwei, He Zijun, Hu Zihang, Chen Zhi, Zhu Rong, Wang Yuming, Liu Wenfei, Luo Qinglu. Intra-articular injection of different concentrations of silicon-based bioceramics in treatment of knee osteoarthritis in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 288-295. |
| [14] | Du Yanli, , Wang Yi, , Wang Zhenyu, Wang Xuanhui, , Li Xinye, , Xiong Xifeng, Miao Haixiong, . The role of p53 in musculoskeletal diseases [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2503-2514. |
| [15] | Qi Xiang, Cao Shan, Chen Jian, Zhang Yijia, Liu Keke, Xu Zifu, Liu Wang, Fu Xiaoxiao, Yin Xiaolei. Screening of genes related to mitochondrial dysfunction and ferroptosis in atherosclerosis and target prediction of regulatory traditional Chinese medicine [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2641-2652. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||