Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (5): 1207-1214.doi: 10.12307/2026.003
Previous Articles Next Articles
Advance in the mechanisms underlying miRNAs in steroid-induced osteonecrosis of the femoral head
Wang Zhengye, Liu Wanlin, Zhao Zhenqun
- Center for Pediatric Orthopedics, Second Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010090, Inner Mongolia Autonomous Region, China
-
Received:2024-11-15Accepted:2025-01-06Online:2026-02-18Published:2025-06-25 -
Contact:Liu Wanlin, Professor, Center for Pediatric Orthopedics, Second Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010090, Inner Mongolia Autonomous Region, China -
About author:Wang Zhengye, Master candidate, Center for Pediatric Orthopedics, Second Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010090, Inner Mongolia Autonomous Region, China -
Supported by:National Natural Science Foundation of China, Nos. 81960397 (to LWL) and 82160414 (to ZZQ); Inner Mongolia Autonomous Region Achievement Transformation Project, No. CGZH2018146 (to LWL)
CLC Number:
Cite this article
Wang Zhengye, Liu Wanlin, Zhao Zhenqun. Advance in the mechanisms underlying miRNAs in steroid-induced osteonecrosis of the femoral head[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1207-1214.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

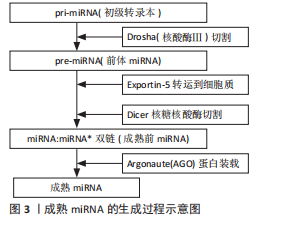
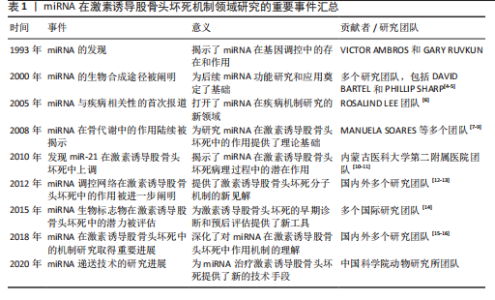
2.1 miRNA在SINOF机制领域研究的重要事件 自1993年VICTOR AMBROS和GARY RUVKUN首次发现miRNA以来,这一领域取得了显著进展,为后续研究奠定了基础。进入2000年代初,DAVID BARTEL和PHILLIP SHARP等科学家进一步阐明了miRNA的生物合成途径,提供了理解其功能和调控机制的关键信息。2005年, ROSALIND LEE团队首次报道miRNA与疾病相关,开启了miRNA在疾病机制研究的新篇章。到了2008年,MANUELA SOARES团队揭示了miRNA在骨代谢中的作用,为miRNA在SINOF中的作用研究提供了理论基础。2010年,内蒙古医科大学第二附属医院团队发现miR-21在SINOF中上调,这是miRNA与SINOF病理过程相关性的首个证据。2012年,多个国内外研究团队进一步阐明了miRNA调控网络在SINOF中的作用,为理解SINOF的分子机制提供了新视角。2015年,多个国际研究团队评估了miRNA作为SINOF生物标志物的潜力,为SINOF的诊断和预后评估提供了新工具。2018年,刘万林教授团队等在miRNA在SINOF中的机制研究中取得重要进展,深化了对miRNA作用机制的理解。到了2020年,中国科学院动物研究所团队在miRNA递送技术的研究中取得进展,为miRNA治疗SINOF提供了新的技术手段。这些事件和贡献标志着miRNA在SINOF机制研究领域的重要进展,从基础科学到潜在的临床应用,每一步都为理解SINOF的复杂性提供了新的视角,并为未来的治疗策略提供了科学依据。miRNA在SINOF机制领域研究的重要事件,见表1。 2.2 miRNA的生物学与作用通路 miRNA是一类在真核生物中发现的内源性的具有调控功能的非编码RNA,长度为19-25个核苷酸。miRNA通过与目标mRNA的3’非翻译区结合抑制其翻译或促进其降解,从而精细调控基因表达[3]。miRNA主要通过参与基因的转录后调控实现对靶基因表达的调节。miRNA的生物合成过程涉及多个步骤,从初级转录本(pri-miRNA)到前体miRNA(pre-miRNA),再到成熟miRNA的生成。在这一过程中,RNA聚合酶Ⅱ或Ⅲ首先转录生成pri-miRNA[17],随后在Drosha-DGCR8复合物的作用下被加工成具有茎环结构的pre-miRNA[18-19],这些pre-miRNA随后在Ran-GTP-Exportin-5(Exp5)转运蛋白的帮助下从细胞核转运到细胞质中,最终被Dicer-TRBP复合物识别并剪切,形成miRNA二聚体,其中一条链降解,另一条链被装载到Argonaute (AGO)蛋白中[20],形成RNA诱导沉默复合体,最终生成成熟的单链miRNA,如图3。miRNA的调控机制非常复杂,涉及多个层面的调控。miRNA前体编码多肽的研究揭示了miRNA前体除了作为RNA分子外,还具有编码多肽的能力,这些多肽具有很强的免疫调节功能,是潜在的新药分子;此外,miRNA的成熟过程也受到精细调控,例如通过Lin-28蛋白与let-7前体的相互作用调节miRNA的加工[21]。miRNA的稳定性和降解也受到严格调控,例如通过末端尿苷化酶家族(如末端尿苷化酶4和末端尿苷化酶7)对pre-miRNA进行尿苷化修饰,影响其成熟和稳定"
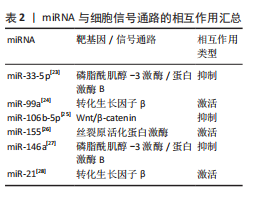
性[22]。 miRNA与细胞信号通路的相互作用是细胞生物学中一个复杂而精细的调控网络,如表2。现有研究表明,miRNA主要调控位于信号通路中间或下游的因子,通过对关键信号蛋白的调控介导了细胞信号通路的信号级联放大、细胞信号通路之间的“相互作用”以及信号网络的鲁棒性。 信号级联放大是一个关键的生物学过程,其中信号分子与细胞表面受体结合后引发一系列反应,信号通过各种激酶逐步放大,使得原始信号变得更强,从而引起细胞的强烈反应,miRNA通过靶向信号通路中的抑制因子可以显著影响这一过程。研究发现,在Wnt信号通路中miRNA可以靶向Wnt抑制因子1、Wnt5a、轴蛋白、磷酸酶和张力蛋白同源物、DKK1以及腺瘤性结肠息肉病蛋白等抑制因子,这些因子对于成熟体中Wnt通路的抑制起着关键作用[29]。通过调节这些抑制因子的表达,miRNA能够激活或抑制Wnt信号通路的级联反应,进而影响细胞的增殖、分化和迁移等生物学行为。 miRNA还介导不同信号通路之间的“相互作用”,即不同信号通路间的相互影响[30]。miRNA在细胞内的交叉对话主要涉及它们与其他非编码RNA(如长链非编码RNA和环状RNA)以及mRNA之间的相互作用,这种相互作用构成了一个复杂的基因表达调控网络,即竞争性内源RNA网络。竞争性内源RNA网络假说提出,一个RNA分子(如mRNA、长链非编码RNA或环状RNA)可以通过其3’非翻"

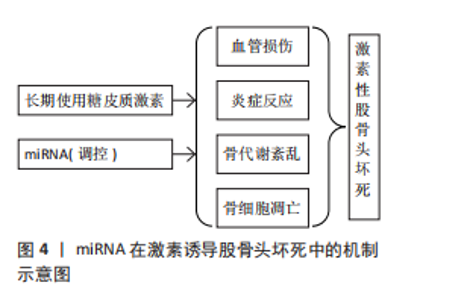
译区中的miRNA结合位点与miRNA相互作用,影响miRNA的可用性,进而调节其他含有相同miRNA结合位点RNA分子的稳定性和翻译。在这个网络中,不同的RNA分子通过共享miRNA响应元件来竞争性地结合miRNA,从而调节彼此的表达[31]。有研究表明,环状RNA E3泛素蛋白连接酶通过吸附miR-7、miR-17和miR-214从而调控E3泛素蛋白连接酶的表达,这种机制展示了竞争性内源RNA如何在细胞内通过竞争性结合miRNA来调节基因表达[32]。值得注意的是,靶基因能以序列依赖性方式调控miRNA的生成和降解,表明miRNA和靶基因之间的调控不是单向的,而是相互调控[33]。 miRNA受不同信号通路的调控及其多靶效应的特性,决定了其在信号通路“相互作用”中的关键作用。有研究表明,miRNA-21与肿瘤转移、肿瘤恶性程度以及早期诊断相关[34],而miR-144的异常表达与神经发育毒性相关,这些通过激活蛋白激酶C/丝裂原活化蛋白激酶信号通路介导[35],揭示了miRNA在细胞信号传导中的重要角色,并为理解miRNA的生物学意义提供了新的视角。最新研究进展显示,miRNA通过直接或间接调控Wnt1/β-catenin、磷脂酰肌醇-3激酶/蛋白激酶B、转化生长因子β、丝裂原活化蛋白激酶等信号通路,在骨代谢机制下对股骨头坏死成骨细胞与破骨细胞分化进程中起到不同程度的调控作用[36],这些信号通路的异常激活或抑制可能导致骨形成和吸收的失衡,从而促进股骨头坏死的发展。因此,miRNA如何与Wnt1/β-catenin信号通路相互作用影响骨代谢和修复,仍然是当前研究的热点之一。有研究表明,miR-144通过激活Wnt1/β-连环蛋白通路上调Runt相关转录因子2、成骨细胞特异性转录因子重组蛋白表达,促进骨髓间充质干细胞增殖、抑制细胞凋亡和诱导成骨细胞分化[37]。miR-134-5p通过直接靶向丝裂原活化蛋白激酶信号通路激活提高磷酸化p38和磷酸化细胞外信号调节激酶的丰度水平,调节破骨细胞分化[38]。以上研究表明,miRNA与细胞信号通路的相互作用可能在SINOF发生和发展中起到关键的调控作用。 miRNA的表达和活性可以受到靶mRNA的影响,通过一种称为“目标导向的miRNA降解”机制,其中miRNA与高度互补的靶mRNA结合后被降解[39],这种机制为miRNA的调控增加了另一层复杂性,并可能影响miRNA在疾病中的功能。德州农工大学张秀任教授团队的研究表明,无序蛋白富含丝氨酸蛋白介导的相分离现象在RNA m6A甲基化修饰与miRNA生成这2个关键RNA代谢过程之间存在相互调控机制[40]。 2.3 miRNA参与SINOF的病理学 股骨头缺血性坏死是由于长期使用糖皮质激素引起的股骨头血供障碍和骨组织死亡,miRNA在这一病理过程中扮演着关键角色,通过调控成骨细胞和破骨细胞的分化以及骨代谢机制影响股骨头坏死的病程进展。另外,miRNA还参与调节细胞凋亡,这对于股骨头坏死的发生发展同样重要。miR-542-3p通过抑制骨形态发生蛋白7及其下游信号传导来抑制成骨分化并促进成骨细胞凋亡[41]。在类固醇诱导的股骨头缺血性坏死患者中,miR-206的表达水平增加,而程序性细胞死亡因子4的表达受到抑制,并且miR-206的过表达抑制程序性细胞死亡因子4、碱性磷酸酶和B细胞淋巴瘤2的表达,诱导成骨细胞凋亡,进而引发股骨头缺血性坏死的发生[42]。 在SINOF中,miRNA在血管损伤、炎症反应、骨代谢紊乱和骨细胞凋亡中的调控作用,见图4。"
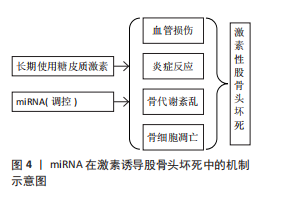

2.3.1 血管损伤 在SINOF中血管损伤是一个关键的病理过程,而miRNA在其中扮演着重要的调控角色。最新的研究揭示了miRNA在血管损伤中的调控机制,特别是在血管内皮细胞凋亡、炎症反应和血管稳态中的作用。miRNA通过调节特定基因的表达来影响血管内皮细胞的凋亡,例如:miR-99a能够抑制高胰岛素的促血管平滑肌细胞增殖效应,而miR-106b-5p过表达可以通过与磷酸酶和张力蛋白同源物的3’非翻译区直接相互作用,降低磷酸酶和张力蛋白同源物表达,进而增加磷脂酰肌醇-3激酶/蛋白激酶B信号通路活性,抑制内皮细胞凋亡并促进内皮细胞增殖[43]。这些发现表明miRNA可以作为内皮细胞凋亡的调节因子,进而影响血管损伤的进程。miRNA在血管内皮细胞的炎症反应中也起着关键作用。内皮细胞凋亡是血管内皮损伤的始动因素,是多种心血管疾病的病理基础,miRNA通过与特异性靶基因mRNA的3’非翻译区结合调控基因的表达,参与内皮细胞功能调节。miR-155在内皮细胞中的过表达抑制了骨形态发生蛋白信号通路,影响成骨分化[44]。力学敏感性miRNA在微重力环境导致的血管平滑肌细胞表型转换中的作用也不容忽视,而血管平滑肌细胞表型转换是血管损伤后修复、高血压、动脉粥样硬化等众多血管疾病发生与发展中的关键起始步骤。研究证实,生长因子、转录因子、缺氧、机械应力等因素能够调节血管平滑肌细胞的表型转换,而miRNA广泛参与了血管平滑肌细胞表型转换的调节。miRNA在血管内皮细胞损伤防治动脉粥样硬化的作用机制中也有所涉及。中药通过miRNA调控血管内皮细胞损伤,从而在动脉粥样硬化的防治中发挥作用,例如丹酚通过miR-21在载脂蛋白E缺乏的小鼠中增加内皮一氧化氮产生并抑制动脉粥样硬化[45],miR-1在血管内皮细胞损伤中同样起作用,可能通过影响炎症和动脉粥样硬化的进程[46]。 2.3.2 炎症反应 miRNA在炎症反应中扮演着复杂的角色,它们可以通过靶向特定的炎症相关基因来调节炎症过程。miR-146a在多种慢性骨病中对骨相关细胞的增殖、分化、炎症和凋亡具有调控作用。在炎症条件下,miR-146a水平会发生变化且其水平受到人关节软骨细胞机械负荷的调节,miR-146a通过核因子κB引发炎症信号通路的负反馈效应[47-48],直接下调促炎因子,使得白细胞介素和肿瘤坏死因子表达降低。在SINOF中,miR-146a可能通过调节炎症反应和骨细胞功能来影响骨代谢。miR-146a通过抑制Notch1/白细胞介素6信号通路来防止关节软骨变性,保护关节软骨,这可能对SINOF中的骨组织保护具有积极作用。另外,miRNA能够结合到靶基因的启动子区域促进靶基因的转录,这一机制可能是体内互转化的关键因素。Toll样受体(toll-like receptor,TLR)作为模式识别受体可以识别病原体相关分子模式,进而激活胞内信号转导级联反应,使炎性递质转录表达,引起炎症反应[49]。 多种miRNA对TLR信号通路具有调控作用,miRNA通过与靶mRNA的3’非翻译区互补配对结合使mRNA降解或抑制其翻译,从而发挥抑制靶mRNA的作用。在SINOF的病理过程中,血管内皮细胞的炎症反应是关键的起始因素。丹皮酚可能通过上调THP-1细胞外泌体中miR-223的表达抑制下游STAT3的信号通路,从而抑制内皮黏附作用,改善内皮细胞炎症反应[50],表明miRNA在调节血管内皮细胞的炎症反应中起着至关重要的作用。一些在炎症过程中诱导的蛋白质可以调节miRNA的加工,如腺苷脱氨酶能够在miRNA前体内插入突变从而改变miRNA的特异性靶点,这种调节机制可能对SINOF中的炎症反应和血管损伤具有重要影响。 2.3.3 骨细胞分化及骨代谢 miRNA参与调控成骨细胞与破骨细胞的分化,从而对股骨头坏死病程进展起到不同程度的影响。成骨细胞和破骨细胞是骨代谢过程中2个关键细胞类型,成骨细胞负责骨质的形成,而破骨细胞则负责骨质的吸收,它们之间的平衡对于维持骨骼健康至关重要。miRNA通过精确调控特定基因的表达影响骨髓间充质干细胞的成骨分化过程,例如:miR-4725-3p可能通过靶向抑制SP1介导的转化生长因子β信号通路参与SINOF的发病机制,miR-127-5p通过抑制磷酸酶和张力蛋白同源物表达间接增加蛋白激酶B的表达,从而促进骨髓间充质干细胞的成骨分化,这些发现不仅揭示了miRNA在骨细胞分化中的关键作用,而且为理解miRNA在SINOF中的调控机制提供了新的视角。有研究证实了在小鼠体内敲除由Ⅱ型胶原α1链介导的Dicer酶会导致严重的骨生成障碍[51],有研究进一步验证了成骨细胞中Dicer酶的功能,强调了miRNA在间充质干细胞成骨分化中的关键作用[52]。miRNA的双向性作用机制(即同时抑制和促进基因表达)可能是体内细胞表型转化的关键因素,对间充质干细胞成骨作用具有正反两面的影响[53]。 有研究表明,miR-33-5p能够通过靶向高迁移率族蛋白A2基因来促进成骨细胞分化,这可能有助于恢复SINOF中受损的骨形成过程;在体外实验中,miR-33-5p能够明显促进小鼠成骨前体细胞系MC3T3-E1的成骨分化;将miR-33-5p投入小鼠后肢卸载模型后,能够部分恢复由机械卸载导致的骨质减少,表明miR-33-5p可能通过影响成骨细胞的功能来对抗骨质减少[54-55],靶向投递miR-33-5p的模拟物可以成为一种治疗病理性骨质减少的潜在治疗策略。 在骨代谢紊乱方面,miRNA通过靶向作用于相关成骨因子或骨吸收因子广泛参与骨组织细胞增殖及分化的调控。运动和机械应力能够诱导骨髓间充质干细胞及成骨细胞中的miRNA差异表达,并通过miRNA参与成骨分化的调控[47-48]。特别是miR-138-5p在运动及机械应力改善骨代谢过程中发挥着重要的调控作用,这可能对SINOF的骨代谢紊乱有重要影响[56-58]。 2.3.4 骨细胞凋亡 miRNA通过靶向特定基因的表达影响骨细胞的生存和凋亡。研究表明,miR-34a的表达在早期骨关节炎患者的软骨细胞中显著增加,过表达miR-34a可以促进软骨细胞的凋亡,而沉默miR-34a基因则能显著减少这些细胞的凋亡,表明miR-34a在调控骨细胞凋亡中具有重要的促凋亡作用[59]。miR-21在SINOF患者的骨组织中上调,它通过抑制靶基因磷酸酶和张力蛋白同源物来促进细胞凋亡[60],通过调节FNDC5/鸢尾素的表达来影响骨组织细胞焦亡和成骨细胞分化,这可能对SINOF中的血管损伤有重要影响[61]。氧化应激也是导致骨细胞凋亡的重要机制[62]。研究发现miR-146a在氧化应激条件下的表达增加,并能促进软骨细胞的凋亡,这一过程可能与氧自由基的产生有关,氧自由基可以调控miRNA的表达,从而影响骨细胞的生存状态[63]。通过调节这些miRNA的表达可能为SINOF治疗提供新的思路。低氧状态下的低氧诱导因子1α能够促进骨细胞的凋亡。在体外实验中,氯化钴处理的小鼠成骨细胞系MLO-Y4显示出氧诱导因子1α的上调与促凋亡因子Caspase-3的表达增加相关,提示氧诱导因子1α在低氧条件下通过促进骨细胞凋亡而影响骨代谢[64]。这些研究结果进一步强调了miRNA与氧诱导因子1α在骨细胞凋亡中的相互作用,为理解SINOF的病理机制提供了新的视角。 此外,miRNA的生物学功能不仅限于基因沉默,它们还参与细胞分化、增殖和生存等多条基因表达通路的调控,对生物体的发育和功能至关重要。 2.4 miRNA作为SINOF的生物标志物 miRNA作为生物标志物在SINOF中的潜力正受到越来越多的关注。特定的miRNA表达模式与SINOF的发病机制密切相关,这些miRNA不仅参与了骨细胞凋亡、血管损伤、炎症反应和骨代谢紊乱的调控,而且它们的表达水平在SINOF患者中发生了显著变化。有研究表明,miR-146a敲除小鼠骨质疏松模型中骨保护素的表达水平提升,而miR-21敲除小鼠表现出核因子κB受体活化因子配体的升高和骨保护素的降低[65],表明miRNA的表达变化与SINOF的病理过程有关,可能作为疾病活动的生物标志物。miRNA能够通过外泌体从细胞中释放并进入体液,这使得miRNA可以作为血液、尿液等体液中的生物标志物,进行疾病的早期诊断和治疗反应监测。miRNA表达具有组织特异性和发育阶段特异性,不同体液中的miRNA也能通过PCR方法被检测出来,这使得miRNA成为无创性标志物。研究表明,miRNA表达在不同人群中存在差异,这可能与性别、年龄、遗传背景和环境因素有关[66],因此,miRNA作为SINOF的生物标志物需要在不同人群中进行验证,以确定其表达模式是否具有普遍性或特定人群的差异性。miRNA作为肿瘤标志物潜力的研究也表明,miRNA在癌细胞和组织有特异性表达谱,而且可以进入体液循环,这增加了miRNA作为诊断标记的潜力[67]。随着新一代肿瘤标志物的研究进展,miRNA的稳定性和组织特异性使其成为理想的生物标志物候选物,它们在癌细胞和组织中有特异性表达谱,并且可以进入体液循环,这些特性使得miRNA不仅在理论上具有作为SINOF生物标志物的潜力,而且在实际应用中也显示出巨大的潜力[68-71]。 2.5 miRNA在SINOF治疗中的潜力 研究表明,miR-214通过靶向ATF4抑制骨形成[72]。miRNA不仅在SINOF的病理过程中扮演着关键角色,而且在治疗策略中显示出巨大的潜力,虽然搜索结果中没有直接提及SINOF的临床前实验,但提供了其他疾病领域中miRNA治疗的临床前研究进展。例如在非小细胞肺癌小鼠异种移植模型中,脂质体包裹的miR-34 mimics通过皮下或静脉注射给肺癌小鼠后肿瘤生长得到明显抑制,并且没有观察到载体介导的免疫刺激不良反应[73-74],为miRNA在SINOF治疗中的临床前实验提供了方法学参考。当前,小干扰RNA和信使核糖核酸治疗方法在临床上的领先地位依然稳固,但miRNA作为新兴疗法仍有潜力成为未来基因治疗领域的重要组成部分。近期有研究表明,工程化细胞载体递送的miR-138-5p能够通过DNMT3A/Rhebl1轴增强线粒体自噬并保护缺氧损伤的神经元[75],这表明通过特定miRNA的递送可以改善神经元的线粒体功能,为SINOF等缺血性疾病的治疗提供了新的思路。miRNA的治疗潜力也体现在作为药物递送工具的应用上。中国科学院动物研究所的研究团队开发了一种器官和细胞双重特异性的mRNA-LNP递送平台,该平台通过在mRNA骨架中引入特定的miRNA靶点反向互补序列,实现了mRNA在靶组织特定细胞类型中的受控蛋白质表达[76],这一技术的进步为miRNA的精准递送和治疗应用提供了新的可能,尤其是在SINOF等需要精确调控基因表达的疾病中。尽管miRNA治疗在临床上的应用还面临诸多挑战,如脱靶效应、递送和安全性等问题,但随着对miRNA生物学作用的深入理解,以及递送技术和靶向技术的进步,miRNA有望在未来的治疗中占据一席之地,为SINOF治疗提供新的策略和希望。"

| [1] 白锐,赵振群,刘万林,等.糖皮质激素诱导缺氧状态及程序性细胞死亡在股骨头坏死中调控机制[Z]. 内蒙古医科大学第二附属医院,2023. [2] 孔令跃,刘万林,任逸众.激素性股骨头缺血坏死与Dickkopf-1及细胞凋亡的关系[J].中国组织工程研究,2017,21(28):4436-4441. [3] TYC KM, WONG A, SCOTT RT JR, et al. Analysis of DNA variants in miRNAs and miRNA 3’UTR binding sites in female infertility patients. Lab Invest. 2021;101(4):503-512. [4] BARTEL DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 200;116(2): 281-297. [5] NOVINA CD, SHARP PA. The RNAi revolution. Nature. 2004;430(6996):161-164. [6] LONG D, LEE R, WILLIAMS P, et al. Potent effect of target structure on microRNA function. Nat Struct Mol Biol. 2007;14(4):287-294. [7] KOBAYASHI T, LU J, COBB BS, et al. Dicer-dependent pathways regulate chondrocyte proliferation and differentiation. Proc Natl Acad Sci U S A. 2008;105(6):1949-1954. [8] PALMIERI A, PEZZETTI F, BRUNELLI G, et al. Medpor regulates osteoblast’s microRNAs. Biomed Mater Eng. 2008;18(2):91-97. [9] PALMIERI A, PEZZETTI F, SPINELLI G, et al. PerioGlas regulates osteoblast RNA interfering. J Prosthodont. 2008;17(7): 522-526. [10] 白锐,刘万林.激素性股骨头缺血坏死病因学机制研究进展[J].内蒙古医学杂志,2010, 42(8):955-958. [11] 赵振群,刘万林.激素性股骨头缺血坏死发病机理基因学研究进展[J].内蒙古医学杂志, 2010,42(7): 804-808. [12] LIAN JB, STEIN GS, VAN WIJNEN AJ, et al. MicroRNA control of bone formation and homeostasis. Nat Rev Endocrinol. 2012;8(4): 212-227. [13] TAIPALEENMÄKI H, BJERRE HOKLAND L, CHEN L, et al. Mechanisms in endocrinology: micro-RNAs: targets for enhancing osteoblast differentiation and bone formation. Eur J Endocrinol. 2012;166(3):359-371. [14] ALEČKOVIĆ M, KANG Y. Bone marrow stroma-derived miRNAs as regulators, biomarkers and therapeutic targets of bone metastasis. Bonekey Rep. 2015;4:671. [15] 刘万林.自噬基因Beclin1与MAP1LC3在激素性股骨头缺血坏死中的作用及3-MA对其影响的实验研究 [D].呼和浩特:内蒙古医科大学第二附属医院,2018. [16] 赵振群.低氧诱导因子-1与自噬相关基因MAP1LC3在激素性股骨头缺血坏死中作用的实验研究[D].呼和浩特:内蒙古医科大学第二附属医院,2018. [17] DIENER C, KELLER A, MEESE E. Emerging concepts of miRNA therapeutics: from cells to clinic. Trends Genet. 2022;38(6):613-626. [18] NOGAMI M, MIYAMOTO K, HAYAKAWA-YANO Y, et al. DGCR8-dependent efficient pri-miRNA processing of human pri-miR-9-2. J Biol Chem. 2021;296:100409. [19] LI Z, IIDA J, SHIIMORI M, et al. Exportin-5 binding precedes 5’- and 3’-end processing of tRNA precursors in Drosophila. J Biol Chem. 2024;300(9):107632. [20] MCGEARY SE, LIN KS, SHI CY, et al. The biochemical basis of microRNA targeting efficacy. Science. 2019;366(6472):eaav1741. [21] NEWMAN MA, THOMSON JM, HAMMOND SM. Lin-28 interaction with the Let-7 precursor loop mediates regulated microRNA processing. RNA. 2008;14(8):1539-1549. [22] RYBAK A, FUCHS H, SMIRNOVA L, et al. A feedback loop comprising lin-28 and let-7 controls pre-let-7 maturation during neural stem-cell commitment. Nat Cell Biol. 2008;10(8):987-993. [23] ZHAO L, HUANG J, ZHU Y, et al. miR-33-5p knockdown attenuates abdominal aortic aneurysm progression via promoting target adenosine triphosphate-binding cassette transporter A1 expression and activating the PI3K/Akt signaling pathway. Perfusion. 2020;35(1):57-65. [24] EMMRICH S, RASCHE M, SCHÖNING J, et al. miR-99a/100~125b tricistrons regulate hematopoietic stem and progenitor cell homeostasis by shifting the balance between TGFβ and Wnt signaling. Genes Dev. 2014; 28(8):858-874. [25] RONG L, XU Y, ZHANG K, et al. HNRNPA2B1 inhibited SFRP2 and activated Wnt-β/catenin via m6A-mediated miR-106b-5p processing to aggravate stemness in lung adenocarcinoma. Pathol Res Pract. 2022; 233:153794. [26] XU Y, ZHANG C, CAI D, et al. Exosomal miR-155-5p drives widespread macrophage M1 polarization in hypervirulent Klebsiella pneumoniae-induced acute lung injury via the MSK1/p38-MAPK axis. Cell Mol Biol Lett. 2023;28(1):92. [27] XIA C, ZHU K, ZHANG Y, et al. Serum exosome-derived miR-146a-3p promotes macrophage M2 polarization in allergic rhinitis by targeting VAV3 via PI3K/AKT/mTOR pathway. Int Immunopharmacol. 2023; 124(Pt B):110997. [28] ZEBOUDJ L, SIDERIS-LAMPRETSAS G, SILVA R, et al. Silencing miR-21-5p in sensory neurons reverses neuropathic allodynia via activation of TGF-β-related pathway in macrophages. J Clin Invest. 2023;133(11):e164472. [29] ONYIDO EK, SWEENEY E, NATERI AS. Wnt-signalling pathways and microRNAs network in carcinogenesis: experimental and bioinformatics approaches. Mol Cancer. 2016; 15(1):56. [30] WANG Z, LI Y, KONG D, et al. Cross-talk between miRNA and Notch signaling pathways in tumor development and progression. Cancer Lett. 2010;292(2):141-148. [31] 李文超,肖骋风,曾朝阳,等.微RNA的发现及其意义:2024年诺贝尔生理学或医学奖的启示[J].生物化学与生物物理进展, 2024,51(12):3061-3072. [32] THOMSON DW, DINGER ME. Endogenous microRNA sponges: evidence and controversy. Nat Rev Genet. 2016;17(5):272-283. [33] 赵健志,李欢欢,刘柯欣,等.microRNA与靶基因相互调控机制的研究进展[J].科学通报,2021,66(24):3123-3140. [34] LI H, QU L. Correlation of miRNA-21 and blood Cr levels with tumor infiltration and distant metastasis in renal cancer patients. Cell Mol Biol (Noisy-le-grand). 2022;68(5):117-123. [35] DIAO W, QIAN Q, SHENG G, et al. Triclosan targets miR-144 abnormal expression to induce neurodevelopmental toxicity mediated by activating PKC/MAPK signaling pathway. J Hazard Mater. 2022;431:128560. [36] NING W, LI S, YANG W, et al. Blocking exosomal miRNA-153-3p derived from bone marrow mesenchymal stem cells ameliorates hypoxia-induced myocardial and microvascular damage by targeting the ANGPT1-mediated VEGF/PI3k/Akt/eNOS pathway. Cell Signal. 2021;77:109812. [37] TANG L, LU W, HUANG J, et al. miR-144 promotes the proliferation and differentiation of bone mesenchymal stem cells by downregulating the expression of SFRP1. Mol Med Rep. 2019;20(1):270-280. [38] HUANG M, WANG Y, WANG Z, et al. miR-134-5p inhibits osteoclastogenesis through a novel miR-134-5p/Itgb1/MAPK pathway. J Biol Chem. 2022;298(7):102116. [39] GHINI F, RUBOLINO C, CLIMENT M, et al. Endogenous transcripts control miRNA levels and activity in mammalian cells by target-directed miRNA degradation. Nat Commun. 2018; 9(1):3119. [40] FENG H, YUAN X, WU S, et al. Effects of writers, erasers and readers within miRNA-related m6A modification in cancers. Cell Prolif. 2023;56(1):e13340. [41] KUREEL J, DIXIT M, TYAGI AM, et al. miR-542-3p suppresses osteoblast cell proliferation and differentiation, targets BMP-7 signaling and inhibits bone formation. Cell Death Dis. 2014;5(2):e1050. [42] ZHANG Z, JIN A, YAN D. MicroRNA-206 contributes to the progression of steroid‑induced avascular necrosis of the femoral head by inducing osteoblast apoptosis by suppressing programmed cell death 4. Mol Med Rep. 2018;17(1):801-808. [43] 刘佳,胡桃红,袁敏,等.微小RNA调控血管内皮细胞凋亡机制的研究进展[J].解放军医学院学报,2018,39(9):826-829. [44] 张斌,谢满江.力学敏感性microRNA在微重力环境致血管平滑肌细胞表型转换中的作用[J].心脏杂志,2019,31(2):190-194. [45] YANG D, YANG Z, CHEN L, et al. Dihydromyricetin increases endothelial nitric oxide production and inhibits atherosclerosis through microRNA-21 in apolipoprotein E-deficient mice. J Cell Mol Med. 2020;24(10): 5911-5925. [46] JIANG F, CHEN Q, WANG W, et al. Hepatocyte-derived extracellular vesicles promote endothelial inflammation and atherogenesis via microRNA-1. J Hepatol. 2020;72(1):156-166. [47] JIANG C, LIN Y, SHAN H, et al. miR-146a Protects against Staphylococcus aureus-Induced Osteomyelitis by Regulating Inflammation and Osteogenesis. ACS Infect Dis. 2022;8(5):918-927. [48] SUN J, LIAO Z, LI Z, et al. Down-regulation miR-146a-5p in Schwann cell-derived exosomes induced macrophage M1 polarization by impairing the inhibition on TRAF6/NF-κB pathway after peripheral nerve injury. Exp Neurol. 2023;362:114295. [49] XIAO L, LIU Y, WANG N. New paradigms in inflammatory signaling in vascular endothelial cells. Am J Physiol Heart Circ Physiol. 2014; 306(3):H317-325. [50] 刘丹丹,秦合伟,高洋,等.中药通过miRNA调控血管内皮细胞损伤防治动脉粥样硬化的作用机制研究进展[J].中国药房, 2023,34(12):1524-1528. [51] 韩杰,林智宇,徐志为,等.miRNA通过骨代谢机制干预股骨头坏死[J].中国组织工程研究,2023,27(32): 5238-5248. [52] YING W, RIOPEL M, BANDYOPADHYAY G, et al. Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity. Cell. 2017;171(2):372-384.e312. [53] YANG C, LIU X, ZHAO K, et al. miRNA-21 promotes osteogenesis via the PTEN/PI3K/Akt/HIF-1α pathway and enhances bone regeneration in critical size defects. Stem Cell Res Ther. 2019; 10(1):65. [54] WANG H, SUN Z, WANG Y, et al. miR-33-5p, a novel mechano-sensitive microRNA promotes osteoblast differentiation by targeting Hmga2. Sci Rep. 2016;6:23170. [55] WANG H, HU Z, SHI F, et al. Osteoblast-targeted delivery of miR-33-5p attenuates osteopenia development induced by mechanical unloading in mice. Cell Death Dis. 2018;9(2):170. [56] CHEN Z, HUAI Y, CHEN G, et al. MiR-138-5p Targets MACF1 to Aggravate Aging-related Bone Loss. Int J Biol Sci. 2022;18(13): 4837-4852. [57] CHEN Z, ZHAO F, LIANG C, et al. Silencing of miR-138-5p sensitizes bone anabolic action to mechanical stimuli. Theranostics. 2020; 10(26):12263-12278. [58] CHUNLEI H, CHANG Z, SHENG L, et al. Down-regulation of MiR-138-5p Protects Chondrocytes ATDC5 and CHON-001 from IL-1 β-induced Inflammation Via Up-regulating SOX9. Curr Pharm Des. 2020;25(43):4613-4621. [59] 赵园园,代思明,张跃,等.miRNAs对骨关节炎调控的研究进展[J].中华医学杂志, 2019,99(3):235-237. [60] HAO Y, LU C, ZHANG B, et al. CircPVT1 up-regulation attenuates steroid-induced osteonecrosis of the femoral head through regulating miR-21-5p-mediated Smad7/TGFβ signalling pathway. J Cell Mol Med. 2021; 25(10):4608-4622. [61] KIM H, WRANN CD, JEDRYCHOWSKI M, et al. Irisin Mediates Effects on Bone and Fat via αV Integrin Receptors. Cell. 2018;175(7):1756-1768.e17. [62] 赵振群,张志峰,刘万林,等.激素性股骨头坏死过程中低氧诱导因子1α与骨细胞凋亡[J].中国组织工程研究,2015,19(51):8201-8207. [63] ZHAO G, GU W. Effects of miR-146a-5p on chondrocyte interleukin-1β-induced inflammation and apoptosis involving thioredoxin interacting protein regulation. J Int Med Res. 2020;48(11): 300060520969550. [64] 宋熙雯,唐燚,宋朝卉,等.低氧状态下HIF-1α对骨细胞凋亡的影响[J].口腔颌面外科杂志,2020,30(6):369-375. [65] ZHOU D, YANG D. [miRNA Is Involved in the Pathogenesis of Multiple Diseases by Targeting Osteoprotegerin]. Sichuan Da Xue Xue Bao Yi Xue Ban. 2024;55(3):777-782. [66] 李文娜,秦怡,彭伟盼.MicroRNA检测方法研究进展[J].传感器与微系统,2024,43(3):1-5+13. [67] What will it take to get miRNA therapies to market? Nat Biotechnol. 2024;42(11):1623-1624. [68] AKHLAGHIPOUR I, TAGHEHCHIAN N, ZANGOUEI AS, et al. MicroRNA-377: A therapeutic and diagnostic tumor marker. Int J Biol Macromol 2023;226:1226-1235. [69] GAHLAWAT AW, WITTE T, SINN P, et al. Circulating cf-miRNA as a more appropriate surrogate liquid biopsy marker than cfDNA for ovarian cancer. Sci Rep. 2023;13(1): 5503. [70] SWELLAM M, ZAHRAN RFK, GHONEM SA, et al. Serum MiRNA-27a as potential diagnostic nucleic marker for breast cancer. Arch Physiol Biochem. 2021;127(1):90-96. [71] ZHANG M, BAI X, ZENG X, et al. circRNA-miRNA-mRNA in breast cancer. Clin Chim Acta. 2021;523:120-130. [72] WANG X, GUO B, LI Q, et al. miR-214 targets ATF4 to inhibit bone formation. Nat Med. 2013;19(1):93-100. [73] WIGGINS JF, RUFFINO L, KELNAR K, et al. Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34. Cancer Res. 2010;70(14): 5923-5930. [74] TRANG P, WIGGINS JF, DAIGE CL, et al. Systemic delivery of tumor suppressor microRNA mimics using a neutral lipid emulsion inhibits lung tumors in mice. Mol Ther.2011;19(6):1116-1122. [75] ZHU X, LIU Q, ZHU F, et al. An engineered cellular carrier delivers miR-138-5p to enhance mitophagy and protect hypoxic-injured neurons via the DNMT3A/Rhebl1 axis. Acta biomater. 2024;186:424-438. [76] FEI Y, YU X, LIU P, et al. Simplified Lipid Nanoparticles for Tissue- And Cell-Targeted mRNA Delivery Facilitate Precision Tumor Therapy in a Lung Metastasis Mouse Model. Adv Mater. 2024;36(48):e2409812. |
| [1] | Sun Yajie, Zhao Xinchen, Bo Shuangling. Spatiotemporal expression of bone morphologic protein 7 in mouse kidney development [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1156-1161. |
| [2] | Li Haojing, Wang Xin, Song Chenglin, Zhang Shengnan, Chen Yunxin. Therapeutic efficacy of extracorporeal shock wave therapy in the upper trapezius muscle area combined with exercise control training in patients with chronic non-specific neck pain [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1162-1170. |
| [3] | Liu Yu, Lei Senlin, Zhou Jintao, Liu Hui, Li Xianhui. Mechanisms by which aerobic and resistance exercises improve obesity-related cognitive impairment [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1171-1183. |
| [4] | Yu Huifen, Mo Licun, Cheng Leping. The position and role of 5-hydroxytryptamine in the repair of tissue injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1196-1206. |
| [5] | Bu Yangyang, Ning Xinli, Zhao Chen. Intra-articular injections for the treatment of osteoarthritis of the temporomandibular joint: different drugs with multiple combined treatment options [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1215-1224. |
| [6] | Wen Fan, Xiang Yang, Zhu Huan, Tuo Yanfang, Li Feng. Exercise improves microvascular function in patients with type 2 diabetes [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1225-1235. |
| [7] | Liu Xinyue, Li Chunnian, Li Yizhuo, Xu Shifang. Regeneration and repair of oral alveolar bone defects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1247-1259. |
| [8] | Leng Xiaoxuan, Zhao Yuxin, Liu Xihua. Effects of different neuromodulatory stimulation modalities on non-motor symptoms in Parkinson’s patients: a network meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1282-1293. |
| [9] | Wen Xiaolong, Weng Xiquan, Feng Yao, Cao Wenyan, Liu Yuqian, Wang Haitao. Effects of inflammation on serum hepcidin and iron metabolism related parameters in patients with type 2 diabetes mellitus: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1294-1301. |
| [10] | Yang Zeyu, Zhi Liang, Wang Jia, Zhang Jingyi, Zhang Qingfang, Wang Yulong, Long Jianjun. A visualized analysis of research hotspots in high-frequency repetitive transcranial magnetic stimulation from the macroscopic perspective [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1320-1330. |
| [11] | Yang Zhijie, Zhao Rui, Yang Haolin, Li Xiaoyun, Li Yangbo, Huang Jiachun, Lin Yanping, Wan Lei, HuangHongxing. Postmenopausal osteoporosis: predictive values of muscle mass, grip strength, and appendicular skeletal muscle index [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1073-1080. |
| [12] | Yin Yongcheng, Zhao Xiangrui, Yang Zhijie, Li Zheng, Li Fang, Ning Bin. Effect and mechanism of peroxiredoxin 1 in microglial inflammation after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1106-1113. |
| [13] | Zhang Jiuxuan, Zhang Jinnan, Sui Xiaofan, Pei Xiaxia, Wei Jianhong, Su Qiang, Li Tian. Effects of ammonia poisoning on cognitive behavior and hippocampal synaptic damage in mice [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1122-1128. |
| [14] | Chen Yixian, Chen Chen, Lu Liheng, Tang Jinpeng, Yu Xiaowei. Triptolide in the treatment of osteoarthritis: network pharmacology analysis and animal model validation [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 805-815. |
| [15] | Yan Chengbo, Luo Qiuchi, Fan Jiabing, Gu Yeting, Deng Qian, Zhang Junmei. Effect of type 2 diabetes mellitus on orthodontic tooth movement and bone microstructure parameters on the tension side in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 824-831. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||