Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (27): 4405-4412.doi: 10.12307/2024.517
Previous Articles Next Articles
Mechanism and potential of vitamin C supplementation in sarcopenia prevention and treatment
Liu Xu1, Chen Bo1, Ning Ke1, Chen Xiaohong2
- 1Shenyang Sport University, Shenyang 110102, Liaoning Province, China; 2Jinqiu Hospital of Liaoning, Shenyang 110016, Liaoning Province, China
-
Received:2023-09-18Accepted:2023-10-30Online:2024-09-28Published:2024-01-29 -
Contact:Chen Xiaohong, MD, Professor, Doctoral supervisor, Jinqiu Hospital of Liaoning, Shenyang 110016, Liaoning Province, China -
About author:Liu Xu, Master candidate, Shenyang Sport University, Shenyang 110102, Liaoning Province, China -
Supported by:Liaoning Province Health and Wellness Appropriate Technology Promotion Project (to CXH)
CLC Number:
Cite this article
Liu Xu, Chen Bo, Ning Ke, Chen Xiaohong. Mechanism and potential of vitamin C supplementation in sarcopenia prevention and treatment[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(27): 4405-4412.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
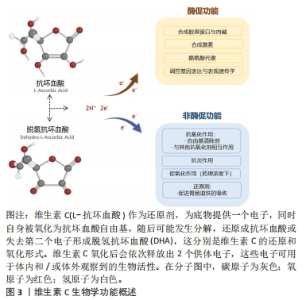
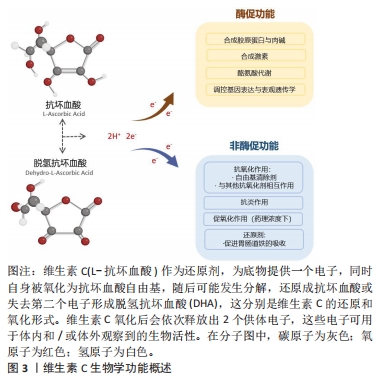
2.1 维生素C概述 维生素C又名抗坏血酸,是人体所必需的营养物质,自1933年首次合成以来,维生素C对人体健康的潜在影响一直是研究的主题[17]。人类不具有合成抗坏血酸的能力,必须依靠从膳食中摄取抗坏血酸来获得充足的供应,包括青椒、西红柿和猕猴桃等水果蔬菜,都是维生素C的丰富膳食来源[18]。摄入的维生素C首经肠道吸收,并随血液输送到各个外周器官,最终经肾脏排泄、重吸收,组织中的维生素C浓度取决于上述的相关过程[19]。维生素C的吸收、分布主要依靠钠依赖性维生素C转运体(sodium-coupled vitamin C transporters,SVCTs)家族处理,包括SVCT1和SVCT2,研究显示,抗坏血酸主要通过 SVCT2 转运到肌肉细胞内[20]。 维生素C具有广泛的生物学效应,发挥酶促和非酶促功能,参与多种生理活动,见图3。参与肉碱和胶原蛋白合成是维生素C最著名的酶促功能(双加氧酶),维生素C还参与激素(去甲肾上腺素/肾上腺素和肽类激素)合成、基因转录、通过不同机制(DNA和组蛋白的去甲基化、转录因子、tRNA和核糖体蛋白的羟基化)调节翻译以及酪氨酸代谢,这些都依赖其酶促反应作用[21]。作为一种化学还原剂,维生素C还具有促进胃肠道对铁的吸收作用[22]。在非酶促功能方面,维生素C以其强大的抗氧化特性而闻名,可通过多种途径发挥抗氧化功能,包括清除自由基和活性氧、抑制活性氧生成、激活转录因子NF-E2相关因子2(nuclear factor E2 related factor 2,Nrf2)信号通路以提高细胞内抗氧化防御能力,并能够刺激超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶等内源性抗氧化酶的生物合成和活化[23]。维生素C的抗氧化作用不仅可以减少活性氧对肌细胞的氧化损伤,还有助于减少循环中炎症细胞因子的浓度,发挥抗炎作用[24],这主要是通过调节核转录因子κB/肿瘤坏死因子α途径来实现的[23]。此外,维生素C还可以与生育酚(维生素E的活性形式)、谷胱甘肽和硫氧还蛋白等低分子量抗氧化剂相互作用,维生素C虽然是一种亲水性分子,但它可以在脂质/水界面上与生育酚及其衍生物发生反应,在氧化条件下,生育酚会中和攻击细胞膜成分的自由基,而后自身被氧化成生育酚自由基,失去抗氧化能力,但细胞质中的维生素C可以恢复生育酚的还原形式,此过程中,维生素C自身会氧化成抗坏血酸自由基,又可被谷胱甘肽和硫氧还蛋白等不溶于脂质的分子还原,从而形成一个联合的抗氧化系统[25]。总之,维生素C可以直接或间接地对DNA、蛋白质和脂质等生物大分子发挥抗氧化作用,使其免受氧化损伤,进而预防炎症反应和细胞凋亡的发生。"

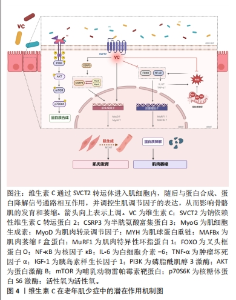
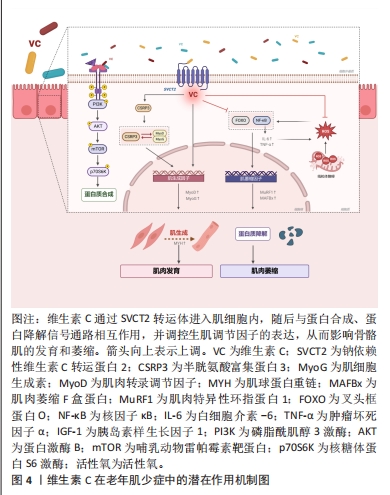
2.2 维生素C在老年肌少症中的防治研究 2.2.1 维生素C缺乏与老年肌少症的关系 有研究证据表明,老年人维生素C摄入不足可能会影响肌少症的进展。维生素C缺乏现象在全球范围内普遍存在,特别是在低收入群体和中低收入国家,目前国际上还没有对维生素C缺乏的临界值达成共识,但通常认为血浆或血清中维生素C浓度低于11 μmol/L为严重缺乏,11-23 μmol/L为边缘性缺乏,23-49 μmol/L为维生素C不足[26-27]。据研究显示,中国80岁及以上的老年人群每天膳食维生素C的摄入量严重不足,低于平均需要量的比例超过60%,这意味着高龄老人面临着严重的维生素C缺乏风险[28]。年龄增长与维生素C缺乏症的患病率呈正相关,影响个体体内维生素C水平的因素主要来自膳食摄入和补充剂的使用。研究发现,经常补充维生素C的人通常体内具有较高的维生素C水平,且罹患维生素C缺乏症的风险较低[29]。SON等[30]研究表明与达到推荐维生素C摄入量的人群相比,未达到推荐摄入量的受试者患有肌少症的风险增加32.6%。ABETE等[31]的调查发现,较高的维生素C摄入量与较低的肌少症患病风险有关。另有研究显示,膳食维生素C摄入量以及循环维生素C水平与老年人躯体功能以及肌肉量具有较强的相关性[32–35]。来自日本的一项横断面调查发现,在665名70岁以上的社区老年女性中,维生素C血浆浓度与她们的握力、睁眼单腿站立时间和步速呈正相关,在调整混杂因素后发现,较高的血浆维生素C水平与受试者较好的握力(P=0.000 4)和睁眼单腿站立能力(P=0.049)显著相关[33]。另一项纳入2 570名年龄在18-79岁女性受试者的横断面研究显示,增加维生素C摄入量与她们的肌肉质量指数(相对于体型的无脂肪质量)和肌肉力量(腿部爆发力)显著提高相关(Q5–Q1=2.0%–12.8%,P < 0.01–0.02)[34],提示摄入足量的维生素C可能是预防肌少症发展并确保健康老龄化的保护性因素,相关研究结果见表1。"

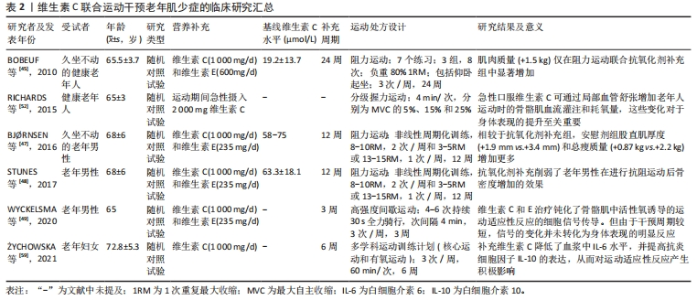
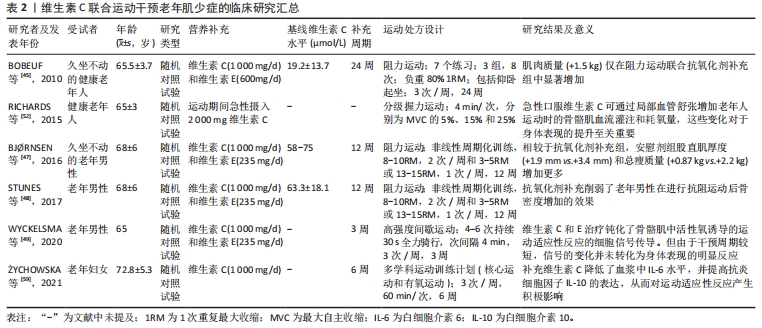
2.2.2 维生素C补充在老年肌少症治疗中的应用研究 目前营养补充和运动干预是治疗与年龄相关肌肉异常的基础措施。近年来,作为营养补充剂增加维生素C-摄入的相关研究显示,维生素C补充对老年人肌肉质量、功能和生活质量的改善具有积极作用。NASIMI等[36]研究发现,66名65岁及以上的老年肌少症患者每天接受含有500 mg维生素C的强化酸奶12周可显著提高其步速、握力、血清胰岛素样生长因子1浓度和生活质量,并降低血清中增加的C-反应蛋白浓度和脂质过氧化标志物丙二醛水平。慢性阻塞性肺疾病是一种常见的老年病,其进展与肌肉质量和肌肉功能进行性丧失有关,AHMADI等[37]研究发现,46例男性慢性阻塞性肺疾病患者(年龄50-70岁)每天接受含有685 mg维生素C的乳清饮料8周可显著提升其血清维生素C浓度,增加无脂肪质量和双手握力以及带来健康相关生活质量的改善,并降低血清中促炎细胞因子白细胞介素6水平。此外,PASSERIEUX等[38]观察到53例成年面肩肱型肌营养不良症患者在接受17周的维生素C(500 mg/d)治疗后,可以通过减少氧化应激和增强抗氧化防御能力来改善双侧股四头肌肌肉功能。但应该指出的是,上述研究均是采用营养复方,如维生素C联合维生素D、氨基酸或其他天然抗氧化物等形式进行干预,目前尚未见单独使用维生素C的证据。尽管如此,这些结果提示补充维生素C联合其他营养剂补充,可能通过改善机体氧化应激与炎症反应来延缓肌少症的进展。 近年来学者们对于将干细胞移植技术应用于肌少症的组织工程研究表现出日益增加的兴趣。维生素C似乎在创造有利的干细胞生态位和促使干细胞正确分化方面具有一定作用。证据表明,维生素C能够通过诱导更好的干细胞生态位来提高脂肪源性干细胞移植对敲除衰老标记蛋白30小鼠肌腱炎的治疗效果[39]。KIM等[40]研究发现通过抗氧化作用,维生素C可以增强脂肪源性干细胞对敲除衰老标记蛋白30小鼠肌肉撕裂的改善情况:维生素C处理组小鼠中央部肌纤维的平均尺寸显著高于维生素C缺乏组。另有研究显示,维生素C能够以剂量依赖性方式驱动小鼠中胚层来源的干细胞向肌细胞分化[41],提示维生素C还可能在肌少症的组织工程研究中具有重要的应用潜力。但目前相关证据较少,还需进一步的研究来探讨该领域的潜力。 2.2.3 维生素C联合运动干预在老年肌少症治疗中的应用研究 运动是目前治疗肌少症的主要干预方式,可有效提高肌肉质量和力量。有学者指出,营养补剂和运动干预联合进行,对肌少症的干预效果可能会产生叠加效应[42]。在年轻个体或运动员的运动锻炼中,维生素C经常与维生素E联合使用[43],旨在提升运动表现。然而,关于维生素C在老年人运动干预中的协同效应,尤其是其对肌肉质量、力量和身体表现影响的研究还相对有限。有证据显示,相较于年轻个体,老年人补充维生素C可能对上述运动干预效果发挥更好的改善作用[44]。BOBEUF等[45]对48名坐久不动老年人的研究发现,在24周的抗阻运动期间每天补充维生素C(1 000 mg/d)和维生素E(600 mg/d)可以显著增加受试者的肌肉质量,而单独进行运动并没有产生显著影响。对于这种差异的可能解释为:老化肌肉的抗氧化防御能力逐渐下降,并伴随有抗氧化剂消耗加快,使其无法有效应对运动过程中活性氧的过量生成,进而导致肌肉的氧化应激反应增强[46],补充维生素C可能使衰老的肌肉从抗氧化剂补充中得到了获益。但另有部分研究认为,维生素C对运动干预效果并无提升作用,甚至会损害一些运动适应性反应[47–49]。例如BJ?RNSEN等[47]研究发现,补充维生素C(1 000 mg/d)和维生素E(235 mg/d)降低了老年男性进行12周抗阻运动对总瘦体质量和股直肌肌肉厚度等带来的有益影响。老年人骨密度的降低往往与较低的肌肉质量有关[50],STUNES等[48]观察到补充维生素C(1 000 mg/d)和维生素E(235 mg/d)削弱了老年人在进行12周的抗阻运动后骨密度增加的改善效果,作者认为这一结果可能与过量补充维生素C限制了活性氧的正常生理作用有关。WYCKELSMA等[49]研究表明,进行3周的高强度间歇训练期间同时应用维生素C(1 000 mg/d)和维生素E(235 mg/d)治疗,会钝化老年人骨骼肌中活性氧所诱导的炎症递质、钙和线粒体相关蛋白的mRNA表达变化,使运动适应性反应的细胞信号传导受损,但由于干预周期较短,信号传导的变化尚未得到身体表现的明显反应。 应该指出的是,维生素C摄入对老年人运动干预产生的不利影响似乎是可以避免的。首先,维生素C是水溶性的,目前研究使用的维生素C剂量多为1 000 mg,这种剂量的维生素C容易随汗液和尿液排出体外,因此不易出现过量的风险[23,51],这也提示短期维生素C补充可能并不会显著影响体内的总抗坏血酸池。BJ?RNSEN等[47]研究发现经过3个月的维生素C(1 000 mg/d)补充后,与基线相比受试者血浆维生素C浓度未得到显著提升。而BOBEUF等[45]的研究是经过6个月的维生素C(1 000 mg/d)补充,结果显示受试者循环维生素C水平提升了两三倍。RICHARDS等[52]研究发现,老年人在进行分级握力锻炼时,单次急性摄入2 000 mg维生素C并未对运动适应产生负面影响,而是能够通过增加局部血管扩张提高骨骼肌的血流灌注和耗氧量,这种变化对于提升身体表现至关重要。另有研究显示,每日补充1 000 mg维生素C可以改善身体活跃成年人的氧化还原状态[53]。由上述的研究推测对于老年人而言,摄入1 000 mg/d的维生素C剂量被认为是安全且有效的,并且维生素C补充可能更容易在长期补充(至少6个月)的情况下展现出积极的影响。另外,使用者自身的氧化还原状态对于接受抗氧化剂干预后的获益与否尤为重要。有学者提出针对特定抗氧化状态较差的个体予以抗氧化剂补充可以提高运动收益[54]。已有研究显示,维生素C补充只会在初始维生素C浓度较低的人群中[(35±8) μmol/L]改善身体表现并减少氧化应激[55]。抗氧化剂补充时间点的选择同样重要,RADAK等[56]提出在运动诱导活性氧生成的钟形曲线达到顶峰后予以抗氧化剂补充可以提高运动收益,这可以通过氧化损伤标志物的水平检测来确定。PAULSEN等[57]认为应该在运动结束的1 h以后予以补充,但具体时间点可能会受到运动强度和个体差异等因素影响。对于运动方式的选择,有研究显示不同运动方式会触发不同的代谢途径和氧化反应[58],建议采用多种类型的综合运动来增强对抗氧化剂额外带来益处的补充响应。?YCHOWSKA等[59]研究证实,在老年女性在进行多学科运动训练计划(核心运动和有氧运动)期间,即使给予6周的维生素C(1 000 mg/d)短期摄入也可以降低血浆中白细胞介素6水平,并增加抗炎细胞因子白细胞介素10的表达,从而对运动适应性反应产生积极影响。 综上所述,老年人补充维生素C带来的获益会受到多种因素的影响。建议未来的研究重点应以维生素C状态不佳(< 50 μmol/L)的老年肌少症患者为受试人群,给予长期维生素C补充(1 000 mg/d,至少6个月)联合多种类型的综合运动(至少2种)干预,旨在探讨维生素C是否可以与肌少症患者的运动干预措施发挥协同作用。此外,建议维生素C在运动结束后的1 h予以补充,并同时对运动期间产生的氧化损伤标志物(如丙二醛或蛋白质羟基)水平进行监测,这有助于进一步优化确定维生素C补充剂量、补充时间的选择。其中,合适的运动处方设计(特别是运动类型和强度)还有待进一步研究,维生素C联合运动干预老年肌少症的临床研究总结在表2。"

2.3.1 维生素C抑制骨骼肌氧化应激与炎症反应 维生素C可通过抑制骨骼肌的氧化应激和炎症反应来改善蛋白质代谢稳态。蛋白质代谢与肌肉质量的调控密切相关,当蛋白质降解速度超过合成速度时,肌肉会出现退化和萎缩,氧化应激是导致蛋白质合成与降解失衡致使肌肉萎缩的主要诱因[60]。泛素-蛋白酶体途径是引起蛋白质分解、肌肉萎缩的最主要路径,该途径包括几个关键的肌萎缩特异性E3泛素连接酶,如MAFBx和MuRF1,过量产生的活性氧可以通过诱导叉头框蛋白O激活来影响这些酶的功能[61]。TAKISAWA等[62]使用敲除衰老标记蛋白30的8周龄雌性小鼠(自身不能合成维生素C),并分为接受维生素C(1.5 g/L)自来水的补充组或接受不含维生素C自来水和饮食的维生素C缺乏组,以观察维生素C缺乏对骨骼肌的影响,结果显示,在4周时,维生素C缺乏组小鼠腓肠肌中维生素C含量仅为补充组的0.7%;8周时,维生素C缺乏组比目鱼肌中活性氧和氧化损伤标志物蛋白质羟基水平显著增加;12周时,维生素C缺乏组腓肠肌、足底肌群、比目鱼肌群、胫前肌群和趾长伸肌群的质量分别较补充组减少75%、77%、83%、74%和76%,反映体能的握力、耐力和笼中活动能力分别下降57%、46%和56%。基因表达方面,叉头框蛋白O、MAFbx和MuRF1的表达在12周时开始上调,16周时较补充组达到显著差异,分别增加193%,418%和268%(P < 0.05)。有意义的发现是,维生素C缺乏对肌肉组织的不利影响在补充一段时间的维生素C后均得以恢复到维生素C补充组的水平[62],这表明长期缺乏维生素C与肌肉萎缩有关,而补充维生素C可通过其抗氧化活性抑制肌肉萎缩相关基因的表达,从而缓解肌肉萎缩。此外,通过恢复肌肉质量和氧化还原状态,体能表现也得以恢复。 机体慢性炎症状态在肌少症的发病机制中起着重要作用,且在控制骨骼肌质量和功能方面,炎症反应与氧化应激之间存在着相互作用关系。氧化应激会导致核转录因子κB激活和相关信号传导,促进炎症细胞因子,如白细胞介素6和肿瘤坏死因子α的表达,这些因子有助于更多的活性氧释放,增加泛素蛋白酶体途径的激活,诱导肌萎缩,从而形成恶性循环[8,61]。早年的研究表明,维生素C可通过激活p38 丝裂原活化蛋白激酶信号通路直接抑制核转录因子κB的激活[63],并能够防止急性运动收缩诱导跛行大鼠模型肌肉中蛋白质氧化、脂质过氧化和中性粒细胞浸润水平的增加[64],提示维生素C可能在炎症与氧化损伤过程中对肌肉组织发挥着保护作用。杜氏肌营养不良症是一种进行性肌肉萎缩疾病,与肌少症发病机制相似,即主要由氧化应激所诱导发生,TONON等[65]研究发现,对杜氏肌营养不良小鼠给予维生素C(200 mg/kg)治疗14 d后,膈肌中肌酸激酶、肌坏死、炎症、肿瘤坏死因子α和脂质过氧化水平下降,显示出对于营养不良退化肌肉的保护作用。另有研究显示,每天对雄性大鼠灌胃给予维生素C(2 g/kg)7 d后,可显著抑制大鼠腰椎后路手术所诱导的萎缩多裂肌中白细胞介素6、肿瘤坏死因子α和丙二醛的表达增加,并提高超氧化物歧化酶活性,说明维生素C可抑制氧化应激和炎症反应,同时提高抗氧化防御能力,从而降低肌肉萎缩速度[66]。 2.3.2 维生素C促进肌肉细胞的增殖与分化 研究表明,维生素C可以通过上调生肌调节因子的表达和激活蛋白质合成信号通路来促进肌细胞增殖和分化。生肌调节因子主要包括MyoD、肌细胞生成素(myogenin,MyoG)和生肌因子5等,是促进肌肉发育的关键正向调节因子和转录因子。研究表明,老化肌肉中逐渐增加的炎症反应与氧化损伤的积累会降低生肌调节因子的表达水平和活性,这与衰老过程中肌肉功能下降和发育能力减弱有关[67]。早年的研究发现,补充维生素C(100 μmol/L)可通过上调MyoG的表达来促进大鼠L6成肌细胞分化[68]。另有研究证明,在低温条件(30 ℃)下,维生素C能够增强胰岛素样生长因子1对C2C12成肌细胞中MyoG基因表达与肌管形成的促进作用[69],提示维生素C与胰岛素样生长因子1之间可能存在相互作用关系。DURAN等[70]研究发现,补充维生素C(200 μmol/L)可增加鱼类肌肉细胞中MyoG和mTOR的mRNA水平,从而促进肌细胞的增殖和迁移,这主要与其抗氧化作用有关,因为维生素C能够保护肌细胞免受强氧化剂甲萘醌的损伤,并提高了内源性抗氧化酶活性。mTOR通路是蛋白质合成与肌肉发育的核心信号通路,胰岛素样生长因子1可通过PI3K/AKT路径刺激mTOR活性来调控下游调节因子[71]。ZANELLA等[72]在对鱼类或其体外肌细胞进行营养剥夺处理的研究中观察到,补充维生素C(200 μmol/L)可同时上调胰岛素样生长因子1、mTOR和MyoD的表达来促进肌肉发育,提示维生素C可能在蛋白质合成信号通路中发挥重要作用。这一假设在FANG等[73]的研究中得到证实,研究发现维生素C处理(100 μmol/L)可显著提高猪肌肉干细胞中胰岛素样生长因子1和SVCT2表达水平,并且使PI3K、AKT、mTOR和p70S6K(mTOR的下游靶标)磷酸化,从而促进细胞增殖,当使用胰岛素样生长因子1抑制剂和SVCT2抑制剂与维生素C同时处理时,维生素C的增殖作用被显著阻断,这也突出了胰岛素样生长因子1和SVCT2对维生素C诱导肌肉发育所具有的重要作用。此外,研究中还发现维生素C能够增加MyoD和肌管形成标志物肌球蛋白重链的表达,进而提高猪肌肉干细胞的成肌分化潜能[73]。另一项最近的研究显示,使用维生素C治疗可以逆转罗哌卡因处理的原代人类成肌细胞中MyoD和生肌因子5的表达下调,并减少活性氧产生以及肌肉生长抑制素的释放,从而改善罗哌卡因对肌细胞增殖和分化的抑制作用[74]。维生素C调节肌肉发育的体内外证据总结在表3。"


2.3.3 维生素C促进损伤肌肉的修复与再生 老化肌肉再生、修复和重塑能力下降是导致肌少症发生与发展的一个关键因素[78]。OMERO?LU等[79]研究发现,在跟腱完全断裂的大鼠模型中,大剂量维生素C(150 mg)补充可通过增加早期血管生成和胶原蛋白合成来加速跟腱愈合,提示维生素C在促进受损肌肉的修复与再生方面具有一定的应用潜力。最近的一项研究显示,维生素C可以促进C2C12细胞成肌分化以及小鼠肌肉损伤模型(盐酸布比卡因诱导)的修复过程,有意义的发现是所涉及的分子机制并不依赖其抗氧化或胶原蛋白合成功能,而是通过诱导半胱氨酸富集蛋白3(cysteine rich protein 3,CSRP3)的表达上调与核转位,进而与MyoD和MyoG相互作用,介导C2C12细胞分化和小鼠损伤肌肉修复[77]。CSRP3是定位于细胞质和细胞核中的LIM蛋白的一个亚类,作为一种肌肉特异性蛋白,其表达仅限于骨骼肌和心肌,是肌源性分化的关键正向调控因子[80]。另一值得关注的是,在使用维生素C处理的损伤肌肉修复过程中观察到配对盒蛋白7的表达水平显著上调[77]。配对盒蛋白7是成肌卫星细胞分化所必需的调控因子,卫星细胞作为存在于骨骼肌中的一种特定成体干细胞群,对于肌肉再生期间产生新的肌纤维和肥大期间新肌细胞的增加至关重要,并在肌肉组织工程研究中发挥着关键作用[81]。FANG等[73]研究发现,在对猪肌肉干细胞进行维生素C处理后,干细胞的成肌潜能增强,同时配对盒蛋白7的表达水平也显著上调。这提示维生素C可能通过上调配对盒蛋白7的表达来影响卫星细胞的功能,从而促进损伤肌肉的再生和成肌细胞发育。然而,目前的研究证据还很有限,维生素C与肌肉卫星细胞的具体作用机制仍需进一步研究验证。 2.3.4 维生素C改善线粒体的抗氧化防御能力及功能 维生素C补充对维持线粒体健康功能可以起到积极的作用。线粒体功能障碍是衰老的主要标志之一,功能失调的线粒体会提供启动肌少症的信号级联,导致运动神经元和肌纤维死亡,并最终诱导肌少症的发生[82],并且健康的线粒体功能对于肌肉的发育和再生均具有重要意义[83]。HWANG等[84]研究发现,维生素C可通过降低活性氧生成,减少线粒体和DNA氧化损伤,从而延长原代人类胚胎成纤维细胞(可分化为肌细胞)的复制寿命,且维生素C处理(200 μmol/L)可以通过增加乌头酸酶活性来延缓成纤维细胞线粒体功能的年龄依赖性下降。线粒体是活性氧生成的主要场所,成肌细胞增殖所需的线粒体呼吸活性与线粒体活性氧的大量产生有关,研究发现增殖阶段的C2C12细胞线粒体中功能性SVCT2高度表达,并发现维生素C在C2C12细胞线粒体中迅速积累,清除线粒体内过氧化物,从而有助于线粒体抗氧化防御,保护线粒体免受氧化损伤并维护其健康功能[85]。ZANELLA等[72]发现线粒体产生的能量可作为一种替代能源,有助于硬骨鱼类禁食期间的肌肉维持,禁食后补充高剂量维生素C(400 mg/kg)会增加线粒体生物发生诱导剂过氧化物酶体增殖物激活受体γ辅助激活因子1α的表达水平,促进禁食后的肌肉生长并提高肌纤维直径,结合较低活性的抗氧化酶(氧化底物数量直接影响酶的活性),提示补充维生素C可能通过中和活性氧促进线粒体能量产生的微环境形成,为再摄食期间的肌肉生长提供更好的条件。"

| [1] 刘娟,丁清清,周白瑜,等.中国老年人肌少症诊疗专家共识(2021)[J].中华老年医学杂志,2021,40(8):943-952. [2] PETERMANN-ROCHA F, BALNTZI V, GRAY SR, et al. Global prevalence of sarcopenia and severe sarcopenia: a systematic review and meta-analysis. J Cachexia Sarcopenia Muscle. 2022;13(1):86-99. [3] CRUZ-JENTOFT AJ, BAEYENS JP, BAUER JM, et al. Sarcopenia: european consensus on definition and diagnosis: report of the european working group on sarcopenia in older people. Age Ageing. 2010;39(4):412-423. [4] ANTUNES AC, ARAÚJO DA, VERÍSSIMO MT, et al. Sarcopenia and hospitalisation costs in older adults: a cross-sectional study. Nutr Diet. 2017;74(1):46-50. [5] CRUZ-JENTOFT AJ, SAYER AA. Sarcopenia. Lancet. 2019;393(10191):2636-2646. [6] CANNATARO R, CARBONE L, PETRO JL, et al. Sarcopenia: etiology, nutritional approaches, and miRNAs. Int J Mol Sci. 2021;22(18):9724. [7] LIGUORI I, RUSSO G, CURCIO F, et al. Oxidative stress, aging, and diseases. Clin Interv Aging. 2018;13:757-772. [8] CHEN M, WANG Y, DENG S, et al. Skeletal muscle oxidative stress and inflammation in aging: focus on antioxidant and anti-inflammatory therapy. Front Cell Dev Biol. 2022;10:964130. [9] LIAN D, CHEN MM, WU H, et al. The role of oxidative stress in skeletal muscle myogenesis and muscle disease. Antioxidants (Basel). 2022;11(4):755. [10] GAO Q, HU K, YAN C, et al. Associated factors of sarcopenia in community-dwelling older adults: a systematic review and meta-analysis. Nutrients. 2021; 13(12):4291. [11] 王坤,罗炯,刘立,等.老年人肌少症的成因、评估及应对[J].中国组织工程研究,2019,23(11):1767-1773. [12] VARESI A, CHIRUMBOLO S, CAMPAGNOLI LIM, et al. The role of antioxidants in the interplay between oxidative stress and senescence. Antioxidants (Basel). 2022;11(7):1224. [13] KOCOT J, LUCHOWSKA-KOCOT D, KIEŁCZYKOWSKA M, et al. Does vitamin c influence neurodegenerative diseases and psychiatric disorders? Nutrients. 2017;9(7):659. [14] MOSER MA, CHUN OK. Vitamin C and heart health: a review based on findings from epidemiologic studies. Int J Mol Sci. 2016;17(8):1328. [15] BÖTTGER F, VALLÉS-MARTÍ A, CAHN L, et al. High-dose intravenous vitamin C, a promising multi-targeting agent in the treatment of cancer. J Exp Clin Cancer Res. 2021;40(1):343. [16] NOWAK D. Vitamin C in human health and disease. Nutrients. 2021;13(5):1595. [17] DUQUE P, VIEIRA CP, VIEIRA J. Advances in novel animal vitamin C biosynthesis pathways and the role of prokaryote-based inferences to understand their origin. Genes (Basel). 2022;13(10):1917. [18] FENECH M, AMAYA I, VALPUESTA V, et al. Vitamin C content in fruits: biosynthesis and regulation. Front Plant Sci. 2019;9:2006. [19] LINDBLAD M, TVEDEN-NYBORG P, LYKKESFELDT J. Regulation of vitamin C homeostasis during deficiency. Nutrients. 2013;5(8):2860-2879. [20] SAVINI I, CATANI MV, DURANTI G, et al. Vitamin C homeostasis in skeletal muscle cells. Free Radic Biol Med. 2005;38(7):898-907. [21] DOSEDĚL M, JIRKOVSKÝ E, MACÁKOVÁ K, et al. Vitamin C-sources, physiological role, kinetics, deficiency, use, toxicity, and determination. Nutrients. 2021;13(2): 615. [22] PADAYATTY SJ, LEVINE M. Vitamin C physiology: the known and the unknown and goldilocks. Oral Dis. 2016;22(6):463-493. [23] GĘGOTEK A, SKRZYDLEWSKA E. Antioxidative and anti-inflammatory activity of ascorbic acid. Antioxidants (Basel). 2022;11(10):1993. [24] 张闻怡,付泓博,杨茗.维生素与肌少症的相关性[J].中华老年医学杂志, 2022,41(8):1002-1006. [25] CARITÁ AC, FONSECA-SANTOS B, SHULTZ JD, et al. Vitamin C: one compound, several uses. advances for delivery, efficiency and stability. Nanomedicine. 2020;24:102117. [26] ROWE S, CARR AC. Global vitamin C status and prevalence of deficiency: a cause for concern? Nutrients. 2020;12(7):2008. [27] CROOK J, HORGAS A, YOON SJ, et al. Insufficient vitamin C levels among adults in the united states: results from the NHANES surveys, 2003-2006. Nutrients. 2021;13(11):3910. [28] ZHAO F, HE L, ZHAO L, et al. The status of dietary energy and nutrients intakes among chinese elderly aged 80 and above: data from the CACDNS 2015. Nutrients. 2021;13(5):1622. [29] CARR AC, ROWE S. Factors affecting vitamin c status and prevalence of deficiency: a global health perspective. Nutrients. 2020;12(7):1963. [30] SON J, YU Q, SEO JS. Sarcopenic obesity can be negatively associated with active physical activity and adequate intake of some nutrients in Korean elderly: findings from the Korea National Health and Nutrition Examination Survey (2008-2011). Nutr Res Pract. 2019;13(1):47-57. [31] ABETE I, KONIECZNA J, ZULET MA, et al. Association of lifestyle factors and inflammation with sarcopenic obesity: data from the PREDIMED-Plus trial. J Cachexia Sarcopenia Muscle. 2019;10(5):974-984. [32] CESARI M, PAHOR M, BARTALI B, et al. Antioxidants and physical performance in elderly persons: the Invecchiare in Chianti (InCHIANTI) study. Am J Clin Nutr. 2004;79(2):289-294. [33] SAITO K, YOKOYAMA T, YOSHIDA H, et al. A significant relationship between plasma vitamin C concentration and physical performance among Japanese elderly women. J Gerontol A Biol Sci Med Sci. 2012;67(3):295-301. [34] WELCH AA, JENNINGS A, KELAIDITI E, et al. Cross-sectional associations between dietary antioxidant vitamins C, E and carotenoid intakes and sarcopenic indices in women aged 18-79 years. Calcif Tissue Int. 2020;106(4):331-342. [35] LEWIS LN, HAYHOE RPG, MULLIGAN AA, et al. Lower dietary and circulating vitamin c in middle- and older-aged men and women are associated with lower estimated skeletal muscle mass. J Nutr. 2020;150(10):2789-2798. [36] NASIMI N, SOHRABI Z, DABBAGHMANESH MH, et al. A Novel fortified dairy product and sarcopenia measures in sarcopenic older adults: a double-blind randomized controlled trial. J Am Med Dir Assoc. 2021;22(4):809-815. [37] AHMADI A, EFTEKHARI MH, MAZLOOM Z, et al. Fortified whey beverage for improving muscle mass in chronic obstructive pulmonary disease: a single-blind, randomized clinical trial. Respir Res. 2020;21(1):216. [38] PASSERIEUX E, HAYOT M, JAUSSENT A, et al. Effects of vitamin C, vitamin E, zinc gluconate, and selenomethionine supplementation on muscle function and oxidative stress biomarkers in patients with facioscapulohumeral dystrophy: a double-blind randomized controlled clinical trial. Free Radic Biol Med. 2015; 81:158-169. [39] KANG KK, LEE EJ, KIM YD, et al. Vitamin C improves therapeutic effects of adipose-derived stem cell transplantation in mouse tendonitis model. In Vivo. 2017;31(3):343-348. [40] KIM AY, LEE EM, LEE EJ, et al. Effects of vitamin C on cytotherapy-mediated muscle regeneration. Cell Transplant. 2013;22(10):1845-1858. [41] RAHMAN F, BORDIGNON B, CULERRIER R, et al. Ascorbic acid drives the differentiation of mesoderm-derived embryonic stem cells. Involvement of p38 MAPK/CREB and SVCT2 transporter. Mol Nutr Food Res. 2017. doi:10.1002/mnfr.201600506. [42] 胡飞, 赵晓光. 体育运动与营养补剂对老年性骨骼肌减少症的干预[J].中国老年学杂志,2023,43(6):1524-1530. [43] HIGGINS MR, IZADI A, KAVIANI M. Antioxidants and exercise performance: with a focus on vitamin E and C supplementation. Int J Environ Res Public Health. 2020;17(22):8452. [44] OTOCKA-KMIECIK A, KRÓL A. The role of vitamin c in two distinct physiological states: physical activity and sleep. Nutrients. 2020;12(12):3908. [45] BOBEUF F, LABONTÉ M, KHALIL A, et al. Effects of resistance training combined with antioxidant supplementation on fat-free mass and insulin sensitivity in healthy elderly subjects. Diabetes Res Clin Pract. 2010;87(1):e1-e3. [46] GOMES MJ, MARTINEZ PF, PAGAN LU, et al. Skeletal muscle aging: influence of oxidative stress and physical exercise. Oncotarget. 2017;8(12):20428-20440. [47] BJØRNSEN T, SALVESEN S, BERNTSEN S, et al. Vitamin C and E supplementation blunts increases in total lean body mass in elderly men after strength training. Scand J Med Sci Sports. 2016;26(7):755-763. [48] STUNES AK, SYVERSEN U, BERNTSEN S, et al. High doses of vitamin C plus E reduce strength training-induced improvements in areal bone mineral density in elderly men. Eur J Appl Physiol. 2017;117(6):1073-1084. [49] WYCKELSMA VL, VENCKUNAS T, BRAZAITIS M, et al. Vitamin C and E treatment blunts sprint interval training-induced changes in inflammatory mediator-, calcium-, and mitochondria-related signaling in recreationally active elderly humans. Antioxidants (Basel). 2020;9(9):879. [50] LIU C, LIU N, XIA Y, et al. Osteoporosis and sarcopenia-related traits: a bi-directional mendelian randomization study. Front Endocrinol (Lausanne). 2022; 13:975647. [51] LYKKESFELDT J, TVEDEN-NYBORG P. The pharmacokinetics of vitamin C. Nutrients. 2019;11(10):2412. [52] RICHARDS JC, CRECELIUS AR, LARSON DG, et al. Acute ascorbic acid ingestion increases skeletal muscle blood flow and oxygen consumption via local vasodilation during graded handgrip exercise in older adults. Am J Physiol Heart Circ Physiol. 2015;309(2):H360-H368. [53] GOLDFARB AH, MCKENZIE MJ, BLOOMER RJ. Gender comparisons of exercise-induced oxidative stress: influence of antioxidant supplementation. Appl Physiol Nutr Metab. 2007;32(6):1124-1131. [54] MARGARITELIS NV, PASCHALIS V, THEODOROU AA, et al. Antioxidants in personalized nutrition and exercise. Adv Nutr. 2018;9(6):813-823. [55] PASCHALIS V, THEODOROU AA, KYPAROS A, et al. Low vitamin C values are linked with decreased physical performance and increased oxidative stress: reversal by vitamin C supplementation. Eur J Nutr. 2016;55(1):45-53. [56] RADAK Z, ISHIHARA K, TEKUS E, et al. Exercise, oxidants, and antioxidants change the shape of the bell-shaped hormesis curve. Redox Biol. 2017;12:285-290. [57] PAULSEN G, CUMMING KT, HAMARSLAND H, et al. Can supplementation with vitamin C and E alter physiological adaptations to strength training? BMC Sports Sci Med Rehabil. 2014;6:28. [58] PINGITORE A, LIMA G PP, MASTORCI F, et al. Exercise and oxidative stress: potential effects of antioxidant dietary strategies in sports. Nutrition. 2015; 31(7-8):916-922. [59] ŻYCHOWSKA M, GRZYBKOWSKA A, ZASADA M, et al. Effect of six weeks 1000 mg/day vitamin C supplementation and healthy training in elderly women on genes expression associated with the immune response - a randomized controlled trial. J Int Soc Sports Nutr. 2021;18(1):19. [60] WANG Y, LIU Q, QUAN H, et al. Nutraceuticals in the prevention and treatment of the muscle atrophy. Nutrients. 2021;13(6):1914. [61] GOMEZ-CABRERA MC, ARC-CHAGNAUD C, SALVADOR-PASCUAL A, et al. Redox modulation of muscle mass and function. Redox Biol. 2020;35:101531. [62] TAKISAWA S, FUNAKOSHI T, YATSU T, et al. Vitamin C deficiency causes muscle atrophy and a deterioration in physical performance. Sci Rep. 2019;9(1):4702. [63] BOWIE AG, O’NEILL LA. Vitamin C inhibits NF-kappa B activation by TNF via the activation of p38 mitogen-activated protein kinase. J Immunol. 2000;165(12): 7180-7188. [64] JUDGE AR, SELSBY JT, DODD SL. Antioxidants attenuate oxidative damage in rat skeletal muscle during mild ischaemia. Exp Physiol. 2008;93(4):479-485. [65] TONON E, FERRETTI R, SHIRATORI JH, et al. Ascorbic acid protects the diaphragm muscle against myonecrosis in mdx mice. Nutrition. 2012;28(6):686-690. [66] TANG P, ZHU R, GU Y, et al. Ascorbic Acid Attenuates Multifidus Muscles Injury and Atrophy After Posterior Lumbar Spine Surgery by Suppressing Inflammation and Oxidative Stress in a Rat Model. Spine (Phila Pa 1976). 2018;43(21):E1249-E1259. [67] MOUSTOGIANNIS A, PHILIPPOU A, TASO O, et al. The Effects of Muscle Cell Aging on Myogenesis. Int J Mol Sci, 2021;22(7):3721. [68] MITSUMOTO Y, LIU Z, KLIP A. A long-lasting vitamin C derivative, ascorbic acid 2-phosphate, increases myogenin gene expression and promotes differentiation in L6 muscle cells. Biochem Biophys Res Commun. 1994;199(1):394-402. [69] SHIMA A, PHAM J, BLANCO E, et al. IGF-I and vitamin C promote myogenic differentiation of mouse and human skeletal muscle cells at low temperatures. Exp Cell Res. 2011;317(3):356-366. [70] DURAN BOS, GÓES GA, ZANELLA BTT, et al. Ascorbic acid stimulates the in vitro myoblast proliferation and migration of pacu (Piaractus mesopotamicus). Sci Rep. 2019;9(1):2229. [71] SCHIAFFINO S, DYAR KA, CICILIOT S, et al. Mechanisms regulating skeletal muscle growth and atrophy. FEBS J. 2013;280(17):4294-4314. [72] ZANELLA BTT, MAGIORE IC, DURAN BOS, et al. Ascorbic acid supplementation improves skeletal muscle growth in pacu (Piaractus mesopotamicus) juveniles: in vivo and in vitro studies. Int J Mol Sci. 2021;22(6):2995. [73] FANG J, LI M, ZHANG G, et al. Vitamin C enhances the ex vivo proliferation of porcine muscle stem cells for cultured meat production. Food Funct. 2022;13(9): 5089-5101. [74] SCIOLI MG, CONIGLIONE F, GREGGI C, et al. Ascorbic acid reduces ropivacaine-induced myotoxicity in cultured human osteoporotic skeletal muscle cell. BMC Musculoskelet Disord. 2023;24(1):576. [75] IKEDA K, ITO A, SATO M, et al. Effects of heat stimulation and l-ascorbic acid 2-phosphate supplementation on myogenic differentiation of artificial skeletal muscle tissue constructs. J Tissue Eng Regen Med. 2017;11(5):1322-1331. [76] DIAO Z, MATSUI T, FUNABA M. Stimulation of myogenesis by ascorbic acid and capsaicin. Biochem Biophys Res Commun. 2021;568:83-88. [77] LI P, ZHANG X, TIAN L, et al. Vitamin C Promotes Muscle Development Mediated by the Interaction of CSRP3 with MyoD and MyoG. J Agric Food Chem. 2022; 70(23):7158-7169. [78] JOANISSE S, NEDERVEEN JP, SNIJDERS T, et al. Skeletal muscle regeneration, repair and remodelling in aging: the importance of muscle stem cells and vascularization. Gerontology. 2017;63(1):91-100. [79] OMEROĞLU S, PEKER T, TÜRKÖZKAN N, et al. High-dose vitamin C supplementation accelerates the Achilles tendon healing in healthy rats. Arch Orthop Trauma Surg. 2009;129(2):281-286. [80] VAFIADAKI E, ARVANITIS DA, SANOUDOU D. Muscle LIM protein: master regulator of cardiac and skeletal muscle functions. Gene. 2015;566(1):1-7. [81] FUKADA SI, AKIMOTO T, SOTIROPOULOS A. Role of damage and management in muscle hypertrophy: Different behaviors of muscle stem cells in regeneration and hypertrophy. Biochim Biophys Acta Mol Cell Res. 2020;1867(9):18742. [82] ALWAY SE, MOHAMED JS, MYERS MJ. Mitochondria initiate and regulate sarcopenia. Exerc Sport Sci Rev. 2017;45(2):58-69. [83] Coen PM, Musci RV, Hinkley JM, et al. Mitochondria as a target for mitigating sarcopenia. Front Physiol. 2019;9:1883. [84] HWANG WS, PARK SH, KIM HS, et al. Ascorbic acid extends replicative life span of human embryonic fibroblast by reducing DNA and mitochondrial damages. Nutr Res Pract. 2007;1(2):105-112. [85] FIORANI M, SCOTTI M, GUIDARELLI A, et al. SVCT2-Dependent plasma and mitochondrial membrane transport of ascorbic acid in differentiating myoblasts. Pharmacol Res. 2020;159:105042. |
| [1] | Yang Yifeng, Ye Nan, Wang Lin, Guo Shuaicheng, Huang Jian. Signaling pathway of dexmedetomidine against ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(9): 1464-1469. |
| [2] | Lou Guo, Zhang Yan, Fu Changxi. Role of endothelial nitric oxide synthase in exercise preconditioning-induced improvement of myocardial ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(8): 1283-1288. |
| [3] | Pan Xiaolong, Fan Feiyan, Ying Chunmiao, Liu Feixiang, Zhang Yunke. Effect and mechanism of traditional Chinese medicine on inhibiting the aging of mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1091-1098. |
| [4] | Kong Jianda, Mu Yujing, Zhu Lei, Li Zhilin, Chen Shijuan. Mechanism of satellite cell regulation and its role in ecological niche signaling during skeletal muscle regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(7): 1105-1111. |
| [5] | He Rongzhen, Ying Lyufang, He Xingwen, Chen Chuanshun, Yin Yuesong, Zhang Kexiang, Wang Zili. Effect of ginsenoside Rg1 on muscle degeneration after massive rotator cuff injury in mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(32): 5136-5140. |
| [6] | Ren Weiliang, Jiao Yongwei, Zhang Jian, Yang Liying, Yang Qi. Modulatory effect of resveratrol on oxidative stress and inflammatory factors in the joint fluid of rats with knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(32): 5154-5158. |
| [7] | Xu Rui, Li Yanyan, Xu Hong. Effect and mechanism of short-chain fatty acids in aged rats with sarcopenia [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(32): 5172-5176. |
| [8] | Song Wenxue, Liao Yidong, Ming Jiang, He Longcai, Chen Guangtang, Chen Chen, Wang Zili, Xiong Mingsong, Cui Junshuan, Xu Kaya. Intracranial transplantation of human bone marrow mesenchymal stem cells alleviates rat brain ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5036-5041. |
| [9] | Li Yue, Qiao Hua. miRNA derived from mesenchymal stem cells and its derivatives in treatment of pathological scar [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5042-5047. |
| [10] | Cao Sheng, Kong Lingwei, Xu Kun, Sun Zhijie. Effect of gelatin methacryloyl hydrogel loaded with salvianolic acid B on intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 380-386. |
| [11] | Qian Longjie, Su Wenli, Zhu Wenxian, Wang Yixin. SRT1720, an activator of silent information regulator 1, alleviates acute traumatic brain injury in a rat model [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(28): 4447-4454. |
| [12] | Zhou Minghan, Zhang Hui, Zheng Xianbo, Xu Wuji. Significance of PI3K/Akt/HIF-1α signaling pathway expression in nucleus pulposus cells at different oxygen concentrations in delaying intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(28): 4491-4497. |
| [13] | Chen Chen, Zheng Runquan, Zhang Guichun. Effects of emodin on the proliferation, apoptosis and oxidative stress of chondrocytes in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(28): 4528-4534. |
| [14] | Ma Jianglei, Zhang Huijie, Zhang Chenfang, Yang Xitong, Cheng Jianjie, Wang Guangming. Neuroprotective mechanism by which fenofibrate regulates superoxide dismutase 2 expression in transgenic C57BL/6J mice [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(28): 4547-4552. |
| [15] | Chen Tianxin, Dong Tingting, Li Yan, Zhang Sheng, Zhang Lei. Causal relationship between blood metabolites and sarcopenia-related traits: a Mendelian randomization study [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(27): 4288-4292. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||