Chinese Journal of Tissue Engineering Research ›› 2017, Vol. 21 ›› Issue (23): 3747-3752.doi: 10.3969/j.issn.2095-4344.2017.23.024
Previous Articles Next Articles
Imaging methods and characters of fetal spinal cord development
He Yu-jie1, Li Zhi-jun1, 2, Gao Shang1, Wang Xing1, 2, Zhang Shao-jie1, 2, Li Kun1, Kang Xiao-yan3
- 1Department of Anatomy, 2Digital Medical Center, College of Basic Medicine, Inner Mongolia Medical University, Hohhot 010059, Inner Mongolia Autonomous Region, China; 3Department of Anesthesia, Inner Mongolia Autonomous Region Hospital of Traditional Chinese Medicine, Hohhot 010059, Inner Mongolia Autonomous Region, China
-
Online:2017-08-18Published:2017-09-01 -
Contact:Li Zhi-jun, Master, Professor, Department of Anatomy and Digital Medical Center, College of Basic Medicine, Inner Mongolia Medical University, Hohhot 010059, Inner Mongolia Autonomous Region, China -
About author:He Yu-jie, Studying for master’s degree, Teaching assistant, Department of Anatomy, College of Basic Medicine, Inner Mongolia Medical University, Hohhot 010059, Inner Mongolia Autonomous Region, China -
Supported by:the National Natural Science Foundation of China, No. 81560348 and 81660358
CLC Number:
Cite this article
He Yu-jie, Li Zhi-jun, Gao Shang, Wang Xing, Zhang Shao-jie, Li Kun, Kang Xiao-yan. Imaging methods and characters of fetal spinal cord development [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(23): 3747-3752.
share this article
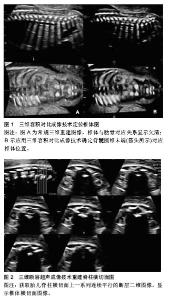
2.1 关于脊柱脊髓的胚胎发育 2.1.1 脊柱的胚胎发育 脊柱的胚胎发育分胚胎期(最初8周)和胎儿期(卵受精第8周起至出生),脊柱的先天畸形一般发生在胚胎期,其胚胎发育可分为3个不同时期:膜状期(软骨前期)、软骨期和骨化期[6]。在胚胎3周末时,轴旁中胚层分化为体节,每个体节又形成生骨节和生皮基节,生骨节细胞形成脊椎和肋骨的软骨、骨和韧带的原基,生皮基节中部的细胞分化发育为成肌肉细胞。到胚胎39 d时,膜性脊柱的间充质内软骨化中心出现,Bagnall等[7]认为此过程最先开始于颈-胸段,后向头尾侧发展,椎体软骨形成早于神经弓,椎体出现2个软骨化骨中心,中线两侧各有1个。在胚胎第6周脊柱完成软骨化,一侧椎体软骨化中心缺如将遗留对侧半椎体。脊柱骨化中心的出现开始于胚胎第8周或第9周,每个椎弓有两个原始化骨中心,椎弓的骨化同样在颈-胸段开始,后向头尾侧发展,而椎体的骨化是在胸-腰段开始,椎弓和椎体的腹侧融合发生于椎弓根的前方,椎体与椎弓的完全骨性融合约在3-6岁[8]。 2.1.2 脊髓的胚胎发育 脊髓和脊膜的胚胎发育与影响脊柱形成的一些因素密切相关,因为导致形成很多不同种类的神经管闭合不全及脊髓脊膜和脊椎的异常[6]。脊髓的胚胎发育可分为3期:神经胚形成,神经管形成,退化分化。胚胎第3周,神经外胚层细胞形成一增厚的细胞板,称神经板。胚胎第18天,神经板中央凹陷形成神经沟,其两侧隆起称神经褶。第3周末,神经沟加深,两侧的神经褶在背中线处逐渐愈合形成神经管,并与外胚层分离而陷入胚体背侧的中胚层内。神经管与外胚层一旦分离过早、分离不全、马尾细胞团异常及脊索发育异常等均会导致脊髓的发育畸形。神经管的愈合始于未来的颈部区域,并逐渐向头、尾两端进行,在头、尾两端分别留有前神经孔和后神经孔,并分别约在胚胎第25,27天闭合。神经管闭合后头端膨大发育为脑,尾段较细,为脊髓的原基,其管腔形成脊髓中央管,后神经孔闭合失败则形成脊髓裂。脊髓形成的第三期在胚胎第38天开始,此时,尾侧的脊索和中央管变小,形成脊髓圆锥终丝、终室(含于脊髓圆锥内的局限性扩张的中央管)[9]。 2.2 X射线、CT技术对胎儿脊柱发育的观测研究 2.2.1 早期X射线对胎儿标本的观测 国内外早于20世纪70年代就有关于X射线研究胎儿标本脊柱生长发育规律的报道[10],但受到当时技术和条件的限制,只停留在对脊柱纵向生长速度与胎龄对应关系的水平[11]。随着CT技术的问世,使得X射线逐渐被淘汰,近10年国内外已无报道。 2.2.2 CT对胎儿脊柱发育的研究 英国工程师Hounsfield等[12](1971年)设计并扫描出第一幅有诊断意义的头部CT图像,在Ambrose的指导下,当时一幅图像处理约需20 min,后借助微处理器减少至4.5 min,该设备由英国EMI公司生产,安装在Atkinson-Morle医院,为此,1979年Hounsfield与Cormack同获诺贝尔医学奖。随后1974年美国George Town医学中心Ledley设计了全身CT机,其与X射线成像技术相比,具有空间分辨力高、断层成像、任意方位重建等优点,通过对人体某一范围行逐层横断扫描,获得人体横断解剖图,并通过计算机行冠状、矢状及斜位图像的三维重建,为临床诊断提供更多的影像学信息。 近年来,Szpinda等[13-16]对胎儿标本脊柱行CT检测,描述了全脊柱各椎体与椎弓根骨化中心CT表现及其随孕周的变化规律,其中重点研究了C4、T6、L3椎体的长、宽、高、面积、容积及初级骨化中心的横径、矢径、面积、容积,椎弓根骨化中心的左右与前后径、面积、容积等;提示胎儿椎体具有特定的发育规律,如C4、T6、L3椎体长、宽、高随孕周为对数关系,但各自的生长速度却不一致,导致椎体形成特定的形状,面积呈线性相关,而容积则呈抛物线或多项式关系,且相应椎体3个骨化中心的横径和矢径呈对数关系,面积和容积却呈抛物线关系。2015年Szpinda等[4]又对55例胎龄17-30周标本C1-S5椎骨的高度、横径、矢径、横截面积及体积进行了全面的测量和分析,发现胎儿椎体的体积从寰椎到枢椎有明显增加,到骶椎又急剧减少,椎体的矢径最大在T7,而横径最大为L1、高度L2最大,L3椎体的横截面积和体积最大,这对产前诊断、优生优育及法医学鉴定均有参考价值;但因CT对胎儿、孕妇均有辐射损害,因此限制了其在活体胎儿脊柱脊髓生长领域的应用;国内尚无CT应用于活体胎儿脊柱脊髓生长发育研究的相关报道。 2.3 超声观察胎儿脊柱脊髓发育的技术方法 2.3.1 二维超声 常规二维超声是产前筛查胎儿脊柱异常的主要检查方法,采用矢状、横断、冠状等3个切面。矢状切面主要观察脊柱的连续性、有无侧弯及骨化中心的大小;横切面观察椎体、椎弓根骨化中心的结构;冠状切面则观察椎体形态、有无侧突及2个椎弓骨化中心是否在骶尾部靠拢[17]。二维超声的主要优点是非侵入性、方便、实时极易为家长接受,缺点是检查时间长,冠状切面不易获取,且对脊柱病变节段定位较困难,故在二维的基础上开展了多种检查途径[18]。 2.3.2 三维超声 三维超声的概念最初由Baum等[19]于1961年提出,即利用电子计算机将一系列按一定规律采集的二维图像信息进行重建,从而构成三维图像,较二维图像更直观、逼真,可弥补二维超声的不足,对观察胎儿骨骼系统、胸廓及脊柱的正常结构及发育异常有重要诊断作用[20]。三维超声可以获取脊柱全节段的容积信息,图像能更加直观地表现脊柱的形态,观察椎体和椎弓的情况,有助于病变节段的定位,对肋弓的观察也优于二维超声。三维图像的显示有断面和总体显示法两种,后者又分为表面和透明成像模式;表面成像是对不同数据进行分割,勾画出部分构造的轮廓,用表面拟合的方式进行图像重建,从而显示出感兴趣区立体形态、表面特征、空间位置关系,但图像内部结构不能显示。透明成像主要用来显示实质性脏器的内部结构和空间位置关系,不受胎儿脊柱、胸廓等生理曲率影响和胎位、羊水量等的限制,清晰显示脊柱和肋之间的空间连接关系等[21]。 断层超声成像:断层超声成像是一种新的三维超声显像和观察模式[22],其利用容积超声原理对所采集的容积数据进行多方位断层,不仅获得与二维超声相似的断面,还可利用容积数据的获取,在短时间内完成对胎儿的检查,且数据可在脱机后进行后处理[23-24],根据需要选择A、B、C平面并适当旋转X、Y、Z轴,获得胎儿脊柱的冠状、横切及矢状切面上的连续平行的断层图像,分别对各切面图像进行观察分析[25]。 王以妮等[26]选取300例19-38孕周胎儿分别利用容积对比成像和断层超声成像技术对其脊柱脊髓的发育测量(图1,2),得出与孕周相关的线性回归方程,并认为三维超声结合容积对比成像、断层超声成像技术有助于评价胎儿脊柱脊髓的发育状况,通过结构定位及相关径线测量,可在早期对胎儿脊柱区的疾病提供诊断帮助。"
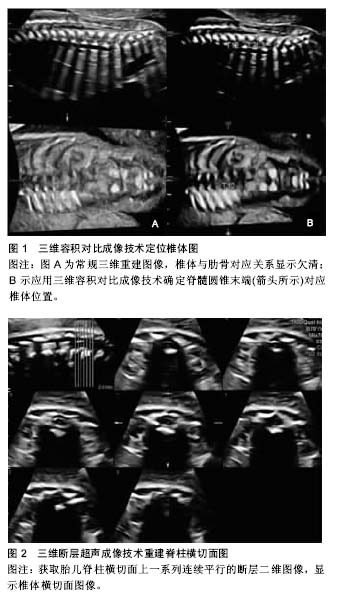

容积对比成像:容积对比成像是一种立体空间复合成像的新技术,能够以实时或重建方式提取组织表面及深层的信息,且可对容积数据行多切面采集和处理,对获得的多个图像进行叠加,减少侧壁回声失落等超声伪像,直观清晰地显示感兴趣区的表面特征、立体形态及空间关系,为胎儿畸形尤其是曲率复杂部位如面部畸形的产前诊断提供有价值的信息[27]。 由于容积对比成像技术和断层超声成像技术依然是建立在二维超声基础上的图像重建,所有尚无法完全代替其进行常规检查,但能在二维超声的基础上联合三维超声弥补其不足,从而为诊断胎儿脊柱脊髓发育异常提供更多有价值的影像学信息。 2.3.3 四维超声 四维超声是由De Vore等[28](2003年)首次提出,是在三维超声基础上加入了时间参数,不仅可获得胎儿的立体图像,还可跟踪胎儿运动,能清晰显示胎儿结构。2015年Öcal等[29]对1 379名产妇行二维超声和四维超声检查并对比,发现四维超声在胎儿体表结构如头颅、颌面部、脊柱、四肢方面的诊断复合率明显高于二维超声。作为一种新的影像学方法,其动态立体成像技术越来越受到临床的关注,可记录胎儿在母体内部分的生理活动及体表一些细小结构,在诊断胎儿体表畸形方面明显优于二维超声,对其进行有效的补充,从而提高检出率[30]。虽然四维超声具有上述优点,但仍会受到孕期过长、胎儿位置、羊水含量及四维探头扫查方向等因素影响,从而导致漏诊[31],故在诊断胎儿畸形时首选二维超声,四维超声可作为二维超声的重要辅助。 2.4 胎儿脊柱脊髓MRI技术的应用 2.4.1 MRI技术在胎儿检查中的发展 1946年美国加州斯坦福大学Felix Bloch及其合作者首次报道了第一次MRI实验,当时主要用于化学分子成分和结构的分析。20世纪70年代被引入到医学领域并用于人体成像。1983年,Smith等[32]在低磁场强度下使用T1W1、IR序列和PDWI获得MRI图像;在随后的几年中出现了不少关于妊娠胎儿解剖的研究。但由于当时研究处于起步阶段,设备较为落后、技术不够成熟,扫描时间过长,临床常需通过镇静减少胎儿运动来获取较好的图片效果,无疑对胎儿和孕妇产生了影响,因此显著制约了胎儿MRI在临床的进一步应用;直至1995年,磁共振快速成像序列得到了深入开发,可有效地避免胎动伪影,并获得高质量的影像图片,从而带动了胎儿MRI诊断的发展。 2.4.2 胎儿脊柱发育的MRI研究 2004年Widjaja等[8]首次用1.5T MRI对解冻后的30例14-41孕周胎儿标本腰椎进行研究,显示了标本MRI的优势,即胎儿标本扫描不受母体及胎动影响、无时间及场强限制,因而可得到较高清晰度图像,通过对图像进行相应的测量和分析可为宫内胎儿MRI表现提供依据。胎儿标本MRI扫描可清晰显示椎体、骨化中心、椎管、脊髓、椎间盘等结构,如椎间盘高度和信号随孕周变化呈现的特点可通过标本MRI检查得到准确地研究,研究表明胎儿椎间盘信号在21孕周为一个分界,在此以前为低信号、之后信号逐渐升高,而椎间盘的高度表现为随孕周增大呈线性增长趋势,开启了脊柱研究方法的新纪元,但由于样本量偏小,且缺乏组织学对照,范围也局限在腰椎,对于脊柱脊髓的整体发育没有阐述。2006年Brookes等[33]对之前近15年来所报道的关于MRI在检查胎儿尸体价值的实验行Meta分析,结果对胎儿心血管、呼吸及神经系统的疾病诊断有重要价值,尤其是对中枢神经系统的显示较传统解剖具有极大优势。 2012年苗明明等[34]利用3.0T MRI分别对52例15-40孕周和20例20-30孕周的胎儿标本脊柱扫描,重点描述了椎间盘信号变化、椎体骨化高度和面积及面积与孕周间的关系,但对胎儿脊髓并未研究(表1)。2014年赵慧等[35]又利用3.0T MRI对71例16-42周新鲜胎儿标本行全脊柱3D-T2WI序列扫描,对脊柱各段的生长发育规律分别进行了研究,使得该领域的研究更加全面。Arthurs等[36]随机选取58例胎儿尸体分别用1.5T MRI和3.0T MRI扫描,观察磁场强度的高低是否对成像有影响,发现在可允许的范围内增加磁场强度可以更好的识别胎儿发育的异常(表1)。 2.4.3 胎儿脊髓发育的MRI研究 目前,大部分关于胎儿的研究多集中在超声及解剖方面对脊髓的形态观察和测量,少数关于胎儿脊髓MRI的研究则主要关注颈膨大、腰骶膨大及脊髓圆锥位置的变化和脊髓脊膜膨出等疾病[37-38] 。 2016年吴勇等[39]利用3.0T MRI扫描了70例16-42孕周正常胎儿标本,观察胎儿脊柱脊髓发育长度随孕周的动态变化,发现约在18周时,颈、胸、腰椎全长与脊髓全长数值接近,在之后的孕周里,颈、胸、腰椎全长逐渐长于脊髓全长,但实验还发现,脊髓的增长并非完全成线性,各节段的发育也有着一定差异(表1)。 2016年5月董金叶等[40]又利用3.0T MRI观察随机选取44例16-42孕周胎儿标本颈膨大最大横断面及其相对位置关系,表明胎儿颈膨大最大横断面面积与孕周具有良好的相关性(表1)。 由于受到母体呼吸和胎动的影响,使得宫内活体胎儿脊柱脊髓MRI图像不够清晰,因而目前还没有宫内活体胎儿脊柱脊髓正常MRI表现的报道。 "

| [1] Bagnall KM, Harris PF. A radiographic study of the growth in width of the human fetal vertebral column. Anat Rec. 1982; 204(3):265-270.[2] 张万盛,王振维.脊柱与脊髓相关发育的研究[J].解剖学通报, 1983,6(4):346-348.[3] Huang YL, Wong AM, Liu HL, et al. Fetal magnetic resonance imaging of normal spinal cord: evaluating cord visualization and conus medullaris position by T2-weighted sequences. Biomed J. 2014;37(4):232-236. [4] Szpinda M, Baumgart M, Szpinda A, et al. Cross-sectional study of C1-S5 vertebral bodies in human fetuses. Arch Med Sci. 2015;11(1):174-189.[5] Baumgart M, Wi?niewski M, Grzonkowska M,et al. Morphometric study of the neural ossification centers of the atlas and axis in the human fetus. Surg Radiol Anat. 2016; 38(10):1205-1215.[6] 潘恩媛,陈丽英.儿科影像诊断学(第一版)[M].北京:人民卫生出版社,2007:145-147. [7] Bagnall KM, Harris PF, Jones PR. A radiographic study of the human fetal spine. 2. The sequence of development of ossification centres in the vertebral column. J Anat. 1977; 124(3):791-802.[8] Widjaja E, Whitby EH, Paley MN, et al. Normal fetal lumbar spine on postmortem MR imaging.AJNR Am J Neuroradiol. 2006;27(3):553-559.[9] 陈丽英,蔡爱露.胎儿影像诊断学 [M]. 北京:人民卫生出版社, 2014:141-144.[10] Bagnall KM, Harris PF, Jones PR.A radiographic study of the human fetal spine. 1. The development of the secondary cervical curvature. J Anat. 1977;123(3): 777-782.[11] 李澎,应福其.国人胎儿脊柱发育宽度的X线照相研究[J].大连医科大学学报,2002,24(2):97-99.[12] Hounsfield GN.Computerized transverse axial scanning (tomography). 1. Description of system.Br J Radiol. 1973; 46(552):1016-1022.[13] Szpinda M, Baumgart M, Szpinda A, et al.Cross-sectional study of the ossification center of the C1-S5 vertebral bodies. Surg Radiol Anat. 2013;35(5):395-402. [14] Szpinda M,Baumgart M,Spinda A,et al.Cross-sectional study of the neural ossification centers of vertebrae C1-S5 in the human fetus. Surg Radiol Anat. 2013;35(8):701-711.[15] Szpinda M,Baumgart M,Spinda A,et al.New anatomical data on the growing C4 vertebra and its three ossification centers in human fetuses. Surg Radiol Anat. 2013;35(3):191-203. [16] Szpinda M,Baumgart M,Spinda A,et al.Morphometric study of the T6 vertebra and its three ossification centers in the human fetus. Surg Radiol Anat. 2013;35(10): 901-916.[17] 邹娅芳,林小影,盂卓,等.二维及三维超声成像在胎儿脊柱病变诊断中的应用[J].中华医学超声杂志,2013,10(12):60-62.[18] 樊慧,张立琼,栗河舟,等.半椎体畸形的二维及三维超声诊断特征分析[J].中华临床医师杂志,2015,9(11):2118-2121.[19] Baum G,Stroke GW. Optical holographic three-dimensional ultrasonography. Science. 1975; 189(4207):994-995. [20] Zhang HM,Hu B,Lin X,et al. Prenatal ultrasonic manifestation and clinical significance of fetal hemivertebra. Beijing Da Xue Xue Bao. 2014;46(2):319-322. [21] Gonçalves LF.Three-dimensional ultrasound of the fetus: how does it help? Pediatr Radiol. 2016;46(2):177-189.[22] Espinoza J,Kusanovic JP,Goncalves LF, et al. A novel algorithm for comprehensive fetal echocardiography using 4D ultrasound and tomographic imaging. Ultrasound Med. 2006; 25(8):947-956.[23] Devore GR,Polanko B. Tomographic ultrasound imaging of the fetal heart: a new technique for identifying normal and abnormal cardiac anatomy. Ultrasound Med. 2005;24(12): 1685-1696.[24] Paladini D,Vassallo M,Sglavo G, et al. The role of spatio-temporal image correlation(STIC) with tomographic ultrasound imaging(TUI) in the sequential analysis of fetal congenital heart disease. Ultrasound Obstet Gynecol. 2006; 27(5):555-561.[25] Markov D. Tomographic ultrasound imaging (TUI)--technique and methodological study. Akush Ginekol. 2008;47(4):9-15.[26] 王以妮,蔡爱露,孙悦,等.三维超声评价中晚孕期胎儿脊髓发育[J].中国超声医学杂志,2016,32(10):925-928.[27] Markov D, Pavlova E, Markov P. Static volume contrast imaging (VCI)--clinical implications in obstetrics and gynecology. Akush Ginekol. 2010;49(3):22-28.[28] DeVore GR,Falkensammer P,Sklansky MS,et al.Spatio- temporal image correlation (STIC): new technology for evaluation of the fetal heart. Ultrasound Obstet Gynecol. 2003;22(4):380-387.[29] Öcal DF, Nas T, Güler I. The place of four-dimensional ultrasound in evaluating fetal anomalies. Ir J Med Sci. 2015; 184(3):607-612.[30] 陈利明,张荣宽. 二维联合四维超声成像在孕11~13+6周胎儿体表结构异常诊断中的应用价值[J].中国临床医学影像杂志,2014, 25(5):367-369.[31] 孙家琦.实时四维超声成像产前诊断胎儿畸形的研究[J].中国医药科学,2012,2(8):74-75.[32] Smith FW,Adani AH,Philips WDP.NMR imaging in pregnancy. Lancet. 1983;1(8314-5):61-62.[33] Brookes JS,Hagmann C.MRI in fetal necropsy. J Magn Reson Imaging. 2006;24(6):1221-1228.[34] 苗明明,林祥涛,刘树伟.正常胎儿标本腰椎发育的磁共振研究[J].中国临床解剖学杂志,2012,30(2):185-188.[35] 赵慧,林祥涛,徐艳霞,等.胎儿腰椎长度发育与孕龄及性别相关性3.0T 磁共振研究[J].医学影像学杂志,2015,25(2):330-336.[36] Arthurs OJ,Thayyil S,Wade A, et al. Normal ascent of the conus medullaris: a post-mortem foetal MRI study. J Matern Fetal Neonatal Med. 2013;26(7): 697-702.[37] Huang YL,Wong AM,Liu HL,et al.Fetal magnetic resonance imaging of normal spinal cord:Evaluating cord visualization and conus medullaris position by T2-weighted sequences. Biomed J.2014;37(4):232. [38] Duczkowska A, Bekiesinska-Figatowska M, Herman-Sucharska I, et al.Magnetic resonance imaging in the evaluation of the fetal spinal canal contents. Brain Dev. 2011;33(1):10-20.[39] 吴勇,林祥涛,董金叶,等.16-42周正常胎儿腰髓长度发育的磁共振研究[J].医学影像学杂志,2016,26(2):332-335.[40] 董金叶,林祥涛,曹金凤,等.16-42周胎儿脊髓颈膨大发育的MRI分析[J].山东大学学报(医学报),2016,54(5):74-78. |
| [1] | Yao Xiaoling, Peng Jiancheng, Xu Yuerong, Yang Zhidong, Zhang Shuncong. Variable-angle zero-notch anterior interbody fusion system in the treatment of cervical spondylotic myelopathy: 30-month follow-up [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1377-1382. |
| [2] | Yu Chengxiang, Liu Lehong, Li Wenbo, Chen Jinshi, Ran Chunlei, Wang Zhongping. Correlation between spine-pelvic sagittal parameters and prognosis of vertebroplasty in the treatment of thoracolumbar osteoporotic vertebral compression fractures [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1412-1417. |
| [3] | Yang Shenglin, Pu Xingwei, Luo Chunshan, Yang Jianwen. Neuroprotective effects of tetrandrine preconditioning in rabbits with spinal cord ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1223-1227. |
| [4] | Kan Houming, Fan Lijun, Chen Xuetai, Shen Wen. Application of platelet-rich plasma in neuropathic pain [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1286-1292. |
| [5] | Hu Wei, Xie Xingqi, Tu Guanjun. Exosomes derived from bone marrow mesenchymal stem cells improve the integrity of the blood-spinal cord barrier after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 992-998. |
| [6] | Zhang Jinglin, Leng Min, Zhu Boheng, Wang Hong. Mechanism and application of stem cell-derived exosomes in promoting diabetic wound healing [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1113-1118. |
| [7] | An Weizheng, He Xiao, Ren Shuai, Liu Jianyu. Potential of muscle-derived stem cells in peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1130-1136. |
| [8] | Fan Yiming, Liu Fangyu, Zhang Hongyu, Li Shuai, Wang Yansong. Serial questions about endogenous neural stem cell response in the ependymal zone after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1137-1142. |
| [9] | Liu Yuhang, Zhou Jianqiang, Xu Xuebin, Qu Xingyue, Li Ziyu, Li Kun, Wang Xing, Li Zhijun, Li Xiaohe, Zhang Shaojie. Establishment and validation of finite element model of lower cervical spine in 6-year-old children [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(6): 870-874. |
| [10] | Li Yuqiao, Sun Tianwei, Ma Bin, Zhou Zhaohong, Dong Runbei, Wu Haiyang. A comparative study of imaging parameters and quality of life scores between subtypes of lumbar spondylolisthesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(6): 943-948. |
| [11] | Li Jian, Bao Zhengqi, Zhou Pinghui, Zhu Ruizhi, Li Zhixiang, Wang Jinzi. Effects of posterior single open-door laminoplasty and anterior cervical corpectomy fusion on cervical sagittal balance parameters in the treatment of multilevel cervical spondylotic myelopathy [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(6): 949-953. |
| [12] | Yi Xinrong, Jia Fuquan, He Xin, Zhang Shaojie, Ren Xiaoyan, Li Zhijun. Establishment of cervical bone age equation for male adolescents aged 8-16 years old in Hohhot based on thin-slice CT [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(6): 954-958. |
| [13] | He Yunying, Li Lingjie, Zhang Shuqi, Li Yuzhou, Yang Sheng, Ji Ping. Method of constructing cell spheroids based on agarose and polyacrylic molds [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 553-559. |
| [14] | He Guanyu, Xu Baoshan, Du Lilong, Zhang Tongxing, Huo Zhenxin, Shen Li. Biomimetic orientated microchannel annulus fibrosus scaffold constructed by silk fibroin [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 560-566. |
| [15] | Chen Xiaoxu, Luo Yaxin, Bi Haoran, Yang Kun. Preparation and application of acellular scaffold in tissue engineering and regenerative medicine [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 591-596. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||