Chinese Journal of Tissue Engineering Research ›› 2023, Vol. 27 ›› Issue (24): 3920-3925.doi: 10.12307/2023.533
Previous Articles Next Articles
Clinical application of vascular cryoprotectants
Wang Shan, Wang Cheng, Shi Yehong
- The Fifth Affiliated (Zhuhai) Hospital of Zunyi Medical University, Zhuhai 519100, Guangdong Province, China
-
Received:2022-08-11Accepted:2022-10-12Online:2023-08-28Published:2023-01-19 -
Contact:Wang Cheng, Associate chief physician, The Fifth Affiliated (Zhuhai) Hospital of Zunyi Medical University, Zhuhai 519100, Guangdong Province, China -
About author:Wang Shan, Master, The Fifth Affiliated (Zhuhai) Hospital of Zunyi Medical University, Zhuhai 519100, Guangdong Province, China
CLC Number:
Cite this article
Wang Shan, Wang Cheng, Shi Yehong. Clinical application of vascular cryoprotectants[J]. Chinese Journal of Tissue Engineering Research, 2023, 27(24): 3920-3925.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
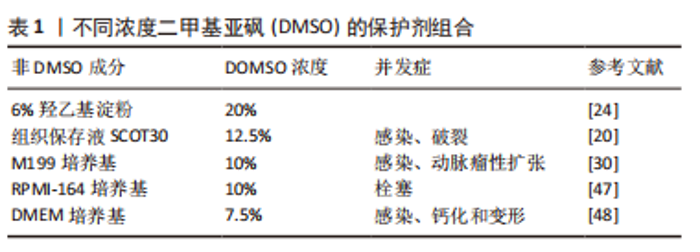
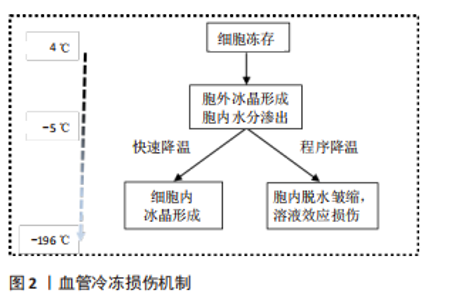
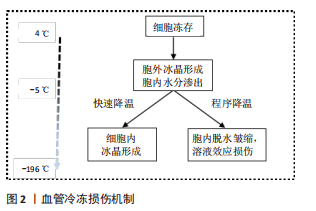
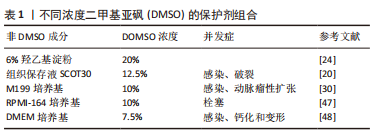
2.1.1 细胞内冰晶形成 在冷冻保存过程中,冷冻和解冻时冰晶的形成或再结晶是导致细胞活力丧失的主要因素[11]。对于大多数细胞类型来说,任何大量的细胞内冰晶形成都是致命的。然而,在完全冷冻保存过程中冰晶的形成是不可避免的,因此控制和抑制细胞内冰晶形成对于最小化细胞损伤至关重要。根据双因素假说理论,在缓慢冻存过程中,因为细胞内水的化学势高于细胞外冰的化学势,胞质的水流向细胞外,导致细胞脱水,从而对细胞造成细胞外冰和渗透压的损害。但随着降温速率的加快,细胞内的水不能快速流出,在细胞内形成冰,从而导致细胞在冷冻过程中受到致命的冰晶损伤[9,12]。最有说服力的证据是,随着降温速度的加快,解冻后细胞存活率的下降与细胞内冰晶的形成相吻合[13]。而细胞内结冰的概率与冷却速率和细胞膜对水的通透性有关[14]。在渗透系数和细胞的表面积与体积比一定时,当冷却速率足够慢,随着温度的下降,水会离开细胞质,所有的冰都会是在细胞外形成,从而减少细胞内冰晶形成。但是,如果冷却速度太慢时,细胞就会长时间暴露在较高浓度的溶质中,会因为“溶液效应”而受到毒性损害[15]。 2.1.2 溶液效应损伤 在缓慢冷却期间,首先在细胞外形成冰晶,由于细胞膜上的水梯度差异,导致细胞内水移动到细胞外,从而避免了细胞内冰晶的形成[9]。但同时,过度脱水会增加细胞内溶质的浓度,即溶液效应,从而导致渗透性休克,产生毒性损害[12]。评价“溶液效应”毒性的一个指标是解冻后6-12 h细胞出现延迟坏死,12-36 h出现细胞凋亡,具体的时间取决于何种细胞类型[15-16]。 2.1.3 血管冷冻损伤 然而,组织包含不同类型的细胞,是复杂的多细胞系统,低温生物学反应可能会因细胞类型的不同而有很大的差异,表现出对最佳保存有不同的要求。通常,组织和器官由细胞和细胞外成分组成,这些成分以非常特殊的结构排列在一起,以产生相对较大的集成功能单元[13]。因此,当人们试图将冷冻保存程序从细胞悬浮液扩展到组织和器官时,其大小、排列和细胞外特殊结构都可能产生新的问题[17]。 在冷冻保存过程中,组织内的所有细胞类型都将受到相同的冷却和解冻参数的影响。此外,组织内的细胞还会受到其他因素的影响,如细胞与细胞或细胞与基质的相互作用、组织内的温度与溶质梯度以及跨细胞膜的水交换受限,这些情况都可能会加剧冷冻损伤[13,17]。在冷冻细胞悬浮液中,如果结合使用缓慢冷却和快速解冻方案,解冻后的细胞活性最好,但这可能不是血管组织冷冻保存的最佳方案[16]。早在20世纪90年代,有研究证明,在快速解冻过程中,由于去玻璃化作用可能会引起动脉壁发生微破裂[18]。NOVOTNY等[19]也描述了不同解冻速率引起的人体大动脉移植物壁的微破裂。在临床应用中,这样的事件可能会导致解冻后的动脉移植物早期破裂而造成严重的后果[20-22]。 离体血管的冷冻保存是以一种最大限度地减少结构损伤、保持结构完整性并旨在保持其血流动力学特性的方式进行的[23]。在血管的冷冻保存过程中,离体后的过渡与转运、冷冻与解冻方式即降温与复温速率、冷冻保护剂以及冷冻保存的时间都是影响保存效果的因素,每一个步骤都会对血管造成一定的损伤[24-26]。血管解冻后其结构的完整性和功能的保留性是评价冻存效果好坏最直观的方法[4]。动脉壁的黏弹性和惯性特性对于正常的动脉功能是必不可少的,使动脉能够将血液的脉动性转化为持续的微动脉-毛细血管流动和压力[27]。冷冻保存及解冻过程是否会影响这些特性仍存在争议。 在深低温冻存血管的临床使用中,一个关键的问题是解冻过程造成的血管损伤引起潜在的血管扩张,动脉瘤形成,甚至最终破裂,从而影响临床效果。对于血管的解冻方式通常有两种:37 ℃水浴快速解冻和室温慢速解冻。在出版的大多数临床著作中,多采用37 ℃水浴快速升温作为标准复温方法[28-30]。然而,NOVOTNY等[19]实验表明,与在水浴中解冻相比,在室温下解冻的动脉移植物的整体结构损伤较小,室温下解冻似乎更温和,不会导致动脉壁受到如此严重的破坏。因此,理论上在室温下解冻的血管具有更高的质量,更适合移植。而且,慢速解冻可以降低同种异体动脉移植后的免疫反应,改善移植后的行为[24]。对于血管组织而言,低温保存会导致血管内皮细胞功能和血管收缩功能的丧失[4,19]。内皮功能是血管内环境稳定的关键调节因素,内皮层的充分保存对血管移植物的中长期存活起着至关重要的作用[31]。不仅如此,血管移植的成功与各层组织成分的表现有关。在血管冷冻保存后,不仅需要细胞可以存活,而且更重要的是在组织内恢复其特殊的生物功能[32]。到目前为止,对于消除血管同种异体移植物在冷冻保存和随后的解冻程序中受到的结构损害,还没有推荐的指南。 2.2 冷冻保护剂 目前的冷冻保存技术涉及冷冻保护剂的选择使用及自动化逐渐冷冻和复温的过程,而冷冻保护剂的合理应用至关重要。冷冻保护剂通过抑制冰晶形成、调节细胞内外渗透压、稳定细胞膜等作用对细胞或组织起到良好的保护效果。但目前涉及应用于临床的冷冻保护剂仍然具有很多缺陷,包括对于细胞、组织的直接毒性作用,保护效果不能达到最优化,以及对应用于临床对象的迟发性损害。所以,广大学者通过不断深入研究深低温冻存中的损伤机制,不断探索最优的冷冻保护剂组合或新型无毒的冷冻保护剂,以求最大限度地减少冷冻损害来改善组织的保存效果[33]。 2.2.1 作用机制 冷冻保护剂可以同溶液中的水分子结合,发生水合作用,弱化水的结晶过程,使溶液的黏性增加从而减少冰晶的形成,同时可通过在细胞内外维持一定的摩尔浓度,降低细胞内外未结冰溶液中电解质的浓度,使细胞免受溶质的损伤[34]。在冷却过程中,低温保护剂与水形成氢键,使其在低于冻结温度的温度下保持液态。同时,通过使凝聚核失活来阻止结晶。人们普遍认为,在细胞外和细胞内介质中存在高浓度的冷冻保护剂会增加黏度并明显减少晶体的成核和聚集[35],但较高浓度的冷冻保护剂本身可能会通过直接毒性作用而导致细胞损伤。然而,可以通过减少组织在环境温度下暴露于冷冻保护剂的时间,来降低这种毒性损害。 冷冻保护剂既有一定的保护作用,又有一定的毒性。毒性的产生可能是由于渗透到细胞膜造成的物理渗透损害,也可能是由于结合蛋白质或脂膜而引起的化学变性损害[36],这种损伤与温度和保护剂含量有关。目前,国内外对冷冻保护剂混合物的研究较多,目的是寻找不同含量和类型的保护剂组合,具有对细胞和组织最佳的保护效果和最小的毒性,以发挥最佳的低温保护特性,提高复温后的细胞存活率。 2.2.2 血管冷冻保护剂 冷冻保护剂根据其是否穿透细胞膜通常分为两大类型:渗透性和非渗透性[8,34-35]。渗透性冷冻保护剂多为小分子中性物质,其作用为弱化水结晶过程以及减少对细胞结构和功能的破坏,主要包括甘油、二甲基亚砜(dimethylsulfoxide,DMSO)、丙二醇、乙二醇、乙酰胺、甲醇等。非渗透性冷冻保护剂多为大分子物质,通过增加细胞外渗透压诱导胞内脱水,降低胞内冰晶形成,主要包括海藻糖、聚乙二醇、羟乙基淀粉、聚乙烯吡咯烷酮(PVP) 、葡聚糖、白蛋白等,其一般与渗透性冷冻保护剂联合应用,不仅可以提高细胞冷冻保存后的存活率,而且可以减少渗透性冷冻保护剂的使用量,从而减轻与后者相关的毒性。 在血管组织的冷冻保存中,尽管有报道指出DMSO的毒性[37],但它仍然是主要的冷冻保护剂[38]。在临床和研究机构中寻找将DMSO的潜在危险影响降至最低的方法是降低它的浓度,并且在临床应用之前从移植物中移除,或者用新型无毒的冷冻保护剂取代DMSO。但在许多国家的组织库产品清单中不包括任何用DMSO以外的冷冻保护剂冷冻保存的心血管组织。在使用DMSO进行低温保存时,减轻潜在或已知毒性问题的一种方法是在低温保护剂混合物中添加其他试剂,如羟乙基淀粉、组织保存液SCOT30、细胞培养基等,这些试剂本身具有冷冻保护作用,尽管其效率通常低于DMSO本身,但它们提供了降低总体DMSO浓度的机会[37]。 2.3 血管冷冻保护剂的临床应用 同种异体血管移植在全球范围内被选择用于血管假体移植物感染或严重肢体缺血的患者,其最常见的手术指征是假体移植物或支架感染[30],移植物可以选择使用新鲜的或冷冻保存的同种异体血管[39]。使用自体股静脉因其较低的感染率,已被推荐为当前指南中的首选方法[40]。然而,当自体股静脉不可用时,冷冻保存的同种异体血管是目前指南中推荐的一种常用选择[41],尽管其再感染率相对较低,但也可能因破裂、假性动脉瘤形成、移植物狭窄和闭塞等并发症的发生而降低近远期通畅率[22,29,42]。大型血管中心发表的关于同种异体血管的冷冻保存或解冻方案不尽相同。不同性质的保存液,移植前或冷冻保存前冷缺血时间的变化,不同的冷冻和解冻方案都会影响同种异体血管的最终质量[25-26],并导致不同时期移植物相关并发症发生的显著差异。因此,该综述从深低温冻存保护剂角度出发,探讨不同血管冷冻保护剂在临床应用中的优缺点,以期为同种异体血管的冷冻保存方案设计提供更多依据。 2.3.1 20%DMSO与6%羟乙基淀粉 自20世纪90年代中期以来,捷克共和国常使用冷藏的同种异体动脉作为受感染血管假体的替代品[43]。相关实验和临床研究表明,冷藏和冷冻保存的同种异体移植具有很强的免疫原性[44],这种免疫原性所引起的排斥反应是移植物晚期相关并发症发生的重要原因,表现为移植物扩张、破裂或血栓形成。因此赫拉德茨·克拉洛夫大学医院组织库根据新的标准化冷藏/慢解冻协议,在不添加抗生素的前提下采用20%DMSO混合6%羟乙基淀粉作为冷冻保存剂,探讨深低温冻存大鼠动脉移植后的急性免疫反应[24],该研究发现冷冻保存的血管在复苏后立即保存在预冷的器官保存液中能够显著降低血管内皮的损伤,明显减少移植30 d后血管内膜的免疫排斥反应。在2011-2016年期间,捷克共和国共交付了87例深低温冻存血管移植物供临床应用[39],尽管使用了含较高浓度DMSO的冷冻保护剂,但在5年的随访期间,未发现明显并发症的发生;是否有相关后期并发症的发生,还未见相关研究报道。DMSO会对细胞生物学产生广泛的不利影响,导致细胞凋亡或死亡,从而在临床实践中带来诸多潜在的问题。并且DMSO浓度越高,其毒性作用越大,所带来的临床并发症越多,最终结果是移植效率的降低,甚至是失败[45]。基于此,有必要进一步降低DMSO的使用浓度来最小化这些潜在风险。 2.3.2 12.5%DMSO与组织保存液SCOT30 在法国巴黎圣路易斯医院组织库中,采用的血管冻存液为12.5% DMSO与组织保存液SCOT30混合[20]。来源于此组织库的同种异体动脉移植物为治疗主动脉移植物感染提供了可接受的结果,虽然有相关的并发症发生,比如侧支出血、血栓形成或狭窄,甚至移植物破裂导致患者死亡,但早期很少发生移植物相关的致命并发症。作者回顾了所有术后破裂或者部分破裂的病例后,发现是因为感染而不是冷冻损伤引起的机械性破裂,说明此保护剂组合对于血管具有较好的保护作用,而感染的发生可能是多方面因素引起的。但其长期相关并发症的发生却很常见,包括移植物破裂、假性动脉瘤或动脉瘤的形成、血栓形成、移植物狭窄等,这与低死亡率和截肢率有关。尽管早期移植物相关的再感染发生,但是冷冻保存的动脉为主动脉移植物感染的治疗提供了可接受的结果。 2.3.3 DMSO与细胞培养基 在克罗地亚心血管组织库中,降低了DMSO的使用浓度,采用混有10%DMSO的M199冷冻保护剂冻存同种异体血管移植物[30]。在用于主动脉重建中,58%的患者没有经历任何移植物相关并发症;而在接受外周重建的患者组中,观察到明显的再感染发生率,表明移植物再感染是一种主要的移植物相关并发症,但它们并没有超过传统治疗方法的风险;但是在移植后长期结果中,可以看到移植血管的动脉瘤性扩张。一些作者推测,当涉及到由于血管弹性组织逐渐减弱而导致的移植物结构退化时,可能是由于在融化过程中处理不当或是在植入过程中造成的损害[46]。同样在韩国的公共组织库中,其对血管的冻存采用10%DMSO与90%RPMI-164培养基混合的保护剂,离体血管在经过程序降温后长期保存于液氮中,使用时经过两步法缓慢解冻后逐步去除冷冻保护剂[47]。基于此,在用于肝移植肝中静脉的重建时,结合改进的手术方式,移植后血管的总体通畅率较好,在1个月时为66.7%,在3个月时为38.9%,在1年时为33.3%。然而在加拿大最大的公共冷冻血管组织库中进一步降低了DMSO的使用浓度,使用的冻存剂为包含7.5%DMSO的DMEM溶液[48],但是在解冻后,一部分血管移植物因不同程度的损伤而不得不丢弃。丢弃的两个主要原因是通过肉眼观察到的血管损伤和微生物培养阳性,其次是血清学筛查阳性,而在肉眼检查中,发现钙化的动脉斑块和明显的变形是其丢弃的主要原因。但是作者在回顾了组织库从2014-2019年的血管移植活动中,所服务的医院中心还没有报道过移植物质量差或直接与移植物相关的不良事件,这说明了较低浓度DMSO的冷冻保护剂仍然具有良好的保护效果,但还需更长的临床随访时间去检验其安全有效性。 可以看出,不同的组织库使用的冷冻保护剂组合不尽相同,但都是以不同浓度DMSO为主要成分的冷冻保护剂。目前可以把DMSO的含量降到很低的程度而对离体血管深低温冻存仍然具有良好的保护作用,从而能够应用于临床血管移植。而这也是目前冷冻保护剂的研究方向,即降低DMSO使用浓度甚至使用完全不含DMSO的冷冻保护剂[49]。但是否通过降低DMSO浓度以减少其带来的毒性作用与其带来的临床效益相匹配,这仍有待进一步的实验研究。虽然低浓度的DMSO毒性作用减少,但是随之对血管的冷冻保护作用可能降低,甚至无法完整地保存血管结构,使血管解冻后遭受严重的破坏而失去临床应用价值。在降低DMSO浓度的同时,除非寻找到能够完全替代DMSO的保护剂,那么作为DMSO的补充剂显得尤为重要。从上述各大组织库的应用情况来看,冷冻保护剂中非DMSO成分不尽相同,说明其对冷冻保护剂的保护效果起到了很好的补充作用,但是否有更好的保护剂组合来进一步降低DMSO的使用浓度还有待研究。 移植后再感染是血管移植术后常见并发症,并且感染后可导致血管破裂或血栓形成等并发症发生。可以看出在各大组织库的临床应用中均有发生,这可能与血管内皮细胞损伤、术前或术中污染有很大的关系。YI等[50]研究表明,DMSO浓度的增加会增强对血管内皮细胞增殖的抑制作用,并且增加内皮细胞的凋亡。血管内皮细胞是血管组织与血液间的第一道屏障,在维持血管壁的完整性方面起着重要作用,其可以通过直接感受血管内内环境的变化,分泌多种血管活性物质,调节血管功能,对机体的应激做出相应反应,从而调节血液在血管内的正常流动。当内皮细胞受损时,会通过多种途径促进血栓形成,从而导致血管移植后的通畅率降低[51]。 在上述临床应用中,移植血管壁前期或后期都有不同程度的损伤,包括早期或晚期破裂、后期动脉瘤性扩张、解冻后钙化变形等。虽然大部分学者并不认为这是深低温冻存直接引起的机械损伤,但其可能与冻存过程中血管壁中层细胞及组织结构的破坏有关[52]。经过仔细分析后,似乎理论上可以推测随着DMSO浓度的下降,血管壁损伤的程度有所降低,这与DMSO的毒性作用相匹配。并且,在加拿大建立的血管组织库中,使用了含较低浓度DMSO的冷冻保护剂保存血管移植物,回顾5年的临床应用中,还尚未发现移植物相关的不良事件。说明在降低冻存液中DMSO浓度的同时,也可以很好地保护血管结构及其生物学功能,减少相关临床并发症的发生,比如破裂、栓塞、感染等,见表1。这为进一步研究开发含低浓度甚至不含DMSO的冷冻保护剂提供了一定的理论依据。但是还未发现有相关高质量的对照试验研究来支撑此推论。"
| [1] VICENTE D, HERNÁNDEZ B, SEGURA V, et al. Methodological Approach to Use Fresh and Cryopreserved Vessels as Tools to Analyze Pharmacological Modulation of the Angiogenic Growth. J Cardiovasc Pharmacol. 2016;68(3): 230-240. [2] MALLIS P, KATSIMPOULAS M, KOSTAKIS A, et al. Vitrified Human Umbilical Arteries as Potential Grafts for Vascular Tissue Engineering. Tissue Eng Regen Med. 2020;7:285-299. [3] MASABNI K, WEAVER MR, KANDAGATLA P, et al. Cryopreserved Allograft in the Management of Native and Prosthetic Aortic Infections. Ann Vasc Surg. 2019;56:1-10. [4] NOVOTN R, MRICKA P, CHLUPAC J, et al. The Effect of Different Thawing Rate on Cryopreserved Human Iliac Arteries Allograft’s Structural Damage and Mechanical Properties. Biomed Res Int. 2020;2020:6545190. [5] GONZÁLEZ-GAY M, LÓPEZ-MARTÍNEZ R, BUSTO-SUÁREZ S, et al. Immunological Aspects Involved in the Degeneration of Cryopreserved Arterial Allografts. Front Surg. 2020;7:616654. [6] RAJU R, BRYANT SJ, WILKINSON BL, et al. The need for novel cryoprotectants and cryopreservation protocols: Insights into the importance of biophysical investigation and cell permeability. Biochim Biophys Acta Gen Subj. 2021; 1865:129749. [7] BURLAGE LC, TESSIER SN, ETRA JW, et al. Advances in machine perfusion, organ preservation,and cryobiology: potential impact on vascularized composite allotransplantation. Curr Opin Organ Transplant. 2018;23:561-567. [8] WHALEY D, DAMYAR K, WITEK RP, et al. Cryopreservation: An Overview of Principles and Cell-Specific Considerations. Cell Transplant. 2021;30(1): 963689721999617. [9] CHANG T, ZHAO G. Ice Inhibition for Cryopreservation: Materials, Strategies, and Challenges. Adv Sci (Weinh). 2021;8:2002425. [10] MAZUR P, LEIBO SP, CHU E. A two-factor hypothesis of freezing injury. Evidence from Chinese hamster tissue-culture cells. Exp Cell Res. 1972; 71(2):345-355. [11] SHANI N, FRIEDMAN O, ARAV A, et al. Cryopreservation and Transplantation of Vascularized Composite Transplants: Unique Challenges and Opportunities. Plast Reconstr Surg. 2019;143(5):1074e-1080e. [12] SHU Z, GAO D, PU L. Update on Cryopreservation of Adipose Tissue and Adipose-derived Stem Cells. Clin Plast Surg. 2015;42(2):209-218. [13] PEGG DE. The relevance of ice crystal formation for the cryopreservation of tissues and organs. Cryobiology. 2020;93:3-11. [14] RAJAN R, MATSUMURA K. Development and Application of Cryoprotectants. Adv Exp Med Biol. 2018;1081:339-354. [15] BAUST JM, CORWIN W, SNYDER KK, et al. Cryopreservation: Evolution of Molecular Based Strategies. Adv Exp Med Biol. 2016;951:13-29. [16] MĚŘIČKA P, JANOUŠEK L, BENDA A, et al. Cell Viability Assessment Using Fluorescence Vital Dyes and Confocal Microscopy in Evaluating Freezing and Thawing Protocols Used in Cryopreservation of Allogeneic Venous Grafts. Int J Mol Sci. 2021;22(19):10653. [17] LIN CC, LI HH, TSAI SW, et al. Tissue Cryopreservation and Cryobanking: Establishment of a Cryogenic Resource for Coral Reefs. Biopreserv Biobank. 2022;20(4):409-411. [18] HUNT CJ, SONG YC, BATESON E, et al. Fractures in Cryopreserved Arteries. Cryobiology. 1994;31(5):506-515. [19] NOVOTNY R, SLIZOVA D, HLUBOCKY J, et al. Cryopreserved human aortic root allografts arterial wall: Structural changes occurring during thawing. Plos One. 2017;12(4):e0175007. [20] COUTURE T, GAUDRIC J, DU MONTCEL ST, et al. Short and Mid Term Outcomes of Cryopreserved Abdominal Aortic Allografts Used as a Substitute for Infected Prosthetic Grafts in 200 Patients. Eur J Vasc Endovasc Surg. 2021;62(1):89-97. [21] WEISS S, BACHOFEN B, WIDMER MK, et al. Long-term results of cryopreserved allografts in aortoiliac graft infections. J Vasc Surg. 2021; 74(1):268-275. [22] BEN AHMED S, LOUVANCOURT A, DANIEL G, et al. Cryopreserved arterial allografts for in situ reconstruction of abdominal aortic native or secondary graft infection. J Vasc Surg. 2018;67(2):468-477. [23] SHAHMANSOURI N, CARTIER R, MONGRAIN R. Characterization of the toughness and elastic properties of fresh and cryopreserved arteries. J Biomech. 2015;48(10):2205-2209. [24] HRUBY J, SPUNDA R, MERICKA P, et al. Influence of the new standardized clinical cryopreservation/slow thawing protocol on immunogenicity of arterial allografts in rats. PLoS ONE. 2020;15(3):e0230234. [25] HEO SH, KIM YW, WOO SY, et al. Recent Results of In Situ Abdominal Aortic Reconstruction with Cryopreserved Arterial Allograft. Eur J Vasc Endovasc Surg. 2017;53(2):158-167. [26] TOUMA J, COCHENNEC F, PARISOT J, et al. In Situ Reconstruction in Native and Prosthetic Aortic Infections Using Cryopreserved Arterial Allografts. Eur J Vasc Endovasc Surg. 2014;48(3):292-299. [27] KIM JH, CHHAI P, RHEE K. Development and characterization of viscoelastic polydimethylsiloxane phantoms for simulating arterial wall motion. Med Eng Phys. 2021;91:12-18. [28] ANTONOPOULOS CN, PAPAKONSTANTINOU NA, HARDY D, et al. Editor’s Choice - Cryopreserved Allografts for Arterial Reconstruction after Aorto-Iliac Infection: A Systematic Review and Meta-Analysis. Eur J Vasc Endovasc Surg. 2019;58:120-128. [29] LEJAY A, DELAY C, GIRSOWICZ E, et al. Cryopreserved Cadaveric Arterial Allograft for Arterial Reconstruction in Patients with Prosthetic Infection. Eur J Vasc Endovasc Surg. 2017;54:636-644. [30] GOLEMOVIC M, SKIFIC M, HALUZAN D, et al. Ten-year experience with cryopreserved vascular allografts in the Croatian Cardiovascular Tissue Bank. Cell Tissue Bank. 2022:1-18. doi: 10.1007/s10561-022-09992-6. [31] ALEXANDER Y, OSTO E, SCHMIDT-TRUCKSÄSS A, et al. Endothelial function in cardiovascular medicine: a consensus paper of the European Society of Cardiology Working Groups on Atherosclerosis and Vascular Biology, Aorta and Peripheral Vascular Diseases, Coronary Pathophysiology and Microcirculation,and Thrombosis. Cardiovasc Res. 2021;117(1):29-42. [32] LOPEZ MJ. Creative technology advances tissue preservation. Ann Transl Med. 2017;5(23):463. [33] CHANG SK, LAU JW, CHUI CK. Changes in mechanical,structural integrity and microbiological properties following cryopreservation of human cadaveric iliac arteries. Ann Acad Med Singap. 2014;43(10):492-498. [34] GORE M, NARVEKAR A, BHAGWAT A, et al. Macromolecular cryoprotectants for the preservation of mammalian cell culture: lessons from crowding, overview and perspectives. J Mater Chem B. 2022;10(2):143-169. [35] JOSEPH B. The cryopreservation of composite tissues: Principles and recent advancement on cryopreservation of different type of tissues. Organogenesis. 2009;5(3):119-126. [36] HE B, SU S, YUAN G, et al. Clinical guideline for vascularized composite tissue cryopreservation. J Tissue Eng Regen Med. 2021;15(6):527-533. [37] AWAN M, BURIAK I, FLECK R, et al. Dimethyl sulfoxide: a central player since the dawn of cryobiology,is efficacy balanced by toxicity? Regen Med. 2020;15(1):1463-1491. [38] JASHARI R, VAN HOECK B, NGAKAM R, et al. Banking of cryopreserved arterial allografts in Europe: 20 years of operation in the European Homograft Bank (EHB) in Brussels. Cell Tissue Bank. 2013;14:589-99. [39] ŠPAČEK M, MĚŘIČKA P, JANOUŠEK L, et al. Current vascular allograft procurement, cryopreservation and transplantation techniques in the Czech Republic. Adv Clin Exp Med. 2019;28(4):529-534. [40] HEINOLA I, KANTONEN I, JAROMA M, et al. Editor’s Choice - Treatment of Aortic Prosthesis Infections by Graft Removal and In Situ Replacement with Autologous Femoral Veins and Fascial Strengthening. Eur J Vasc Endovasc Surg. 2016;51:232-239. [41] CHAKFÉ N, DIENER H, LEJAY A, et al. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Vascular Graft and Endograft Infections. Eur J Vasc Endovasc Surg. 2020;59:339-384. [42] HARLANDER-LOCKE MP, HARMON LK, LAWRENCE PF, et al. The use of cryopreserved aortoiliac allograft for aortic reconstruction in the United States. J Vasc Surg. 2014;59(3):669-674. [43] MATIA I, ADAMEC M, VARGA M, et al. Aortoiliac reconstruction with allograft and kidney transplantation as a one-stage procedure: long term results. Eur J Vasc Endovasc Surg. 2008;35:353-357. [44] RODRÍGUEZ M, PASCUAL G, PÉREZ-KÖHLER B, et al. Immune response to the long-term grafting of cryopreserved small-diameter arterial allografts. Histol Histopathol. 2012;27(7):873-884. [45] MITRUS I, SMAGUR A, FIDYK W, et al. Reduction of DMSO concentration in cryopreservation mixture from 10% to 7.5% and 5% has no impact on engraftment after autologous peripheral blood stem cell transplantation: results of a prospective, randomized study. Bone Marrow Transplant. 2018; 53(3):274-280. [46] MINGA LOWAMPA E, HOLEMANS CH, STIENNON L, et al. Late Fate of Cryopreserved Arterial Allografts. Eur J Vasc Endovasc Surg. 2016;52: 696-702. [47] PARK GC, HWANG S, JUNG DH, et al. Refined surgical techniques to improve the patency of cryopreserved iliac artery homografts for middle hepatic vein reconstruction during living donor liver transplantation. Ann Surg Treat Res. 2020;99(5):294-304. [48] GEORGES G, ALLARD B, DAKKAK M, et al. Appraising 5 Years in Activity of the Largest Public Canadian Vascular Graft Bank. J Vasc Surg. 2021;74(3):972-978. [49] ROGULSKA O, PETRENKO Y, PETRENKO A. DMSO-free cryopreservation of adipose-derived mesenchymal stromal cells: expansion medium affects post-thaw survival. Cytotechnology. 2017;69(2):265-276. [50] YI XY, LIU MX, LUO Q, et al. Toxic effects of dimethyl sulfoxide on red blood cells, platelets, and vascular endothelial cells in vitro. FEBS Open Bio. 2017; 7:485-494. [51] 李苗,王丽丽,常冰梅.血管内皮细胞功能损伤机制的研究进展[J].中国动脉硬化杂志,2019,27(8):730-736. [52] SAKALIHASAN N, MICHEL JB, KATSARGYRIS A, et al. Abdominal aortic aneurysms. Nat Rev Dis Primers. 2018;4:34. [53] MENNA C, ANDREETTI C, IBRAHIM M, et al. Successful Total Tracheal Replacement by Cryopreserved Aortic Allograft in a Patient Post-COVID-19 Infection. Chest. 2021;160(6):e613-e617. [54] MARTINOD E, CHOUAHNIA K, RADU DM, et al. Feasibility of Bioengineered Tracheal and Bronchial Reconstruction Using Stented Aortic Matrices. JAMA. 2018;319(21):2212-2222. |
| [1] | Shi Yehong, Wang Cheng, Chen Shijiu. Early thrombosis and prevention of small-diameter blood vessel prosthesis [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(7): 1110-1116. |
| [2] | Zhang Yuan, Zeng Min, Zhai Bo. Vitrification-based cryopreservation of tissues: strengths and existing problems [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(23): 3751-3755. |
| [3] | Long Huidong, Long Lingli, Mai Qingyun, Zhao Wen, Li Yubin. Protection of reduced glutathione and ulinastatin on frozen-thawed ovarian tissues after xenotransplantation [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(7): 1084-1089. |
| [4] | Zheng Wanling1, Zhang Aijun2, Wang Hao1, Wang Pingping1, Li Jianhua1, Wen Minmin1, Jin Peisheng2. Feasibility of fat particles cryopreserved for different time for use as subcutaneous fillers [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(11): 1706-1710. |
| [5] | Yan Shan-shan, Li Yi-jia, Chen Xi, Liu Li-jun. Effect of cold storage time on cellular viability of umbilical cord mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(5): 748-753. |
| [6] | Zhang Yuan, Yang Qiu-rui, Zhang Hong-dan, Zhu Xue-jing, Li Wei-jian, Wang Zhen-yu, Jing Hong-shu, Zhai Bo. A novel vitrified cryopreservation method for the establishment of tumor tissue biobank [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(4): 587-592. |
| [7] | Yang Zhen-yu, Li Zheng-fa, Fu Ling-mei, Zhu Xiang-ming. Optimal temperature and storage time span for cryopreservation of platelets [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(33): 5368-5372. |
| [8] | Liu Ting, Jiang Hui, Liu Zhi-hua, Sun Ning, Li Xiao-mei, Weng Jin-sheng. Cryopreserved human umbilical cord mesenchymal stem cells: isolation and culture [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(29): 4637-4642. |
| [9] | Zhang Feng-li, Shao Xiao-hu, Ren Huai-juan, Chen Yan-tian, Qi Nian-min. Effect of low-temperature preparation on the biological characteristics of adipose-derived mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(33): 5255-5261. |
| [10] | Wang Zhi, Tan Mei-yun, Qing Quan, Chen Xi, Liu Cheng-jun, Qin Ting-wu. Vitreous cryopreservation of tenocytes co-cultured with porous polydimethylsiloxane scaffolds [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(2): 238-243. |
| [11] | Zhao De-fang, Chen Li-kun. Static cold storage versus hypothermic machine perfusion: changes in inflammatory cytokines and apoptotic factors in isolated liver before and after liver transplantation [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(33): 5323-5326. |
| [12] | . Different thawing methods for cryopreserved rabbit limbs: activity of Schwann cells after thawing [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(20): 3200-3204. |
| [13] | Wang Pei-tao, Shao Cui-hua, Liu Hai-ning. Strategic thinking of human oocyte cryopreservation [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(19): 3074-3082. |
| [14] | Liu Dai, Jin Jie, Xie Fang, Zhang Chao, Lu Jian-jian, Xu Jia-jie, Xu Jun, Teng Li. Effects of different cryopreservation methods on the ultrastructure and viability of amniotic membrane [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(15): 2376-2381. |
| [15] | Zhang Shao-chun, Qin Xin-yuan, Zuo You-wei, Gao Lei, Yin Ye-feng, Wang Jiang-ning. Effect of Mailuoning on an ischemia/reperfusion injury model in the system of simulated in vivo physiological environment for amputated limbs [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(36): 5825-5829. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||