Chinese Journal of Tissue Engineering Research ›› 2024, Vol. 28 ›› Issue (31): 5078-5084.doi: 10.12307/2024.719
Research, development and advance in precise screening of lung cancer drugs with tumor organoids
Liu Jiwei, Liu Weici, Mao Wenjun
- Department of Thoracic Surgery, Affiliated Wuxi People’s Hospital of Nanjing Medical University, Wuxi Medical Center, Nanjing Medical University, Wuxi 214023, Jiangsu Province, China
-
Received:2023-09-11Accepted:2023-10-25Online:2024-11-08Published:2024-01-23 -
Contact:Mao Wenjun, PhD, Associate chief physician, Associate professor, Master’s supervisor, Department of Thoracic Surgery, Affiliated Wuxi People’s Hospital of Nanjing Medical University, Wuxi Medical Center, Nanjing Medical University, Wuxi 214023, Jiangsu Province, China -
About author:Liu Jiwei, Master candidate, Department of Thoracic Surgery, Affiliated Wuxi People’s Hospital of Nanjing Medical University, Wuxi Medical Center, Nanjing Medical University, Wuxi 214023, Jiangsu Province, China -
Supported by:Jiangsu Provincial Natural Science Foundation (Youth Project), No. BK20210068 (to MWJ); Wuxi “Double Hundred” Medical and Health Young Talents Project, No. HB2020003 (to MWJ); Mega-Project of Wuxi Commission of Health, No. Z202216 (to MWJ); the Project of Wuxi Medical Center of Nanjing Medical University, No. WMCG202305 (to MWJ)
CLC Number:
Cite this article
Liu Jiwei, Liu Weici, Mao Wenjun. Research, development and advance in precise screening of lung cancer drugs with tumor organoids[J]. Chinese Journal of Tissue Engineering Research, 2024, 28(31): 5078-5084.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
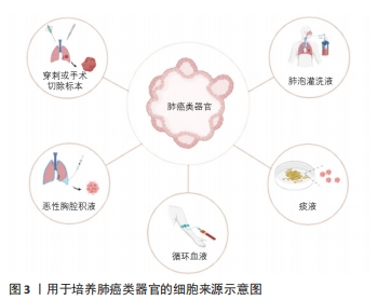
2.1 肺癌研究模型的创新 以往有关肺癌的探索主要基于已经建立的肿瘤细胞系和患者来源的异种移植物等模型。然而,肺癌肿瘤细胞系仅能展现二维细胞活动、缺乏细胞间交流互动和肿瘤微环境,最重要的是缺乏个体异质性,故在实际应用中仍存在障碍。患者来源的异种移植模型是将患者的肿瘤组织移植于免疫缺陷小鼠后建立的,能保持原位肿瘤部分遗传特性,但物种差异、构建成本高是其主要局限[7]。 类器官(Organoids)是由干细胞或器官特异性祖细胞通过自组织过程发展而来,能够展现与体内相应器官相似结构和功能的复杂三维结构[8] ,能够展现细胞间、细胞与基质间的相互作用。LANCASTER等[9]定义了类器官的3个重要特征:必须包含相应器官特异性的细胞;能重复该器官某些特定功能;细胞的空间组织排布应与原器官相似。类似地,将癌症患者的癌细胞进行体外三维培养,同样可构建包括肺癌在内的多种患者来源的肿瘤类器官模型[10]。相比传统模型,肺癌类器官构建成功率更高[11],增殖速度快,具有良好的可操作性,高度保留了患者肿瘤的异质性[12],且较高的经济性保证了其能够进行高通量药物筛选[7],因此在指导肺癌精准治疗的临床前药物决策层面具备巨大价值。 用于培养肺癌类器官的细胞可从多处获取,包括穿刺或手术标本、胸腔积液、循环血液及肺泡灌洗液等[13-17],甚至痰源性的肺癌类器官也被成功构建[18],见图3。对于肺癌晚期无手术指征的患者来说,这些非手术标本的肿瘤细胞来源具有重要意义;而对于一般活检或手术标本来源的组织,多采用酶解法获取癌细胞。但LI等[19]认为机械解离法更具优势,能够解决肺腺癌类器官在传代后期停止生长的问题。目前,对于不同细胞来源和组织处理方式是否影响肺癌类器官的形成仍并不清楚[20]。肺癌类器官需要培养基中的基质材料为细胞增殖提供落脚点并调节其生长代谢。从小鼠肉瘤中提取的Matrigel基质胶是最常见的基质材料[21]。然而,Matrigel不同批次之间存在成分差异,导致培养结果的可重复性较低。"
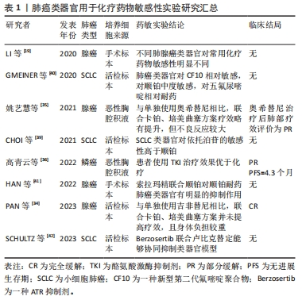
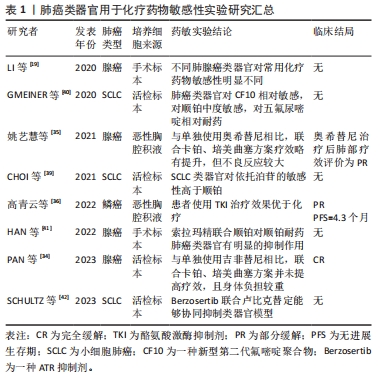
目前,研究人员开发了多种天然或合成材料制备的水凝胶系统并成功应用于肺癌类器官培养,通过对其生化特性进行调节,显著提高了培养效率和可重复性[22-24]。值得注意的是,URCIUOLO等[25]提出的水凝胶嵌套水凝胶实时生物打印方法,能够在细胞培养过程中,根据其形态、特性的变化,对水凝胶的物理性质进行精确调节,这实现了对水凝胶支架的动态控制,初步解决了生物支架可塑性有限的问题,有望更加真实地模拟肿瘤发展。另外,猪肺源性脱细胞细胞外基质水凝胶能再现自体肺组织的细胞外基质成分,充分模拟肿瘤微环境[26]。这些新技术和方法的创新性在于它们以前所未有的方式改进了肺癌类器官的培养和模拟肿瘤微环境的能力。实时生物打印方法的引入允许研究人员根据细胞的实际行为对培养条件进行动态调整,这种实时性和精确性将有助于更好地模拟肿瘤的生长和响应过程。同时,细胞外基质水凝胶作为能够再现自体肺组织特性的材料,弥补了以往培养基质的不足的缺陷,更真实地模拟了肿瘤微环境。多样的取材来源和培养方式的创新将有望提高肺癌类器官的可操作性和生物相似性,从而更好地模拟真实的肿瘤情境,提高肺癌研究的深度和广度,为未来的精准医学治疗提供更多可能性。 为进一步验证肺癌类器官的可靠性,CHEN等 [27]通过多种方法对比了7对非小细胞肺癌类器官与相应的肿瘤手术标本,发现其中5对的相关基因突变一致率超过80%。类似地,研究人员将痰源性肺癌类器官移植到免疫缺陷小鼠,发现其病理外观、组织学亚型标志物表达均与原发肿瘤一致,且肺癌类器官中亚型标志物mRNA的表达也与原发肿瘤中的蛋白表达一致[18]。由此可见,患者来源的肺癌类器官能够良好地继承并再现原发肿瘤在组织形态和生物标志物等方面的特异性,具有高度可信性。 综上,肺癌类器官作为新的肺癌研究模型,其培养细胞来源多样,培养介质不断优化创新,同时能继承原发肿瘤的生物特征,展现出巨大应用潜力,不仅为深入了解肺癌发生发展机制提供了研究平台,更有望成为抗癌药物筛选的重要工具指导未来临床实践。 2.2 肺癌类器官用于精准医疗指导下的药物筛选 癌症的精准医疗强调患者的特异性,旨在根据个体内在的生物学信息,通过多种医学前沿技术为患者提供个性化治疗[28]。目前关于肺癌的精准治疗方案主要依赖于其组织学亚型和基因特征[29],如针对表皮细胞生长因子(epidermal growth factor receptor,EGFR)等基因突变或融合的患者首选酪氨酸激酶抑制剂(tyrosine Kinase Inhibitor,TKI)等,而对于未发现常见驱动基因突变的患者则首选化疗或联合免疫疗法。新型靶向药物、免疫治疗药物确有成效[30],但临床耐药时常发生,且由于个体差异和肿瘤异质性,不同患者对同一药物的治疗反应不尽相同[19]。另外,化疗药物多属细胞毒类药物,不良反应较大,患者常因难以耐受而暂停用药,这导致肺癌的5年生存率只有近20%[2]。 抗癌药物筛选是潜在的优化策略。通过筛选协助制定治疗方案,以最大限度地提升治疗效果、减轻毒副反应。然而,通过传统二维细胞系筛选的抗肿瘤药物实际效果并不理想[31]。前文已述,肺癌类器官相较于传统模型具有多种优势,可作为新的药物筛选模型。目前基于肺癌类器官进行高通量药物筛选已被证实可行且灵敏度极高[17,32]。另外在一项包含212例样本的大规模研究中,其药敏检测结果与临床反应的总体一致率达到83.33%,证实肺癌类器官药敏检测具有很高的准确率[14]。总之,肺癌类器官具有成为筛选抗癌药物的可靠新工具的潜力,以弥补临床经验性治疗的不足,进一步推动精准医疗的发展。 2.2.1 化疗药物 化疗药物主要通过干扰细胞增殖的不同环节以抑制或消灭肿瘤细胞,然而此类药物毒副反应大,患者依从性差,且几乎所有化疗药物都缺乏明确的疗效预测标志物[33]。因此可基于肺癌类器官开展化疗药敏检测以选择最优解。针对不同个体,通过对紫杉醇、依托泊苷及吉西他滨等常用化疗药物开展药敏检测[19],修正具体的临床用药方案,有望使患者最大限度获益。另外在化疗与其他类型药物联合治疗方面,肺癌类器官亦能发挥其辅助意义。多项研究通过肺癌类器官检测发现,与靶向药物单药治疗相比,化疗药物的引入并未增强肿瘤抑制效果[34-36];且最终患者接受靶向药物单药治疗后,肿瘤抑制效果明显,这反映出,即使患者接受化疗,付出更高代价的同时并未增加收益,而利用肺癌类器官进行药敏检测有效避免了此问题。除常规药物,肺癌类器官还被用于筛选包括去氢骆驼蓬碱、小檗碱和甜菜碱等在内的多种天然化合物[37],这为开发新一代治疗药物提供了基础。 化疗是小细胞肺癌的治疗核心,且几乎所有的患者都在短暂缓解后出现耐药[38]。通过肺癌类器官探索可行的联合治疗方案或替代药物有望改善小细胞肺癌治疗现状。相关肺癌类器官药敏研究发现,相较于顺铂,依托泊苷对RNA培养条件下的小细胞肺癌类器官抑制效果更明显[39];新型第二代氟嘧啶聚合物CF10的抗肿瘤效果同样优于顺铂,5-氟尿嘧啶效果则较差[40],提示依托泊苷和CF10对小细胞肺癌的治疗潜力。而对于复发耐药型的小细胞肺癌,多项研究利用肺癌类器官筛选发现,联合用药,如索拉玛精联合顺铂[41]、ATR抑制剂Berzosertib联合卢比克替定[42],可以对肿瘤细胞起到协同抑制作用,用于小细胞肺癌耐药后治疗。这为了解和应对小细胞肺癌化疗耐药问题提供了潜在解决思路或方案,为个性化治疗提供了基础,有望改善临床治疗效果。 值得注意的是,顺铂和依托泊苷对小细胞肺癌类器官不同部位的肿瘤细胞抑制作用并不一致[43];且与肺癌类器官相比,相同组织来源的肺癌细胞系对化疗药物的敏感性更高[13,44]。这可能与细胞空间排布引起不同部位的药物浓度不同有关,也可能是癌细胞在体外扩增后表型改变导致,如何对肺癌类器官药物筛选模型进行改进是未来可行的研究方向。另外,某些化疗药物需要被机体代谢转化为活性形式才能发挥抗肿瘤效应[33],如环磷酰胺需要在体内经肝脏代谢后形成磷酰胺氮芥,在这种情况下,只能用其活性形式进行类器官药敏检测。总之,在进行具体化疗药物评估之前,需充分了解药物作用机制,避免出现错误结论。利用肺癌类器官开展化疗药物敏感性检测相关文献结论总结如表1所示。"
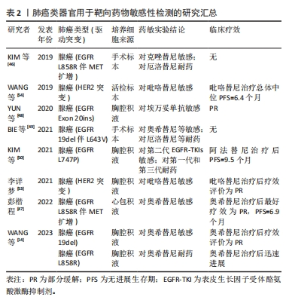
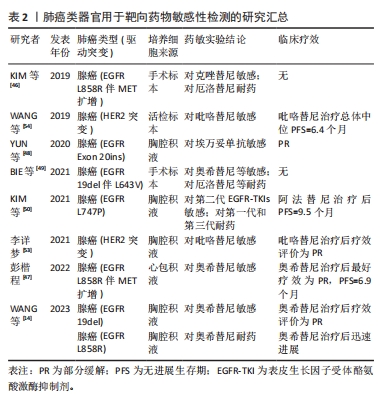
2.2.2 靶向药物 与传统的广谱化疗药不同,靶向治疗通过直接干预癌细胞的异常信号通路来发挥作用,是目前肺癌治疗备受关注的新方法。目前绝大部分靶向药物都有明确的异常基因筛选标志[45],因此基因检测对这部分药物的选择非常重要。然而基因检测所能达到的精准度仍然有限,肺癌类器官有望起到良好的辅助作用,已弥补靶向药物精准治疗的不足。 目前,已有多个团队针对临床常见的EGFR突变型肺癌开展了类器官靶向药敏实验。在WANG等[14]的一项研究中,一位EGFR 19号外显子缺失患者接受一线埃克替尼治疗后效果评价为局部进展,而最终根据肺癌类器官药敏试验结果改选奥希替尼治疗后疗效持续评价为局部缓解。同时,肺癌类器官也证明了临床指南的局限性,有患者使用指南推荐药物后迅速进展,与肺癌类器官药敏结果提示耐药一致。以上病例从正反两方面展现出肺癌类器官对于靶向药物的疗效预测潜力。通过观察体外模型的反应,临床医师可以选择更精准的治疗方案,以期在治疗中取得更好的效果,进一步提升患者生存率。另一方面,疗效预测也有助于提示更换药物选择,避免无效治疗。对于多种突变并存的病例,肺癌类器官亦展现出不俗的药物筛选能力。如对于EGFR突变伴MET扩增型非小细胞肺癌,肺癌类器官药敏检测结果可以很好地展现不同代际甚至不同类别靶向药物之间的抗肿瘤活性差异[46-47],部分结果与患者最终疗效是一致的。另外,随着测序技术的发展,越来越多的罕见EGFR突变类型逐渐受到关注,针对这些肺癌类型开展肺癌类器官药敏检测有助于推动相关诊疗进步。研究人员首先通过肺癌类器官证明了埃万妥单抗对EGFR 20号外显子插入型非小细胞肺癌的有效性,在随后开展的体内实验更是显示,埃万妥单抗疗效优于西妥昔单抗[48],表明其可能是治疗EGFR 20号外显子插入突变型非小细胞肺癌的候选药物。对于其他罕见突变类型,如EGFR 19del伴L643V双突变[49]、EGFR L747P[50],肺癌类器官均成功预测敏感药物,且使患者获益。针对此类罕见病例,肺癌类器官的意义在于更好地在现有治疗指南的指导下进一步修正治疗方案,弥补经验性治疗在此方面的不足甚至空白,为罹患此类肺癌的患者带来新的机会和希望HER2突变约与3%的非鳞状非小细胞肺癌有关,HER2靶向药物效果有限导致与一般非小细胞肺癌Ⅳ期患者相比,HER2突变患者的总生存期更短[51-52]。利用肺癌类器官针对此类患者筛选有效的HER2靶向药物以改善其预后是一条可行策略。通过肺癌类器官筛选发现,对比联合化疗方案,吡咯替尼的半数抑制浓度和细胞抑制率表现更优,且患者使用吡咯替尼治疗前后CT对比显示肿物明显缩小,正面验证了药敏检测结果[53]。同样的结论也见于WANG等[54]的研究,他们根据肺癌类器官药敏检测结果,给予15例未接受过吡咯替尼作为一线用药的HER2突变型非小细胞肺癌患者较高计量的吡咯替尼治疗,最终总体中位无进展生存期为6.4个月。以上报道为靶向药物能够批准应用于此型肺癌提供了依据[55]。总的来说,类器官对于HER2突变型肺癌的意义不仅在于个体化的药物选择,还在于提供了更深入、更全面的药物评价和临床指导,这为改善此型肺癌患者的治疗效果和生存预后提供了潜在解决方案,同时也为类器官技术在肿瘤治疗领域的应用带来了更多希望。 利用肺癌类器官开展靶向药物敏感性检测相关文献结论总结如表2所示。"

2.2.3 免疫治疗药物 免疫疗法是癌症治疗领域的一大创新,为肿瘤治疗带来根本性的改变[56]。目前,免疫检查点抑制剂已经获批应用于肺癌一线治疗,程序性细胞死亡蛋白1 (PD-1)/程序性细胞死亡配体1 (PD-L1)的单克隆抗体等也已成为肺癌免疫治疗的主要药物[57]。但由于诱导持久有效的免疫细胞应答尚有困难,且目前临床实践中,仅通过免疫组化染色检测PD-1的表达量以预测其疗效的效果不佳[57],加之此类药物高昂的成本,仅有一小部分患者获益,故总体治疗效果十分有限[58]。 肺癌类器官虽然在化疗及靶向治疗方面拥有优秀的药效预测能力,但无法直接应用于免疫治疗药物的筛选预测。这主要是因为,免疫治疗药物主要干预免疫调节机制,通过增强免疫细胞对癌细胞的杀伤能力来发挥作用,而肺癌类器官中缺乏至关重要的免疫细胞成分,无法体现免疫细胞与肿瘤细胞之间的相互作用[59]。幸运的是,目前已有多种方法可实现类器官-免疫细胞共培养[60],使利用肺癌类器官平台进行免疫药物筛选成为可能。NEAL等[61]用气液界面法成功构建出含有T细胞、B细胞及NK细胞等免疫细胞的肺癌类器官,他们用纳武利尤单抗阻断免疫检查点,发现T细胞对IFNG,PRF1和/或GZMB转录物的表达增加,肿瘤细胞被破坏。这些结果证明肺癌类器官与免疫细胞共培养能够观察到免疫治疗药物的效果,证明了将其用于免疫治疗药物筛选的可行性。为比较不同免疫检查点抑制剂之间的差异,TAKAHASHI团队[62]将高表达PD-1的外周血单个核淋巴细胞与肺癌类器官共培养后检测发现,帕博利珠单抗的细胞溶解活性约为纳武利尤单抗的50倍,这一显著差异可能与两种单抗与PD-1的亲和力大小有关,说明帕博利珠单抗的效果可能更优。然而其结果与临床实际的一致性有待验证,且尚不清楚在PD-1正常表达的条件下是否能获得同样结果。 MEK1和MEK2是MAPK通路的关键分子,MEK抑制剂被发现在阻断信号通路的同时对免疫系统有一定的调节作用,这提示MEK抑制剂与免疫检查点抑制剂之间可能存在协同作用[63]。为此,DELLA等[63]利用肺癌类器官对比阿替利珠单抗、阿维单抗和司美替尼3种药物的单药或联合用药效果,最终发现两类药物联合用药后药效显著增强。这可能是由于MEK抑制剂通过刺激免疫细胞分泌细胞因子维持了免疫反应,增强了抗PD-1对T细胞的作用。这项研究为深入理解两者在联合治疗中的相互作用提供了重要线索和有利见解。同时结果提示,在抗PD-1/PD-L1的基础上联合MEK抑制剂将获取协同作用,这可能是潜在的新型治疗方案,能够获得更令人满意的免疫治疗效果,从而为癌症患者提供更有效的治疗选择,未来可开展相关临床实验进一步验证。 利用肺癌类器官开展靶向药物敏感性检测相关文献结论总结如表3所示。"

综上所述,肺癌类器官作为一种创新技术,对于化疗、靶向治疗和免疫治疗药物的选择方面具有巨大辅助意义。通过药物敏感性测试,为患者定制个体化的治疗策略,可避免不必要的药物试错和毒副反应;或为基于基因检测的靶向药物提供精确支持,提高治疗的成功率,同时弥补对于罕见突变类型的治疗空白;亦或是通过免疫共培养模拟免疫微环境,为优化免疫治疗方案、最大限度地提高患者的治疗效果提供了新途径。且值得注意的是,为指导肿瘤类器官在精准治疗中的应用、规范肿瘤类器官药物敏感性检测流程,多项共识相继发布[33,64],不仅肯定了肿瘤类器官对于抗癌药物的预测价值,对于确保药敏检测结果准确可靠也具有重要意义,有助于推动相关领域的发展和临床转化。值得一提的是,肺癌类器官在培养过程中可能出现与原始细胞不同的亚群[44],这种内部异质性提示不同部位的癌细胞可能表现出不同的药物敏感性,应尽可能考虑从肿瘤不同部位取材进行多次检测,以提高检测结果准确性。总之,通过肺癌类器官模型进行药物敏感性实验筛选最佳药物,可以更准确地预测评估药物疗效或彼此之间的协同作用,以获得最大收益,为未来的肺癌临床治疗提供参考和指导,进一步实现精准医疗。 2.3 肺癌类器官应用中的挑战与创新 尽管肺癌类器官在药物筛选和制定个性化用药方案等方面展现了特有优势,但在实际应用中也显现出局限性,在其真正实现临床转化之前仍有诸多不足需弥补,见图4。"
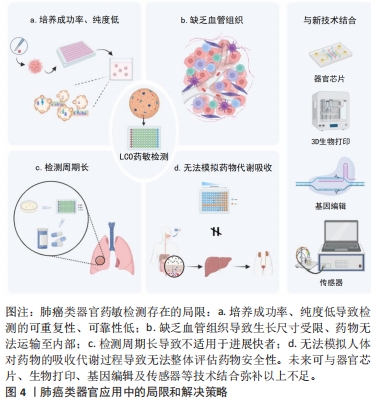

肺癌类器官培养成功率并不稳定,为7%-87%[65],且正常气道类器官的生长,使得肺癌类器官纯度降低。研究显示,超过80%的肺癌类器官存在正常气道类器官的生长,纯非小细胞肺癌类器官的培养率仅为17%[66],这导致肺癌类器官的可重复性和作为药敏实验平台的可靠性和准确性受到影响。细胞来源可能是影响纯度和成功率的一个因素。恶性胸腔积液来源的肺癌类器官培养成功率和纯度较组织来源更高[14]。这可能是因为恶性胸腔积液中肺癌细胞成分占比较大,而后者包含大量正常气道或肺泡上皮细胞,且无法完全通过酶消化。另外,获取足够数量的存活癌细胞是培养的前提,而活检方式获取量较少[67-68],这可能是导致肺癌类器官培养成功率低的另一个原因。PARK等[68]证明支气管冷冻活检可以安全获取大量肺组织,构建成功率约为40%,且能够维持较高的癌细胞纯度。此外,一种基于超疏水微孔阵列芯片的原位冷冻保存技术为肺癌类器官传代至后期纯度降低的问题提供了可能的解决方案[65-66,69-70]。肺癌类器官培养基缺乏标准化对培养结果也存在一定影响,不同实验室对培养基中细胞因子等的添加不同,培养时间为3-6个月[46,71]。目前肺癌类器官培养基多是在结直肠癌类器官培养基基础上进行改进[72],缺乏肺癌特异性。因此未来可挑选肺癌高相关性细胞因子,优化培养基配方以提高培养成功率和纯度,必要时具体浓度和添加顺序也可纳入研究范畴。此外,SACHS等[73]发现Nutlin-3a可诱导TP53野生型正常气道类器官衰老凋亡,以纯化TP53突变型肺癌类器官。这为针对不同肺癌亚型制定特异性的培养基配方提供了很好的思路和范例。 肺癌类器官当前还无法预测抗血管生成药物的效果[74],这主要是因为其缺乏血管组织。缺乏血液循环的类器官生长超过一定大小后,其中心会因营养和氧气扩散限制等原因而发生坏死[75];同时,缺乏血管组织意味着药物无法经血液途径向类器官内部运输,进而影响药敏结果的准确性,故实现其内部血管化是完善类器官模型的关键一环。PARK等[76]在水凝胶上选择性去除部分材料以形成管状空隙来模拟血管,通过肺癌细胞与人脐静脉内皮细胞共培养初步实现肺癌类器官血管化。同样基于共培养策略,SEITLINGER等[77]证明血管化肺癌类器官同血管化微环境之间可以进行相互连接,这在血管化基础上进一步还原了肿瘤微环境,尽管如此,该研究也存在明显局限性,研究人员仅通过共聚焦显微镜分析获得三维重建来证实微血管管腔的存在,而这并不能直接证明血管的通透性。值得注意的是,基于3D生物打印技术构建的血管化肺癌类器官被证实可在多细胞水平实现灌注[28],但受限于生物打印技术高昂的成本和复杂的技术,此方法难以实现临床普及。 药敏检测周期较长是阻碍肺癌类器官临床转化的另一大壁垒,完整进行肺癌类器官培养及药敏检测的周期通常为数周甚至数月[30,46,78],这对病情进展快的晚期肺癌患者来说并不友好[79]。因此,如何加快培养检测流程是未来的探索方向。有学者利用超疏水微孔阵列芯片成功将药敏检测周期缩短至1周,并证明了其与临床疗效的一致性[78]。另外,基于CRISPR-Cas9基因编辑技术,可以利用小鼠肺类器官快速生成在基因组和表型水平上与人类肺鳞癌密切相似的肺癌类器官[80],提示这可能是加快肺癌类器官生成的另一种策略。 从宏观层面而言,药物在体内的吸收、代谢是多器官协同作用的结果,而肺癌类器官难以模拟这种生理过程,故无法评估药物对于其他器官的安全性。幸运的是,基于微流控技术,构建创新性的体外多类器官系统已成现实[81]。在此基础上,蒋得明[82]整合多参数传感器技术,构建出一套包括肺癌类器官、肝类器官和培养三维心肌模型的多器官传感器系统,用于模拟药物在人体内经肝脏-心脏-肺癌的循环过程,从而同步评价抗肺癌药物的疗效和对心、肝的毒性。这项创新性研究虽然仅是对人体生理系统的简单提炼,但通过将肺癌类器官与多个其他器官模型相结合,实现了对药物在多器官、多系统内的整体评估,这有助于更全面地衡量药物的利害,完善经类器官的敏感药物筛选。除此以外,这对药物研发和优化也具有重要意义。"

| [1] SIEGEL RL, MILLER KD, WAGLE NS, et al. Cancer statistics, 2023. CA Cancer J Clin. 2023;73(1):17-48. [2] CAO M, LI H, SUN D, et al. Current cancer burden in China: epidemiology, etiology, and prevention. Cancer Biol Med. 2022;19(8):1121-1138. [3] WANG DC, WANG W, ZHU B, et al. Lung cancer heterogeneity and new strategies for drug therapy. Annu Rev Pharmacol Toxicol. 2018;58:531-546. [4] BYRNE AT, ALFÉREZ DG, AMANT F, et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 2017;17(4): 254-268. [5] JIN Y, LIU M, SA R, et al. Mouse models of thyroid cancer: Bridging pathogenesis and novel therapeutics. Cancer Lett. 2020;469:35-53. [6] LI M, IZPISUA BELMONTE JC. Organoids-preclinical models of human disease. N Engl J Med. 2019;380(6):569-579. [7] 贾梓淇, 梁乃新, 李单青. 类器官在肺癌精准治疗中的应用[J].中国肺癌杂志,2020,23(7):615-620. [8] ROSSI G, MANFRIN A, LUTOLF MP. Progress and potential in organoid research. Nat Rev Genet. 2018;19(11):671-687. [9] LANCASTER MA, KNOBLICH JA. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. 2014;345(6194):1247125. [10] MONDRINOS MJ, JONES PL, FINCK CM, et al. Engineering de novo assembly of fetal pulmonary organoids. Tissue Eng Part A. 2014;20(21-22):2892-2907. [11] KENNY HA, LAL-NAG M, WHITE EA, et al. Quantitative high throughput screening using a primary human three-dimensional organotypic culture predicts in vivo efficacy. Nat Commun. 2015;6:6220. [12] DROST J, CLEVERS H. Organoids in cancer research. Nat Rev Cancer. 2018;18(7): 407-418. [13] MAZZOCCHI A, DEVARASETTY M, HERBERG S, et al. Pleural effusion aspirate for use in 3D lung cancer modeling and chemotherapy screening. ACS Biomater Sci Eng. 2019;5(4):1937-1943. [14] WANG H, ZHANG C, PENG K, et al. Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: a real-world study. Cell Rep Med. 2023;4(2):100911. [15] 周鲁林,张文,段新春,等.3D培养体系富集外周血中的循环肿瘤干细胞的研究[J].中国肿瘤,2019,28(5):381-386. [16] 李国良.患者来源肿瘤类器官的细胞与分子生物学特征及其临床意义[D].北京:北京协和医学院,2022. [17] SACHS N, PAPASPYROPOULOS A, ZOMER-VAN OD, et al. Long-term expanding human airway organoids for disease modeling. EMBO J. 2019;38(4):e100300. [18] EBISUDANI T, HAMAMOTO J, TOGASAKI K, et al. Genotype-phenotype mapping of a patient-derived lung cancer organoid biobank identifies NKX2-1-defined Wnt dependency in lung adenocarcinoma. Cell Rep. 2023;42(3):112212. [19] LI Z, QIAN Y, LI W, et al. Human lung adenocarcinoma-derived organoid models for drug screening. iScience. 2020;23(8):101411. [20] 潘跃天.肺癌类器官建模成功率及体外敏感性检测相关分析[D].石家庄:河北医科大学,2020. [21] LI Z, YU L, CHEN D, et al. Protocol for generation of lung adenocarcinoma organoids from clinical samples. STAR Protoc. 2021;2(1):100239. [22] AISENBREY EA, MURPHY WL. Synthetic alternatives to matrigel. Nat Rev Mater. 2020;5(7):539-551. [23] MONLEÓN-GUINOT I, MILIAN L, MARTÍNEZ-VALLEJO P, et al. Morphological characterization of human lung cancer organoids cultured in type I collagen hydrogels: a histological approach. Int J Mol Sci. 2023;24(12):10131. [24] GAN Z, QIN X, LIU H, et al. Recent advances in defined hydrogels in organoid research. Bioact Mater. 2023;28:386-401. [25] URCIUOLO A, GIOBBE GG, DONG Y, et al. Hydrogel-in-hydrogel live bioprinting for guidance and control of organoids and organotypic cultures. Nat Commun. 2023;14(1):3128. [26] CHOI YM, LEE H, ANN M, et al. 3D bioprinted vascularized lung cancer organoid models with underlying disease capable of more precise drug evaluation. Biofabrication. 2023. doi: 10.1088/1758-5090/acd95f. [27] CHEN JH, CHU XP, ZHANG JT, et al. Genomic characteristics and drug screening among organoids derived from non-small cell lung cancer patients. Thorac Cancer. 2020;11(8):2279-2290. [28] MATEO J, STEUTEN L, AFTIMOS P, et al. Delivering precision oncology to patients with cancer. Nat Med. 2022;28(4):658-665. [29] MA H, ZHU Y, ZHOU R, et al. Lung cancer organoids, a promising model still with long way to go. Crit Rev Oncol Hematol. 2022;171:103610. [30] ZENG X, MA Q, LI X, et al. Patient-derived organoids of lung cancer based on organoids-on-a-chip: enhancing clinical and translational applications. Front Bioeng Biotechnol. 2023;11:1205157. [31] WANG J, LI X, CHEN H. Organoid models in lung regeneration and cancer. Cancer Lett. 2020;475:129-135. [32] VLACHOGIANNIS G, HEDAYAT S, VATSIOU A, et al. Patient-derived organoids model treatment response of metastatic gastrointestinal cancers. Science. 2018; 359(6378):920-926. [33] 王树滨,高静,朱宇,等.类器官药物敏感性检测指导肿瘤精准治疗临床应用专家共识(2022年版)[J].中国癌症防治杂志,2022,14(3):234-239. [34] PAN Y, CUI H, SONG Y. Organoid drug screening report for a non-small cell lung cancer patient with EGFR gene mutation negativity: a case report and review of the literature. Front Oncol. 2023;13:1109274. [35] 姚艺慧.探索第一、二代序贯第三代EGFR-TKI治疗EGFR突变晚期非小细胞肺癌的适宜人群[D].广州:南方医科大学,2021. [36] 高青云,林晓程,陈雨晴,等.驱动基因阳性肺鳞癌的疗效及肿瘤免疫微环境探索分析[J].循证医学,2022,22(2):105-118. [37] LI Y F, GAO Y, LIANG BW, et al. Patient-derived organoids of non-small cells lung cancer and their application for drug screening. Neoplasma. 2020;67(2):430-437. [38] ZUGAZAGOITIA J, PAZ-ARES L. Extensive-stage small-cell lung cancer: first-line and second-line treatment options. J Clin Oncol. 2022;40(6):671-680. [39] CHOI SY, CHO Y, KIM D, et al. Establishment and long-term expansion of small cell lung cancer patient-derived tumor organoids. Int J Mol Sci. 2021;22(3):1349. [40] GMEINER WH, MILLER LD, CHOU JW, et al. Dysregulated pyrimidine biosynthesis contributes to 5-FU resistance in SCLC patient-derived organoids but response to a novel polymeric fluoropyrimidine, CF10. Cancers (Basel). 2020;12(4):788. [41] HAN Y, SHI J, XU Z, et al. Identification of solamargine as a cisplatin sensitizer through phenotypical screening in cisplatin-resistant NSCLC organoids. Front Pharmacol. 2022;13:802168. [42] SCHULTZ CW, ZHANG Y, ELMESKINI R, et al. ATR inhibition augments the efficacy of lurbinectedin in small-cell lung cancer. EMBO Mol Med. 2023;15(8):e17313. [43] JUNG DJ, SHIN TH, KIM M, et al. A one-stop microfluidic-based lung cancer organoid culture platform for testing drug sensitivity. Lab Chip. 2019;19(17): 2854-2865. [44] 李松旻.呼吸系统中化学感觉信号转导通路在生物传感器构建、免疫响应检测和肿瘤药物筛选中的应用[D].杭州:浙江大学,2021. [45] TAN AC, TAN D. Targeted therapies for lung cancer patients with oncogenic driver molecular alterations. J Clin Oncol. 2022;40(6):611-625. [46] KIM M, MUN H, SUNG CO, et al. Patient-derived lung cancer organoids as in vitro cancer models for therapeutic screening. Nat Commun. 2019;10(1):3991. [47] 彭楷程. EGFR突变伴原发MET基因扩增晚期非小细胞肺癌临床结局及类器官模型研究[D].广州:华南理工大学,2022. [48] YUN J, LEE SH, KIM SY, et al. Antitumor activity of amivantamab (JNJ-61186372), an EGFR-MET bispecific antibody, in diverse models of EGFR Exon 20 insertion-driven NSCLC. Cancer Discov. 2020;10(8):1194-1209. [49] BIE Y, WANG J, XIONG L, et al. Lung adenocarcinoma organoids harboring EGFR 19Del and L643V double mutations respond to osimertinib and gefitinib. Medicine (Baltimore). 2021;100(11):e24793. [50] KIM SY, KIM SM, LIM S, et al. Modeling clinical responses to targeted therapies by patient-derived organoids of advanced lung adenocarcinoma. Clin Cancer Res. 2021;27(15):4397-4409. [51] JEBBINK M, DE LANGEN AJ, BOELENS MC, et al. The force of HER2 - A druggable target in NSCLC? Cancer Treat Rev. 2020;86:101996. [52] HYMAN DM, PIHA-PAUL SA, WON H, et al. Author correction: HER kinase inhibition in patients with HER2- and HER3-mutant cancers. Nature. 2019;566 (7745):E11-E12. [53] 李祥梦.ERBB1/2/4突变型晚期非小细胞肺癌患者的临床疗效观察及体外模型验证[D].广州:华南理工大学,2021. [54] WANG Y, JIANG T, QIN Z, et al. HER2 exon 20 insertions in non-small-cell lung cancer are sensitive to the irreversible pan-HER receptor tyrosine kinase inhibitor pyrotinib. Ann Oncol. 2019;30(3):447-455. [55] LI BT, SMIT EF, GOTO Y, et al. Trastuzumab deruxtecan in HER2-mutant non-small-cell lung cancer. N Engl J Med. 2022;386(3):241-251. [56] ROBERT C. A decade of immune-checkpoint inhibitors in cancer therapy. Nat Commun. 2020;11(1):3801. [57] WIELEBA I, WOJAS-KRAWCZYK K, KRAWCZYK P, et al. Clinical application perspectives of lung cancers 3D tumor microenvironment models for in vitro cultures. Int J Mol Sci. 2022;23(4):2261. [58] MAGRE L, VERSTEGEN M, BUSCHOW S, et al. Emerging organoid-immune co-culture models for cancer research: from oncoimmunology to personalized immunotherapies. J Immunother Cancer. 2023;11(5):e006290. [59] ESFAHANI K, ROUDAIA L, BUHLAIGA N, et al. A review of cancer immunotherapy: from the past, to the present, to the future. Curr Oncol. 2020;27(Suppl 2): S87-S97. [60] YUKI K, CHENG N, NAKANO M, et al. Organoid models of tumor immunology. Trends Immunol. 2020;41(8):652-664. [61] NEAL JT, LI X, ZHU J, et al. Organoid modeling of the tumor immune microenvironment. Cell.2018;175(7):1972-1988.e16. [62] TAKAHASHI N, HOSHI H, HIGA A, et al. An in vitro system for evaluating molecular targeted drugs using lung patient-derived tumor organoids. Cells. 2019;8(5):481. [63] DELLA CC, BARRA G, CIARAMELLA V, et al. Antitumor activity of dual blockade of PD-L1 and MEK in NSCLC patients derived three-dimensional spheroid cultures. J Exp Clin Cancer Res. 2019;38(1):253. [64] 中国抗癌协会肿瘤多学科诊疗专业委员会,中国抗癌协会肿瘤内分泌专业委员会, 赵冰,等. 肿瘤类器官诊治平台的质量控制标准中国专家共识(2022年版)[J].中国癌症杂志,2022,32(7):657-668. [65] LEE D, KIM Y, CHUNG C. Scientific validation and clinical application of lung cancer organoids. Cells. 2021;10(11):3012. [66] DIJKSTRA KK, MONKHORST K, SCHIPPER LJ, et al. Challenges in establishing pure lung cancer organoids limit their utility for personalized medicine. Cell Rep. 2020;31(5):107588. [67] WERNER RS, KIRSCHNER MB, OPITZ I. Primary lung cancer organoids for personalized medicine—are they ready for clinical use? Cancers (Basel). 2021; 13(19):4832. [68] PARK D, LEE D, KIM Y, et al. Cryobiopsy: a breakthrough strategy for clinical utilization of lung cancer organoids. Cells. 2023;12(14):1854. [69] LIU Q, ZHAO T, WANG X, et al. In situ vitrification of lung cancer organoids on a microwell array. Micromachines (Basel). 2021;12(6):624. [70] ROSSI R, DE ANGELIS ML, XHELILI E, et al. Lung cancer organoids: the rough path to personalized medicine. Cancers (Basel). 2022;14(15):3703. [71] SHI R, RADULOVICH N, NG C, et al. Organoid cultures as preclinical models of non–small cell lung cancer. Clin Cancer Res. 2020;26(5):1162-1174. [72] LI Y, GAO X, NI C, et al. The application of patient-derived organoid in the research of lung cancer. Cell Oncol (Dordr). 2023;46(3):503-519. [73] SACHS N, PAPASPYROPOULOS A, ZOMER-VAN O D, et al. Long-term expanding human airway organoids for disease modeling. EMBO J. 2019;38(4):e100300. [74] 黎文锋.TP53基因对EGFR突变晚期非小细胞癌患者的预测和预后意义[D].广州:华南理工大学临床医学,2021. [75] WANG J, CHEN C, WANG L, et al. Patient-derived tumor organoids: new progress and opportunities to facilitate precision cancer immunotherapy. Front Oncol. 2022;12:872531. [76] PARK S, KIM TH, KIM SH, et al. Three-dimensional vascularized lung cancer-on-a-chip with lung extracellular matrix hydrogels for in vitro screening. Cancers (Basel). 2021;13(16):3930. [77] SEITLINGER J, NOUNSI A, IDOUX-GILLET Y, et al. Vascularization of patient-derived tumoroid from non-small-cell lung cancer and its microenvironment. Biomedicines. 2022;10(5):1103. [78] HU Y, SUI X, SONG F, et al. Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week. Nat Commun. 2021; 12(1):2581. [79] 张仕灵.化疗联合EGFR-TKIs或抗血管生成靶向突变转化型SCLC/NEC的表型和基因型复杂性[D].广州:南方医科大学,2022. [80] HAI J, ZHANG H, ZHOU J, et al. Generation of genetically engineered mouse lung organoid models for squamous cell lung cancers allows for the study of combinatorial immunotherapy. Clin Cancer Res. 2020;26(13):3431-3442. [81] RAJAN S A P, ALEMAN J, WAN M, et al. Probing prodrug metabolism and reciprocal toxicity with an integrated and humanized multi-tissue organ-on-a-chip platform. Acta Biomater. 2020;106:124-135. [82] 蒋得明.细胞与类器官传感器在抗肺癌药物评价和个体化治疗中的应用研究[D]. 杭州:浙江大学,2021. [83] NARANJO S, CABANA CM, LAFAVE LM, et al. Modeling diverse genetic subtypes of lung adenocarcinoma with a next-generation alveolar type 2 organoid platform. Genes Dev. 2022;36(15-16):936-949. [84] DEBEN C, DE LA HOZ EC, COMPTE ML, et al. OrBITS: label-free and time-lapse monitoring of patient derived organoids for advanced drug screening. Cell Oncol. 2023;46(2):299-314. |
| [1] | Zhang Aili, Huang Jiazheng, Fan Wen, Li Yihuan, Li Shuang, Gan Xuewen, Xiong Ying. Establishing equivalent model to verify the precision of personalized bone model rapidly [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(30): 4795-4799. |
| [2] | Jiang Yong, Guan Tianmin, Ci Yuan, Zhu Ye, Zhao Peng, Zheng Jiafa, Yang Tao, Zhang Guangyu. Application of mixed reality technology in vertebroplasty [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(30): 4812-4816. |
| [3] | Liu Chunlei, , , Yao Xi, Wei Zhengbo, Xie Ying. Construction methods and application of assembloids [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(1): 113-120. |
| [4] | Gan Tian, Wang Wenyuan, Yan Shujin, Hao Lan, Ran Haitao, Wang Zhigang, Xia Jizhu. Near infrared photoresponsive nanoparticles loaded with LXR agonists for photothermal immunotherapy [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(12): 1863-1869. |
| [5] | Ma Munan, Xie Jun, Sang Yuchao, Huang Lei, Zhang Guodong, Yang Xiaoli, Fu Songtao. Electroacupuncture combined with bone marrow mesenchymal stem cells in the treatment of chemotherapy-induced premature ovarian insufficiency in rats [J]. Chinese Journal of Tissue Engineering Research, 2023, 27(1): 1-7. |
| [6] | Wang Jifang, Bao Zhen, Qiao Yahong. miR-206 regulates EVI1 gene expression and cell biological behavior in stem cells of small cell lung cancer [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1027-1031. |
| [7] | Cai Shengsheng, Mei Heng, Zhang Xuequan, Deng Jin, Cao Jun, He Bin. Prepared HPe6DF composite nanoparticles enhance the effect of photodynamic therapy [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(10): 1566-1573. |
| [8] | Zhang Xiumei, Zhai Yunkai, Zhao Jie, Zhao Meng. Research hotspots of organoid models in recent 10 years: a search in domestic and foreign databases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(8): 1249-1255. |
| [9] | Jiao Hui, Zhang Yining, Song Yuqing, Lin Yu, Wang Xiuli. Advances in research and application of breast cancer organoids [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(7): 1122-1128. |
| [10] | Xu Junma, Yu Yuechao, Liu Zhi, Liu Yu, Wang Feitong. Application of 3D-printed coplanar template combined with fixed needle technique in percutaneous accurate biopsy of small pulmonary nodules [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(5): 761-764. |
| [11] | Liu Qi, Yao Xi, Wei Zhengbo, Xie Ying. Action mechanism and potential function on main components of organoid culture medium [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(31): 5072-5078. |
| [12] | Yu Dan, Xu Guanglan, Zhao Mei, Li Jiao, Li Guosheng, Wang Guangyao, Lin Hao, Zheng Manli, Li Yuanling. Significance and possibility of stem cells and multiple cell derived exosomes in the treatment of chronic respiratory diseases [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(25): 4053-4057. |
| [13] | Feng Ziyi, Liang Shanshan, Yu Weiting, Wang Ruoyu. Culture, research and application of patient-derived tumor organoids [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(25): 4082-4088. |
| [14] | Pan Xuan, Zhao Meng, Zhang Xiumei, Zhao Jie, Zhai Yunkai. Research and application of biological three-dimensional printing technology in the field of precision medicine: analysis of Chinese and English literature [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(21): 3382-3389. |
| [15] | Chen Jie, Liao Chengcheng, Chen Zhiwei, Wang Yan. Bladder cancer stem cell markers and related signaling pathways: antibody targeted therapy [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(19): 3090-3096. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||