Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (21): 3401-3409.doi: 10.12307/2022.651
Previous Articles Next Articles
Advantage of mesoporous materials in bone repair
Gao Feifei1, Du Bin2, Liu Xin2, Chen Hao1, Chen Yang1, Hou Wei1
- 1Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China; 2Department of Orthopedics and Traumatology, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China
-
Received:2021-07-03Accepted:2021-08-04Online:2022-07-28Published:2022-01-28 -
Contact:Du Bin, Professor, Chief physician, Doctoral supervisor, Department of Orthopedics and Traumatology, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China -
About author:Gao Feifei, Master candidate, Affiliated Hospital of Nanjing University of Chinese Medicine, Nanjing 210029, Jiangsu Province, China -
Supported by:National Natural Science Foundation of China, No. 82074471 (to DB); Youth Foundation of National Natural Science Foundation of China, No. 81804417 (to LX); Jiangsu Provincial Commission of Health Research Project, No. K2019027 (to DB)
CLC Number:
Cite this article
Gao Feifei, Du Bin, Liu Xin, Chen Hao, Chen Yang, Hou Wei. Advantage of mesoporous materials in bone repair[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(21): 3401-3409.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
2.1 介孔材料概述 介孔材料是理想的促骨修复材料,一方面其可以实现药物的控释,另一方面部分介孔材料可以作为支架材料在生物体内起到一定良好支撑作用及骨替代;更重要的是一些介孔材料本身就具有着骨传导甚至骨诱导特性。与普通缓释材料相比,介孔材料突出的特点就在于释药过程的可控、持续而且稳定。如OH等[6]的研究中,负载万古霉素的聚甲基丙烯酸甲酯骨水泥在释药过程中明显出现了短期暴发和后期持续低浓度释药过程,这就可能导致治疗效果不良。在生物医药领域,一般的生物大分子,如酶、蛋白质及核酸等,它们的相对分子质量为1-100万,它们的尺寸通常小于10 nm[7],如骨形态发生蛋白可以促进骨髓间充质干细胞定向分化为成骨细胞以诱导成骨,为骨再生常用诱导药物,仅由2个114肽亚单位通过二硫键共价连接的[8]。介孔材料的孔径为2-50 nm,对于这些药物的控释是分子水平的,故能够通过合成时调节孔径大小或者化学结构修饰的方法达到持久而又稳定的药物释放目的。作者检索以往文献,共总结出5类热门介孔材料:"
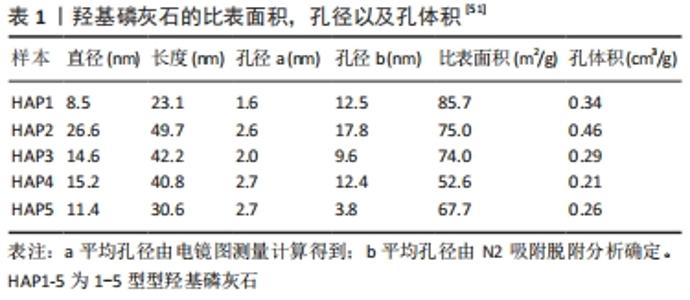
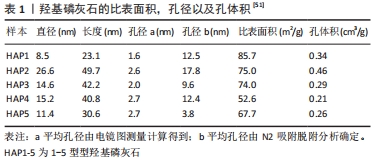
2.2 介孔硅基材料在骨修复中的应用 介孔硅基材料虽然目前种类繁多,但主要集中在介孔二氧化硅、介孔硅酸盐的研究。在介孔硅基材料中最具代表性的就是介孔二氧化硅,有研究在20世纪90年代初首次报道了介孔二氧化硅材料[16-17],他们将这种分级结晶分子筛命名为介孔二氧化硅,其制作方法是:前驱体与表面活性剂分子结合,从而形成有序介孔材料。介孔二氧化硅纳米颗粒作为一种重要的多孔材料,因其广泛的高比表面积,孔体积可调,易于表面功能化以及有吸引力的物理化学性质,是当今纳米材料领域的研究热点;在生物医药领域,介孔二氧化硅的这些特性也在逐渐被广泛研究,如单分散二氧化硅微球表面和内部多孔结构的特殊拓扑结构使其具有预期的性能(可以通过调节合成条件来很好地调节其性能) [18]。这些理想的特性使得介孔二氧化硅在精确控释药物方面有着独有优势。 介孔二氧化硅材料在骨缺损的治疗领域优于人工制备的骨修复材料,在研究中上得到了越来越有力的证实。由于骨修复材料活性低以及由此导致的过慢修复速度是众多骨修复材料面临的主要挑战。因此具有突出的诱导成骨分化和促进成骨功能的骨形态发生蛋白2已被广泛用于骨修复材料的活性化。然而,骨形态发生蛋白的临床应用受到超高剂量要求、短半衰期、高成本和不良反应(如炎症反应、肿瘤形成和异位骨形成)的阻碍[19-20]。在应对此问题时,甘琪[21]研发了可降解的骨形态发生蛋白2-介孔钙镁氧化硅骨修复材料,此材料具有良好的降解性、缓释性能、生物活性以及具有异位和原位的成骨能力,并且在动物实验中发现可降解的骨形态发生蛋白2-介孔钙镁氧化硅材料的体内降解速度更好,且生成了更多的新骨。由此可见,介孔硅基材料可以作为一种良好的骨缺损修复材料继续深入的研究。 而YAO等[22]开发的新型介孔硅酸盐纳米粒子结合-3D纳米纤维明胶支架,用于装载骨形态发生蛋白2和去铁胺(可诱导血管生成)实现双重递送,再同时将骨髓间充质干细胞和此微粒整合到一个多孔的3D玻璃纤维支架上,由此构成一个仿生成骨微环境。在其研究中,去铁胺和骨形态发生蛋白2以不同的释放速率(10 d和28 d)从支架中释放,该缓释材料保持了较长时间的血管生成和成骨能力,并成功避免了骨形态发生蛋白2和去铁胺的高浓度毒性。 在LIAO等[23]的研究中,研究者将钆(gadolinium Gd)掺入介孔硅酸钙(Mesoporous calcium silicate)和壳聚糖(chitosan)复合支架中(Gd-MCS/CTS),两种支架中的Gd掺杂物都有效地激活了Wnt/β-连环蛋白信号通路,诱发了细胞增殖和成骨分化能力。但是成骨相关基因如碱性磷酸酶、发育相关转录因子2 和Ⅰ型胶原在Gd-MCS支架中的表达水平显著高于对照组普通支架,且其表达水平与Gd掺杂量呈正相关。而且,在其大鼠颅骨缺损试验中进一步证实,Gd-MCS/CTS支架显著刺激胶原沉积和新骨形成。虽然此研究并未充分排除壳聚糖与介孔硅酸钙的互相干扰因素,但是此介孔支架也的确提供了一个促进促进成骨的平台。 与传统缓释材料相比,介孔硅酸盐可以更有效控释骨形态发生蛋白,是最经典的介孔材料,介孔的低纳米级孔径可以严格控制药物分子的进出。在其体内外研究中,通过直接测量新骨生成或间接测量成骨基因表达的方式,都证明了此材料的优异缓释性能。其优异的中空球体及表面介孔机构类似与细胞核,其高分散性又使得这些纳米微球可以悬浮于体液中。由此可以设想出,研究者完全可以将装载了骨形态发生蛋白或者相关转录基因片段的介孔硅酸盐纳米微球导入脂肪细胞中,促使这些脂肪细胞也转化为成骨细胞,增加骨缺损部位成骨能力。不仅局限于单纯植入骨缺损部位缓释药物,介孔硅酸盐材料诸多特性并未被完全应用。 2.3 介孔碳材料在骨修复中的应用 介孔碳材料近年来逐步成为纳米材料学研究的热点,因其不仅具有介孔材料共有特点,而且介孔碳材料具有其独特的物理特性,如高强度、导电性等[24]。介孔碳材料作为缓释材料有着明显的优点[25],包括:①大比表面积和孔径有利于大量载药;②可调节的孔结构使药物释放得到更好的控制;③易修饰的表面便于控制性、靶向给药,提高治疗效果,减少不良反应;④在近红外区域具有良好的热转换能力,为局部靶向光热治疗提供了诸多可能;⑤优异的生物相容性,理化稳定性和力学强度;⑥超分子π-π叠加使其具有较高的载药量和持续稳定释放的能力;⑦独特的光学特性以及与发光化合物的容易结合,使体内实时监测和治疗功能成为可能。因此,介孔碳纳米材料被认为是下一代药物传递的优秀候选平台。 目前介孔碳材料在骨修复领域中的研究主要集中在它的吸附性能、物理及电化学性能、药物载体性能、介孔碳的表面润湿性问题及生物相融性的研究[26],介孔碳材料主要有纳米微粒以及纳米管两种形式。介孔碳纳米微粒的合成方法有很多,有催化活化法、有机凝胶碳化法和模板法等,其最主要的特点就是吸附力强、载药量大,而且制作相对廉价[27]。如李沫瑶等[28]采用高温灼烧模板法制备介孔空心碳纳米球,先用正硅酸乙酯及十八烷基三甲氧基硅烷合成硅源,合成出的硅源作为模板,并且使用蔗糖为碳源材料合成的介孔碳微球比表面积和孔隙体积分别为SBET=380 m2/g,Vtotal=0.26 cm3/g,孔径为2.2 nm。即便此方法证明介孔碳微球制作有相对低廉的制作方法,但是介孔碳微球还没有用于骨修复研究。与介孔硅酸盐材料相比,介孔碳纳米微球的安全性不明;载药量也没有中空的硅酸盐材料更多,故其用于骨修复研究也就相对不够理想。但在介孔碳材料中,有一类特殊群体——介孔碳纳米管,比之介孔碳纳米微球,介孔碳纳米管可以说是理想的骨修复材料。 介孔碳纳米管(以下简称碳纳米管)除了具有介孔微球的优秀特性外还具有管状结构的独特优势,在骨修复研究中发挥重要作用,是未来骨修复临床应用的优良备选品,有着可靠的理论支持。首先,碳纳米管良好的强度、弹性和抗疲劳性能使其成为骨组织工程复合支架中优秀的增强材料[29]。与传统金属或陶瓷相比,碳纳米管不仅具有柔韧性,而且具有更高的强度和更低的密度。这些密度为1.3-2.0 g/cm3的超轻碳纳米管的拉伸强度为11-5 GPa (杨氏模量),弯曲强度为14.2-8.0 GPa,抗压杨氏模量为32-1 470 GPa,表明介孔碳纳米管材料的机械强度比钢大117%[30]。作为已知最坚固的材料之一,它们的强度大约是骨的3倍,已经研究证明,当碳纳米管与少量聚合物混合时,碳纳米管更可以显著提高机械强度[31]。 其次,碳纳米管的三维多孔结构具有高比表面积,同样有利于更多的蛋白质吸附和细胞黏附生长[32]。再者,碳纳米管相互连接的纳米网络结构和适宜的孔隙率有利于骨组织细胞外基质的物质交换。它们可调节的表面化学和对细胞结合蛋白的高亲和力可用于调节细胞形态和促进干细胞分化为骨细胞,特别是成骨细胞和神经元谱系细胞[33]。碳纳米管通常分为2个亚型:①由类似于单层管状石墨烯形成的单壁碳纳米管;②由多层同心管状石墨烯层组成的多壁碳纳米管。单壁碳纳米管通常呈紧密排列的六边形束,直径约为1 nm,长度可达1 mm或更长。多壁碳纳米管由39根中空石墨纤维组成,其直径比单壁碳纳米管大,从2 nm到100 nm可控范围内[34],通过调节其介孔直径大小,可以使其适合于递送多种适体、肽、生物分子和各种药物。LI等[35]证明多壁碳纳米管可以吸附和浓缩更多的肽链,诱导碱性磷酸酶和发育相关转录因子2 和1型胶原基因的表达,进而促进体外培养的人脂肪间充质干细胞的成骨分化。此外,在Li等[35]的实验中,多壁碳纳米管还在体内诱导小鼠背部肌肉组织异位骨形成,表明它们能够在不掺入外源生长因子和其他复杂配体的情况下调节下游干细胞的反应,由此可见多壁碳纳米管具有一定的骨诱导能力。 最后,可控的导电率在调节细胞的生理行为和充当电子-细胞生物传感器方面也可发挥重要的作用[36]。碳纳米管具有独特的电学性质,从金属、半导体到超导导电,它们可控的电子电导率很大程度上取决于它们的排列、直径、纵横比。这种独特的性能使碳纳米管能够用于研究电刺激对细胞增殖和活性的影响,或者作为生物活性分子如DNA、蛋白质和生长因子的电子生物传感器[37]。因为此特性,碳纳米管在用于骨组织再生和修复中,NEWMAN等[38]证明它们能够促进相关生物分子和蛋白质的电化学和电子传导相关性,从而加速成骨细胞增殖和骨形成。碳纳米管不仅能产生高速率的细胞和成骨表达标记物,形成板状晶体,还能维持细胞膜的电功能,增强钙离子通道的功能[39]。此外,碳纳米管基复合材料被认为是最好的电活性纳米纤维,它可以诱导细胞在随机取向和排列的纤维类型中沿电荷方向排列,并显示出良好的抗菌活性[40]。 更值得一提的是碳纳米管基磁性复合纳米粒子能够有效地将磁靶向技术与生物治疗相结合,为靶向治疗提供新的理论基础。用Fe3O4修饰的碳纳米管显示出增强的生物相容性特征,当暴露于外部磁场时,对细胞行为有积极的影响[41],那么在其用于骨修复时,研究员甚至有可能定向促进骨修复。 但是,必须关注的是单一的碳纳米管材料不适合骨组织的再生。纯碳纳米管支架的轴向强度、韧性和杨氏模量远高于骨组织,与人体组织不太匹配,只有通过与其他材料的复合应用,碳纳米管才能发挥其独特的力学、电学和表面性质,进而提高复合材料的整体理化性能和骨导电性。而且作为新型生物材料,介孔碳材料的生物毒性仍然不明确。研究人员发现,介孔碳材料的最基本风险是植入物和支架表面的炎症反应,这也会导致植入物从所需的位置迁移,并将杂质金属离子释放到周围组织中,有引起细胞毒性反应的可能[42]。到目前为止,碳纳米管的纯化仍然是制备复合医学要求的介孔碳材料的一大障碍。 而且介孔碳材料在体内的代谢途径至今仍然不明确,有对碳纳米管药代动力学的综述,原始的和非共价功能化的碳纳米管可能在脾脏和肝脏中积累,而共价功能化的碳纳米管可能在尿液中排泄[43-44]。碳纳米管在生产和应用过程中可能对人体健康具有潜在的毒性,这对其在骨再生中的临床应用提出了巨大的挑战。关于介孔碳材料甚至整个碳材料学的毒性需要基于不同细胞系的底物进一步表征和准确鉴定,并在体外和体内进行测试。 如果说介孔碳纳米微球在骨修复研究中完全可以被替代,那么介孔碳纳米管材料的诸多优秀特性还是提供了一种可以克服“合成骨修复材料不具有与天然骨组织相当的机械性能”问题的方法,并使其成为在骨再生领域中挑战生物玻璃及其增强材料目前地位的优秀候选物[45]。介孔碳纳米管材料不仅是优异的药物控释载体,其自身更是良好的骨替代品,极低的密度、极高的强度、可控的半导体特性等使其甚至有可能制备出生物电控制的义肢,而在骨修复的研究中,介孔碳材料的更多特征及应用潜力还有待发掘。 2.4 介孔羟基磷灰石在骨修复中的应用 介孔羟基磷灰石是羟基磷灰石的一种特殊应用。羟基磷灰石已经广泛用于骨科临床,它是一种天然形成的磷酸钙,是构成人体骨骼中最大量的无机成分。羟基磷灰石在人体中是最稳定的磷酸钙,在生理环境中具有低溶解度,其表面可作为体液中骨矿物质的成核位点,因此羟基磷灰石在临床应用时不会引起炎症反应[46]。同时羟基磷灰石具有骨传导性(但不具有骨诱导性),通常研究者们会在羟基磷灰石中掺入氟、氯、铜、镁、碳酸根离子等多种成分以达到不同的使用要求[47]。羟基磷灰石在骨再生中的临床应用研究始于20世纪80年代中期,主要用于种植体涂层和移植材料。尽管羟基磷灰石已被用于临床应用,但由于其独特的硬脆特性,尚未被直接用作填充物植入高负荷的骨组织,目前在骨再生应用中还是主要用作种植体涂层或牙科骨修复材料[48]。例如,金属植入物表面上的介孔羟基磷灰石涂层改善了成骨细胞活性和植入物的生物相容性和生物活性。还可以通过将其与诸多材料混合以制作出更多不同类型的介孔羟基磷灰石,由此控制孔隙率,增强机械强度,改善生物活性和提高易用性等[49]。LIN等[50]以Ca(NO3)2:4H2O和NHH2PO4的水溶液作为电解液,在纯钛表面通过电化学沉积涂层法制备的羟基磷灰石涂层中分布有连通均匀的微米孔,而这些微米孔是由介孔羟基磷灰石晶体组成的,此涂层具有高的比表面积和孔隙率,可以更有效促进骨长入,而LIN也设想了介孔可以负载促骨修复药物从而促进骨长期而稳定的再生。 但需要注意的是羟基磷灰石还可能具有低生物毒性,在季玉琴[51]的研究中,通过调整浓度的方式,分别将20,40,80 mg的羟基磷灰石样品在10 mL的含体积分数10%胎牛血清的DMEM培养液中,测定样本对骨髓干细胞的细胞毒性。最终通过测得:羟基磷灰石浓度过高时(实验中浓度为8 g/L),可能对骨髓间充质干细胞有低毒性。此结果可以作为羟基磷灰石作为药物载体的释药临床参考。此研究制备了5种介孔羟基磷灰石,粒径为23.1-49.7 nm的介孔羟基磷灰石纳米棒[51],见表1。"

季玉琴[51]的研究在测试介孔羟基磷灰石纳米棒对5-氟尿嘧啶的负载量为1%,5%和10%的缓释效果时发现,释放24 h后,5-氟尿嘧啶的释放百分比和释放量分别为97.3%,89.2%,87.3%,随着释放时间的延长,释放百分数以及累积释放量一直在增加。这些结果表明5-氟尿嘧啶的释放速度可以通过选择不同粒径的羟基磷灰石纳米棒或改变5-氟尿嘧啶的负载量调节。在此介孔纳米棒的控释下药物的缓释时间延长至24 h,远远长于5-氟尿嘧啶的生物半衰期(10-20 min)。由此可以看出介孔羟基磷灰石对药物的控释能力是优异的,尤其是此材料还具备体内降解性,完全可以用做非承重骨的直接植入材料。 羟基磷灰石的介孔化处理的优异特征已被广大研究者发现并研究,如李林龙等[52]的实验中,在制备的γ-苄基-L-谷氨酸-介孔羟基磷灰石薄膜上,比普通羟基磷灰石对照组生成更多骨组织且促进了成骨细胞增殖及细胞外基质分泌和成熟;在兔桡骨缺损修复实验中,进一步证明了此材料对于骨缺损修复的促进作用。介孔羟基磷灰石不仅弥补了传统羟基磷灰石只有骨传导特性不具备骨诱导的缺点,更提供了进一步加强羟基磷灰在骨修复材料中作用。在促进骨再生中,介孔化处理后的控释药物特性也为研究者提供更多促骨修复的方法。 2.5 介孔生物玻璃在骨修复中的应用 介孔生物玻璃是一类重要的无机生物活性材料,被广泛地用于骨修复研究及应用,其主要成分有Na2O,CaO,SiO2,P2O5;此类材料具有优异的可降解性、生物相容性和生物活性,能诱导类骨磷灰石形成,与宿主骨骼或软组织发生化学键合,且无炎症、免疫排斥等反应[53],可用于多种生物医学材料人体骨骼修复、创口愈合等。生物活性玻璃还具有多样性,通过改变其的初始成分和加工方法(熔融淬火或溶胶-凝胶技术)就可制备不同种类的生物玻璃[54]。 自第3代生物活性玻璃纳米多孔材料研发后,生物玻璃的介孔结构和生物活性特征逐渐成为热点[55],由YAN等[56-57]在2004年将溶胶-凝胶法和表面活性剂的超分子化学方法结合起来,开发出了新一类的介孔生物玻璃,这些新一代生物活性玻璃基于CaO-SiO2-P2O5成分,具有高度有序的互联中孔通道,孔径为5-20 nm。与普通生物玻璃相反,介孔生物玻璃显示出更高的比表面积、孔体积、在模拟体液中改善了体外磷灰石矿化和非常好的细胞相容性。 在骨修复应用中,介孔生物玻璃的介孔特性可以改善血管形成、促进成骨细胞黏附、保持酶活性和诱导骨髓间充质干细胞的分化[58]。除了将介孔生物玻璃用于生产多孔支架之外,它们还可以用于制作各种形状及尺寸的粉末或颗粒。如LALZAWMLIANA等[59]在兔股骨骨缺损处植入不同尺寸的介孔生物玻璃粉,并用相应的生物玻璃大颗粒密封,术后第45,90天收集骨样本用于进一步分析,发现兔股骨缺损的部位新生大量骨质,并且介孔生物玻璃大部分被吸收代谢。该实验结果表明,研究者所制备的介孔生物玻璃材料无毒、可生物降解、机械性能、生物相容性好,适合作为骨替代材料。 研究表明,通过对介孔生物玻璃的化学修饰后,还可以使其某些特性提升或改变,以使其适应更多的应用环境。如CHEN等[60]将聚乳酸-羟基乙酸共聚物(Polylactic acid-glycolic acid copolymer,PLGA)电纺纤维支架浸渍到介孔生物玻璃前驱体溶液中,制备的电纺纤维支架表面改性介孔生物活性玻璃(PLGA-MBG)表明,掺入介孔生物玻璃后的PLGA支架更有利于人骨髓间充质干细胞的细胞增殖和成骨分化,而且PLGA-MBG支架能够大量装载骨形态发生蛋白2并长期释放。 随着纳米技术领域的快速发展,生物医学科学取得了巨大进步,介孔生物玻璃的这些优异特性使其成为骨修复研究中的合适植入材料[61],并已被广泛用于其他生物医学科学研究中。得益于前人对生物玻璃的应用与研究,介孔生物玻璃不仅可以像羟基磷灰石具有骨传导特性,更有骨诱导特性,可以说介孔生物玻璃是目前最有应用价值的骨修复材料。虽然目前仍有很多关于介孔生物玻璃代谢产物安全性的担忧,只要对合成材料及过程严格把控,此问题也将被合理解决。随着各类新型介孔生物玻璃的研发,如:K2O,MgO,CaF2和B2O3等成分的加入,还应考虑这些新开发材料的潜在毒性,以及完善生物体内降解产物的安全限值的研究[62]。 2.6 介孔金属材料在骨修复中的应用 金属材料有着优秀的承重能力、弹性形变能力、物理稳定性等。在金属材料中,钛合金材料在骨科应用有着至高的地位,钛(Ti)及其合金由于具有良好的生物相容性、适中的力学性能和耐腐蚀性能,常被用作骨科种植材料,并在关节置换以及骨折修复中发挥着重要作用[63-64]。尤其在关节骨缺损的治疗中,钛基材料常常被直接用做关节替代材料。钛基种植体的早期骨整合和初期稳定性是种植体成功的关键,具有显著的临床实用意义。在骨组织的修复中,细胞与生物材料的初始黏附是组织-植入物相互作用的第一步,随后是细胞增殖、分化、骨形成和最终骨整合[65]。由于钛的生物惰性阻碍了其与细胞-材料的相互作用和早期骨整合[66],近年来,人们常通过改变Ti植入表面的表面形貌以获得早期成骨细胞黏附,如植入物表面阳极氧化法制备的二氧化钛(TiO2)介孔表面结构[67]。WEBSTER等[68]发现,与不具有介孔表面结构的钛植入物相比,成骨细胞在有介孔表面的钛植入物上的黏附力增加,在其体内研究表明,与未处理的钛植入物相比,覆盖介孔表面的种植体周围的骨愈合效果更良好。 一些研究也表明,还可以通过赋予介孔TiO2表面额外的化学或生物特征来模拟天然骨结构来改善成骨细胞反应和促进骨整合[69]。如在LI等[70]实验中证明了,TiO2纳米介孔形貌和羟基磷灰石涂层在促进成骨细胞黏附、增殖、分化和骨整合方面具有协同作用。而在钛金属表面形成的二氧化钛介孔纳米管结构同样可以作为理想的药物缓释层[71]。WANG等[72]将重组人骨形态发生蛋白2装载入种植体钛金属表面的介孔纳米管中,不仅持续发挥重组人骨形态发生蛋白2的成骨功能,还避免了如骨过度生长、异位骨形成、免疫反应等不良反应。 金属材料中,除了Ti金属外还有诸多其他相对应用较少的金属,如氧化铝、坦、氧化锆等,但是介孔金属材料用作骨组织移植物还是局限用于种植体表面。一方面,介孔金属材料有利于细胞攀附,促进骨-金属整合;另一方面,植入金属材料具有良好的生物惰性以及机械性能,可以替代缺损骨组织,这就使得介孔化处理的金属植入物可以用作长期植入物,并在一定程度上提高植入物的长期生存率。 表2介绍了5类典型介孔材料相关研究的概况。"

| [1] GAO C, FENG P, PENG S, et al. Carbon nanotube, graphene and boron nitride nanotube reinforced bioactive ceramics for bone repair. Acta Biomater. 2017;61:1-20. [2] KADHIM M, HOLMES L JR, GESHEFF MG, et al. Treatment options for nonunion with segmental bone defects: systematic review and quantitative evidence synthesis. J Orthop Trauma. 2017;31(2):111-119. [3] CHENG X, WAN Q, PEI X. Graphene family materials in bone tissue regeneration: perspectives and challenges. Nanoscale Res Lett. 2018; 13(1):289. [4] SPIN-NETO R, LANDAZURI DEL BARRIO RA, PEREIRA LA, et al. Clinical similarities and histological diversity comparing fresh frozen onlay bone blocks allografts and autografts in human maxillary reconstruction. Clin Implant Dent Relat Res. 2013;15(4):490-497. [5] ROBERTS TT, ROSENBAUM AJ. Bone grafts, bone substitutes and orthobiologics: the bridge between basic science and clinical advancements in fracture healing. Organogenesis. 2012;8(4):114-124. [6] OH EJ, OH SH, LEE IS, et al. Antibiotic-eluting hydrophilized PMMA bone cement with prolonged bactericidal effect for the treatment of osteomyelitis. J Biomater Appl. 2016;30(10):1534-1544. [7] 吴海霞,秦玉明,温冲.介孔碳材料的制备和应用研究进展[J].中国石油和化工标准与质量,2020,40(4):170-172. [8] 费晓娟,金美林,卢曾奎,等.骨形态发生蛋白2(BMP2)基因的生理功能和信号通路研究进展[J].中国畜牧杂志,2021,57(3):1-7. [9] KRESGE C, LEONOWICZ M, ROTH W, et al. Ordered mesoporous molecular sieves synthesized by a liquid-crystal template mechanism. Nature. 1992;359;710-712. [10] LIJIMA S. Helical microtubules of graphitic carbon. Nature. 1991;354:56-58 . [11] YNOS ID, EDGAR AJ, BUTTERY LD, et al. Ionic products of bioactive glass dissolution increase proliferation of human osteoblasts and induce insulin-like growth factor II mRNA expression and protein synthesis. Biochem Biophys Res Commun. 2000;276(2):461-465. [12] VALLET-REGI M, RAMILA A, DEL REAL R, et al. A New Property of MCM-41: Drug Delivery System. Chem Mater. 2001;13:308-311. [13] IQUIERDO-BARBA I, RUIZ-GONZALEZ L, DOADRIO JC, et al. Tissue regeneration: a new property of mesoporous materials. Solid State Sci. 2005;7(8):983-989. [14] HERTZ A, BRUCE IJ. Inorganic materials for bone repair or replacement applications. Nanomedicine (Lond). 2007;2(6):899-918. [15] SADAT-SHOJAI M, KHORASANI MT, DINPANAH-KHOSHDARGI E, et al. Synthesis methods for nanosized hydroxyapatite with diverse structures. Acta Biomater. 2013;9(8):7591-7621. [16] SAHITHI K, SWETHA M, RAMASAMY K, et al. Polymeric composites containing carbon nanotubes for bone tissue engineering. Int J Biol Macromol. 2010;46(3):281-283. [17] POPAT A, HARTONO SB, STAHR F, et al. Mesoporous silica nanoparticles for bioadsorption, enzyme immobilisation, and delivery carriers. Nanoscale. 2011;3(7):2801-2818. [18] ROSENHOLM JM, ZHANG J, LINDEN M, et al. Mesoporous silica nanoparticles in tissue engineering-a perspective. Nanomedicine (Lond). 2016;11(4):391-402. [19] LAD SP, BAGLEY JH, KARIKARI IO, et al. Cancer after spinal fusion: the role of bone morphogenetic protein. Neurosurgery. 2013;73(3):440-449. [20] GOTHARD D, SMITH EL, KANCZLER JM, et al. Tissue engineered bone using select growth factors: a comprehensive review of animal studies and clinical translation studies in man. Eur Cell Mater. 2014;28:166-208. [21] 甘琪. 介孔氧化硅基纳米输送体系的构建及其在骨修复材料中的应用[D]. 上海:华东理工大学,2012. [22] YAO Q, LIU Y, SELVARATNAM B, et al. Mesoporous silicate nanoparticles/3D nanofibrous scaffold-mediated dual-drug delivery for bone tissue engineering. J Control Release. 2018;279:69-78. [23] LIAO F, PENG XY, YANG F, et al. Gadolinium-doped mesoporous calcium silicate/chitosan scaffolds enhanced bone regeneration ability. Mater Sci Eng C Mater Biol Appl. 2019;104:109999. [24] 王贤书,汪祖华,贾双珠,等.介孔碳材料CMK-3及改性介孔碳材料N,O-CMK-3对药物的吸附和释放性能[J].化学研究与应用, 2020,32(9):1635-1645. [25] ZHAO Q, LIN Y, HAN N, et al. Mesoporous carbon nanomaterials in drug delivery and biomedical application. Drug Deliv. 2017;24(sup1):94-107. [26] 刘晓蒙,高云鹏,张佳,等.不同孔径介孔碳的合成及对药物的缓释性能研究[J].沈阳化工大学学报,2014,28(2):137-164. [27] 刘建峰,宁锴,丁昇,等.介孔碳材料合成的研究进展[J].上海电力大学学报,2020,36(6):567-572. [28] 李沫瑶,金明实.介孔空心碳纳米球的制备研究[J].科学与财富, 2020(5):72. [29] NEGRI V, PACHECO-TORRES J, CALLE D, et al. Carbon nanotubes in biomedicine. Top Curr Chem (Cham). 2020;378(1):15. [30] MUNIR KS, WEN C, LI Y. Carbon nanotubes and graphene as nanoreinforcements in metallic biomaterials: a review. Adv Biosyst. 2019;3(3):e1800212. [31] ARYAEI A, JAYATISSA AH, JAYASURIYA AC. Mechanical and biological properties of chitosan/carbon nanotube nanocomposite films. J Biomed Mater Res A. 2014;102(8):2704-2712. [32] GOMEZ-GUALDRóN DA, BURGOS JC, YU J, et al. Carbon nanotubes: engineering biomedical applications. Prog Mol Biol Transl Sci. 2011;104: 175-245. [33] PATEL H, KWON S. Multi-walled carbon nanotube-induced inflammatory response and oxidative stress in a dynamic cell growth environment. J Biol Eng. 2012;6(1):22. [34] RODE A, SHARMA S, MISHRA DK. Carbon nanotubes: classification, method of preparation and pharmaceutical application. Curr Drug Deliv. 2018;15(5):620-629. [35] LI X, LIU H, NIU X, et al. The use of carbon nanotubes to induce osteogenic differentiation of human adipose-derived MSCs in vitro and ectopic bone formation in vivo. Biomaterials. 2012;33(19):4818-4827. [36] MENEZES BRC, RODRIGUES KF, FONSECA BCDS, et al. Recent advances in the use of carbon nanotubes as smart biomaterials. J Mater Chem B. 2019;7(9):1343-1360. [37] LIU J, WANG C, TU X, et al. Chirality-controlled synthesis of single-wall carbon nanotubes using vapour-phase epitaxy. Nat Commun. 2012;3:1199. [38] NEWMAN P, MINETT A, ELLIS-BEHNKE R, et al. Carbon nanotubes: their potential and pitfalls for bone tissue regeneration and engineering. Nanomedicine. 2013;9(8):1139-1158. [39] GUPTA A, WOODS MD, LLLINGWORTH KD, et al. Single walled carbon nanotube composites for bone tissue engineering. J Orthop Res. 2013; 31(9):1374-1381. [40] MACKLE JN, BLOND DJ, MOONEY E, et al. In vitro characterization of an electroactive carbon-nanotube-based nanofiber scaffold for tissue engineering. Macromol Biosci. 2011;11(9):1272-1282. [41] CUNHA C, PANSERI S, LANNAZZO D, et al. Hybrid composites made of multiwalled carbon nanotubes functionalized with Fe3O4 nanoparticles for tissue engineering applications. Nanotechnology. 2012;23(46):465102. [42] EDWARDS SL, WERKMEISTER JA, RAMSHAW JA. Carbon nanotubes in scaffolds for tissue engineering. Expert Rev Med Devices. 2009;6(5): 499-505. [43] ALI-BOUCETTA H, AL-JAMAL KT, KOSTARELOS K. Cytotoxic assessment of carbon nanotube interaction with cell cultures. Methods Mol Biol. 2011;726:299-312. [44] ALI-BOUCETTA H, AL-JAMAL KT, MULLER KH, et al. Cellular uptake and cytotoxic impact of chemically functionalized and polymer-coated carbon nanotubes. Small. 2011;7(22):3230-3238. [45] WANG W, ZHU Y, LIAO S, et al. Carbon nanotubes reinforced composites for biomedical applications. Biomed Res Int. 2014;2014:518609. [46] KIM HD, JANG HL, AHN HY, et al. Biomimetic whitlockite inorganic nanoparticles-mediated in situ remodeling and rapid bone regeneration. Biomaterials. 2017;112:31-43. [47] 刘兆强,朱立国.磷酸钙材料在骨再生中的应用进展[J].中国医疗设备,2019,34(10):158-163. [48] DHIVYA S, SARAVANAN S, SASTRY TP, et al. Nanohydroxyapatite-reinforced chitosan composite hydrogel for bone tissue repair in vitro and in vivo. J Nanobiotechnol. 2015;13:40. [49] THORPE AA, CREASEY S, SAMMON C, et al. Hydroxyapatite nanoparticle injectable hydrogel scaffold to support osteogenic differentiation of human mesenchymal stem cells. Eur Cell Mater. 2016;32:1-23. [50] LIN DY, WANG XX. A novel method to synthesize hydroxyapatite coating with hierarchical structure. Colloids Surf B Biointerfaces. 2011; 82(2):637-640. [51] 季玉琴.介孔材料中空SiO2、SBA-15分子筛、羟基磷灰石药物缓释性能研究[D].镇江:江苏大学,2016. [52] 李林龙,史新翠,王宗良,等.介孔羟基磷灰石表面聚(γ-苄基-L-谷氨酸)改性及其在骨修复中的应用[C]. 2017中国生物材料大会论文集,2017:1-4. [53] 康静.基于生物活性玻璃/碳纳米纤维骨组织工程材料的制备及性能研究[D].杭州:浙江理工大学,2020. [54] KARGOZAR S, MONTAZERIAN M, HAMZEHLOU S, et al. Mesoporous bioactive glasses: promising platforms for antibacterial strategies. Acta Biomater. 2018;81:1-19. [55] VALLET-REGI M. Nanostructured mesoporous silica matrices in nanomedicine. J Intern Med. 2010;267(1):22-43. [56] YAN X, HUANG X, YU C, et al. The in-vitro bioactivity of mesoporous bioactive glasses. Biomaterials. 2006;27(18):3396-3403. [57] YAN X, YU C, ZHOU X, et al. Highly ordered mesoporous bioactive glasses with superior in vitro bone-forming bioactivities. Angew Chem Int Ed Engl. 2004;43(44):5980-5984. [58] KOTANI S, FUJITA Y, KITSUGI T, et al. Bone bonding mechanism of beta-tricalcium phosphate. J Biomed Mater Res. 1991;25(10):1303-1315. [59] LALZAWMLIANA V, ANAND A, KUMAR V, et al. Potential of growth factor incorporated mesoporous bioactive glass for in vivo bone regeneration. J Mech Behav Biomed Mater. 2019;91:182-192. [60] CHEN S, JIAN Z, HUANG L, et al. Mesoporous bioactive glass surface modified poly(lactic-co-glycolic acid) electrospun fibrous scaffold for bone regeneration. Int J Nanomedicine. 2015;10:3815-3827. [61] HENCH LL, POLAK JM. Third-generation biomedical materials. Science. 2002;295(5557):1014-1017. [62] KAUR G, PANDEY OP, SINGH K, et al. A review of bioactive glasses: Their structure, properties, fabrication and apatite formation. J Biomed Mater Res A. 2014;102(1):254-274. [63] LONG M, RACK HJ. Titanium alloys in total joint replacement--a materials science perspective. Biomaterials. 1998;19(18):1621-1639. [64] BAGNO A, DI BELLO C. Surface treatments and roughness properties of Ti-based biomaterials. J Mater Sci Mater Med. 2004; 15(9):935-949. [65] DECUZZI P, FERRARI M. Modulating cellular adhesion through nanotopography. Biomaterials. 2010;31(1):173-179. [66] LIU P, HAO Y, ZHAO Y, et al. Surface modification of titanium substrates for enhanced osteogenetic and antibacterial properties. Colloids Surf B Biointerfaces. 2017;160:110-116. [67] NUNE KC, MISRA R, GAI X, et al. Surface nanotopography-induced favorable modulation of bioactivity and osteoconductive potential of anodized 3D printed Ti-6Al-4V alloy mesh structure. J Biomater Appl. 2018;32(8):1032-1048. [68] WEBSTER TJ, ERGUN C, DOREMUS RH, et al. Enhanced functions of osteoblasts on nanophase ceramics. Biomaterials. 2000;21(17):1803-1810. [69] GUAZZO R, GARDIN C, BELLIN G, et al. Graphene-based nanomaterials for tissue engineering in the dental field. Nanomaterials (Basel). 2018; 8(5):349. [70] LI Y, LI B, SONG Y, et al. Improved osteoblast adhesion and osseointegration on TiO2 nanotubes surface with hydroxyapatite coating. Dent Mater J. 2019;38(2):278-286. [71] ZHOU J, FRANK MA, YANG Y, et al. A novel local drug delivery system: superhydrophobic titanium oxide nanotube arrays serve as the drug reservoir and ultrasonication functions as the drug release trigger. Mater Sci Eng C Mater Biol Appl. 2018;82:277-283. [72] WANG Y, CUI H, WU Z, et al. Modulation of osteogenesis in mc3t3-e1 cells by different frequency electrical stimulation. PLoS One. 2016; 11(5):e0154924. |
| [1] | Gao Yujin, Peng Shuanglin, Ma Zhichao, Lu Shi, Cao Huayue, Wang Lang, Xiao Jingang. Osteogenic ability of adipose stem cells in diabetic osteoporosis mice [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 999-1004. |
| [2] | Wu Weiyue, Guo Xiaodong, Bao Chongyun. Application of engineered exosomes in bone repair and regeneration [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1102-1106. |
| [3] | Zhou Hongqin, Wu Dandan, Yang Kun, Liu Qi. Exosomes that deliver specific miRNAs can regulate osteogenesis and promote angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1107-1112. |
| [4] | Zhang Tong, Cai Jinchi, Yuan Zhifa, Zhao Haiyan, Han Xingwen, Wang Wenji. Hyaluronic acid-based composite hydrogel in cartilage injury caused by osteoarthritis: application and mechanism [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 617-625. |
| [5] | Li Hui, Chen Lianglong. Application and characteristics of bone graft materials in the treatment of spinal tuberculosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 626-630. |
| [6] | Yang Feng, Zhao Qian, Zhang Shixuan, Zhao Tienan, Feng Bo. Effectiveness and safety of rapamycin combined with CD133 antibody stent in preventing vascular restenosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 579-584. |
| [7] | Kang Kunlong, Wang Xintao. Research hotspot of biological scaffold materials promoting osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 597-603. |
| [8] | Shen Jiahua, Fu Yong. Application of graphene-based nanomaterials in stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 604-609. |
| [9] | Li Jing, Qiao Wei, Ren Xiaoqi, Shi Hao, Yang Ting, Ma Shaoying, Su Chengzhong, Li Baoxing, Zhao Yaping. Calcined bovine bone combined with acellular dermal matrix for maintaining the alveolar ridge in dog [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3445-3449. |
| [10] | Liu Ming, Wang Kai. Theaflavin-3-gallate modified nano-hydroxyapatite/polycaprolactone composite porous scaffold in bone defect repair [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3480-3486. |
| [11] | Liu Liang, Hu Gaoquan, Wei Zhao, Chen Lin, Hong Feng. Potential of bacterial nanocellulose/polydopamine composite tubes as small-diameter artificial blood vessel [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3535-3542. |
| [12] | Guo Yangyan, Yu Zhengwen, Zhang Jian. Research hotspots of magnesium alloy biomaterials in an in vivo animal [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3556-3565. |
| [13] | Lu Haiping, Lang Xuemei, Zhang Cheng, Ju Songli, Zhang Yi, Wang Xin. Application of polycaprolactone modified biological barrier membrane in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3580-3585. |
| [14] | Jin Herong, Cui Jingbin, Shao Cang. Materials of interbody fusion cage: advantages and focus of clinical application [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3592-3597. |
| [15] | Li Duchenhui, Tian Ai, Tang Zhenglong. Angiogenesis induced by bone bioscaffold materials [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(22): 3602-3608. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||

