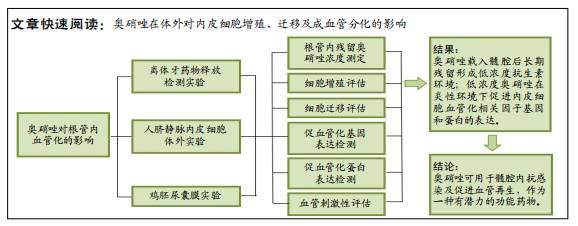
1.1 设计 离体牙药物释放检测实验、细胞学体外实验和鸡胚尿囊膜实验,采用单因素方差分析进行组间比较。
1.2 时间及地点 实验于 2023 年 3-12 月在暨南大学口腔医学院和基础医学院中心实验室完成。
1.3 材料
1.3.1 牙齿标本 在暨南大学口腔医学院收集拔除的废弃牙齿 15 颗。该实验已申请获得供者知情同意豁免权。实验方案已通过暨南大学医学伦理审查委员会批准 ( 批准号:JNUKY-2022-070)。
入选标准:磨牙,牙根发育完全,无明显龋齿,牙冠完整,无根管治疗,牙根无隐裂、纵裂。
排除标准:牙根未发育完全,有明显龋坏或已穿髓,已行根管治疗,牙冠严重缺损。
1.3.2 主要细胞、材料 人脐静脉内皮细胞 ( 美国 Lonza公司 );SBF 级 9 d 龄鸡胚 18 个 ( 新兴大华农禽蛋有限公司 );奥硝唑 ( 上海麦克林生化科技有限公司 );胎牛血清( 以色列 Biological Industries 公司 );高糖 DMEM 培养基( 美国 GIBCO 公司 );牙龈卟啉单胞菌来源脂多糖 [ 百盈利创生物科技 ( 北京 ) 有限公司 ];三抗 ( 青霉素、链霉素和两性霉素 B,南京生航生物技术有限公司 );血管内皮生长因子抗体、GAPDH 抗体、活死染色试剂盒、CalceinAM、碘化丙啶 ( 碧云天生物有限公司 );超敏 ECL 化学发光试剂盒 ( 碧云天生物有限公司 );Trizol 试剂盒、反转录试剂盒 ( 艾科瑞生物科技有限公司 );Ceivitron 暂封膏 ( 台湾东权国际有限公司 );玻璃离子水门汀 [ 而至齿科 ( 苏州 ) 有限公司 ];CCK-8( 美仑生物科技有限公司 );Hanks缓冲液 ( 自配,每升超纯水中依次溶入 160 g NaCl、2 gMgSO4•H2O、8 g KCl、2 g MgCl2•6H2O、2.8 g CaCl2、3.4 gNa2HPO4•12H2O 及 1.2 g KH2PO4);微量核酸分光光度计 (Nanodrop 1000,美国 Thermo Fisher 公司 );酶标仪(Epoch2,美国 BioTeK 公司 );倒置荧光显微镜 (TCS SP8,德国 Leica 公司);荧光定量 PCR 仪 (CFX Connect,美国Bio-Rad 公司 );体式显微镜 (SOPTOP SZN71 变焦体视显微镜 )。
1.4 实验方法
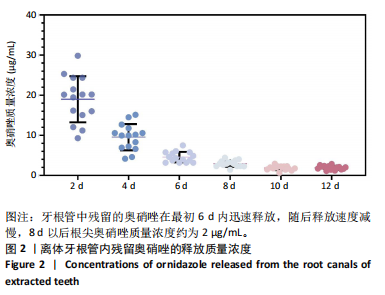
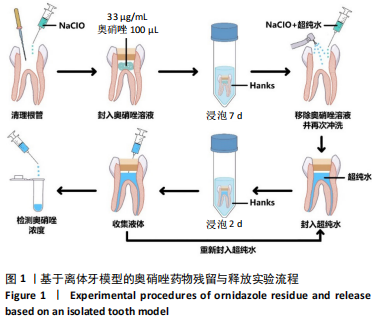
1.4.1 离体牙根管内奥硝唑药物残留与释放实验 如图 1所示,使用牙科高速涡轮手机打开牙髓腔,建立直线通道,使用拔髓针拔除牙髓,使用 20 mL 2.5% 次氯酸钠溶液、20 mL 超纯水结合超声振荡冲洗髓腔并进行根管预备,使用三用枪及棉球干燥髓腔,采用 Ceivitron 暂封膏和玻璃离子水门汀将 100 μL 奥硝唑溶液 (33 µg/mL) 封于髓腔中。将每颗离体牙浸泡于 15 mL Hanks 缓冲液中,置于 37 ℃摇床中孵育,隔天更换浸泡液。7 d 后再次打开髓腔,去除充填物及药物,先后使用 20 mL 2.5% 次氯酸钠溶液和20 mL 超纯水超声振荡冲洗髓腔并封入无菌水,再次使用暂封膏和玻璃离子水门汀封闭髓腔,重新放回摇床中,隔天更换浸泡液,定期使用 1 mL 注射器收集髓腔液体样品用于后续奥硝唑质量浓度检测。使用 Hanks 缓冲液配制奥硝唑的标准溶液,质量浓度分别为 0.25,0.5,2,2.5,5,10,20,25 及 50 µg/mL,使用微量核酸分光光度计检测在 322 nm 处吸光度 (A) 值,绘制标准曲线,采用比色法检测样品中奥硝唑质量浓度。
1.4.2 不同质量浓度奥硝唑对人脐静脉内皮细胞的影响
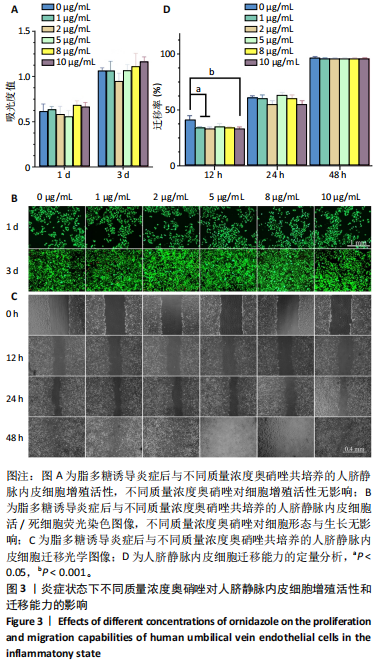
细胞活性检测:将人脐静脉内皮细胞接种于 96 孔板中,细胞密度为 3×103 / 孔,待细胞贴壁后加入 1 mg/L 脂多糖刺激 24 h,去除高糖 DMEM 细胞完全培养基 ( 含体积分数 10% 胎牛血清、1% 青霉素 - 链霉素 ),更换为含不同质量浓度 [0( 对照 ),1,2,5,8 及 10 μg/mL] 奥硝唑的高糖 DMEM 细胞完全培养基共培养 [30]。共培养 1,3 d 后,采用 CCK-8 试剂盒定量检测细胞活性,使用酶标仪测量 450 nm 处的吸光度值;用 Calcein AM/PI 染色试剂盒进行活死细胞荧光染色,置于倒置荧光显微镜观察并拍照。
细胞划痕实验:将人脐静脉内皮细胞接种于 6 孔板中,细胞密度为 1.6×105 / 孔,细胞贴壁后加入 1 mg/L 脂多糖刺激 24 h,去除培养基,用 200 μL 移液枪尖在细胞膜层均匀划痕。用 PBS 冲洗细胞,分别加入含不同质量浓度 (0,1,2,5,8 及 10 μg/mL) 奥硝唑的培养基,使用倒置荧光显微镜分别在 0,12,24 及 48 h 对细胞进行观察和拍照,使用 Image J 1.53t 软件 ( 美国国立卫生研究院 ) 处理数据,计算细胞迁移率。
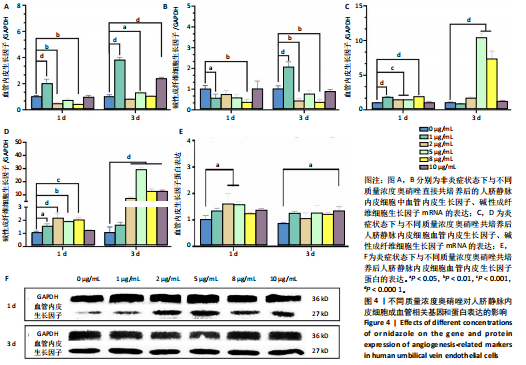
RT-PCR 检测成血管相关基因的表达:将人脐静脉内皮细胞接种于 6 孔板中,细胞密度为 1.6×105
/ 孔,分别与不同质量浓度 (0,1,2,5,8 及 10 μg/mL) 奥硝唑直接共培养,或者加入 1 mg/L 脂多糖刺激 24 h 后分别与不同质量浓度 (0,1,2,5,8 及 10 μg/mL) 奥硝唑共培养。共培养 1,3 d 后,使用 Trizol 试剂盒提取细胞总 RNA,使用反转录试剂盒将其反转录为 cDNA,进行实时定量 PCR反应:95 ℃预变性 10 min,95 ℃保温 3-10 s,60 ℃保温10-30 s,共循环 40 次。通过荧光定量 PCR 仪检测成血管相关标志物血管内皮生长因子和碱性成纤维细胞生长因子的 mRNA 表达,以 GAPDH 为内参基因。引物序列见表 1。

Western blot 检测血管内皮生长因子蛋白表达:将人脐静脉内皮细胞接种于 6 孔板中,细胞密度为 1.6×105
/ 孔,加入 1 mg/L 脂多糖刺激 24 h 后分别与不同质量浓度 (0,1,2,5,8 及 10 μg/mL) 奥硝唑共培养。共培养 1,3 d 后,用 RIPA 溶液裂解细胞后收集裂解液,4 ℃下 12 000 r/min离心 10 min,取上清液,用 BCA 试剂盒测定蛋白浓度,进行归一化后加入上样缓冲液,置入水浴锅中 100 ℃加热。使用 SDS-PAGE 凝胶分离蛋白后转膜,用 5% 脱脂牛奶封闭膜孔,分别与血管内皮生长因子、GAPDH 溶液 ( 均为 1 ∶ 1 000 稀释比 ) 于摇床中 4 ℃孵育过夜,与对应的二抗溶液 (1 ∶ 2 000 稀释比 ) 在室温下孵育 2 h,用 ECL化学发光试剂盒孵育,使用凝胶成像仪曝光条带,通过Image J 1.53t 软件分析条带灰度值。
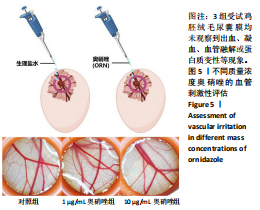
1.4.3 鸡胚绒毛尿囊膜实验评估奥硝唑的血管刺激性 将SBF 级 9 d 龄鸡胚随机分成 3 组,每组 6 个。用牙科弯镊去除气室的部分蛋壳及蛋壳膜,保证暴露的尿囊膜完整不受损伤;在尿囊膜上放置尼龙环,实验组尼龙环内分别加入 2,10 μg/mL 奥硝唑溶液 ( 生理盐水配制 )200 μL,对照组尼龙环内加入 200 μL 生理盐水;在 37 ℃、60% 湿度下孵育 1 h 后,用体式显微镜观察不同质量浓度奥硝唑对鸡胚血管变化的影响。
1.5 主要观察指标 奥硝唑在牙根管内的残留质量浓度,不同质量浓度奥硝唑对人脐静脉内皮细胞活性、迁移及分化的影响,以及不同质量浓度奥硝唑对血管的刺激性。
1.6 统计学分析 采用 GraphPad Prism 9.0 软件 ( 美国GraphPad Software 公司 ) 对实验数据进行处理并作图,两组数据之间比较采用 t 检验,多组间数据比较采用单因素方差分析。P < 0.05 表示差异有显著性意义。该文统计学方法已经暨南大学生物统计学专家审核。