1.1 设计 原代小鼠大脑皮质神经元细胞提取及体外细胞实验。
1.2 时间及地点 实验于2022年12月至2023年6月在南京大学医学院附属鼓楼医院中心实验室完成。
1.3 材料
1.3.1 实验动物 孕16-17 d C57BL/6L小鼠,SPF级,体质量25-30 g,用于提取原代神经元细胞,购于斯贝福(苏州)生物技术有限公司,实验动物合格证号:SCXK(苏)2022-0006,实验动物使用许可证号:SYXK(苏)2019-0059。所有动物实验操作均严格遵循实验动物管理相关条例及保护准则,且通过南京大学医学院附属鼓楼医院伦理委员会的动物实验伦理审查(批准号为2023AE01027)。
1.3.2 主要试剂 1×Neurobasal、50× B27、100× GlutaMax、TrypLE、DMEM/F12、胎牛血清、青霉素-链霉素(Gibco公司);D-Hank’s缓冲液、PBS缓冲液(BioChannel公司);SLC7A11/xCT多克隆抗体(#DF12509,Affinity公司);GPX4单克隆抗体(ab125066,Abcam公司);血红蛋白、β-Actin抗体(Sigma公司);鼠抗兔IgG、山羊抗鼠IgG(Cell Signaling Technology公司);黄芩素、SLC7A11抑制剂Erastin(MCE公司);多聚赖氨酸、CCK-8试剂盒、DEPC水、超级核酸酶、蛋白酶抑制剂、BCA试剂盒、TBST、Western blot一抗和二抗稀释液、RIPA、二甲基亚砜、丙二醛试剂盒、活性氧试剂盒(碧云天生物科技公司);PTGS2、SLC7A11、GPX4的mRNA引物(擎科生物);PAGE凝胶快速制备试剂盒、电泳蛋白分子量marker、10×Tris/甘氨酸/SDS电泳缓冲液、10×转膜缓冲液(上海雅酶生物医药科技有限公司);Millipore PVDF膜(0.22 μm、0.45 μm)、5%脱脂奶粉、RNA提取试剂盒、HiScript II Q Select RT SuperMix for qPCR、ChamQ SYBR qPCR Master Mix、ECL(诺唯赞生物科技股份有限公司)。
1.3.3 主要仪器 动物解剖器械(显微剪、显微镊、弯镊、烧杯)、动物解剖显微镜(玉研仪器);4 ℃高速离心机、生物安全柜、细胞培养箱、酶标仪、超微量分光光度计、自动化PCR仪、实时荧光定量PCR仪器(Thermo);普通光学显微镜(Olympus);高压灭菌锅(上海讯博);恒温水浴锅(上海跃进);恒温金属浴(杭州瑞诚);Western blot电泳仪、电泳槽(Bio-Rad);Thunder荧光显微镜(Leica);曝光机(上海天能)。
1.4 实验方法
1.4.1 神经元的提取及培养 孕16-17 d C57BL/6L小鼠吸入CO2麻醉后,开腹腔取出胎鼠,转移至提前预冷的D-Hank’s缓冲液中,随后操作均在冰上进行。根据生理结构依次剥离头皮、颅骨、大脑,尽可能剥去血管和脑膜。将分离出的脑组织放入60 cm2培养皿中,加入TrypLE,置于37 ℃培养箱消化10 min,用含有体积分数10%胎牛血清的DMEM/F12终止消化,随后用1 mL枪头反复、缓慢吹打脑组织至无组织块,将细胞悬液过滤,1 500 r/min离心5 min,去除上清,加入无血清的DMEM/F12重悬,计数后按合适细胞密度接种于提前使用多聚赖氨酸包被好的孔板内,4 h后更换为神经元专用培养基。在培养的第3,5天进行半换液,第7天全换液。
1.4.2 原代神经元培养基、血红蛋白及黄芩素溶液配制
(1)原代神经元培养基:1×Neurobasal、50×B27、100× GlutaMax混合配制成完全培养基用于后续实验。
(2)血红蛋白溶液:称取适量血红蛋白粉末溶解于原代神经元培养基,使其终浓度为25 μmol/L,配制后用于模拟体外蛛网膜下腔出血模型。
(3)黄芩素溶液:将13.5 mg黄芩素粉末溶于1 mL二甲基亚砜中,配成50 mmol/L的储存液,避光分装后-20 ℃保存。
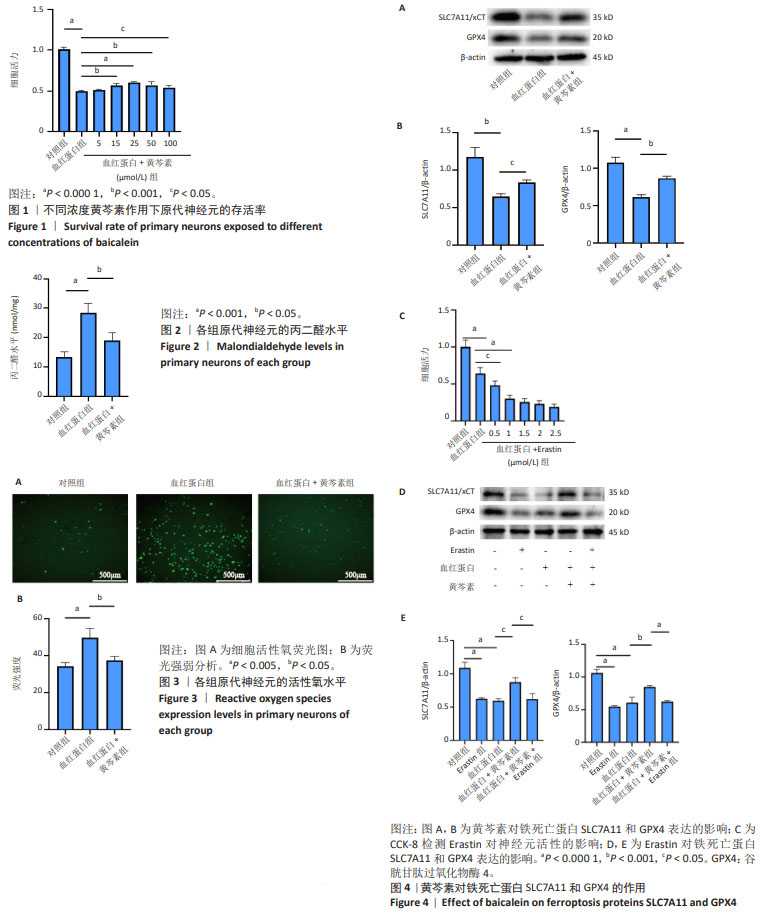
1.4.3 CCK-8法检测细胞活力筛选黄芩素的最佳浓度 将原代神经元细胞制成2×107 L-1的细胞悬液,以每孔200 μL的体积种植于96孔板,培养7 d,分为对照组、血红蛋白组和血红蛋白+黄芩素不同浓度组,每组设置6个复孔,另设空白孔(仅加培养基)为空白对照组。其中血红蛋白浓度为25 μmol/L,黄芩素浓度分别为5,15,25,50,100 μmol/L,黄芩素预处理2 h后加入血红蛋白共同培养24 h,随后每孔按照100∶1比例加入20 μL CCK-8工作液,孵育2 h后用酶标仪检测各组细胞450 nm处吸光度值。
1.4.4 试剂盒检测细胞内丙二醛水平 将原代神经元细胞制成4×108 L-1的细胞悬液,以每孔200 μL的体积种植于96孔板,培养7 d,分为对照组、血红蛋白组和血红蛋白+黄芩素组,每组设置3个复孔,其中血红蛋白浓度为25 μmol/L,黄芩素浓度为25 μmol/L,血红蛋白+黄芩素组先用黄芩素预处理2 h,然后加入血红蛋白共同作用24 h。收集细胞,建立标准曲线,加入提前配置的丙二醛检测工作液,混匀,100 ℃金属浴加热15 min,冷却至室温,1 000×g室温离心10 min,取200 μL上清液进入96孔板,用酶标仪在532 nm波长处测定吸光度值。
1.4.5 试剂盒检测细胞内活性氧水平 将原代神经元细胞制成2×108 L-1的细胞悬液,以每孔200 μL的体积种植于96孔板,培养7 d,分为对照组、血红蛋白组和血红蛋白+黄芩素组,每组设置3个复孔,其中血红蛋白浓度为25 μmol/L,黄芩素浓度为25 μmol/L,血红蛋白+黄芩素组先用黄芩素预处理2 h,然后加入血红蛋白共同作用24 h,检测活性氧水平。按照1∶1 000无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L。去除细胞培养液,加入100 μL稀释好的DCFH-DA,37 ℃细胞培养箱内孵育20 min,用无血清细胞培养液洗涤细胞3次,去除未进入细胞内的DCFH-DA,激发光波长和发射光波长分别为488 nm、525 nm,在荧光显微镜下观察并拍照,Image J软件分析平均荧光强度。
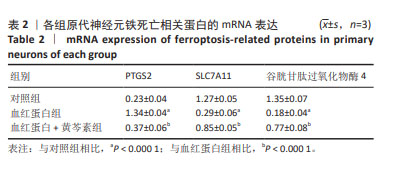
1.4.6 RT-PCR检测PTGS2、SLC7A11、GPX4的mRNA表达 将原代神经元细胞制成8×108 L-1的细胞悬液,以每孔1 mL的体积种植于12孔板,培养7 d,分为对照组、血红蛋白组和血红蛋白+黄芩素组,每组设置3个复孔,其中血红蛋白浓度为25 μmol/L,黄芩素浓度为25 μmol/L,血红蛋白+黄芩素组先用黄芩素预处理2 h,然后加入血红蛋白共同作用24 h,用RNA提取试剂盒提取每组细胞总RNA,测浓度后,反转录合成cDNA,按照试剂盒说明书采用SYBR Green染料法荧光定量PCR,以GAPDH作为内参基因,以2-ΔΔCT法计算PTGS2、SLC7A11、GPX4的mRNA表达水平。引物序列见表1。

1.4.7 CCK-8法检测细胞活力筛选Erastin的最佳浓度 将原代神经元细胞制成2×107 L-1的细胞悬液,以每孔200 μL的体积种植于96孔板,培养7 d,分为对照组、血红蛋白组和血红蛋白+Erastin不同浓度组,每组设置3个复孔,另设空白孔(仅加培养基)为空白对照组。其中血红蛋白浓度为25 μmol/L,Erastin浓度分别为0.5,1.0,1.5,2.0,2.5 μmol/L,Erastin与血红蛋白共同作用24 h,随后每孔按照100∶1加入20 μL CCK-8工作液,孵育2 h后用酶标仪检测各组细胞450 nm处吸光度值。
1.4.8 Western blot检测蛋白表达水平 将原代神经元细胞制成8×108 L-1的细胞悬液,以每孔2 mL的体积种植于6孔板,培养7 d,分为对照组、Erastin组、血红蛋白组、血红蛋白+黄芩素组、血红蛋白+黄芩素+Erastin组,每组设置3个复孔,其中血红蛋白浓度为25 μmol/L,黄芩素浓度为25 μmol/L,Erastin浓度为1.5 μmol/L,与血红蛋白连用Erastin浓度为0.5 μmol/L,血红蛋白+黄芩素组先用黄芩素预处理2 h,然后加入血红蛋白共同作用24 h,血红蛋白+黄芩素+Erastin组先用黄芩素预处理2 h,然后加入血红蛋白和Erastin共同作用24 h。各组干预结束后,每孔加入RIPA、蛋白酶抑制剂和超级核酸酶混合液,裂解提取细胞总蛋白,用BCA试剂盒测定蛋白浓度。蛋白加热变性,以30-50 μg的质量上样,电泳、转膜后用5%脱脂奶粉封闭1 h,分别加入以1∶1 000稀释的SLC7A11一抗和1∶5 000稀释的GPX4一抗,孵育过夜,选择一抗相应种属的二抗,室温摇床孵育1 h,ECL化学发光显影,Image J软件分析蛋白条带灰度值。
1.5 主要观察指标 ①黄芩素对原代神经元细胞活性的影响;②黄芩素对原代神经元细胞丙二醛水平的影响;③黄芩素对原代神经元细胞活性氧水平的影响;④黄芩素对SLC7A11和GPX4蛋白表达的影响;⑤黄芩素对PTGS2、SLC7A11和GPX4 mRNA表达的影响。
1.6 统计学分析 采用GraphPad Prism 9.0软件进行统计分析,数据为计量资料,以x±s表示,采用单因素方差分析(ANOVA)和t检验进行统计学处理,其中两组间对比用t检验,3组或3组以上对比用单因素方差分析。P < 0.05为差异有显著性意义。文章的统计学方法经南京大学医学院附属鼓楼医院生物统计学专家审核。
中国组织工程研究杂志出版内容重点:干细胞;骨髓干细胞;造血干细胞;脂肪干细胞;肿瘤干细胞;胚胎干细胞;脐带脐血干细胞;干细胞诱导;干细胞分化;组织工程