Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (13): 3392-3401.doi: 10.12307/2026.358
Previous Articles Next Articles
Application of exosomes in the diagnosis and monitoring of oral diseases
Huang Jiayao1, Gu Yu1, 2
- 1Zhuhai Campus of Zunyi Medical University, Zhuhai 519041, Guangdong Province, China; 2Key Laboratory of Guizhou Province for Stomatological Disease Research, Zunyi 563000, Guizhou Province, China
-
Accepted:2025-09-12Online:2026-05-08Published:2025-12-26 -
Contact:Gu Yu, MS, Associate professor, Zhuhai Campus of Zunyi Medical University, Zhuhai 519041, Guangdong Province, China; Key Laboratory of Guizhou Province for Stomatological Disease Research, Zunyi 563000, Guizhou Province, China -
About author:Huang Jiayao, Zhuhai Campus of Zunyi Medical University, Zhuhai 519041, Guangdong Province, China -
Supported by:National Undergraduate Innovation and Entrepreneurship Training Program for Local Universities, No. 2024106610916 (to HJY)
CLC Number:
Cite this article
Huang Jiayao, Gu Yu. Application of exosomes in the diagnosis and monitoring of oral diseases[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(13): 3392-3401.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
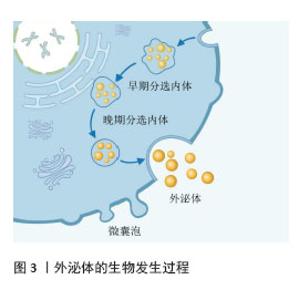
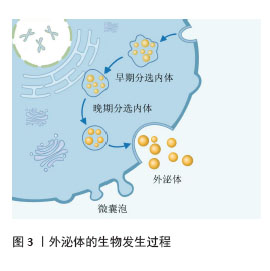
2.1 外泌体概述 外泌体由免疫系统、再生医学及肿瘤微环境中的关键细胞群体(包括但不限于活化的免疫细胞、组织修复相关的间充质干细胞、屏障功能上皮细胞以及恶性转化细胞)通过精密的内吞-分泌机制持续释放至胞外空间,外泌体的膜结构囊泡特性使它成为捕获细胞动态的微型生物传感器[6]。外泌体具有典型的脂质双分子层结构,携带DNA、RNA、脂质、代谢物及跨膜蛋白等生物活性分子,广泛分布于血液、唾液、脑脊液等体液中[7],构成复杂的细胞间通讯系统[8]。研究表明,外泌体通过两种作用模式调控靶细胞功能:①表面配体与受体细胞膜蛋白特异性结合激活信号通路;②通过内吞或膜融合递送内容物,介导组织微环境重塑及疾病进展[9]。值得注意的是,外泌体分子谱可动态反映疾病特异性改变,这一特性使其在液体活检领域备受关注。以唾液外泌体为例,由于其非侵入性的采集方式及与口腔病理的高度相关性,现已成为口腔癌早期诊断和疗效监测的理想标志物,展现出显著的临床转化价值。 2.2 外泌体的生物发生 外泌体的形成过程分为3个阶段:①膜内陷与内体形成;②多囊泡体成熟与管腔内囊泡生成;③多囊泡体分选与外泌体释放。首先,细胞通过内吞作用摄取胞外成分,触发质膜首次内陷形成早期分选内体。在此过程中,胞外成分沿细胞表面的蛋白质进入细胞,进入细胞后在细胞内侧形成的质膜芽呈“外向内”取向。质膜芽可与内质网、反式高尔基体网络等细胞器融合,进一步富集生物活性分子。随后早期分选内体经动态重塑转化为晚期分选内体,通过二次膜内陷形成管腔内囊泡,而细胞质成分会进入新形成的管腔内囊泡。质膜第二次内陷形成管腔内囊泡过程中可能修饰未来外泌体的内容物。在管腔内囊泡形成过程中,蛋白质根据内陷的体积生成不同大小的管腔内囊泡,这些囊泡含有不同的内容物。晚期分选内体产生具有确定的管腔内囊泡集合的多囊泡体。成熟的多囊泡体呈现双重命运:被降解和分泌。多囊泡体的降解可通过2种途径实现:一方面,多囊泡体通过与自噬体结合形成复合结构,将内容物递送至溶酶体进行分解;另一方面,多囊泡体绕过自噬体,直接与溶酶体融合后完成降解过程。经上述途径产生的分解产物可作为原料被细胞循环再利用。而剩余的多囊泡体通过细胞的细胞骨架和微管网络转运至质膜,在多囊泡体停靠蛋白的帮助下停靠在质膜的腔侧完成膜对接与融合,最终通过胞吐作用释放管腔内囊泡,即形成具有生理活性的外泌体[8]。外泌体的生物发生过程见图3。"
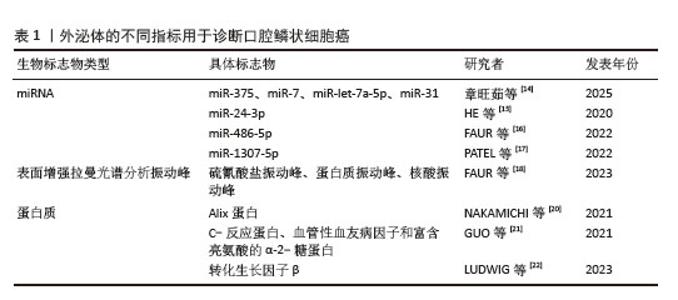
2.3 外泌体在口腔疾病诊断和监测中的应用 2.3.1 口腔鳞状细胞癌的诊断 口腔鳞状细胞癌(oral squamous carcinoma,OSCC)是头颈部最常见的恶性肿瘤[10]。临床上,早期口腔鳞状细胞癌(Ⅰ期)的5年生存率可达80%,而晚期(Ⅳ期)患者生存率则下降至30%[11]。目前口腔鳞状细胞癌的诊断主要依赖甲苯胺蓝染色、脱落细胞学检测及组织病理活检。然而,甲苯胺蓝染色易受浓度和炎性病灶干扰,导致假阳性结果[12],脱落细胞学检测存在耗时长、成本高的局限性[12]。组织病理活检作为“金标准”,其有创性降低了患者依从性,且诊断结果易受病理医生经验的影响[13]。因此,开发无创、客观的诊断方法成为口腔鳞状细胞癌早期筛查的研究热点。 近年研究表明,唾液外泌体微小RNA(miRNA)作为口腔鳞状细胞癌的生物标志物具有巨大潜力[14]。miRNA通过调控肿瘤微环境参与口腔鳞状细胞癌的发生发展,例如miR-375通过靶向胰岛素样生长因子受体1抑制肿瘤细胞增殖并增强放疗敏感性,而miR-7则通过抑制表皮生长因子受体信号通路发挥抑癌作用,miR-let-7a-5p表达失调与细胞凋亡、血管生成及细胞周期调控密切相关,其表达降低可促进口腔鳞状细胞癌的进展。此外,miR-31通过激活缺氧诱导因子通路诱导血管生成,显著增强肿瘤侵袭性。这些发现表明,特定miRNA的表达谱与口腔鳞状细胞癌的生物学行为存在密切关联。 在诊断效能评估方面,多项研究逐步揭示了关键miRNA在口腔鳞状细胞癌诊断中的临床价值。HE等[15]的研究显示,口腔鳞状细胞癌患者唾液外泌体中miR-24-3p的表达水平显著高于健康对照组,且miR-24-3p的表达与细胞周期蛋白依赖性激酶(CDK4/6)的激活密切相关,提示其可能作为早期检测的潜在标志物。FAUR等[16]的后续研究进一步指出,miR-486-5p在口咽鳞状细胞癌中的表达水平较非口腔鳞状细胞癌患者升高更为显著(曲线下面积=0.89 vs. 0.67),尤其在Ⅱ期肿瘤中表达量达到峰值(FC=12.85),显示出对早期病变较强的诊断潜力。值得关注的是,miR-10b-5p在口腔鳞状细胞癌患者中呈现下调趋势,其表达水平与肿瘤分化程度呈负相关——G3鳞状细胞癌中miR-10b-5p表达量较G1鳞状细胞癌升高,这一矛盾现象提示miRNA可能参与肿瘤进展的复杂调控网络。 近期研究还发现,miR-1307-5p在口腔鳞状细胞癌组织和患者唾液外泌体中均为高水平表达,尤其在Ⅲ-Ⅳ期患者中表达水平显著高于早期患者(FC=31.3 vs. 1.18)。PATEL等[17]发现,miR-1307-5p通过靶向THOP1、EHF、RNF4和RNF114调控口腔鳞状细胞癌进展,其高表达与CD44+肿瘤干细胞亚群相关,为晚期口腔鳞状细胞癌的分子分型提供了新视角。综上,唾液外泌体miRNA谱的动态变化不仅反映了口腔鳞状细胞癌的生物学特性,还为个体化诊疗提供了新靶点。 除miRNA外,外泌体蛋白质谱分析在口腔鳞状细胞癌诊断中也具有重要价值。FAUR等[18]通过表面增强拉曼光谱技术分析唾液外泌体发现,口腔鳞状细胞癌患者样本中硫氰酸盐、蛋白质(如酰胺Ⅰ带)及核酸的振动峰信号强度均显著高于健康对照组,提示外泌体生化成分的变化可作为潜在诊断指标。ZLOTOGORSKI-HURVITZ团队[19]采用傅里叶变换红外光谱技术进一步观察到口腔鳞状细胞癌患者唾液外泌体的特征峰强度与健康人群存在显著差异。 在蛋白质组学层面,NAKAMICHI等[20]发现口腔鳞状细胞癌患者血清及唾液外泌体中Alix蛋白水平显著升高,且免疫组化显示Alix在肿瘤组织中广泛表达,提示其可能参与外泌体生物发生过程。GUO等[21]通过蛋白质组学筛选并验证了C-反应蛋白、血管性血友病因子和富含亮氨酸的α-2-糖蛋白3种血清外泌体蛋白标志物,联合检测时曲线下面积达0.96,敏感性为84.7%,特异性为95%,显著优于单一标志物。值得注意的是,LUDWIG等[22]最新研究表明,口腔鳞状细胞癌患者血浆外泌体中转化生长因子β含量随肿瘤进展显著增加,且与肿瘤大小呈正相关,提示外泌体中转化生长因子β可作为监测疾病进展的动态生物标志物。 这些研究揭示了外泌体蛋白质组在口腔鳞状细胞癌诊断中的多重价值:一方面,表面增强拉曼光谱和傅里叶变换红外光谱等光谱技术通过无标记检测外泌体生化特征,展现出高灵敏度和特异性;另一方面,Alix、C-反应蛋白等关键蛋白的异常表达不仅反映肿瘤微环境变化,还可能参与调控肿瘤进展。未来需进一步探索外泌体蛋白质与核酸的协同作用机制,并建立标准化检测流程以实现临床转化。 以上研究仍存在诸多不足之处:①样本异质性限制了结论的可推广性,如FAUR等[16]仅纳入50例患者,且84%为晚期病例,可能导致早期标志物的敏感性被低估。ZLOTOGORSKI-HURVITZ等[19]研究中混合样本量,牺牲了个体化数据,可能降低临床转化价值。②对比不同研究的诊断效能,miRNA的临床适用性差异显著。受限于技术异质性、机制碎片化和临床设计不足,其转化应用仍面临挑战。因此未来研究可继续扩大样本量,聚焦于结合多组学技术构建动态监测模型,提高标志物特异性等。上述外泌体在口腔鳞状细胞癌诊断中的研究进展总结见表1。"


2.3.2 口腔潜在恶性病变的诊断和监测 口腔潜在恶性病变的学术定义经历了显著的演变过程[23]:早期研究(1805年)将其界定为“形态学改变显著且癌变倾向高于正常组织的病变”。后续研究提出了“口腔癌前状态”的概念,专门指代具有显著癌变风险的系统性病理状态。随着循证医学证据的不断积累,WHO于2005年整合了此前相关概念,将一类具有明确统计学意义的癌变风险临床表现统一命名为“口腔潜在恶性病变”。2021年,WHO口腔癌协作中心基于最新分子病理学研究进展,进一步将其重新定义为“经统计学验证与口腔癌发生风险呈显著正相关的口腔黏膜异常综合征”,这一分类体系明确纳入了口腔白斑、口腔黏膜下纤维性变及口腔扁平苔藓等具体病变[24]。 口腔白斑(oral leukemia,OLK)是一种口腔潜在恶性疾患,恶性转化风险为1.1%-40.8%,其特征为上皮显著角化和增厚[25]。组织活检是诊断口腔白斑的金标准,随着临床诊疗技术的发展,甲苯胺蓝染色、自体荧光检测及DNA倍体分析等椅旁无创/微创技术可作为口腔白斑癌变监测的重要辅助手段,然而检测结果仍需与临床医师的实践经验相结合,方能形成有效诊断结论[26]。因此急需一种新的无创、高效、准确的诊断方法用于诊断口腔白斑。 WANG等[27]通过构建仓鼠口腔鳞状细胞癌动物模型,成功模拟了正常上皮经口腔白斑、异型增生最终进展为口腔鳞状细胞癌的多阶段癌变过程。研究结果显示,miR-450b在口腔白斑向口腔鳞状细胞癌进展过程中呈现显著上调趋势,这可能意味着其可作为口腔白斑恶性转化的潜在生物标志物。进一步机制研究发现,miR-450b通过靶向抑制SERPINB2基因表达,导致尿激酶型纤溶酶原激活物、基质金属蛋白酶及波形蛋白表达升高,同时抑制E-钙黏蛋白表达,从而促进上皮-间质转化过程。值得注意的是,作为miR-450b的直接靶基因,SERPINB2在口腔鳞状细胞癌组织中表达显著下调,且其低表达与肿瘤细胞迁移、侵袭能力增强密切相关,这一现象提示SERPINB2可能成为口腔白斑诊断或预后评估的潜在指标。 YU等[28]通过免疫组化检测发现,口腔白斑组织中BRCA1、核因子E2相关因子2、血红素加氧酶1及醌氧化还原酶1的表达水平显著高于正常黏膜组织,但低于口腔鳞状细胞癌组织,提示这些分子可能参与了口腔白斑的恶性转化过程。值得关注的是,BRCA1与核因子E2相关因子2信号通路的下游关键靶基因(血红素加氧酶1及醌氧化还原酶1)在口腔白斑组织中表现出协同高表达的特点,且细胞增殖标志物Ki-67的表达水平与BRCA1、核因子E2相关因子2的表达呈显著正相关。这一现象提示,BRCA1-核因子E2相关因子2信号轴的激活可能通过调控氧化应激反应及DNA损伤修复机制,增加口腔白斑的进展风险。 在探讨外泌体miR-185作为口腔白斑恶变诊断标志物可行性的研究中,夏倩等[29]将93例受试者划分为健康组、白斑组、白斑伴上皮轻度异常增生组、白斑伴上皮重度异常增生组及鳞状细胞癌组,通过检测唾液外泌体miR-185的表达水平发现:与健康组相比,白斑伴上皮轻度异常增生组miR-185表达量升高1.8倍(P < 0.05);而白斑组、白斑伴上皮重度异常增生组及鳞状细胞癌组则分别降至健康组的0.6倍、0.3倍和0.2倍(P均< 0.01),其中白斑伴上皮重度异常增生组的降幅最为突出。值得关注的是,白斑伴上皮轻度异常增生组与白斑伴上皮重度异常增生组、鳞状细胞癌组之间miR-185的表达差异均有显著性意义(P < 0.05),这提示外泌体miR-185的表达水平可能随着口腔白斑恶变程度的加重呈现动态下降趋势。综合来看,通过检测上述分子的异常表达(如血清miR-450b、组织中的SERPINB2、BRCA1、核因子E2相关因子2、血红素加氧酶1、醌氧化还原酶1及Ki-67等),可辅助评估口腔白斑的生物学行为,并预测其向口腔鳞状细胞癌进展的风险。 口腔黏膜下纤维化是一种慢性疾病,常被视为口腔癌的前体,其病理特征包括慢性炎症和局部组织炎症,临床表现主要为口干、疼痛、味觉障碍和吞咽困难,其发病率与地区、饮食、生活习惯密切相关[30]。临床尚缺乏用于评估口腔黏膜下纤维化癌变风险的可靠生物标志物。ZHOU等[31]的研究显示,外泌体源性长链非编码RNA ADAMTS9-AS2通过靶向抑制蛋白激酶B信号通路发挥口腔黏膜下纤维化阻滞效应。黄永祺[32]研究表明,槟榔碱通过促进THP-1细胞释放外泌体,间接提升人口腔黏膜成纤维细胞中miR-155的表达水平,进而促进纤维化表型的表达,确定了THP-1细胞外泌体内miR-155在促进人口腔黏膜成纤维细胞向纤维化表型转化中扮演着关键角色,因此可以推测,检测人口腔黏膜成纤维细胞中的外泌体可能成为判断口腔黏膜下纤维化疾病进展情况的有效诊断标志物。 口腔扁平苔藓作为高发性自身免疫相关口腔黏膜慢性炎性病变,其发病机制尚未完全阐明[33-34],典型病损多累及颊黏膜与舌体,临床以糜烂型及萎缩型为主要表型特征。患者常主诉黏膜疼痛、粗糙感及持续性灼痛,生活质量受到了严重影响。建立精准诊疗体系并实施长期动态监测以预警癌变风险具有重要的临床价值。近年研究揭示循环外泌体可作为口腔扁平苔藓的新型生物标志物[35],PENG等[36]研究发现患者血浆外泌体中miR-34a-5p与miR-130b-3p高表达,而miR-301b-3p表达受抑制,其中miR-34a-5p的表达水平与疾病严重程度呈正相关,表明其具有作为病情评估指标的价值。另有研究采用miRNA芯片联合qPCR验证技术,证实口腔扁平苔藓患者唾液外泌体中miR-4484特异性表达上调,为开发无创诊断工具提供了新的分子靶点[37]。 外泌体整合核酸、蛋白等分子信息,为口腔潜在恶性病变提供了多维度诊断窗口。未来可继续研究开发外泌体组学的动态监测体系,以实现从癌前病变到恶性转化的全程管理。上述外泌体在口腔潜在恶性病变诊断中的研究进展总结见表2。"

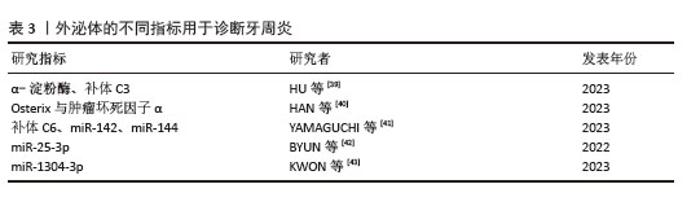
2.3.3 牙周炎的诊断 牙周炎的传统检查(如视诊、探诊、放射影像学检查)操作困难,只能反映牙周炎的累积性破坏,存在一定的局限性,无法准确判断炎症的程度和发展趋势[38]。早期诊断是牙周炎治疗的关键,外泌体因携带丰富的疾病特征信息成为诊断牙周炎的研究热点,可通过监测外泌体的内容物、表面标记物等揭示局部微环境的变化,提示牙周炎的进展状态。 近年来,围绕唾液外泌体在牙周炎诊断中的应用价值,学界开展了多项探索性研究,但整体仍停留在初步阶段。例如,HU等[39]借助质谱技术筛选出α-淀粉酶、补体C3等9种差异表达蛋白,并提出它们作为潜在诊断标志物的可能性。然而该研究存在显著局限性:样本量较小、未开展独立队列验证,且未充分论证标志物的特异性——如补体C3在多种炎症状态下均会出现表达波动,难以单独作为牙周炎的特异性指标。HAN等[40]则聚焦唾液外泌体中的mRNA表达谱,发现Osterix与肿瘤坏死因子α在牙周炎患者中呈现反向调控特征,且受试者工作特征曲线分析显示其具备一定诊断效能(曲线下面积> 0.7)。但该研究同样存在不足:未对牙周炎严重程度、吸烟史等混杂因素进行控制,也未与其他口腔疾病开展鉴别验证,可能导致对标志物诊断特异性的高估。 YAMAGUCHI团队[41]基于纵向队列研究观察到,初始牙周治疗后患者补体C6的表达变化与miR-142/144水平呈现显著相关性,这一现象提示外泌体成分的动态变化可能与治疗效果存在关联。该研究的局限性较为明显:研究对象主要纳入Ⅲ/Ⅳ期重度牙周炎患者,且随访周期较短,因此难以评估相关标志物的长期稳定性。BYUN等[42]通过构建糖尿病牙周炎小鼠模型,证实抑制miR-25-3p可减轻炎症反应;但需注意的是,动物模型与人类疾病的生理机制存在差异,且该研究未进一步验证此作用通路在人类牙周炎中的具体表现。KWON等[43]基于小样本测序数据筛选出血浆外泌体miR-1304-3p等潜在标志物,但研究纳入对象包含牙龈炎患者,可能导致炎症分期差异对结果产生干扰;此外,小核仁RNA的生物学功能至今仍未完全阐明。 综合来看,现有研究在标志物发现层面虽取得一定进展,但仍普遍面临以下挑战:①样本异质性特征显著,牙周炎分期、全身代谢状态等关键因素未得到严格控制;②不同研究采用的技术平台(如质谱、微阵列、qPCR等)缺乏统一性;③多维度验证不足,多数研究仅通过单一技术平台或小样本量完成标志物的发现与验证;④机制阐释深度有限,现有研究多停留在相关性分析层面,尚未阐明外泌体与宿主细胞作用的具体路径。未来研究需着力构建标准化操作流程,开展大样本队列研究,同时整合代谢组、转录组等多组学数据,并深入探索外泌体介导的免疫调控网络,从而推动唾液外泌体从实验室研究向临床应用的跨越式发展。上述外泌体在牙周炎诊断中的研究进展总结见表3。"


2.3.4 正畸牙移动的诊断和监测 正畸牙移动是牙齿受到外界矫治力刺激后,牙齿及其牙周组织发生组织学及生物力学适应性反应,其核心在于牙槽骨和牙周膜的重塑[44]。正畸牙齿高效的移动及牙周组织稳定的改建一直是临床正畸医生所追求的目标。医生掌握患者牙齿移动时牙周组织的改建状态对正畸治疗具有重要意义[45]。 龈沟液生物标志物检查以无创和可重复性的采样方式,已成为正畸治疗中一种具有发展前景的诊断和监测手段。对龈沟液内特定生物标志物的定性和定量分析可以用来了解正畸牙移动时牙周组织对正畸力的响应及其改建状态。现阶段,外泌体在正畸牙移动诊断研究中的应用呈现方法学演进。早期研究多采用龈沟液样本,如KAPOOR等[46]通过生物信息学分析提出miR-29、miR-21、miR-34a可能参与破骨-成骨平衡调控和炎症反应影响正畸牙移动,但存在显著局限:①样本易受唾液污染导致外泌体纯度不足;②未区分张力侧与压力侧的力学响应差异。KAZANOPOULOS等[47]首次突破样本类型限制,在唾液外泌体中发现hsa-miR-4634的表达水平显著下调,提示其与破骨细胞功能(通过VAV3调控)的潜在关联。正畸牙齿移动可分为3个阶段:初始期(加力后快速牙移动)、滞后期(牙周膜透明样变导致牙移动停滞)和重塑期(坏死组织清除后牙移动恢复)[48]。研究中,第0-7天对应初始期,第7-40天对应滞后期和重塑期,这项研究的不足在于仅有15例样本量与仅收集治疗前、治疗后第7天和第40天的唾液样本,难以排除个体差异干扰,且未验证hsa-miR-4634在整个正畸牙移动过程中的动态变化。BAI等[49]通过体外实验证实人牙周膜细胞来源外泌体可通过诱导巨噬细胞M2极化间接促进破骨分化,首次揭示外泌体介导的力学-免疫调控轴。近期POLIZZI等[50]在同一患者的加力侧与非加力侧采集龈沟液样本,发现非加力侧miR-7a-2-3p、miR-21-5p显著上调,张力侧miR-7a-3p上调。但他们并未控制白细胞介素6等全身炎症因子的混杂影响。 现阶段研究的不足之处在于,龈沟液样本受污染风险高,采样频率受限,难以捕捉整个疾病过程监测物的动态变化。未来可聚焦于唾液外泌体用于正畸牙移动的研究,建立分阶段动态监测体系,针对初始期、滞后期、重塑期设计差异化采样策略;或者开发侧向特异性检测技术,通过单外泌体表面标记区分力学响应侧分子特征。但目前需优先解决样本异质性问题,通过标准化外泌体分离流程提升数据可比性。上述外泌体在正畸牙移动诊断和监测中的研究进展总结见表4。"


2.3.5 干燥综合征的诊断 干燥综合征(Sj?gren’s syndrome,SS)是一种以淋巴细胞浸润外分泌腺(如泪腺和唾液腺)为特征的慢性自身免疫性疾病,主要表现为口干、眼干等症状。根据是否伴随其他自身免疫病,干燥综合征分为原发性(pSS)和继发性(sSS)两类[51]。 干燥综合征的诊断依赖于临床评分(如唇腺活检、抗SSA/SSB抗体检测等)[52],其中唇腺活检是诊断干燥综合征的金标准,但该方法的局限性在于:唇线活检是侵入性操作,部分患者依从性差。而口干、眼干等症状也见于糖尿病、药物不良反应等,缺乏特异性,且存在部分血清学抗体检查阴性的患者,易出现漏诊的情况[53],对干燥综合征的早期诊断较困难,而疾病严重时可导致患者生活质量下降和恶性淋巴瘤等发生。因此,迫切需要用于干燥综合征早期检测的非侵入性、敏感和特异性的诊断工具,以减少由于漏诊而经历延误的患者数量。 近年来,外泌体作为液态活检的新型生物标志物载体,在原发性干燥综合征发病机制解析及诊断标志物筛选中展现出独特价值。多组学技术的交叉应用揭示了外泌体在反映疾病异质性中的分子特征:FERRANT等[54]基于流式细胞术与蛋白质组学联合分析发现,原发性干燥综合征患者血浆外泌体中内皮细胞(CD31+、CD146+)、上皮细胞(CK+)及中性粒细胞(CD15+)来源亚群显著增加,伴随整合素αM、嗅素4等特征蛋白富集,提示血管内皮损伤、腺体上皮破坏及髓系免疫激活的病理协同机制。PENG等[55]通过超速离心联合无标记定量蛋白质组学进一步证实,铁死亡相关通路调控蛋白(铜蓝蛋白、转铁蛋白)与补体系统组分(C5、C9)的异常表达具有外泌体特异性,且与外分泌腺损伤程度呈正相关。值得注意的是,唾液外泌体研究揭示了独特的非编码RNA调控网络,CROSS等[56]发现tRNA-Ile-AAT-2-1下调可能参与原发性干燥综合征的表观遗传调控,而YAMASHIRO等[57]通过漱口水样本捕获的miR-1290与let-7b-5p组合显示出高达0.856的诊断效能,突破了传统组织活检的局限性。在动物研究方面,KAKAN等[58]通过小RNA深度测序和验证实验,确定了NOD小鼠血清外泌体中5个显著上调的miRNA(miR-127-3p、miR-409-3p、miR-410-3p、miR-541-5p和miR-540-5p)。这些miRNA可能参与炎症相关通路,提示其在干燥综合征发病机制中的作用,具有作为干燥综合征早期诊断生物标志物的潜力。 尽管上述研究在标志物发现层面取得突破,但存在以下不足:多数研究样本量偏小且缺乏纵向追踪。此外,存在技术偏倚:如FERRANT等[54]研究中Annexin V标记法可能混杂脂蛋白干扰。未来需构建标准化外泌体分离流程,整合空间多组学与单细胞测序技术,以突破当前标志物敏感性与特异性瓶颈,以推动外泌体的临床应用转化。上述外泌体在干燥综合征诊断中的研究进展总结见表5。"


2.3.6 龋病早期诊断与进展监测 龋病流行率与发病率长期处于较高水平,已成为当前口腔健康领域的核心公共卫生负担。龋病本质是口腔微生物群落生态失衡引发的牙体硬组织慢性进行性病理性损害,依据细菌侵袭牙体组织的深度差异,可划分为浅龋、中龋及深龋3个阶段。龋病的关键危害特征在于早期病变具有显著隐匿性——患者早期多无显著痛感,待临床症状明显时,往往已造成牙体软硬组织的不可逆损伤。因此,早期龋病的精准诊断与进展监测在临床实践中具有重要意义。使用国际龋病检测和评估系统能够根据龋损的进展程度和分级,帮助医生更准确地诊断早期龋[59]。 当前临床龋病检测仍以传统视诊为主要手段,该方法高度依赖操作医师的临床经验,诊断准确性存在局限性;X射线检测技术虽为常用辅助手段,但其对邻面龋的检出敏感度较低,且存在电离辐射暴露风险。尽管近年来激光荧光龋检测仪、定量光导荧光检测仪、光纤透照技术及人工智能检测技术等新型辅助设备逐步应用,但此类技术普遍面临成本高昂的问题[60]。综上,亟需开发一种高效、精准、快速的龋病早期筛查技术。 外泌体作为新型液体活检的工具,用于龋病研究具有独特优势,目前关于龋病诊断和进展监测的相关研究甚少,但初步证据可表明外泌体用于龋病诊断和进展监测也具有良好前景。 一方面,通过检测细菌来源的外泌体来反映龋病进展情况:变形链球菌是口腔中的正常菌群,目前学界普遍公认其致龋的核心地位[61-62],它的病理机制涉及三大关键能力——牙面黏附优势、酸性产物生成及耐酸适应特性[63],这些特性协同驱动生物膜形成,打破牙釉质脱矿-再矿化的动态平衡,引发牙体硬组织破坏性改变[64]。变形链球菌核心致龋毒力因子网络由黏附素、葡糖基转移酶、葡聚糖结合蛋白构成[65]。葡聚糖结合蛋白家族成员GbpA-D则通过特异性识别α-1,6糖苷键结构,在生物膜不同发展阶段发挥双重调控作用,初期通过葡聚糖结合结构域介导细菌锚定,在生物膜成熟阶段则借助疏水结构域构建“葡聚糖-蛋白-菌体”三维交联网络,显著增强了菌斑机械稳定性从而驱动菌斑的成熟进程。 另一方面,可通过检测宿主的唾液蛋白水平变化来反映龋病进展。乳铁蛋白可抑制牙面黑色素沉着,但黑色素沉着患者通常龋齿发生率低。虽然高铁摄入会增加口腔菌群,并增加患黑色素沉着的风险,但同时也降低了龋病的易感性[66]。因此乳铁蛋白水平可反映龋病的易感性。分泌型免疫球蛋白对机体局部免疫有重要作用。李潇潇等[67]研究发现,分泌型免疫球蛋白在高龋组的含量明显高于无龋组,说明致龋菌活化而后激活机体免疫系统,促进分泌型免疫球蛋白的产生,从而抑制了龋损的进展。HERTEL等[68]发现低龋活跃儿童唾液总分泌型免疫球蛋白A浓度显著高于龋活跃儿童;但LO GIUDICE等[69]的结论却发现不同龋活跃性组儿童唾液中分泌型免疫球蛋白A含量无显著差异。因此,分泌型免疫球蛋白A与龋活跃性的关系还需更精确的实验进行研究。 同时,研究显示重度低龄儿童龋组的唾液溶菌酶水平和活性显著增加,表明溶菌酶在儿童早发性龋齿进展中起着重要的免疫防御作用[70]。 为防止唾液蛋白因脱离适宜环境而发生降解,避免由此导致的检测敏感性和特异性不足问题,需通过添加蛋白酶抑制剂与核酸酶抑制剂来稳定唾液成分,维持其生物完整性。唾液外泌体所具备的脂质双层结构可保护其内部物质,同时降低了唾液成分的复杂性。因此相比于直接检测唾液成分,检测唾液外泌体成分能为疾病诊断提供更稳定和准确的临床信息。 许多外泌体蛋白质反映了常见的外泌体生物发生途径,有研究表明,变形链球菌可产生外泌体[71]。变形链球菌外泌体完整保留了母体细胞的毒力分子谱系(含黏附素、葡糖基转移酶及葡聚糖结合蛋白)和乳铁蛋白、分泌型免疫球蛋白、溶菌酶水平变化,建立基于外泌体组分的龋损进程监测体系可反映龋病进展情况。 今后可围绕检测唾液外泌体或与龋病有关细菌或真菌来源的外泌体成分如miRNA、蛋白质来反映龋病进展情况,开发研究新的与龋病有关的生物标志物,研究其诊断效能,制定出不同龋病进展程度的分级对应的生物标志物水平范围,为龋病监测提供新思路标准。上述外泌体在龋病早期诊断与进展监测中的研究进展总结见表6。"


2.3.7 唇腭裂的诊断 外泌体在唇腭裂的研究和应用仍处于起步阶段。唇腭裂是一种常见的先天缺陷,具有复杂的病因[72]。唇腭裂分为综合征型唇腭裂和非综合征型唇腭裂。唇腭裂会造成言语、进食等多种功能障碍[72],可以通过手术、牙科治疗、言语治疗和心理治疗进行不同程度的纠正。 超声是筛查胎儿畸形的重要手段,但由于体位因素等影响,胎儿面部难以完全展示,因此对诊断结果存在影响。寻找可靠的诊断方法早期筛查、诊断唇腭裂至关重要。 颅颌面发育依赖于神经嵴细胞增殖、分化与迁移的时空动态协调,这一过程受Wnt、Notch、转化生长因子β等信号通路的精密调控[73]。当特定调控节点发生异常时(如miRNA介导的病理改变),均可能破坏胚胎发育稳态,最终表现为非综合征型唇腭裂表型。近年研究聚焦于miR-299-5p、CD44等分子在非综合征型唇腭裂中的调控作用,但其临床转化价值仍受限于研究设计的局限性。李姣等[74]通过样本病例-对照研究发现:非综合征型唇腭裂患儿血清miR-299-5p表达量较健康对照组下降66.2%,且miR-299-5p与CD44联合检测可将诊断效能提升至曲线下面积为0.821。张兆华等[75]则通过外周血检测发现:非综合征型唇腭裂患儿外周血miR-299-5p表达量下降,曲线下面积为0.770。以上2项研究均未区分唇裂伴或不伴腭裂与单纯腭裂的分子差异,存在亚型覆盖不足的问题,导致结果可比性受限。隗子文等[76]通过蛋白质组学分析发现:非综合征型唇腭裂组织中CD44表达量较健康对照组显著下降,但并未明确CD44表达下调的具体分子机制。此外,3项研究仅局限于产后横断面检测,缺乏妊娠期miRNA/mRNA的时序表达谱分析,且对CD44与转化生长因子β/Smad、Wnt/β-catenin通路的互作模式均未阐明。未来研究需关注亚型特异性,加强动态检测及通路互作机制解析,以推动非综合征型唇腭裂分子机制研究的深度与广度。上述外泌体在唇腭裂诊断与进展监测中的研究进展总结见表7。"

| [1] 褚厚斌,谢云博,宋国华.外泌体介导的细胞间通讯在动脉粥样硬化中的研究进展[J].中国动脉硬化杂志,2025,33(9): 815-822. [2] ZHAO Y, TANG J, JIANG K, et al. Liquid biopsy in pancreatic cancer - Current perspective and future outlook. Biochim Biophys Acta Rev Cancer. 2023;1878(3):188868. [3] FREITAS AJA, CAUSIN RL, VARUZZA MB, et al. Liquid Biopsy as a Tool for the Diagnosis, Treatment, and Monitoring of Breast Cancer. Int J Mol Sci. 2022;23(17):9952. [4] HOFMAN P. Liquid biopsy for lung cancer screening: Usefulness of circulating tumor cells and other circulating blood biomarkers. Cancer Cytopathol. 2021; 129(5):341-346. [5] KIM Y, SHIN S, LEE KA. Exosome-based detection of EGFR T790M in plasma and pleural fluid of prospectively enrolled non-small cell lung cancer patients after first-line tyrosine kinase inhibitor therapy. Cancer Cell Int. 2021;21(1):50. [6] 张咪,吴赛璇,董明,等.新型纳米递送系统:工程化小细胞外囊泡[J].中国组织工程研究,2022,26(27):4417-4422. [7] 王季然,谷颖之,白玉兴.外泌体在牙周炎中组织修复及免疫调控作用的研究进展[J].北京口腔医学,2024,32(6):425-428. [8] KALLURI R, LEBLEU VS. The biology, function, and biomedical applications of exosomes. Science. 2020;367(6478):eaau6977. [9] CAI R, WANG L, ZHANG W, et al. The role of extracellular vesicles in periodontitis: pathogenesis, diagnosis, and therapy. Front Immunol. 2023;14:1151322. [10] 张旭,刘法昱,范杰.HERC5对口腔鳞癌顺铂耐药性的影响[J].医药论坛杂志, 2025,46(6):568-573+580. [11] JÄWERT F, NYMAN J, OLSSON E, et al. Regular clinical follow-up of oral potentially malignant disorders results in improved survival for patients who develop oral cancer. Oral Oncol. 2021;121:105469. [12] 周梦缘,卢杨,许益敏,等.口腔鳞状细胞癌及口腔潜在恶性病变早期诊断研究进展[J].医药前沿,2024,14(28):40-43. [13] 徐英娇,王姗.唾液外泌体在口腔鳞状细胞癌的研究进展[J].口腔医学,2022,42(7): 664-667+672. [14] 章旺茹,陈媛媛,李志萍,等.口腔鳞状细胞癌淋巴结转移机制及相关研究模型进展[J].中华老年口腔医学杂志,2025, 23(2):155-160. [15] HE L, PING F, FAN Z, et al. Salivary exosomal miR-24-3p serves as a potential detective biomarker for oral squamous cell carcinoma screening. Biomed Pharmacother. 2020;121: 109553. [16] FAUR CI, ROMAN RC, JURJ A, et al. Salivary Exosomal MicroRNA-486-5p and MicroRNA-10b-5p in Oral and Oropharyngeal Squamous Cell Carcinoma. Medicina (Kaunas). 2022;58(10):1478. [17] PATEL A, PATEL S, PATEL P, et al. Salivary Exosomal miRNA-1307-5p Predicts Disease Aggressiveness and Poor Prognosis in Oral Squamous Cell Carcinoma Patients. Int J Mol Sci. 2022;23(18):10639. [18] FAUR CI, DINU C, TOMA V, et al. A New Detection Method of Oral and Oropharyngeal Squamous Cell Carcinoma Based on Multivariate Analysis of Surface Enhanced Raman Spectra of Salivary Exosomes. J Pers Med. 2023;13(5):762. [19] ZLOTOGORSKI-HURVITZ A, DEKEL BZ, MALONEK D, et al. FTIR-based spectrum of salivary exosomes coupled with computational-aided discriminating analysis in the diagnosis of oral cancer. J Cancer Res Clin Oncol. 2019;145(3):685-694. [20] NAKAMICHI E, SAKAKURA H, MII S, et al. Detection of serum/salivary exosomal Alix in patients with oral squamous cell carcinoma. Oral Dis. 2021;27(3):439-447. [21] GUO H, JIANG W, HUANG S, et al. Serum exosome-derived biomarkers for the early detection of oral squamous cell carcinoma. Mol Cell Biochem. 2021;476(12):4435-4447. [22] LUDWIG N, YERNENI SS, HARASYMCZUK M, et al. TGFβ carrying exosomes in plasma: potential biomarkers of cancer progression in patients with head and neck squamous cell carcinoma. Br J Cancer. 2023; 128(9):1733-1741. [23] 崔莹莹,丁传扬,彭超然,等.口腔潜在恶性病变的临床病理学诊断研究进展[J].华西口腔医学杂志,2025,43(3): 314-324. [24] WARNAKULASURIYA S, KUJAN O, AGUIRRE-URIZAR JM, et al. Oral potentially malignant disorders: A consensus report from an international seminar on nomenclature and classification, convened by the WHO Collaborating Centre for Oral Cancer. Oral Dis. 2021;27(8):1862-1880. [25] 韩莹,赵璞,刘宏伟.细针扣刺预处理联合光动力疗法治疗口腔白斑[J].北京大学学报(医学版),2025,57(1):91-96. [26] 魏子豪,曾昕,陈谦明.口腔白斑病的规范性临床诊疗[J].中华口腔医学杂志, 2022,57(8):884-889. [27] WANG X, NIE X, XU G, et al. miR-450b promotes cell migration and invasion by inhibiting SERPINB2 in oral squamous cell carcinoma. Oral Dis. 2024;30(2):376-389. [28] YU X, DENG J, ZHANG H, et al. Effects of BRCA1 overexpression via the NRF2/HO1/NQO1 pathway on oral cancer cells proliferation, migration, and apoptosis. Heliyon. 2024;10(20):e38977. [29] 夏倩,王嘉祺,王紫钰,等.外泌体miR-185作为口腔白斑恶变诊断标志物的可行性研究[C]//中华口腔医学会口腔粘膜病专业委员会,中华口腔医学会中西医结合专业委员会.中华口腔医学会第十三次全国口腔粘膜病学暨第十一次全国口腔中西医结合学术大会论文汇编.首都医科大学附属北京口腔医院黏膜科,2021:95. [30] 柴娟华,李阳,梁冰,等.口腔黏膜下纤维化患者血清miR-204和miR-200b水平与临床疗效的关系研究[J].国际检验医学杂志,2024,45(10):1212-1217. [31] ZHOU S, ZHU Y, LI Z, et al. Exosome-derived long non-coding RNA ADAMTS9-AS2 suppresses progression of oral submucous fibrosis via AKT signalling pathway. J Cell Mol Med. 2021;25(4):2262-2273. [32] 黄永祺.槟榔碱通过巨噬细胞外泌体miR-155促进口腔黏膜下纤维化[D].广州:南方医科大学,2024. [33] ABDELSAMIE M, ZAHRAN F, HUSSINE AA, et al. Clinical and biochemical assessment of the effect of topical use of coenzyme Q10 versus topical corticosteroid in management of symptomatic oral lichen planus: randomized controlled clinical trial. BMC Oral Health. 2023;23(1):506. [34] ZHAO Z, WANG L, ZHANG M, et al. Reveals of quercetin’s therapeutic effects on oral lichen planus based on network pharmacology approach and experimental validation. Sci Rep. 2022;12(1):1162. [35] SALINAS-GILABERT C, GÓMEZ GARCÍA F, GALERA MOLERO F, et al. Photodynamic Therapy, Photobiomodulation and Acetonide Triamcinolone 0.1% in the Treatment of Oral Lichen Planus: A Randomized Clinical Trial. Pharmaceutics. 2022;15(1):30. [36] PENG Q, ZHANG J, ZHOU G. Differentially circulating exosomal microRNAs expression profiling in oral lichen planus. Am J Transl Res. 2018;10(9):2848-2858. [37] BYUN JS, HONG SH, CHOI JK, et al. Diagnostic profiling of salivary exosomal microRNAs in oral lichen planus patients. Oral Dis. 2015;21(8):987-993. [38] 娜密牙,白丽娜,冯美玲,等.通过龈沟液SERS检测早期诊断牙周炎的研究进展[J].光散射学报,2025,37(1):1-7. [39] HU H, LEUNG WK. Mass Spectrometry-Based Proteomics for Discovering Salivary Biomarkers in Periodontitis: A Systematic Review. Int J Mol Sci. 2023;24(19):14599. [40] HAN P, JIAO K, MORAN CS, et al. TNF-α and OSX mRNA of Salivary Small Extracellular Vesicles in Periodontitis: A Pilot Study. Tissue Eng Part C Methods. 2023;29(7):298-306. [41] YAMAGUCHI A, TSURUYA Y, IGARASHI K, et al. Changes in the components of salivary exosomes due to initial periodontal therapy. J Periodontal Implant Sci. 2023;53(5):347-361. [42] BYUN JS, LEE HY, TIAN J, et al. Effect of Salivary Exosomal miR-25-3p on Periodontitis With Insulin Resistance. Front Immunol. 2022;12:775046. [43] KWON EJ, KIM HJ, WOO BH, et al. Profiling of plasma-derived exosomal RNA expression in patients with periodontitis: A pilot study. Oral Dis. 2023;29(4):1726-1737. [44] MALTHA JC, KUIJPERS-JAGTMAN AM. Mechanobiology of orthodontic tooth movement: An update. J World Fed Orthod. 2023;12(4):156-160. [45] 管佳妮,严斌.龈沟液内正畸牙移动相关生物标志物的研究进展[J].口腔医学研究,2022,38(5):400-403. [46] KAPOOR P, CHOWDHRY A, BAGGA DK, et al. MicroRNAs in oral fluids (saliva and gingival crevicular fluid) as biomarkers in orthodontics: systematic review and integrated bioinformatic analysis. Prog Orthod. 2021;22(1):31. [47] KAZANOPOULOS N, SIDERIS CD, XU Y, et al. Identification of Salivary Exosome-Derived miRNAs as Potential Biomarkers of Bone Remodeling During Orthodontic Tooth Movement. Int J Mol Sci. 2025;26(3):1228. [48] JEON HH, TEIXEIRA H, TSAI A. Mechanistic Insight into Orthodontic Tooth Movement Based on Animal Studies: A Critical Review. J Clin Med. 2021;10(8):1733. [49] BAI X, WANG Y, MA X, et al. Periodontal ligament cells-derived exosomes promote osteoclast differentiation via modulating macrophage polarization. Sci Rep. 2024; 14(1):1465. [50] POLIZZI A, ALIBRANDI A, LO GIUDICE A, et al. Impact of periodontal microRNAs associated with alveolar bone remodeling during orthodontic tooth movement: a randomized clinical trial. J Transl Med. 2024;22(1):1155. [51] NAGI R, KUMAR SS, SHETH M, et al. Association between oral microbiome dysbiosis and Sjogren Syndrome. A systematic review of clinical studies. Arch Oral Biol. 2025;172:106167. [52] ZHAO T, ZHANG R, LI Z, et al. A comprehensive review of Sjögren’s syndrome: Classification criteria, risk factors, and signaling pathways. Heliyon. 2024;10(17):e36220. [53] VEENBERGEN S, KOZMAR A, VAN DAELE PLA, et al. Autoantibodies in Sjögren’s syndrome and its classification criteria. J Transl Autoimmun. 2021;5:100138. [54] FERRANT J, PONTIS A, ZIMMERMANN F, et al. Phenotypic and proteomic analysis of plasma extracellular vesicles highlights them as potential biomarkers of primary Sjögren syndrome. Front Immunol. 2023; 14:1207545. [55] PENG X, HOU L, WU X, et al. The plasma exosomes from patients with primary Sjögren’s syndrome contain epithelial cell-derived proteins involved in ferroptosis. J Mol Med (Berl). 2023;101(10):1289-1304. [56] CROSS T, HAUG KBF, BRUSLETTO BS, et al. Non-Coding RNA in Salivary Extracellular Vesicles: A New Frontier in Sjögren’s Syndrome Diagnostics? Int J Mol Sci. 2023; 24(17):13409. [57] YAMASHIRO K, HAMADA T, MORI K, et al. Exosome-Derived microRNAs from Mouthrinse Have the Potential to Be Novel Biomarkers for Sjögren Syndrome. J Pers Med. 2022;12(9):1483. [58] KAKAN SS, JANGA SR, COOPERMAN B, et al. Small RNA Deep Sequencing Identifies a Unique miRNA Signature Released in Serum Exosomes in a Mouse Model of Sjögren’s Syndrome. Front Immunol. 2020;11:1475. [59] YAMAL JM, MOFLEH D, CHUANG RJ, et al. Training protocol and calibration of the International Caries Detection and Assessment System in a school-based clinical trial of elementary school-age children. J Public Health Dent. 2025;85(1):13-20. [60] 杜民权.早期龋的临床诊断和治疗[C]//中华口腔医学会口腔预防医学专业委员会.中华口腔医学会口腔预防医学专业委员会第24次口腔预防学术年会论文集.武汉大学口腔医院,2024:15. [61] SHAFAIE E, BADRI Z, SALEHINIYA H, et al. Comparison the salivary streptococcus mutans levels between caries-active and caries-free children from Birjand, Iran: A case-control study. Heliyon. 2024;10(3):e25663. [62] SALTOS ROSERO N, SEOANE PRADO R, et al. Molecular and serological typing of Streptococcus mutans strains isolated from young Galician population: relationship with the oral health status. Int Microbiol. 2020;23(4):589-596. [63] BENDER O, KHOURY J, HIRSCH G, et al. Immunorecognition of Streptococcus mutans secreted proteins protects against caries by limiting tooth adhesion. J Dent. 2024;141:104805. [64] PALLAVI P, SAHOO PP, SEN SK, et al. Comparative evaluation of anti-biofilm and anti- adherence potential of plant extracts against Streptococcus mutans: A therapeutic approach for oral health. Microb Pathog. 2024;188:106514. [65] ELLEPOLA K, SHIELDS RC, KAJFASZ JK, et al. MecA in Streptococcus mutans is a multi-functional protein. mSphere. 2024;9(12): e0030824. [66] 朱锦怡,樊琪,周媛,等.唾液蛋白作为低龄儿童龋预测标志物的研究进展[J].国际口腔医学杂志,2022,49(2):212-219. [67] 李潇潇,李芝香,董宁,等.儿童龋病唾液氧化应激和免疫 指标与龋病严重程度的相关性[J].疑难病杂志,2022,21(1): 69-73. [68] HERTEL S, HANNIG M, HANNIG C, et al. Mucins 5b and 7 and secretory IgA in the oral acquired pellicle of children with caries and caries-free children. Arch Oral Biol. 2022;134:105314. [69] LO GIUDICE G, NICITA F, MILITI A, et al. Correlation of s-IgA and IL-6 Salivary with Caries Disease and Oral Hygiene Parameters in Children. Dent J (Basel). 2019;8(1):3. [70] 王建鑫,王舒婷,马雷,等.牙面黑色素沉着与铁、龋病关系的研究进展[J].国际口腔医学杂志,2025,52(4):456-465. [71] OH SY, KIM DY, LEE KY, et al. Streptococcus mutans-derived extracellular vesicles promote skin wound healing via tRNA cargo. J Nanobiotechnology. 2025;23(1):322. [72] 郑思颖,王诗怡,虞千瑶,等.唇腭裂伴牙槽突裂患者裂隙邻近牙的发育异常和错位特征及治疗进展[J].口腔疾病防治, 2025,33(10):908-918. [73] WU N, YAN J, HAN T, et al. Integrated assessment of differentially expressed plasma microRNAs in subtypes of nonsyndromic orofacial clefts. Medicine (Baltimore). 2018;97(25):e11224. [74] 李姣,张楠,朱艳艳.miR-299-5p联合CD44对儿童非综合征型唇腭裂的诊断价值[J].河南医学研究,2024,33(17):3113-3116. [75] 张兆华,高雨蔚,宋红权,等.外周血miR-299-5p和miR-127-3p的表达水平与非综合征型唇腭裂相关性研究[J].口腔生物医学,2021,12(1):30-33. [76] 隗子文,李佳兴,张兆华,等.非综合征型唇腭裂中SMAD7和CD44表达水平及其临床意义[J].哈尔滨医科大学学报, 2022,56(1):55-58. |
| [1] | Min Changqin, Huang Ying. Construction of pH/near-infrared laser stimuli-responsive drug delivery system and its application in treatment of oral squamous cell carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1940-1951. |
| [2] | Han Teng, Ma Hong, Yang Ruoyi, Luo Yi, Li Chao. Oral squamous cell carcinoma-derived exosomal delivery of angiopoietin-2 is involved in tumor angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1755-1767. |
| [3] | Wang Baiyan, Yang Shu, Wang Yiming, Wu Mengqing, Xiao Yu, Guo Zixuan, Zhang Boyi, Feng Shuying. Exosome-delivered CRISPR/Cas system enables gene editing in target cells [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1839-1849. |
| [4] | Lai Jiaming, , Song Yuling, Chen Zixi, Wei Jinghuan, Cai Hao, , Li Guoquan, . Screening of diagnostic markers for endothelial cell Senescence in mice with radiation-induced heart disease and analysis of immune infiltration [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1450-1463. |
| [5] | Yan Chengbo, Luo Qiuchi, Fan Jiabing, Gu Yeting, Deng Qian, Zhang Junmei. Effect of type 2 diabetes mellitus on orthodontic tooth movement and bone microstructure parameters on the tension side in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 824-831. |
| [6] | Wang Xinyue, Li Hongli, Guo Chunhui, Chen Jibing, Yu Hua. Changes in the expression of six microRNAs in ovarian tissue from animal models of premature ovarian failure and in peripheral blood of patients with premature ovarian failure [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(18): 4675-4684. |
| [7] | Lu Biqiong, Wei Zhongjian. Skeletal muscle-derived exosome-mediated regulation of bone formation and role of exercise intervention [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(13): 3379-3391. |
| [8] | Wu Xianyuan, Zhang Nini, Huang Guilin. Gene transfection technology and tissue fibrosis repair [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(13): 3424-3434. |
| [9] | Liang Liang, Yan Yulu, Zheng Yang, Zhang Xiaoyun, Wang Lei, Qi Wen . Lactylation-related potential targets and Chinese herbal medicine active ingredients targeting treatment of spinal cord injury: GEO database screening analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(12): 3156-3170. |
| [10] | Yang Xirui, He Jinfeng. Pathogenesis of diabetic periodontitis and its local drug delivery treatment strategies [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(11): 2846-2857. |
| [11] | Tian Meng, Lou Tianwei, Zhang Yongchen, Jia Hongling . Cathepsin F as a potential serum biomarker for stroke risk prediction: GWAS database data analysis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(10): 2662-2670. |
| [12] | Jin Kai, Tang Ting, Li Meile, Xie Yuan. Effects of conditioned medium and exosomes of human umbilical cord mesenchymal stem cells on proliferation, migration, invasion, and apoptosis of hepatocellular carcinoma cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1350-1355. |
| [13] | Cao Yue, Ye Xinjian, Li Biyao, Zhang Yining, Feng Jianying. Effect of extracellular vesicles for diagnosis and therapy of oral squamous cell carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1523-1530. |
| [14] | Bai Jing, Zhang Xue, Ren Yan, Li Yuehui, Tian Xiaoyu. Effect of lncRNA-TNFRSF13C on hypoxia-inducible factor 1alpha in periodontal cells by modulation of #br# miR-1246 #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 928-935. |
| [15] | Zhao Zengbo, Li Chenxi, Dou Chenlei, Ma Na, Zhou Guanjun. Anti-inflammatory and osteogenic effects of chitosan/sodium glycerophosphate/sodium alginate/leonurine hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 678-685. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||