Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (7): 1808-1817.doi: 10.12307/2025.685
Previous Articles Next Articles
Interactions between cytokines and satellite cells in muscle regeneration
Cao Yong, Teng Hongliang, Tai Pengfei, Li Junda, Zhu Tengqi, Li Zhaojin
- School of Physical Education, Qufu Normal University, Jining 272000, Shandong Province, China
-
Received:2024-06-11Revised:2024-10-11Accepted:2024-10-18Online:2026-03-08Published:2025-08-20 -
Contact:Li Zhaojin, MD, Associate professor, Master’s supervisor, School of Physical Education, Qufu Normal University, Jining 272000, Shandong Province, China -
About author:Cao Yong, Master candidate, School of Physical Education, Qufu Normal University, Jining 272000, Shandong Province, China -
Supported by:Shandong Provincial Social Science Plan Research Project, No. 21CTYJ08 (to ZTQ)
CLC Number:
Cite this article
Cao Yong, Teng Hongliang, Tai Pengfei, Li Junda, Zhu Tengqi, Li Zhaojin. Interactions between cytokines and satellite cells in muscle regeneration [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1808-1817.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
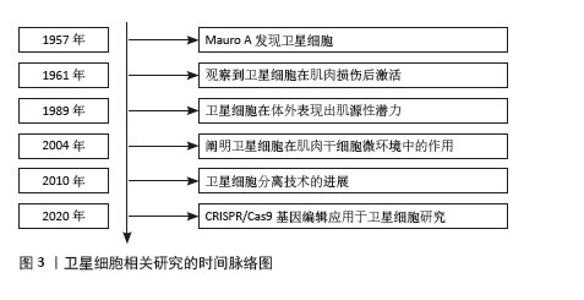
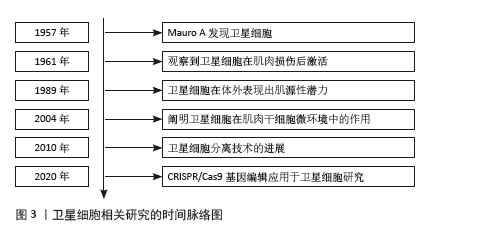
2.1 卫星细胞概述 2.1.1 卫星细胞的定义与特性 卫星细胞是位于成体骨骼肌纤维表面的一类未成熟的单核前体细胞[1-2]。卫星细胞是骨骼肌生长、修复和再生的关键细胞源,对成人肌肉的维持至关重要。研究表明,卫星细胞能够根据肌肉组织的需要快速转变为肌母细胞进行分化和增殖[2,8-9]。卫星细胞位于成年骨骼肌纤维的基底膜和肌纤维膜之间的特定位置,以静息状态存在于成熟骨骼肌中,但其在受到刺激或损伤后被激活,促进骨骼肌的修复和再生[8-10]。卫星细胞的重要标志物之一是成对盒基因7,有助于卫星细胞在成年骨骼肌生成中发挥作用[11]。此外,研究显示,衰老个体的卫星细胞更容易发生凋亡和衰老,这一变化可能影响骨骼肌的再生能力[12]。卫星细胞相关研究的时间脉络图见图3。"

2.1.2 卫星细胞在肌肉修复中的作用 卫星细胞的激活与增殖是骨骼肌修复和再生的关键过程。当骨骼肌损伤后,卫星细胞迅速从休眠状态被激活,并迁移到骨骼肌的受损区域,开始增殖和分化,称为肌母细胞,肌母细胞通过细胞分裂产生新的肌纤维或与现有受损的肌纤维融合,从而实现骨骼肌的修复和再生[8]。 研究表明,骨骼肌再生的过程涉及多种细胞类型的协同作用,包括卫星细胞、免疫细胞和血管内皮细胞等,其中,免疫细胞的作用和细胞因子密切相关。例如,巨噬细胞在骨骼肌再生中发挥重要作用,不仅能够帮助清除受损组织,还可以通过分泌生长因子如胰岛素样生长因子1来促进卫星细胞的激活和增殖[13]。此外,卫星细胞在完成骨骼肌修复任务后,可通过自我更新回到休眠状态[2,8,14]。 2.1.3 卫星细胞的激活与分化机制 卫星细胞的激活与分化过程涉及多种细胞内外因素。骨骼肌发生损伤后,卫星细胞即被激活并重新进入细胞周期,这一过程涉及多种转录因子的表达,包括肌成纤维细胞因子5(myogenic factor 5,Myf5)和肌成分化因子1(myogenic differentiation 1,MyoD)[15]。 肌成纤维细胞因子5和肌成分化因子1的表达对于肌母细胞的命运决定尤为关键,能够使肌母细胞进入增殖状态并促进分化过程的启动[16]。在分化过程中,肌母细胞逐渐表达肌原素基因(Myogenin)和肌肉调控因子4(muscle regulatory factor 4,MRF4),进一步分化为成熟的肌纤维细胞,在此过程中肌母细胞退出细胞周期,合成大量的肌动蛋白和肌球蛋白,促进骨骼肌修复[15]。 2.2 骨骼肌再生过程中细胞因子对卫星细胞的调控作用 在骨骼肌再生过程中,一些小分子蛋白质或肽类通过促进卫星细胞的激活、增殖和分化,影响肌肉的修复和再生能力[17-19]。特定细胞因子如白细胞介素6和肿瘤坏死因子α在卫星细胞激活和肌肉再生中起着重要作用,通过激活特定的信号通路调节卫星细胞的行为。另一方面,细胞因子在卫星细胞分化过程中亦起着负调节作用,帮助维持卫星细胞的未分化状态。骨骼肌再生过程中细胞因子对卫星细胞的调控作用见表1。 "

2.2.1 细胞因子及其功能概述 细胞因子是一类由细胞分泌的小分子蛋白质或肽类,主要功能是介导细胞间的信息传递,调控细胞的生长、分化、迁移及功能[20]。细胞因子在免疫系统中发挥关键作用,通过激活细胞表面受体,触发下游信号传导和基因表达调控,从而调节各种细胞的功能,参与组织的再生与修复[17,21]。研究表明,细胞因子通过激活特定信号通路调控卫星细胞的激活、增殖和分化,进而有效促进肌肉的修复与再生[22-23]。 2.2.2 细胞因子和卫星细胞的激活 细胞因子在卫星细胞的激活和肌肉再生中起到关键作用。其中,白细胞介素6作为一种重要的递质,在肌肉损伤后的再生和抗炎过程中具有重要作用[3-4]。在肌肉炎症过程中,免疫细胞(如中性粒细胞、嗜酸性粒细胞和巨噬细胞)会释放多种细胞因子作用于卫星细胞,促进肌肉修复[24]。此外,肿瘤坏死因子α在慢性局部炎症和肌肉蛋白质代谢中发挥作用[5]。已有研究表明,在遗传性肿瘤坏死因子α基因缺失的老年小鼠中,肌肉萎缩明显改善,同时卫星细胞活化能力增强[17]。细胞因子通过影响包括STAT3和核因子κB在内的多种信号通路,调控卫星细胞的活性和肌肉的修复能力[21,25]。 其他细胞因子,包括肌肉生长抑制素、鸢尾素、胰岛素样生长因子1、肿瘤坏死因子α以及干扰素γ,也参与到卫星细胞的激活。其中,肌肉生长抑制素抑制了肌肉的生长和修复,其拮抗剂可以增强卫星细胞的活性[18]。鸢尾素作为肌肉分泌的激素,参与调节体内脂肪代谢的同时,可能通过运动调控来促进卫星细胞的活化[19],胰岛素样生长因子1在细胞增殖和分化中发挥关键作用[19]。 总的来说,特定的细胞因子在卫星细胞的激活和肌肉再生中发挥重要作用,还有一些细胞因子能够通过不同的信号机制,共同促进卫星细胞的激活和增殖,从而影响肌肉的生长和修复过程。 2.2.3 细胞因子和卫星细胞的增殖与分化 细胞因子对卫星细胞的增殖和分化具有双重影响。一方面,细胞因子如白细胞介素6通过激活JAK/STAT通路和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,对卫星细胞的增殖和分化起到重要作用。对于JAK/STAT通路,白细胞介素6首先与其受体结合,激活JAK酶,进而激活STAT蛋白,使STAT蛋白发生磷酸化,随后进入细胞核,促进目标基因的表达,从而影响卫星细胞的增殖与分化[21]。此外,白细胞介素6还能通过激活MAPK 信号通路,进而影响卫星细胞的功能[26]。这些机制表明,细胞在肌肉再生和炎症反应中具有双重作用,既能促进卫星细胞的增殖,亦参与细胞的分化过程。 另一方面,细胞因子还在卫星细胞的分化过程中起负调节作用,来维持卫星细胞的未分化状态并防止过早的分化[27]。例如,在组织损伤和修复过程中转化生长因子β1的表达上调,进而影响到卫星细胞的分化[17]。转化生长因子β超家族成员(包括骨形态发生蛋白和肌生成素)对细胞分化具有不同的影响[17]。研究表明,运动对卫星细胞的增殖和分化具有促进作用[28-29]。 此外,其他细胞因子和卫星细胞的增殖和分化也密切相关。例如,白细胞介素4和白细胞介素6作为炎症调节因子,能够促进肌肉卫星细胞的增殖和分化,加速损伤后肌肉的修复过程[24]。肌肉生长抑制素在肌肉发育中具有抑制作用,其抑制剂(如鸢尾素)则能够通过激活肌肉卫星细胞促进肌肉生长和修复[30]。胰岛素样生长因子1作为生长因子,不仅直接促进肌肉细胞增殖和分化,还间接通过激活卫星细胞来增强骨骼肌修复能力[31]。肿瘤坏死因子α和干扰素γ作为炎症相关因子,在炎症和损伤后能够调控卫星细胞的活化和增殖,从而参与骨骼肌修复的调节过程[20]。 综上所述,细胞因子在卫星细胞的增殖和分化过程中具有双重作用。一方面,细胞因子可以促进卫星细胞的增殖和分化,参与骨骼肌损伤后的修复过程;另一方面,细胞因子对卫星细胞的分化起到负调节作用,能维持卫星细胞的未分化状态。细胞因子还能够改善卫星细胞的功能,加速骨骼肌损伤后的修复。 2.3 运动通过诱导细胞因子调控卫星细胞促进骨骼肌再生 2.3.1 运动通过细胞因子调控卫星细胞的基本机制 运动对促进卫星细胞增殖和分化具有积极作用,进而促进骨骼肌再生[28]。研究表明,运动通过促进卫星细胞的增殖和分化,改善肌肉纤维的损伤,这一过程和细胞因子密切相关[32-33]。此外,运动会显著增加肌肉细胞的代谢活动,促进细胞因子如白细胞介素6的分泌,这些细胞因子不仅在肌肉组织中发挥作用,还可以通过血液传递到其他组织,进而影响全身骨骼肌的修复[34-35]。 2.3.2 运动调控不同细胞因子影响卫星细胞 运动通过调节白细胞介素(如白细胞介素4和白细胞介素6)以及其他细胞因子(如肌肉生长抑制素和鸢尾素),来影响骨骼肌的功能和修复过程。白细胞介素4和白细胞介素6在肌肉修复和再生中扮演重要角色,特别是白细胞介素6通过促进卫星细胞的激活和参与细胞信号传递途径,直接影响肌肉肥大。肌肉生长抑制素则通过信号传导途径影响肌肉的生长和萎缩,表现出运动调节的时间依赖性。鸢尾素能够增强肌肉功能并减少跌倒风险,与卫星细胞的激活和蛋白质合成密切相关。此外,免疫细胞因子如白细胞介素6和M2型巨噬细胞在运动后的肌肉适应和修复中也发挥关键作用。有关运动调控不同细胞因子对卫星细胞作用的具体机制,见图4。"
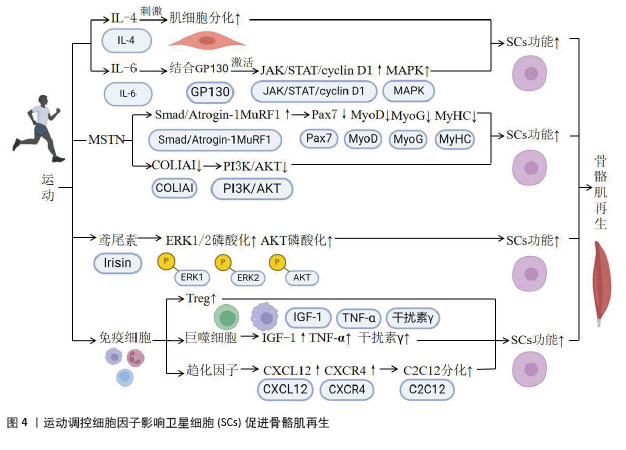

(1)运动调控白细胞介素调控卫星细胞:白细胞介素参与机体的免疫反应和炎症反应,调节免疫系统中的细胞通讯和细胞行为[36]。骨骼肌能够分泌白细胞介素4、白细胞介素6、白细胞介素7、白细胞介素8、白细胞介素13和白细胞介素15[37]。研究表明,运动能够上调骨骼肌中白细胞介素2和白细胞介素4表达水平[24]。白细胞介素4和白细胞介素6对骨骼肌的恢复具有至关重要的作用,并与卫星细胞密切相关。例如,DE MIGUEL等[38]对C26结肠癌小鼠注射白细胞介素4后发现,小鼠的肌肉质量得以恢复,同时伴随着卫星细胞的增殖和分化。研究发现,白细胞介素4还可以直接刺激C2C12细胞的分化[30]。上述结果说明,运动可能调控白细胞介素4水平,进而调控卫星细胞的增殖和分化来实现骨骼肌的修复。此外,肌细胞能够分泌白细胞介素6,且研究证实了运动能够调控白细胞介素6。一项研究发现,高强度间歇训练能显著增加骨骼肌中的白细胞介素6水平[39]。然而,HADDAD等[40]发现,注射白细胞介素6会导致大鼠肌肉萎缩,主要表现为肌原纤维蛋白的丢失,这表明白细胞介素6在肌肉代谢和功能中具有复杂的作用,可能导致骨骼肌的萎缩。此外,白细胞介素6可以促进卫星细胞的激活,且敲除白细胞介素6将会降低卫星细胞促进肌肉增长的能力[24]。研究还发现,白细胞介素6能够与细胞膜受体糖蛋白130结合,并引发JAK/STAT/细胞周期蛋白D1和MAPK信号通路的激活[41]。白细胞介素6缺失会减弱由超负荷引起的肌肉肥大[33]。上述结果共同表明,运动能够通过调节白细胞介素4和白细胞介素6影响卫星细胞的功能,进而促进骨骼肌修复。 此外,运动还可能通过诱导白细胞介素8、白细胞介素10和白细胞介素15影响卫星细胞功能,进而促进骨骼肌修复。研究表明,马拉松运动能够诱导白细胞介素8、白细胞介素10和白细胞介素15的释放,并在这一过程中发现卫星细胞被激活[42]。然而,这些白细胞介素在运动条件下对卫星细胞增殖和分化的作用仍然未知。因此,未来研究还应着重于探讨其他白细胞介素在运动调节卫星细胞中的具体机制和功能。 综上所述,运动能够通过调节白细胞介素4和白细胞介素6来影响骨骼肌功能,并且与卫星细胞密切相关。白细胞介素4能直接刺激肌细胞分化,在肌肉再生中起到关键作用。白细胞介素6在肌肉修复和重建过程中同样发挥重要作用,但其在不同运动条件下的具体作用机制尚不明确。此外,一些其他白细胞介素如白细胞介素8、白细胞介素10和白细胞介素15在运动状态下也会释放,但对卫星细胞增殖和分化的影响仍不清楚。有关运动对骨骼肌中白细胞介素调控的研究见表2。"


(2)运动调控肌肉生长抑制素影响卫星细胞:肌肉生长抑制素又称生长分化因子8(GDF-8),是转化生长因子β超家族的一员,与骨骼肌的生长呈现负相关关系[43]。 运动可以影响骨骼肌中的肌肉生长抑制素水平。研究显示,急性运动会导致人体血清中肌肉生长抑制素浓度的升高[44]。另一项研究表明,抗阻训练后24 h内血清中肌肉生长抑制素的浓度下降,可能是由于血样采集时间的不同所致[45]。这表明,运动能够调控肌肉生长抑制素水平,且运动对肌肉生长抑制素的影响存在时间依赖性。然而,目前尚不清楚不同类型和强度的运动如何精确调节肌肉生长抑制素的动态变化,因此未来的研究需要重点探讨不同运动模式对肌肉生长抑制素调节机制的影响。 运动能够通过调控肌肉生长抑制素来改善骨骼肌萎缩,对骨骼肌修复起到重要作用。研究显示,抗阻训练可以有效抑制肌肉生长抑制素的表达,从而减轻骨骼肌萎缩的程度[28]。此外,白学成[46]研究发现,抗阻训练通过抑制肌肉生长抑制素及其信号转导通路中的Smad同源物3和肌肉萎缩F-盒蛋白1,显著改善骨骼肌的状态。此外,其他研究也指出,离心耐力运动通过调节肌肉生长抑制素、p-Smad3和肌肉萎缩F-盒蛋白1的表达,有效抑制了糖尿病引起的肌肉萎缩[47]。然而,不同类型的骨骼肌对运动调节肌肉生长抑制素的反应可能存在差异,例如,跑台运动对大鼠腓肠肌的肌肉生长抑制素表达有显著抑制作用,而对比目鱼肌则影响较小[48]。这表明,运动可能在肌肉纤维类型上具有特异性作用。此外,肌肉生长抑制素在基因层面的突变或敲除,已被证实能导致肌肉肥大[49-50]。肌肉生长抑制素通过激活Smad/Atrogin1/MuRF1信号通路,抑制肌源性基因的转录,从而诱导肌肉萎缩信号的产生[51]。上述结果表明,运动能够通过调控肌肉生长抑制素改善肌肉萎缩,促进肌肉修复。 肌肉生长抑制素对骨骼肌萎缩的影响可能和卫星细胞密切相关。例如,一项研究发现,敲低肌肉生长抑制素基因会减少卫星细胞的增殖[52]。还有研究表明,敲低肌肉生长抑制素会促进牛卫星细胞的增殖和肌源性分化[53]。这表明,肌肉生长抑制素在不同物种中对卫星细胞的作用可能存在差异。因此,未来研究应着重于揭示肌肉生长抑制素在不同物种和不同细胞环境中的具体机制。而在分子水平上,肌肉生长抑制素与Ⅰ型胶原α1等细胞外基质相关蛋白相互作用,以抑制卫星细胞的黏附、磷脂酰肌醇3激酶/蛋白激酶B (phosphatidyqinositol‐3 kinase/protein kinase B,PI3K/Akt)通路和核糖体通路[42]。此外,肌肉生长抑制素已被鉴定为卫星细胞卸载的主要效应物。研究表明,微重力会诱导卫星细胞中肌肉生长抑制素的表达,而使用抗肌肉生长抑制素抗体可保持卫星细胞的存活和分化[54]。 上述研究说明,肌肉生长抑制素可能通过影响卫星细胞功能,进而改善骨骼肌萎缩。然而,目前尚不清楚肌肉生长抑制素在不同生理和病理条件下的调节机制,因此未来的研究应重点关注这些方向,特别是在运动和微重力环境中的作用。 总的来说,运动可能通过调控肌肉生长抑制素,进而影响卫星细胞功能,以促进骨骼肌修复和再生。急性运动可增加血清中肌肉生长抑制素的浓度,但抗阻训练后其浓度可能下降,显示出运动对其调节的时间依赖性。肌肉生长抑制素通过激活特定信号通路阻断肌源性基因的转录,对卫星细胞增殖和分化起关键作用。肌肉生长抑制素在不同物种和细胞环境下的作用存在差异,未来研究应深入探究肌肉生长抑制素与卫星细胞功能之间的关联。运动调控骨骼肌中肌肉生长抑制素的相关研究见表3。"


(3)运动调控骨骼肌鸢尾素影响卫星细胞:运动可能通过调控鸢尾素,进而影响卫星细胞功能,以促进骨骼肌修复和再生。鸢尾素是一种由含纤连蛋白Ⅲ型结构域蛋白5切割产生的激素,包含长达112个氨基酸[55]。鸢尾素最初主要由骨骼肌分泌,被定义为肌细胞因子。然而,研究表明,除了骨骼肌外,脂肪组织和肝脏也能分泌少量的鸢尾素[56-57]。 研究表明,运动能显著促进鸢尾素的分泌[58-59]。其中,LIU等[60]综述中提到,不同类型的运动训练均能够诱导骨骼肌向血液中释放鸢尾素。此外,郭延云等[61]的研究表明,运动能够提高肥胖大鼠的血清鸢尾素水平。但急性运动则能瞬间增加骨骼肌中的鸢尾素水平[48]。然而,左崇文[62]的研究表明,无论是功能性训练还是传统抗阻训练,均能显著调节血清AMP激活的蛋白激酶、过氧化物酶体增殖物激活受体γ共激活因子1α和鸢尾素的表达,这说明运动和鸢尾素的关系不受运动类型和强度差异的影响。此外,鸢尾素还具有促肌生成因子的功能。一项研究纳入了138例受试者,发现血清鸢尾素浓度与握力强度及低跌倒风险呈正相关[63],这说明鸢尾素在增强肌肉功能和减少跌倒风险方面具有重要作用。此外,鸢尾素可以作为肌生成的预测因子。例如,ROTTER等[64]发现,鸢尾素能在人体原代成肌细胞中诱导肌肉生成,在小鼠实验中促进肌肉肥大和再生,同时提升握力水平。上述研究均表明,运动对鸢尾素的表达水平具有显著影响。 鸢尾素与卫星细胞密切相关,能够促进卫星细胞的激活和蛋白质合成,同时通过增加细胞外信号调节激酶1/2和AKT的磷酸化来实现这一过程,进而实现肌肉修复再生[56]。CARIATI等[54]发现,鸢尾素能够缓解由于去神经或卸载引起的肌肉萎缩,这表明鸢尾素可能通过影响卫星细胞的激活和蛋白质合成以及相关信号传导实现骨骼肌再生。然而,目前尚不清楚鸢尾素在人类骨骼肌中的具体作用及其激活卫星细胞的机制。因此,未来的研究应当重点探索鸢尾素在人体内的具体作用及分子机制,以支持其在治疗肌肉疾病中的应用。 总体而言,运动可能通过调控鸢尾素,影响卫星细胞的激活和蛋白质合成以及相关信号传导实现骨骼肌再生,但尚不清楚鸢尾素在人类骨骼肌中的具体作用及其激活卫星细胞的机制。 运动调控骨骼肌中鸢尾素的相关研究见表4。"


2.4 运动调控免疫细胞因子影响卫星细胞 运动可能通过调控免疫细胞因子影响卫星细胞功能,进而实现骨骼肌再生。免疫细胞在运动过程中对肌肉组织的作用至关重要。运动能够促使肌肉释放白细胞介素6,增加骨骼肌中调节性T细胞的数量,然而,调节性T细胞的消耗可能会抑制肌肉特异性基因表达,例如己糖激酶2、线粒体肌酸激酶2和肉毒碱棕榈酰基转移酶1B[65]。因此,免疫细胞在运动诱导的肌肉适应中发挥着重要作用。 运动能够调控免疫细胞因子。研究指出,离心运动能够动态改变大鼠骨骼肌中巨噬细胞的表型[66]。此外,持续性运动训练(循环踏车)可以增加人类骨骼肌中M2型巨噬细胞的数量,这种现象与纤维肥大和卫星细胞丰度增加呈正相关[67]。这些研究结果表明,巨噬细胞在运动诱导的肌肉适应中发挥了重要作用,可能通过调节细胞因子实现这一调节功能。此外,在免疫细胞中,巨噬细胞主要通过释放细胞因子来调节肌肉适应。例如,巨噬细胞释放基质金属蛋白酶,通过抑制Notch信号传导诱导卫星细胞激活[68]。巨噬细胞还释放细胞因子如胰岛素样生长因子1、肿瘤坏死因子α、白细胞介素1β和干扰素γ[69],但尚不清楚这些由巨噬细胞释放的细胞因子是否有助于运动诱导的肌肉适应。此外,趋化因子家族是一类免疫细胞因子,包括约50种内源性趋化因子配体,通过控制细胞迁移和定位,在造血和免疫细胞稳态中发挥关键作用,也调节骨骼肌的再生修复[70]。 免疫细胞因子对骨骼肌再生修复具有一定作用,并和卫星细胞密切相关。其中,趋化因子在卫星细胞功能中发挥着关键作用。例如,巨噬细胞分泌的趋化因子配体10能够通过CXC趋化因子受体3诱导卫星细胞的增殖[71]。此外,巨噬细胞还通过分泌Nampt,通过C-C基序趋化因子受体5促进卫星细胞的增殖[72]。因此,运动可能通过对免疫细胞因子调控进而促进骨骼肌再生中卫星细胞的增殖。许多趋化因子(如趋化因子C-X-C基元配体1, 5,12和趋化因子C-C基元配体1,2,7)及其受体已在原发性肌细胞中得到确认表达[73-74]。研究表明,进行4周的跑步运动会导致肌肉中趋化因子配体12和趋化因子受体4的表达增加,并且趋化因子配体12-趋化因子受体4轴能够促进肌细胞的分化[75]。此外,研究表明,身体活跃的人在运动后会显示出更为广泛的趋化因子诱导效应,这一现象无论年龄大小都适用,但长期运动对与年龄相关的趋化因子变化的影响相对较小[76]。这些研究表明,趋化因子在对抗运动诱导的肌肉维持中具有潜在的作用。然而,尚不清楚这些趋化因子在不同类型的运动(如有氧运动和负重训练)中的表达模式是否相同,以及在肌肉损伤和康复过程中的动态变化。 综上,运动可能通过调控免疫细胞因子影响卫星细胞功能,进而实现骨骼肌再生。运动可促使肌肉释放白细胞介素6等肌肽,增加骨骼肌中调节性T细胞的数量。然而,调节性T细胞的过度消耗可能会阻碍运动适应,例如调节肌肉特异性基因表达。此外,运动改变肌肉中巨噬细胞的表型,增加M2型巨噬细胞的数量,可能与肌肉纤维肥大和卫星细胞丰度增加相关。趋化因子家族受运动影响,并可能在卫星细胞促进肌肉损伤和康复过程中发挥作用,但需要更深入的研究来阐明其在不同类型运动和肌肉状态下的动态变化及作用机制。 运动调控骨骼肌中免疫细胞及其因子的相关研究见表5。"

| [1] AHMAD K, SHAIKH S, CHUN HJ, et al. Extracellular matrix: the critical contributor to skeletal muscle regeneration-a comprehensive review. Inflamm Regen. 2023;43(1):58. [2] 孔健达,穆玉晶,朱磊,等.骨骼肌再生过程中卫星细胞调控机制及其生态位信号的作用[J].中国组织工程研究,2024, 28(7):1105-1111. [3] CARECCIA G, MANGIAVINI L, CIRILLO F. Regulation of Satellite Cells Functions during Skeletal Muscle Regeneration: A Critical Step in Physiological and Pathological Conditions. Int J Mol Sci. 2023;25(1):512. [4] SNIJDERS T, NEDERVEEN JP, MCKAY BR, et al. Satellite cells in human skeletal muscle plasticity. Front Physiol. 2015;6:283. [5] KACZMAREK A, KACZMAREK M, CIAŁOWICZ M, et al. The Role of Satellite Cells in Skeletal Muscle Regeneration-The Effect of Exercise and Age. Biology (Basel). 2021;10(10):1056. [6] ALVES J, MAGALHÃES R, MACHADO A, et al. Non-pharmacological cognitive intervention for aging and dementia: Current perspectives. World J Clin Cases. 2013;1(8):233-241. [7] 解瑛傲,孔健达,陈芸,等.骨骼肌中卫星细胞衰老生物学机制及潜在的应对策略[J].中国组织工程研究,2024, 28(25):4094-4100. [8] DUMONT NA, WANG YX, RUDNICKI MA. Intrinsic and extrinsic mechanisms regulating satellite cell function. Development. 2015;142(9):1572-1581. [9] RODRIGUEZ-OUTEIRIÑO L, HERNANDEZ-TORRES F, RAMÍREZ-DE ACUÑA F, et al. Muscle Satellite Cell Heterogeneity: Does Embryonic Origin Matter? Front Cell Dev Biol. 2021;9:750534. [10] GUGLIUZZA MV, CRIST C. Muscle stem cell adaptations to cellular and environmental stress. Skelet Muscle. 2022;12(1):5. [11] HEKMATNEJAD B, RUDNICKI MA. Transplantation to study satellite cell heterogeneity in skeletal muscle. Front Cell Dev Biol. 2022;10:902225. [12] ARPKE RW, SHAMS AS, COLLINS BC, et al. Preservation of satellite cell number and regenerative potential with age reveals locomotory muscle bias. Skelet Muscle. 2021;11(1):22. [13] KOIKE H, MANABE I, OISHI Y. Mechanisms of cooperative cell-cell interactions in skeletal muscle regeneration. Inflamm Regen. 2022; 42(1):48. [14] LAUMONIER T, MENETREY J. Muscle injuries and strategies for improving their repair. J Exp Orthop. 2016;3(1):15. [15] DILWORTH FJ, BLAIS A. Epigenetic regulation of satellite cell activation during muscle regeneration. Stem Cell Res Ther. 2011;2(2):18. [16] ZAMMIT PS, GOLDING JP, NAGATA Y, et al. Muscle satellite cells adopt divergent fates: a mechanism for self-renewal? J Cell Biol. 2004;166(3):347-357. [17] CHEN YF, LEE CW, WU HH, et al. Immunometabolism of macrophages regulates skeletal muscle regeneration. Front Cell Dev Biol. 2022;10: 948819. [18] SONG T, SADAYAPPAN S. Featured characteristics and pivotal roles of satellite cells in skeletal muscle regeneration. J Muscle Res Cell Motil. 2020;41(4):341-353. [19] WITT R, WEIGAND A, BOOS AM, et al. Mesenchymal stem cells and myoblast differentiation under HGF and IGF-1 stimulation for 3D skeletal muscle tissue engineering. BMC Cell Biol. 2017;18(1):15. [20] MARSHALL E, COSTA LM, GUTIERREZ-MARCOS J. Cysteine-rich peptides (CRPs) mediate diverse aspects of cell-cell communication in plant reproduction and development. J Exp Bot. 2011;62(5):1677-1686. [21] XIAO T, YAN Z, XIAO S, et al. Proinflammatory cytokines regulate epidermal stem cells in wound epithelialization. Stem Cell Res Ther. 2020;11(1):232. [22] MORRONI J, BENEDETTI A, ESPOSITO L, et al. Injury-experienced satellite cells retain long-term enhanced regenerative capacity. Stem Cell Res Ther. 2023;14(1):246. [23] JOHNSON AL, KAMAL M, PARISE G. The Role of Supporting Cell Populations in Satellite Cell Mediated Muscle Repair. Cells. 2023; 12(15):1968. [24] BELIZÁRIO JE, FONTES-OLIVEIRA CC, BORGES JP, et al. Skeletal muscle wasting and renewal: a pivotal role of myokine IL-6. Springerplus. 2016;5:619. [25] ISESELE PO, MAZURAK VC. Regulation of Skeletal Muscle Satellite Cell Differentiation by Omega-3 Polyunsaturated Fatty Acids: A Critical Review. Front Physiol. 2021;12: 682091. [26] KAGAN P, SULTAN M, TACHLYTSKI I, et al. Both MAPK and STAT3 signal transduction pathways are necessary for IL-6-dependent hepatic stellate cells activation. PLoS One. 2017;12(5):e0176173. [27] BURKS TN, COHN RD. Role of TGF-β signaling in inherited and acquired myopathies. Skelet Muscle. 2011;1(1):19. [28] 孔健达,解瑛傲,陈世娟,等.血流限制训练干预老年肌少症:生物学机制和应用方案建议[J].中国组织工程研究, 2024,28(23): 3743-3750. [29] 王震,蔺海旗,何霏,等.运动激活骨骼肌卫星细胞:增龄性肌衰减症及肌肉损伤修复的运动预防和治疗[J].中国组织工程研究,2021,25(23):3752-3759. [30] CHEN B, SHAN T. The role of satellite and other functional cell types in muscle repair and regeneration. J Muscle Res Cell Motil. 2019;40(1): 1-8. [31] SHAMIM B, HAWLEY JA, CAMERA DM. Protein Availability and Satellite Cell Dynamics in Skeletal Muscle. Sports Med. 2018;48(6):1329-1343. [32] MASSCHELEIN E, D’HULST G, ZVICK J, et al. Exercise promotes satellite cell contribution to myofibers in a load-dependent manner. Skelet Muscle. 2020;10(1):21. [33] HAWKE TJ. Expanding Roles for Muscle Satellite Cells in Exercise-Induced Hypertrophy. Function (Oxf). 2020;2(1):zqaa040. [34] SUZUKI K. Cytokine response to exercise and its modulation. Antioxidants. 2018;7(1):17. [35] DOCHERTY S, HARLEY R, MCAULEY JJ, et al. The effect of exercise on cytokines: implications for musculoskeletal health: a narrative review. BMC Sports Sci Med Rehabil. 2022;14(1):5. [36] VARLJEN T, SEKULOVIC G, RAKIC O, et al. Genetic variant rs16944 in IL1B gene is a risk factor for early-onset sepsis susceptibility and outcome in preterm infants. Inflamm Res. 2020;69(2):155-157. [37] ROSA NETO JC, LIRA FS, ZANCHI NE, et al. Acute exhaustive exercise regulates IL-2, IL-4 and MyoD in skeletal muscle but not adipose tissue in rats. Lipids Health Dis. 2011;10:97. [38] DE MIGUEL Z, KHOURY N, BETLEY MJ, et al. Exercise plasma boosts memory and dampens brain inflammation via clusterin. Nature. 2021;600(7889):494-499. [39] 孙磊,李方晖.高强度间歇训练对老龄大鼠骨骼肌减少症及某些氧化应激、脂肪细胞因子和炎症因子的影响[J].中国运动医学杂志,2019,38(8):691-699. [40] HADDAD F, ZALDIVAR F, COOPER DM, et al. IL-6-induced skeletal muscle atrophy. J Appl Physiol (1985). 2005;98(3): 911-917. [41] TIERNEY MT, AYDOGDU T, SALA D, et al. STAT3 signaling controls satellite cell expansion and skeletal muscle repair. Nat Med. 2014;20(10):1182-1186. [42] DE SOUSA CAZ, SIERRA APR, MARTÍNEZ GALÁN BS, et al. Time Course and Role of Exercise-Induced Cytokines in Muscle Damage and Repair After a Marathon Race. Front Physiol. 2021;12:752144. [43] LIN W, SONG H, SHEN J, et al. Functional role of skeletal muscle-derived interleukin-6 and its effects on lipid metabolism. Front Physiol. 2023;14:1110926. [44] PIOTROWICZ Z, CZUBA M, CHALIMONIUK M, et al. The Impact of Acute Mild Normobaric Hypoxia and a Single Bout of Exercise to Volitional Exhaustion on Cognitive Performance in Endurance and Strength-Trained Athletes: The role of BDNF, EP-1, Catecholamines and Lactate. J Hum Kinet. 2023;87:77-93. [45] KABAK B, BELVIRANLI M, OKUDAN N. Irisin and myostatin responses to acute high-intensity interval exercise in humans. Horm Mol Biol Clin Investig. 2018;35(3):20180008. [46] 白学成.抗阻训练缓解低氧诱导的骨骼肌萎缩及对Myostatin/Smad3信号转导通路的影响[D].北京:北京体育大学,2022. [47] 王继,周越,张荷,等.Myostatin信号通路在4周离心耐力运动改善2型糖尿病大鼠骨骼肌萎缩中的作用[J].中国应用生理学杂志,2018,34(3):223-228+282+292. [48] 张靓,刘小园,杨洪涛.跑台运动对比目鱼肌和腓肠肌肌肉生长抑制素表达的影响[J].沈阳体育学院学报,2012,31(5): 73-75+88. [49] WILLIAMS MS. Myostatin mutation associated with gross muscle hypertrophy in a child. N Engl J Med. 2004;351(10):1030-1031. [50] LI W, ZHU Z, HE K, et al. Primary cilia in satellite cells are the mechanical sensors for muscle hypertrophy. Proc Natl Acad Sci U S A. 2022;119(24):e2103615119. [51] SNIJDERS T, VERDIJK LB, VAN LOON LJ. The impact of sarcopenia and exercise training on skeletal muscle satellite cells. Ageing Res Rev. 2009;8(4):328-338. [52] ORAL O. Nitric oxide and its role in exercise physiology. J Sports Med Phys Fitness. 2021;61(9):1208-1211. [53] ABREU P, KOWALTOWSKI AJ. Satellite cell self-renewal in endurance exercise is mediated by inhibition of mitochondrial oxygen consumption. J Cachexia Sarcopenia Muscle. 2020;11(6):1661-1676. [54] CARIATI I, SCIMECA M, BONANNI R, et al. Role of Myostatin in Muscle Degeneration by Random Positioning Machine Exposure: An in vitro Study for the Treatment of Sarcopenia. Front Physiol. 2022;13:782000. [55] 张嫆嫆,司芹芹.鸢尾素在肌肉减少症中的作用[J].生命的化学,2024,44(5): 837-843. [56] DEWI L, LIN YC, NICHOLLS A, et al. Pax7+ Satellite Cells in Human Skeletal Muscle After Exercise: A Systematic Review and Meta-analysis. Sports Med. 2023;53(2): 457-480. [57] ALMADA AE, WAGERS AJ. Molecular circuitry of stem cell fate in skeletal muscle regeneration, ageing and disease. Nat Rev Mol Cell Biol. 2016;17(5):267-279. [58] HUGHES DC, ELLEFSEN S, BAAR K. Adaptations to Endurance and Strength Training. Cold Spring Harb Perspect Med. 2018;8(6):a029769. [59] 于涛,李鹏飞,房国梁,等.大鼠一次性下坡跑运动后FNDC5和Irisin水平变化特点[J].中国运动医学杂志,2016,35(10): 908-912. [60] LIU C, CHU D, KALANTAR-ZADEH K, et al. Cytokines: From Clinical Significance to Quantification. Adv Sci (Weinh). 2021; 8(15):e2004433. [61] 郭延云,霍琴琴,寿盼盼,等.运动对肥胖大鼠肌因子Irisin及骨骼肌AMPK的影响[J].安徽医科大学学报,2017,52(12): 1778-1782. [62] 左崇文.功能性和传统抗阻训练对男大学生肌肉适能和血清AMPK/PGC-1α/Irisin通路的影响[D].北京:首都体育学院,2024. [63] WEI W, RILEY NM, LYU X, et al. Organism-wide, cell-type-specific secretome mapping of exercise training in mice. Cell Metab. 2023;35(7):1261-1279.e11. [64] ROTTER R, MENSHYKOVA M, WINKLER T, et al. Erythropoietin improves functional and histological recovery of traumatized skeletal muscle tissue. J Orthop Res. 2008; 26(12):1618-1626. [65] BECKER M, JOSEPH SS, GARCIA-CARRIZO F, et al. Regulatory T cells require IL6 receptor alpha signaling to control skeletal muscle function and regeneration. Cell Metab. 2023;35(10):1736-1751.e7. [66] ZUO Q, WANG SC, YU XK, et al. Response of macrophages in rat skeletal muscle after eccentric exercise. Chin J Traumatol. 2018;21(2):88-95. [67] WALTON RG, KOSMAC K, MULA J, et al. Human skeletal muscle macrophages increase following cycle training and are associated with adaptations that may facilitate growth. Sci Rep. 2019;9(1):969. [68] NARKAR VA, DOWNES M, YU RT, et al. AMPK and PPARdelta agonists are exercise mimetics. Cell. 2008;134(3):405-415. [69] MOSSER DM, EDWARDS JP. Exploring the full spectrum of macrophage activation. Nat Rev Immunol. 2008;8(12):958-969. [70] SOKOL CL, LUSTER AD. The chemokine system in innate immunity. Cold Spring Harb Perspect Biol. 2015;7(5):a016303. [71] ZHANG C, CHENG N, QIAO B, et al. Age-related decline of interferon-gamma responses in macrophage impairs satellite cell proliferation and regeneration. J Cachexia Sarcopenia Muscle. 2020;11(5): 1291-1305. [72] RATNAYAKE D, NGUYEN PD, ROSSELLO FJ, et al. Macrophages provide a transient muscle stem cell niche via NAMPT secretion. Nature. 2021;591(7849):281-287. [73] GRIFFIN CA, APPONI LH, LONG KK, et al. Chemokine expression and control of muscle cell migration during myogenesis. J Cell Sci. 2010;123(Pt 18):3052-3060. [74] LUTHER SA, BIDGOL A, HARGREAVES DC, et al. Differing activities of homeostatic chemokines CCL19, CCL21, and CXCL12 in lymphocyte and dendritic cell recruitment and lymphoid neogenesis. J Immunol. 2002; 169(1):424-433. [75] PUCHERT M, ADAMS V, LINKE A, et al. Evidence for the involvement of the CXCL12 system in the adaptation of skeletal muscles to physical exercise. Cell Signal. 2016;28(9):1205-1215. [76] MACNEIL LG, TARNOPOLSKY MA, CRANE JD. Acute, Exercise-Induced Alterations in Cytokines and Chemokines in the Blood Distinguish Physically Active and Sedentary Aging. J Gerontol A Biol Sci Med Sci. 2021; 76(5):811-818. |
| [1] | Wu Yanting, Li Yu, Liao Jinfeng. Magnesium oxide nanoparticles regulate osteogenesis- and angiogenesis-related gene expressions to promote bone defect healing [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1885-1895. |
| [2] | Fu Lyupeng, Yu Peng, Liang Guoyan, Chang Yunbing. Electroactive materials applied in spinal surgery [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2113-2123. |
| [3] | Tan Jing, Li Li, Wang Liangliang, Qin Xiangyu. Bionic functional coating improves the integration of titanium implants and skin tissue interface [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 2014-2022. |
| [4] | Cai Ziming, Yu Qinghe, Ma Pengfei, Zhang Xin, Zhou Longqian, Zhang Chongyang, Lin Wenping. Heme oxygenase-1 alleviates lipopolysaccharide-induced inflammatory response in nucleus pulposus mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1624-1631. |
| [5] | He Jiale, Huang Xi, Dong Hongfei, Chen Lang, Zhong Fangyu, Li Xianhui. Acellular dermal matrix combined with adipose-derived stem cell exosomes promotes burn wound healing [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1699-1710. |
| [6] | Xia Linfeng, Wang Lu, Long Qianfa, Tang Rongwu, Luo Haodong, Tang Yi, Zhong Jun, Liu Yang. Human umbilical cord mesenchymal stem cell-derived exosomes alleviate blood-brain barrier damage in mice with septic encephalopathy [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1711-1719. |
| [7] | Cui Lianxu, Li Haomin, Xu Junrong, Tan Baodong, Lu Dahong, Peng Siwei, Wang Jinhui. Effect of umbilical cord mesenchymal stem cell conditioned medium on tissue repair after traumatic craniocerebral injury in miniature pigs [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1730-1735. |
| [8] | Pan Dong, Yang Jialing, Tian Wei, Wang Dongji, Zhu Zheng, Ma Wenchao, Liu Na, Fu Changxi. Resistance exercise activates skeletal muscle satellite cells in aged rats: role of adiponectin receptor 1 pathway [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(7): 1736-1746. |
| [9] | Li Linzhen, Jiao Hongzhuo, Chen Weinan, Zhang Mingzhe, Wang Jianlong, Zhang Juntao. Effect of icariin-containing serum on lipopolysaccharide-induced inflammatory damage in human chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1368-1374. |
| [10] | You Huijuan, Wu Shuzhen, Rong Rong, Chen Liyuan, Zhao Yuqing, Wang Qinglu, Ou Xiaowei, Yang Fengying. Macrophage autophagy in lung diseases: two-sided effects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1516-1526. |
| [11] | Peng Zhiwei, Chen Lei, Tong Lei. Luteolin promotes wound healing in diabetic mice: roles and mechanisms [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1398-1406. |
| [12] | Hou Chaowen, Li Zhaojin, Kong Jianda, Zhang Shuli. Main physiological changes in skeletal muscle aging and the multimechanism regulatory role of exercise [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1464-1475. |
| [13] | Sun Yaotian, Xu Kai, Wang Peiyun. Potential mechanisms by which exercise regulates iron metabolism in immune inflammatory diseases [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(6): 1486-1498. |
| [14] | Zhang Qian, Huang Dongfeng. Weighted gene co-expression network analysis combined with machine learning to screen and validate biomarkers for osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1096-1105. |
| [15] | Yin Yongcheng, Zhao Xiangrui, Yang Zhijie, Li Zheng, Li Fang, Ning Bin. Effect and mechanism of peroxiredoxin 1 in microglial inflammation after spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1106-1113. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||