Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (36): 7827-7838.doi: 10.12307/2025.502
Previous Articles Next Articles
Action mechanism of mesenchymal stem cell-derived exosomes carrying miRNAs in improving spinal cord injury
Guo Jia1, 2, Ren Yafeng2, Li Bing2, Huang Jing1, Shang Wenya1, Yang Yike1, Liu Huiyao1
- 1School of Rehabilitation Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; 2First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China
-
Received:2024-04-08Accepted:2024-04-24Online:2025-12-28Published:2025-03-14 -
Contact:Ren Yafeng, MD, Chief physician, Master’s supervisor, First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China -
About author:Guo Jia, Master candidate, School of Rehabilitation Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China -
Supported by:Henan Province Traditional Chinese Medicine Science Research Special Project, No. 2021JDZY022, 2022JDZY015 (to RYF); “Double First Class” Creation Engineering Traditional Chinese Medicine Discipline Project of Henan University of Chinese Medicine, No. HSRP-DFCTCM-2023-1-25 (to RYF)
CLC Number:
Cite this article
Guo Jia, Ren Yafeng, Li Bing, Huang Jing, Shang Wenya, Yang Yike, Liu Huiyao. Action mechanism of mesenchymal stem cell-derived exosomes carrying miRNAs in improving spinal cord injury[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7827-7838.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

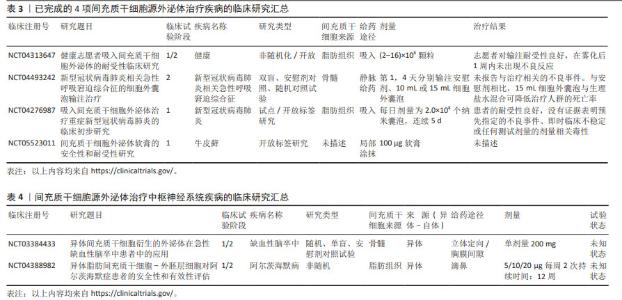
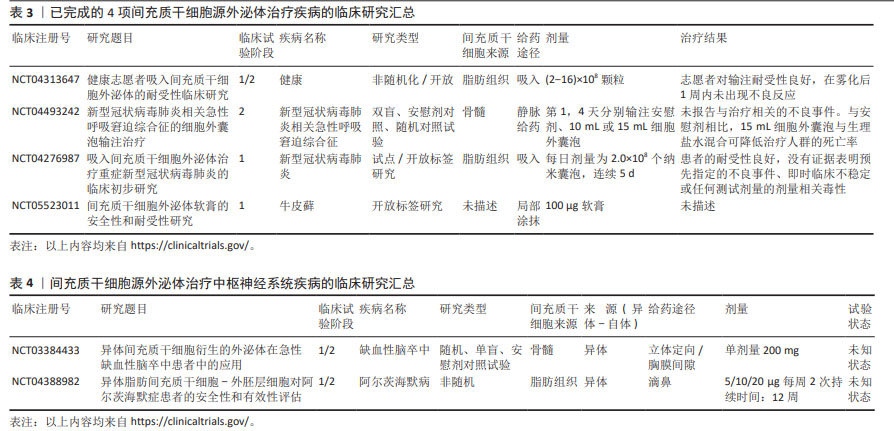
2.1 间充质干细胞-外泌体负载miRNA的特性及功能 2.1.1 外泌体的发现 长期以来,细胞外囊泡被认为是细胞排泄代谢废物的“垃圾袋”。20世纪60年代末,有研究者首次在血浆中观察到小的分泌囊泡,后来被称为“血小板尘埃”[9]。与此同时,有研究者发现了软骨细胞在骨钙化过程中分泌的基质囊泡[10]。还有研究者发现,在绵羊网状细胞成熟过程中,多囊体与质膜融合释放出含有转铁蛋白受体的囊泡,这种囊泡在20世纪80年代被称为“外泌体”[11]。然而,直到1996年有研究者发现来自B淋巴细胞的囊泡具有抗原呈递功能并参与免疫调节时,外泌体才被认为是一个重要的东西[12]。另一个重大发现发生在2007年,当时人们发现囊泡能够传输mRNA和miRNA以进行细胞内交流[13]。在2013年,诺贝尔生理学或医学奖被授予了3位科学家(James E. Rothman,Randy W. Schekman和Thomas C. Südhof),以表彰他们“发现了调节囊泡交通的机制,囊泡交通是细胞中的一个主要运输系统”。从那时起,外泌体研究便成为一大热点,研究者利用其独特生物特性在治疗疾病的过程中发挥出了巨大效力,具体时间脉络见图3。 "

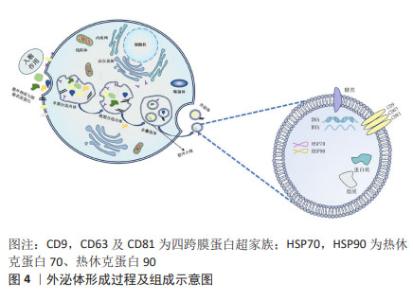
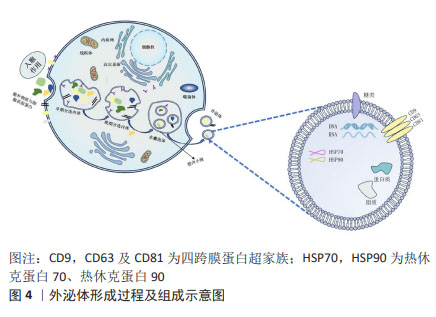
2.1.2 间充质干细胞-外泌体的形成 在间充质干细胞-外泌体的形成过程中,涉及质膜的两次内陷和含有腔内小泡的细胞内多囊泡体的形成。最初,早期分选内体是由细胞膜第一次内陷,即膜的内吞和向内发芽形成的,其中含有细胞外成分和细胞表面蛋白。然后,早期分选内体经高尔基体、内质网和线粒体成熟形成晚期分选内体,并最终通过质膜的二次内陷产生含有腔内小泡的多囊泡体。部分多囊泡体可以与溶酶体或自噬体融合以被降解,或者与质膜融合以释放被包含的腔内小泡来作为外泌体[14]。 研究发现,外泌体可通过受体配体结合、直接膜融合和内吞作用将其内容物运送到靶细胞[15],是细胞间通讯的重要介质,在生理和病理过程中发挥着重要作用。 2.1.3 间充质干细胞-外泌体的内容物及功能 间充质干细胞-外泌体包含蛋白质、脂质以及糖类和核酸等多种物质[16]。即使是来自同一个细胞,外泌体的大小和所携带的物质也各不相同;不过,在不同来源的外泌体中发现了一些部分共同的物质[17]。 外泌体中不仅有取决于分泌细胞类型的特定蛋白质,还有一个无论细胞类型如何,均存在的特定的蛋白质子集。常见蛋白有:对细胞靶向和黏附至关重要的四跨膜蛋白超家族(CD9,CD63及CD81)、具有分子伴侣特性的热休克蛋白(HSP70,HSP90)和其他相关蛋白的蛋白质,这些物质通常用于外泌体的鉴定[18]。 外泌体富含特定的脂质,主要包括神经酰胺、胆固醇和鞘脂,其有助于外泌体的形成和结构稳定性[19]。外泌体还含有表面多糖和聚糖,它们存在于其质膜上,有助于外泌体与受体细胞的对接和附着[20]。此外,外泌体携带DNA和RNA,包括mRNA和一些非编码RNA。这些RNA可调节细胞间通讯,特别是miRNA,在各种生物机制中发挥着至关重要的作用。外泌体的形成过程及组成示意图见图4。 "
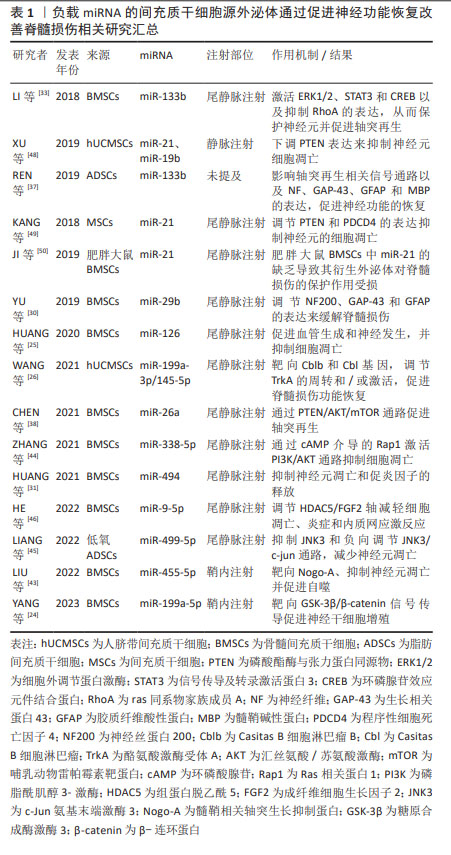
2.1.4 间充质干细胞-外泌体负载miRNA 目前,miRNA在治疗脊髓损伤方面展现出巨大潜力,但活细胞分泌量较少,体内运输的便捷性有限,从而对其治疗效果产生不利影响。因此,如何将miRNA运送到目标细胞或组织仍然是其临床应用面临的巨大挑战。 外泌体被认为是向中枢神经系统递送miRNA的理想载体,其可作为治疗脊髓损伤的理想miRNA载体的优势如下:首先,外泌体可穿过几乎98%的全身用药都无法通过的血脑屏障;其次,外泌体具有脂质双层结构,因此可以有效保护其内容物,免受酶分解或其他过程的影响;最后,作为miRNA载体的外泌体能靶向输入受体细胞。在特异性表达miRNA的细胞中,该细胞的外泌体更有可能含有该特异性miRNA,这一特性对于提取目标外泌体-miRNA和研究携带miRNA的外泌体在疾病中的作用具有积极作用[21]。 2.2 脊髓损伤的病理生理学机制 脊髓损伤的病理生理变化主要包括两个阶段:原发性损伤和继发性损伤。原发性损伤包括脊髓出血、神经细胞膜破裂以及外部牵引或压迫引起的血脑屏障破坏[22]。继发性损伤是原发性损伤后的一系列连锁反应,包括局部血流障碍、组织缺血缺氧、炎性细胞浸润和神经细胞坏死,进而引发自由基形成、谷氨酸介导的兴奋毒性和神经毒性。继发性损伤会导致脊髓损伤区域进一步扩大,更多神经细胞死亡,甚至神经纤维变形[23]。一般来说,继发性损伤比原发性损伤更严重,更难处理。因此,治疗脊髓损伤的重点应放在如何促进轴突再生、减少炎症和重塑功能性神经回路上。 2.3 间充质干细胞-外泌体所负载miRNA在治疗脊髓损伤中的作用机制 大量研究表明,间充质干细胞-外泌体装载的miRNAs可以通过多个方面来促进脊髓损伤后的恢复,现将关于负载多种miRNA的间充质干细胞-外泌体对脊髓损伤的治疗作用大致分为3类加以阐述:①促进神经功能恢复:促进神经元再生与轴突再生和抑制凋亡;②调节炎症反应:调节巨噬细胞、小胶质细胞和星形胶质细胞的表型和下调促炎因子的表达;③促进血管生成。 2.3.1 促进神经功能恢复 由间充质干细胞-外泌体所运输的miRNA对神经功能恢复的促进作用已被大量临床前实验证实,并预示着未来可能用于临床治疗中,其中包括 miR-199a-5p,miR-199a-3p/145-5p,miR-29b,miR-133b以及miR-26等多种miRNA。 促进神经元再生:在促进神经元再生方面,YANG等[24]通过建立使用神经干细胞的氧-葡萄糖剥夺/再氧合模型和大鼠主动脉夹闭模型,来探究骨髓间充质干细胞-外泌体对神经干细胞增殖的影响和其潜在机制。研究发现,骨髓间充质干细胞-外泌体可促进神经干细胞的增殖,并且这种有益作用是由骨髓间充质干细胞-外泌体直接转运成熟miR-199a-5p产生的,而后证实糖原合成酶激酶3(GSK-3β)是miR-199a-5p的直接靶标,因此,得出miR-199a-5p可通过靶向调节GSK-3β促进神经干细胞增殖。HUANG等[25]实验指出骨髓间充质干细胞-外泌体来源的miR-126增加了内源性神经干细胞的两个标记物巢蛋白(Nestin)和SRY-box转录因子2(SOX2)的表达,同时也增加了神经元细胞数量,从而促进脊髓损伤后的内源性神经发生。内源性神经发生可从神经干细胞中生成新的神经细胞类型,这对损伤后神经功能的恢复非常重要。 WANG等[26]通过研究源自人脐带间充质干细胞的miR-199a-3p/145-5p在体内和体外诱导神经元生长的潜在作用机制,发现Casitas B细胞淋巴瘤B(Cblb)是miR-199a-3p的直接靶标,Casitas B细胞淋巴瘤(Cbl)是miR-145-5p的直接靶标。在体外可通过调节神经生长因子/酪氨酸激酶受体A(TrkA)通路促进受脂多糖抑制的PC12细胞分化。在体内实验发现,外泌体-miR-199a-3p/145-5p能上调损伤部位的TrkA表达,促进脊髓损伤大鼠的运动功能。因此得出,人脐带间充质干细胞-外泌体-miR-199a-3p/145-5p可通过影响TrkA泛素化和促进神经生长因子 /TrkA信号通路,成为治疗神经元损伤的有效策略。而神经生长因子/TrkA这一信号通路在神经系统的发育和成熟过程中不可或缺。 促进神经元再生这一功能还可通过调节神经再生相关蛋白的表达来实现。神经丝蛋白200(NF200)是神经细胞和轴突的骨架结构[27]。生长相关蛋白43(GAP-43)是脊椎动物神经细胞膜上的特异性磷蛋白,被认为是突触可塑性、神经元发育和再生的标志物[28]。胶质纤维酸性蛋白是构成神经胶质细胞的主要成分的一种细胞骨架蛋白[29],这3种蛋白可以反映脊髓损伤大鼠脊髓组织中神经元再生的程度。YU等[30]在使用标准打击装置来制备脊髓损伤模型的SD大鼠中,通过尾静脉注射从miR-29b改良的大鼠胫骨和股骨骨髓间充质干细胞中获得的外泌体,结果发现,外泌体可减少胶质纤维酸性蛋白和收缩神经细胞数量,增加神经丝蛋白200和生长相关蛋白43的表达、提高神经元再生率和Basso Beattie Bresnahan(BBB)评分以及运动功能,从而促进神经元再生。此外,HUANG等[31]通过化学转染将miR-494有效地装载到外泌体中,通过尾静脉注射外泌体-miR-494发现其下调了胶质纤维酸性蛋白的表达,并促进神经纤维增加,提高大鼠BBB评分,从而促进了神经细胞的再生与行为功能的恢复。 促进轴突再生与抑制凋亡:神经元轴突在传递生物信号方面起着核心作用,但它们在损伤后无法接收和发送电子和化学信号。即使脊髓损伤患者的运动能力得到了一定程度的恢复,但损伤的轴突很少能像正常脊髓中的轴突那样重新连接,患者的运动功能也无法恢复正常[32]。因此,促进轴突再生与恢复对脊髓损伤患者的运动恢复至关重要。已有研究证实,中枢神经系统损伤后轴突不能再生的主要原因是抑制分子的存在,包括少突胶质细胞髓鞘糖蛋白、髓鞘-Nogo和髓鞘相关糖蛋白。 miR-133b在促进轴突生长方面被广泛研究。在SD大鼠动脉瘤夹闭合性脊髓损伤模型中,尾静脉注射外泌体-miR-133b后,可减少ras同系物家族成员A(RhoA)表达、神经元凋亡和病变面积,同时增加神经元再生能力、成熟神经元数量、生长相关蛋白43、神经纤维及神经元核(NeuN)等物质的表达和促进神经元生长以及后肢运动功能的恢复。因此得出,miR-133b可通过靶向抑制RhoA,促进细胞外调节蛋白激酶(extracellular signal-regulated kinase 1/2,ERK1/2)的磷酸化来进行脊髓损伤后的神经保护作用[33]。RhoA是Rho家族的成员之一,可作用于其直接下游效应物Rho相关激酶(Rho kinase,ROCK)。RhoA/ROCK信号通路在急性脊髓损伤后脊髓神经元的死亡中起着关键作用[34]。而ERK1/2的激活可保护神经元免受凋亡,并改善脊髓损伤后的功能恢复[35]。同时,研究也表明,其也可促进环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)和信号传导及转录激活蛋白3(signal tranducers andactivators of transcription 3,STAT3)的磷酸化,增强脊髓损伤后轴突的再生能力。CREB的激活足以克服髓鞘相关抑制剂,并促进体内脊髓轴突的再生[36]。而REN等[37]也利用miR-133b修饰的脂肪间充质干细胞-外泌体对脊髓损伤后神经功能的恢复作用及其机制进行探究,结果发现miR-133b修饰的脂肪间充质干细胞外泌体可通过下调RhoA、促进CREB和STAT3磷酸化以及改变神经纤维、生长相关蛋白43、胶质纤维酸性蛋白和髓鞘碱性蛋白(MBP)的表达,促进脊髓损伤大鼠轴突的恢复。上述两项实验均利用miR-133b为外泌体内容物,并且得到相似结果,但其来源不一致,为探究何种间充质干细胞为用于递送miR-133b的外泌体治疗最佳来源,可在后续实验中进一步对比探究,为基于间充质干细胞-外泌体的治疗提供新思路。 CHEN等[38]研究发现外泌体-miR-26a能够上调神经纤维和?Ⅲ微管蛋白的表达,从而促进轴突再生。磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome 10,PTEN)被认为是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路的一个重要负调控因子,它调控轴突再生、神经元存活和中枢神经系统损伤后的功能恢复。缺失或抑制PTEN可激活mTOR信号传导,从而在神经系统损伤后发挥神经保护作用[39]。在该研究中,将外泌体-miR-26a注入脊髓损伤大鼠的尾静脉,进一步探究发现其可下调PTEN的水平并激活mTOR通路。因此,过表达miR-26a的外泌体可通过PTEN/汇丝氨酸/苏氨酸激酶(AKT)/mTOR通路发挥脊髓损伤后的神经保护作用。 而神经细胞凋亡是脊髓损伤过程中另一个主要的继发性损伤机制[40]。Bcl-2相关X蛋白(Bax)和B淋巴细胞瘤-2基因(Bcl-2)是最常见的细胞凋亡标志物,分别具有促凋亡和抗凋亡作用[41]。胱天蛋白酶3(Caspase-3)是脊髓神经凋亡中最重要的半胱氨酸蛋白酶,抑制caspase 3的活性可减轻脊髓继发性损伤[42]。HUANG等[25]用来自间充质干细胞-外泌体的miR-126处理脊髓损伤大鼠模型后,发现其可抑制Bax和裂解的caspase-3的表达,增加Bcl-2的表达,同时显著减少脊髓中TUNEL阳性细胞的数量,因此表明其具有抗脊髓损伤后细胞凋亡的作用。LIU等[43]发现,鞘内注射经miR-455-5p慢病毒载体转染的骨髓间充质干细胞-外泌体能显著减少模型大鼠脊髓神经元的凋亡,阻断caspase3的裂解。同时也下调了其靶基因髓鞘相关轴突生长抑制蛋白(Nogo-A),从而抑制神经元凋亡来促进神经保护。然而,关于骨髓间充质干细胞-外泌体-miR-455-5p/Nogo-A轴在脊髓缺血再灌损伤中的作用还有待进一步深入细致的研究。 ZHANG等[44]在大鼠脊髓挫伤模型中发现,过表达miR-338-5p的外泌体能显著提高神经丝蛋白M(NF-M)和生长相关蛋白43的表达水平,降低髓鞘相关糖蛋白和胶质纤维酸性蛋白的表达水平,从而提供神经保护作用。在体外研究中,过表达外泌体-miR-338-5p抑制了PC12细胞在过氧化氢诱导的氧化应激损伤后的细胞凋亡。进一步研究得出,miR-338-5p可下调其靶标大麻素受体1基因(Cnr1)的表达,来激活Ras相关蛋白1(Rap1),增加环磷酸腺苷(cAMP)的积累,随后激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸/AKT通路,从而抑制细胞凋亡,提高神经元存活率。 为模拟脊髓损伤后的缺氧环境,LIANG等[45]在体外建立了神经元氧-葡萄糖剥夺和再灌注模型,观察到低氧条件下的外泌体能显著减少神经元的凋亡;同时,向脊髓损伤大鼠的尾静脉注射缺氧处理的外泌体,发现其能显著改善后肢功能的恢复,并减少受损部位空洞的形成。利用miRNA序列分析及一系列实验确定miR-499-5p在其中发挥了作用,随后利用一系列生物信息学分析工具确定miR-499-5p的靶基因c-Jun氨基末端激酶3(JNK3),从而提出miR-499-5p通过靶向抑制JNK3来负调控JNK3/c-jun凋亡信号通路,来调控神经元凋亡。值得一提的是,此项研究中透射电子显微镜和纳米颗粒跟踪分析技术结果显示,外泌体和低氧外泌体在大小、形状和电子密度方面没有形态学差异。此外,脂肪间充质干细胞分泌的外泌体颗粒数量也无显著差异,这表明缺氧环境主要是通过改变外泌体的组成而不是增加外泌体的分泌来产生不同的效应。并且,这项实验也并不能排除其他基因单独或与低氧外泌体联合发挥治疗作用的可能性,因为在低氧预处理过程中,有多种miRNA含量均上调,有可能是多种miRNA一齐发挥了作用。 HE等[46]探讨了骨髓间充质干细胞-外泌体-miR-9-5p对脂多糖诱导的PC12细胞凋亡、炎症和内质网应激的影响及调控机制,并进一步研究其对脊髓损伤大鼠的影响。在体外实验中发现,外泌体中miR-9-5p的表达增加,并且抑制了细胞凋亡以及炎症细胞因子和内质网应激标志蛋白的水平。在脊髓损伤大鼠模型中,发现miR-9-5p治疗缓解了脊髓损伤大鼠的运动能力、组织病理学损伤、神经元凋亡。并且,进一步研究确定组蛋白脱乙酰5(Histone deacetylase 5,HDAC5)是miR-9-5p的靶基因。而PC12细胞中成纤维细胞生长因子2的表达受HDAC5介导的去乙酰化调控。因此,骨髓间充质干细胞-外泌体-miR-9-5p通过抑制HDAC5介导的去乙酰化来促进成纤维细胞生长因子2的表达,从而抑制脂多糖诱导的PC12细胞凋亡、炎症和内质网应激。 而作为在染色体10q24上新发现的肿瘤抑制基因,程序性细胞死亡因子4(programmed cell death 4,PDCD4)也与细胞的程序性死亡有关[47]。XU等[48]的研究表明从人脐带间充质干细胞-外泌体中提取的miR-21和miR-19b可通过下调PTEN的表达来抑制神经元的凋亡。而KANG等[49]进一步研究得到,PDCD4和PTEN是miR-21的直接靶标。从转染的间充质干细胞上清液中收集的外泌体中含有miR-21,它能改善脊髓损伤大鼠的功能恢复,并通过miR-21/PTEN/PDCD4信号通路抑制神经元细胞死亡。JI等[50]则是利用肥胖大鼠间充质干细胞作为外泌体来源,发现其中miR-21水平下降,并且由于肥胖大鼠间充质干细胞的胰岛素抵抗作用,使其对脊髓损伤的保护作用受损,从侧面进一步证实了miR-21作为脊髓损伤治疗靶点的潜力。以上研究表明,含有miR-21的外泌体很有可能是治疗脊髓损伤的一种潜在方法。 上述内容介绍了间充质干细胞-外泌体所递送的miRNA可通过促进神经元生成、促进轴突再生以及抑制凋亡3个方面来促进脊髓损伤后神经功能的恢复。这其中有两点值得引起注意:第一,同一外泌体-miRNA在脊髓损伤的不同阶段可能具有不同的功能,如miR-126同时具有促进内源性神经生成、减少凋亡以及促进血管生成的作用。当上调外泌体中相关miRNA的含量时,可能对脊髓损伤某一方面功能的改善具有重要的治疗价值。第二,虽然肥胖并不影响从间充质干细胞中分离的外泌体数量与分布,但却改变了它们的miRNA载体。还需要更多的实验来确定肥胖大鼠来源的间充质干细胞中整个miRNA特征的变化,并探讨这些变化的意义。 2.3.2 调节炎症反应 神经炎症是中枢神经系统先天免疫系统响应炎症挑战的激活,其特征在于中枢神经系统内的大量细胞和分子变化。这种炎症由细胞因子/趋化因子的上调介导,细胞因子/趋化因子由常驻小胶质细胞、星形胶质细胞、外周来源的免疫细胞等一系列细胞产生[51]。目前,对于脊髓损伤后炎症机制的研究不断深入发展,合理调控炎症细胞以及促炎、趋化因子的发展可在一定程度上减少脊髓损伤后组织的损伤。 调控小胶质细胞/巨噬细胞与星形胶质细胞表型:作为炎症反应过程中的关键效应细胞,小胶质细胞/巨噬细胞激活在脊髓损伤后神经炎症的激活和调节中发挥着重要作用[52]。其对神经炎症和神经发生具有双重作用,这取决于它们的极化程度:经典的M1表型分泌促炎细胞因子,加剧神经元的损伤;相反,M2表型分泌抗炎细胞因子,以减轻神经元损伤并有利于组织修复[53]。因此,应重点探索将小胶质细胞/巨噬细胞从M1表型转变为M2表型以及抑制有害的过度神经炎症的治疗策略,为脊髓损伤的治疗提供新的治疗途径。 LI等[54]建立了脊髓缺血再灌注损伤大鼠模型,给大鼠注射含miR-124-3p的外泌体,并将巨噬细胞与含miR-124-3p的骨髓间充质干细胞-外泌体共同培养。随后测定抑制内质网到细胞核信号1(Ern1)与巨噬细胞极化相关标记物的表达。研究发现,来自骨髓间充质干细胞-外泌体的miR-124-3p通过抑制Ern1并促进M2巨噬细胞极化,改善了脊髓缺血再灌注损伤及其相关的神经损伤。然而,要阐明Ern1如何调控巨噬细胞极化以及其他miRNA是否能调控Ern1,还需要进一步研究。CHANG等[55]建立大鼠脊髓损伤模型并用提取的骨髓间充质干细胞-外泌体治疗,发现其促进了大鼠运动功能的恢复和M2表型的极化,同时抑制了脊髓损伤引起的神经元凋亡、变性和炎症反应。随后证明干扰素调节因子5(Interferon regulator factor 5,IRF5)的变化与治疗效果的关联性。进一步综合生物信息学预测确定,miR-125a是IRF5的上游miRNA。并且外泌体中miR-125a的敲除增加了IRF5在组织中的表达,削弱了骨髓间充质干细胞-外泌体对脊髓损伤的神经保护作用。因此得出,来源于骨髓间充质干细胞-外泌体所负载miR-125a靶向并负向调节IRF5的表达,促进了M2巨噬细胞的极化,从而改善脊髓损伤。IRF5可激活炎症细胞因子和肿瘤抑制因子等基因。M1型巨噬细胞的特点是富集表达IRF5,而在M2型中强化表达IRF5则会增强M1型特异性细胞因子和趋化因子的表达[56]。因此,miR-125a可通过增强M2极化被视为治疗脊髓损伤的新靶点。然而,还需要进一步的研究来阐明脊髓损伤中的下游信号轴。 对于小胶质细胞的调控,LIU等[57]研究表明,缺氧外泌体能在体内和体外将小胶质细胞极化从M1表型转变为M2表型,从而促进行为功能的恢复。通过miRNA阵列分析,确定miR-216a-5p参与了缺氧外泌体介导的小胶质细胞极化。随后确定Toll样受体4(Toll-like receptor 4,TLR4)为miR-216a-5p的下游靶基因,一系列功能增益和缺失实验证实了miR-216a-5p/TLR4轴。最后,指出来自缺氧骨髓间充质干细胞-外泌体可以通过转移miR-216a-5p抑制TLR4/核转录因子kB和激活PI3K/AKT信号通路,使小胶质细胞从M1促炎表型转变为M2抗炎表型,从而改善脊髓损伤。然而,该实验并没有解释TLR4/核转录因子κB和PI3K/AKT信号通路之间相互影响的内在机制,还需要进行下一步的实验,并且,也不能排除其他可能单独或与缺氧骨髓间充质干细胞-外泌体结合发挥作用以显示治疗效果的基因。 同时,这也揭示低氧预处理是优化间充质干细胞来源的外泌体治疗作用的一种有前途和有效的方法。但是,这项研究只揭示了一种可能性,即在缺氧条件下,骨髓间充质干细胞-外泌体可能会导致miR-216a-5p的增加,从而进一步帮助加强脊髓损伤后的功能恢复。XUE等[58]则进一步探索骨髓间充质干细胞-外泌体衍生的miR-216a-5p在脊髓损伤中的直接参与作用。他们发现骨髓间充质干细胞-外泌体衍生的miR-216a-5p能减轻脊髓损伤中神经元损伤和小胶质细胞介导的炎症反应,从而促进功能恢复,这可能归因于它对TLR4/核转录因子κB通路的抑制作用。仍需要更多的证据来验证这项发现。 ZHANG等[59]收集了骨髓间充质干细胞-外泌体来处理脊髓损伤大鼠和脂多糖诱导的小胶质细胞,发现其在体内体外均可降低促炎因子的表达,升高miR-181c含量,并产生抗炎作用。为深入探索其机制,又进一步确定了其靶基因PTEN,并验证了骨髓间充质干细胞-外泌体可通过其所含的miR-181c抑制PTEN和核转录因子κB信号来改善脊髓损伤。 星形胶质细胞是中枢神经系统中数量最多的细胞,具有神经营养、血流调节和其他平衡维持等功能。急性损伤会引发小胶质细胞活化和免疫细胞浸润等严重的炎症反应,进而推动星形胶质细胞的反应性[60]。反应性星形胶质细胞可通过促进组织碎片清除和抑制过度炎症反应来保护神经。然而,中枢神经系统损伤也会诱导星形胶质细胞获得神经毒性表型,从而对神经组织造成相应的过度损伤[61]。因此,逆转神经毒性表型的获得或消除神经毒性星形胶质细胞的有害影响是促进脊髓损伤患者神经功能恢复的重要途径。 作为源自人脐带间充质干细胞-外泌体能显著降低神经毒性星形胶质细胞标记物表达的miRNA之一的miR-146a-5p,在经过一系列功能增益和功能缺失实验后,可证实miR-146a-5p修饰的外泌体通过抑制典型核转录因子κB通路激活过程中的信号转导介质肿瘤坏死因子受体相关因子6(Traf6)和白细胞介素1受体相关激酶1(Irak1)的表达,来抑制核转录因子κB信号级联,逆转星形胶质细胞的神经毒性表型,促进脊髓损伤神经功能的恢复。该研究也指出,为获得最佳治疗效果,外泌体应在7 d pi内给药,以减弱星形胶质细胞的神经毒性效应[62]。然而,这项结果并不能排除其他miRNA表现出与miR-146a-5p相同治疗效果的可能性。CHEN等[38]实验发现从miR-26a修饰的间充质干细胞中提取的外泌体减少了炎症反应和星形胶质细胞瘢痕的标志物胶质纤维酸性蛋白的表达和核转录因子κB信号转导。因此,得出miR-26a可通过核转录因子κB通路来调节脊髓损伤中星形胶质细胞的增生。 调控炎症因子:众所周知,先天性免疫细胞和淋巴白细胞在损伤后会被激活,从而导致炎症级联反应。上述炎症细胞会释放各种神经毒素、促炎细胞因子、趋化因子、自由基、兴奋毒性氨基酸、一氧化氮等,为神经元的再生创造一个非常不利的微环境[63]。因此及时调控促炎因子对于治疗脊髓损伤有着重要意义。 LI等[64]在硬膜外压迫脊髓损伤模型的SD大鼠尾静脉注射经miR-544修饰的胫股骨骨髓间充质干细胞-外泌体,发现miR-544明显抑制脊髓损伤后脊髓组织中促炎因子白细胞介素1a、肿瘤坏死因子α、白细胞介素17b和白细胞介素36b的产生,同时提高BBB评分和脊髓神经元存活率,减轻脊髓损伤炎症反应。然而,鉴于外泌体的保护作用,还需要进一步的体外实验。 SHAO等[65]研究发现,miR-137过表达的骨髓间充质干细胞-外泌体可降低脊髓损伤大鼠组织中促炎因子如白细胞介素1β、白细胞介素6和肿瘤坏死因子α等的表达,同时减少组织损伤,提高神经元活力与运动功能的恢复。由于通过鞘内注射将药物直接输送到脊髓的侵入性更大,会对未损伤或损伤的脊髓组织造成毒性,而且在非医院环境中很难进行鞘内注射,该研究选择了尾部静脉注射外泌体。然而,该实验还有一定局限性:尽管在分离外泌体时使用了已被证明高效的分离方法,但在分离后并未评估其纯度。 目前,TLR4/核转录因子κB信号通路是研究脊髓损伤发病相关分子机制最常见的信号通路之一。TLR4是调节宿主免疫系统的关键受体,通过调节核转录因子κB级联诱导炎性细胞因子的表达[66]。 JIANG等[67]研究表明,含有miR-145-5p的骨髓间充质干细胞-外泌体可抑制脊髓损伤大鼠体内TLR4/核转录因子κB通路的激活,从而减轻炎症反应,改善脊髓损伤大鼠的功能恢复,减少组织病理学损伤。同时,miR-145-5p在由脂多糖诱导的PC12细胞中,可特异性靶向TLR4,抑制TLR4/核转录因子κB通路的激活和炎症反应。但是,该实验仍有不足,仅用透射电子显微镜对间充质干细胞中的外泌体进行分析,应该更准确地观察外泌体的结构特征,如利用纳米颗粒追踪分析实验观察颗粒的大小和分布,定量分析异物。WANG等[68]也通过建立体内大鼠脊髓损伤模型和脂多糖刺激的体外细胞模型,证明人脐带间充质干细胞衍生的外泌体miR-146b可通过靶向抑制TLR4和灭活核转录因子κB信号来缓解脊髓损伤和减少炎症细胞因子如白细胞介素1β、白细胞介素6和肿瘤坏死因子α的产生。该实验以肾上腺嗜铬细胞瘤细胞株PC12为研究对象,证明了miR-146b可调控 PC12 细胞的死亡和炎症反应。然而,miR-146b也可能产生于大脑中的其他细胞,如神经元、小胶质细胞和星形胶质细胞,这些细胞产生的miR-146b有何作用,以及miR-146b是否会影响原发性神经元、小胶质细胞、少突胶质细胞和星形胶质细胞的行为,目前仍是未知数。后续应开展进一步的研究,探讨miR-146b对脊髓损伤期间神经元系统的详细影响。 间充质干细胞-外泌体所负载miRNA可通过调节巨噬细胞/小胶质细胞、星形胶质细胞表型和调控促炎因子等方面来改善脊髓损伤后的微环境,促进脊髓损伤恢复。其中,有以下几点值得思考:第一,体内生理条件下的氧浓度与体外培养基中的氧浓度是不同的,体外常氧条件并不能模拟体内真实的缺氧微环境。由于缺氧微环境是包括脊髓损伤在内的各种炎症和病变组织的显著特征,所以应在正常缺氧和缺氧细胞预处理后对这些相互作用进行深入探究,以此来深入发掘脊髓损伤的发病机制,为其治疗提供新思路。第二,TLR4/核转录因子κB这一信号通路在调节炎症过程中反复出现,miR-216-5p,miR-145-5p及miR-146b均能通过调节TLR4/核转录因子κB来发挥作用。由此可见,若集中具有相似作用的miRNA一齐运用于实验,是否可产生更明显的效果来改善脊髓损伤。 2.3.3 促进血管生成 血管生成是脊髓损伤后损伤部位血管演变的基本形式,血运重建在其康复中至关重要。通过提供血液供应充足、触发血管生成和确保血脊髓屏障完整性来针对受损血管系统的干预措施,能够潜在地延缓继发性脊髓损伤发展并促进损伤后的轴突导向和功能恢复[69]。 目前关于促进血管生成这一功能,相关临床前实验较少。HUANG等[25]在将miR-126由骨髓间充质干细胞-外泌体递送到脊髓损伤大鼠模型与体外细胞模型的研究中观察到,在脊髓损伤大鼠模型中,miR-126外泌体能促进脊髓损伤后的血管生成。在体外细胞模型中,可抑制血管内皮生长因子途径的负调控因子含发芽相关的EVH1域1(spouty related EVH domain containing protein1,SPRED1)和磷酸肌醇3激酶调节亚基2(PIK3R2)的表达,从而促进体外人脐静脉内皮细胞的血管生成和迁移,从而促进脊髓损伤后的血管生成。其中,SPRED1可抑制生长因子信号的激活,还能调节肌动蛋白细胞骨架的重组,这对稳定血管非常重要[70]。然而,miR-126富集的外泌体与这两个靶基因之间的确切关系,以及这些过程如何影响脊髓损伤后血管内皮生长因子的表达,还有待进一步明确,需后续实验加以进一步验证。 负载miRNA的间充质干细胞源外泌体通过促进神经功能恢复改善脊髓损伤相关研究汇总见表1。负载miRNA的间充质干细胞源外泌体通过调节炎症反应及促进血管生成改善脊髓损伤相关研究汇总见表2。负载miRNA的间充质干细胞源外泌体治疗脊髓损伤作用机制见图5。"
| [1] ALIZADEH A, DYCK SM, KARIMI-ABDOLREZAEE S. Traumatic spinal cord injury: an overview of pathophysiology, models and acute injury mechanisms. Front Neurol. 2019;10:282. [2] VARMA AK, DAS A, WALLACE G, et al. Spinal cord injury: a review of current therapy, future treatments, and basic science frontiers. Neurochem Res. 2013; 38(5):895-905. [3] TYLER JY, XU XM, CHENG JX. Nanomedicine for treating spinal cord injury. Nanoscale. 2013;5(19):8821. [4] YU B, ZHANG X, LI X. Exosomes derived from mesenchymal stem cells. Int J Mol Sci. 2014;15(3):4142-4157. [5] CHANG C, YAN J, YAO Z, et al. Effects of mesenchymal stem cell-derived paracrine signals and their delivery strategies. Adv Healthc Mater. 2021;10(7):2001689. [6] LIU WZ, MA ZJ, LI JR, et al. Mesenchymal stem cell-derived exosomes: therapeutic opportunities and challenges for spinal cord injury. Stem Cell Res Ther. 2021; 12(1):102. [7] UMEZU T, TADOKORO H, AZUMA K, et al. Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1. Blood. 2014;124(25):3748-3757. [8] CHEN L, LU FB, CHEN DZ, et al. BMSCs-derived miR-223-containing exosomes contribute to liver protection in experimental autoimmune hepatitis. Mol Immunol. 2018;93:38-46. [9] NINIVAGGI M, FEIJGE MAH, BAATEN CCFMJ, et al. Additive roles of platelets and fibrinogen inwhole-blood fibrin clot formation upon dilution as assessed by thromboelastometry. Thromb Haemostasis. 2014;111(3):447-457. [10] STRZELECKA-KILISZEK A, BOŻYCKI Ł, KOMIAŻYK M, et al. Vesicles of the intracellular and extracellular transport - key structures in the process of tissue differentiation towards bone and cartilage. Postepy Biochem. 2018;64(3):253-260. [11] JIAO YR, CHEN KX, TANG X, et al. Exosomes derived from mesenchymal stem cells in diabetes and diabetic complications. Cell Death Dis. 2024;15(4):271. [12] POINSOT V, PIZZINAT N, ONG-MEANG V. Engineered and mimicked extracellular nanovesicles for therapeutic delivery. Nanomaterials (Basel). 2024;14(7):639. [13] MCANDREWS KM, XIAO F, CHRONOPOULOS A, et al. Exosome-mediated delivery of CRISPR/Cas9 for targeting of oncogenic KrasG12D in pancreatic cancer. Life Sci Alliance. 2021;4(9):e202000875. [14] KALLURI R, LEBLEU VS. The biology, function, and biomedical applications of exosomes. Science. 2020;367(6478):eaau6977. [15] GUO M, YIN Z, CHEN F, et al. Mesenchymal stem cell-derived exosome: a promising alternative in the therapy of alzheimer’s disease. Alzheimers Res Ther. 2020;12(1):109. [16] PEGTEL DM, GOULD SJ. Exosomes. Annu Rev Biochem. 2019;88(1):487-514. [17] MATHIVANAN S, JI H, SIMPSON RJ. Exosomes: extracellular organelles important in intercellular communication. J. Proteomics. 2010;73(10):1907-1920. [18] ZHANG Y, LIU Y, LIU H, et al. Exosomes: biogenesis, biologic function and clinical potential. Cell BioSci. 2019;9(1):19. [19] SUBRA C, LAULAGNIER K, PERRET B, et al. Exosome lipidomics unravels lipid sorting at the level of multivesicular bodies. Biochimie. 2007;89(2):205-212. [20] BATISTA BS, ENG WS, PILOBELLO KT, et al. Identification of a conserved glycan signature for microvesicles. J Proteome Res. 2011;10(10):4624-4633. [21] BRACCIOLI L, VAN VELTHOVEN C, HEIJNEN CJ. Exosomes: a new weapon to treat the central nervous system. Mol Neurobiol. 2014;49(1):113-119. [22] KUMAR H, ROPPER AE, LEE SH, et al. Propitious therapeutic modulators to prevent blood-spinal cord barrier disruption in spinal cord injury. Mol Neurobiol. 2017;54(5):3578-3590. [23] WHITE-SCHENK D, SHI R, LEARY JF. Nanomedicine strategies for treatment of secondary spinal cord injury. Int J Nanomed. 2015;10:923-938. [24] YANG Y, LI Y, ZHANG S, et al. miR-199a-5p from bone marrow mesenchymal stem cell exosomes promotes the proliferation of neural stem cells by targeting GSK-3β. Acta Biochim Biophys Sin. 2023;55(5):783-794. [25] HUANG JH, XU Y, YIN XM, et al. Exosomes derived from mir-126-modified MSCs promote angiogenesis and neurogenesis and attenuate apoptosis after spinal cord injury in rats. Neuroscience. 2020;424:133-145. [26] WANG Y, LAI X, WU D, et al. Umbilical mesenchymal stem cell-derived exosomes facilitate spinal cord functional recovery through the miR-199a-3p/145-5p-mediated NGF/TrkA signaling pathway in rats. Stem Cell Res Ther. 2021;12(1):117. [27] GAGLIARDI D, MENERI M, SACCOMANNO D, et al. Diagnostic and prognostic role of blood and cerebrospinal fluid and blood neurofilaments in amyotrophic lateral sclerosis: a review of the literature. Int J Mol Sci. 2019;20(17):4152. [28] CHUNG D, SHUM A, CARAVEO G. GAP-43 and BASP1 in axon regeneration: implications for the treatment of neurodegenerative diseases. Front Cell Dev Biol. 2020;8:567537. [29] KOTLIAROVA A, SIDOROVA YA. Glial cell line-derived neurotrophic factor family ligands, players at the interface of neuroinflammation and neuroprotection: focus onto the glia. Front Cell Neuro Sci. 2021;15:679034. [30] YU T, ZHAO C, HOU S, et al. Exosomes secreted from miRNA-29b-modified mesenchymal stem cells repaired spinal cord injury in rats. Braz J Med Biol Res. 2019;52(12):e8735. [31] HUANG W, LIN M, YANG C, et al. Rat bone mesenchymal stem cell-derived exosomes loaded with miR-494 promoting neurofilament regeneration and behavioral function recovery after spinal cord injury. Oxid Med Cell Longevity. 2021;2021:1-15. [32] O’SHEA TM, BURDA JE, SOFRONIEW MV. Cell biology of spinal cord injury and repair. J Clin Invest. 2017;127(9):3259-3270. [33] LI D, ZHANG P, YAO X, et al. Exosomes derived from miR-133b-modified mesenchymal stem cells promote recovery after spinal cord injury. Front Neurosci. 2018;12:845. [34] WU X, WALKER CL, LU Q, et al. RhoA/Rho kinase mediates neuronal death through regulating cPLA2 activation. Mol Neurobiol. 2017;54(9):6885-6895. [35] LI F, JIANG Q, SHI KJ, et al. RhoA modulates functional and physical interaction between ROCK1 and Erk1/2 in selenite-induced apoptosis of leukaemia cells. Cell Death Dis. 2013;4(7):e708-e708. [36] CHOWDHURY MAR, AN J, JEONG S. The pleiotropic face of CREB family transcription factors. Mol Cells. 2023;46(7):399-413. [37] REN ZW, ZHOU JG, XIONG ZK, et al. Effect of exosomes derived from MiR-133b-modified ADSCs on the recovery of neurological function after SCI. Eur Rev Med Pharmacol Sci. 2019;23(1):52-60. [38] CHEN Y, TIAN Z, HE L, et al. Exosomes derived from miR-26a-modified MSCs promote axonal regeneration via the PTEN/AKT/mTOR pathway following spinal cord injury. Stem Cell Res Ther. 2021;12(1):224. [39] DU K, ZHENG S, ZHANG Q, et al. Pten deletion promotes regrowth of corticospinal tract axons 1 year after spinal cord injury. J NeuroSci. 2015;35(26):9754-9763. [40] ELI I, LERNER DP, GHOGAWALA Z. Acute traumatic spinal cord injury. Neurol Clin. 2021;39(2):471-488. [41] WEI AH, ROBERTS AW. BCL2 inhibition: a new paradigm for the treatment of AML and beyond. Hemasphere. 2023;7(6):e912. [42] JULIEN O, WELLS JA. Caspases and their substrates. Cell Death Differ. 2017;24(8): 1380-1389. [43] LIU B, ZHENG W, DAI L, et al. Bone marrow mesenchymal stem cell derived exosomal miR-455-5p protects against spinal cord ischemia reperfusion injury. Tissue Cell. 2022;74:101678. [44] ZHANG A, BAI Z, YI W, et al. Overexpression of miR-338-5p in exosomes derived from mesenchymal stromal cells provides neuroprotective effects by the Cnr1/Rap1/Akt pathway after spinal cord injury in rats. Neurosci Lett. 2021;761:136124. [45] LIANG Y, WU JH, ZHU JH, et al. Exosomes secreted by hypoxia–pre-conditioned adipose-derived mesenchymal stem cells reduce neuronal apoptosis in rats with spinal cord injury. J Neurotraum. 2022;39(9-10):701-714. [46] HE X, ZHANG J, GUO Y, et al. Exosomal miR-9-5p derived from BMSCs alleviates apoptosis, inflammation and endoplasmic reticulum stress in spinal cord injury by regulating the HDAC5/FGF2 axis. Mol Immunol. 2022;145:97-108. [47] MATSUHASHI S, MANIRUJJAMAN M, HAMAJIMA H, et al. Control mechanisms of the tumor suppressor PDCD4: expression and functions. Int J Mol Sci. 2019; 20(9):2304. [48] XU G, AO R, ZHI Z, et al. miR‐21 and miR‐19b delivered by hMSC‐derived EVs regulate the apoptosis and differentiation of neurons in patients with spinal cord injury. J Cell Physiol. 2019;234(7):10205-10217. [49] KANG J, LI Z, ZHI Z, et al. MiR-21 derived from the exosomes of MSCs regulates the death and differentiation of neurons in patients with spinal cord injury. Gene Ther. 2019;26(12):491-503. [50] JI W, JIANG W, LI M, et al. miR-21 deficiency contributes to the impaired protective effects of obese rat mesenchymal stem cell-derived exosomes against spinal cord injury. Biochimie. 2019;167:171-178. [51] HELLENBRAND DJ, QUINN CM, PIPER ZJ, et al. Inflammation after spinal cord injury: a review of the critical timeline of signaling cues and cellular infiltration. J Neuroinflamm. 2021;18(1):284. [52] DAVID S, KRONER A. Repertoire of microglial and macrophage responses after spinal cord injury. Nat Rev NeuroSci. 2011;12(7):388-399. [53] ORIHUELA R, MCPHERSON CA, HARRY GJ Microglial M1/M2 polarization and metabolic states. Br J Pharmacol. 2016;173(4):649-665. [54] LI R, ZHAO K, RUAN Q, et al. Bone marrow mesenchymal stem cell-derived exosomal microRNA-124-3p attenuates neurological damage in spinal cord ischemia-reperfusion injury by downregulating Ern1 and promoting M2 macrophage polarization. Arthritis Res Ther. 2020;22(1):75. [55] CHANG Q, HAO Y, WANG Y, et al. Bone marrow mesenchymal stem cell-derived exosomal microRNA-125a promotes M2 macrophage polarization in spinal cord injury by downregulating IRF5. Brain Res Bull. 2021;170:199-210. [56] ROBERTS BK, COLLADO G, BARNES BJ. Role of interferon regulatory factor 5 (IRF5) in tumor progression: prognostic and therapeutic potential. Biochim Biophys Acta Rev Cancer. 2024;1879(1):189061. [57] LIU W, WANG J, GE X, et al. Exosome-shuttled miR-216a-5p from hypoxic preconditioned mesenchymal stem cells repair traumatic spinal cord injury by shifting microglial M1/M2 polarization. J Neuroinflamm. 2020;17(1):47. [58] XUE H, RAN B, LI J, et al. Bone marrow mesenchymal stem cell exosomes-derived microRNA-216a-5p on locomotor performance, neuronal injury, and microglia inflammation in spinal cord injury. Front Cell Dev Biol. 2023;11:1227440. [59] ZHANG M, WANG L, HUANG S, et al. Exosomes with high level of miR-181c from bone marrow-derived mesenchymal stem cells inhibit inflammation and apoptosis to alleviate spinal cord injury. J Mol Histol. 2021;52(2):301-311. [60] LIDDELOW SA, BARRES BA. Reactive astrocytes: production, function, and therapeutic potential. Immunity. 2017;46(6):957-967. [61] LIDDELOW SA, GUTTENPLAN KA, CLARKE LE, et al. Neurotoxic reactive astrocytes are induced by activated microglia. Nature. 2017;541(7638):481-487. [62] LAI X, WANG Y, WANG X, et al. miR-146a-5p-modified hUCMSC-derived exosomes facilitate spinal cord function recovery by targeting neurotoxic astrocytes. Stem Cell Res. Ther. 2022;13(1):487. [63] LV B, ZHANG X, YUAN J, et al. Biomaterial-supported MSC transplantation enhances cell-cell communication for spinal cord injury. Stem Cell Res. Ther. 2021;12(1):36. [64] LI C, LI X, ZHAO B, et al. Exosomes derived from miR-544-modified mesenchymal stem cells promote recovery after spinal cord injury. Arch Physiol Biochem. 2020;126(4):369-375. [65] SHAO Y, WANG Q, LIU L, et al. Alleviation of spinal cord injury by microRNA 137-overexpressing bone marrow mesenchymal stem cell- derived exosomes. Tohoku J Exp. Med. 2023;259(3):237-246. [66] WANG J, ZHANG F, XU H, et al. TLR4 aggravates microglial pyroptosis by promoting DDX3X-mediated NLRP3 inflammasome activation via JAK2/STAT1 pathway after spinal cord injury. Clin Transl Med. 2022;12(6):e894. [67] JIANG Z, ZHANG J Mesenchymal stem cell-derived exosomes containing miR-145-5p reduce inflammation in spinal cord injury by regulating the TLR4/NF-κB signaling pathway. Cell Cycle. 2021; 20(10):993-1009. [68] WANG X, YANG Y, LI W, et al. Umbilical mesenchymal stem cell-derived exosomes promote spinal cord functional recovery through the miR-146b/TLR4 -mediated NF-κB p65 signaling pathway in rats. Biochem Biophys Rep. 2023;35:101497. [69] TSIVELEKAS KK, EVANGELOPOULOS DS, PALLIS D, et al. Angiogenesis in spinal cord injury: progress and treatment. Cureus. 2022;14(5):e25475. [70] LORENZO C, MCCORMICK F. SPRED proteins and their roles in signal transduction, development, and malignancy. Gene Dev. 2020;34(21-22):1410-1421. [71] CHEN YS, LIN EY, CHIOU TW, et al. Exosomes in clinical trial and their production in compliance with good manufacturing practice. Ci Ji Yi Xue Za Zhi. 2020;32(2):113-120. [72] XIAO Y, HU X, JIANG P, et al. Thermos-responsive hydrogel system encapsulated engineered exosomes attenuate inflammation and oxidative damage in acute spinal cord injury. Front Bioeng Biotechnol. 2023;11:1216878. |
| [1] | Yang Zhihang, Sun Zuyan, Huang Wenliang, Wan Yu, Chen Shida, Deng Jiang. Nerve growth factor promotes chondrogenic differentiation and inhibits hypertrophic differentiation of rabbit bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1336-1342. |
| [2] | Hu Taotao, Liu Bing, Chen Cheng, Yin Zongyin, Kan Daohong, Ni Jie, Ye Lingxiao, Zheng Xiangbing, Yan Min, Zou Yong. Human amniotic mesenchymal stem cells overexpressing neuregulin-1 promote skin wound healing in mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1343-1349. |
| [3] | Jin Kai, Tang Ting, Li Meile, Xie Yuan. Effects of conditioned medium and exosomes of human umbilical cord mesenchymal stem cells on proliferation, migration, invasion, and apoptosis of hepatocellular carcinoma cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1350-1355. |
| [4] | Li Dijun, Jiu Jingwei, Liu Haifeng, Yan Lei, Li Songyan, Wang Bin. Three-dimensional gelatin microspheres loaded human umbilical cord mesenchymal stem cells for chronic tendinopathy repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1356-1362. |
| [5] | Liu Qi, Li Linzhen, Li Yusheng, Jiao Hongzhuo, Yang Cheng, Zhang Juntao. Icariin-containing serum promotes chondrocyte proliferation and chondrogenic differentiation of stem cells in the co-culture system of three kinds of cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1371-1379. |
| [6] | Zhang Zhenyu, Liang Qiujian, Yang Jun, Wei Xiangyu, Jiang Jie, Huang Linke, Tan Zhen. Target of neohesperidin in treatment of osteoporosis and its effect on osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1437-1447. |
| [7] | Weng Zongqin, Zhao Hailong. Mechanism of exosomal miRNA involved in tumor chemotherapy resistance [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1504-1511. |
| [8] | Li Jialin, Zhang Yaodong, Lou Yanru, Yu Yang, Yang Rui. Molecular mechanisms underlying role of mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1512-1522. |
| [9] | Cao Yue, Ye Xinjian, Li Biyao, Zhang Yining, Feng Jianying. Effect of extracellular vesicles for diagnosis and therapy of oral squamous cell carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1523-1530. |
| [10] | Zhao Ruihua, Chen Sixian, Guo Yang, Shi Lei, Wu Chengjie, Wu Mao, Yang Guanglu, Zhang Haoheng, Ma Yong. Wen-Shen-Tong-Du Decoction promoting spinal cord injury repair in mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1118-1126. |
| [11] | He Bo, Chen Wen, Ma Suilu, He Zhijun, Song Yuan, Li Jinpeng, Liu Tao, Wei Xiaotao, Wang Weiwei, Xie Jing . Pathogenesis and treatment progress of flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1230-1238. |
| [12] | Wang Rongrong, Huang Yushan, Li Xiangmiao, Bai Jinzhu. Prostaglandin E1 regulates vascular-related factors and protects microcirculatory function during the acute phase of traumatic spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 958-967. |
| [13] | Wang Sifan, He Huiyu, Yang Quan, Han Xiangzhen. miRNA-378a overexpression of macrophage cell line composite collagen sponge: anti-inflammation and tissue repair promotion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 789-799. |
| [14] | Sun Xianjuan, Wang Qiuhua, Zhang Jinyi, Yang Yangyang, Wang Wenshuang, Zhang Xiaoqing. Adhesion, proliferation, and vascular smooth muscle differentiation of bone marrow mesenchymal stem cells on different electrospinning membranes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 661-669. |
| [15] | Ge Xiao, Zhao Zhuangzhuang, Guo Shuyu, Xu Rongyao. HOXA10 gene-modified bone marrow mesenchymal stem cells promote bone regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7701-7708. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||