Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (19): 4111-4121.doi: 10.12307/2025.072
Previous Articles Next Articles
Scientific basis for acupuncture combined with neural stem cells for repairing spinal cord injury
Huang Xiaomeng1, 2, Zhang Zhilan1, Shang Wenya1, Huang Jing1, Wei Huilin1, Li Bing2, Ren Yafeng2
- 1School of Rehabilitation Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; 2First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China
-
Received:2024-02-21Accepted:2024-04-27Online:2025-07-08Published:2024-09-13 -
Contact:Ren Yafeng, PhD, Chief physician, Master's supervisor, First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China -
About author:Huang Xiaomeng, Master candidate, School of Rehabilitation Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, Henan Province, China; First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China -
Supported by:Henan Province Chinese Medicine Scientific Research Special Project, Nos. 2022JDZX015, 2021JDZY022 (to RYF)
CLC Number:
Cite this article
Huang Xiaomeng, Zhang Zhilan, Shang Wenya, Huang Jing, Wei Huilin, Li Bing, Ren Yafeng. Scientific basis for acupuncture combined with neural stem cells for repairing spinal cord injury[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(19): 4111-4121.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
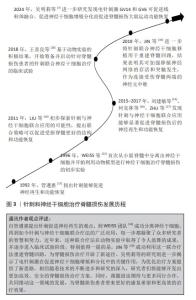
2.1 针刺和神经干细胞治疗脊髓损伤发展概述 如图3所示,自1992年管遵惠[12]提出针刺促进神经再生与功能恢复的观点以来,神经再生领域的研究取得了显著进展。在1996年,WEISS等[13]研究团队首次从小鼠脊髓中分离出神经干细胞,为脊髓损伤治疗开辟了新的道路。随着研究的深入,在2011年,LIU等[14]初步探索了针刺与神经干细胞的联合应用,展现出令人鼓舞的效果。随后,刘建敏等[15]、何克林等[16]和ZHU等[17]的研究进一步证实了这种联合疗法的显著疗效,为脊髓损伤治疗提供了新的可能性。在取得一系列实验性成果后,在2018年,王喜良等[18]基于动物实验成果,启动了针对脊髓损伤患者的临床试验,以验证这种联合疗法在人体上的有效性。近年来,随着技术不断进步,JIN等[19]更是利用针刺联合神经干细胞移植,成功地重建了脊髓回路,从而显著提升了治疗效果。到了2024年,吴明莉等[7]的研究进一步深入,他们发现电针刺激GV14和GV6可以促进线粒体的融合,并增强神经干细胞的增殖和分化,从而进一步促进脊髓损伤大鼠的运动功能恢复。这一发现为脊髓损伤的治疗提供了新的策略和方向。如今,研究人员正不断优化治疗方案,以期为脊髓损伤患者带来更好的康复希望和更高效的治疗效果。"

2.2 脊髓损伤治疗的关键环节:减轻继发性损伤以优化神经修复环境 在临床上,原发性损伤导致神经元立即死亡,无法治疗,而继发性损伤被认为是修复受损神经元的决定性因素[20]。这些继发性损伤包括血脊髓屏障的破坏、炎症性细胞的浸润以及细胞内离子稳态失衡,尤其是钙离子浓度的异常增加,这不仅加剧了脊髓损伤的程度,还严重影响了受损神经的修复与再生。此外,钙离子浓度的增加会激活钙依赖蛋白酶,进而导致线粒体功能障碍同时,兴奋性氨基酸的释放又会引发兴奋性毒性反应,最终导致神经元和胶质细胞的凋亡[6]。在脊髓损伤的后期,这些凋亡细胞会形成神经胶质瘢痕和囊腔,成为轴突再生的物理障碍[8]。因此,通过减轻继发性损伤的程度,为受损神经的修复创造更好的环境不仅是早期治疗脊髓损伤的关键,也是神经干细胞移植疗法的重要研究方向[21-28],见表1。"

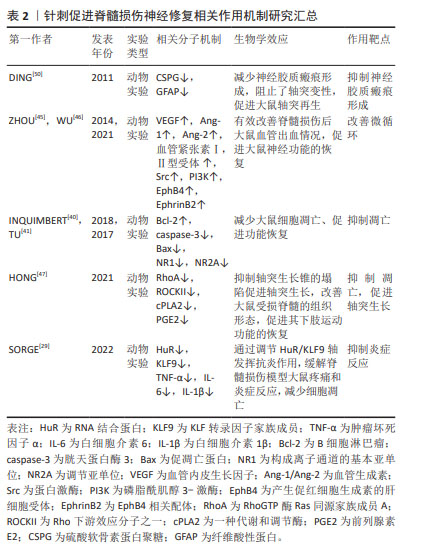
2.3 针刺改善脊髓损伤受损环境,促进神经再生 2.3.1 针刺缓解炎症反应,减少继发性损伤 RNA结合蛋白HuR,在神经再生、细胞凋亡和与中枢神经系统相关的各种疾病中起着关键作用[29]。研究表明,脊髓损伤后,HuR从细胞核转移到细胞质,并且正向调节星形胶质细胞中关键炎症递质的分泌[30]。通过抑制HuR,可以减少炎性细胞因子的分泌,进而减轻脊髓损伤后的炎症反应,这无疑为脊髓损伤的治疗提供了新的思路[29,31]。而HuR的下游因子锌指蛋白Krüppel样转录因子9(Krüppel-like factors,KLF9)在维持脊髓网络中的神经元敏化和疼痛所需突触变化方面的作用,进一步强调了HuR/KLF9轴在脊髓损伤过程中的重要性[32]。通过调控这一轴,可推测有可能在多个层面影响脊髓损伤的进展,包括减轻炎症、促进神经再生以及减少神经元凋亡[33-34]。此外,电针作为一种传统中医疗法,在调节HuR/KLF9轴方面的作用不容忽视。电针能够通过下调HuR和KLF9的表达,抑制促炎细胞因子和凋亡因子的产生,从而发挥抗炎、镇痛和促神经再生的作用[11]。此发现不仅为电针在脊髓损伤治疗中的应用提供了理论基础,也为其他中枢神经系统疾病的治疗提供了新的策略。除了HuR/KLF9轴外,NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体在中枢神经系统疾病中的作用也日益受到关注。通过抑制NLRP3炎症小体的激活,可以有效缓解神经炎症,进而改善疾病的进展[35]。而针刺在抑制NLRP3炎症小体通路方面的作用,为研究者们提供了一种非药物性的治疗选择,具有广阔的应用前景。因此,通过深入研究和应用电针等治疗方法,研究者们可以更有效地调节HuR/KLF9轴和NLRP3炎症小体,缓解炎症反应,为中枢神经系统疾病的治疗开辟新的途径。 2.3.2 针刺抑制神经元凋亡,发挥神经保护作用 神经元凋亡是脊髓损伤的重要病理机制[36-37],其会阻断脊髓损伤后神经传导通路,加重继发性损伤。因此,抑制细胞凋亡是促进脊髓损伤恢复的关键[38]。在众多治疗手段中,针刺,特别是电针,展现出了在抑制神经元凋亡方面的独特优势。研究表明,电针可以通过调控凋亡相关因子的表达,如增加抗凋亡因子B淋巴细胞瘤2(B-cell lymphoma-2,Bcl-2)表达,同时下调凋亡因子caspase-3和Bax的表达,来有效地抑制脊髓神经元的凋亡过程[39]。这一发现不仅揭示了电针治疗脊髓损伤的内在机制,也为其在临床实践中的应用提供了坚实的理论基础。此外,电针还能够通过降低脊髓损伤大鼠模型损伤区域N-甲基-D-天冬氨酸(N-Methyl-D-aspartic acid,NMDA)亚基NR1和NR2A的表达,来减轻兴奋性氨基酸的毒性作用,从而进一步发挥神经保护作用[40-41]。这一发现不仅拓宽了研究者们对电针治疗脊髓损伤作用机制的认识,也为其在治疗其他神经系统疾病中的应用提供了启示。综上所述,针刺通过多种机制减少神经细胞凋亡,发挥神经保护作用,为其临床应用提供了科学依据。 2.3.3 针刺改善微循环功能障碍 在脊髓损伤后会出现一系列的病理变化,包括血管破裂、出血、血流量减少和毛细血管栓塞等,这些变化导致血-脊髓屏障受到破坏,引发炎症细胞浸润和脊髓组织水肿,进而导致微循环功能障碍[42-43]。针刺治疗在改善微循环方面发挥了重要作用。临床研究显示,针刺特定穴位能够显著调节毛细血管的直径和充盈程度,这对于改善微循环至关重要[44]。在动物实验中,针刺更是通过促进血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素1(angiopoietins 1,Ang-1)、血管生成素2(angiopoietins 2,Ang-2)等血管生长因子的表达,有效改善出血状况[45],从而缓解了脊髓损伤后的微循环障碍,这一过程与EphB4/EphrinB2介导的Src/PI3K信号通路的调节密切相关[46]。值得一提的是,针刺治疗改善微循环的机制并不仅限于对血管的直接作用。HONG等[47]的研究进一步揭示了针刺通过抑制炎症反应来调节微循环的新机制。细胞质磷脂酶A2(cytosolic phospholipase A2,cPLA2)活性和前列腺素E2(prostaglandin E2,PGE2)作为炎症反应中的关键因子,其活性的降低不仅有助于减轻炎症反应,更能有效地改善微循环,从而为神经细胞的存活和功能恢复创造更有利的环境。综上所述,针刺治疗在改善脊髓损伤后的微循环方面具有显著效果,其机制多样且深入。通过调节血管状态、促进血管生长因子表达以及抑制炎症反应等途径,针刺能够有效地改善微循环障碍,减少神经元的凋亡,促进功能的恢复。这为研究者们在未来研究和应用针刺治疗脊髓损伤提供了更为丰富的理论依据和实践指导。 2.3.4 针刺抑制神经胶质瘢痕形成,促进轴突再生 脊髓损伤后,星形胶质细胞增殖并分泌多种细胞外基质,形成神经胶质瘢痕。一方面,它将受伤的组织与健康组织隔开,限制病变扩张并保护周围组织;另一方面,它还通过分泌一些生长抑制因子,如硫酸软骨素蛋白多糖,形成化学屏障,限制了神经元再生,阻碍神经通路恢复[48-49]。针刺治疗作为一种传统的中医疗法,近年来在脊髓损伤治疗领域展现了其独特的优势。DING等[50-52]的研究发现,电针可以有效下调硫酸软骨素蛋白多糖蛋白这一星形胶质细胞的重要组成部分的表达,从而减少这种化学屏障的生成,为轴突的再生创造了有利条件。这不仅有助于减轻脊髓损伤后的病理改变,更能够促进神经功能的恢复,提高患者的生活质量。胶质纤维酸性蛋白不仅可以形成物理屏障隔离受损组织,同时也阻碍了轴突生长[53]。研究表明,火针针灸和电针可以降低胶质纤维酸性蛋白的表达,这有助于减少神经胶质瘢痕的形成,为轴突的生长创造有利条件[54]。同时,这些针刺方法还可以促进神经干细胞的分化,有助于损伤部位的修复和神经功能的恢复[55]。综上所述,针刺治疗可以通过多种机制调节神经胶质瘢痕的形成和神经干细胞的分化,为脊髓损伤的治疗提供了科学依据。 2.3.5 针刺减少活性氧产生,抑制氧化应激 脊髓损伤后,活性氧形成的增多及其随后的氧化应激成为神经元凋亡和功能障碍的关键诱因[56]。因此,针对脊髓损伤后的氧化应激损伤和抗氧化治疗构成了改善脊髓损伤继发性损伤策略的重要部分。脊髓内富含不饱和脂肪酸并拥有高活性的氧化代谢,然而,其神经元的抗氧化能力相对不足且再生能力受限。这种内在的脆弱性易导致氧化代谢产物的积累和抗氧化剂的过度消耗,从而加剧了脊髓损伤所介导的氧化应激损伤,这一过程进一步触发了小胶质细胞和星形胶质细胞的活化,以及炎性细胞因子的释放,最终导致神经元细胞的死亡[57-58]。研究表明,JNK/p66 Shc信号通路的激活可以促进活性氧的产生,而叉头转录因子(Forkhead box O3,FoxO3a)则能保护细胞免受氧化应激的损伤。然而,在脊髓损伤后,激活的JNK/p66Shc信号通路不仅促进了活性氧的生成,还抑制了FoxO3a的抗氧化作用,从而加剧了氧化应激损伤[59-60]。值得注意的是,针刺已被证实能够通过减弱p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)介导的小胶质细胞活化和炎症反应,以及抑制JNK/p66Shc介导的活性氧生成和氧化应激损伤,发挥神经保护作用[58]。 此外,脊髓损伤后炎症细胞会释放过量的活性氧和氮物质[61],这些物质能够造成DNA氧化损伤、蛋白质氧化和脂质过氧化[6],进而加剧神经元和神经胶质细胞的坏死和凋亡[62]。载脂蛋白E(apolipoprotein E,ApoE)具有抗炎、抗氧化和抗凋亡特性[63],ApoE的缺失会加剧炎症反应和氧化应激,增加神经凋亡,从而延缓脊髓损伤后运动和神经功能的恢复[64]。研究表明,ApoE能够诱导核转录因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)的抗氧化信号激活,这在脊髓损伤后抗氧化过程中起着至关重要的作用[65]。然而,在脊髓损伤后,ApoE的水平下降会导致Nrf2和血红素氧合酶1(heme oxygenase-1,HO-1)的表达降低,进而增加氧化应激[64]。针刺不仅能够上调ApoE的表达,还能够通过激活Nrf2/HO-1抗氧化信号通路,增强细胞对氧化应激的抵抗能力。同时,针刺还能够抑制炎症相关因子如白细胞介素1β和核转录因子κB(nuclear factor kappa-B,NF-κB)的表达,从而减轻炎症反应,为神经元的再生和修复创造了更有利的环境[66-67]。综上所述,针刺作为一种有效的治疗手段,在脊髓损伤后的抗氧化和抗炎过程中发挥着重要作用,为脊髓损伤的治疗提供了新的思路和策略。见表2。"
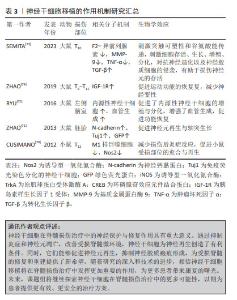
2.4 神经干细胞在脊髓损伤治疗中的神经保护与修复作用 脊髓损伤是由外力导致神经元回路的严重破坏,神经元数量大量减少,并且成年神经元的再生能力有限,从而造成脊髓神经功能缺损。在这种情况下,干细胞移植,尤其是神经干细胞移植,可以促进神经修复、减少神经功能的缺损,成为了治疗脊髓损伤的一种充满希望的方法。现代研究已经揭示了神经干细胞在神经保护方面的关键作用[68]。神经干细胞通过抑制炎症反应和细胞凋亡,为受损神经元提供必要的保护。此外,神经干细胞与内源性吞噬细胞之间的连接偶联有助于建立新的神经通路和清除受损部位的坏死组织,从而促进健康的神经细胞生长和修复,这种连接偶联为脊髓损伤患者带来了新的治疗希望。进一步的研究显示,神经干细胞不仅具有替代丢失的神经元和神经胶质细胞的潜力,而且能够促进轴突的双向生长和形成相互突触,这一过程在损伤后的脊髓分离节段之间建立新的中继连接,对于恢复神经系统的完整性和功能至关重要,为脊髓损伤患者提供了更好的康复前景[69]。 2.4.1 神经干细胞改善受损脊髓微环境,抑制炎症和神经元凋亡 神经干细胞在脊髓损伤治疗中的潜力已得到广泛认可。当神经干细胞迁移至病变区域时,它们能够显著改善受损脊髓的微环境。这一过程不仅通过调节免疫反应来降低炎症和神经元的凋亡,还抑制了继发性损伤,这为神经组织的修复创造了有利条件。此外,神经干细胞还能有效促进内源性神经干细胞的增殖和迁移,加速神经发生和增强神经再生,这些发现进一步证实了神经干细胞在脊髓损伤治疗中的积极作用[5]。CUSIMANO等[70]的研究进一步支持了神经干细胞移植在脊髓损伤治疗中的关键作用,他们发现,通过减少M1巨噬细胞和抑制炎症细胞浸润,神经干细胞有效地减轻了损伤部位的炎症反应,这为损伤脊髓的愈合创造了有利的环境。 2.4.2 神经干细胞促进神经元再生,抑制神经胶质瘢痕形成 神经干细胞移植在治疗脊髓损伤中展现出了巨大的潜力,其作用机制涉及多个层面。首先,神经干细胞能有效抑制神经胶质瘢痕的形成,这是脊髓损伤后阻碍轴突再生和神经功能恢复的关键病理改变,通过减少瘢痕组织的形成,神经干细胞为神经再生创造了更有利的环境。其次,神经干细胞能够替代受损的中枢神经系统神经元,促进新生神经元的生成,从而重建脊髓回路连接,减少凋亡,显著促进神经元的再生[71]。此外,神经干细胞还能改善微循环,为移植细胞的存活和分化提供良好的环境,进一步促进神经修复[72]。在炎症方面,神经干细胞具有抑制炎症的作用,有助于减轻脊髓损伤后的继发性损伤[70]。综上所述,神经干细胞移植通过抑制神经胶质瘢痕形成、促进神经元再生、改善微循环以及抑制炎症等多种机制,为脊髓损伤的治疗提供了新的思路和前景,有望成为未来脊髓损伤治疗的重要方向之一,为更多患者带来希望与康复,见表3。"
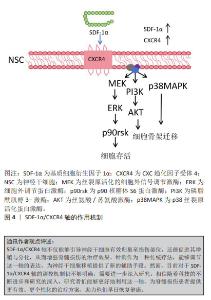
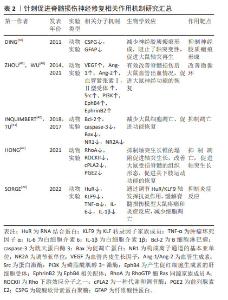
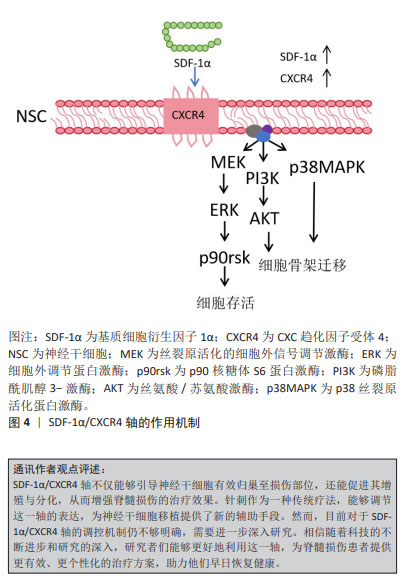
2.5 神经干细胞移植的关键因素——SDF-1α/CXCR4轴 神经干细胞是一种具有自我更新能力的多能干细胞,具有分化为神经元、星形胶质细胞和少突胶质细胞的潜力,足以提供大量神经组织细胞,为脊髓损伤的治疗提供了可能[76]。将神经干细胞移植到损伤部位,可以发挥多方面的治疗作用。首先,神经干细胞能够促进巨噬细胞的极化,从而有效调节炎症和免疫微环境[77];其次,神经干细胞能够分泌神经营养因子,改善受损神经的微环境,并刺激受损轴突实现再生[8];此外,神经干细胞还可以分化为少突胶质细胞,有助于髓鞘的形成,从而促进神经系统的修复和功能恢复[78]。这些作用机制以协同的方式增强神经干细胞移植后受损脊髓的可塑性和组织再生能力。因此,神经干细胞移植在脊髓损伤治疗中具有广阔的应用前景,有望为脊髓损伤患者带来更好的治疗结果。 神经发生是一个复杂的过程,涉及神经干细胞的增殖和分裂,以及定向祖细胞的生成。这些祖细胞会逐渐迁移到功能区域,经历可塑性变化,并与其他神经元建立突触联系,从而发挥神经功能。在这一过程中,SDF-1α/CXCR4信号传导起到了至关重要的作用[8]。SDF-1表达的增加能够促进神经干细胞向损伤部位的迁移,并维持其干细胞特性;此外,神经干细胞能够表达CXCR4,使其沿着SDF-1α的趋化因子梯度进行迁移,在这个过程中,神经干细胞可以与血管、胼胝体和胶质细胞形成支架,进而参与轴突生长、模式形成、突触功能以及重塑的调节[79]。 这些发现为深入理解神经干细胞在脊髓损伤修复中的作用提供了重要的理论依据。尽管神经干细胞移植在脊髓损伤治疗中具有巨大的潜力,但其归巢到损伤部位的效率不理想是限制治疗效果的主要瓶颈[80-81]。因此,提高干细胞归巢效率是干细胞移植治疗脊髓损伤的关键切入点。有研究显示,针刺能够调节SDF-1α/CXCR4轴,进而促进神经球的增殖、迁移和形成[82]。当SDF-1α与CXCR4结合后,引发细胞内信号转导,包括MAPK级联反应的激活,在这个级联反应中,MEK(MAPK/ERK激酶)首先被激活,进而磷酸化并激活其下游的ERK(细胞外信号调节激酶),激活的ERK随后磷酸化并激活P90核糖体S6蛋白激酶(RSK),这一过程涉及细胞存活、凋亡抑制和细胞周期调控,从而有助于神经干细胞的存活和增殖,并增强其归巢至损伤部位的能力。此外,神经干细胞表达的CXCR4是SDF-1α的特异性受体,大量的SDF-1α表达可能作为“路标”,通过二者之间的相互作用动员和引导神经干细胞的归巢[83]。 综上所述,通过深入研究SDF-1α/CXCR4信号传导机制以及如何通过针刺等手段调节这一机制,研究者们可以为脊髓损伤的治疗提供新的策略和思路,有望在未来实现更有效的神经再生和功能恢复,见图4。"
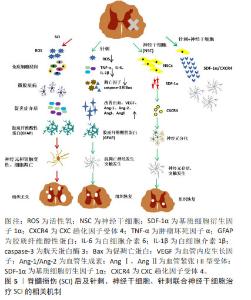
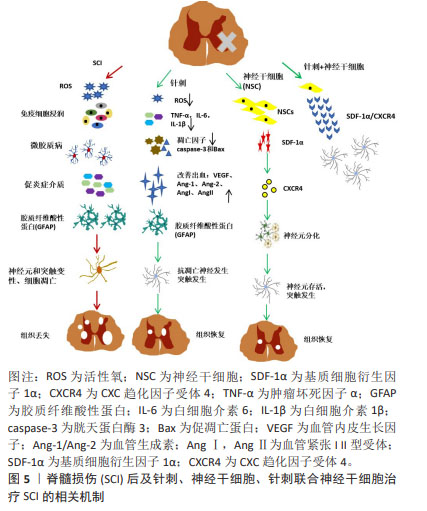
2.6 针刺联合神经干细胞移植疗法治疗脊髓损伤潜力巨大 单纯针刺或神经干细胞移植治疗脊髓损伤都具有巨大的潜力,而当这两种方法联合应用时,其治疗效果更是值得期待。目前,针刺联合神经干细胞移植治疗脊髓损伤已经有了初步的探索性研究,主要集中在以下几个方面:抑制炎性反应、促进神经营养因子的表达、抑制神经细胞凋亡、提高神经干细胞的分化及治疗效率等。 2.6.1 针刺联合神经干细胞的研究进展 有研究显示,针刺与神经干细胞联合治疗确实能产生显著的效果[84]。这一创新策略不仅通过调控凋亡相关蛋白的表达,有效减少了神经细胞的凋亡,还通过改善受损组织的微环境,促进了神经元的再生和轴突的生长[85]。而LI等[86]进一步发现,电针能够促进从人类胚胎干细胞分化而来的内侧神经节隆起神经祖细胞的存活,并显著减轻脑缺血大鼠的学习和记忆障碍。这一积极效果部分归因于肿瘤坏死因子α和白细胞介素1β的表达受到抑制,以及海马体中血管内皮生长因子的表达增加和血管密度的增大,这些改变可以促进血管生成并抑制炎症反应,从而有助于移植的神经祖细胞的存活,并进一步提升移植治疗的疗效。值得一提的是,当针刺应用于受损的脊髓时,它可以诱导NT-3的合成与分泌,这一过程不仅可以显著增强移植到损伤或移植部位的TrkC过表达的神经干细胞和间充质干细胞的存活、分化和迁移能力,还能促使它们与现有的神经元回路进行整合,这一整合过程能够替换受伤的宿主神经元,改善受伤组织周围的微环境,刺激神经纤维的再生和髓鞘的形成;最终,这些改变会增强皮质运动诱发电位,从而恢复瘫痪肢体的运动功能[87-88]。综上所述,将针刺与干细胞移植相结合是脊髓损伤治疗的一种创新策略,具有巨大的临床应用潜力,值得进一步开发与测试。 2.6.2 针刺联合神经干细胞移植疗法的协同机制 神经干细胞移植治疗脊髓损伤的核心在于其分化成神经元以修复受损的神经环路。电针作为传统物理疗法,通过穴位刺激可调节机体的神经内分泌系统,进而促进内源性神经干细胞的增殖与分化,与神经干细胞移植结合时,电针能够进一步激活移植部位的微环境,为神经干细胞的存活、增殖和分化创造有利条件。ZHAO等[89]研究发现,当与神经干细胞移植结合时,电针能够进一步激活移植部位的微环境,为神经干细胞的存活和分化提供了必要的营养和生长因子。这种联合作用加速了神经干细胞向神经元的分化,更有效地补充了受损脊髓部位的神经元,促进了神经环路的重建。此外,电针还能改善损伤部位的血液循环,减轻炎症反应和水肿,为神经干细胞的移植和分化提供稳定环境,并促进移植的神经干细胞与宿主组织的融合及神经再生。同时,电针调节神经递质释放,改善神经传导功能,与神经干细胞移植结合,共同促进新神经环路的形成和受损脊髓功能的恢复。卫哲[90]研究发现,早期电针刺激能够促进星形胶质细胞的活化,发挥其神经保护作用;而在后期,电针能够抑制胶质纤维酸性蛋白的免疫反应性,促进神经功能的重塑,进一步改善神经传导和运动功能。JIN等[19]研究发现,电针治疗可以通过增加NT-3水平,并激活NT-3/TRKC/AKT通路来增强神经元的存活、神经元分化和突触连接;当电针联合神经干细胞治疗时,这种效果更为明显。这种联合治疗能够促进宿主轴突再生进入损伤/移植部位,重建与移植神经网络的突触连接,这有助于部分恢复脊髓神经回路,最终改善脊髓的神经传导以及瘫痪后肢的运动功能。 综上所述,电针联合神经干细胞治疗的协同机制在于通过电针调节神经内分泌系统、改善局部微环境和神经传导功能,结合神经干细胞移植直接补充受损神经元,共同促进神经环路的重建和功能恢复。这种联合治疗方法充分发挥了两者的优势,为脊髓损伤患者提供了更有效的康复策略。 2.6.3 针刺增强SDF-1α/CXCR4轴作用,促进神经干细胞移植和分化效率 SDF-1α/CXCR4轴在神经干细胞移植过程中发挥关键作用,能够促进神经干细胞迁移至病变部位[8],对于其的深入研究可以作为提高神经干细胞移植效率的切入点。脊髓损伤模型相关研究发现,针刺可通过激活SDF-1α/CXCR4轴促进外源性神经干细胞迁移至损伤组织,提高神经干细胞移植的治疗效率[91]。还有相关基础研究表明,电针可通过调控SDF-1α/CXCR4轴改善脊髓损伤模型大鼠的神经功能,促进神经干细胞迁移分化[83]。如果在神经干细胞移植治疗脊髓损伤的早期介入针刺疗法,针刺可以激活脊髓损伤损伤部位中星形胶质细胞和少突胶质细胞,促进SDF-1在神经干细胞中的聚集,从而增强神经干细胞表达的CXCR4的梯度迁移,这可以发挥靶向治疗作用,促进轴突生长和突触功能的重塑,进一步提高单纯神经干细胞移植治疗脊髓损伤的效率及临床转化能力。总体来说,针刺通过调节SDF-1α/CXCR4轴促进干细胞的归巢作用,发挥干细胞自身的修复功能。这不仅能抑制损伤部位的继发性损伤级联反应、降低星形胶质细胞的活化、减少小胶质细胞的激活、调节炎性因子的表达、抑制炎性信号通路,还能促进神经细胞的修复、降低神经元和神经胶质的凋亡。这一科学依据为针刺联合神经干细胞治疗脊髓损伤提供了有力的支持,见图5。 2.6.4 针刺联合神经干细胞治疗脊髓损伤的临床应用前景 近年来,针刺治疗脊髓损伤的临床应用逐渐受到医学界的关注,其独特的疗效已在多项研究中得到证实。针刺作为传统中医疗法,其疗效在脊髓损伤治疗中得到了多方面的验证。无论是芒针还是毫针,亦或是超声引导下的电针刺激,都展现出了在促进神经功能恢复方面的显著效果[92-93]。通过刺激穴位,针刺能够调节机体的神经内分泌系统,进而促进神经干细胞的增殖与分化,加速损伤部位的神经再生。与此同时,神经干细胞治疗脊髓损伤的研究也取得了长足进展。从人类神经干/祖细胞到中枢神经系统干细胞,这些细胞移植治疗不仅显示了良好的安全性和耐受性,还有助于受损脊髓的神经功能恢复,这些研究成果为脊髓损伤的修复提供了新的希望[94-95]。值得注意的是,当针刺与神经干细胞移植联合应用时,二者能够发挥协同效应,进一步提高治疗效果。这种联合疗法不仅加速了神经干细胞的增殖和分化,还促进了移植细胞的存活和与宿主组织的融合,从而更有效地补充了受损脊髓部位的神经元,促进了神经环路的重建[7,96]。然而,尽管针刺对神经干细胞增殖分化的影响已有较多研究,但关于神经干细胞联合针刺治疗脊髓损伤的研究仍然较少。因此,日后研究应该侧重于针刺联合神经干细胞移植的临床应用细节、疗效评估指标、并发症和长期转归等,以期为患者提供更有效、更安全的治疗方法,促进他们的神经修复和功能恢复。"
| [1] 刘培培,贾露露,牛向宝,等.温阳通利灸联合膀胱功能训练治疗脊髓损伤后神经源性膀胱尿潴留临床研究[J].实用中医内科杂志, 2023,37(9):152-156. [2] 郭宁,秦合伟,李彦杰,等.近5年电针治疗脊髓损伤后神经源性膀胱机制研究进展[J].中国中医药信息杂志,2022,29(9):153-156. [3] 毛治杰,罗珊,刘蓉,等.针刺治疗脊髓损伤后神经源性膀胱随机对照试验Meta分析[J].亚太传统医药,2023,19(3):149-156. [4] HOSSEII SM, BORYS B, KARIMI-ABDOLZAEE S. Neural stem cell therapies for spinal cord injury repair: an update on recent preclinical and clinical advances. Brain. 2024;147(3):766-793. [5] 何宛俞,程乐平.干细胞移植修复脊髓损伤的策略与进展[J].中国组织工程研究,2024,28(19):3090-3096. [6] AHUJA CS, NORI S, TETREAULT L, et al. Traumatic spinal cord injury-repair and regeneration. Neurosurgery. 2017;80(3S):S9-S22. [7] 吴明莉,段昭远,常文涛,等.电针督脉对脊髓损伤大鼠脊髓组织线粒体融合及神经干细胞增殖分化的影响[J].针刺研究,2024, 49(2):119-126. [8] 吴成林,郭德华,许洋,等.基于JAK2/STAT3信号通路探讨补阳还五汤联合骨髓间质干细胞移植治疗大鼠脊髓损伤的机制[J].时珍国医国药,2023,34(7):1543-1546. [9] 刘成贺,刘强,王攀,等.SDF-1α/CXCR4轴在脊髓损伤干细胞治疗中的作用研究进展[J].山东医药,2023,63(19):107-110. [10] JU D, DONG C. The combined application of stem cells and three-dimensional bioprinting scaffolds for the repair of spinal cord injury. Neural Regen Res. 2024;19(8):1751-1758. [11] ZHANG J, XU J, LI S, et al. Electroacupuncture relieves HuR/KLF9-mediated inflammation to enhance neurological repair after spinal cord injury. eNeuro. 2023;10(11):ENEURO.0190-23.2023. [12] 管遵惠.针刺治疗脊髓损伤3则[J].云南中医学院学报,1992(1): 17-19. [13] WEISS S, DUNNE C, HEWSON J, et al. Multipotent CNS stem cells are present in the adult mammalian spinal cord and ventricular neuroaxis. J Neurosci. 1996;16(23):7599-7609. [14] LIU Z, DING Y, ZENG YS. A new combined therapeutic strategy of governor vessel electro-acupuncture and adult stem cell transplantation promotes the recovery of injured spinal cord. Curr Med Chem. 2011;18(33):5165-5171. [15] 刘建敏,王福川,周亚净,等.电针刺激对神经干细胞移植治疗脊髓损伤大鼠后肢功能的影响[J].中国组织工程研究,2015,19(50): 8132-8138. [16] 何克林,孙连珠,张柳娟,等.夹脊电针对急性脊髓损伤大鼠神经干细胞分化趋势的影响[J].中华中医药学刊,2016,34(12): 2849-2851. [17] ZHU Y, WU Y, ZHANG R. Electro-acupuncture promotes the proliferation of neural stem cells and the survival of neurons by downregulating miR-449a in rat with spinal cord injury. Excli J. 2017;16:363-374. [18] 王喜良,赵岩,肖宇龙.神经干细胞移植治疗人脊髓损伤的临床应用研究[J].世界最新医学信息文摘,2018,18(30):14-15, 17. [19] JIN H, ZHANG YT, YANG Y, et al. Electroacupuncture facilitates the integration of neural stem cell-derived neural network with transected rat spinal cord. Stem Cell Reports. 2019;12(2):274-289. [20] LI F, WANG H, CHEN H, et al. Mechanism of ferroptosis and its role in spinal cord injury. Front Neurol. 2022;13:926780. [21] 杨迎暴,朴英杰.白藜芦醇对脊髓损伤后继发性脊髓水肿,乳酸脱氢酶及ATP酶活性的影响[J].中国药理学通报,2002,18(5):539-543. [22] 朱天胜,金伟,倪红斌,等.N-乙酰半胱氨酸对大鼠急性脊髓损伤后继发性脊髓损伤的保护作用[J].江苏医药,2013,39(10):1124-1126, 1112. [23] 曹园,易成腊,潘睿,等.脱氢表雄酮对大鼠脊髓损伤后继发性炎症反应的影响及其机制[J].山东医药,2015,55(13):22-24. [24] 刘明,杭春华,蔡智基,等.Necrostatin-1在小鼠脊髓损伤后继发性损伤中的作用[J].中国临床神经外科杂志,2018,23(6):419-422. [25] 曾欢欢,黄英如,李子健,等.大黄素对大鼠急性脊髓损伤后继发脊髓水肿的影响[J].中国康复理论与实践,2018,24(4):378-384. [26] 李坚,李刚,郭卫东,等.TGN-020对大鼠脊髓损伤后继发性水肿和星形胶质细胞增生的影响[J].西安交通大学学报(医学版),2018, 39(5):685-690,718. [27] 陈剑平,廖祥萍,李正南,等.芍药苷基于IKK/NF-κB信号通路对大鼠脊髓损伤后继发性损害的保护作用[J].广东医学,2019,40(18): 2578-2582. [28] 李沐,郭燕春,洪伟达.孕酮对脊髓外伤动物模型的治疗作用及其调控c-myc以拮抗脊髓外伤后继发性损伤[J].中国处方药,2022, 20(3):19-22. [29] SORGE RE, SI Y, NORIAN LA, et al. Inhibition of the RNA regulator HuR by SRI-42127 attenuates neuropathic pain after nerve injury through suppression of neuroinflammatory responses. Neurotherapeutics. 2022;19(5):1649-1661. [30] KWAN T, FLOYD CL, PATEL J, et al. Astrocytic expression of the RNA regulator HuR accentuates spinal cord injury in the acute phase. Neurosci Lett. 2017;651:140-145. [31] BORGONETTI V, GALEOTTI N. Intranasal delivery of an antisense oligonucleotide to the RNA-binding protein HuR relieves nerve injury-induced neuropathic pain. Pain. 2021;162(5):1500-1510. [32] MAMET J, KLUKINOV M, HARRIS S, et al. Intrathecal administration of AYX2 DNA-decoy produces a long-term pain treatment in rat models of chronic pain by inhibiting the KLF6, KLF9 and KLF15 transcription factors. Mol Pain. 2017;13:1744806917727917. [33] QU R, LIU J, FENG L, et al. Down-regulation of KLF9 ameliorates LPS-caused acute lung injury and inflammation in mice via reducing GSDMD expression. Autoimmunity. 2022;55(8):587-596. [34] APARA A, GALVAO J, WANG Y, et al. KLF9 and JNK3 Interact to Suppress Axon Regeneration in the Adult CNS. J Neurosci. 2017;37(40):9632-9644. [35] ZHANG HM, LUO D, CHEN R, et al. Research progress on acupuncture treatment in central nervous system diseases based on NLRP3 inflammasome in animal models. Front Neurosci. 2023;17:1118508. [36] ABBASZADEH F, FAKHRI S, KHAN H. Targeting apoptosis and autophagy following spinal cord injury: therapeutic approaches to polyphenols and candidate phytochemicals. Pharmacol Res. 2020;160:105069. [37] SHI Z, YUAN S, SHI L, et al. Programmed cell death in spinal cord injury pathogenesis and therapy. Cell Prolif. 2021;54(3):e12992. [38] 赵继荣,蔡毅,陈文,等.中药治疗脊髓损伤相关机制研究进展[J].中华中医药学刊,2021,39(8):5-9. [39] 许明,艾坤,卓越,等.电针对骶上脊髓损伤后神经源性膀胱大鼠尿流动力学及脊髓组织ERK/CREB/Bcl-2通路表达的影响[J].中国中医药信息杂志,2024,31(4):100-105. [40] INQUIMBERT P, MOLL M, LATREMOLIERE A, et al. NMDA receptor activation underlies the loss of spinal dorsal horn neurons and the transition to persistent pain after peripheral nerve injury. Cell Rep. 2018;23(9):2678-2689. [41] TU WZ, CHEN WC, XIA W, et al. The regulatory effect of electro-acupuncture on the expression of NMDA receptors in a SCI rat model. Life Sci. 2017;177:8-14. [42] 李建花,罗林钊,邓强,等.中药治疗脊髓损伤后血-脊髓屏障功能障碍机制的研究进展[J].中医研究,2023,36(12):84-88 [43] 周逸敏,李宗洋,许翰勋,等.中药改善脊髓微环境修复血-脊髓屏障的机制研究进展[J].中医骨伤科杂志,2023,31(9):80-83. [44] YEH BY, CHAO YL, CHEN YS, et al. Effect of acupuncture on capillary refill time in healthy adults: a clinical study. Microvasc Res. 2021;135: 104135. [45] ZHOU HJ, TANG T, ZHONG JH, et al. Electroacupuncture improves recovery after hemorrhagic brain injury by inducing the expression of angiopoietin-1 and -2 in rats. BMC Complement Altern Med. 2014;14:127. [46] WU Y, HU R, ZHONG X, et al. Electric acupuncture treatment promotes angiogenesis in rats with middle cerebral artery occlusion through EphB4/EphrinB2 mediated Src/PI3K signal pathway. J Stroke Cerebrovasc Dis. 2021;30(3):105165. [47] HONG ES, YAO HH, MIN YJ, et al. The mechanism of electroacupuncture for treating spinal cord injury rats by mediating Rho/Rho-associated kinase signaling pathway. J Spinal Cord Med. 2021;44(3):364-374. [48] 潘志鹏,李思成,姚黎清.星形胶质细胞演变及相关信号通路对脊髓损伤后胶质瘢痕调节作用的研究进展[J].山东医药,2022, 62(16):104-107. [49] TRAN AP, WARREN PM, SILVER J. The biology of regeneration failure and success after spinal cord injury. Physiol Rev. 2018;98(2):881-917. [50] DING Y, YAN Q, RUAN JW, et al. Bone marrow mesenchymal stem cells and electroacupuncture downregulate the inhibitor molecules and promote the axonal regeneration in the transected spinal cord of rats. Cell Transplant. 2011;20(4):475-491. [51] 尚文雅,任亚锋,李冰,等.脊髓损伤后细胞焦亡调控机制及治疗策略[J].中国组织工程研究,2024,28(11):1772-1779. [52] 吴永萌,马宁,李国婧,等.胶质纤维酸性蛋白在脑损伤中作用的研究进展[J].中西医结合心脑血管病杂志,2024,22(5):852-856. [53] 杨成,谭程方,杨祝歆,等.电针联合细胞移植对脊髓损伤大鼠轴突再髓鞘化的作用及神经调节蛋白Nrg1的影响[J].针刺研究, 2021,46(12):987-995. [54] ZHANG M, DAI Q, LIANG D, et al. Involvement of adenosine A1 receptor in electroacupuncture-mediated inhibition of astrocyte activation during neuropathic pain. Arq Neuropsiquiatr. 2018;76(11):736-742. [55] XU J, CHENG S, JIAO Z, et al. Fire needle acupuncture regulates Wnt/ERK multiple pathways to promote neural stem cells to differentiate into neurons in rats with spinal cord injury. CNS Neurol Disord Drug Targets. 2019;18(3):245-255. [56] 赵继荣,蒋鹏,薛旭,等.人参皂苷抗脊髓损伤作用机制的研究进展[J/OL].中华中医药学刊,1-14[2024-04-09]. http://kns.cnki.net/kcms/detail/21.1546.R.20240307.1045.010.html. [57] HAMANN K, SHI R. Acrolein scavenging: a potential novel mechanism of attenuating oxidative stress following spinal cord injury. J Neurochem. 2009;111(6):1348-1356. [58] CHENG M, WU X, WANG F, et al. Electro-acupuncture inhibits p66Shc-mediated oxidative stress to facilitate functional recovery after spinal cord injury. J Mol Neurosci. 2020;70(12):2031-2040. [59] 尹刚,申国明,江爱娟,等.基于PKCβ/P66shc信号通路探讨针刺干预肥胖糖尿病大鼠氧化应激的作用机制[J].针刺研究,2021, 46(8):642-648, 678. [60] 张仙宏,魏萌萌,袁冬冬,等.转录因子FOXOs家族调控肿瘤生物学功能的研究进展[J].生理学报,2022,74(5):843-855. [61] WANG C, ZHANG L, NDONG JC, et al. Progranulin deficiency exacerbates spinal cord injury by promoting neuroinflammation and cell apoptosis in mice. J Neuroinflammation. 2019;16(1):238. [62] ALIZADEH A, DYCK SM, KARIMI-ABDOLREZAEE S. Traumatic spinal cord injury: an overview of pathophysiology, models and acute injury mechanisms. Front Neurol. 2019;10:282. [63] 杨语晗,许明军,穆敬平.电针通过调节Notch3信号通路改善大脑中动脉闭塞小鼠海马神经元凋亡的作用机制[J].中西医结合心脑血管病杂志,2023,21(24):4530-4535. [64] YANG X, CHEN S, SHAO Z, et al. Apolipoprotein E deficiency exacerbates spinal cord injury in mice: inflammatory response and oxidative stress mediated by NF-κB signaling pathway. Front Cell Neurosci. 2018; 12:142. [65] MOLAGODA IMN, LEE KT, CHOI YH, et al. Anthocyanins from hibiscus syriacus l. inhibit oxidative stress-mediated apoptosis by activating the Nrf2/HO-1 signaling pathway. Antioxidants (Basel). 2020;9(1):42. [66] DAI N, TANG C, LIU H, et al. Effect of electroacupuncture on inhibition of inflammatory response and oxidative stress through activating ApoE and Nrf2 in a mouse model of spinal cord injury. Brain Behav. 2021;11(9):e2328. [67] LI X, YIN C, HU Q, et al. Nrf2 Activation mediates antiallodynic effect of electroacupuncture on a rat model of complex regional pain syndrome type-i through reducing local oxidative stress and inflammation. Oxid Med Cell Longev. 2022;2022:8035109. [68] 王素平,钟亮,兰小磊,等.hUC-MSCs源性神经干细胞样细胞对大鼠脑缺血再灌注损伤的保护作用[J].青岛大学学报(医学版), 2023,59(5):709-713. [69] LU P, KADOYA K, TUSZYNSKI MH. Axonal growth and connectivity from neural stem cell grafts in models of spinal cord injury. Curr Opin Neurobiol. 2014;27:103-109. [70] CUSIMANO M, BIZIATO D, BRAMBILLA E, et al. Transplanted neural stem/precursor cells instruct phagocytes and reduce secondary tissue damage in the injured spinal cord. Brain. 2012;135(Pt 2):447-460. [71] ZHAO J, SUN W, CHO HM, et al. Integration and long distance axonal regeneration in the central nervous system from transplanted primitive neural stem cells. J Biol Chem. 2013;288(1):164-168. [72] 岳倩文,夏铂.神经干细胞在脊髓损伤修复机制中的实验研究进展[J].贵州医药,2020,44(6):859-862. [73] SEMITA IN, UTOMO DN, SUROTO H, et al. The mechanism of human neural stem cell secretomes improves neuropathic pain and locomotor function in spinal cord injury rat models: through antioxidant, anti-inflammatory, anti-matrix degradation, and neurotrophic activities. Korean J Pain. 2023;36(1):72-83. [74] ZHAO XM, HE XY, LIU J, et al. Neural stem cell transplantation improves locomotor function in spinal cord transection rats associated with nerve regeneration and IGF-1 R expression. Cell Transplant. 2019; 28(9-10):1197-1211. [75] RYU S, LEE SH, KIM SU, et al. Human neural stem cells promote proliferation of endogenous neural stem cells and enhance angiogenesis in ischemic rat brain. Neural Regen Res. 2016;11(2): 298-304. [76] 仇静茹,林志,霍桂桃,等.神经干细胞移植治疗神经系统疾病的研究进展[J].药物评价研究,2023,46(12):2724-2728. [77] JI Z, JIANG X, LI Y, et al. Neural stem cells induce M2 polarization of macrophages through the upregulation of interleukin-4. Exp Ther Med. 2020;20(6):148. [78] SANKAVARAM SR, HAKIM R, COVACU R, et al. Adult neural progenitor cells transplanted into spinal cord injury differentiate into oligodendrocytes, enhance myelination, and contribute to recovery. Stem Cell Reports. 2019;12(5):950-966. [79] SANCHEZ AB, MEDDERS KE, MAUNG R, et al. CXCL12-induced neurotoxicity critically depends on NMDA receptor-gated and L-type Ca2+ channels upstream of p38 MAPK. J Neuroinflammation. 2016; 13(1):252. [80] NI W, RAMALINGAM M, LI Y, et al. Immunomodulatory and anti-inflammatory effect of neural stem/progenitor cells in the central nervous system. Stem Cell Rev Rep. 2023;19(4):866-885. [81] SONG AT, SINDEAUX RHM, LI Y, et al. Developmental role of macrophages modeled in human pluripotent stem cell-derived intestinal tissue. Cell Rep. 2024;43(1):113616. [82] 王泽然,巴特,桑博默,等.针灸干预神经干细胞治疗缺血性脑卒中机制探析[J].针灸临床杂志,2023,39(1):1-5. [83] STEWART AN, KENDZIORSKI G, DEAK ZM, et al. Co-transplantation of mesenchymal and neural stem cells and overexpressing stromal-derived factor-1 for treating spinal cord injury. Brain Res. 2017;1672:91-105. [84] 介小素,侯玉晋.针刺联合神经干细胞移植对脑性瘫痪幼鼠模型的作用机制[J].中国组织工程研究,2015,19(45):7309-7313. [85] 饶芳,林斌,钟伟平.穴位针刺和神经干细胞联合治疗实验性大脑中动脉闭塞性脑缺血损伤的机制研究[J].黑龙江医学,2020,44(7): 886-888. [86] LI J, CHEN L, LI D, et al. Electroacupuncture promotes the survival of the grafted human mge neural progenitors in rats with cerebral ischemia by promoting angiogenesis and inhibiting inflammation. Neural Plast. 2021;2021:4894881. [87] ZHANG YT, JIN H, WANG JH, et al. Tail nerve electrical stimulation and electro-acupuncture can protect spinal motor neurons and alleviate muscle atrophy after spinal cord transection in rats. Neural Plast. 2017;2017:7351238. [88] ZENG YS, DING Y, XU HY, et al. Electro-acupuncture and its combination with adult stem cell transplantation for spinal cord injury treatment: a summary of current laboratory findings and a review of literature. CNS Neurosci Ther. 2022;28(5):635-647. [89] ZHAO L, LIU JW, KAN BH, et al. Acupuncture accelerates neural regeneration and synaptophysin production after neural stem cells transplantation in mice. World J Stem Cells. 2020;12(12):1576-1590. [90] 卫哲.电针对脊髓损伤后小鼠神经功能重塑的机制研究[J].上海针灸杂志,2017,36(5):608-613. [91] CHEN Y, WEI Y, LIU J, et al. Chemotactic responses of neural stem cells to SDF-1α correlate closely with their differentiation status. J Mol Neurosci. 2014;54(2):219-233. [92] 张灿,全仁夫,柴乐,等.芒针针刺秩边、水道对脊髓损伤患者尿潴留的影响[J].中国针灸,2019,39(4):359-363. [93] SONG XZ, CHU XL, LIU T, et al. Case report: ultrasound-guided multi-site electroacupuncture stimulation for a patient with spinal cord injury. Front Neurol. 2022;13:903207. [94] SHIN JC, KIM KN, YOO J, et al. Clinical trial of human fetal brain-derived neural stem/progenitor cell transplantation in patients with traumatic cervical spinal cord injury. Neural Plast. 2015;2015:630932. [95] LEVI AD, OKONKWO DO, PARK P, et al. Emerging safety of intramedullary transplantation of human neural stem cells in chronic cervical and thoracic spinal cord injury. Neurosurgery. 2018;82(4):562-575. [96] DENG Q, MA L, YANG Y, et al. Effect of electroacupuncture stimulation on proliferation and differentiation of endogenous neural stem cells in rats with spinal cord injury. Mol Neurobiol. 2024;61(2):635-645. |
| [1] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [2] | Li Huayuan, Li Chun, Liu Junwei, Wang Ting, Li Long, Wu Yongli. Effect of warm acupuncture on PINK1/Parkin pathway in the skeletal muscle of rats with chronic fatigue syndrome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1618-1625. |
| [3] | Chi Wenxin, Zhang Cunxin, Gao Kai, Lyu Chaoliang, Zhang Kefeng. Mechanism by which nobiletin inhibits inflammatory response of BV2 microglia [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1321-1327. |
| [4] | Zhao Ruihua, Chen Sixian, Guo Yang, Shi Lei, Wu Chengjie, Wu Mao, Yang Guanglu, Zhang Haoheng, Ma Yong. Wen-Shen-Tong-Du Decoction promoting spinal cord injury repair in mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1118-1126. |
| [5] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [6] | He Guanghui, Yuan Jie, Ke Yanqin, Qiu Xiaoting, Zhang Xiaoling. Hemin regulates mitochondrial pathway of oxidative stress in mouse chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1183-1191. |
| [7] | He Bo, Chen Wen, Ma Suilu, He Zhijun, Song Yuan, Li Jinpeng, Liu Tao, Wei Xiaotao, Wang Weiwei, Xie Jing . Pathogenesis and treatment progress of flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1230-1238. |
| [8] | Zhi Fang, Zhu Manhua, Xiong Wei, Lin Xingzhen. Analgesic effect of acupuncture in a rat model of lumbar disc herniation [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 936-941. |
| [9] | Wang Rongrong, Huang Yushan, Li Xiangmiao, Bai Jinzhu. Prostaglandin E1 regulates vascular-related factors and protects microcirculatory function during the acute phase of traumatic spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 958-967. |
| [10] | Lu Ranran, Zhou Xu, Zhang Lijie, Yang Xinling. Dimethyl fumarate alleviates nerve damage in a mouse model of Parkinson’s disease [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 989-994. |
| [11] | Yang Bin, Tao Guangyi, Yang Shun, Xu Junjie, Huang Junqing . Visualization analysis of research hotspots of artificial intelligence in field of spinal cord nerve injury and repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 761-770. |
| [12] | Sima Xinli, Liu Danping, Qi Hui. Effect and mechanism of metformin-modified bone marrow mesenchymal stem cell exosomes on regulating chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7728-7734. |
| [13] | Guo Jia, Ren Yafeng, Li Bing, Huang Jing, Shang Wenya, Yang Yike, Liu Huiyao. Action mechanism of mesenchymal stem cell-derived exosomes carrying miRNAs in improving spinal cord injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7827-7838. |
| [14] | Zheng Yitong, Wang Yongxin, Liu Wen, Amujite, Qin Hu. Action mechanism of intrathecal transplantation of human umbilical cord mesenchymal stem cell-derived exosomes for repair of spinal cord injury under neuroendoscopy [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7743-7751. |
| [15] | Zhu Chuanxi, Qiu Long, Li Lingxu, Ji Guangcheng. Chinese herbal prescription combined with head acupuncture exercise therapy improves limb spasticity in rats with ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7571-7577. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||



