Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (1): 147-155.doi: 10.12307/2024.744
Previous Articles Next Articles
Mechanism of postoperative abdominal adhesion formation and therapeutic prospect of mesenchymal stem cell exosomes
Zhang Xingzhou1, Wei Ming2, Dong Guoqiang1, Du Wei3, Luo Yiwen4, Zhang Nan1
- 1Department of Gastrointestinal Surgery, 2Department of Obstetrics and Gynecology, Tianjin Nankai Hospital, Tianjin 300100, China; 3Tianjin Key Laboratory of Blood Cell Therapy Technology, Tianjin 300100, China; 4Clinical College of Tianjin Medical University, Tianjin 300270, China
-
Received:2023-09-28Accepted:2023-12-14Online:2025-01-08Published:2024-05-20 -
Contact:hang Nan, MD, Chief physician, Master’s supervisor, Department of Gastrointestinal Surgery, Tianjin Nankai Hospital, Tianjin 300100, China -
About author:Zhang Xingzhou, Master, Attending physician, Department of Gastrointestinal Surgery, Tianjin Nankai Hospital, Tianjin 300100, China Wei Ming, Master, Attending physician, Department of Obstetrics and Gynecology, Tianjin Nankai Hospital, Tianjin 300100, China Zhang Xingzhou and Wei Ming contributed equally to this article. -
Supported by:Research Project on the Integration of Traditional Chinese Medicine and Western Medicine by Tianjin Municipal Health Commission and Tianjin Administration of Traditional Chinese Medicine, No. 2023167 (to ZXZ)
CLC Number:
Cite this article
Zhang Xingzhou, Wei Ming, Dong Guoqiang, Du Wei, Luo Yiwen, Zhang Nan . Mechanism of postoperative abdominal adhesion formation and therapeutic prospect of mesenchymal stem cell exosomes[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(1): 147-155.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

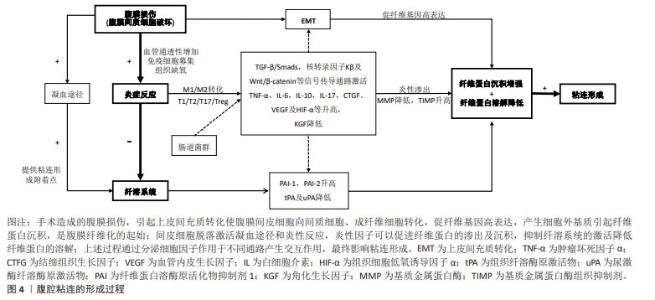
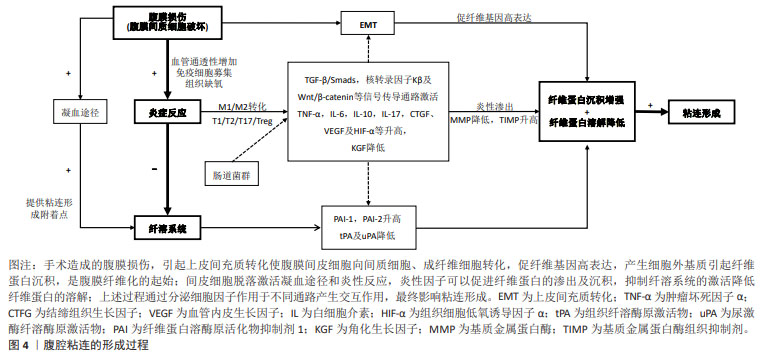
2.1.1 腹膜间皮细胞的作用 腹膜包括壁层腹膜和脏层腹膜,壁层位于腹壁、盆腔壁和膈的内面,脏层位于腹腔脏器表面。腹膜由单层间皮细胞、基底膜层和结缔组织层构成。腹膜间皮细胞呈单层被覆于腹膜表面,其完整性及功能影响粘连的形成,腹膜受损使间皮细胞发生气球样变,从基底膜上脱落,形成片状的“裸露区”是粘连形成提供了附着点。除完整性外,腹膜功能的改变也具有重要意义,腹膜间皮细胞发生上皮间充质转化(epithelial-mesenchymal transition,EMT)使腹膜间皮细胞向间质细胞、成纤维细胞转化,产生大量胶原蛋白、纤维连接蛋白等细胞外基质,是腹膜纤维化的起始,是术后粘连的关键,具有一定可逆性[4-5]。 2.1.2 炎症反应的作用 在急性炎症反应阶段,腹膜间皮细胞和腹腔单核细胞释放大量细胞因子,使血管的通透性增加,形成炎性渗出形成纤维蛋白凝块,抑制纤溶系统及MMP等活性,使纤维蛋白凝块的生成与溶解平衡破坏。巨噬细胞具有在炎性因子诱导下进行分化即极化的特点,在干扰素y、肿瘤坏死因子α和脂多糖等致炎因子刺激下极化为典活化巨噬细胞(M1型),产生白细胞介素,包括白细胞介素1、白细胞介素6及诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等在内的炎性因子,介导炎症反应和辅助性T细胞1(Th1) 的免疫应答,在粘连组织中促炎性因子水平升高。巨噬细胞在细胞因子白细胞介素4或白细胞介素13诱导下产生替代性活化巨噬细胞 (M2型),通过释放白细胞介素4、白细胞介素10和白细胞介素13等免疫调节因子在抗炎和修复过程中发挥作用。M2型巨噬细胞释放转化生长因子β、血管内皮生长因子和表皮生长因子等,促进2型辅助T细胞(Th2)发挥作用,促进炎症的消除、组织修复,因此过度的M2会使组织纤维化形成粘连[6-7]。T淋巴细胞 17(Th17)/调节性T淋巴细胞(Treg)平衡也影响着免疫炎症反应,Th17细胞分泌促炎因子白细胞介素6、白细胞介素17A,诱导炎症级联反应,Treg 细胞分泌抗炎因子 白细胞介素10、转化生长因子β[8-9]。因此M1/M2及T1/T2/T17/Treg的动态转化在粘连形成的过程中协同作用。有研究表明肠道微生态并通过TLR4 (Toll样受体4)/TRIF(含tir结构域的适配器诱导干扰素β)途径增强了白细胞的黏附,影响腹腔的炎症反应,从而调节腹腔纤维化基因的表达[10]。 2.1.3 纤溶系统的作用 纤维蛋白的形成和溶解是一个动态平衡的过程,正常情况下,凝固的纤维蛋白在72-96 h内被纤溶酶溶解,但是腹膜发生损伤后,毛细血管通透性增高,局部纤维蛋白、纤维连接蛋白、血小板、淋巴细胞和中性粒细胞渗出;缺氧及局部刺激激活巨噬细胞、肥大细胞、成纤维细胞和血小板,释放大量生物活性物质促进成纤维细胞的增生,纤维蛋白生成、胶状物的沉积[5]。纤溶系统激活,无活性的纤溶酶原被组织纤溶酶原激活物(tissue plasminogen activator,tPA)或尿激酶纤溶酶原激活物(urokinase plasminogen activator,uPA)转变为有活性的纤溶酶,后者即可降解纤维蛋白和纤维蛋白原,从而阻碍细胞外基质中纤维胶状物的形成,因此纤维蛋白沉积和纤维蛋白溶解之间的失衡,是腹腔粘连形成中的关键[6]。腹膜间皮细胞损伤时,tPA及uPA 释放减少,纤维蛋白溶酶原活化物抑制剂1(plasminogen activator inhibitor-1,PAI-1)、纤维蛋白溶酶原活化物抑制剂2(PAI-2)释放增加,纤维蛋白溶解障碍,细胞外基质生成堆积[5],虽然正常情况下细胞外基质又可以被MMP-1 降解,但炎症反应使MMP-1释放减少,拮抗物基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinase,TIMP)释放增加,抑制细胞外基质的降解[3,5],最终导致腹腔粘连形成。 2.2 腹腔粘连相关的细胞因子 2.2.1 肿瘤坏死因子α 肿瘤坏死因子α由单核细胞、巨噬细胞和T细胞产生,一方面,肿瘤坏死因子α与肿瘤坏死因子受体2(tumor necrosis factor receptor2,TNFR2)的结合,可以激活核转录因子kB信号通路,上调炎症因子白细胞介素6、白细胞介素8的表达,介导粘连局部炎性失衡,促使术后腹腔粘连发生;另一方面,肿瘤坏死因子α促进成纤维细胞的增殖,刺激腹膜间皮细胞促进PAI-1的合成,抑制纤溶组织溶解。有研究明确表明在腹部手术后患者血清肿瘤坏死因子α水平与粘连形成的严重程度相关,在大鼠动物模型中术前抑制肿瘤坏死因子α活性或阻断相关受体可降低腹膜粘连的程度,总之肿瘤坏死因子α是腹腔粘连形成的重要标志[11]。 2.2.2 白细胞介素 是由淋巴细胞和巨噬细胞分泌的一类细胞因子,在免疫炎症反应中发挥重要作用,可刺激免疫细胞活化、增殖及分化,调节M1/M2、T1/T2/T17/Treg的转化,与多个细胞因子及信号通路相互作用 [11]。白细胞介素1可以调节纤维蛋白沉积和溶解,刺激成纤维细胞增殖,是粘连形成的可靠生物学标志,抗白细胞介素1β抗体能够有效减少术后腹腔粘连的发生。白细胞介素 6可促进炎性细胞和纤维在损伤部位聚集,促进粘连病理进程,诱导粘连发生发展。而白细胞介素17可上调促炎因子白细胞介素6的分泌,在术后腹腔粘连的形成过程中发挥重要作用[8,12]。 2.2.3 生长因子 是一类细胞因子。其中,结缔组织生长因子(connective tissue growth factor,CTGF)是由成纤维细胞、血管内皮细胞和间充质细胞产生和分泌,受到转化生长因子β1 的调控,是Hippo通路的下游效应因子,是众多纤维化疾病治疗的新靶点,在大鼠术后腹腔粘连组织中发现 CTGF 水平也显著升高,研究表明刺激转化生长因子β1可使CTGF表达显著上调,促进组织纤维化[13];而角化生长因子由间质细胞产生,可促进上皮细胞增殖、分化,使损伤处腹膜再生及提高腹膜纤溶活性来预防术后粘连的形成,WEI等[14]利用透明质酸钠凝胶装载角化生长因子,保持生物活性,可以显著提高预防腹腔粘连的效果。血管内皮生长因子是促血管生成因子,能影响血管内皮细胞的迁移、增殖和分化,在组织重塑过程中起着重要的作用。一方面在腹膜损伤处血管内皮生长因子过表达会导致粘连部位微血管新生、血管通透性增强,血浆蛋白和纤维蛋白原渗出,而手术引起的炎症反应可趋化炎性细胞,分泌大量炎性因子,激活转化生长因子β1/Smad通路,进一步促进血管内皮生长因子的表达,另一方面血管内皮生长因子对纤维蛋白具有高度亲和力,使细胞外基质增加。除外上述细胞因子,低氧诱导因子1在腹腔粘连形成中发挥重要作用。缺氧环境改变腹腔原有微环境,刺激腹膜组织细胞低氧诱导因子1、血管内皮生长因子的表达,促进细胞外基质形成和毛细血管生成,导致粘连形成[15]。腹膜组织缺氧,会上调腹膜组织的 低氧诱导因子1α的表达,促进 PAI-1表达,抑制tPA表达;腹膜间皮细胞的MMP-1表达减少,阻碍细胞外基质的降解;同时腹膜组织中转化生长因子β1的表达增加,以上各途径相互影响形成粘连。低氧诱导因子1同时可以促进血管内皮生长因子表达,细胞外基质形成和毛细血管生成,进一步形成永久性粘连[4,16]。而核转录因子E2相关因子2(nuclear factor erythroid 2 related factor,Nrf2)是体内重要的抗氧化分子之一,有研究表明Nrf2 激动可通过降低炎症反应、减轻氧化应激反应抑制术后腹腔粘连形成[17]。 2.3 腹腔粘连相关的信号通路 2.3.1 转化生长因子β/Smads信号通路 转化生长因子β是粘连形成机制中重要的细胞因子,转化生长因子β1在组织损伤和腹腔粘连形成中作用最强,与转化生长因子β2及转化生长因子β3相互作用。研究表明转化生长因子β1能刺激成纤维细胞增殖,引起细胞外基质的堆积,促进EMT,引起腹膜纤维化,转化生长因子β1表达被阻断后,术后腹腔粘连程度显著降低,而转化生长因子β3可以下调转化生长因子β1的表达。转化生长因子β1/Smads信号通路由转化生长因子β1、转化生长因子β受体蛋白(TβR)、下游激活蛋白Smads蛋白家族及相关调控基因等组成,转化生长因子β1可以减少腹膜间皮细胞的tPA合成,促进PAI-1释放,抑制MMP活性,使纤维蛋白沉积和溶解的失衡,趋化成纤维细胞及单核细胞细胞,促进血管形成。研究表明通过下调Smad3,上调抑制性的Smad7或抑制转化生长因子βRI的活性,均可以阻断转化生长因子β诱导纤维化的过程[9]。研究表明升高的 转化生长因子β1水平和 转化生长因子β1/Smad 信号都与腹膜粘连的形成有关,可以通过暂时阻断 转化生长因子β1/Smad信号转导来预防术后粘连[18]。 2.3.2 核转录因子kB信号通路 激活核转录因子kB通路是一种经典的炎症相关通路,可以上调细胞炎症因子的表达,促进成纤维细胞增生。胞浆中的核转录因子kB与其抑制蛋白IkBα非共价结合表现出无活性,在刺激状态下,IkB能够被IkK(即 IkB 激酶复合物)磷酸化,随后泛素化被蛋白酶降解,使核转录因子kB 释放,转位进入细胞核,从而调节炎症因子和黏附分子如 肿瘤坏死因子α、白细胞介素6、白细胞介素12、环氧合酶2、iNOS等的表达使炎症加重研究。核转录因子kB通路的活化会诱导转化生长因子β表达,从而导致结缔组织生长因子表达,通过促纤维化过程最终导致粘连的发生[19]。TIAN等[20]开发的载药水凝胶可以通过核转录因子κB通路和转化生长因子β/Smad2/3通路的调节作用,加速了损伤组织的重塑,显着减少胶原蛋白的沉积,同时降低了白细胞介素6和肿瘤坏死因子α的表达,有效抑制术后粘连的形成。 2.3.3 Wnt/β-catenin通路 是经典的Wnt信号通路,在静息状态下,细胞质内大部分β-连环蛋白(β-catenin)附着于Axin/APC/GSK-3β组成的蛋白复合体上。通路激活时解复合体解离,细胞质内游离状态的β-catenin 蛋白增加,进入细胞核,结合LEF/TCF,启动下游靶基因包括促纤维化基因的转录表达。Wnt/β-catenin通路与转化生长因子β/Smads信号通路之间的串扰能够诱导纤维化和血管生成,在EMT的发展、组织纤维化的过程中发挥关键作用[21]。有研究表明腹膜纤维化大鼠腹膜组织中钙粘蛋白(E-cadherin)、α-肌动蛋白(α-SMA)、β-catenin、Ⅰ型胶原蛋白、Wnt-1和淋巴细胞增强结合因子 1蛋白水平明显升高[22]。 除了上述研究较多的信号通路,通过抑制JAK2/STAT3途径的磷酸化,降低白细胞介素1、白细胞介素6、白细胞介素10和肿瘤坏死因子α水平来改善炎症,并能够通过激活过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)来减轻腹腔粘连[23]。Wnt/Notch 信号级联的串扰导致下游靶基因的激活,如MMP-21和白细胞介素10,Hippo通路MAPK-ERK1/2和PI3K-Akt与上述通路交互作用,可能参与腹腔粘连的过程[24]。 2.4 间充质干细胞外泌体在腹腔粘连中的应用 间充质干细胞来源于胚胎发育早期的中胚层,是具有自我更新、多向分化潜能的一类多能干细胞,间充质干细胞的治疗作用很大程度上依赖其分泌的胞外囊泡,包括外泌体(直径< 150 nm)、微粒体(直径100-1 000 nm)和凋亡小体(直径> 1 000 nm),与其他细胞或者组织进行信息传递[25]。间充质干细胞外泌体与间充质干细胞均有促进组织再生、抑制炎症反应及调节机体免疫功能的作用,在多种纤维化疾病中有较好的疗效,但间充质干细胞外泌体更稳定,更好保存,不会过多增殖或放大疗效,外泌体内含物有蛋白质、miRNA、mRNA、DNA和细胞因子等,被认为是细胞通讯的一种新机制,因此目前再生医学从依赖间充质干细胞的细胞替代疗法正在趋向外泌体的生物疗法转变[26]。 传统的预防术后腹腔粘连的方法主要包括使用机械屏障和抗粘连剂。机械屏障目前在临床上使用仍是最广泛的,包括可吸收的凝胶或薄膜等材料物,但是物理阻隔受损缺乏生物活性,不能抑制腹膜的上皮间充质转化,也不能有效抑制炎症反应或作用于纤溶系统,其局限性降低了临床使用[3]。抗粘连剂是有巨大潜能的预防方式,包括纤溶剂、抗炎药、抗凝剂及各种细胞因子及基因治疗,其与机械屏障结合能延长作用时间,如有研究通过凝胶装载药物或细胞因子[13,21]。多种中药也被证实可以作用于粘连形成过程的信号通路[27]。 近年来,再生医学因实现疾病逆转和组织修复的特点在腹腔粘连中的应用受到显著关注,研究发现干细胞治疗不仅能阻止纤维化,同时能引导一种正常的修复和愈合。再生医学早期认为干细胞是各种组织的主要直接替代物,但随着认识的深入,人们已经把研究重点放在了干细胞的旁分泌功能上了,并对作用的复杂细胞内信号传导途径进行了一定的探索。近年来,大量的动物体内及体外细胞研究发现间充质干细胞及外泌体可以促进腹膜间质细胞迁移、减低早期炎症反应及减轻术后腹腔粘连形成[28-36],见表1,2。"

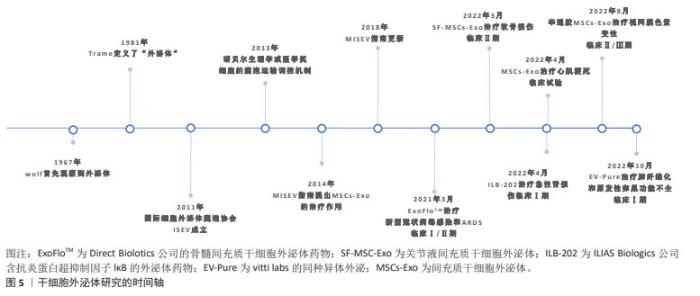
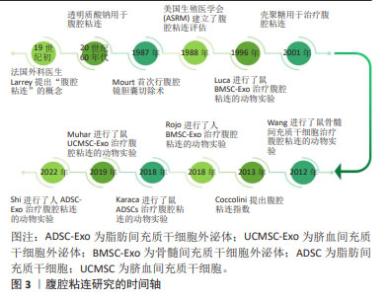
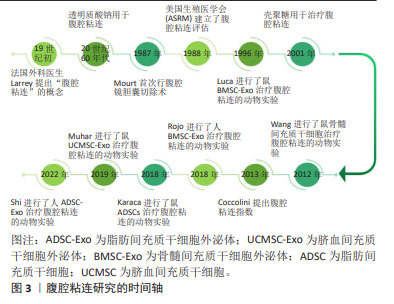
多种间充质干细胞外泌体被证实可作用于多种靶细胞,促进血管新生、细胞增殖、调节免疫,进一步修复损伤的组织器官,在基础科研领域研发火热。由于具有以下优势:①安全高,可以避免产生免疫排斥、栓塞、成瘤致瘤风险;②更易保存与运输:分离出的干细胞外泌体可以在低温下长期保存,2-8 ℃,72 h内仍然保持活性;③来源更为广,产量更高;④无伦理问题,因此有具有极大的临床价值。目前间充质干细胞外泌体的临床试验已在冠状病毒治疗、软骨修复、心肌缺血、眼部疾病、肾脏损伤、卵巢功能修复等疾病领域开展。 在1967年Wolf首先观察到了外泌体,当时被称为“血小板尘埃”,1981年Trame定义了“外泌体”,被认为是具有生理功能的分泌囊泡,并推进了囊泡分泌的细胞功能概念。2011年国家细胞外泌体囊泡协会ISEV成立,开始了外泌体在组织修复再生领域的全面研究。2013年诺贝尔生理学奖或医学奖授予了发现囊泡转运机制的詹姆斯·罗斯曼、兰迪·谢克曼、托马斯·聚德霍夫3位科学家,为外泌体的细胞间作用提供了理论支持。2014年的MISEV指南进一步提出了间充质干细胞外泌体(间充质干细胞外泌体)在疾病中的治疗作用。2018年MISEV指南更新,外泌体的分离、定量和功能研究进一步规范。自2021年开始外泌体已逐步应用于临床研究,如新冠病毒感染、软骨损伤、肾损伤、视网膜额色素变性及肺纤维化等。文章总结间充质干细胞外泌体的研究进展时间轴,见图5。"
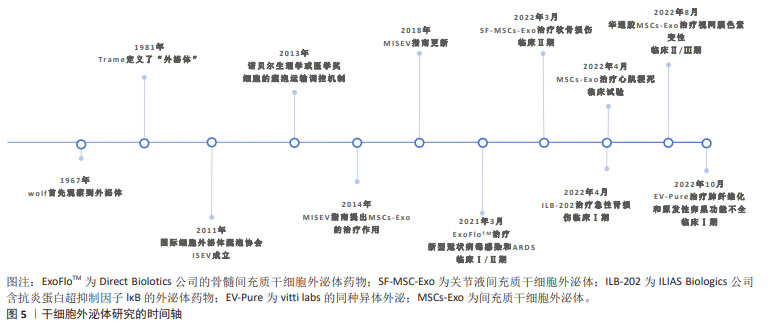
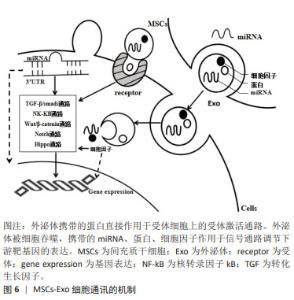
2.6 间充质干细胞外泌体在损伤修复过程中的作用机制 目前认为间充质干细胞外泌体在细胞通讯方面的主要机制包括:①外泌体携带的蛋白直接作用于受体细胞上的受体激活通路;②外泌体被细胞吞噬,携带的RNA、DNA及细胞因子等作用于信号通路或直接作用于下游靶基因,调节基因的表达,后者联级反应作用效果更明显,调控细胞的生物学功能[25-26],文章总结了间充质干细胞外泌体的主要作用机制,见图6。而间充质干细胞外泌体在组织损伤修复中的作用机制可能涉及3方面:①抑制间皮细胞的凋亡及上皮间质转化;②调节免疫炎性反应,减少组织损伤;③下调纤维基因表达,激活纤溶系统。 2.6.1 抑制间皮细胞的凋亡及上皮间质转化 外泌体介导的分化在治疗组织损伤中发挥着重要作用,可通过促进 间充质干细胞产生不同种类细胞替代受损组织中丢失的细胞,可促进腹膜间皮细胞的增殖、迁移,抑制或逆转腹膜的EMT。SHI等[28]的体外实验发现人脂肪间充质干细胞外泌体(adipose mesenchymal stem cells exosomes,ADSC-Exo)可能通过激活MAPK-ERK1/2和PI3K-Akt促进腹膜间皮细胞增殖和迁移,可以促进腹膜损伤大鼠模型的腹膜修复来减轻术后腹腔粘连。纪鸥洋等[36]的体外实验表明,人脐血间充质干细胞来源的外泌体(human umbilical cord mesenchymal stem cells-derived exosomes,hUCMSC-Exo)对人腹膜间皮细胞存在修复作用,抑制高糖刺激下细胞凋亡的发生和炎症因子白细胞介素6和肿瘤坏死因子α的表达,促进人腹膜间皮细胞的增殖。在多种损伤修复性疾病的中,间充质干细胞外泌体被证明有抑制逆转EMT的作用,间充质干细胞外泌体对的miR-21-5p和miR-7162-3p 调节可能是促进子宫内膜基质细胞增殖的关键分子,脐血间充质干细胞外泌体通过上调miR199a逆转转化生长因子β诱导的肾小管的EMT[44-45],鼠源性骨髓间充质干细胞外泌体(bone marrow mesenchymal stem cells exosomes,BMSC-Exo)通过下调实验性结肠炎大鼠结肠中白细胞介素β、白细胞介素10、肿瘤坏死因子α、iNOS和环氧合酶2水平,抑制caspase的表达肠上皮细胞的凋亡[46],体外实验中通过转染miR-200b验证骨髓间充质干细胞外泌体通过减低转化生长因子β水平抑制肠上皮间质转化途径[47]。因此,在今后的研究中可以建立腹腔粘连疾病模型,通过转染或敲除特定的miRNA,验证间充质干细胞外泌体的有效成分及作用的信号通路,进一步完善间充质干细胞外泌体抑制或逆转腹腔粘连组织EMT的机制。 2.6.2 调节免疫炎性反应,减少组织损伤 间充质干细胞外泌体通过传递炎症因子、转录因子和miRNA来调节免疫微环境,进而调节各种免疫效应细胞的增殖、成熟、极化和迁移。间充质干细胞外泌体可触发巨噬细胞向M1型极化,诱导Th1转化为Th2,减少T细胞向辅助性T细胞17(Th17)转变,增加调节性T细胞(Treg)维持免疫平衡,减少组织损伤。刘文涛等[48]的体外研究发现,鼠源性骨髓间充质干细胞外泌体可触发巨噬细胞白细胞介素6和iNOS高表达,诱导巨噬细胞向M1型极化。林颖等[49]研究表明鼠源性骨髓间充质干细胞外泌体能逆转哮喘小鼠的Treg/Th17失衡,抑制气道炎症反应。LI等[50]体外实验发现,通过转染miR-181c验证hUCMSC-Exo的可通过抑制Toll-4信号通路来减轻烧伤引起的炎性反应。因此收集腹腔粘动物模型的腹腔积液,检测免疫细胞的表达可以验证间充质干细胞外泌体通过调节免疫炎性反应,减少粘连的形成。 2.6.3 下调纤维基因表达,激活纤溶系统 间充质干细胞外泌体一方面可直接抑制多种胶原蛋白的表达,减少细胞外基质的聚集,另一方面纤溶系统及调节MMP/TIMP的平衡。有研究在的腹腔粘连大鼠模型中发现,ADSC-Exo可以上调腹膜中TIMP-1表达,下调Ⅰ型胶原和MMP-9表达[28]。QU等[51]也在肝纤维化小鼠模型中证实miRNA-181-5p上调的ADSC-Exo能通过转移下调肝星状细胞中转化生长因子β1、纤维化基因及Bcl-2的表达,减少波形蛋白、纤维连接蛋白等的形成。LI等[52]研究表明兔骨髓间充质干细胞外泌体能调节骨折局部微环境中的纤溶系统平和,miR-451-5p可直接上调体内PAI-1表达促进纤维蛋白降解。 除了可以参与上述过程,间充质干细胞外泌体内富含多种生长因子(如血管内皮生长因子、白细胞介素6和低氧诱导因子1α)及miRNA也可以调控促血管生成因子和抗血管生成因子之间的平衡发挥作用。研究发现ADSC-Exo中的白细胞介素6通过STAT3提高毛细血管密度[53],miR-21可能通过增加低氧诱导因子1α和血管内皮生长因子的表达[54],miR-125a可以靶向抑制Delta样配体4(Delta-like ligand 4,DLL4)的表达,促进血管内皮细胞生成,但也有研究提示,间充质干细胞外泌体可以通过抑制转化生长因子β通路降低低氧诱导因子1α和血管内皮生长因子的表达,因此其在纤维组织中对血管生成的调节有待进一步研究。"
| [1] MORIS D, CHAKEDIS J, RAHNEMAI-AZAR AA, et al. Postoperative abdominal adhesions: clinical significance and advances in prevention and management. J Gastrointest Surg. 2017;21(10):1713-1722. [2] CARMICHAEL SP, SHIN J, VAUGHAN JW, et al. Regenerative medicine therapies for prevention of abdominal adhesions: a scoping review. J Surg Res. 2022;275:252-264. [3] 朱兰,郎景和,任常,等.妇产科手术后盆腹腔粘连预防中国指南[J].中华妇产科杂志,2023,58(3):161-169. [4] 张龙龙,樊强,顾越雷,等.术后腹腔粘连的研究进展[J].中国普外基础与临床杂志,2018,25(2):245-249. [5] WANG R, GUO T, LI J. Mechanisms of peritoneal mesothelial cells in peritoneal adhesion. Biomolecules. 2022;12(10):1498-1513. [6] ORECCHIONI M, GHOSHEH Y, PRAMOD AB, et al. Macrophage polarization: different gene signatures in M1(LPS+) vs. Classically and M2(LPS–) vs. alternatively activated macrophages. Front Immunol. 2019;24(10):1084-1096. [7] BUTCHER MJ, ZHU J. Recent advances in understanding the Th1/Th2 effector choice. Fac Rev. 2021;15(10):10-30. [8] DONG L, ZHENG X, WANG G. Peritoneal adhesions induce Th17/Treg imbalance in mice. Int J Clin Exp Pathol. 2018;11(9):4352-4362. [9] 成晶晶.外周血Th17/Treg失衡与卵巢子宫内膜异位囊肿的关系及对其粘连程度的评估价值[J].中国现代医药杂志,2022,24(5):35-38. [10] ASCHER S, WILMS E, PONTAROLLO G, et al. Gut microbiota restricts NETosis in acute mesenteric ischemia-reperfusion injury. Arterioscler Thromb Vasc Biol. 2020;40(9):2279-2292. [11] 杨丽丽,卞尧尧,赵敏,等.细胞因子与术后腹腔粘连关系及中医药防治[J].中华中医药学刊,2018,36(12):2935-2939. [12] TANG J, XIANG Z, BERNARDS MT, et al. Peritoneal adhesions: occurrence, prevention and experimental models. Acta Biomater. 2020;116(15):84-104. [13] FU M, PENG D, LAN T, et al. Multifunctional regulatory protein connective tissue growth factor (CTGF): a potential therapeutic target for diverse diseases. Acta Pharm Sin B. 2022;12(4):1740-1760. [14] WEI G, WANG Z, LIU R, et al. A combination of hybrid polydopamine-human keratinocyte growth factor nanoparticles and sodium hyaluronate for the efficient prevention of postoperative abdominal adhesion formation. Acta Biomater. 2022;138(15):155-167. [15] 谢中,杨标顺,钱亮.达芙通联合补佳乐对腔镜粘连术后患者TNF-α、VEGF、TGF-β的影响及疗效观察[J].中国计划生育学杂志, 2019,27(3):342-345. [16] SHENTU Y, JIANG H, LIU X, et al. Nestin promotes peritoneal fibrosis by protecting hif1-αfrom proteasomal degradation. Front Physiol. 2020;16(11):517912. [17] 吴云桦,杨妮,王星傑,等.Nrf2激动剂t-BHQ在预防术后腹腔粘连形成中的价值及其可能的机制[J].临床医学研究与实践,2021, 6(13):1-3, 15. [18] ZENG X, LU B, WANG F, et al. The effect of Smad2- and Smad3-targeting RNA interference on extracellular matrix synthesis in rat fibroblasts of peritoneal adhesion tissues. Am J Transl Res. 2020;12(11):7420-7429. [19] LI H, WANG L, SHAO M, et al. Pirfenidone attenuates the EMT process and the secretion of VEGF in TGF-β2-induced ARPE-19 cells via inhibiting the activation of the NF-κB/snail signaling pathway. J Ophthalmol. 2023;303:4798071-47980720. [20] TIAN L, SUN T, FAN M, et al. Novel silk protein/hyaluronic acid hydrogel loaded with azithromycin as an immunomodulatory barrier to prevent postoperative adhesions. Int J Biol Macromol. 2023; 235(30):123811. [21] ALBRECHT LV, TEJEDA-MUÑOZ N, DE ROBERTIS EM. Cell biology of canonical wnt signaling. Annu Rev Cell Dev Biol. 2021;37(6):369-389. [22] 于晓猛,冯仁蕊,王宏,等.Wnt/β-catenin信号通路与大鼠腹膜纤维化-EMT相关研究[J].生物医学工程与临床,2022,26(4):486-490. [23] 赵敏.活血通腑方调控巨噬细胞极化和SOCS/JAK2/STAT/PPAR-γ通路防治腹腔粘连的机制研究[D].南京:南京中医药大学,2020. [24] ARDALAN KHALES S, AARABI A, ABBASZADEGAN MR, et al. INPP5A/HLA-G1/IL-10/MMP-21 axis in progression of esophageal squamous cell carcinoma. Iran Biomed J. 2022;26(6):440-453. [25] 郭嘉,丁琼桦,刘泽,等.间充质干细胞来源外泌体的生物学特性及免疫调控作用[J].中国组织工程研究,2022,26(7):1093-1101. [26] 王含必,邓成艳.外泌体的生物功能及临床治疗应用潜能[J].生殖医学杂志,2021,30(7):966-970. [27] 陈妍锜,赵敏,杨丽丽,等.中医药防治间皮细胞参与术后腹腔粘连形成[J].中华中医药学刊,2021,39(4):32-35. [28] SHI M, LIU H, ZHANG T, et al. Extracellular vesicles derived from adipose mesenchymal stem cells promote peritoneal healing by activating MAPK-ERK1/2 and PI3K-Akt to alleviate postoperative abdominal adhesion. Stem Cells Int. 2022;2022:1940761. [29] MUHAR AM, PUTRA A, WARLI SM, et al. Hypoxia-mesenchymal stem cells inhibit intra-peritoneal adhesions formation by upregulation of the IL-10 expression. Open Access Maced J Med Sci. 2019;7(23): 3937-3943. [30] ROJO D, CONGET P. Acellular derivatives of mesenchymal stem cells prevent peritoneal adhesions in an animal model. J Surg Res. 2018; 223:198-206. [31] KARACA G, PEHLIVANLI F, AYDIN O, et al. The effect of mesenchymal stem cell use on intra-abdominal adhesions in a rat model. Ann Surg Treat Res. 2018;94(2):57-62. [32] WANG N, LI Q, ZHANG L, LIN H, et al. Mesenchymal stem cells attenuate peritoneal injury through secretion of TSG-6. PLoS One. 2012;7(8):e43768. [33] LUCAS PA, WAREJCKA DJ, ZHANG LM, et al. Effect of rat mesenchymal stem cells on development of abdominal adhesions after surgery. J Surg Res. 1996;62(2):229-232. [34] JIAO T, HUANG Y, SUN H, et al. Exosomal lnc-CDHR derived from human umbilical cord mesenchymal stem cells attenuates peritoneal epithelial-mesenchymal transition through AKT/FOXO pathway. Aging (Albany NY). 2023;15(14):6921-6932. [35] HUANG Y, MA J, FAN Y, et al. Mechanisms of human umbilical cord mesenchymal stem cells-derived exosomal lncRNA GAS5 in alleviating EMT of HPMCs via Wnt/β-catenin signaling pathway. Aging (Albany NY). 2023;15(10):4144-4158. [36] 纪鸥洋,方均燕,宋阿会,等.间充质干细胞外泌体对腹膜间皮细胞高糖损伤的作用研究[J].组织工程与重建外科,2022,18(4):294-299. [37] 胡珍艳,尕永梅,麦迪乃姆·努尔麦麦提.间充质干细胞来源的外泌体中miR-143-3p抑制自噬并逆转心肌缺血再灌注损伤的机制研究[J].实用临床医药杂志,2022,26(17):46-52. [38] 蔡黎黎,咸娴,胡维佳,等.人脐带干细胞外泌体对抑郁模型小鼠海马小胶质细胞极化和神经元凋亡的影响[J].中华行为医学与脑科学杂志,2023,32(5):399-406. [39] 杨静,胡华钟,张书勤,等.脐带间充质干细胞来源的外泌体通过抑制上皮间质转化缓解肺纤维化[J].南方医科大学学报,2020, 40(7):988-994. [40] 沈括,王许杰,刘开拓,等.人脂肪间充质干细胞外泌体对小鼠RAW264.7细胞的炎症反应和小鼠全层皮肤缺损创面愈合的影响[J].中华烧伤与创面修复杂志,2022,38(3):215-226. [41] 赵海波,赵夏,高甲科,等.间充质干细胞来源的外泌体对肌腱细胞损伤修复的影响及其机制[J].中华创伤杂志,2021,37(7):653-661. [42] 王振刚,付塬,张闻达,等.间充质干细胞来源的外泌体对2型糖尿病小鼠胰岛功能和炎症因子的影响[J].中国实验诊断学,2023, 27(9):1077-1082. [43] 赵莹莹,陈莉莎,闫丽,等.脐带间充质干细胞外泌体对大鼠卵巢功能作用及机制研究[J].临床军医杂志,2022,50(11):1155-1158. [44] HORITA M, FARQUHARSON C, STEPHEN LA. The role of miR-29 family in disease. J Cell Biochem. 2021;122(7):696-715. [45] 张旭东,谭季春.间充质干细胞及外泌体治疗子宫内膜损伤的研究进展[J].中国实用妇科与产科杂志,2023,39(2):236-239. [46] YANG J, LIU XX, FAN H, et al. Extracellular vesicles derived from bone marrow mesenchymal stem cells protect against experimental colitis via attenuating colon inflammation, oxidative stress and apoptosis. PLoS One. 2015;10(10):e0140551. [47] YANG J, ZHOU CZ, ZHU R, et al. miR-200b-containing microvesicles attenuate experimental colitis associated intestinal fibrosis by inhibiting epithelial-mesenchymal transition. J Gastroenterol Hepatol. 2017;32(12):1966-1974. [48] 刘文涛,王新月,杨毅等.骨髓间充质干细胞来源的外泌体诱导巨噬细胞向M型极化[J].中国组织化学与细胞化学杂志,2022,31(3): 232-238. [49] 林颖,胡锦章,颛孙永勋,等.骨髓间充质干细胞外泌体调节哮喘小鼠Foxp3+ Treg/Th17的平衡[J].中国组织工程研究,2018,22(17): 2637-2643. [50] LI X, LIU L, YANG J, et al. Exosome derived from human umbilical cord mesenchymal stem cell mediates MiR-181c attenuating burn-induce-d excessive inflammation. EBioMedicine. 2016;8(10):72-82. [51] QU Y, ZHANG Q, CAI X, et al. Exosomes derived from miR-181-5p-modified adipose-derived mesenchymal stem cells prevent liver fibrosis via autophagy activation. J Cell Mol Med. 2017;21(10):2491-2502. [52] LI L, WANG Y, YU X, et al. Bone marrow mesenchymal stem cell-derived exosomes promote plasminogen activator inhibitor 1 expression in vascular cells in the local microenvironment during rabbit osteonecrosis of the femoral head. Stem Cell Res. 2020;11(1):480-493. [53] AN Y, ZHAO J, NIE F, et al. Exosomes from adipose-derived stem cells (ADSCs) overexpressing miR-21 promote vascularization of endothelial cells. Sci Rep. 2019;9(1):12861. [54] ZHE C, WANG H, YANG X, et al. Therapeutic potential of mesenchymal cell–derived miRNA-150-5p–expressing exosomes in rheumatoid arthritis mediated by the modulation of MMP14 and VEGF. J Immunol. 2018:2472-2482. |
| [1] | Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [2] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [3] | Yin Lu, Jiang Chuanfeng, Chen Junjie, Yi Ming, Wang Zihe, Shi Houyin, Wang Guoyou, Shen Huarui. Effect of Complanatoside A on the apoptosis of articular chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1541-1547. |
| [4] | De Ji, Suo Langda, Wei Yuchen, Wang Bin, Awangcuoji, Renqingcuomu, Cui Jiuzeng, Zhang Lei, Ba Gui. Comprehensive analysis of genes related to endometrial receptivity and alternative splicing events in northwest Tibetan cashmere goats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1429-1436. |
| [5] | Peng Hongcheng, Peng Guoxuan, Lei Anyi, Lin Yuan, Sun Hong, Ning Xu, Shang Xianwen, Deng Jin, Huang Mingzhi . Role and mechanism of platelet-derived growth factor BB in repair of growth plate injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1497-1503. |
| [6] | Yu Ting, Lyu Dongmei, Deng Hao, Sun Tao, Cheng Qian. Icariin pretreatment enhances effect of human periodontal stem cells on M1-type macrophages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1328-1335. |
| [7] | Yang Zhihang, Sun Zuyan, Huang Wenliang, Wan Yu, Chen Shida, Deng Jiang. Nerve growth factor promotes chondrogenic differentiation and inhibits hypertrophic differentiation of rabbit bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1336-1342. |
| [8] | Chen Yuning, Jiang Ying, Liao Xiangyu, Chen Qiongjun, Xiong Liang, Liu Yue, Liu Tong. Buqi Huoxue Compounds intervene with the expression of related factors and autophagy related proteins in a rat model of cerebral ischemia/reperfusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1152-1158. |
| [9] | Ji Huihui, Jiang Xu, Zhang Zhimin, Xing Yunhong, Wang Liangliang, Li Na, Song Yuting, Luo Xuguang, Cui Huilin, Cao Ximei. SR9009 combined with indolepropionic acid alleviates inflammation in C2C12 myoblasts through the nuclear factor-kappa B signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1220-1229. |
| [10] | He Bo, Chen Wen, Ma Suilu, He Zhijun, Song Yuan, Li Jinpeng, Liu Tao, Wei Xiaotao, Wang Weiwei, Xie Jing . Pathogenesis and treatment progress of flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1230-1238. |
| [11] | Lang Mecuo, Zhang Yilin, Wang Li. MiR-338-3p affects proliferation and apoptosis of alveolar bone osteoblasts by targeting receptor activator of nuclear factor-kappaB ligand [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 899-907. |
| [12] | Xiang Pan, Che Yanjun, Luo Zongping. Compressive stress induces degeneration of cartilaginous endplate cells through the SOST/Wnt/beta-catenin pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 951-957. |
| [13] | Han Haihui, Meng Xiaohu, Xu Bo, Ran Le, Shi Qi, Xiao Lianbo. Effect of fibroblast growth factor receptor 1 inhibitor on bone destruction in rats with collagen-induced arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 968-977. |
| [14] | Zhang Min, Zhang Nini, Huang Guilin, Li Zhuangzhuang, Wang Xue, Wang Huike. Human amniotic mesenchymal stem cell exosomes repair radiation-induced submandibular gland damage in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7804-7815. |
| [15] | Liu Xuan, Ding Yuqing, Xia Ruohan, Wang Xianwang, Hu Shujuan. Exercise prevention and treatment of insulin resistance: role and molecular mechanism of Keap1/nuclear factor erythroid2-related factor 2 signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(35): 7578-7588. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||