Chinese Journal of Tissue Engineering Research ›› 2015, Vol. 19 ›› Issue (11): 1761-1767.doi: 10.3969/j.issn.2095-4344.2015.11.023
Previous Articles Next Articles
Semaphorins play an important role in bone homeostasis and metabolic bone disease
Cong Yu, Guo Ting, Zhao Jian-ning, Ru Jiang-ying, Zhou Li-wu, Bao Ni-rong
- Department of Orthopedics, School of Clinical Medicine, Nanjing University/Nanjing General Hospital of Nanjing Military Command, Nanjing 210002, Jiangsu Province, China
-
Revised:2015-01-16Online:2015-03-12Published:2015-03-12 -
Contact:Bao Ni-rong, M.D., Associate chief physician, Department of Orthopedics, School of Clinical Medicine, Nanjing University/Nanjing General Hospital of Nanjing Military Command, Nanjing 210002, Jiangsu Province, China -
About author:Cong Yu, Studying for doctorate, Attending physician, Department of Orthopedics, School of Clinical Medicine, Nanjing University/Nanjing General Hospital of Nanjing Military Command, Nanjing 210002, Jiangsu Province, China -
Supported by:the Specific Fund for Clinical Medicine in Jiangsu Province, No. BL2012002
CLC Number:
Cite this article
Cong Yu, Guo Ting, Zhao Jian-ning, Ru Jiang-ying, Zhou Li-wu, Bao Ni-rong. Semaphorins play an important role in bone homeostasis and metabolic bone disease [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(11): 1761-1767.
share this article
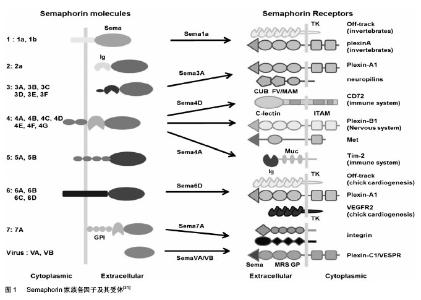
2.1 骨的自身动态平衡与代谢性骨病 骨质疏松症是一种会导致骨折的代谢性骨病,多发生于老人和绝经后妇女。在骨质疏松症患者中,破骨细胞的活性增加,成骨细胞的骨形成没有跟上骨吸收程度。过度的骨吸收导致骨量丢失,抗骨吸收的药物(比如双膦酸盐类药物)治疗骨质疏松已经成为主要的治疗。但是,单纯的抑制破骨细胞的活性会破坏骨重塑过程从而导致“冻结骨”的发生,它会减少骨的质量从而增加骨的脆性甚至会导致下颌骨坏死等并发症。对骨质疏松治疗来说,刺激骨形成并且没有“冻结骨”的发生将是一个理想的治疗目标[1]。 骨是一个动态的器官,它不断的在重塑着以维持它的结构完整性。骨的重塑过程由两种细胞控制:破骨细胞和成骨细胞。破骨细胞是最重要的骨破坏性细胞,它可以帮助形成骨架并且能调控骨量。成骨细胞是一种专门的骨形成细胞,它可以合成骨基质、控制矿化作用,最终分化为骨细胞或者骨衬底细胞。近来,研究认为骨重塑过程是由大量的体液及偶联因子调控,而这些因子则可能由骨基质中的破骨细胞和成骨细胞释放[2]。比如,在骨质吸收过程中,转化生长因子和胰岛素样生长因子1被诱导并刺激骨中的成骨细胞[3-4]。另外,cardiotrophin-1是一种由破骨细胞衍生的因子,它是一种能诱导骨形成的体液因子[5]。 Ephrin B2是一种与成骨细胞和破骨细胞相关的偶联因子。一些体外研究表明Ephrin B2通过它的配体EphB4绑定在破骨细胞上再作用于成骨细胞,以一种细胞间接触和依赖的方式促进成骨细胞分化和骨的形成。因此,局部和全身的因子调控破骨细胞和成骨细胞之间的联系来维持骨的动态平衡。由破骨细胞或者成骨细胞带来的骨重塑中的不平衡会导致一系列骨病,比如骨量减少、骨质疏松症、骨硬化症。因为骨重塑是一个多细胞参与的事件,所以在控制骨重塑过程中细胞间相互干扰很重要。 骨重塑过程包含3个阶段[1,6]:①由破骨细胞引发的骨质吸收开始。②成骨细胞促发新骨的重建。③新骨的合成和终止。骨的自身动态平衡在过去长时间里被认为主要是由钙调节激素为主的内分泌系统来维持,但越来越多的证据揭示免疫系统和神经系统调节因子也参与这一过程[7-8]。破骨细胞由单核巨噬细胞前体及单核细胞衍生而来,而这些细胞分化时由间充质细胞调节,比如成骨细胞、软骨细胞、骨细胞,单核细胞及单核巨噬细胞前体表达重要的破骨细胞分化因子(核因子κB受体活化因子配体)[9-10]。成骨细胞通过产生骨保护素即Opg来抗衡核因子κB受体活化因子配体的功能。 2.2 semaphorin家族与骨的重塑 近来的研究显示轴突导向分子semaphorins与破骨细胞和成骨细胞的细胞间通信有关,其功能涉及到骨的重塑[1,11-15]。破骨细胞和成骨细胞表达semaphorin家族蛋白,研究报告这些蛋白通过充当旁分泌信号分子局部的管理骨重塑造过程[13,16-17]。semaphorin家族在调节骨的动态平衡即骨的发生、分化、吸收以及各种骨病的发生上充当着重要的角色[1,7,13,16-18]。 Semaphorin家族最早是作为轴突导向分子而被发现[19],在进化上是保守的,在病毒、线虫、果蝇、脊椎动物中普遍存在。目前发现Semaphorin家族至少含有20个成员[20],所有家族成员都具有一个保守的由约 400个氨基酸残基组成的Sema结构域,主要以分泌型和跨膜型两种形式存在(SemaI、SemaIV-VII是跨膜型, SemaII、III、VIII是分泌型)。基于C端结构以及相似的氨基酸残疾结构域,不同种类的semaphorin蛋白又被分为8类[20],前两类是无脊椎动物Semaphorin分子,包括Sema1a、Sema1b和Sema2a,3-7类是脊椎动物Semaphorin分子[20],包括Sema3A-F,Sema4A-C,Sema5A-B,Sema6A-C和Sema7A;另一类是病毒属Sema8分子。Semaphorin分布广泛,功能复杂,在许多不同组织里面表达,并且调节很多非神经系统的生理过程,在轴突导向、细胞迁移、瘤的转化、免疫调节、器官发生及血管形成等不同的生物学过程中发挥重要作用[20-23],Semaphorin的特异性受体主要有neuropilins及plexins[24-26],其中neuropilins为结合受体而plexins为信号转导受体,Sema和受体形成复合物后才能传导相应的信号并激活下游分子发挥功能。大多数跨膜型semaphorins结合plexins作为它们的受体,除了Sema3E之外的SemaIII需要neuropilins作为专有的共同结合受体来结合Plexin-D1。除此而外,某些semaphorin通过其他受体独立的表达信号,比如,Sema7A在神经系统、免疫系统中通过整合素来发挥它的生理功能[27-29](见图1)。 近些年,semaphorins通过受体转导信号的分子机制已经被找到,Plexin-A1介导的信号通路通过调节GTPase的活性和细胞质受体蛋白激酶在调整细胞支架结构方面发挥着重要作用[30-31]。Plexin关联的效应器分子能够调控RhoA、AKT、MAPK信号通路。Plexin-B1关联受体酪氨酸激酶Met和ErbB2,诱导侵入的上皮细胞生长。这些研究指出了semaphorin信号的复杂性以及拓宽了这些分子相互作用的范围。下面分别从各个semaphorin分子角度来介绍其在骨重建中所起的作用。 2.2.1 Sema3E 研究证实老鼠成骨细胞表达大多数第3类信号素,并且各自不同的调节细胞生长和分化。培养增殖过程中Sema3D的表达增加,而Sema3E的表达则降低,虽然Sema3A的表达不受细胞密度的影响,但是在成骨细胞矿化培养中是增加的。Sema3A、3E、3D的表达都不同程度的受成骨性刺激的调节。虽然 1,25-(OH)2D3增加Sema3E的表达,但抑制糖原合成酶激酶3β可以减少Sema3A、3E的表达。甲状旁腺激素对Sema3A、3B、3D的表达不起作用。成骨细胞、巨噬细胞和破骨细胞表达Sema3E受体PlexinD1,提示Sema3E是以自分泌和旁分泌形式进行的。过去没有观察到Sema3E重组体对成骨细胞的增殖、分化、矿化起作用。但是在伤口愈合测定中Sema3E确实抑制成骨细胞的迁移。用200 μg/L的Sema3E培育的小鼠骨髓巨噬细胞做培养,抗酒石酸酸性磷酸酶(TRAP)阳性、多核的破骨细胞形成减少了81%。相应的,在用有Sema3E的巨噬细胞培养后,用qPCR可以观察到破骨细胞标志(Itgb3,Acp5,Cd51,Nfatc1,CalcR,and Ctsk)表达减少。在体外研究中,Sema 3E是一种新颖的破骨细胞抑制剂,可能在维持骨平衡中扮演一种重要角色,并且有可能在破骨细胞和成骨细胞之间担任一种偶联因子[32]。 2.2.2 Sema3A Sema3A在包括骨的许多组织中表达,意味着它各种不同的生理功能[33]。血浆或者骨的微环境中Sema3A蛋白水平可能是骨转换的生物标记物[16]。 成骨细胞分化时Sema3A的表达增加,而破骨细胞分化时其表达降低[33]。另外其受体Plexin-A1,2,3和neuropilin-1(Nrp1)在成骨细胞中表达,这些都提示Sema3A在成骨细胞分化过程中扮演着重要的角色[33]。 有研究显示成骨细胞表达Sema3A,Sema3A通过抑制破骨细胞的骨吸收作用和增加成骨细胞的骨形成作用来发挥一种骨保护效应[18]。Sema3A与它的受体neuropilin-1(Nrp1)结合后通过抑制RhoA信号转导通路以及ITAM来抑制核因子kB配体(核因子κB受体活化因子配体)的受体激活剂诱导的破骨细胞分化[16]。此外,Sema3A和Nrp1结合后还通过Wnt/-catenin信号转导通路刺激成骨细胞的骨形成和抑制脂肪细胞的分 化[16],因此可以认为它是成骨细胞产生的有效的骨保护因子。 Sema3A抗骨吸收的机制:核因子κ B受体活化因子配体和它的受体RANK结合后导致肿瘤坏死因子受体相关因子6(TRAF6)的活化,然后激活核因子kB和促分裂原活化蛋白激酶(MAPK)信号传导通路。核因子κ B受体活化因子配体还激活AP-1转录因子复合体,包括c-Fos,它可以与核因子kB一起诱导NFATc1,它可以激活特定的破骨细胞基因转录,核因子κB受体活化因子配体激活的破骨细胞基因(Ctsk,Acp5,Nfatc1)诱导过程被Sema3A严重的损坏了。 现在除了甲状旁腺激素或者抗硬化剂抗体可以用来增加骨形成之外,其余没有有效的治疗剂。Sema3A的研究提供发展一种复合剂的分子学基础,这种复合剂通过同时促进骨量增加和抑制骨质吸收来促进骨的再生[16,18]。 感觉神经在骨重塑过程中发挥了重要的作用[33]。另有研究证明Sema3A-Plexin-A4信号通路在骨的神经支配中非常重要[33]。在体内,神经元衍生的Sema3A促成普通的神经系统生长,也就是说Sema3A作为一种自分泌因子在神经元的生长中起作用[33]。神经元衍生的Sema3A通过调节发射到骨组织的感觉神经来管理骨的重塑[33]。不能排除成骨细胞衍生的Sema3A在骨的新陈代谢中发挥作用的可能性,但Sema3A首要的是通过调整感觉神经支配来调节骨的新陈代谢[16]。 2.2.3 Sema4D 研究发现破骨细胞分泌Sema4D,它可以通过抑制成骨细胞的分化和调整成骨细胞的能动性来抑制骨重建过程[17]。Sema4D和它的受体Plexin-B1结合后作用于成骨细胞导致小GTPase RhoA的活化从而抑制成骨细胞的分化,它通过抑制胰岛素样生长激素1的信号表达和通过调整成骨细胞的能动性来抑制骨形成。在这项研究中,还发现破骨细胞通过Sema4D管理成骨细胞的分化和运动,来控制成骨细胞的定位,表明Sema4D可以作为骨细胞定位的导向分子,就象semaphorins家族作为轴突导向分子那样[17]。另外Sema4D在T细胞和某些肿瘤细胞中表达,由这些细胞表达的Sema4D可能会减少骨重建。特定的Sema4D抗体治疗可以显著的阻止一组绝经后骨质疏松患者的骨丢失。在骨生长药物的发现和发展方面,Sema4D已经显现成为一种新的治疗靶点[17],抑制Sema4D- PlexinB1-RhoA信号轴可以为治疗骨与关节疾病(包括骨质疏松、类风湿关节炎、骨肿瘤)带来新的希望。 2.2.4 Sema6D Plexins作为一个关键的调节蛋白质在各种发生、再生和病理过程中起作用[34]。Plexin-A1与配体结合型受体neuropilins转导semaphorinsIII的信号[35]。Plexin-A1缺陷的小鼠在骨骼结构方面显示了严重的缺陷并能增加骨量,因而导致了骨硬化症并且破坏了骨的动态平衡。Plexin-A1的缺乏不会影响成骨细胞但会导致破骨细胞数量的减少。破骨细胞的活性和骨骼吸收减少了,然而在破骨细胞分化标记的表达上却没有区别,所以Plexin-A1在骨骼组织中为Sema6D充当了一个有用的受体。Plexin-A1利用酪氨酸激酶形成一个受体复合物来活化Sema6D,细胞内Sema6D诱导的DAP12磷酸化表达Plexin-A1、Trem-2、DAP12。这些发现有力的揭示DAP12和Trem-2是Sema6D的功能性受体组成部分。事实上,Sema6D-Plexin-A1介导的破骨细胞调控过程部分的依靠Trem2和DAP12[36],提示Plexin-A1也诱导独立的DAP-12信号通路。 研究发现的新型共受体Plexin-A1通过与Trem- 2(能够结合跨膜分子DAP12)相互作用发挥生物学功能。这种结合能够磷酸化细胞内酪氨酸激酶Syk上ITAM基序中的酪氨酸,招募其到细胞表面,进而促发一系列下游信号转导(包括AKT、MAPK以及PLC-gamma和钙离子诱导NFAT依赖的转录调节。在体外研究发现,破骨细胞中缺失DAP12或者Trem-2能够导致其分化受损,类似的现象发生在DAP12或Trem-2缺失小鼠中。 在神经元细胞中,通过Sema6D刺激Plexin-A1介导了Rac(一种Rho GTP酶)的活性,然而在DAP12缺陷小鼠中,Sema6D没有影响Rac的活性。已有研究发现,在神经系统中神经纤毛蛋白的存在能够促进含有FERM结构域的GEF FARP2蛋白直接与Plexin-A1的相互作用,继而通过抑制PIPKI_61的功能来调节Rac1的活化和整合素的抑制,PIPKI_661作为一个磷脂酰肌醇激酶,能够促进整合素粘着斑装配。"

最近一份关于FARP2缺陷小鼠的分析显示FARP2不仅需要破骨细胞伪足小体重排和重吸收活性,而且在骨诱裂发生中还局限性的活化Rac1变成结构型的伪足小体。而且,FARP2可以参与调控破骨细胞中整合素3的活性。 实际上,FARP2表型缺陷的破骨细胞和那些Plexin-A1缺陷的破骨细胞很相似,虽然,在存在Sema6B或者Sema6D的情况下,FARP2表达缺陷导致骨诱裂发生的破坏,提示了在Pexin-A1介导的骨诱裂发生过程中,FARP2和TREM-2/DAP12控制了一个特殊的路径。然而,这两条独特的信号通路不同的调控骨诱裂发生过程。TREM-2/DAP12活化了NFATc1,它需要早期过程,而FARP2介导的信号通路需要骨诱裂发生的晚期过程,在伪足小体重排的期间。这些结果清楚的说明了semaphorins和它们的受体不仅是特殊细胞的导向分子,而且可以协调多重的信号通路来掌控多效性功能。 骨骼系统在发生和维持方面和心血管系统及神经系统有许多相似的地方,尤其是在细胞迁移和分化的背景下。不仅是因为骨骼被神经和血管浸润,而且是因为骨的形成和破坏包含了这些细胞的发展和指导[37]。 2.2.5 Sema7A Sema7A也称为CD108或者SemaK1,是一类glycosylphosphatidyl-inositol(GPI)锚定的semaphorin。它在免疫系统中因为它与痘苗病毒SemaphorinA39R同源第一次被认识[38-40]。Sema包含了一个含有500氨基酸的Sema结构域,这个结构域是Plexin-C1的结合位点。除此而外,Sema7A还包括了整合素结合位点Arg-Gly-Asp(RGD)。 Sema7A由许多种淋巴细胞、骨髓细胞或刚生成前和刚生成后的神经细胞表达[41-42]。Sema7A通过整合素1在轴突导向分子和巨噬/单核细胞方面以及不依赖Plexin-C1的MAPK信号传导通路起着重要作用[41,43-44]。Sema7A已经被报道会诱导趋化现象、产生炎性细胞因子(白细胞介素6、肿瘤坏死因子、白细胞介素8)以及单核细胞中的超氧化物释放[45],但是它不影响淋巴细胞中的细胞因子产生。除此而外,Sema7A还能诱导产生GM-CSF以及促进单核细胞分化为DCs[45]。最近,两个结构性的分析报告了Sema4D和Sema3A有一个7个叶片的螺旋桨结构,这种结构高度类似整合素受体的单位[46]。 此外,结合在Ⅰ型胶原(骨基质的主要成分)的整合素1由骨细胞大量的表达,包括成骨细胞和破骨细胞。另外,在细胞黏附和骨质吸收时破骨细胞通过一种依靠Ⅰ型胶原的作用机制来表达整合素1[47-48]。在成骨细胞及破骨细胞分化全过程中都有Sema7A表达,Sema7A通过整合素1增加了成骨细胞谱系的迁移,在重组Sema7A治疗的基础上也通过增加前体的融合来促进成熟的破骨细胞形成。一个韩国人的研究发现在绝经后的妇女身上Sema7A多态性和骨密度减少以及骨折风险增加有关。 半定量反转录PCR证实了Sema7AmRNA在小鼠头颅骨成骨和分化的所有阶段都表达,体外实验还能观察到它在最主要的破骨细胞分化过程中也表达并调节。这项研究第一次解释了Sema7A在骨细胞分化中可能发生作用[12]。 在综合这些实验结果的基础上,很清楚的可以发现Sema7A可能是一种可以帮助维持骨自身动态平衡的信号导向分子。 Semaphorin家族Sema3E、Sema3A、Sema4D、Sema6D、Sema7A存在部位及作用见表1。"

| [1] Cao X.Targeting osteoclast-osteoblast communication.Nat Med 2011;17(11):1344-1346. [2] Martin TJ,Sims NA.Osteoclast-derived activity in the coupling of bone formation to resorption. Trends Mol Med 2005;11(2): 76-81. [3] Hayden JM, Mohan S, Baylink DJ. The insulin-like growth factor system and the coupling of formation to resorption. Bone 1995;17(2 Suppl):93S-98S. [4] Tang Y, Wu X, Lei W, et al. TGF-beta1-induced migration of bone mesenchymal stem cells couples bone resorption with formation. Nat Med 2009;15(7):757-765. [5] Walker EC,McGregor NE,Poulton IJ,et al.Cardiotrophin-1 is an osteoclast-derived stimulus of bone formation required for normal bone remodeling.J Bone Miner Res 2008;23(12): 2025-2032. [6] Matsuo K, Irie N. Osteoclast-osteoblast communication. Arch Biochem Biophys 2008;473(2):201-209. [7] Takayanagi H. Osteoimmunology: shared mechanisms and crosstalk between the immune and bone systems. Nat Rev Immunol.2007;7(4):292-304. [8] Elefteriou F. Regulation of bone remodeling by the central and peripheral nervous system. Arch Biochem Biophys. 2008; 473(2):231-236. [9] Nakashima T, Hayashi M, Fukunaga T, et al. Evidence for osteocyte regulation of bone homeostasis through RANKL expression. Nat Med.2011;17(10):1231-1234. [10] Xiong J, Onal M, Jilka RL, et al. Matrix-embedded cells control osteoclast formation. Nat Med.2011;17(10):1235-1241. [11] Koh JM, Oh B, Lee JY, et al. Association study of semaphorin 7a (sema7a) polymorphisms with bone mineral density and fracture risk in postmenopausal Korean women. J Hum Genet. 2006;51(2):112-117. [12] Delorme G, Saltel F, Bonnelye E, et al. Expression and function of semaphorin 7A in bone cells. Biol Cell.2005;97(7): 589-597. [13] Takegahara N, Takamatsu H, Toyofuku T, et al. Plexin-A1 and its interaction with DAP12 in immune responses and bone homeostasis.Nat Cell Biol. 2006;8(6):615-622. [14] Sutton AL, Zhang X, Dowd DR, et al. Semaphorin 3B is a 1,25-Dihydroxyvitamin D3-induced gene in osteoblasts that promotes osteoclastogenesis and induces osteopenia in mice. Mol Endocrinol.2008;22(6):1370-1381. [15] Irie N, Takada Y, Watanabe Y, et al.Bidirectional signaling through ephrinA2-EphA2 enhances osteoclastogenesis and suppresses osteoblastogenesis. J Biol Chem.2009;284(21): 14637-14644. [16] Hayashi M, Nakashima T, Taniguchi M, et al. Osteoprotection by semaphorin 3A. Nature.2012;485(7396):69-74. [17] Negishi-Koga T, Shinohara M, Komatsu N, et al. Suppression of bone formation by osteoclastic expression of semaphorin 4D. Nat Med 2011;17(11):1473-80 [18] Zaidi M, Iqbal J. Translational medicine: Double protection for weakened bones. Nature.2012;485(7396):47-48. [19] Kolodkin AL, Matthes DJ, Goodman CS. The semaphorin genes encode a family of transmembrane and secreted growth cone guidance molecules.Cell 1993;75(7):1389-1399. [20] Unified nomenclature for the semaphorins/collapsins. Semaphorin Nomenclature Committee. Cell 1999;97(5):551-2 [21] Bagci T, Wu JK, Pfannl R, et al. Autocrine semaphorin 3A signaling promotes glioblastoma dispersal. Oncogene 2009; 28(40):3537-3550. [22] Chen G, Sima J, Jin M, et al. Semaphorin-3A guides radial migration of cortical neurons during development. Nat Neurosci.2008;11(1):36-44. [23] Sadanandam A,Rosenbaugh EG,Singh S,et al.Semaphorin 5A promotes angiogenesis by increasing endothelial cell proliferation, migration, and decreasing apoptosis. Microvasc Res.2010;79(1):1-9. [24] Takahashi T, Fournier A, Nakamura F, et al. Plexin-neuropilin-1 complexes form functional semaphorin-3A receptors. Cell. 1999;99(1):59-69. [25] Tamagnone L, Artigiani S, Chen H, et al. Plexins are a large family of receptors for transmembrane, secreted, and GPI-anchored semaphorins in vertebrates. Cell.1999; 99(1): 71-80. [26] Winberg ML, Noordermeer JN, Tamagnone L, et al. Plexin A is a neuronal semaphorin receptor that controls axon guidance. Cell.1998;95(7):903-916. [27] Kang S, Okuno T, Takegahara N, et al. Intestinal epithelial cell-derived semaphorin 7A negatively regulates development of colitis via alphavbeta1 integrin. J Immunol 2012;188(3) 1108-1116. [28] Pasterkamp RJ, Peschon JJ, Spriggs MK, et al. Semaphorin 7A promotes axon outgrowth through integrins and MAPKs. Nature 2003;424(6947):398-405. [29] Suzuki K, Okuno T, Yamamoto M, et al. Semaphorin 7A initiates T-cell-mediated inflammatory responses through alpha1beta1 integrin. Nature 2007;446(7136):680-684. [30] Kruger RP, Aurandt J, Guan KL. Semaphorins command cells to move. Nat Rev Mol Cell Biol 2005;6(10):789-800. [31] Kang S, Kumanogoh A. Semaphorins in bone development, homeostasis, and disease. Semin Cell Dev Biol 2013;24(3): 163-171. [32] Hughes A, Kleine-Albers J, Helfrich MH, et al. A class III semaphorin (Sema3e) inhibits mouse osteoblast migration and decreases osteoclast formation in vitro. Calcif Tissue Int 2012;90(2):151-162. [33] Fukuda T, Takeda S, Xu R, et al. Sema3A regulates bone-mass accrual through sensory innervations. Nature 2013;497(7450):490-493. [34] Kruger RP, Aurandt J, Guan KL. Semaphorins command cells to move. Nat Rev Mol Cell Biol.2005;6(10):789-800. [35] Takahashi T, Fournier A, Nakamura F, et al. Plexin-neuropilin-1 complexes form functional semaphorin-3A receptors. Cell.1999;99(1):59-69. [36] Takegahara N, Takamatsu H, Toyofuku T, et al. Plexin-A1 and its interaction with DAP12 in immune responses and bone homeostasis.Nat Cell Biol. 2006;8(6):615-622 [37] Martin TJ, Sims NA. Osteoclast-derived activity in the coupling of bone formation to resorption. Trends Mol Med. 2005;11(2):76-81. [38] Angelisova P, Drbal K, Cerny J, et al. Characterization of the human leukocyte GPI-anchored glycoprotein CDw108 and its relation to other similar molecules. Immunobiology.1999; 200(2): 234-245. [39] Lange C, Liehr T, Goen M, et al. New eukaryotic semaphorins with close homology to semaphorins of DNA viruses. Genomics.1998;51(3):340-350. [40] Xu X,Ng S,Wu ZL,et al.Human semaphorin K1 is glycosylphosphatidylinositol-linked and defines a new subfamily of viral-related semaphorins. J Biol Chem.1998; 273(35):22428-22434. [41] Pasterkamp RJ, Peschon JJ, Spriggs MK, et al. Semaphorin 7A promotes axon outgrowth through integrins and MAPKs. Nature.2003;424(6947):398-405. [42] Holmes S, Downs AM, Fosberry A, et al. Sema7A is a potent monocyte stimulator. Scand J Immunol 2002;56(3):270-275. [43] Kang S, Okuno T, Takegahara N, et al. Intestinal epithelial cell-derived semaphorin 7A negatively regulates development of colitis via alphavbeta1 integrin. J Immunol 2012;188(3): 1108-1116. [44] Suzuki K, Okuno T, Yamamoto M, et al. Semaphorin 7A initiates T-cell-mediated inflammatory responses through alpha1beta1 integrin. Nature 2007;446(7136):680-684. [45] Holmes S, Downs AM, Fosberry A, et al. Sema7A is a potent monocyte stimulator. Scand J Immunol 2002;56(3):270-275. [46] Love CA, Harlos K, Mavaddat N, et al.The ligand-binding face of the semaphorins revealed by the high-resolution crystal structure of SEMA4D. Nat Struct Biol 2003;10(10):843-848. [47] Helfrich MH, Nesbitt SA, Lakkakorpi PT, et al. Beta 1 integrins and osteoclast function: involvement in collagen recognition and bone resorption. Bone 1996;19(4):317-328. [48] Gronthos S, Stewart K, Graves SE, et al. Integrin expression and function on human osteoblast-like cells. J Bone Miner Res.1997;12(8):1189-1197. |
| [1] | Zhang Yun-ge, Song Ke-guan. Periprosthetic osteolysis induced by wear particles: research progress of calcineurin/activated T cell nuclear factor signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(7): 1115-1122. |
| [2] | Xi Li-cheng, Li Hong-yu. Research progress of the influence of alcohol on the local microenvironment of femoral head [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(7): 1137-1142. |
| [3] | Lin Shu-zhong, Liu Jun. Effects of different doses of puerarin on osteoblasts in vitro [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(11): 1658-1662. |
| [4] | Han Xiang-zhen, He Hui-yu, Hu Yang, Ba Jiao-jiao, Wang Huan-huan, Mi Xue, Abulizi•Abudula. Recombinant lentiviral vector transfected sheep bone marrow mesenchymal stem cells and osteogenic gene expression changes [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(6): 821-828. |
| [5] | Liu Rui, Jiang Ke, Zhao Bao-dong, Zeng Rong-chang, Xu Hao, Wang Lan-ying. In vitro biocompatibility and bioactivity of a new medical Mg-Li-Ca alloy [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(52): 8409-8413. |
| [6] | Fu Lei, Ke Dan-dan, Zhang Ling-li, Lu Da-jiang. Exercise and bone metabolism: evaluation based on bone mineral density, bone biomechanics and biochemical indicators [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(46): 7487-7491. |
| [7] | Geng Hai-xia, Guo Xiu-juan, Qian Jun-rong, Feng Wei . Imaging evaluation of hydroxyapatite/gel nano-composite in rabbit skull defect repair [J]. Chinese Journal of Tissue Engineering Research, 2014, 18(34): 5413-5417. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||