Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (29): 6260-6268.doi: 10.12307/2025.742
Previous Articles Next Articles
Mechanisms by which traumatic brain injury promotes bone callus formation and fracture healing
Liu Hanfei, Cai Zhencun, Zhou Xueting, Wen Hang, Chen Zhenjun
- Central Hospital of Shenyang Medical College, Shenyang 110024, Liaoning Province, China
-
Received:2024-09-06Accepted:2024-10-31Online:2025-10-18Published:2025-03-07 -
Contact:Chen Zhenjun, MS, Chief physician, Central Hospital of Shenyang Medical College, Shenyang 110024, Liaoning Province, China -
About author:Liu Hanfei, Master candidate, Central Hospital of Shenyang Medical College, Shenyang 110024, Liaoning Province, China -
Supported by:Shenyang Science and Technology Program Project, No. 22-321-32-13 (to CZC); The 2023 Basic Research Project of Liaoning Provincial Department of Education, No. JYTMS20231396 (to CZC)
CLC Number:
Cite this article
Liu Hanfei, Cai Zhencun, Zhou Xueting, Wen Hang, Chen Zhenjun. Mechanisms by which traumatic brain injury promotes bone callus formation and fracture healing[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(29): 6260-6268.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
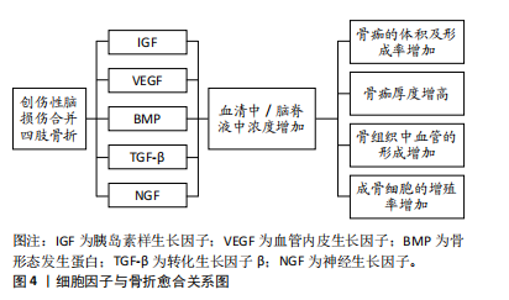
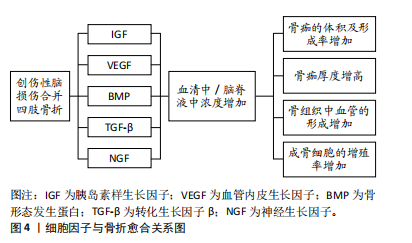
2.1 创伤性脑损伤的病生改变 2.1.1 炎症反应 创伤性脑损伤后会触发炎症反应,包括激活免疫细胞、释放细胞因子和炎症递质[5]。这些细胞因子和炎症递质积聚在骨折部位的血肿中,免疫细胞在血肿中清除细胞碎片和代谢产物,从而促进骨折愈合。SHIM等[14]的研究显示,与单纯骨折患者相比,合并创伤性脑损伤骨折患者的白细胞和淋巴细胞增多,红细胞、血红蛋白和血细胞比容减少,这表明创伤性脑损伤加速骨折愈合与增强的炎症状态有关。韩立功等[15]的研究发现在创伤性脑损伤合并骨折的情况下,实验动物的骨折愈合明显加快,这可能与血清中花生四烯酸和环氧二十碳三烯酸水平的升高有关。此外,创伤性脑损伤后由免疫细胞释放的白细胞介素和肿瘤坏死因子α等炎性细胞因子在早期具有促炎作用,对骨折修复有积极影响,在晚期,它们显示出抗炎作用,这表明某些炎性细胞因子具有双重功能[16-17],而过度的或长时间的炎症反应会导致组织损伤和神经功能障碍[18]。由于创伤性脑损伤后全身性炎症逐渐转变为适应性免疫反应,并进入慢性阶段,这一过程可能持续数天、数周甚至数年,实际上可能加速骨质的恶化。例如,白细胞介素6,11,18的全身性增加不仅能够直接激活破骨细胞的活动,还可能通过成骨细胞系的间接作用,利用核转录因子κB受体活化因子配体促进破骨细胞的形成[19-20]。核转录因子κB受体活化因子配体是一种关键的信号分子,属于肿瘤坏死因子家族,其在骨代谢和免疫调节中发挥重要作用,特别是在破骨细胞(负责骨质吸收的细胞)的形成、激活和存活过程中。ZHANG等[21]的研究表明,骨折后免疫细胞迅速聚集到骨折部位,释放的肿瘤坏死因子α对间充质干细胞介导的骨折愈合至关重要,而过高的肿瘤坏死因子α水平可能阻碍骨折愈合,影响骨质。 创伤性脑损伤与长骨骨折常在多发性创伤中同时出现。与单纯创伤性脑损伤相比,这种组合损伤在小鼠模型中引发更强的促炎反应,如白细胞介素1β水平升高,伴随神经病理学恶化,以及中性粒细胞和水肿的显著增加[22]。SHULTZ等[23]的研究进一步证实,骨折可显著加重创伤性脑损伤的预后,创伤性脑损伤加骨折组的小鼠在MRI中显示脑室扩大和扩散异常,并伴有更严重的神经炎症、水肿及血脑屏障损伤。结果表明,胫骨骨折通过加剧神经炎症,显著影响创伤性脑损伤的恢复过程,这种双向作用机制不仅表明创伤性脑损伤可通过促进骨痂形成加速骨折愈合,骨折也会通过引发全身炎症反应加重创伤性脑损伤后的神经损伤。两者之间的复杂相互作用对患者预后产生深远影响,值得深入研究与探索。 2.1.2 血脑屏障的破坏 血脑屏障是由血管内皮细胞、基底膜和星形胶质细胞等构成的生理屏障,限制大多数物质通过血液进入脑组织,以维持大脑的稳定环境并保护神经细胞功能。然而,在创伤性脑损伤后,血脑屏障的完整性受到破坏。血脑转移常数(Ki)用于评估物质通过血脑屏障的速率,反映其通透性。JUNGNER等[24]的研究表明,脑损伤损伤区域的Ki值增加了2-10倍,意味着血脑屏障的通透性大幅提升,导致蛋白质及离子等物质异常渗入脑组织。大量血浆蛋白的渗入不仅加剧了脑组织中的炎症反应,还与神经源性炎症形成了正反馈机制,促使促炎递质和氧化因子的持续释放,进一步扩大了炎症范围,导致更严重的神经损伤[25]。此外,创伤性脑损伤导致的血脑屏障破坏使得免疫细胞得以穿越屏障进入中枢神经系统,进一步加剧局部的炎症反应[26]。免疫细胞不仅在大脑内部活动,还可能通过血液迁移至其他损伤部位,如骨折区域,在这些区域释放细胞因子和炎症递质,影响骨痂形成和骨愈合过程。因此,创伤性脑损伤不仅对脑组织造成损伤,还会引发全身性免疫反应。 2.2 骨折愈合的生理过程及创伤性脑损伤相关研究时线图 骨折愈合过程主要分为3个关键阶段,包括血肿炎症机化期、原始骨痂形成期和骨痂改造塑形期[27]。血肿炎症机化期又涉及许多生理变化,如各种细胞因子和炎性递质的释放。骨折部位的坏死骨细胞、成骨细胞和被吸收的骨基质会释放内源性生长因子,如胰岛素样生长因子、血管内皮生长因子及转化生长因子β等,这些因子可刺激血管生成,促进间充质干细胞的聚集和增殖,并在炎症阶段诱导间充质干细胞分化为成骨细胞,因此这些细胞因子在骨折愈合过程中发挥重要作用[28]。促炎细胞因子的释放(白细胞介素1、白细胞介素6及肿瘤坏死因子α)同样可以促进间充质干细胞分化为成骨细胞,而骨形态发生蛋白则在间充质干细胞分化过程中起诱导作用[29]。此外,转化生长因子β是成纤维细胞的趋化因子,成纤维细胞在骨折愈合阶段合成并分泌大量胶原纤维,胶原纤维转化成纤维结缔组织,从而连接骨折两端促进骨折愈合。然而,研究也表明,创伤性脑损伤可能对骨形成质量产生负面影响。部分研究指出,经历过创伤性脑损伤患者患骨量减少和骨质疏松症的风险可能显著增加[30-31],这两种疾病是无症状的全身性骨骼疾病,会导致骨组织微观结构恶化,从而导致骨骼脆弱,最终导致骨折。在动物模型中,创伤性脑损伤显著降低了皮质骨的骨密度 [32-33],并降低了胫骨小梁骨的质量 [34]。而且已有研究表明,患有创伤性脑损伤的成年人股骨骨密度下降幅度更大,并伴有维生素D缺乏[30]。 2.3 细胞因子 创伤性脑损伤合并四肢骨折的情况下,血清和脑脊液中多种生长因子的浓度发生变化并对骨愈合过程有影响。具体来说,胰岛素样生长因子、血管内皮生长因子、骨形态发生蛋白、转化生长因子β和神经生长因子的浓度显著增加,这些生长因子的上调不仅促进了骨痂的体积和形成速率的增加,还导致骨痂厚度的增加以及骨组织中血管的形成增强,成骨细胞的增殖率也随之提高,从而加速了骨愈合的进程。这些变化表明,创伤性脑损伤对骨愈合的积极影响可能与生长因子的释放和相互作用密切相关,为未来的临床治疗提供了重要的理论基础。创伤性脑损伤后的细胞因子的变化及其对骨折愈合的促进作用见图4。"

2.3.1 胰岛素样生长因子 胰岛素样生长因子包括胰岛素样生长因子1和胰岛素样生长因子2,主要由肝脏合成,受到生长激素的调控,促进骨骼、软组织生长,维护神经系统和肌肉。胰岛素样生长因子在创伤性脑损伤加速骨折愈合方面的研究涵盖了病例对照研究和实验研究,涉及人类患者和动物模型,重点探讨胰岛素样生长因子1,2的作用。研究表明,创伤性脑损伤伴随骨折的患者中,胰岛素样生长因子的水平显著增加,并与骨折愈合速度加快相关。此外,研究还探讨了胰岛素样生长因子与创伤性脑损伤严重程度的关系,以及其与其他生长因子(如血小板衍生生长因子)在骨折愈合中的协同作用。 CHEN等[35]的研究比较了单纯骨折的大鼠(单纯骨折组)和合并创伤性脑损伤的骨折大鼠(合并组),结果显示合并组血清胰岛素样生长因子1水平显著高于单纯骨折组;此外,与单纯骨折组相比,合并组的大鼠骨折愈合加速,骨痂体积、梁宽度和梁骨比例显著改善。MOLLAHOSSEINI等[36]进行了一项临床病例对照研究,结果显示创伤性脑损伤合并骨折组患者的血清胰岛素样生长因子1水平在脑损伤后的12 h和4周时显著增加,其骨折愈合时间短于单纯骨折组。ZHANG等[37]对不同程度创伤性脑损伤患者的血清胰岛素样生长因子1 的浓度变化进行了研究,发现血清中胰岛素样生长因子1浓度与脑损伤的严重程度呈反比。胰岛素样生长因子2在胎儿发育中表达显著,成年后表达较低,同样具有生长和细胞增殖功能。因此,还有研究调查了患者在创伤性脑损伤后胰岛素样生长因子2水平的一系列变化,发现创伤性脑损伤合并骨折的患者中胰岛素样生长因子2水平明显高于单纯骨折组,骨痂形成率也显著提高[38-39]。此外,有研究指出,创伤性脑损伤后患者血清中的胰岛素样生长因子1和血小板衍生生长因子可能协同促进骨折愈合,血小板衍生生长因子的表达水平随着骨折愈合过程进展逐渐增高,在合并 创伤性脑损伤骨折患者的骨折愈合过程中发挥了重要作用[40-41],具体研究成果见表1。因此,创伤性脑损伤合并骨折患者的血清中胰岛素生长因子水平升高会加速骨折愈合,但胰岛素样生长因子与其他因子的联合作用以及在不同程度脑损伤情况下是否仍会对骨折愈合产生积极影响有待研究。"

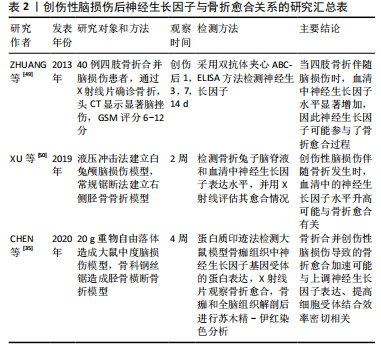
2.3.2 血管内皮生长因子 血管内皮生长因子是主导新血管形成的关键因子,成骨细胞和软骨细胞释放的血管内皮生长因子能够引导骨组织中血管的形成[42]。血管内皮生长因子可增加血管通透性参与组织修复,为组织提供氧气和营养,支持创伤愈合,推动有效的组织修复和再生。有研究发现降钙素基因相关肽、血管内皮生长因子是骨折合并创伤性脑损伤后加速骨痂形成的主要生长因子,血管内皮生长因子A和α-降钙素基因相关肽的协同作用促进骨痂中骨生成H型血管的形成[43-44]。ZHANG等[45]的研究发现,与单纯锁骨骨折患者相比,锁骨骨折合并创伤性脑损伤患者的骨痂中血管内皮生长因子的表达明显增加,且合并组患者骨折愈合时间明显缩短。还有研究发现,创伤性脑损伤合并骨折的患者血清中血管内皮生长因子表达在高峰值、高峰出现时间和维持时间方面与单纯骨折患者之间存在显著差异[46]。这些研究结果表明血管内皮生长因子通过促进血管生成参与骨折愈合过程,因此创伤性脑损伤后血清中高血管内皮生长因子水平可促进骨痂形成和加速骨折愈合。这些发现为理解创伤性脑损伤对骨折部位骨痂形成的影响提供了新的认识。 2.3.3 骨形态发生蛋白和转化生长因子β 骨形态发生蛋白是一类在生物体内作为生长因子发挥作用的蛋白质,对于骨骼的形成具有重要的调控作用。DING等[47]的研究使用软骨细胞特异性缺失骨形态发生蛋白2的小鼠模型,发现软骨骨痂形成的延长和骨生成的延迟。MOLLAHOSSEINI等[36]还研究了合并股骨骨折(合并组)的创伤性脑损伤患者转化生长因子β和骨形态发生蛋白2血清水平的变化,发现转化生长因子β在12 h内显著增加,骨形态发生蛋白2在12 h内及4周后均显著升高,且合并组比单纯骨折组患者的骨折愈合时间更短。CHEN等[35]的研究还发现了合并创伤性脑损伤的骨折大鼠模型中血清骨形态发生蛋白7和转化生长因子β1水平显著高于单纯骨折组。因此,合并创伤性脑损伤患者的骨折愈合加速可能通过上调骨形态发生蛋白和转化生长因子β来实现。但GAUTSCHI等[48]的研究观察到创伤性脑损伤组患者的脑脊液对成骨细胞的增殖率显著高于无创伤性脑损伤组和对照组患者,虽然研究发现创伤性脑损伤患者的脑脊液具有成骨诱导效应,但具体的成骨诱导因子(如骨形态发生蛋白2,4,7和S100B 在脑脊液中的水平较低)在脑脊液中是否对成骨存在诱导效应尚未确定。 2.3.4 神经生长因子 神经生长因子是一种重要的神经营养因子,促进神经元的生存、分化和生长,并在神经系统的发育、修复和神经退行性疾病中发挥关键作用。但有研究表明, 创伤性脑损伤伴随骨折时神经生长因子水平显著升高,并与加速骨折愈合有关。多项研究探讨了神经生长因子在创伤性脑损伤患者中的表达上调,以及其通过增强受体结合效率和促进骨折修复的作用[49-50]。关于创伤性脑损伤后神经生长因子与骨折愈合关系的研究详细信息见表2。 ZHUANG等[49]调查了40例创伤性脑损伤合并四肢骨折患者中神经生长因子的表达情况,发现创伤性脑损伤合并四肢骨折组的患者神经生长因子水平显著高于其他组。与该研究相似的是,ZHANG等[45]研究了创伤性脑损伤合并锁骨骨折(合并组)患者和单纯锁骨骨折(单纯骨折组)患者的神经生长因子的表达情况,同样发现合并组患者血清中神经生长因子的表达高于单纯骨折组。还有研究人员建立了一系列动物模型来探究创伤性脑损伤后神经生长因子的表达水平及其对骨折愈合的影响。XU等[50] 的研究建立了创伤性脑损伤合并胫骨骨折的兔模型,发现血清中的神经生长因子含量显著增加。类似于XU等[50]的研究,CHEN等[35]建立了创伤性脑损伤合并胫骨骨折的大鼠模型,发现在骨折伴有创伤性脑损伤的情况下,血清中神经生长因子水平显著增加,且第14天时创伤性脑损伤合并骨折组的骨折愈合情况优于单纯骨折组。以上"

2.4.1 生长激素 生长激素在生长、细胞修复和代谢调节等生理过程中扮演着至关重要的角色,它不仅直接促进骨骼、肌肉和内脏器官的生长和发育,而且还通过激活肝脏产生胰岛素样生长因子1,间接促进细胞的生长和分化。RAVI等[2]的研究表明,在创伤性脑损伤后,骨痂量增加与生长激素水平的增加呈正相关,特别是在严重的创伤性脑损伤患者中,经过6个月的观察后,创伤性脑损伤合并骨折患者的骨痂量显著增加。此外,KHALLAF等[52] 对162例患有创伤性脑损伤并伴有骨折患者的骨折愈合情况进行了研究,结果显示创伤性脑损伤合并骨折组患者的愈合时间短、骨痂厚度高及愈合率高,且该组的生长激素水平高于单纯骨折组。因此,以上研究提示创伤性脑损伤后生长激素水平的增加有助于增强合并创伤性脑损伤患者的骨折愈合。然而,曾有研究表明,生长激素显著加速闭合性骨折的愈合过程,而在开放性骨折中没有观察到生长激素对骨折愈合时间的显著影响[53]。这表明生长激素对骨折愈合的影响可能因骨折类型而异。因此,需要进一步研究创伤性脑损伤后生长激素对开放性骨折患者的影响,同时血清生长激素与胰岛素生长因子之间协同促进骨折愈合的具体机制也有待进一步研究。表3汇总了关于生长激素在长骨骨折患者中的作用的研究,并揭示了神经激素机制在骨折修复中的潜在作用。"

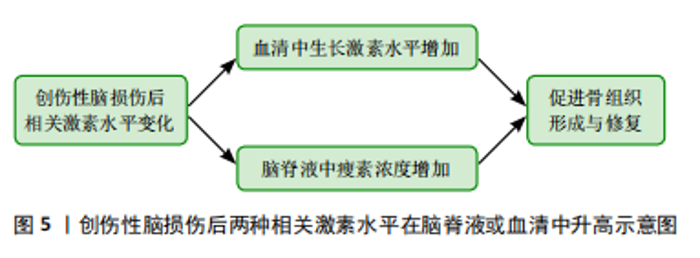
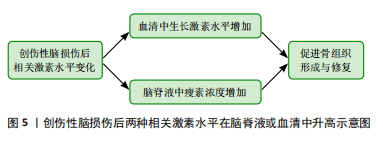
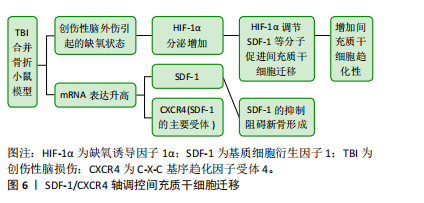
2.4.2 瘦素 瘦素是一种由脂肪细胞产生的激素,对体质量和能量平衡具有重要的调控作用。它被认为是一种饱腹激素,主要通过作用于大脑的食欲中枢来调节食物摄入和能量消耗。但总结以往的研究表明,瘦素对骨折愈合也具有积极的影响,而且瘦素还可能与其他生长因子和激素相互作用,形成复杂的调控网络,通过多种途径影响骨组织的形成和修复。综合分析以往的研究,发现瘦素对骨折愈合具有积极影响。创伤性脑损伤患者血清瘦素水平升高的原因主要有3点,首先高代谢引发游离脂肪酸的动员,其次缺氧状态下脂肪细胞瘦素表达增加,最后骨折部位骨髓释放的含造血细胞物质促进了瘦素在组织中的传递 [54]。YAN等[55]的研究发现创伤性脑损伤患者脑脊液中的瘦素浓度增加,结合血清中生长激素和胰岛素样生长因子1的升高,可能是导致骨折愈合加速的主要原因。WANG等[56]的研究将72只有股骨骨折的雄性 SD 大鼠分为接受生理盐水和瘦素治疗的2组,结果显示在第8周时瘦素组的大鼠骨折愈合速度明显快于生理盐水组。GARBE等[57]的研究比较了野生型小鼠和ob/ob小鼠(缺乏功能性瘦素的实验室小鼠)的骨折愈合情况,结果发现缺乏瘦素会干扰小鼠的骨折愈合。GRAEF等[58]和SEEMANN等[59]对骨折合并创伤性脑损伤的ob/ob小鼠进行了研究,发现在骨折愈合过程中,这些小鼠的骨痂形成受损,且骨不连率增加。以上研究强调了瘦素在创伤性脑损伤后骨痂形成及骨折愈合中的关键作用,创伤性脑损伤后血脑屏障破裂可能使瘦素进入脑脊液,从而促进骨愈合。 2.5 创伤性脑损伤促进骨折愈合的可能神经机制 2.5.1 降钙素基因相关肽 降钙素基因相关肽是一种有效的血管扩张剂,并且还可以在生理和病理条件下为伤口愈合提供保护机制。很早就有研究表明,创伤性脑损伤后大鼠骨痂中的降钙素基因相关肽有显著性改变[60]。降钙素基因相关肽通过促进成骨细胞中环腺苷单磷酸和胰岛素样生长因子1的生成,同时可以抑制促破骨细胞生成的促炎因子肿瘤坏死因子α的生成 [61]。因此,降钙素基因相关肽通过调节骨细胞活动、影响炎症反应并与神经系统相互作用来影响骨折愈合过程 [62]。APPELT等[63]研究的野生型小鼠在股骨骨折期间显示出降钙素基因相关肽水平增加,而α-降钙素基因相关肽缺陷小鼠出现成骨细胞减少,骨愈合受损。降钙素基因相关肽诱导与骨化、骨重塑和脂肪生成相关的基因表达,揭示了α-降钙素基因相关肽在促进骨再生中的关键作用。XU等[50]研究了兔模型的脑脊液中和血清中降钙素基因相关肽表达情况,结果显示创伤性脑损伤合并骨折导致血清中降钙素基因相关肽水平显著增加,SONG等[64]分析了SD大鼠模型中海马降钙素基因相关肽的表达情况,并发现创伤性脑损伤合并骨折组中降钙素基因相关肽表达增加。但也有研究表明降钙素基因相关肽主要集中在骨折愈合的早、中期表达[65]。降钙素基因相关肽在创伤性脑损伤合并骨折患者中,通过促进细胞趋化、增殖和分化,加速了骨折的早期和中期愈合。然而,随着时间的推移,降钙素基因相关肽在愈合晚期的表达可能发生变化,这反映了其动态调控作用。因此,降钙素基因相关肽在骨折修复和再生中发挥了重要作用,但尚需进一步研究其晚期表达变化及影响,以全面理解其调控机制。 2.5.2 交感神经 NIEDERMAIR等[66]的研究探讨了交感神经在骨折愈合中的作用,他们的实验证明交感神经的损伤不仅降低了小鼠的运动能力,还影响了骨痂的重塑过程,这表明神经元通路在骨折愈合中扮演着至关重要的角色。还有研究人员发现创伤性脑损伤后交感神经张力增高,交感神经的兴奋状态可以促使肾上腺素的释放,从而加速骨折愈合。创伤性脑损伤诱导的肾上腺素信号过敏促使骨髓造血干细胞增殖,并向抗炎髓系细胞转变,β3-和β2-肾上腺素受体激动剂协同促进M2巨噬细胞在骨痂中的浸润[67]。不仅肾上腺素受体在创伤性脑损伤后的骨痂形成中发挥了积极作用,肾上腺素能受体也同样对骨痂形成有显著的促进效果。JAHN等[43]的研究发现,在接受去甲肾上腺素治疗的患者中,骨痂形成情况得到了明显改善,β2肾上腺素能受体可能是促进骨愈合的潜在治疗靶点。随着深入了解神经系统对骨折愈合的调控机制,可以更有针对性地干预这些机制,以促进更快、更有效的骨折愈合。 2.6 创伤性脑损伤促进骨折愈合的可能其他机制 2.6.1 非编码RNA 神经干细胞在创伤性脑损伤后释放出外泌体,外泌体中所含的非编码RNA参与了骨折愈合过程,并在间充质干细胞的成骨分化、破骨细胞的骨吸收和血管生成等方面发挥调控作用[68-69]。LIN等[70]的研究发现创伤性脑损伤患者循环外分泌体中富含miR-21-5p,而这些富含miR-21-5p的创伤性脑损伤-外泌体可以通过调节SMAD7信号通路促进成骨细胞分化和骨重塑,有助于骨折愈合。HAN等[71]的研究发现,与单纯骨折患者相比,创伤性脑损伤合并骨折患者的血浆和骨痂中SPP1的mRNA和蛋白水平升高,这种上升趋势可能是由于miR-433表达下调所致。创伤性脑损伤诱导的SPP1表达增加可能增强了骨折患者的骨痂形成,但未改变骨折愈合时间。此外,创伤性脑损伤也还影响了其他miRNA如miR-92a-3p,miR-16-5p和miR-26a-5p的表达水平,这些miRNA参与调节骨折愈合过程中成骨细胞的分化[72-74]。例如,研究表明miR-16-5p在创伤性脑损伤患者中表达下调,这一变化与成骨细胞增殖的促进和凋亡的抑制相关,从而加速了骨折愈合过程。miR-16-5p通过直接靶向Bcl-2和Cyclin-D1,负向调节这些基因的表达,进而影响成骨细胞的活动[73]。长链非编码RNA在创伤性脑损伤后的骨折愈合过程中也发挥着关键作用,调节多种细胞的变化,包括嗜碱性粒细胞、CD8+T效应记忆细胞、幼稚B细胞和B细胞的下调,以及微血管内皮细胞的上调。血管内皮细胞与成骨细胞之间通过分泌的细胞因子和信号分子(如转化生长因子β、骨形态发生蛋白和白细胞介素6)进行沟通,这些信号分子能够调节成骨细胞的增殖和分化,进而支持骨代谢和修复 [75]。因此,长链非编码RNA可能通过影响成骨细胞的增殖、分化和功能,以及调节骨折愈合过程中的炎症反应和免疫细胞的活性,从而在创伤性脑损伤加速骨折愈合中发挥作用[76]。 2.6.2 干细胞 创伤性脑损伤不仅是神经系统的重大损伤事件,同时也能引发全身范围的复杂病理生理反应。有研究发现,在建立的创伤性脑损伤大鼠模型上会监测出脑电信号的异常[77],此时干细胞通过调节免疫系统、内分泌系统以及炎症反应,显著促进了受损组织的修复和再生。AHMED等[78]的研究发现,在创伤性脑损伤后,原本处于休眠状态的干细胞可以在受损区域重新活化并开始增殖。这些干细胞不仅具备多能性,还能够分化为成骨细胞,直接参与骨折部位的修复过程,显著加速骨组织的再生与愈合。类似地,KRUMINA等[79]和LEI等[80]通过在SD大鼠上的实验进一步证实了骨髓间充质干细胞的重要作用,实验结果表明,骨髓间充质干细胞移植能够显著促进骨缘的巩固、骨痂的形成,且有助于新生骨小梁的增大和成熟。LIU等[81]在创伤性脑损伤合并骨折的小鼠模型中观察到,SDF-1和CXCR4信使RNA的表达水平显著增加。这一现象表明SDF-1/CXCR4轴在骨折修复过程中发挥了重要作用,见图6。当SDF-1的表达被抑制时,新骨的形成过程会受到明显阻碍。进一步研究还发现,创伤性脑损伤诱导的缺氧状态能够通过增加低氧诱导因子1α的分泌,间接促进SDF-1等分子对间充质干细胞的调控,增强骨髓间充质干细胞向缺血缺氧区域迁移的能力。XUE等[82]的研究指出,这一过程不仅有助于骨折愈合,还对组织缺氧后的再生修复提供了理论依据。这些发现为干细胞疗法在临床骨折修复中的应用提供了坚实的实验依据。SDF-1/CXCR4轴被认为是创伤性脑损伤后骨折愈合中非常关键的信号通路,它不仅调节着干细胞的趋化性,还对骨组织的再生具有深"

远的影响。在研究骨折愈合相关信号通路的过程中,有研究者发现骨髓间充质干细胞衍生的外泌体能够通过激活骨形态发生蛋白2/Smad1/RUNX2信号通路来促进成骨细胞的生成,该信号通路在骨髓间充质干细胞的增殖和成骨分化中发挥关键作用。使用骨形态发生蛋白2抑制剂(如noggin和LDN193189)时,骨髓间充质干细胞衍生外泌体对Smad1和RUNX2蛋白表达的促进效应显著降低,进一步验证了骨髓间充质干细胞衍生外泌体通过骨形态发生蛋白2/Smad1/RUNX2信号通路激活成骨分化。此外,该外泌体显著增加了骨折部位的血管分支数量,提升了低氧诱导因子1α和血管内皮生长因子的表达水平,表明骨髓间充质干细胞衍生外泌体促进了骨折部位的血管生成,从而有助于骨修复[83]。尽管当前的研究已经提供了初步证据,显示干细胞在创伤性脑损伤后的骨折愈合中起到了积极作用,但未来还需要更多的深入研究来揭示创伤性脑损伤与骨折愈合之间复杂的相互作用机制。"

| [1] EINHORN TA, GERSTENFELD LC. Fracture healing: mechanisms and interventions. Nat Rev Rheumatol. 2015;11(1):45-54. [2] RAVI P, NAGESWARAN J, RAMANUJAM M, et al. Correlation between traumatic brain injuries and callusformation in long bone fractures. Indian J Orthop. 2022; 56(5):837-846. [3] TSITSILONIS S, SEEMANN R, MISCH M, et al. The effect of traumatic brain injury on bone healing: an experimental study in a novel in vivo animal model. Injury. 2015;46(4):661-665. [4] BRADY RD, GRILLS BL, CHURCH JE, et al. Closed head experimental traumatic brain injury increases size and bone volume of callus in mice with concomitant tibial fracture. Sci Rep. 2016;6:34491. [5] RUSSO MV, MCGAVERN DB. Inflammatory neuroprotection following traumatic brain injury. Science. 2016;353(6301):783-785. [6] CALANDRIELLO B. Callus formation in severe brain injuries. Bull Hosp Joint Dis. 1964;25:170-175. [7] ROBERTS PH. Heterotopic ossification complicating paralysis of intracranial origin. J Bone Joint Surg Br. 1968;50-B(1):70-77. [8] GARLAND DE, DOWLING V. Forearm fractures in the head-injured adult. Clin Orthop Relat Res. 1983;(176):190-196. [9] NEWMAN RJ, STONE MH, MUKHERJEE SK. Accelerated fracture union in association with severe head injury. Injury. 1987;18(4):241-246. [10] WILDBURGER R, ZARKOVIC N, EGGER G, et al. Basic fibroblast growth factor (BFGF) immunoreactivity as a possible link between head injury and impaired bone fracture healing. Bone Miner. 1994;27(3):183-192. [11] WILDBURGER R, ZARKOVIC N, TONKOVIC G, et al. Post-traumatic hormonal disturbances: prolactin as a link between head injury and enhanced osteogenesis. J Endocrinol Invest. 1998;21(2):78-86. [12] KUSHWAHA VP, GARLAND DG. Extremity fractures in the patient with a traumatic brain injury. J Am Acad Orthop Surg. 1998;6(5):298-307. [13] WEI Y, WANG L, CLARK JC, et al. Elevated leptin expression in a rat model of fracture and traumatic brain injury. J Pharm Pharmacol. 2008;60(12):1667-1672. [14] SHIM DW, HONG H, CHO KC, et al. Accelerated tibia fracture healing in traumatic brain injury in accordance with increased hematoma formation. BMC Musculoskelet Disord. 2022;23(1):1110. [15] 韩立功,刘林,陈天成,等.脑外伤合并尺骨骨折家兔血清花生四烯酸、环氧二碳三烯酸的变化及对骨折愈合的影响[J].徐州医科大学学报,2017,37(7): 448-451. [16] CORREALE J, VILLA A. The neuroprotective role of inflammation in nervous system injuries. J Neurol. 2004;251(11):1304-1316. [17] CRUPI R, CORDARO M, CUZZOCREA S, et al. Management of traumatic brain injury: from present to future. Antioxidants (Basel). 2020;9(4):297. [18] CALIS Z, MOGULKOC R, BALTACI AK. The roles of flavonols/flavonoids in neurodegeneration and neuroinflammation. Mini rev med chem. 2020;20(15): 1475-1488. [19] SIMS NA. Cell-specific paracrine actions of IL-6 family cytokines from bone, marrow and muscle that control bone formation and resorption. Int J Biochem Cell Biol. 2016;79:14-23. [20] CIARAMELLA A, DELLA VEDOVA C, SALANI F, et al. Increased levels of serum IL-18 are associated with the long-term outcome of severe traumatic brain injury. Neuroimmunomodulation. 2014;21(1):8-12. [21] ZHANG E, MIRAMINI S, PATEL M, et al. Role of TNF-α in early-stage fracture healing under normal and diabetic conditions. Comput Methods Programs Biomed. 2022;213:106536. [22] SUN M, BRADY RD, WRIGHT DK, et al. Treatment with an interleukin-1 receptor antagonist mitigates neuroinflammation and brain damage after polytrauma. Brain Behav Immun. 2017;66:359-371. [23] SHULTZ SR, SUN M, WRIGHT DK, et al. Tibial fracture exacerbates traumatic brain injury outcomes and neuroinflammation in a novel mouse model of multitrauma. J Cereb Blood Flow Metab. 2015;35(8):1339-1347. [24] JUNGNER M, SIEMUND R, VENTUROLI D, et al. Blood-brain barrier permeability following traumatic brain injury. Minerva Anestesiol. 2016;82(5):525-533. [25] BAJWA NM, KESAVAN C, MOHAN S. Long-term consequences of traumatic brain injury in bone metabolism. Front Neurol. 2018;9:115. [26] ALLURI H, WIGGINS-DOHLVIK K, DAVIS ML, et al. Blood-brain barrier dysfunction following traumatic brain injury. Metab Brain Dis. 2015;30(5):1093-1104. [27] AURORA R, SILVA MJ. T cells heal bone fractures with help from the gut microbiome. J Clin Invest. 2023;133(8):e167311. [28] MARSELL R, EINHORN TA. The biology of fracture healing. Injury. 2011;42(6):551-555. [29] SALHOTRA A, SHAH HN, LEVI B, et al. Mechanisms of bone development and repair. Nat Rev Mol Cell Biol. 2020;21(11):696-711. [30] SMITH É, COMISKEY C, CARROLL Á. Prevalence of and risk factors for osteoporosis in adults with acquired brain injury. Ir J Med Sci. 2016;185(2):473-481. [31] BANHAM-HALL N, KOTHWAL K, PIPKIN J, et al. Prevalence of low bone mineral density in inpatients with traumatic brain injury receiving neurobehavioural rehabilitation: a postoperative, observational study. Physiotherapy. 2013;99(4): 328-334. [32] YU H, WATT H, MOHAN S. The negative impact of traumatic brain injury (TBI) on bone in a mouse model. Brain Inj. 2014;28(2):244-251. [33] BRADY RD, SHULTZ SR, SUN M, et al. Experimental Traumatic Brain Injury Induces Bone Loss in Rats. J Neurotrauma. 2016;33(23):2154-2160. [34] YU H, WERGEDAL JE, RUNDLE CH, et al. Reduced bone mass accrual in mouse model of repetitive mild traumatic brain injury. J Rehabil Res Dev. 2014;51(9): 1427-1437. [35] CHEN CH, GAN D, YANG CS, et al. Discussion on bone healing rate and expression of cytokines and growth factors in rat models with simple fracture and brain injury. J King Saud Univ Sci. 2020;32(4):2439-2444. [36] MOLLAHOSSEINI M, AHMADIRAD H, GOUJANI R, et al. The association between traumatic brain injury and accelerated fracture healing: a study on the effects of growth factors and cytokines. J Mol Neurosci. 2021;71(1):162-168. [37] ZHANG Z, WU X, KONG Y, et al. Dynamic changes and effects of H(2)S, IGF-1, and GH in the traumatic brain injury. Biochem Genet. 2024;62(5):3821-3840. [38] 张立沼.手术治疗对脑外伤合并骨折患者血清胰岛素样生长因子Ⅱ水平的影响[J].中国老年学杂志,2013,33(24):6310-6311. [39] 郑少涛,林喜容,周少鹏.脑外伤合并骨折患者血清胰岛素生长因子Ⅱ水平的变化[J].中国现代医生,2014,52(2):19-20. [40] 田宝鹏,陈雯辉,潘海涛,等.脑外伤后胰岛素样生长因子Ⅰ及血小板衍生生长因子对骨折愈合的影响[J].首都医科大学学报,2008,29(1):69-73. [41] 杨海,董金波,王维山,等.PDGF-BB在脑外伤合并骨折患者血液中的表达及临床意义[J].系统医学,2016,1(11):7-10. [42] 唐生平,廖世杰,黄乾,等.骨H型血管生成机制及影响因素的研究现状[J].中国矫形外科杂志,2024,32(6):525-529. [43] JAHN D, KNAPSTEIN PR, OTTO E, et al. Increased β(2)-adrenergic signaling promotes fracture healing through callus neovascularization in mice. Sci Transl Med. 2024;16(743):eadk9129. [44] 季卫锋,杨成贵,肖鲁伟.补肾助阳中药与合并脑外伤骨折加速愈合分子机制的研究[J].中华中医药学刊,2015,33(7):1570-1573. [45] ZHANG R, LIANG Y, WEI S. The expressions of NGF and VEGF in the fracture tissues are closely associated with accelerated clavicle fracture healing in patients with traumatic brain injury. Ther Clin Risk Manag. 2018;14:2315-2322. [46] 段世博,刘永杰,王志峰,等.血管内皮生长因子在骨折伴颅脑损伤患者血清中的表达[J].世界最新医学信息文摘,2018,18(34):132-133. [47] DING W, JI R, YAO S, et al. Hu’po Anshen decoction promotes fracture healing in mice with traumatic brain injury through BMP2-COX2-ATF4 signaling pathway. FASEB J. 2023;37(6):e22952. [48] GAUTSCHI OP, TOFFOLI AM, JOESBURY KA, et al. Osteoinductive effect of cerebrospinal fluid from brain-injured patients. J Neurotrauma. 2007;24(1):154-162. [49] ZHUANG YF, LI J. Serum EGF and NGF levels of patients with brain injury and limb fracture. Asian Pac J Trop Med. 2013;6(5):383-386. [50] XU YQ, QIN ML, FENG SY, et al. Expressions and significance of calcitonin gene-related peptide and nerve growth factor in rabbit model of traumatic brain injury complicated with tibial fracture: preliminary results. Eur Rev Med Pharmacol Sci. 2019;23(12):5040-5050. [51] Yang S, Cheng J, Man C, et al. Effects of exogenous nerve growth factor on the expression of BMP-9 and VEGF in the healing of rabbit mandible fracture with local nerve injury. J Orthop Surg Res. 2021;16(1):74. [52] KHALLAF FG, KEHINDE EO, HUSSEIN S. Bone healing and hormonal bioassay in patients with long-bone fractures and concomitant head injury. Med Princ Pract. 2016;25(4):336-342. [53] RASCHKE M, RASMUSSEN MH, GOVENDER S, et al. Effects of growth hormone in patients with tibial fracture: a randomised, double-blind, placebo-controlled clinical trial. Eur J Endocrinol. 2007;156(3):341-351. [54] ZHANG C, DENG K, GUO Y, et al. Research progress of correlation between traumatic brain injury and fracture healing. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2017;31(7):885-889. [55] YAN H, ZHANG HW, FU P, et al. Leptin’s effect on accelerated fracture healing after traumatic brain injury. Neurol Res. 2013;35(5):537-544. [56] WANG L, SUN S, YANG L, et al. Effects of leptin on femoral fracture in rats. J Biomed Res. 2018;32(2):130-135. [57] GARBE A, GRAEF F, APPELT J, et al. Leptin mediated pathways stabilize posttraumatic insulin and osteocalcin patterns after long bone fracture and concomitant traumatic brain injury and thus influence fracture healing in a combined murine trauma model. Int J Mol Sci. 2020;21(23):9144. [58] GRAEF F, SEEMANN R, GARBE A, et al. Impaired fracture healing with high non-union rates remains irreversible after traumatic brain injury in leptin-deficient mice. J Musculoskelet Neuronal Interact. 2017;17(2):78-85. [59] SEEMANN R, GRAEF F, GARBE A, et al. Leptin-deficiency eradicates the positive effect of traumatic brain injury on bone healing: histological analyses in a combined trauma mouse model. J Musculoskelet Neuronal Interact. 2018; 18(1):32-41. [60] 李祥泽,卜宪敏,李冬梅,等.创伤性脑外伤促进骨折愈合中的干细胞、细胞因子、激素、神经肽及基因[J].中国组织工程研究,2021,25(19):3057-3063. [61] XU J, WANG J, CHEN X, et al. The effects of calcitonin gene-related peptide on bone homeostasis and regeneration. Curr Osteoporos Rep. 2020;18(6):621-632. [62] PARKER RS, NAZZAL MK, MORRIS AJ, et al. Role of the neurologic system in fracture healing: an extensive review. Curr Osteoporos Rep. 2024;22(1):205-216. [63] APPELT J, BARANOWSKY A, JAHN D, et al. The neuropeptide calcitonin gene-related peptide alpha is essential for bone healing. EBioMedicine. 2020;59:102970. [64] SONG Y, HAN GX, CHEN L, et al. The role of the hippocampus and the function of calcitonin gene-related peptide in the mechanism of traumatic brain injury accelerating fracture-healing. Eur Rev Med Pharmacol Sci. 2017;21(7):1522-1531. [65] 孙东良,陈通,付爱军,等.颅脑损伤合并股骨闭合性骨折大鼠模型的建立及骨痂中降钙素基因相关肽的表达及意义[J].中国煤炭工业医学杂志, 2014,17(7):1123-1126. [66] NIEDERMAIR T, STRAUB RH, BROCHHAUSEN C, et al. Impact of the sensory and sympathetic nervous system on fracture healing in ovariectomized mice. Int J Mol Sci. 2020;21(2):405. [67] LIU WJ, CHEN W, XIE M, et al. Traumatic brain injury stimulates sympathetic tone-mediated bone marrow myelopoiesis to favor fracture healing. Signal Transduct Target Ther. 2023;8(1):260. [68] ZHONG L, WANG J, WANG P, et al. Neural stem cell-derived exosomes and regeneration: cell-free therapeutic strategies for traumatic brain injury. Stem Cell Res Ther. 2023;14(1):198. [69] 苏友祥,李志超,管华鹏,等.外泌体非编码RNA调控骨折愈合机理的研究进展[J].中国矫形外科杂志,2023,31(24):2260-2263, 2269. [70] LIN Z, XIONG Y, SUN Y, et al. Circulating miRNA-21-enriched extracellular vesicles promote bone remodeling in traumatic brain injury patients. Exp Mol Med. 2023;55(3):587-596. [71] HAN Z, SHI F, CHEN Y, et al. Relationship between miRNA-433 and SPP1 in the presence of fracture and traumatic brain injury. Exp Ther Med. 2021;22(3):928. [72] HU L, LIU J, XUE H, et al. miRNA-92a-3p regulates osteoblast differentiation in patients with concomitant limb fractures and tbi via IBSP/PI3K-AKT inhibition. Mol Ther Nucleic Acids. 2021;23:1345-1359. [73] SUN Y, XIONG Y, YAN C, et al. Downregulation of microRNA-16-5p accelerates fracture healing by promoting proliferation and inhibiting apoptosis of osteoblasts in patients with traumatic brain injury. Am J Transl Res. 2019;11(8):4746-4760. [74] XIONG Y, CAO F, HU L, et al. MiRNA-26a-5p accelerates healing via downregulation of PTEN in fracture patients with traumatic brain injury. Mol Ther Nucleic Acids. 2019;17:223-234. [75] YU G, SHEN P, LEE YC, et al. Multiple pathways coordinating reprogramming of endothelial cells into osteoblasts by BMP4. iScience. 2021;24(4):102388. [76] GUO GN, GOU YJ, JIANG XY, et al. Long non-coding RNAs in traumatic brain injury accelerated fracture healing. Front Surg. 2021;8:663377. [77] 高思淼,韩雪,吴晓光,等.电针联合低频经颅超声刺激对创伤性脑损伤大鼠脑电信号的影响[J].中国组织工程研究,2025,29(2):402-408. [78] AHMED A I, SHTAYA A, ZABEN M, et al. Activation of endogenous neural stem cells after traumatic brain injury. The Lancet. 2014,383(140-6736):S18. [79] KRUMINA G, BABARYKIN D, KRUMINA Z, et al. Effects of systemically transplanted allogeneic bone marrow multipotent mesenchymal stromal cells on rats’ recovery after experimental polytrauma. J Trauma Acute Care Surg. 2013;74(3):785-791. [80] LEI SH, GUO L, YUE HY, et al. Marrow stromal stem cell autologous transplantation in denervated fracture healing: an experimental study in rats. Orthop Surg. 2013; 5(4):280-288. [81] LIU XQ, ZHOU CL, LI YJ, et al. SDF-1 Promotes endochondral bone repair during fracture healing at the traumatic brain injury condition. PLoS One. 2013;8(1): e54077. [82] XUE YH, LI ZK, WANG Y, et al. Role of the HIF-1α/SDF-1/CXCR4 signaling axis in accelerated fracture healing after craniocerebral injury. Mol Med Rep. 2020; 22(4):2767-2774. [83] ZHANG L, JIAO G, REN S, et al. Exosomes from bone marrow mesenchymal stem cells enhance fracture healing through the promotion of osteogenesis and angiogenesis in a rat model of nonunion. Stem Cell Res Ther. 2020;11(1):38. |
| [1] | Li Zikai, Zhang Chengcheng, Xiong Jiaying, Yang Xirui, Yang Jing, Shi Haishan. Potential effects of ornidazole on intracanal vascularization in endodontic regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-7. |
| [2] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [3] | Lou Guo, Zhang Min, Fu Changxi. Exercise preconditioning for eight weeks enhances therapeutic effect of adipose-derived stem cells in rats with myocardial infarction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1363-1370. |
| [4] | He Bo, Chen Wen, Ma Suilu, He Zhijun, Song Yuan, Li Jinpeng, Liu Tao, Wei Xiaotao, Wang Weiwei, Xie Jing . Pathogenesis and treatment progress of flap ischemia-reperfusion injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1230-1238. |
| [5] | Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275. |
| [6] | Han Haihui, Meng Xiaohu, Xu Bo, Ran Le, Shi Qi, Xiao Lianbo. Effect of fibroblast growth factor receptor 1 inhibitor on bone destruction in rats with collagen-induced arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 968-977. |
| [7] | Zhao Zengbo, Li Chenxi, Dou Chenlei, Ma Na, Zhou Guanjun. Anti-inflammatory and osteogenic effects of chitosan/sodium glycerophosphate/sodium alginate/leonurine hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 678-685. |
| [8] | Li Tingyue, Guo Qian, He Wenxi, Wu Jiayuan. Long noncoding RNA TP53TG1 promotes odontogenic and osteogenic differentiation of stem cells from the apical papilla [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(36): 7776-7782. |
| [9] | Zhao Jianwei, Li Xunsheng, Lyu Jinpeng, Zhou Jue, Jiang Yidi, Yue Zhigang, Sun Hongmei. Deer antler stem cell exosome composite hydrogel promotes the repair of burned skin [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7344-7352. |
| [10] | Pan Chun, Fan Zhencheng, Hong Runyang, Shi Yujie, Chen Hao. Effect and mechanism of polystyrene microplastics on prostate in male mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7353-7361. |
| [11] | Zhang Pulian, Liu Baoru, Yang Min . Mesenchymal stem cells for treatment of aplastic anemia: inhibiting or activating relevant targets in its pathological evolution [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(31): 6800-6810. |
| [12] | Bu Xianmin, Liang Di, Zhang Bin, Xu Yingjie, Ding Hao, Wu Bin, Tian Ronghua. Exosomes derived from human umbilical cord mesenchymal stem cells in treatment of osteoporotic femoral fractures in SD rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(31): 6634-6641. |
| [13] | Zhang Zihan¹, Wang Jiaxin¹, Yang Wenyi², Zhu Lei¹. Regulatory mechanism of exercise promoting mitochondrial biogenesis in skeletal muscle [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6499-6508. |
| [14] | Liu Haowen, Qiao Weiping, Meng Zhicheng, Li Kaijie, Han Xuan, Shi Pengbo. Regulation of osteogenic effects by bone morphogenetic protein/Wnt signaling pathway: revealing molecular mechanisms of bone formation and remodeling [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 563-571. |
| [15] | Si Juncheng, Peng Lina, Sun Lili, Wang Yu, Shi Lei, Shen Wenhui, Li Mengqi, Zang Wanli. Transcriptome sequencing analysis of the mechanism by which cold water swimming regulates inflammatory response in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(29): 6205-6211. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||