Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (28): 5957-5967.doi: 10.12307/2025.485
Previous Articles Next Articles
Techniques and performance of biominerals for fabricating bone tissue engineering scaffolds
Gang Fangli, Dang Zhongxiu, Li Ruiyun, Li Xiao, Sun Xiaoyang
- Department of Biology, Xinzhou Normal University, Xinzhou 034000, Shanxi Province, China
-
Received:2024-06-12Accepted:2024-08-14Online:2025-10-08Published:2024-12-07 -
Contact:Gang Fangli, PhD, Associate professor, Department of Biology, Xinzhou Normal University, Xinzhou 034000, Shanxi Province, China -
About author:Gang Fangli, PhD, Associate professor, Department of Biology, Xinzhou Normal University, Xinzhou 034000, Shanxi Province, China -
Supported by:Youth Science Project of Shanxi Applied Basic Research Plan, No. 20210302124286 (to GFL)
CLC Number:
Cite this article
Gang Fangli, Dang Zhongxiu, Li Ruiyun, Li Xiao, Sun Xiaoyang. Techniques and performance of biominerals for fabricating bone tissue engineering scaffolds[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 5957-5967.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
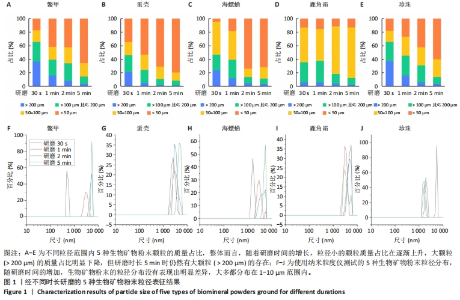
2.1 生物矿物粉末粒径分布表征结果 将鳖甲、蛋壳、海螵蛸、鹿角霜、珍珠5种生物矿物用于骨组织工程复合材料的制备,需要先将其研磨成粉末然后才能使用。为探究研磨时长对5种生物矿物粉末粒径分布的影响,将其放入粉磨机分别研磨30 s、1 min、2 min和5 min,然后通过筛选称质量、纳米粒度仪测试和扫描电镜观察对生物矿物粉末粒径分布进行了表征。图1为经过不同时长研磨的5种生物矿物粉末的筛选称质量和纳米粒度测试结果。从图1A-E可以看出,整体而言,随着研磨时间的增长,粒径小的颗粒质量占比在逐渐上升,大颗粒( > 200 μm)的质量占比明显下降,但研磨时长5 min时仍然有大颗粒( > 200 μm)的存在,因此,粉末在研磨后还需要根据需求筛选才能使用。但不同种类生物矿物之间也有差异,例如研磨30 s的粉末中,蛋壳粉中< 50 μm的颗粒质量明显高于其他几种生物矿物粉末。5种粉末中,鳖甲粉、蛋壳粉和珍珠粉基本遵循研磨时间越长颗粒越小的规律,但蛋壳粉末的粒径分布偏小,珍珠和鳖甲粉末的粒径分布偏大,因此相对而言,蛋壳更容易被研磨成更细的粉末。对海螵蛸而言,研磨时间30 s和1 min的结果差别不十分明显,而当时间增加到2 min之后,小颗粒(< 50 μm)的含量明显增加,并且随时间的继续增加其不同粒径范围内粉末的含量没有再出现显著变化,因此,海螵蛸最佳的研磨时间为2 min,既能得到较细的粉末又更节省时间;但如果需要的是50-100 μm范围的粉末,则研磨30 s即可。鹿角霜与其他几种生物矿物相比有明显差别,无论研磨时长多久,小颗粒(< 50 μm)的质量比例都比较稳定,但50-100 μm范围内的颗粒质量随研磨时长的增加而增多。因此,粉末在使用时应根据需求进行制备和筛选。在实际应用,例如3D打印过程中,常用的喷嘴内径在200-600 μm之间,因此墨水中包含的粉末应小于200 μm,甚至更小,以免打印过程中出现喷嘴堵塞的情况,静电纺丝也会出现类似问题;但对于普通的铸模、冷冻干燥等制备方法影响较小,可以不特别关注粉末的粒径,但也应考虑到粉末后期的降解等问题,确定合适的粒径范围。"
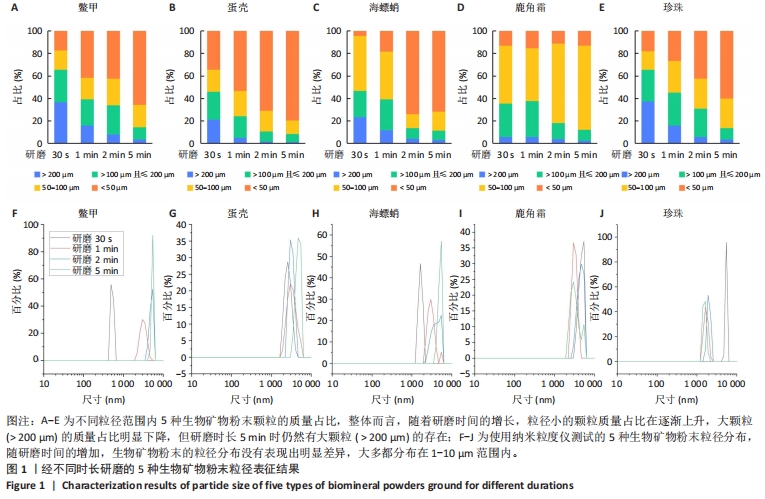

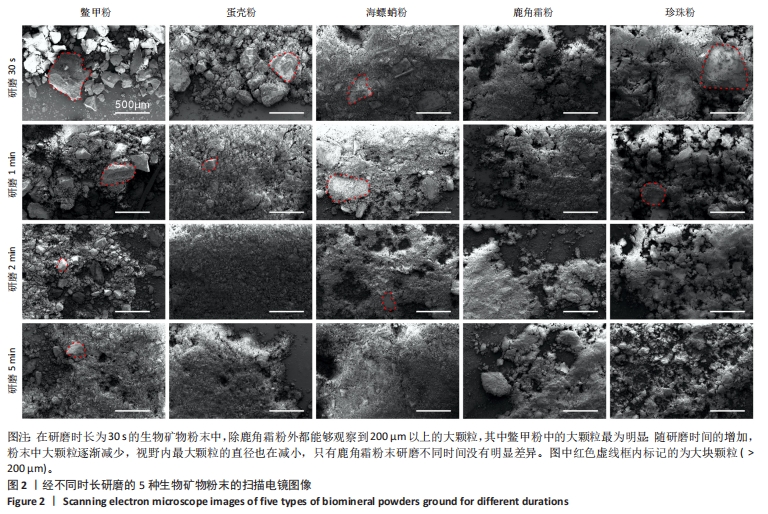
图1A-E中已对粉末进行了粗略的筛选称质量,为更加细致地表征粉末的粒径分布,使用纳米粒度仪对粉末进行了粒径分布表征,如图1F-J所示。从图中可以看出,随研磨时间的增加,生物矿物粉末的粒径分布没有表现出明显差异,大多都分布在1-10 μm范围内,能够达到纳米级的粉末极少出现。值得一提的是,如上结果是将粉末分散在水中后直接放入纳米粒度测试样品池静置2 min后测试所得,因此将矿物粉末分散在水中静置2 min后去掉沉淀,然后离心所得即为1-10 μm范围粒径的颗粒,此方法可用于此范围纳米颗粒的筛选提取。总的来说,使用粉磨机进行研磨的方法可以获得从1-200 μm以上粒度的生物矿物粉末,通过过筛、水中分散、沉淀离心的方法可以分离获取所需粒度范围内的颗粒,可以根据研磨时间与粉末粒径的对应关系选择合适的研磨时间。 为更直观地观察生物矿物粉末,将不同研磨时长的5种生物矿物粉末分别进行了扫描电镜观察,如图2所示。在研磨时长为30 s的生物矿物粉末中,除鹿角霜粉外,都能够观察到200 μm以上的大颗粒,其中鳖甲粉中的大颗粒最为明显,其他几种粉末由于细粉的包裹,大颗粒不易观察到,如图2中红色虚线所示。随研磨时间的增加,5种粉末中大颗粒( > 200 μm)逐渐减少,视野内最大颗粒的直径也在减小,只有鹿角霜粉末研磨不同时间没有明显差异。鹿角霜粉末随研磨时间的增加变化不明显,说明此种研磨方法能把鹿角霜很容易地研磨成粉末,但只能到一定的粒度范围,研磨时间的增长不会让鹿角霜粉末明显变细。海螵蛸粉末中,研磨时长30 s和1 min时视野内可见大块颗粒( > 200 μm),研磨时长为2 min和5 min的粉末中几乎看不到大块颗粒。因此总的来说,对于大部分生物矿物而言,研磨时间越长粉末越细,只是变化的程度有一定差异,在研磨和筛选生物矿物粉末时应注意该生物矿物的特性。"

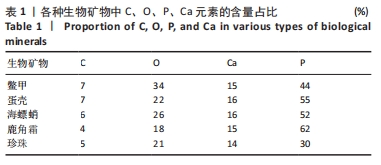
2.2 生物矿物粉末及与聚己内酯制备复合材料的成分表征 生物矿物主要由CaCO3、Ca3(PO4)2和蛋白质构成,CaCO3和Ca3(PO4)2提供了硬度和结构强度,而蛋白质则起到黏结、调控和增强材料韧性的作用。这种复合结构使得生物矿物具有独特的力学性能和生物功能,在生物仿生、组织工程等领域被广泛应用。 为确定生物矿物的元素分布,对生物矿物粉末进行了元素面扫,图3A-E为进行元素面扫部位的扫描电镜图像,图3F-J为元素面扫的结果,图3K-O为通过元素面扫得出的C、O、P、Ca 4个元素的含量比例。从图中可以看出,5种生物矿物均含有C、O、P、Ca这4种元素,其中O元素含量最多,其次是C和Ca,P元素含量最少。其中,O元素的来源比较宽泛,CaCO3、Ca3(PO4)2和有机成分,如胶原蛋白、壳蛋白等,都含量大量O元素,O元素也是生物矿物中含量最高的元素。Ca元素主要来源是矿物成分CaCO3和Ca3(PO4)2。C元素主要来源于CaCO3和蛋白质。而P除了在Ca3(PO4)2中存在以外,也可能来源于有机成分中的磷化合物。因此,这5种生物矿物在元素成分上没有明显差别,只是含量上略有不同(表1)。"
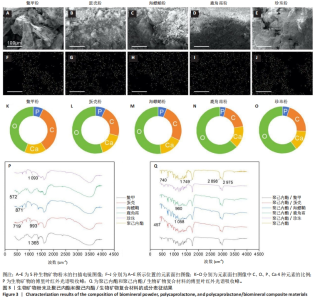
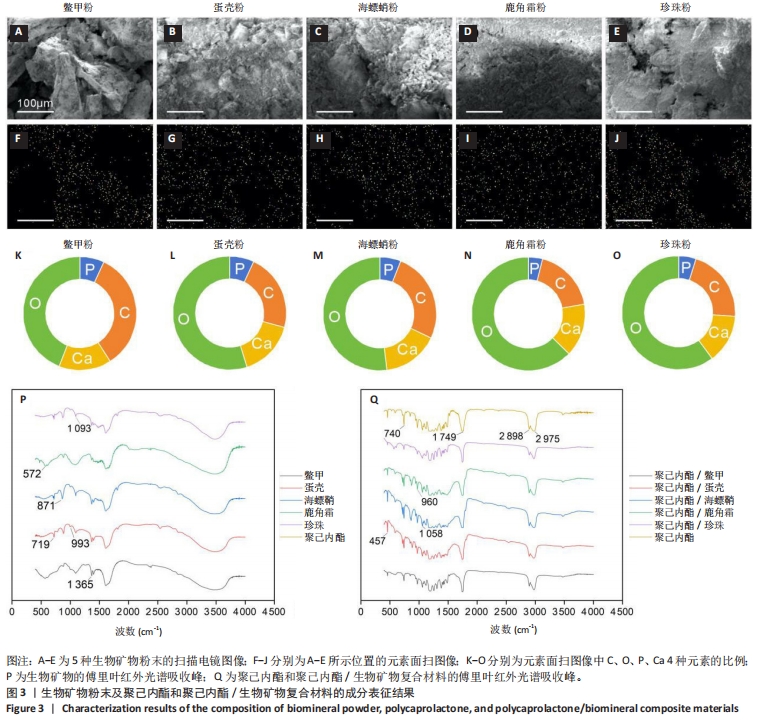
为确定5种生物矿物中的化学键和分子结构以及复合材料制备过程中这些化学键和分子结构有没有遭受破坏,对生物矿物粉末和制备的聚己内酯/生物矿物复合材料进行了红外光谱学测试。图3P为聚己内酯与5种生物矿物粉末的红外光谱吸收峰。从图中可以看出,5种生物矿物的红外光谱吸收峰中都包含蛋白质的酰胺Ⅰ带(约1 650 cm-1,C=O伸缩振动)和酰胺Ⅱ带(约1 550 cm-1,N-H弯曲振动和C-N伸缩振动)吸收峰。蛋壳、海螵蛸和珍珠中在约700 cm-1处由C=O弯曲振动形成的吸收峰十分明显,鳖甲和鹿角霜在此处的吸收峰不太明显。但鳖甲和鹿角霜在约560 cm-1处由PO43-弯曲振动形成的吸收峰比较明显,蛋壳、海螵蛸和珍珠在此处的吸收峰不明显。此外,鳖甲、蛋壳和海螵蛸中在约1 400 cm-1处由C=O对称伸缩振动形成的吸收峰都十分明显,而鹿角霜和珍珠在此处的吸收峰不太明显,但也是存在的。图3Q为聚己内酯和聚己内酯/生物矿物复合材料的红外光谱吸收峰。从图中可以看出,复合材料的红外光谱吸收峰以聚己内酯的特征峰为主,如在2 940 cm-1附近由CH2不对称伸缩振动产生的吸收峰和在2 865 cm-1附近有CH2对称伸缩振动形成的吸收峰,以及在1 720 cm-1附近由C=O伸缩振动形成的酯基特征峰。聚己内酯在1 720 cm-1附近由C=O伸缩振动形成的酯基特征峰与生物矿物中蛋白质的酰胺Ⅰ带吸收峰十分接近,不能清晰区分,并且都涉及羰基(C=O)的伸缩振动,但它们来自不同的化学环境和分子结构,聚己内酯中的C=O在酯基中,蛋白质中的C=O键在酰胺键中。蛋壳、海螵蛸、珍珠在约700 cm-1处的吸收峰和鳖甲、鹿角霜在约560 cm-1处的吸收峰都比较明显,说明5种生物矿物已经成功复合在材料里,而且其本身的化学键和分子结构没有遭受明显破坏。"
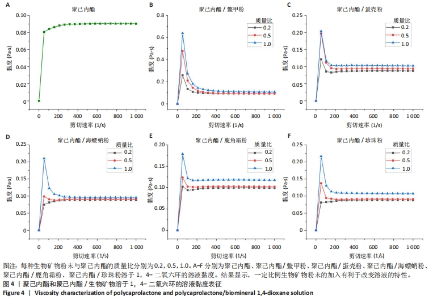
2.3 聚己内酯/生物矿物粉末溶液黏度表征结果 黏度对于材料的制备特别是3D打印和静电纺丝等方法有显著影响,为探讨生物矿物粉末的加入对复合材料溶液黏度的影响,分别制备了3种比例的溶液并进行黏度测试,测试结果如图4所示。如图4A为无粉末添加的聚己内酯溶液黏度测试结果,聚己内酯溶液的黏度在0.08-0.09 Pa·s,并且随着剪切速率的增加,黏度出现了先增加后维持稳定的趋势。这种现象属于剪切增稠,对于3D打印而言是不利的,溶液经喷嘴流出前剪切力较强,黏度较高不容易被挤出,而挤出后剪切力小,黏度下降,不利于材料的稳定成型。图4B-F为添加了不同比例生物矿物粉末的聚己内酯溶液黏度测试结果,在添加了生物矿物粉末后,几乎所有的溶液都出现了剪切变稀的现象,即随着切应力的增加溶液黏度下降,这种趋势有利于3D打印的进行。只有添加了比例较低的海螵蛸粉和珍珠粉时还是剪切增稠的趋势,但提高生物矿物粉末的添加比例后溶液黏度变化又呈现出剪切变稀的趋势。因此,一定比例生物矿物粉末的加入有利于改变溶液的特性,使其更有利于用于3D打印等材料制备成型方式。其中相比而言,聚己内酯/鳖甲粉溶液的剪切变稀趋势更明显。在剪切速率高于300 s-1后,溶液的黏度都趋于稳定。从图中还可以看出,随着生物矿物粉末加入比例的增加,溶液整体黏度也呈现出上升的趋势,其中添加比例为1.0的聚己内酯/鳖甲粉、聚己内酯/鹿角霜粉、聚己内酯/珍珠粉的溶液黏度均在0.1 Pa·s以上(剪切速率> 300 s-1),黏度增强效果比聚己内酯/蛋壳粉和聚己内酯/海螵蛸粉更强。"

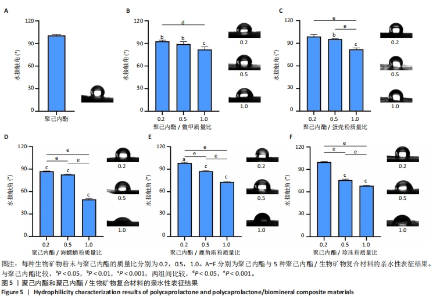
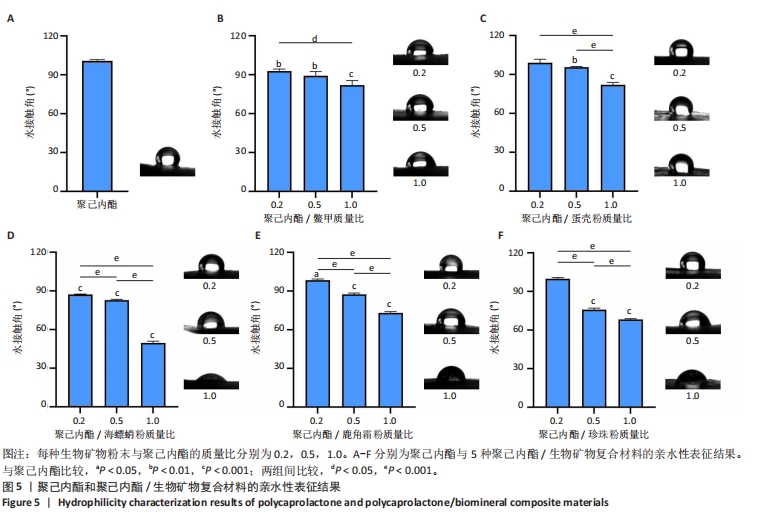
2.4 聚己内酯/生物矿物复合材料亲水性表征结果 聚己内酯材料是疏水的,疏水性主要来源于其分子结构中的长碳氢链段,而生物矿物粉末的加入能改善聚己内酯材料的亲水性。生物矿物主要由碳酸钙、磷酸钙和有机质组成,其中磷酸钙和有机质亲水性较好,碳酸钙虽然具有疏水性,但在生物矿物中碳酸钙往往吸附有机质进而增强自身的亲水性,因此生物矿物粉末的加入有利于聚己内酯材料亲水性的增强。生物矿物粉末的种类和比例对复合材料亲水性的影响,见图5所示。从图中可以看出,生物矿物粉末的种类和添加比例对复合材料整体的亲水性影响是不同的,但总的来看,添加生物矿物粉末比例越高,复合材料的亲水性就越强,因此,生物矿物的加入能够有效改善复合材料的亲水性。具体而言,鳖甲粉的加入能够改善复合材料的亲水性,生物矿物粉末添加比例越高复合材料亲水性越好,复合材料的亲水性均高于纯聚己内酯材料,但随生物矿物粉末添加比例的增加,复合材料的亲水性变化不十分明显,相邻比例之间的亲水性无显著差异。添加蛋壳粉复合材料的亲水性变化趋势与添加鳖甲粉的复合材料比较接近,但低比例(0.2)添加蛋壳粉时,复合材料的亲水性与纯聚己内酯无显著差异,相邻比例生物矿物粉末间的亲水性差异比聚己内酯/鳖甲粉复合材料更明显。海螵蛸粉的加入可明显提升复合材料的亲水性。添加鹿角霜粉和珍珠粉复合材料的亲水性比较接近,都是随着生物矿物粉末添加比例的升高,复合材料的亲水性越来越好,并且变化比较明显,但低比例(0.2)添加粉末时,与纯聚己内酯材料的亲水性差异不显著。因此,总的来说,生物矿物粉末的加入能够改善聚己内酯材料的亲水性,并且生物矿物粉末比例越高复合材料亲水性越好,但不同种类的生物矿物粉末之间效果有所不同。"
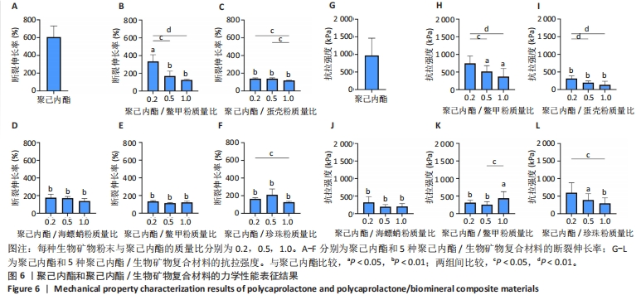
2.5 聚己内酯/生物矿物复合材料力学性能表征结果 生物矿物粉末与聚己内酯材料的界面结合较差,可能会成为应力集中点,导致支架在拉伸时容易发生破裂,进而造成材料抗拉强度降低,因此,特别关注了聚己内酯/生物矿物粉末复合材料的抗拉强度和断裂伸长率。图6A-F所示为聚己内酯及5种聚己内酯/生物矿物复合材料的断裂伸长率,图6G-L为聚己内酯及5种聚己内酯/生物矿物复合材料的抗拉强度。从图中可以看出,生物矿物粉末的添加会导致复合材料断裂伸长率和抗拉强度的下降,而且生物矿物粉末添加比例越高复合材料断裂伸长率和抗拉强度下降越明显。所有生物矿物粉末的添加都会导致材料力学性能的下降,但不同生物矿物粉末之间还是有差异的。"
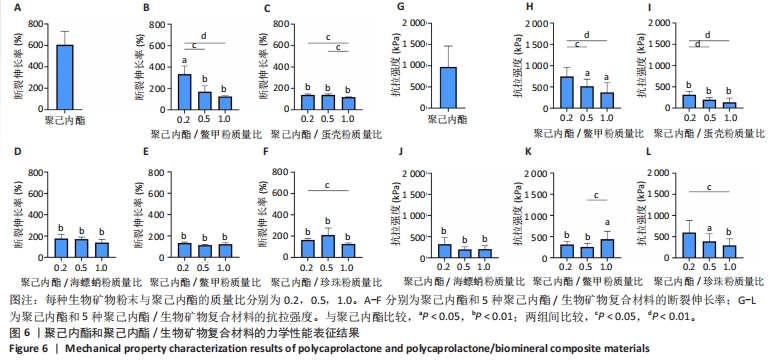
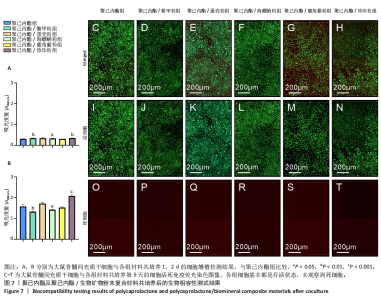
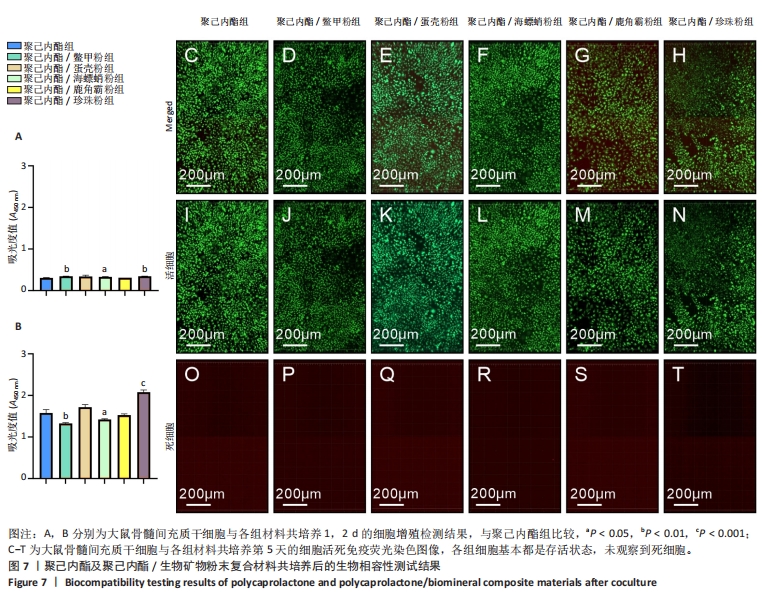
添加鳖甲粉、蛋壳粉和海螵蛸粉后复合材料都呈现出了规律的生物矿物粉末添加比例越高材料断裂伸长率越低的趋势,而低比例添加鳖甲粉后复合材料的力学性能下降较少,蛋壳和海螵蛸粉添加在比例为0.2时就导致复合材料断裂伸长率明显下降,随着生物矿物粉末添加比例的增加,复合材料断裂伸长率下降趋势并不十分明显,不同生物矿物粉末添加比例之间差别不大。添加鹿角霜粉和珍珠粉与添加蛋壳粉和海螵蛸粉复合材料的断裂伸长率类似,虽然统计数据上显示出了不同的规律,但组与组之间没有显著差异,因此就统计学而言,添加蛋壳粉、海螵蛸粉、鹿角霜粉和珍珠粉对复合材料断裂伸长率的影响是十分接近的,只有鳖甲粉呈现出了明显的生物矿物粉末添加比例越高复合材料断裂伸长率越低的特点。 就抗拉强度而言,与材料断裂伸长率的表征结果类似,生物矿物粉末的添加导致复合材料抗拉强度的下降,而且生物矿物粉末添加比例越高材料抗拉强度下降就越多。相比较而言,随生物矿物粉末添加比例的增加,聚己内酯/鳖甲粉和聚己内酯/珍珠粉复合材料的抗拉强度下降趋势较缓,聚己内酯/蛋壳粉、聚己内酯/海螵蛸粉和聚己内酯/鹿角霜粉复合材料在低比例(0.2)添加生物矿物粉末时抗拉强度就下降十分明显了,随着生物矿物粉末添加比例的增加,复合材料的的抗拉强度进一步下降,但下降幅度较小。 总的来说,生物矿物粉末的添加会导致复合材料整体力学性能的下降,相比较而言,添加鳖甲粉导致复合材料力学性能下降最不显著。因此,在使用生物矿物粉末制备复合材料时应注意其对材料力学性能的影响,选取合适的添加比例。 2.6 聚己内酯/生物矿物复合材料生物相容性表征结果 聚己内酯和5种生物矿物都具有良好的生物相容性,但在聚己内酯/生物矿物复合材料制备过程中引入了具有毒性的有机溶剂1,4-二氧六环,虽然在后期制备过程中有步骤将有机溶剂挥发掉,但在该过程中是否对材料造成了一些影响,或使材料生物相容性下降尚不可知,为此,对5种聚己内酯/生物矿物复合材料进行了生物相容性测试。 图7A,B分别为各组材料与大鼠骨髓间充质干细胞分别共培养1,2 d的细胞增殖情况,图7C-T为各组材料与大鼠骨髓间充质干细胞分别共培养第5天的细胞活死免疫荧光染色图像。细胞增殖检测结果显示,共培养1 d后,每组细胞数量都还很少,但第2天时就出现了明显增长,尽管在第2天时添加了鳖甲粉和海螵蛸粉复合材料上的细胞数量低于聚己内酯组,但细胞数量仍然是明显增加的,因此整体来说,所有材料都没有表现出细胞毒性,添加生物矿物粉末有助于改善材料的生物相容性,其中珍珠粉对材料生物相容性的改善效果最明显。细胞活死免疫荧光染色结果显示,共培养第5天时,各组细胞基本都是存活状态,几乎观察不到死细胞,因此,这5种复合材料都具有良好的生物相容性,该制备过程不会对材料的生物相容性造成影响。"
| [1] COPP DH, SHIM SS. The homeostatic function of bone as a mineral reservoir. Oral Surg Oral Med Oral Pathol. 1963;16(6):738-744. [2] WANG W, YEUNG KW. Bone grafts and biomaterials substitutes for bone defect repair: A review. Bioact Mater. 2017;2(4):224-247. [3] 李剑锋.生命的矿物质“银行”:骨骼[J].环球中医药,2008(2):62-63. [4] ANNAMALAI RT, HONG X, SCHOTT NG, et al. Injectable osteogenic microtissues containing mesenchymal stromal cells conformally fill and repair critical-size defects. Biomaterials. 2019;208:32-44. [5] 王兴,刘洪臣.自体骨移植修复种植位点骨缺损的研究进展[J].口腔颌面修复学杂志,2016,17(1):49-52. [6] AZI ML, APRATO A, SANTI I, et al. Autologous bone graft in the treatment of posttraumatic bone defects: a systematic review and meta-analysis. BMC Musculoskel Dis. 2016;17(1):465. [7] 马武秀,程迅生.自体骨移植修复骨缺损的研究进展[J].中国骨与关节损伤杂志,2011,26(6):574-576. [8] SHIBUYA N, JUPITER DC. Bone graft substitute: allograft and xenograft. Clin Podiatr Med Surg. 2015;32(1):21-34. [9] BRACEY DN, JINNAH AH, WILLEY JS, et al. Investigating the osteoinductive potential of a decellularized xenograft bone substitute. Cells Tissues Organs. 2019;207(2):97-113. [10] 曹国定,裴豫琦,刘军,等.骨缺损修复材料的研究进展[J].中国骨伤,2021,34(4):382-388. [11] BLACK CR, GORIAINOV V, GIBBS D, et al. Bone tissue engineering. Curr Mol Biol Rep. 2015;1:132-140. [12] DEC P, MODRZEJEWSKI A, PAWLIK A. Existing and novel biomaterials for bone tissue engineering. Int J Mol Sci. 2022;24(1):529. [13] FERRETRA AM, GENTILE P, CHIONO V, et al. Collagen for bone tissue regeneration. Acta Biomater. 2012;8(9):3191-200. [14] WUBNEH A, TSEKOURA EK, AYRANCI C, et al. Current state of fabrication technologies and materials for bone tissue engineering. Acta Biomater. 2018;80:1-30. [15] RODDY E, DEBAUN MR, DAOUD-GRAY A, et al. Treatment of critical-sized bone defects: clinical and tissue engineering perspectives. Eur J Orthop Surg Traumatol. 2018;28(3):351-362. [16] 秦宇星,任前贵,沈佩锋,等.组织工程技术治疗骨缺损:应用于临床还有多远?[J].中国组织工程研究,2021,25(29):4703-4708. [17] TURNBULL G, CLARKE J, PICARD F, et al. 3D bioactive composite scaffolds for bone tissue engineering. Bioact Mater. 2018;3(3):278-314. [18] KARA A, DISTLER T, POLLEY C, et al. 3D printed gelatin/decellularized bone composite scaffolds for bone tissue engineering: Fabrication, characterization and cytocompatibility study. Mater Today Bio. 2022;15: 100309. [19] 申亚杰,程雯,马晓婷,等.胶原/无机物复合支架在骨缺损修复中的研究进展[J].口腔材料器械杂志,2024,33(1):42-49. [20] HASSANAJILI S, KARAMI-POUR A, ORYAN A, et al. Preparation and characterization of PLA/PCL/HA composite scaffolds using indirect 3D printing for bone tissue engineering. Mater Sci Eng C. 2019;104: 109960. [21] NITYA G, NAIR GT, MONY U, et al. In vitro evaluation of electrospun PCL/nanoclay composite scaffold for bone tissue engineering. J Mater Sci Mater Med. 2012;23:1749-1761. [22] RODENAS-ROCHINA J, RIBELLES JLG, LEBOURG M. Comparative study of PCL-HAp and PCL-bioglass composite scaffolds for bone tissue engineering. J Mater Sci Mater Med. 2013;24:1293-1308. [23] XU M, LI Y, SUO H, et al. Fabricating a pearl/PLGA composite scaffold by the low-temperature deposition manufacturing technique for bone tissue engineering. Biofabrication. 2010;2(2):025002. [24] NIE D, LUO Y, LI G, et al. The construction of multi-Incorporated polylactic composite nanofibrous scaffold for the potential applications in bone tissue regeneration. Nanomaterials (Basel). 2021;11(9):2402. [25] GANG F, YE W, MA C, et al. 3D printing of PLLA/biomineral composite bone tissue engineering scaffolds. Materials (Basel). 2022;15(12):4280. [26] ZHANG X, DU X, LI D, et al. Three dimensionally printed pearl powder/poly-caprolactone composite scaffolds for bone regeneration. J Biomater Sci Polym Ed. 2018;29(14):1686-1700. [27] LIU Y, HUANG Q, FENG Q. 3D scaffold of PLLA/pearl and PLLA/nacre powder for bone regeneration. Biomed Mater. 2013;8(6):065001. [28] DU X, YU B, PEI P, et al. 3D printing of pearl/CaSO4 composite scaffolds for bone regeneration. J Mater Chem B. 2018;6(3):499-509. [29] FENG Y, ZHU S, MEI D, et al. Application of 3D printing technology in bone tissue engineering: A review. Curr Drug Deliv. 2021;18(7):847-861. [30] 刘嗣聪,刘宏治,殷亚然.生物可降解聚酯/生物陶瓷3D打印骨组织工程支架研究进展[J].复合材料学报,2024,41(4):1672-1693. [31] 刚芳莉,石瑞,马春阳,等.低温冷凝沉积法3D打印骨组织工程左旋聚乳酸/珍珠粉复合支架[J].中国组织工程研究,2024,28(17): 2702-2707. [32] JANG J H, CASTANO O, KIM HW. Electrospun materials as potential platforms for bone tissue engineering. Adv Drug Deliv Rev. 2009; 61(12):1065-1083. [33] GOUMA PI, RAMACHANDRAN K. Electrospinning for bone tissue engineering. Recent Pat Nanotechnol. 2008;2(1):1-7. [34] NIE L, CHEN D, SUO J, et al. Physicochemical characterization and biocompatibility in vitro of biphasic calcium phosphate/polyvinyl alcohol scaffolds prepared by freeze-drying method for bone tissue engineering applications. Colloids Surf B Biointerfaces. 2012;100: 169-176. [35] SUN W, GREGORY DA, TOMEH MA, et al. Silk fibroin as a functional biomaterial for tissue engineering. Int J Mol Sci. 2021;22(3):1499. [36] 陈佩,戴红莲.骨组织工程中天然生物衍生材料的研究进展[J].生物骨科材料与临床研究,2005,2(5):26-28. [37] BRETT E, FLACCO J, BLACKSHEAR C, et al. Biomimetics of bone implants: the regenerative road. Biores Open Access. 2017;6(1):1-6. |
| [1] | Li Jialin, Zhang Yaodong, Lou Yanru, Yu Yang, Yang Rui. Molecular mechanisms underlying role of mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1512-1522. |
| [2] | Sun Xianjuan, Wang Qiuhua, Zhang Jinyi, Yang Yangyang, Wang Wenshuang, Zhang Xiaoqing. Adhesion, proliferation, and vascular smooth muscle differentiation of bone marrow mesenchymal stem cells on different electrospinning membranes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 661-669. |
| [3] | Li Mingzhe, Ye Xiangling, Wang Bing, Yu Xiang. Preparation and osteogenic properties of liquid crystal display light-cured polylactic acid scaffold loaded with nano-tantalum [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 670-677. |
| [4] | Ren Bo, Tang Yongliang, Li Ni, Liu Bangding. Thermosensitive antibacterial hydrogel for treatment of infected bone defects [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7269-7277. |
| [5] | Sheng Wenbo, Liu Bingli, Li Sibo, Ao Rongguang, Yu Baoqing. Cement-augmented short-segment percutaneous pedicle screw fixation for the stage II Kümmell’s disease [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7286-7292. |
| [6] | Yi Xiaoding, Zhang Di, Guo Hong, Qing Liang, Zhao Tianyu. Decellularized tendon scaffold: a biomedical material for tendon injury repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7385-7392. |
| [7] | Hu Kai, Guo Yongqin, Shao Yiran, Wang Jingjing. Changes in properties of treated allogeneic tendons after multiple freeze-thaw cycles [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6046-6051. |
| [8] | Liu Xiaojun, Shang Yuqing, Guan Wenchao, Xu Linlin, Li Guicai. Oriented electrostatically spun polycaprolactone/silk fibroin scaffold loaded with calcium titanate promotes peripheral nerve regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6070-6082. |
| [9] | Zeng Yu, Xie Chengwei, Hong Yuanqi, Su Shenghui, Dong Xieping. In vitro angiogenesis and osteogenesis properties of copper-doped mesoporous bioactive glass [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 5941-5949. |
| [10] | Shen Zhen, Huang Ziyue, He Zhijuan, Wang Yiting, Chen Qigang, Geng Chunmei, Huang Yajing, Wu Zugui. Dynamic expression of H-type vessels coupled with bone repair effect in bone induced membrane for massive bone defects [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 5950-5956. |
| [11] | Hou Licun, Hu Kai, Shao Yiran. Methods and effects on endotoxin removal in allogeneic bone [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 5985-5993. |
| [12] | Wu Yonghao, Zhu Shuaiqi, Li Yuqiao, Zhang Chenfei, Xia Weiwei, Zhu Zhenqi, Wang Kaifeng. Correction effect of local kyphosis of the spine after percutaneous kyphoplasty in super-aging patients with vertebral compression fractures [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(27): 5854-5861. |
| [13] | Jiang Zhixiu, Ji Yuchen, Liu Danyu, Cao Yilin, Jiang Tingting, Song Yihan, Wang Lei, Wang Xinyu. Biomechanical properties of Gyroid structured titanium bionic bone scaffolds for repairing segmental mandibular defects [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(22): 4621-4628. |
| [14] | Zhang Jiahao, Li Jiacheng, Wen Mingtao, Guo Yanbo, Luo Di, Li Gang. Astragaloside IV alleviates oxidative stress injury and promotes osteogenesis in MC3T3-E1 cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3529-3536. |
| [15] | An Jiangru, Zhang Jinyi, Wang Qiuhua, Yang Yangyang, Wang Wenshuang, Zhang Xiaoqing. Mesenchymal stem cells combined with polycaprolactone-hyaluronic acid electrospinning membrane in repair of endometrial injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3369-3379. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||