Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (23): 4993-5001.doi: 10.12307/2025.093
Previous Articles Next Articles
Role and influence of compressive stress on cells in vitro
Yan Pengan1, Cai Yifan1, Yan Zhenxing1, Wei Yuqiao1, Geng Bin1, 2, 3, Xia Yayi1, 2, 3
- 1Second Clinical Medical School, Lanzhou University, Lanzhou 730000, Gansu Province, China; 2Second Hospital of Lanzhou University, Lanzhou 730000, Gansu Province, China; 3Orthopedic Clinical Research Center of Gansu Province, Lanzhou 730000, Gansu Province, China
-
Received:2024-03-26Accepted:2024-05-24Online:2025-08-18Published:2024-09-30 -
Contact:Xia Yayi, PhD, Chief physician, Second Clinical Medical School, Lanzhou University, Lanzhou 730000, Gansu Province, China; Second Hospital of Lanzhou University, Lanzhou 730000, Gansu Province, China; Orthopedic Clinical Research Center of Gansu Province, Lanzhou 730000, Gansu Province, China -
About author:Yan Pengan, Master candidate, Second Clinical Medical School, Lanzhou University, Lanzhou 730000, Gansu Province, China -
Supported by:National Natural Science Foundation of China, No. 82060405, 81874017 (to XYY); National Natural Science Foundation of China, No. 81960403 (to GB)
CLC Number:
Cite this article
Yan Pengan, Cai Yifan, Yan Zhenxing, Wei Yuqiao, Geng Bin, Xia Yayi. Role and influence of compressive stress on cells in vitro[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(23): 4993-5001.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
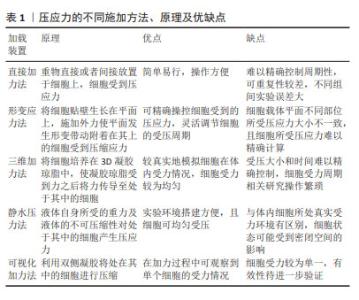
2.2 体外实验中压应力的施加方式 2.2.1 直接加力法 不借助其他介质,直接或间接在细胞表面加载压应力的方法被称作直接加力法,如王碧超等[14]将成骨细胞接种于6孔板,在细胞上放置盖玻片,通过调节放在盖玻片上砝码的质量来调节成骨细胞受到的压应力。SONG等[15]将成骨细胞接种于载玻片上,并在其上覆盖载玻片,形成以细胞为中心,载玻片在两侧的“三明治”模型,在此模型上方以一定高度向下滴PBS使细胞受到冲击力,细胞受到压应力可根据PBS的滴加频率和高度来控制,这种加载压应力的方法操作简单,但不足是除了考虑载玻片自身的重力影响外,还需考虑细胞分布的密度和大小,细胞受到压应力的实际值与理论值有一定的误差,且实验中干扰因素较多,实验可重复性受限。这类方法是压应力研究初期尝试的一些方法,由于误差较大、可控性一般等问题现已很少用到。 2.2.2 形变应力法 形变应力法是将贴壁细胞生长在可形变平面上,施加外力使平面弯曲,从而使细胞受到压缩应力。如杜启翠等[16-17]使用的Flexcell细胞生物力学加载装置系统,其原理是将细胞放置在密封的真空室内,通过真空泵使真空室内压力产生周期性变化,带动密封的弹性基底膜发生形变,从而使贴壁生长的细胞受到机械压缩力。曹阳等[18] 根据此原理自主研发了四点弯曲细胞加力装置,利用数控电机使细胞培养板发生应变,从而间接对贴壁生长的细胞产生一个精确、恒定的周期性单轴应力。这种方法可通过计算机操控细胞受到的压力大小和时间,能更好地根据实验需求使细胞受到周期性应力变化,但此时细胞所受的力只能用细胞载体形变量的百分比来衡量,难以计算细胞所受具体压应力大小。其次,载体中心和边缘区域细胞所受到的压应力可能并不相等,且受形变材料弹性系数不同,此方法在不同实验室间的差异性难以统一。 2.2.3 三维加力法 在平面对细胞进行加力的方法并不能模拟细胞在体内的三维受力状态,为了更真实模拟细胞在体内的受力情况,刘伟龙等[19-25]使用三维凝胶模型对细胞进行加力,其做法是将凝胶琼脂作为细胞的培养环境,然后在其上方放置砝码使细胞受到压应力,原理是将砝码的重力施加到凝胶琼脂上,引起凝胶琼脂发生压缩形变,利用凝胶琼脂这一介质再间接将力传递给处于其中的细胞,从而使细胞受到压应力,这种方法较为真实地模拟了细胞在体内的三维受力情况,是目前较为常用的压应力加载模型。 2.2.4 静水压力法 作为压应力的一种,静水压力是指均质流体全方位、均匀地向处在其中的物体表面施加的压力。由于静水压力在调节细胞形状、体积、运动性和行为方面有重要作用[26],因此YAMAMOTO等[27-30]将静水压力作为压应力来研究其对细胞的影响。在实际实验中,仅靠液体自身重力产生的静水压力往往不能达到所需大小的压应力,用真空泵对柔性膜密封的液体进行加力,可利用液体的不可压缩性对处于其中的细胞进行加载压应力,这在一定程度上使细胞均匀接受压应力。由于静水压力可对细胞施加较大的压应力,在生物制品的温和消毒方面有较大应用潜力,同时,这种方法对细胞施加周期性压应力较为容易,可探索不同细胞对压应力的周期性反应关系。 2.2.5 可视化加力法 以上实验设备在细胞受压过程中并不能实时观察细胞的微观状态,YEH等[31]开发了一种设备,将细胞放在透明薄膜凝胶上,然后在顶部堆叠多层透明薄膜来施加可控的压应力,其可以在单个细胞分辨率下进行实时观察,研究者用MDA-MB-231和MCF7乳腺癌细胞验证了此方法具有良好的效果。这种设备将微观层面细胞的受力情况转化成宏观可视化的过程,是一种较为新颖的向细胞加载压应力的方法。 目前已开发了多种装置对细胞加载压应力,且不同的方法各有其优缺点,见表1。总体而言,目前细胞加载压应力的方式可分为三大类:一是借助单层细胞所在平面形变加载压应力;二是借助三维凝脂琼胶这一介质对细胞加载压应力;三是用静水压力对细胞加载压应力。其中,三维凝脂琼胶加力法可更真实地模拟细胞在体内的受力情况且误差相对较小,是普遍认可且运用广泛的实验方法[32]。尽管有大量研究探索了机械应力对细胞的影响,但仍然没有统一、可大量使用且精确的压应力加载装置[33]。未来在压应力的相关加载中,加载装置的研发仍有重要地位,将三维凝胶琼脂加力模型与精准的控制装置结合起来,研发更为标准化、精确可控且可重复的加载装置,或许是以后压应力相关研究的重点。"


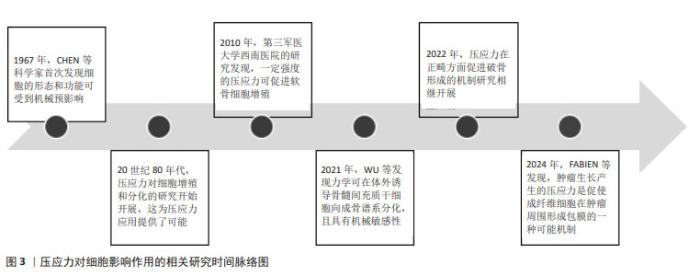
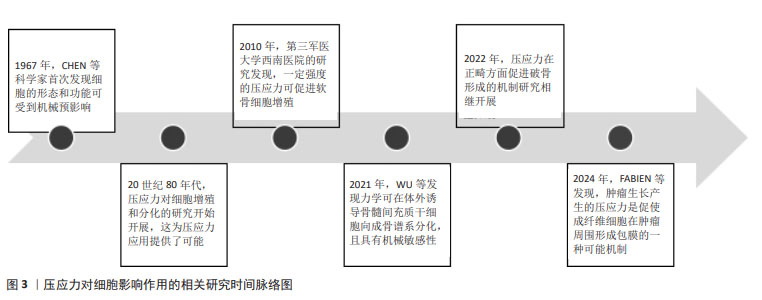
2.3 压应力对细胞表型的影响 2.3.1 对细胞增殖的影响 研究表明,较小的压应力会促进细胞增殖,而较大的压应力则会抑制细胞增殖[34-35]。TASEVSKI等[36]研究发现,间歇循环流体静压可使成骨细胞中特定基因亚群的mRNA水平发生变化,提示压应力可能会影响体内骨组织的功能。TAIJI等[28]研究表明,静水压应力联合弧形弯曲应变可抑制细胞外基质合成活性,促进纤维环细胞增殖。刘志超等[37]研究发现,适当的静水压力刺激可促进椎间盘髓核细胞增殖,而长时间过高的静水压力则使人椎间盘髓核细胞增殖率下降,导致椎间盘退变的发生。在椎间盘退行性疾病中,合理利用压应力促进髓核细胞增殖,可有效缓解椎间盘退变性疾病。但目前关于压应力刺激细胞增殖的最佳强度和时间的相关研究并不充分,未来需要更精确地探索压应力促进细胞增殖的强度和时间,为压应力的更深入研究提供参考。 2.3.2 对细胞分化的影响 促进干细胞分化为所需要的特定细胞一直是研究的热点问题。在骨髓间充质干细胞中,合理利用压应力使其分化为成骨细胞或软骨细胞,可能为骨移植和软骨移植等难题提供解决方案。刘伟龙[19]发现压应力可以使MC3T3-E1细胞成骨分化水平提高,且成骨细胞中miR-222-3p的表达显著下降,miR-222-3p可能通过靶向Runx2抑制MC3T3-E1细胞的成骨分化。SOMEMURA等[21]研究发现,压应力会诱导Glut1表达,导致成骨细胞中成骨转导因子Runx2的活性增加,从而诱导成骨细胞分化和骨形成。WALETZKO-HELLWIG等[38]将骨髓间充质干细胞与高静水压力处理和未处理的同种异体小梁骨块共培养28 d后,基因表达和蛋白表达检测结果显示高静水压力处理的骨块可促进骨髓间充质干细胞向成骨细胞分化和骨基质矿化。细胞分化在组织修复、免疫反应中发挥着重要的角色,利用机械应力如压应力对细胞进行刺激,促进其分化为目的细胞是一种新颖、简便且潜力巨大的方法。 2.3.3 对细胞自噬的影响 自噬作为细胞的一种自我保护机制,可保护细胞免受细胞器、病原体和有毒、错误折叠蛋白的侵害。KING等[39]发现持续性机械应力可以引起细胞自噬,并且自噬的机械诱导独立于经典的TOR/Akt或AMPK信号。MA等[40]发现压应力能刺激大鼠髓核细胞产生活性氧来启动自噬,且这一效应具有时间依赖性。LI等[41]也发现持续的压应力会导致过度的自噬。ZOU等[42]发现静态压应力可以在一定大小的范围内诱导自噬,并且可能与ILK/PI3K信号通路有关。在肿瘤球体中,利用恰当的压应力促进肿瘤细胞自噬有望为抑制肿瘤进展提供新的思路。 2.3.4 对细胞凋亡的影响 适当的压应力对细胞有利,而过载的压应力作用于细胞时可引起细胞凋亡。研究表明,生理情况下压应力不会影响细胞活力,而大于100 MPa的非生理压力可能会影响细胞活力,导致真核细胞凋亡或坏死等结果[29]。SONG等[15]发现压应力可在一定程度上诱导成骨细胞凋亡,且呈剂量依赖性关系。CHEN等[43]发现压应力诱导的Piezo1表达水平与脊柱侧弯椎体生长板两侧的细胞凋亡程度密切相关,凹侧椎体生长板的Piezo1表达量和细胞凋亡程度要显著高于凸侧,通过外界压应力降低凹侧软骨细胞Piezo1的表达来抑制其凋亡,可能是治疗青少年特发性脊柱侧弯的一种策略。在骨质疏松的治疗中,用适当的压应力抑制成骨细胞凋亡有望在一定程度上缓解骨质疏松的发生发展。 2.3.5 对细胞迁移的影响 在球体肿瘤中,肿瘤的包膜会限制肿瘤的生长,处于瘤体中心的肿瘤细胞就会受到压缩应力,在压应力刺激下肿瘤的行为学特征会发生不同程度的改变。CAI等[23]发现,在肿瘤的发展和侵袭中,压应力会抑制正常上皮细胞的迁移活动,并通过增强癌细胞间的黏附,使大量癌细胞团块作为一个整体进行快速迁移。NISHI等[24]发现压应力会促进肿瘤的生长和表型转化,从而帮助肿瘤转移。MORIKURA等[25]发现间歇性压应力通过抑制F-肌动蛋白延伸和胶原降解来降低黑色素瘤细胞的迁移和侵袭能力。压应力在不同肿瘤组织中可引起不同的生物学改变,这可能与肿瘤细胞的生长环境和其原始细胞的特性有关,未来需要针对不同类型的肿瘤细胞分别探究不同大小肿瘤球体产生的压应力抑制其增殖的效果。 综上所述,压应力可在不同程度上影响多种细胞的生理表型改变,如表2所示,且主要集中在影响细胞增殖、分化、自噬、凋亡和迁移等方面,在不同组织中,压应力对细胞产生的行为学影响可能并不相同,体外研究压应力的最佳刺激条件并进一步调控细胞表型改变将是未来研究的重点问题。"

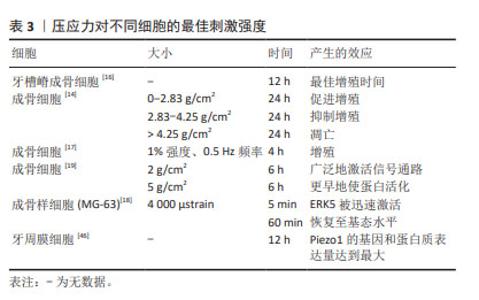
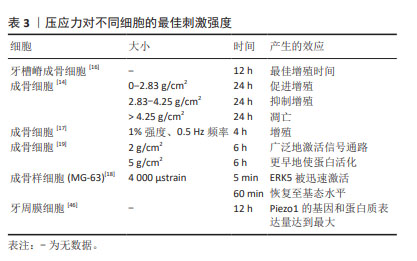
2.3.6 对细胞强度、时间及周期性依赖关系 压应力可在一定的强度、时间和周期范围内调控细胞的生命活动,且具有剂量依赖性。GHASEMZADEH等[13,44]研究发现,压应力促进骨髓间充质干细胞成骨分化作用具有大小依赖性。压应力以周期性依赖的方式影响黑色素瘤细胞的进展[25],以时间依赖性的方式调节大鼠骨骼肌细胞的细胞周期和凋亡[45]。在压应力的相关研究中,促进成骨细胞增殖的最佳刺激模式可为骨质疏松治疗提供新的思路。杜启翠等[16]发现大小为15%的压应力作用于牙槽嵴成骨细胞12 h后,细胞的增殖活性最高;王碧超等[14]发现0-2.83 g/cm2的周期性压应力作用24 h内,压应力可促进成骨细胞增殖,2.83-4.25 g/cm2的压应力对成骨细胞增殖起抑制作用,而超过4.25 g/cm2的周期性压应力可能会直接导致细胞凋亡;张玲莉等[17]用三维水凝胶模型发现以1%强度、0.5 Hz频率、4 h大小和周期的压应力干预可促进成骨细胞增殖;刘伟龙[19]发现,持续性加力6 h是压应力对成骨细胞产生早期应答反应的关键时间点,在同样加载6 h的压应力后,2 g/cm2比5 g/cm2的压应力能更广泛地激活相关信号通路参与早期骨应答反应;曹阳等[18]发现,对成骨样细胞(MG-63)施加4 000 μstrain的周期性压应力时,细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)可在5 min内被迅速激活,但在 60 min时恢复至基态水平。除此之外,JIANG等[46]对牙周膜细胞施加压应力后,Piezo1的基因和蛋白表达量在12 h时均达到了最大值。 多数实验表明,压应力促进成骨细胞增殖的时间集中在6-12 h,促进成骨细胞增殖的大小集中在2 g/cm2左右,如表3所示。而促进成骨细胞增殖的最佳压应力大小受限于不同的仪器设备和加力方式,并没有相对统一的计量单位,不同实验组间结果难以对比,且细胞在微观层面所受到的压应力并不直接等同于外界所加载压应力的大小,需要考虑力在实验设备上的传导和细胞自身因素。由于压应力加载设备的不同,不同实验组压应力的加载频率也缺乏参考性,需要更标准化、规范化的加载方式来探究不同细胞受到的压应力刺激关系,为后续压应力的更进一步研究提供参考。"
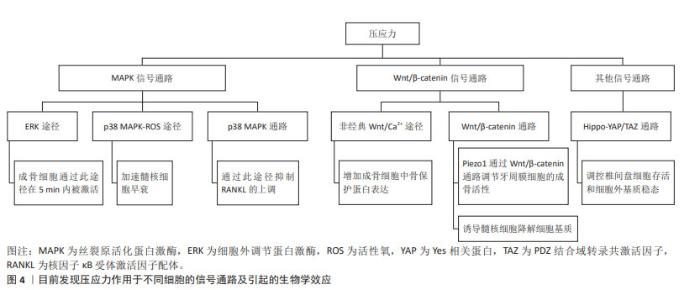
2.4 压应力作用于细胞的信号通路研究 在多种细胞中均有涉及压应力引起细胞反应的信号通路研究,但在成骨细胞方面的研究较为广泛且成熟,因此,该综述重点关注压应力作用于成骨细胞的相关信号通路。 2.4.1 丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路 MAPK信号通路存在于大多数细胞内,可将细胞外的刺激信号转导至细胞内,从而调节细胞的增殖、分化、凋亡、炎症反应等多种生物学反应,其包括4个分支路线:ERK1/2、p38MAPK、JUK和ERK5。杜启翠等[16]发现p38MAPK信号通路可介导压应力对细胞的刺激,参与了骨组织的修复改建过程。LI等[47]发现高强度压缩通过p38 MAPK-ROS途径加速髓核细胞的早衰。YAMAMOTO等[27]发现静水压力以幅度和剂量依赖性方式促进白细胞介素6和肿瘤坏死因子α的表达,通过上调核因子κB 受体激活因子配体(receptor activator of nuclear factor kappa B ligand,RANKL)的表达来改变RANKL/OPG比例,且p38MAPK通路的特异性抑制剂能够抑制静水压力刺激下RANKL的上调。曹阳等[18]发现压应力和牵张力均可以在早期激活成骨细胞内的MAPK/ERK信号通路,ERK可在5 min内被压应力激活,ERK激活可能与后续其他转导途径的激活密切相关。SONG等[15]发现p38和ERK不参与压应力诱导的成骨细胞凋亡,压应力通过激活JNK通路并抑制磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)通路的激活来诱导成骨细胞凋亡,压应力通过平衡这二者来实现对成骨细胞的调控。压应力可以同时诱导JNK和AKT磷酸化,但只有在较小的压应力下,PI3K/AKT信号通路才会显著激活,产生抗凋亡作用,随着压应力的增大,JNK的磷酸化增加而AKT磷酸化减少,从而诱导成骨细胞凋亡。综上可知,压应力可能通过多种MAPK信号途径调控成骨细胞的生命活动,且不同MAPK信号通路可能存在相互联系,细胞类型是否会造成压应力对细胞的激活通路不同等仍有待进一步研究。 2.4.2 Wnt/β-catenin信号通路 Wnt细胞信号通路在进化过程中高度保守,其分为Wnt/β-catenin、Wnt/Ca2+和Wnt/Planar polarity 3条通路。KANEUJI等[22]发现压应力以剂量依赖性的方式促进MC3T3-E1细胞分泌骨保护蛋白,选择性的Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ抑制剂可以抑制骨保护蛋白分泌,即压应力通过激活非经典Wnt/Ca2+途径增加了成骨细胞中骨保护蛋白的表达,从而调控破骨细胞的生成,达到调控骨代谢的作用。JIANG等[46]发现Piezo1在压应力作用下通过Wnt/β-catenin通路调节牙周膜细胞的成骨活性,并且Wnt/β-catenin通路可能位于piezo1的下游,即piezo1可能通过激活β-连环蛋白来调整牙槽骨重塑。XU等[48]发现高静水压力可通过Wnt/β-catenin信号通路诱导髓核细胞降解细胞基质。 2.4.3 其他信号通路及分子 WANG等[49]发现静水压通过调节Hippo-YAP/TAZ通路来调控椎间盘细胞存活和细胞外基质稳态,从而应对不同负荷的压应力。YU等[50]研究表明,静水压力通过激活p300/p53/smad通路促进心房纤维化。LI等[51]发现EZH2在压应力的作用下持续下降,提示其对维持细胞稳定性有重要的作用。 综上可知,在目前研究中,压应力作用于成骨细胞主要是通过p38MAPK信号通路、ERK信号通路、Wnt/β-catenin等信号通路来调节细胞生命活动,见图4。在这些信号通路激活后,其下游是如何引起细胞产生应答效应及不同类型的力对同一细胞的刺激途径是否一样,各信号通路之间是否存在相互影响等问题均需更进一步去研究。"

| [1] NOURSE JL, PATHAK MM. How cells channel their stress: Interplay between Piezo1 and the cytoskeleton. Semin Cell Dev Biol. 2017;71: 3-12. [2] WU T, YIN F, WANG N, et al. Involvement of mechanosensitive ion channels in the effects of mechanical stretch induces osteogenic differentiation in mouse bone marrow mesenchymal stem cells. J Cell Physiol. 2021;236(1):284-293. [3] YANG W, ZHONG W, YAN S, et al. Mechanical Stimulation of Anti-Inflammatory and Antioxidant Hydrogels for Rapid Re-Epithelialization. Adv Mater. 2024;36(18):e2312740. [4] PETITJEAN N, CANADAS P, JORGENSEN C, et al. Complex deformation of cartilage micropellets following mechanical stimulation promotes chondrocyte gene expression. Stem Cell Res Ther. 2023;14(1):226. [5] VERMEULEN S, TAHMASEBI BIRGANI Z, HABIBOVIC P. Biomaterial-induced pathway modulation for bone regeneration. Biomaterials. 2022;283:121431. [6] GHASEMZADEH-HASANKOLAEI M, MIRANDA JM, CORREIA CR, et al. Viscous Microcapsules as Microbioreactors to Study Mesenchymal Stem/Stromal Cells Osteolineage Commitment. Small Methods. 2023; 7(7):e2201503. [7] JESUS D, PINHO AR, GOMES MC, et al. Emerging modulators for osteogenic differentiation: a combination of chemical and topographical cues for bone microenvironment engineering. Soft Matter. 2022;18(16):3107-3119. [8] DU L, XU B, CHENG L, et al. Mechanobiological Mechanisms Involved in the Regualation of the Blood-Brain Barrier by Fluid Shear Force. Sichuan Da Xue Xue Bao Yi Xue Ban. 2024;55(1):74-80. [9] FRANCO MELÉNDEZ K, CRENSHAW K, BARRILA J, et al. Role of RpoS in Regulating Stationary Phase Salmonella Typhimurium Pathogenesis-Related Stress Responses under Physiological Low Fluid Shear Force Conditions. mSphere. 2022;7(4):e0021022. [10] LI J, WANG Y, ZHU W, et al. A novel mechanocatalytical reaction system driven by fluid shear force for the mild and rapid pretreatment of lignocellulosic biomass. Waste Manag. 2022;148:98-105. [11] FORGHANI P, RASHID A, ARMAND LC, et al. Simulated microgravity improves maturation of cardiomyocytes derived from human induced pluripotent stem cells. Sci Rep. 2024;14(1):2243. [12] ZHANG J, WANG X, FU Z, et al. Long-term simulated microgravity fosters carotid aging-like changes via Piezo1. Cardiovasc Res. 2024;120(5): 548-559. [13] GHASEMZADEH-HASANKOLAEI M, PINTO CA, JESUS D, et al. Effect of high cyclic hydrostatic pressure on osteogenesis of mesenchymal stem cells cultured in liquefied micro-compartments. Mater Today Bio. 2023;23:100861. [14] 王碧超,付雪飞,朱铭慧,等.周期性压应力对成骨细胞增殖及活性的影响[J].贵州医科大学学报,2018,43(1):30-33,66. [15] SONG F, WANG Y, JIANG D, et al. Cyclic Compressive Stress Regulates Apoptosis in Rat Osteoblasts: Involvement of PI3K/Akt and JNK MAPK Signaling Pathways. PLoS One. 2016;11(11):e0165845. [16] 杜启翠,苏林旺,杭晨,等.p38MAPK在周期性压应力下对颌骨成骨细胞分化的作用[J].中华老年口腔医学杂志,2023,21(4): 193-197,241. [17] 张玲莉,仝晓阳,郭健民,等.3D水凝胶压应力模型建立及压应力对成骨细胞的影响[J].中国生物工程杂志,2017,37(8):8-14. [18] 曹阳,郑翼,陈扬熙,等.机械应力下成骨细胞外信号调节激酶ERK1/2的早期变化[J].第四军医大学学报,2007,28(18):1663-1666. [19] 刘伟龙.压应力诱导MC3T3--E1细胞成骨分化过程中miRNA表达谱分析及miR--222--3p功能验证[D].广州:南方医科大学,2020. [20] SHEN XQ, GENG YM, LIU P, et al. Magnitude-dependent response of osteoblasts regulated by compressive stress. Sci Rep. 2017;7:44925. [21] SOMEMURA S, KUMAI T, YATABE K, et al. Physiologic Mechanical Stress Directly Induces Bone Formation by Activating Glucose Transporter 1 (Glut 1) in Osteoblasts, Inducing Signaling via NAD+-Dependent Deacetylase (Sirtuin 1) and Runt-Related Transcription Factor 2 (Runx2). Int J Mol Sci. 2021;22(16):9070. [22] KANEUJI T, ARIYOSHI W, OKINAGA T, et al. Mechanisms involved in regulation of osteoclastic differentiation by mechanical stress-loaded osteoblasts. Biochem Biophys Res Commun. 2011;408(1):103-109. [23] CAI G, NGUYEN A, BASHIRZADEH Y, et al. Compressive stress drives adhesion-dependent unjamming transitions in breast cancer cell migration. Front Cell Dev Biol. 2022;10:933042. [24] NISHI R, ODA Y, MORIKURA T, et al. Effect of Compressive Stress in Tumor Microenvironment on Malignant Tumor Spheroid Invasion Process. Int J Mol Sci. 2022;23(13):7091. [25] MORIKURA T, MIYATA S. Mechanical Intermittent Compression Affects the Progression Rate of Malignant Melanoma Cells in a Cycle Period-Dependent Manner. Diagnostics (Basel). 2021;11(6):1112. [26] CHUGH M, MUNJAL A, MEGASON SG. Hydrostatic pressure as a driver of cell and tissue morphogenesis. Semin Cell Dev Biol. 2022;131: 134-145. [27] YAMAMOTO K, YAMAMOTO T, ICHIOKA H, et al. Effects of mechanical stress on cytokine production in mandible-derived osteoblasts. Oral Dis. 2011;17(7):712-719. [28] TAIJI R, KANG JD, MIZUNO S. Cellular behavior and extracellular matrix turnover in bovine annulus fibrosus cells under hydrostatic pressure and deviatoric strain. J Orthop Res. 2024;42(6):1326-1334. [29] FREY B, JANKO C, EBEL N, et al. Cells under pressure - treatment of eukaryotic cells with high hydrostatic pressure, from physiologic aspects to pressure induced cell death. Curr Med Chem. 2008;15(23): 2329-2336. [30] FREY B, FRANZ S, SHERIFF A, et al. Hydrostatic pressure induced death of mammalian cells engages pathways related to apoptosis or necrosis. Cell Mol Biol (Noisy-le-grand). 2004;50(4):459-467. [31] YEH CF, JUANG DS, CHEN YW, et al. A Portable Controllable Compressive Stress Device to Monitor Human Breast Cancer Cell Protrusions at Single-Cell Resolution. Front Bioeng Biotechnol. 2022; 10:852318. [32] KOUROUKLIS AP, WAHLSTEN A, STRACUZZI A, et al. Control of hydrostatic pressure and osmotic stress in 3D cell culture for mechanobiological studies. Biomater Adv. 2023;145:213241. [33] SEGERITZ P, KOLESNIK K, SCOTT DJ, et al. Quantitative mechanical stimulation of GPR68 using a novel 96 well flow plugin. Lab Chip. 2024;24(6):1616-1625. [34] ALFORD AI, KOZLOFF KM, HANKENSON KD. Extracellular matrix networks in bone remodeling. Int J Biochem Cell Biol. 2015;65: 20-31. |
| [1] | Li Liangkui, Huang Yongcan, Wang Peng, Yu Binsheng. Effect of anterior controllable anteriodisplacement and fusion on vertebrae-ossification of posterior longitudinal ligament complex and implants: a finite element analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1761-1767. |
| [2] | Xu Biao, Lu Tan, Jiang Yaqiong, Yin Yujiao. Xu Biao, Lu Tan, Jiang Yaqiong, Yin Yujiao [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1768-1774. |
| [3] | Zhou Jinhai, Li Jiangwei, Wang Xuquan, Zhuang Ying, Zhao Ying, Yang Yuyong, Wang Jiajia, Yang Yang, Zhou Shilian. Three-dimensional finite element analysis of anterior femoral notching during total knee arthroplasty at different bone strengths [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1775-1782. |
| [4] | Fu Enhong, Yang Hang, Liang Cheng, Zhang Xiaogang, Zhang Yali, Jin Zhongmin. OpenSim-based prediction of lower-limb biomechanical behavior in adolescents with plantarflexor weakness [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1789-1795. |
| [5] | Sun Xiaojun, Wang Huaming, Zhang Dehong, Song Xuewen, Huang Jin, Zhang Chen, Pei Shengtai. Effect of finite element method in treatment of developmental dysplasia of the hip in children [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1897-1904. |
| [6] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [7] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [8] | Yin Lu, Jiang Chuanfeng, Chen Junjie, Yi Ming, Wang Zihe, Shi Houyin, Wang Guoyou, Shen Huarui. Effect of Complanatoside A on the apoptosis of articular chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1541-1547. |
| [9] | Zhu Hanmin, Wang Song, Xiao Wenlin, Zhang Wenjing, Zhou Xi, He Ye, Li Wei, . Mitophagy regulates bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1676-1683. |
| [10] | Yu Ting, Lyu Dongmei, Deng Hao, Sun Tao, Cheng Qian. Icariin pretreatment enhances effect of human periodontal stem cells on M1-type macrophages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1328-1335. |
| [11] | Aikepaer · Aierken, Chen Xiaotao, Wufanbieke · Baheti. Osteogenesis-induced exosomes derived from human periodontal ligament stem cells promote osteogenic differentiation of human periodontal ligament stem cells in an inflammatory microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1388-1394. |
| [12] | Zhang Haojun, Li Hongyi, Zhang Hui, Chen Haoran, Zhang Lizhong, Geng Jie, Hou Chuandong, Yu Qi, He Peifeng, Jia Jinpeng, Lu Xuechun. Identification and drug sensitivity analysis of key molecular markers in mesenchymal cell-derived osteosarcoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1448-1456. |
| [13] | Wang Mi, Ma Shujie, Liu Yang, Qi Rui. Identification and validation of characterized gene NFE2L2 for ferroptosis in ischemic stroke [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1466-1474. |
| [14] | Sun Yuting, Wu Jiayuan, Zhang Jian. Physical factors and action mechanisms affecting osteogenic/odontogenic differentiation of dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1531-1540. |
| [15] | Lu Jieming, Li Yajing, Du Peijie, Xu Dongqing. Effects of artificial turf versus natural grass on biomechanical performance of the lower limbs in young females during jump-landing [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1101-1107. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||