Chinese Journal of Tissue Engineering Research ›› 2022, Vol. 26 ›› Issue (36): 5881-5888.doi: 10.12307/2022.995
Previous Articles Next Articles
Mechanism of bone healing and angiogenesis during distraction osteogenesis
Lyu Zichen, Tu Zhenxing, Xu Ao, Cheng Kang, Wang Hongtao, Wang Bin
- Department of Hand Surgery, Tangshan Second Hospital, Tangshan 063000, Hebei Province, China
-
Received:2021-10-30Accepted:2021-12-02Online:2022-12-28Published:2022-04-28 -
Contact:Wang Bin, Professor, Master’s supervisor, Department of Hand Surgery, Tangshan Second Hospital, Tangshan 063000, Hebei Province, China -
About author:Lyu Zichen, Master candidate, Department of Hand Surgery, Tangshan Second Hospital, Tangshan 063000, Hebei Province, China
CLC Number:
Cite this article
Lyu Zichen, Tu Zhenxing, Xu Ao, Cheng Kang, Wang Hongtao, Wang Bin. Mechanism of bone healing and angiogenesis during distraction osteogenesis[J]. Chinese Journal of Tissue Engineering Research, 2022, 26(36): 5881-5888.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
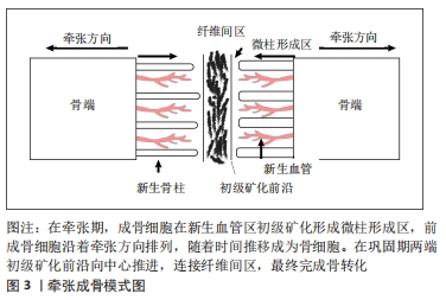
2.1 牵张成骨过程中骨的新生与重建 2.1.1 牵张成骨的成骨模式 目前牵张成骨技术广泛地应用于颌面外科与骨科,并在下颌骨、颅骨及外周长骨的牵张愈合过程中表现出相似的组织学特性。在牵张成骨的潜伏期,截骨端的组织学和分子学特征和正常骨折间隙有很大的相似性,但是牵引成骨的新骨形成速度是一般骨折成骨的2倍[3]。有组织学研究显示,在牵引三四周后,实验标本的标准化X射线片即可显示位于间隙中央的透明间隙,且定量计算机断层扫描及双能X射线吸收法测量显示,早在开始牵引的第10天,牵张间隙就已经有新骨矿化沉积[4-6]。 以往研究广泛认为,牵张成骨过程中只有2种经典的骨化模式[7-11],即软骨内成骨和膜下成骨。典型的软骨内骨形成可以发生在潜伏期和牵张的早期,但是膜内骨形成才是牵张成骨过程中成骨的主要机制,并且在后期牵张成骨的骨沉积中起到了主要作用。直到有研究通过实验观察到在牵张成骨过程中,存在于牵张间隙的纤维间区的骨基质中含有大量的“软骨样骨”[12],“软骨样骨”在组织学上类似一种骨与软骨组织的中间体,其由一种软骨细胞样细胞组成,虽然地高辛-11-UT标记的互补RNA原位杂交显示这种细胞暂时表达Ⅱ型胶原mRNA。但并不具有软骨细胞的典型特征,也不具有经典软骨内成骨过程中的毛细血管生成。由此提出了牵张成骨过程中存在着一种不同于一般骨折愈合过程中软骨内成骨和膜内成骨的第3种骨化机制,即“经软骨成骨”。HAMANISHI等[13]发现在超微结构水平上,潜伏期结束存在散乱的Ⅰ型胶原束。随着牵张的开始这些胶原纤维束会逐渐增粗,并逐渐沿着牵张力的方向固定,随后位于截骨端两侧的成骨细胞会逐渐沿着这些胶原纤维束进行沉积骨化[14-15]。 2.1.2 牵引成骨对骨愈合的生理影响 牵张成骨的潜伏期与骨折的早期愈合拥有相似的组织学特征,均伴有血肿形成和炎性细胞及间充质干细胞的募集[16-17],在骨折或截骨后炎症细胞、血管母细胞、成纤维细胞、软骨母细胞和成骨细胞等不同细胞系开始协同增殖从而形成初始骨痂[18-19]。但在随后的延长期和巩固期与骨折愈合并不相同。在牵张成骨的潜伏期和牵张早期可于骨膜附近观察到软骨内骨的形成,虽然在牵张间隙内未发现软骨内骨,但牵张过程可能会抑制软骨的发育。在成骨过程中并不在牵张间隙内形成软骨骨痂,而是在牵张间隙内形成一种纤维血管桥,称为纤维间区[3,20-21],见图3。 "
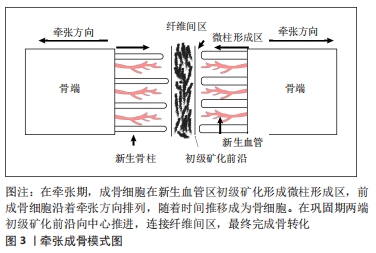

纤维间区在形态上是成纤维细胞和软骨细胞之间的中间体,其中富含软骨细胞样细胞、成纤维细胞和椭圆形细胞[3,11,22]。在这个过程结束时,纤维间区是最后一个骨化的区域。纤维间区两侧是高密度增殖的成骨细胞称为初级矿化前沿,这些成骨细胞在新形成的毛细血管和血管窦区域进行初级矿化,导致形成类似石笋和钟乳石的骨柱,称为微柱形成区。微柱形成区从每处皮质断端向中心突出。这些微柱锥体在皮质切开面的普遍直径为150-200 μm,在牵张期,前成骨细胞在初级矿化前沿和微柱形成区中的细长胶原纤维之间沿着拉伸方向排列。在牵张晚期和巩固期早期,成骨细胞前体细胞分化为成骨细胞,随后在初级矿化前沿处被矿化的基质包围,当基质完全矿化时,最终成为骨细胞。当牵张结束时,初级矿化前沿从两端向中心推进,连接纤维间区,最终完成骨转化,实现牵张成骨从微观到宏观的改建。在整个牵张成骨过程中,新生骨的形成和改建似乎更多地是由于牵张成骨过程中成骨细胞及破骨细胞的募集和激活,而不是单个细胞活动水平的增加。类骨质的连续矿化发生在牵张激活过程中,特别是在之后的巩固阶段。在巩固期间,新骨的矿化完成,并发生骨重塑,形成成熟的,带骨髓的板层骨。 牵张成骨的生物过程,见图4。 "


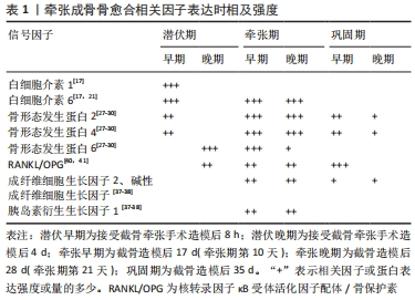
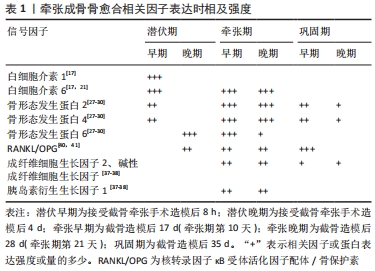
2.1.3 牵张成骨在骨愈合中的分子效应 牵张成骨术截骨后血管破裂立即形成血肿,激活的血小板聚集以控制受伤部位的失血。一系列的生化和细胞事件开始诱导炎症反应。截骨后即刻(潜伏期)阶段促炎因子白细胞介素1和白细胞介素6在早期表达增加,促进细胞外基质合成和炎细胞招募[17,21]。在牵张期开始时,成骨细胞、软骨细胞和拉伸应变最高的纤维间区内的椭圆形细胞中白细胞介素6表达增加,导致白细胞介素6表达的第2次高峰。此时,白细胞介素6被认为拥有通过促进成骨分化进而促进膜内成骨的能力及调控牵张成骨过程中促进合成代谢和分解代谢的作用[21]。 转化生长因子β超家族成员在牵张期也有上调。在牵引过程中,转化生长因子β促进成骨细胞增殖,同时抑制成骨细胞的成熟,有效地延缓成骨细胞的分化,从而促进新骨的形成[23-24]。骨形态发生蛋白属于转化生长因子β超家族,是一类可由骨膜细胞分泌的具有多向调节作用的生长因子,对心脏、神经系统、软骨发育以及骨组织的形成与修复等过程均起重要的调节作用[25]。其中骨形态发生蛋白2/4在骨损伤修复过程中发挥关键性作用。 有研究通过对35只大鼠进行股骨延长实验,分别于牵张结束后、牵张结束后第1,3,5,7,9,14天取材[26],对股骨延长区两侧骨缘进行骨形态发生蛋白2/4的免疫组化检测。结果证明牵张结束时,骨形态发生蛋白2/4在牵张间隙并不表达;从牵张完成后5 d,肥大的软骨细胞中骨形态发生蛋白2/4表达增强,牵张完成7 d后,骨形态发生蛋白2/4在靠近新生骨的肥大软骨细胞和成骨样细胞中可见表达;而牵张完成后14 d,骨形态发生蛋白2/4表达下降,呈降低趋势,仅部分肥大的软骨细胞和成骨样细胞可见骨形态发生蛋白2/4的表达,证明了骨形态发生蛋白2/4在牵张结束后的矿化期高表达。但有研究通过原位杂交和Northern印迹分析的方法发现在截骨后4 d,骨膜下未成熟骨痂的软骨前体细胞中就可以检测到骨形态发生蛋白2/4 mRNA的表达[27];在截骨后7 d,软骨外骨痂和骨内骨痂形成;同时,骨形态发生蛋白2,4 mRNA的表达降至术前水平,随后在牵张期牵张力的作用下受到明显诱导一直维持高表达状态。 初级矿化前沿处的软骨细胞和纤维间区内的卵圆形细胞受到牵张机械力作用影响导致骨形态发生蛋白2及骨形态发生蛋白4的表达特异上调,并且在整个牵张过程中一直保持,随后逐渐消失;这些骨形态发生蛋白在初级矿化前沿处的软骨细胞内和纤维间区内的卵圆形细胞内对机械应变保持高敏感性且具有特异性的上调作用,进一步提示了骨形态发生蛋白2/4在牵张成骨细胞增殖中起了重要作用[27-28]。虽然以往研究对于骨形态发生蛋白2/4的表达时间及持续状态的研究结果并不相同,但都同样表明了骨形态发生蛋白2/4基因的表达增强是牵张成骨过程中良好且持续的骨再生的原因,在牵张成骨骨再生的过程中起到了重要的正向作用[29-30]。FLOERKEMEIER等[29]通过在牵张成骨巩固期加入外源性骨形态发生蛋白2加速骨形成而缩短了牵张成骨期间的治疗时间更证明了其作用。 有研究通过向裸鼠皮下组织植入过表达鼠骨形态发生蛋白6基因的CHO细胞,发现了诱导软骨内成骨的作用[30]。在牵张成骨中骨形态发生蛋白6与骨形态发生蛋白2/4不同,其仅表达于潜伏期纤维间区内的软骨细胞,随后其表达在牵张期下降,证明了骨形态发生蛋白6基因对机械张力刺激无反应。骨形态发生蛋白6下调是骨化从软骨内向膜内转变的主要方式,提示了其在牵张成骨初始阶段软骨内成骨的作用[27]。 相较于骨形态发生蛋白2/4/6在牵张成骨中的明显过量表达,骨形态发生蛋白7在牵张成骨过程中的表达和作用尚存在不同的研究结果和意见。多数实验证明骨形态发生蛋白7常在牵张成骨中呈现较低的表达水平。有动物实验通过对兔进行下颌骨牵张,随后用免疫组织化学染色对牵张区骨形态发生蛋白7的表达进行分析,实验结果显示骨形态发生蛋白7在牵张期间在成骨细胞中的表达相对较弱[31-32],LAMMENS等[33]通过对小鼠长骨实施牵张成骨,并在牵张期结束后检测骨形态发生蛋白的表达,与兔的下颌骨牵张成骨实验中得到了相似的结果,即骨形态发生蛋白7基因在牵张成骨中呈现低表达状态。SAILHAN等[34]在其研究中对实验组家兔实施胫骨截骨术后注射外源性重组骨形态发生蛋白7,而对照组不应用,干预7 d后,以0.5 mm/ 12 h的速度牵引3周,从牵张第2周开始,每周评估1次放射学、超声和密度学参数。分别于牵张期结束及巩固期1,2,3周时取材,经放射学评估显示,与注射重组人骨形态发生蛋白7的实验组相比,对照组有增加骨愈合和骨分化的趋势,且对照组各时间点骨矿含量均高于实验组;超声检查显示,实验组92%的动物在再生过程中出现囊肿,而对照组为0%;超声检查和组织形态计量学显示实验组骨再生延迟,并未显示出骨形态发生蛋白7促进骨生长愈合的作用。上述实验均证实骨形态发生蛋白7在牵张成骨中呈现弱表达,甚至对牵张成骨中骨的生长和固结产生负作用。但也有研究表明在重组人骨形态发生蛋白7可刺激骨化再生率并增加牵张成骨过程中的骨矿物密度[35]。 一项英国的回顾性研究显示,临床中应用外源性重组人骨形态发生蛋白7在治疗持续性骨折不愈合、髋臼重建后促进骨折愈合、牵张成骨、游离腓骨移植骨折不愈合等领域也显现出良好的疗效,653例患者的总有效率为82% [36]。通过上述实验及研究来看,外源性注射骨形态发生蛋白7可刺激骨化再生率并增加牵张成骨过程中的骨矿物密度,骨形态发生蛋白7对牵张成骨骨再生起到了积极的作用,但由于骨形态发生蛋白7对牵张应力并不敏感,导致其在牵张成骨过程中不能过量表达,从而其在牵张成骨中的作用不明显。而SAILHAN等[34]实验中骨形态发生蛋白7对牵张成骨成骨的负作用,可能是因为其研究的局限性(注射液浓度,应用骨形态发生蛋白7注射液时间,延长方案,评估时间较短等)所致。 FARHADIEH等[37]通过动物实验发现胰岛素衍生生长因子1、成纤维细胞生长因子2及碱性成纤维细胞生长因子都在初级矿化前沿周围高表达,然后在巩固过程中下调,实验显示,实验组的胰岛素衍生生长因子与成纤维细胞生长因子均高于对照组,很可能是牵张产生的机械应力促进了上述3种因子的过表达从而起到了促进成骨细胞分化的作用[37-38]。但不同的是胰岛素衍生生长因子更倾向于在骨再生的早期起到促进作用,而成纤维细胞生长因子的表达却相对滞后且广泛存在于破骨细胞之中,但激活程度相较于对照组更为明显,这提示它在骨再生的重塑阶段中所起的作用,破骨细胞的强烈染色可能是由于成纤维细胞生长因子在牵张成骨过程中持续的骨吸收的作用。这与另一项研究结果相符[39]。 破骨细胞生成在牵张成骨中同样扮演者十分重要的角色,有助于于牵张成骨中的骨重建和塑性。核转录因子κB受体激活子(receptor activator of nuclear factor-κB ligand,RANK)是一种在破骨细胞中表达的跨膜蛋白,属于肿瘤坏死因子超家族,存在于破骨细胞中。当RANK与成骨细胞和其他基质细胞产生的RANKL(核转录因子κB受体活化因子配体)结合时,RANK被激活。会促进破骨细胞的形成。骨保护素(osteoprotegerin,OPG)是一种抑制破骨细胞发育的蛋白质,作为诱饵受体与RANKL结合,阻止RANK信号转导。破骨细胞的激活因此被阻断,在严重的骨溶解患者中,RANKL/OPG比率显著升高,这种失衡与骨吸收机制有关。体外研究表明,RANKL和RANK中的一种或两种都降低或不存在会导致骨化病和成熟破骨细胞浓度降低;同样,RANKL和RANK中的一种或两种的过量会导致骨质疏松和破骨细胞活性增加而导致的快速骨质丢失。有研究发现RANK/RANKL/OPG系统同样在牵张成骨期间的平衡骨转换过程中起到了关键作用[40]。与骨折愈合一样,RANKL/OPG系统的高表达比率促进破骨细胞生成。RANKL/OPG比值在潜伏期后期增加,并在巩固阶段达到高峰[40-41],提示RANKL/OPG在牵张成骨最后的骨成熟和塑形过程中起主要作用。 上述研究结果表明,目前骨愈合过程中相关因子的表达及作用机制已相对明确,多数因子及蛋白已经被证实能够有效促进牵张成骨过程中骨的再生与矿化。该综述的大量基础研究也证明了其在牵张成骨动物模型中的作用,其中关于部分骨形态发生蛋白的研究与作用较为成熟,已经成功应用于临床中骨不连、骨延迟愈合等疾病的治疗当中,但许多现有研究成果仍未在牵张成骨领域进行大规模应用。成骨蛋白在临床牵张成骨中的应用及作用将会是今后的一大热点,今后应加快此方面的临床研究,在做出新的创新型基础实验研究的同时,将现有的成果进行转化,才能发挥实验研究的真正作用,牵张成骨过程中成骨相关因子及蛋白表达及作用见图5,表1。 "


2.2 牵张成骨过程中血管的重建与矿化 2.2.1 牵张成骨中的血管生成 血管生成是牵张成骨过程中的重要一环,对新骨的生成至关重要。机械牵引诱导的血管生成反应比骨折愈合要大得多[17]。ARONSON[3]通过定量氚闪烁测量,发现牵张过程中的血流量增加到正常血流量的10倍。免疫组织化学分析还鉴定了血管基膜层粘连蛋白和Ⅳ型胶原的2种成分,为活跃的血管生成提供了证据[45]。新生血管生长方向同初级矿化前沿相同。在纤维间区内,毛细血管是由新生窦状毛细血管和新生运输毛细血管形成的。在巩固期间,骨膜和髓质血管网在牵张部位连接。CHOI等[7]在血管腐蚀铸型实验中发现牵引成骨过程中的血供显著增加,骨膜与髓质血管增殖和矿化之间存在着时间和空间上的密切关系。在实验的第7-14天,骨膜血管增生较骨内膜血管明显;牵张期第7天(实验开始第14 天)在相应的牵张新骨形成区发现有来源于髓窦和骨膜血管的血管网的早期形成;实验第21天(牵引期结束),可以发现在牵张区有来源于骨膜和骨内膜表面的血管广泛增生并通向纤维间区,但纤维间区本身缺乏血管化,这个现象也验证了上文中提到的纤维间区是最后矿化成骨的区域,牵张区血管的生长模式为:血管的分支与新生骨新生微柱沿同一方向平行排列,可能表明血管生成与矿化密切相关;实验第42天,牵张部位骨膜血管网和髓质血管网完全连通,包括纤维间区,牵张间隙被再生的成骨组织填充。 虽然在牵张期间就开始新的血管形成,但血管体积增加主要出现在巩固期内,这表明在牵张成骨中血管生成和骨形成之间存在联系[46-49]。MORGAN等[46]发现,主动牵张期的主要特征是周围肌肉的动脉生成,在巩固期间,血管生成主要发生在骨内区域,血管形成从周围肌肉进入再生。强烈的成骨周期与血管生成周期是同时发生的。 2.2.2 牵张成骨中血管生成的细胞分子学影响 作为血管生成-成骨偶联的关键调节因子,血管内皮生长因子在牵张成骨过程中具有多重作用。牵张成骨截骨后即刻骨创伤后的血肿和随后的炎症反应启动了骨修复,血管内皮生长因子在这一过程中起着关键作用,主要集中在骨损伤后的血肿中。据报道,血肿中的血管内皮生长因子浓度可以是血浆中血管内皮生长因子浓度的15倍[26,50],截骨端形成的血肿缺氧诱导周围骨细胞过表达血管内皮生长因子或募集炎症细胞,从碎裂的骨基质、血小板或浸润的天然免疫细胞中释放的血管内皮生长因子可能与纤维蛋白(Nogen)相关的肝素结合,并被隔离在纤维蛋白基质中,使血肿中的纤维蛋白基质成为血管内皮生长因子的储存库[49-51]。此机制也对牵张成骨过程中后续的新生血管生成提供条件。在后续牵张机械力的作用下血管内皮生长因子会从成骨细胞中释放出来,并通过自分泌机制调节成骨细胞的分化和矿化[52-53]。 来自成骨细胞的血管内皮生长因子结合相邻内皮细胞上的受体,可促进新生血管生成,并促进骨形态发生蛋白2/4从血管中释放[54]。JACOBSEN等[55]通过对小鼠使用血管内皮生长因子抗体阻断血管内皮生长因子R1和血管内皮生长因子受体2降低了小鼠牵引成骨模型中的血管生成反应和骨再生,说明了血管内皮生长因子/血管内皮生长因子受体介导的血管生成的重要性。另有研究证明可以通过敲低血管内皮生长因子1/2基因从而减少成骨细胞分化[56],但ECKARDT等[57]通过给兔注射外源性血管内皮生长因子或抑制剂并不能影响早期成骨细胞系细胞的分化,实验组骨血流、扭转刚度、骨矿物质含量和骨再生的组织形态学等指标和对照组并无明显差异,这表明可能只有成骨细胞内分泌的内源性血管内皮生长因子才能在刺激成骨细胞分化和矿化方面发挥作用。 在血管内皮生长因子家族成员中,只有血管内皮生长因子A和Neuropilin(一种血管内皮生长因子受体)在牵张阶段显著上调[58]。牵张成骨过程中新生血管的形成可能是由血管内皮生长因子A和作为血管内皮生长因子替代受体的Neuropilin诱导的。在牵张成骨过程中,其他血管内皮生长因子配体和受体的表达比血管内皮生长因子A和Neuropilin低很多倍,且难以量化,见表2。 "
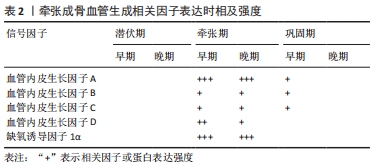

血管内皮生长因子A在初级矿化前沿内的成熟成骨细胞和微柱形成区的破骨细胞中表达[59],在牵张成骨的胫骨模型中部分阻断血管内皮生长因子信号导致膜内骨化的阻断,但允许软骨生成,而完全阻断血管内皮生长因子既抑制成骨又抑制软骨生成[60]。牵张成骨过程中血管内皮生长因子A的主要来源是周围肌肉内的间充质细胞。通过这些血管然后合成促进牵张成骨过程中骨形成的形态原(例如,骨形态发生蛋白2/4等)[48]。与骨折愈合相比,血管内皮生长因子A的上游激活因子缺氧诱导因子1α在牵张的骨中显著上调[61],提示许多与缺氧诱导因子1α相关的下游基因在牵张成骨过程中促进新骨形成方面发挥了重要作用。也有越来越多的证据表明,缺氧诱导因子和血管内皮生长因子通路在牵张成骨过程中的血管生成-成骨耦合中起着非常重要的作用[62-64]。 骨的发育和重塑还依赖于成骨细胞和骨微环境中的其他细胞之间的复杂相互作用,特别是血管内皮细胞,它可能是骨中复杂互动通讯网络的关键成员。在一项动物实验中发现,在小鼠牵张成骨模型中,内皮祖细胞比例增加的时间模式与骨折愈合模型相似,均表现为外周血和脾脏内皮祖细胞比例增加,骨折(截骨)后达高峰,但牵张成骨中内皮祖细胞比例在牵张和巩固期再次增加[65]。说明牵张阶段的缺血应激可能会产生诱导内皮祖细胞动员的信号,且内皮祖细胞可通过刺激血管生成加速牵张成骨期间的骨再生[66]。而内皮祖细胞数量的后期二次上升和激活与牵张和巩固阶段活跃的新血管及新骨形成时相一致,这种时间关系表明,持续的牵张力可以诱导骨髓内皮祖细胞动员,动员后的内皮祖细胞有助于增加牵张成骨期间的新生血管。在该实验随后的异体体外扩增的内皮祖细胞移植实验中,发现移植的内皮祖细胞除了停留在脾脏的细胞外,外循环中的内皮祖细胞呈剂量依赖关系,其中绝大部分存在于微柱形成区。表明在骨折愈合和牵张成骨过程中,外周血单核细胞中内皮祖细胞的比例增加,骨折或截骨断端新生骨痂表达的细胞因子可能在骨髓内皮祖细胞动员中起作用。骨痂表达与内皮祖细胞归巢相关的黏附分子,循环中内皮祖细胞数量的增加导致内皮祖细胞归巢到骨再生部位的数量增加。因此,由骨再生部位的信号动员的内皮祖细胞似乎有助于新生血管的形成,从而增加骨折愈合和牵张成骨的血流量。 LEE等[67]通过研究包括13例接受长骨肢体延长手术的患者,并分别于手术前、截骨后第2天或第3天、牵张开始前和牵张开始后第7-14天采集外周血样,对采集到的血样进行血细胞分类计数、单核细胞培养、流式细胞仪分析和血浆细胞因子水平测定等操作。在手术后白细胞数量和C-反应蛋白均升高,内皮祖细胞集落数量增加,且血浆中动员内皮祖细胞细的细胞因子(如血管内皮生长因子)水平升高。由于已知在牵张成骨期间,牵张张力会上调血管内皮生长因子的mRNA表达,且血管内皮生长因子由于其本身具有促有丝分裂和迁移的作用,在血管生成中起着重要作用,特别是对内皮细胞[68-71]。此外,血管内皮生长因子还促进体内内皮祖细胞的分化,并诱导骨髓中的内皮祖细胞动员[72],因此牵张-巩固阶段的血管增殖和生成可能大部分归因于血管内皮生长因子。 牵张成骨中骨的再生与血管的再生矿化息息相关,互相耦合关联,血管的再生与矿化是一切骨愈合与再生的起点。血管内皮生长因子在许多临床试验中已经被验证起到了积极的作用,相信今后通过一系列临床试验可以确定其用量、用法,进而应用于临床治疗之中。其次内皮祖细胞、间充质干细胞等前体细胞在血管生成与重建中同样起到了不可或缺的作用,各种前体细胞除可以通过缺血应激、应力效应募集外,同样广泛存在与骨髓之中。因此在临床手术中,尽力避免损伤术区血供,降低热损伤,保护骨髓细胞也将对愈合效果产生积极的影响。合理的牵张速度和治疗方案同样对牵张区血管的再生有重要的意义。 2.3 牵张成骨机制总结 牵张成骨修复的过程十分复杂,在截骨术后即刻形成血肿,发生炎症反应,白细胞介素1和白细胞介素6在早期表达增加,促进细胞外基质合成和炎细胞招募启动了修复的第一步。进入牵张期后,牵张力的介入可使内皮祖细胞等功能前体细胞被激活和募集,使血管内皮生长因子开始过表达和生成,这些机制均在血管生成中发挥重要作用。随后新生血管开始大规模生成,其发生早于新生骨的再生,被认为是牵张成骨的起始和开端。机械牵张诱导的血管生成反应相较于潜伏期更为剧烈,截骨两端骨膜和骨内膜表面的血管逐渐增生并通向纤维间区,随后牵张部位骨膜血管网和髓质血管网完全连通。在此期间,成骨细胞沿着新生血管和纤维束排列,骨形态发生蛋白等细胞因子参与其中促进多种来源的干细胞从截骨端至纤维间区逐渐骨化,经过骨的矿化与塑性。最终在牵张区形成新生骨。 "

| [1] YIN P, ZHANG Q, MAO Z, et al. The treatment of infected tibial nonunion by bone transport using the Ilizarov external fixator and a systematic review of infected tibial nonunion treated by Ilizarov methods. Acta Orthop Belg. 2014;80(3):426-435. [2] ERALP L, BILEN FE, ROZBRUCH SR, et al. External fixation reconstruction of the residual problems of benign bone tumours. Strategies Trauma Limb Reconstr. 2016;11(1):37-49. [3] ARONSON J. Temporal and spatial increases in blood flow during distraction osteogenesis. Clin Orthop Relat Res. 1994;(301):124-131. [4] ARONSON J, GOOD B, STEWART C, et al. Preliminary studies of mineralization during distraction osteogenesis. Clin Orthop Relat Res. 1990;(250):43-49. [5] ARONSON J, HARP JH. Mechanical forces as predictors of healing during tibial lengthening by distraction osteogenesis. Clin Orthop Relat Res. 1994;(301):73-79. [6] EYRES KS, BELL MJ, KANIS JA. New bone formation during leg lengthening. Evaluated by dual energy X-ray absorptiometry. J Bone Joint Surg Br. 1993;75(1):96-106. [7] CHOI IH, AHN JH, CHUNG CY, et al. Vascular proliferation and blood supply during distraction osteogenesis: a scanning electron microscopic observation. J Orthop Res. 2000;18(5):698-705. [8] MEYER U, MEYER T, VOSSHANS J, et al. Decreased expression of osteocalcin and osteonectin in relation to high strains and decreased mineralization in mandibular distraction osteogenesis. J Craniomaxillofac Surg. 1999;27(4):222-227. [9] MEYER U, MEYER T, WIESMANN HP, et al. The effect of magnitude and frequency of interfragmentary strain on the tissue response to distraction osteogenesis. J Oral Maxillofac Surg. 1999;57(11):1331-1341. [10] MEYER U, WIESMANN HP, MEYER T, et al. Microstructural investigations of strain-related collagen mineralization. Br J Oral Maxillofac Surg. 2001; 39(5):381-389. [11] SATO M, YASUI N, NAKASE T, et al. Expression of bone matrix proteins mRNA during distraction osteogenesis. J Bone Miner Res. 1998;13(8): 1221-1231. [12] YASUI N, SATO M, OCHI T, et al. Three modes of ossification during distraction osteogenesis in the rat. J Bone Joint Surg Br. 1997;79(5): 824-830. [13] HAMANISHI C, YOSHII T, TOTANI Y, et al. Lengthened callus activated by axial shortening. Histological and cytomorphometrical analysis. Clin Orthop Relat Res. 1994;(307):250-254. [14] KARP NS, MCCARTHY JG, SCHREIBER JS, et al. Membranous bone lengthening: a serial histological study. Ann Plast Surg. 1992;29(1):2-7. [15] KARAHARJU EO, AALTO K, KAHRI A, et al. Distraction bone healing. Clin Orthop Relat Res. 1993;(297):38-43. [16] MCCARTHY JG, STELNICKI EJ, MEHRARA BJ, et al. Distraction osteogenesis of the craniofacial skeleton. Plast Reconstr Surg. 2001; 107(7):1812-1827. [17] AI-AQL ZS, ALAGL AS, GRAVES DT, et al. Molecular mechanisms controlling bone formation during fracture healing and distraction osteogenesis. J Dent Res. 2008;87(2):107-118. [18] MIZUTA H, SANYAL A, FUKUMOTO T, et al. The spatiotemporal expression of TGF-beta1 and its receptors during periosteal chondrogenesis in vitro. J Orthop Res. 2002;20(3):562-574. [19] SIMMONS DJ. Fracture healing perspectives. Clin Orthop Relat Res. 1985;(200):100-113. [20] JAZRAWI LM, MAJESKA RJ, KLEIN ML, et al. Bone and cartilage formation in an experimental model of distraction osteogenesis. J Orthop Trauma. 1998;12(2):111-116. [21] CHO TJ, KIM JA, CHUNG CY, et al. Expression and role of interleukin-6 in distraction osteogenesis. Calcif Tissue Int. 2007;80(3):192-200. [22] VAUHKONEN M, PELTONEN J, KARAHARJU E, et al. Collagen synthesis and mineralization in the early phase of distraction bone healing. Bone Miner. 1990;10(3):171-181. [23] LAMMENS J, LIU Z, AERSSENS J, et al. Distraction bone healing versus osteotomy healing: a comparative biochemical analysis. J Bone Miner Res. 1998;13(2):279-286. [24] HOLBEIN O, NEIDLINGER-WILKE C, SUGER G, et al. Ilizarov callus distraction produces systemic bone cell mitogens. J Orthop Res. 1995; 13(4):629-638. [25] SALAZAR VS, GAMER LW, ROSEN V. BMP signalling in skeletal development, disease and repair. Nat Rev Endocrinol. 2016;12(4):203-221. [26] SOJO K, SAWAKI Y, HATTORI H, et al. Immunohistochemical study of vascular endothelial growth factor (VEGF) and bone morphogenetic protein-2, -4 (BMP-2, -4) on lengthened rat femurs. J Craniomaxillofac Surg. 2005;33(4):238-245. [27] SATO M, OCHI T, NAKASE T, et al. Mechanical tension-stress induces expression of bone morphogenetic protein (BMP)-2 and BMP-4, but not BMP-6, BMP-7, and GDF-5 mRNA, during distraction osteogenesis. J Bone Miner Res. 1999;14(7):1084-1095. [28] RAUCH F, LAUZIER D, CROTEAU S, et al. Temporal and spatial expression of bone morphogenetic protein-2, -4, and -7 during distraction osteogenesis in rabbits. Bone. 2000;27(3):453-459. [29] FLOERKEMEIER T, THOREY F, WELLMANN M, et al. rhBMP-2 in an injectable Gelfoam carrier enhances consolidation of the distracted callus in a sheep model. Technol Health Care. 2017;25(6):1163-1172. [30] GITELMAN SE, KOBRIN MS, YE JQ, et al. Recombinant Vgr-1/BMP-6-expressing tumors induce fibrosis and endochondral bone formation in vivo. J Cell Biol. 1994;126(6):1595-1609. [31] YAZAWA M, KISHI K, NAKAJIMA H, et al. Expression of bone morphogenetic proteins during mandibular distraction osteogenesis in rabbits. J Oral Maxillofac Surg. 2003;61(5):587-592. [32] CAMPISI P, HAMDY RC, LAUZIER D, et al. Expression of bone morphogenetic proteins during mandibular distraction osteogenesis. Plast Reconstr Surg. 2003;111(1):201-210. [33] LAMMENS J, LIU Z, LUYTEN F. Bone morphogenetic protein signaling in the murine distraction osteogenesis model. Acta Orthop Belg. 2009; 75(1):94-102. [34] SAILHAN F, CHOTEL F, CHOUSTA A, et al. Unexpected absence of effect of rhBMP-7 on distraction osteogenesis. Clin Orthop Relat Res. 2007; 457:227-234. [35] Ren LF, Shi GS, Tong YQ, et al. Effects of rhBMP-2/7 heterodimer and RADA16 hydrogel scaffold on bone formation during rabbit mandibular distraction. J Oral Maxillofac Surg. 2018;76(5):1092.e1-1092.e10. [36] GIANNOUDIS PV, TZIOUPIS C. Clinical applications of BMP-7: the UK perspective. Injury. 2005;36 Suppl 3:S47-S50. [37] FARHADIEH RD, DICKINSON R, YU Y, et al. The role of transforming growth factor-beta, insulin-like growth factor I, and basic fibroblast growth factor in distraction osteogenesis of the mandible. J Craniofac Surg. 1999;10(1):80-86. [38] TAVAKOLI K, YU Y, SHAHIDI S, et al. Expression of growth factors in the mandibular distraction zone: a sheep study. Br J Plast Surg. 1999; 52(6):434-439. [39] DENG C, WYNSHAW-BORIS A, ZHOU F, et al. Fibroblast growth factor receptor 3 is a negative regulator of bone growth. Cell. 1996;84(6): 911-921. [40] PÉREZ-SAYÁNS M, SOMOZA-MARTÍN JM, BARROS-ANGUEIRA F, et al. RANK/RANKL/OPG role in distraction osteogenesis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;109(5):679-686. [41] ZHU WQ, WANG X, WANG XX, et al. Temporal and spatial expression of osteoprotegerin and receptor activator of nuclear factor -kappaB ligand during mandibular distraction in rats. J Craniomaxillofac Surg. 2007;35(2):103-111. [42] NUNTANARANONT T, SUTTAPREYASRI S, VONGVATCHARANON S. Quantitative expression of bone-related cytokines induced by mechanical tension-stress during distraction osteogenesis in a rabbit mandible. J Investig Clin Dent. 2014;5(4):255-265. [43] KHANAL A, YOSHIOKA I, TOMINAGA K, et al. The BMP signaling and its Smads in mandibular distraction osteogenesis. Oral Dis. 2008;14(4): 347-355. [44] LI G, VIRDI AS, ASHHURST DE, et al. Tissues formed during distraction osteogenesis in the rabbit are determined by the distraction rate: localization of the cells that express the mRNAs and the distribution of types I and II collagens. Cell Biol Int. 2000;24(1):25-33. [45] GANEY TM, KLOTCH DW, SASSE J, et al. Basement membrane of blood vessels during distraction osteogenesis. Clin Orthop Relat Res. 1994; (301):132-138. [46] MORGAN EF, HUSSEIN AI, AL-AWADHI BA, et al. Vascular development during distraction osteogenesis proceeds by sequential intramuscular arteriogenesis followed by intraosteal angiogenesis. Bone. 2012;51(3): 535-545. [47] BRAGDON B, LYBRAND K, GERSTENFELD L. Overview of biological mechanisms and applications of three murine models of bone repair: closed fracture with intramedullary fixation, distraction osteogenesis, and marrow ablation by reaming. Curr Protoc Mouse Biol. 2015;5(1):21-34. [48] MATSUBARA H, HOGAN DE, MORGAN EF, et al. Vascular tissues are a primary source of BMP2 expression during bone formation induced by distraction osteogenesis. Bone. 2012;51(1):168-180. [49] STREET J, WINTER D, WANG JH, et al. Is human fracture hematoma inherently angiogenic? Clin Orthop Relat Res. 2000;(378):224-237. [50] MARTINO MM, BRIQUEZ PS, RANGA A, et al. Heparin-binding domain of fibrin(ogen) binds growth factors and promotes tissue repair when incorporated within a synthetic matrix. Proc Natl Acad Sci U S A. 2013; 110(12):4563-4568. [51] MOSESSON MW. Fibrinogen and fibrin structure and functions. J Thromb Haemost. 2005;3(8):1894-1904. [52] THI MM, SUADICANI SO, SPRAY DC. Fluid flow-induced soluble vascular endothelial growth factor isoforms regulate actin adaptation in osteoblasts. J Biol Chem. 2010;285(40):30931-30941. [53] THI MM, IACOBAS DA, IACOBAS S, et al. Fluid shear stress upregulates vascular endothelial growth factor gene expression in osteoblasts. Ann N Y Acad Sci. 2007;1117:73-81. [54] SCHIPANI E, MAES C, CARMELIET G, et al. Regulation of osteogenesis-angiogenesis coupling by HIFs and VEGF. J Bone Miner Res. 2009;24(8): 1347-1353. [55] JACOBSEN KA, AL-AQL ZS, WAN C, et al. Bone formation during distraction osteogenesis is dependent on both VEGFR1 and VEGFR2 signaling. J Bone Miner Res. 2008;23(5):596-609. [56] LIU Y, BERENDSEN AD, JIA S, LOTINUN S, et al. Intracellular VEGF regulates the balance between osteoblast and adipocyte differentiation. J Clin Invest. 2012;122(9):3101-3113. [57] ECKARDT H, BUNDGAARD KG, CHRISTENSEN KS, et al. Effects of locally applied vascular endothelial growth factor (VEGF) and VEGF-inhibitor to the rabbit tibia during distraction osteogenesis. J Orthop Res. 2003; 21(2):335-340. [58] CARVALHO RS, EINHORN TA, LEHMANN W, et al. The role of angiogenesis in a murine tibial model of distraction osteogenesis. Bone. 2004;34(5):849-861. [59] CHOI IH, CHUNG CY, CHO TJ, et al. Angiogenesis and mineralization during distraction osteogenesis. J Korean Med Sci. 2002;17(4):435-447. [60] JACOBSEN KA, AL-AQL ZS, WAN C, et al. Bone formation during distraction osteogenesis is dependent on both VEGFR1 and VEGFR2 signaling. J Bone Miner Res. 2008;23(5):596-609. [61] PACICCA DM, PATEL N, LEE C, et al. Expression of angiogenic factors during distraction osteogenesis. Bone. 2003;33(6):889-898. [62] SCHIPANI E, MAES C, CARMELIET G, et al. Regulation of osteogenesis-angiogenesis coupling by HIFs and VEGF. J Bone Miner Res. 2009;24(8): 1347-1353. [63] RIDDLE RC, KHATRI R, SCHIPANI E, et al. Role of hypoxia-inducible factor-1alpha in angiogenic-osteogenic coupling. J Mol Med (Berl). 2009;87(6):583-590. [64] WAN C, GILBERT SR, WANG Y, et al. Activation of the hypoxia-inducible factor-1alpha pathway accelerates bone regeneration. Proc Natl Acad Sci U S A. 2008;105(2):686-691. [65] LEE DY, CHO TJ, KIM JA, et al. Mobilization of endothelial progenitor cells in fracture healing and distraction osteogenesis. Bone. 2008; 42(5):932-941. [66] Jia Y, Zhu Y, Qiu S, et al. Exosomes secreted by endothelial progenitor cells accelerate bone regeneration during distraction osteogenesis by stimulating angiogenesis. Stem Cell Res Ther. 2019;10(1):12. [67] LEE DY, CHO TJ, LEE HR, et al. Distraction osteogenesis induces endothelial progenitor cell mobilization without inflammatory response in man. Bone. 2010;46(3):673-679. [68] SHIRLEY D, MARSH D, JORDAN G, et al. Systemic recruitment of osteoblastic cells in fracture healing. J Orthop Res. 2005;23(5):1013-1021. [69] ISNER JM, PIECZEK A, SCHAINFELD R, et al. Clinical evidence of angiogenesis after arterial gene transfer of phVEGF165 in patient with ischaemic limb. Lancet. 1996;348(9024):370-374. [70] LEUNG DW, CACHIANES G, KUANG WJ, et al. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science. 1989;246 (4935):1306-1309. [71] PUFE T, WILDEMANN B, PETERSEN W, et al. Quantitative measurement of the splice variants 120 and 164 of the angiogenic peptide vascular endothelial growth factor in the time flow of fracture healing: a study in the rat. Cell Tissue Res. 2002;309(3):387-392. [72] ASAHARA T, TAKAHASHI T, MASUDA H, et al. VEGF contributes to postnatal neovascularization by mobilizing bone marrow-derived endothelial progenitor cells. EMBO J. 1999;18(14):3964-3972. [73] PAES EC, BITTERMANN GKP, BITTERMANN D, et al. Long-term results of mandibular distraction osteogenesis with a resorbable device in infants with robin sequence: effects on developing molars and mandibular growth. Plast Reconstr Surg. 2016;137(2):375e-385e. [74] TONOGAI I, TAKAHASHI M, TSUTSUI T, et al. Forearm lengthening by distraction osteogenesis: a report on 5 limbs in 3 cases. J Med Invest. 2015;62(3-4):219-222. |
| [1] | Li Rui, Shi Wen, Yang Shicai, Lü Linwei, Zhang Chunqiu. Effect of splintage and Shenxiaosan cataplasm on fracture healing in rabbits with radial fracture model [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(9): 1329-1333. |
| [2] | Wang Baojuan, Zheng Shuguang, Zhang Qi, Li Tianyang. Miao medicine fumigation can delay extracellular matrix destruction in a rabbit model of knee osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1180-1186. |
| [3] | Wang Qin, Shen Cheng, Liao Jing, Yang Ye. Dapagliflozin improves renal injury in diabetic nephropathy rats [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(8): 1216-1222. |
| [4] | Hou Jingying, Guo Tianzhu, Yu Menglei, Long Huibao, Wu Hao. Hypoxia preconditioning targets and downregulates miR-195 and promotes bone marrow mesenchymal stem cell survival and pro-angiogenic potential by activating MALAT1 [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(7): 1005-1011. |
| [5] | Yang Feng, Zhao Qian, Zhang Shixuan, Zhao Tienan, Feng Bo. Effectiveness and safety of rapamycin combined with CD133 antibody stent in preventing vascular restenosis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 579-584. |
| [6] | Yang Sidi, Wang Qian, Xu Nuo, Wang Ronghan, Jin Chuanqi, Lu Ying, Dong Ming. Biodentine enhances the proliferation and differentiation of osteoblasts through upregulating bone morphogenetic protein-2 [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(4): 516-520. |
| [7] | Long Zhisheng, Xiong Long, Gong Feipeng, Li Jingtang, Zeng Jianhua, Deng Ying, Lan Min, Kong Weihao, Chen Gang. Effect of artificial bone with multi-scale hydroxyapatite/chitosan microtubule structure on rabbit bone defect repair and angiogenesis [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(34): 5436-5441. |
| [8] | Li Yi, Yang Yanjun, Peng Songyun, Cheng Zhigang, Zhong Kai, Yin Tianping, Tang Lianghua. Effect of Miao medicine Jiuxian Luohan Jiegu Decoction on osteogenic differentiation and fracture healing in tibial fracture rats [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(33): 5350-5356. |
| [9] | Liu Jie, Hua Qikai, Li Shanlang, Yu Jie, Su Hongjie, Ding Yi, Zhao Yongxin, Su Yongfeng, Chen Yan. Periosteum distraction for the treatment of diabetic foot ulcer: theoretical basis and clinical verification [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(32): 5236-5241. |
| [10] | Yu Yunbao, Chen Lin, Wu Xiya, Yan Lerong, Miao Zhang, Man Yang, Jing Renyi, Lei Zhen, Chu Zhiqiang, Zhang Hongwei. Vascular endothelial growth factor-Notch signaling pathways in endothelial precursor cells in promoting the transformation of bone marrow mesenchymal stem cells into hepatocyte-like cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(31): 4946-4953. |
| [11] | Deng Xiaohui, Zhang Zengzeng, Zhang Zhihua, Zhu Lingyan. Mechanism and application prospects of mesenchymal stem cell exosomes gene-modified microRNA in the treatment of diabetic foot [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(31): 5076-5084. |
| [12] | Wu Chengcong, Wang Fang, Wan Jianshan, Wu Zheng, Sun Rong, Huang Hefei, Qian Xuankun, Ou Hua, Ren Jing. Adenovirus-mediated bone morphogenetic protein 2 induces osteogenic differentiation of rabbit bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(30): 4757-4761. |
| [13] | Jia Qiyu, Huang Xiaoxia, Guo Jian, Huang Jinyong, Guo Xiaobin, Abdussalam·Alimujiang, Wu Tong, Ma Chuang. Integrin-targeted peptide promotes proliferation of bone marrow mesenchymal stem cells in SD rats [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(30): 4780-4786. |
| [14] | Zhao Xinxin, Yang Xiaoqing, Zhang Yuquan. Umbilical cord mesenchymal stem cells improve pregnancy outcomes of spontaneous abortion mouse models by promoting vascular endothelial growth factor expression in decidua [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(30): 4793-4799. |
| [15] | Ailimaierdan·Ainiwaer, Muhetaer·Huojia, Wang Ling. Effect of transforming growth factor-beta 3 and bone morphogenetic protein-2 on proliferation and osteogenic differentiation of dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2022, 26(30): 4862-4866. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||