中国组织工程研究 ›› 2013, Vol. 17 ›› Issue (51): 8907-8913.doi: 10.3969/j.issn.2095-4344.2013.51.020
• 药物控释材料 drug delivery materials • 上一篇 下一篇
生物活性玻璃与壳聚糖复合的骨修复材料
孙 晨1, 2,祝少博1,禹志宏2,孙志波2,漆白文1,张 韬1,金 林1,麦合木提江•穆海麦提1
- 1武汉大学中南医院骨科,湖北省武汉市 430071;2湖北医药学院附属十堰市人民医院骨科,湖北省十堰市 442000
Combination of bioactive glass and chitosan as a bone repair material
Sun Chen 1, 2, Zhu Shao-bo1, Yu Zhi-hong2, Sun Zhi-bo2, Qi Bai-wen1, Zhang Tao1, Jin Lin1, Maihemutijiang• Muhaimaiti1
- 1 Department of Micro-Orthopedics, Zhongnan Hospital of Wuhan University, Wuhan 430071, Hubei Province China; 2 Department of Orthopedic Surgery, the Affiliated People’s Hospital of Siyan City, Hubei Medical University, Shiyan 442000, Hubei Province, China
摘要:
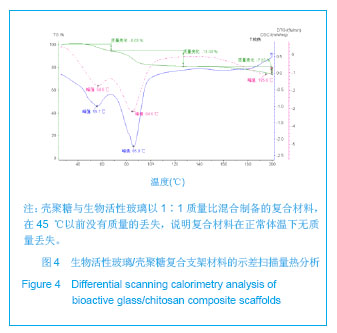
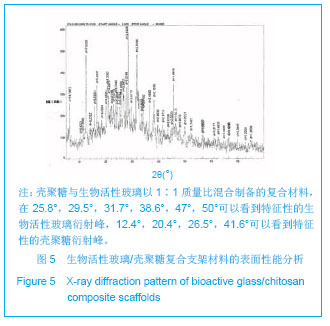
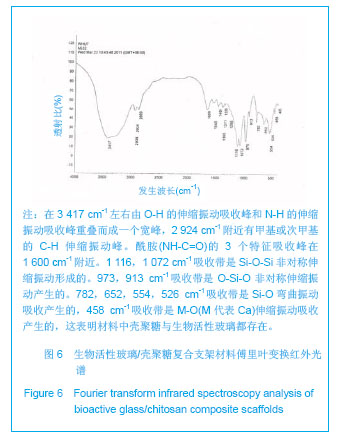
背景:生物活性玻璃是一种多相复合材料,具有良好的生物活性、骨传导性及生物相容性,但作为骨修复材料仍然存在不能完全降解、机械强度较低等不足。 目的:设计生物活性玻璃/壳聚糖复合材料骨组织工程支架,并检测其理化性能。 方法:将2.0%壳聚糖盐酸溶液与β-甘油磷酸钠以7∶1的体积比混合制备壳聚糖溶液。称取0.5,1.0,1.5 g生物活性玻璃分别加入上述壳聚糖溶液中,使得壳聚糖与生物活性玻璃的质量比为2∶1,1∶1及1∶1.5。将复合材料浸泡于模拟生理体液中7 d进行体外矿化。 结果与结论:扫描电镜见复合支架具有相互贯通的多孔结构,孔隙率最高可达89%,孔径大小合适,为100- 300 µm,生物活性玻璃以针状形式分散在壳聚糖支架之间,均匀排列,被壳聚糖支架充分包裹结合紧密。随生物活性玻璃含量的增加,复合材料的孔隙率逐渐下降,断裂强度逐渐升高,他们之间呈正相关性。X射线衍射图及傅里叶变换红外光谱证实复合支架中的单一材料未发生性质改变,示差扫描量热法分析显示正常体温情况下材料无质量丢失。矿化3 d后材料表面形成的羟基磷灰石逐渐长大为绒毛状,数量也明显增多;矿化7 d后绒毛状的羟基磷灰石长成为针状,数量进一步增多,且众多的矿化物结成球状。
中图分类号:




.jpg)