Chinese Journal of Tissue Engineering Research ›› 2026, Vol. 30 ›› Issue (4): 908-916.doi: 10.12307/2025.978
Previous Articles Next Articles
Effect of compressive stress microenvironment on cytokines during fracture healing
Guo Jiachen, Gao Jun, Dai Wenhao, Liao Huayuan, Jiang You, Zhang Xi
- Department of Chinese Orthopedics, Changzhou Hospital of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Changzhou 213000, Jiangsu Province, China
-
Received:2024-10-15Accepted:2024-12-03Online:2026-02-08Published:2025-05-20 -
Contact:Gao Jun, MD, Chief physician, Doctoral supervisor, Department of Chinese Orthopedics, Changzhou Hospital of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Changzhou 213000, Jiangsu Province, China -
About author:Guo Jiachen, Master candidate, Department of Chinese Orthopedics, Changzhou Hospital of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Changzhou 213000, Jiangsu Province, China -
Supported by:National Natural Science Foundation of China, No. 82374479 (to GJ); The Fourth Batch of Provincial Famous Old Chinese Medicine Experts Inheritance Studio Construction Project, No. (2021)7 (to GJ)
CLC Number:
Cite this article
Guo Jiachen, Gao Jun, Dai Wenhao, Liao Huayuan, Jiang You, Zhang Xi . Effect of compressive stress microenvironment on cytokines during fracture healing[J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 908-916.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

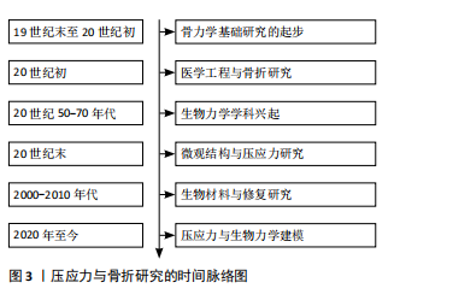
骨折愈合是一个复杂的过程,旨在将受损的骨骼恢复至原始状态,是涉及早期炎症免疫调节、血管生成及成骨分化的多步骤过程[4]。骨折愈合的类型取决于骨折部位的机械稳定性[5],其中适当的机械刺激对骨组织的形成尤为关键[6]。压应力是一种机械应力,是施加在人体骨骼上的压缩力。压应力对成骨细胞的作用受到力度和持续时间的影响,骨细胞能够感知并响应外界的机械信号,这一能力被称为“机械感知”。不同强度的压应力会对成骨细胞产生双向的影响。王海锋等[7]在实验中对成骨细胞分别施加100,200和400 g的压力,发现在100 g压力下培养24 h组成骨细胞的数量大于对照组,然而随着应力的变大及持续时间的变长,在施加200 g和400 g压应力下持续120 min后成骨细胞的数量明显减少,这表明一定范围内的压力会刺激成骨细胞的增殖,压应力过大、时间过长时又会影响成骨细胞的存活率。在桂颖丽[8]的研究中发现成骨细胞加力24 h后进入增殖高峰期,48 h"

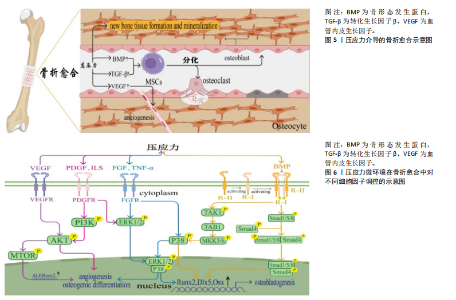
后增殖变缓,证实了成骨细胞也受到压应力持续时间的影响。Rath等[9]在研究中利用FX-5000C细胞压力加载系统对成骨细胞分别施加10%,20%压缩率,发现10%压缩率组成骨细胞出现明显的骨基质蛋白合成,而20%压缩率组并无此现象,证明了一定范围内的压应力在骨形成过程中有促进成骨的作用。目前,关于压应力对成骨细胞增殖活性影响的研究结果也不尽相同,有研究表示当外界提供较小的压应力时能够促进成骨细胞的增殖和分化,而较大的压应力则会抑制细胞的增殖,骨形成受到抑制[10-11]。刘奕斐[12]发现利用 FX-5000C 压力加载系统对三维结构的成骨细胞施加压力,成骨细胞在加力4 h达到增殖高峰,随着加力时间的延长,成骨细胞的增殖呈现下降趋势;随后通过对加力4 h组与相应对照组小鼠胚胎成骨细胞进行了差异基因的初步筛选,发现Myc、Jun、Fos、Runx2、Wnt10b、Lrp5 等基因水平上调,可能主要通过转化生长因子β信号通路和Wnt信号通路促进成骨细胞增殖分化有关。总之,在骨折愈合中,压应力作为一种重要的机械因素可激活骨折部位的成骨细胞和软骨细胞增殖分化,如激活Wnt/β-catenin、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/AKT)等通路促进成骨细胞向成骨分化、激活软骨细胞中骨形态发生蛋白等信号通路,有利于软骨的矿化和成熟[13]。 压应力微环境对骨组织的形成和愈合过程具有重要影响,施加于人体骨折部位的压应力能够激活内部的成骨细胞,增加骨质的生成,同时降低破骨细胞的活性,减少骨质流失[14-15]。在一定压应力下的成骨细胞与破骨细胞的活动通常处于动态平衡状态[16-17],共同促进骨质的健康和强度,维持骨重塑的稳定。在骨折初期,轴向的压应力刺激能显著增强成骨细胞分化能力,抑制破骨细胞成熟,进而促进骨愈合[18];同时,轴向的压应力可加速钙盐的沉积和骨痂量,骨矿化程度更高,胶原组织排列更加紧密,使骨骼更加牢固可靠[19]。 2.2 压应力在骨折愈合中的细胞级别反应和组织器官级别反应 压应力介导的骨折愈合的相关示意图,见图5。 2.2.1 细胞级别反应 骨细胞是骨基质中数量最多的细胞,也被认为是组织骨重塑的中枢[20]。骨细胞在感知和响应压应力方面发挥着至关重要的作用,而压应力反过来又会影响骨骼的生长和重塑。骨细胞能够根据压应力的变化而对人体骨骼生长产生影响,当压应力作用于骨组织时,骨细胞感知这种力学信号主要通过其细胞膜和细胞骨架结构来实现[17],并将这种机械信号转化为生物化学信号,从而影响成骨细胞与破骨细胞的分化[21]。压应力对特定细胞因子的表达具有促进作用,例如,骨形态发生蛋白(BMPs)、转化生长因子β(TGF-β)等均可在压应力的刺激下促进成骨细胞及成软骨细胞分化,在骨组织完整性和稳定性方面发挥关键作用[22-24]。压应力还可促进血管新生[25],这为骨折断端环境提供了充足的营养,血管生成是造骨的必要条件。据研究表明,压应力可通过调节与血管生成相关的细胞因子如血管内皮生长因子促进新血管的形成[26]。 此外,压应力可影响细胞间的通讯,主要通过改变细胞因子的分泌模式调节整个愈合过程[27]。 2.2.2 组织和器官级别的反应 压应力影响炎症反应的进展。适当条件下的压应力会对炎症细胞(如巨噬细胞)产生影响[28-29],巨噬细胞具有机械反应性,可以根据周围的机械刺激改变其谱系,有利于清除损伤区域的坏死组织和病原体,对整个骨折愈合过程起到促进作用。用编织骨替代软骨细胞是骨折修复与愈合的关键。在软骨形成阶段,压应力可以促进软骨基质的积累和软骨细胞的分化[30-32],软骨细胞发生肥大和分化后发生广泛、有序的凋亡,最终被成骨细胞取代而实现骨愈合。在随后的骨形成阶段中,压应力通过调节成骨细胞的活性,影响新骨组织的生成和矿化过程,影响骨细胞间(成骨与破骨细胞间)的动态平衡来调节新骨的结构,帮助恢复骨的原有形态和功能。总之,压应力通过机械转导机制影响细胞行为,并转化为生化信号影响骨折愈合过程[32-34]。 2.3 压应力在骨折愈合中对不同细胞因子调控的影响 有关“压应力微环境在骨折愈合中对不同细胞因子调控”的总结图,见图6。 2.3.1 骨形态发生蛋白 骨形态发生蛋白(BMP)属于转化生长因子β超家族成员[35],是一种强大的成骨分化因子,"
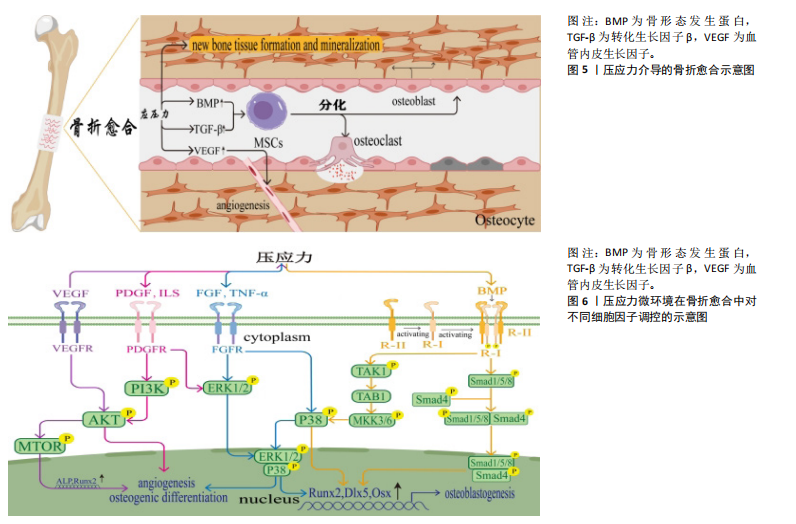

能在所有分化阶段促进成骨、破骨细胞生成和软骨生成分化[36]。目前通过重组技术已经发现20多种骨形态发生蛋白分型,其中骨形态发生蛋白2,6,7 和9等骨形态发生蛋白分子有助于骨骼形成,而骨形态发生蛋白3则可以通过负向调节骨形态发生蛋白信号传导,限制骨骼祖细胞分化为成熟成骨细胞,抑制骨形成[37]。此外,骨形态发生蛋白2、骨形态发生蛋白7 已被 FDA 批准在临床上应用于长骨骨折、脊柱融合等创伤骨科之中,逐渐成为了促进骨形成和加速骨折愈合的主要治疗策略[38-39]。众所周知,骨形态发生蛋白可以通过多种信号通路调节骨细胞转录因子Runx2的转录活性,从而介导成骨形成,其中最经典的是骨形态发生蛋白/Smad信号通路介导的成骨细胞分化,首先骨形态发生蛋白与Ⅰ型和Ⅱ型受体相互作用形成复合物,使Ⅰ型受体被Ⅱ型受体磷酸化,从而激活并募集Smad 1、Smad 5和Smad 8,随后这些磷酸化的R-Smad又与Smad 4形成入核复合物,在细胞核中,该复合物引起转录因子Runx2的表达上调,并促进骨形成[40]。此外,骨形态发生蛋白还可通过非经典途径调节Runx2表达,研究发现骨形态发生蛋白还可以通过TAK1通路调节,磷酸化的TAK1能够募集TAB1,并引起MKK3/6介导的下游-p38 MAPK的激活,激活的p38磷酸化并激活细胞核中Runx2、Dlx5和Sp7等转录因子的表达,从而促进成骨细胞功能[41-42]。 有研究为了确定压应力如何影响人成骨细胞(Saos-2)的成骨反应,通过施加0.5-3.0 g/cm2的压应力干预Saos-2细胞,并应用实时PCR和/或蛋白质印迹分析来测量骨形态发生蛋白及其拮抗剂和参与转录因子的表达,结果表明压应力通过提高 Saos-2细胞的骨形态发生蛋白含量并减少其拮抗剂的产生去诱导骨形成[43]。DA SILVA MADALENO等[44-45]的研究揭示了压应力如何通过骨形态发生蛋白受体1激活骨形态发生蛋白信号通路中的SMAD 1/5/8,从而上调依赖于SMAD的成骨基因表达,加速骨组织的形成。另一方面,压应力还可通过提高骨形态发生蛋白表达来促进自分泌骨形态发生蛋白信号传导诱导骨形成。此外,也有研究证明压应力可以上调骨形态发生蛋白2基因的表达,通过自分泌骨形态发生蛋白信号诱导成骨分化,有利于骨重塑与骨愈合[48-49]。PéREZ-LOZANO等[50]研究得出结论:在长期压应力作用下会诱导小鼠成骨细胞中骨形态发生蛋白4表达上升,骨形态发生蛋白4靶向基因又与破骨细胞生成和血管生成密切相关,骨形态发生蛋白4强烈表达可诱导成骨细胞、肥大前和肥大软骨细胞中组织重塑程序的表达来改变骨软骨连接稳态,在骨重塑过程中发挥重要作用。近年的一些研究进一步指出:压应力还能通过增强骨形态发生蛋白2的活性,并激活Runx2乙酰化途径和SMAD5过程,使未分化的成骨前体细胞成骨细胞分化,合成对骨形成至关重要的基质蛋白[9,49]。综上所述,骨形态发生蛋白作为一类多功能信号蛋白,在骨折愈合过程中发挥重要作用,其中压应力对其调控尤为关键。 2.3.2 成纤维细胞生长因子(FGFs) 成纤维细胞生长因子是一类多功能的生长因子,是骨折愈合中的关键因子。成纤维细胞生长因子家族大约有22 个成员,其中成纤维细胞生长因子2、成纤维细胞生长因子9和成纤维细胞生长因子18与成骨细胞的分化和骨组织再生密切相关[50]。成纤维细胞生长因子2对人软骨的稳态具有双向代谢作用,可以通过促进韧带血运重建以及间充质干细胞的募集迁移来实现软骨修复和骨骼愈合[51-52]。成纤维细胞生长因子2主要激活ERK1/2和p38 MAPK通路促进RUNX2的转录从而增强骨髓间充质干细胞的成骨分化[53]。另外,成纤维细胞生长因子23对骨形成也有多方面的影响,其通过成纤维细胞生长因子受体3介导的非Klotho依赖途径以及自分泌/旁分泌的方式抑制间充质干细胞分化和成骨细胞矿化[54]。成纤维细胞生长因子参与了细胞增殖分化、新血管形成以及调控炎症细胞活动等多种生物过程。结合成纤维细胞生长因子在骨愈合领域中的关键作用,目前其已为临床上治疗骨不愈合及骨缺损的患者铺平道路。 目前,一些相关研究表明压应力可以调节成纤维细胞生长因子的表达在骨折愈合过程中发挥了重要作用。OGURA等[55]指出:当骨组织受到机械压力时,压应力会诱导间充质干细胞产生成纤维细胞生长因子2,通过自分泌/旁分泌机制促进成骨细胞的活化和分化,加速骨折愈合。除此之外,压应力还可诱导成纤维细胞生长因子通过加速骨折断端新血管的生成,重建骨痂血运,为骨折愈合提供充足营养,加快骨痂成熟与骨化。NAKAJIMA等[56]证实压应力可以激活成纤维细胞生长因子2,从而提高核因子κB受体活化因子配体水平促进成骨发生。还有研究表明成纤维细胞生长因子23受到机械应力的调节影响[57],是由骨细胞产生的一种分泌因子,但随后的一些研究并未证实成纤维细胞生长因子23是否确实是一种机械敏感基因。总之,成纤维细胞生长因子是一组广泛的细胞生长和分化调节因子,应深入理解压应力对成纤维细胞生长因子的调控机制,创造更有效的骨折愈合治疗之法。 2.3.3 血小板衍生生长因子(PDGF) 血小板衍生生长因子起源于血小板和成纤维细胞,在正常情况下血小板衍生生长因子趋于稳定状态,当机体发生骨缺失或骨细胞受损时,会刺激血小板衍生生长因子的加速分泌[58]。血小板衍生生长因子的过表达可通过PI3K/AKT和 ERK1/2等信号通路募集促进血管生成和成骨分化[59],并通过促使细胞进入S期以及加速DNA合成从而实现成纤维细胞和骨母细胞的大量增殖并向骨折断端迁移等方式促进新骨的生成,加快骨愈合及修复过程。此外,骨折愈合需要良好的血液和营养供应,血小板衍生生长因子还参与了骨折部位新血管的生成过程,建立新的“血管网”提升骨愈合质量[60]。目前,有研究表明压应力在骨折愈合过程中对血小板衍生生长因子的调控发挥着关键作用,通过生物力学因素的干预,为临床治疗骨不愈合或骨缺损提供了新的治疗方法。 其中,有科学家研究了机械应变如何促进成骨,通过定量反转录/聚合酶链反应测定证明骨折愈合加快所归结于的成骨细胞大量增加与机械刺激所诱导的血小板衍生生长因子A 水平的上升密切相关[61]。在骨折愈合过程中,血小板衍生生长因子不仅促进断端间充质细胞的增加,还被压应力所激活,从而提高断端骨细胞中血小板衍生生长因子的水平[62-64]。血小板衍生生长因子通过特异性活动有丝分裂,显著增加成骨细胞和成纤维细胞的数量,并使细胞向断端迁移,加速了基质的沉淀和骨折愈合。此外,血小板衍生生长因子通过相同机制促进新血管形成,压应力增加的血小板衍生生长因子水平加速了内皮细胞分裂,形成功能性毛细血管,为骨折断端提供必要的营养,从而有利于骨的重塑与再生。 2.3.4 血管内皮生长因子(VEGF) 血管内皮生长因子属于同二聚体血管活性糖蛋白家族,是骨折愈合过程中的关键细胞因子[65],主要通过刺激新血管生成为骨折的早期愈合奠定基础[66],并且参与破骨细胞的募集、活性和分化过程以及在软骨内骨化过程中诱导愈伤组织重塑发挥着至关重要的作用[67]。目前,血管内皮生长因子还可应用于糖尿病创面、心血管疾病等领域的研究,可以说是再生医学科的关键细胞因子。 近些年,压应力的调控研究表明压应力可以显著提高血管内皮生长因子表达[68-70],有研究者发现持续性压应力能够通过ERK1/2的激活调节成骨细胞大量产生血管内皮生长因子,通过血管新生为骨愈合提供必需的营养条件[71]。石笑[72]用不同的动态压力刺激牙周膜干细胞,发现0-120 kPa下的动态压力值可以显著上调血管内皮生长因子受体2、血管内皮生长因子A等蛋白的表达,通过增强血管形成能力有助于牙周膜组织的修复和愈合。钟刚等[73]研究了骨折端压力刺激耦合外源性血管内皮生长因子基因转染对骨折愈合的影响,发现压应力与血管内皮生长因子二者间具有协同作用,能显著加快骨折愈合。综上,压应力在骨愈合过程中能显著提高血管内皮生长因子表达,建立“新”血管网络加速骨修复与再生。 2.3.5 白细胞介素(Interleukin) 白细胞介素是一组由淋巴细胞和巨噬细胞所组成的免疫调控因子,包含至少38种不同的家族成员,从白细胞介素1至白细胞介素38等,各有独特的功能和作用机制。其中,白细胞介素1、白细胞介素6、白细胞介素8、白细胞介素10等成员主要参与骨折愈合过程。例如,白细胞介素1和白细胞介素6被认为是骨折愈合最重要的因子[74-75],若白细胞介素1、白细胞介素6缺失会抑制间充质祖细胞向成骨细胞的分化,导致骨延迟愈合[76]。白细胞介素6对于骨形成具有双向作用,一方面它可以通过促进破骨细胞增殖促进骨吸收[77],另一方面还可以通过诱导胆碱能信号传导实现骨合成代谢作用[78]。白细胞介素8可以通过增强CXCR2介导的PI3k/Akt信号通路上调Sox9 和COL2的表达,从而促进软骨细胞分化与骨再生[79]。此外在软骨骨化的早期阶段,白细胞介素8还可通过促进骨形态发生蛋白受体的高表达与定位,从而提高骨形态发生蛋白2骨再生的效率[80]。有研究发现M2巨噬细胞介导的间充质干细胞成骨主要是通过白细胞介素10依赖性方式实现的,白细胞介素10能通过抑制破骨细胞成熟以及骨吸收,从而促进骨形成[81-82]。此外,白细胞介素10还可充当骨形态发生蛋白信号通路的刺激剂,通过激活 STAT-3、Smad1/5/8 和 ERK/MAPK通路,诱导软骨细胞中骨形态发生蛋白家族的表达,从而促进软骨成骨[83]。目前研究表明,压应力可刺激白细胞介素家族的表达来优化骨折愈合过程。 目前有研究表明压应力能诱导白细胞介素6在PI3K/AKT和ERK1/2信号的同步激活下加速骨重塑过程[84-85]。此外,GARCíA-LóPEZ等[86]研究表明,白细胞介素10能够抑制碱性磷酸酶、Ⅰ型胶原蛋白和骨蛋白基因的表达从而抑制成骨细胞的分化,白细胞介素12由巨噬细胞和B细胞所合成,在骨髓培养中白细胞介素12也被证明是成骨形成的抑制剂。但压应力微环境可下调白细胞介素10的表达并刺激白细胞介素12的合成,从而促进骨重塑过程。另外, ZHANG等[87]发现压应力能够诱导白细胞介素17S及其受体在成骨细胞样细胞中的表达,通过调节核因子κB受体活化因子配体、巨噬细胞集落刺激因子和骨保护素的表达而影响成骨细胞的发生,进而促进骨折愈合。FAHY等[88]研究发现将人单核细胞暴露于压应力下会增加其促炎基因和蛋白质的表达,压应力显著上调白细胞介素6和白细胞介素8水平,最大限度地发挥炎症介导的修复机制,有利于骨折部位的重塑和愈合。 CHATMAHAMONGKOL等[89]对人牙槽骨成骨细胞分别施加压应力、机械振动、压应力联合机械振动以及空白对照展开研究,使用定量实时聚合酶链反应评估白细胞介素1β、白细胞介素6,发现施加压应力和压应力联合机械振动的成骨细胞白细胞介素1β、白细胞介素6 mRNA和蛋白表达显著高于对照组和机械振动组,加速牙槽骨的修复再生。总之,压应力对免疫细胞因子白细胞介素的调控,主要通过减少炎症反应和调节免疫来发挥作用,深入研究两者间的相互作用有助于为骨科疾病治疗提供新策略。 2.3.6 肿瘤坏死因子α 肿瘤坏死因子α是具有多种生物学效应的炎症细胞因子,属于肿瘤坏死因子超家族成员,被广泛应用于炎症反应和病原体免疫学等领域。目前,研究发现肿瘤坏死因子α在骨相关疾病领域也有显著影响,其对不同骨组织细胞均有不同的调节作用[90]。简言之,肿瘤坏死因子α在骨组织中的效应以抑制成骨、促进破骨为主,在骨组织细胞中实现生物效应通常依赖于肿瘤坏死因子受体及核转录因子κB信号通路的激活。21世纪,压应力对于肿瘤坏死因子α的调控在骨折愈合中的研究已成为热点话题。 WU 等[91]研究发现,压应力可诱导DKK-1和肿瘤坏死因子α在ERK信号通路中相关表达,这促进成骨前细胞的增殖和分化,从而形成新骨。另一方面,KITAURA等[92]研究指出,肿瘤坏死因子α1的缺失会增加破骨细胞的形成,而肿瘤坏死因子α2的缺失会抑制破骨细胞的形成,这表明机械压应力通过调节肿瘤坏死因子α表达,不仅诱导破骨细胞的形成和骨吸收,而且帮助清除损伤区域的细胞碎片。ZHANG等[93]研究发现机械压缩力联合肿瘤坏死因子α可诱导病理性软骨变薄,促进坏骨的凋亡,为新骨的新生铺路。在炎症和愈合过程中,肿瘤坏死因子α作为一种强效促炎的细胞因子[94],过度表达一方面致使损伤部位的细菌感染率增加,另一方面过多的炎症因子会引起骨骼中骨髓间充质干细胞的分化延迟,可能会延缓骨折的愈合过程。"

| [1] 冯兴超,杨毅,金格勒.力学刺激在骨愈合中的作用及机制研究进展[J].四川解剖学杂志,2021,29(1):187-191. [2] JIN SS, HE DQ, WANG Y, et al. Mechanical force modulates periodontal ligament stem cell characteristics during bone remodelling via TRPV4. Cell Prolif. 2020;53(10):e12912. [3] EDAMOTO M, KURODA Y, YODA M, et al. Trans-pairing between osteoclasts and osteoblasts shapes the cranial base during development. Sci Rep. 2019;9(1):1956. [4] ZHANG S, LU C, ZHENG S, et al. Hydrogel loaded with bone marrow stromal cell-derived exosomes promotes bone regeneration by inhibiting inflammatory responses and angiogenesis. World J Stem Cells. 2024;16(5):499-511. [5] 胡建威,彭烨,张里程,等.骨折端力学环境研究进展[J].中华骨与关节外科杂志,2022,15(1):76-80. [6] SHEEN JR, MABROUK A, GARLA VV. Fracture Healing Overview. StatPearls. Treasure Island (FL); StatPearls Publishing Copyright © 2024, StatPearls Publishing LLC. 2024. [7] 王海锋,韩培彦,郝龙英,等.成骨细胞承受不同大小和不同时间压力后增殖变化的研究[J].北京口腔医学,2010,18(4):193-1955. [8] 桂颖丽.静态张应力和压力刺激对大鼠成骨样细胞增殖及碱性磷酸酶表达影响的研究[D].成都:四川大学,2005. [9] RATH B, NAM J, KNOBLOCH TJ, et al. Compressive forces induce osteogenic gene expression in calvarial osteoblasts. J Biomech. 2008; 41(5):1095-1103. [10] YANG X, JIANG J, ZHOU L, et al. Osteogenic and angiogenic characterization of mandible and femur osteoblasts. J Mol Histol. 2019;50(2):105-117. [11] ALFORD AI, KOZLOFF KM, HANKENSON KD. Extracellular matrix networks in bone remodeling. Int J Biochem Cell Biol. 2015;65:20-31. [12] 刘奕斐.压力对小鼠成骨细胞增殖活性影响的基因表达谱差异分析[D].石家庄:河北医科大学,2016. [13] D’ANDREA CR, ALFRAIHAT A, SINGH A, et al. Part 2. Review and meta-analysis of studies on modulation of longitudinal bone growth and growth plate activity: A micro-scale perspective. J Orthop Res. 2021;39(5):919-928. [14] LIU P, TU J, WANG W, et al. Effects of Mechanical Stress Stimulation on Function and Expression Mechanism of Osteoblasts. Front Bioeng Biotechnol. 2022;10:830722. [15] 闫鹏安,蔡逸帆,闫振兴,等.体外实验中压应力对细胞的作用和影响[J].中国组织工程研究,2025,29(23):4993-5001. [16] 陈涵纲,陈华,苏楠,等.FGFR1在骨骼发育、稳态维持和损伤修复中的作用研究进展[J].中国骨质疏松杂志,2024,30(6):869-874. [17] WANG L, YOU X, ZHANG L, et al. Mechanical regulation of bone remodeling. Bone Res. 2022;10(1):16. [18] SUN X, MCLAMORE E, KISHORE V, et al. Mechanical stretch induced calcium efflux from bone matrix stimulates osteoblasts. Bone. 2012; 50(3):581-591. [19] 林伟斌,朱聪,洪海森,等.体外周期性压应力对兔胫骨骨折愈合过程成骨与破骨细胞增殖分化能力的影响[J].中华损伤与修复杂志(电子版),2021,16(4):289-300. [20] LI X, KORDSMEIER J, XIONG J. New Advances in Osteocyte Mechanotransduction. Curr Osteoporos Rep. 2021;19(1):101-106. [21] BUCK HV, STAINS JP. Osteocyte-mediated mechanical response controls osteoblast differentiation and function. Front Physiol. 2024; 15:1364694. [22] WU Y, LI X, SUN Y, et al. Multiscale design of stiffening and ROS scavenging hydrogels for the augmentation of mandibular bone regeneration. Bioact Mater. 2023;20:111-125. [23] GE YW, FAN ZH, KE QF, et al. SrFe(12)O(19)-doped nano-layered double hydroxide/chitosan layered scaffolds with a nacre-mimetic architecture guide in situ bone ingrowth and regulate bone homeostasis. Mater Today Bio. 2022;16:100362. [24] NA NAN D, KLINCUMHOM N, TRACHOO V, et al. Periostin-integrin interaction regulates force-induced TGF-β1 and α-SMA expression by hPDLSCs. Oral Dis. 2024;30(4):2570-2579. [25] WANG Y, ZHENG Y, LI W. Compression loading of osteoclasts attenuated microRNA-146a-5p expression, which promotes angiogenesis by targeting adiponectin. Sci China Life Sci. 2022;65(1):151-166. [26] ZHAN JW, WANG SQ, FENG MS, et al. Constant compression decreases vascular bud and VEGFA expression in a rabbit vertebral endplate ex vivo culture model. PLoS One. 2020;15(6):e0234747. [27] DAZZI C, MEHL J, BENAMAR M, et al. External mechanical loading overrules cell-cell mechanical communication in sprouting angiogenesis during early bone regeneration. PLoS Comput Biol. 2023; 19(11):e1011647. [28] GANGULY K, LUTHFIKASARI R, RANDHAWA A, et al. Stimuli-Mediated Macrophage Switching, Unraveling the Dynamics at the Nanoplatforms-Macrophage Interface. Adv Healthc Mater. 2024;13(20):e2400581. [29] SU Y, YIN X. The Molecular Mechanism of Macrophages in Response to Mechanical Stress. Ann Biomed Eng. 2024 Oct 1. doi: 10.1007/s10439-024-03616-8. [30] LIU Q, HU X, ZHANG X, et al. Effects of mechanical stress on chondrocyte phenotype and chondrocyte extracellular matrix expression. Sci Rep. 2016;6:37268. [31] LIU Y, DZIDOTOR G, LE TT, et al. Exercise-induced piezoelectric stimulation for cartilage regeneration in rabbits. Sci Transl Med. 2022; 14(627):eabi7282. [32] WU W, ZHAO Z, WANG Y, et al. Biomechanical Effects of Mechanical Stress on Cells Involved in Fracture Healing. Orthop Surg. 2024;16(4): 811-820. [33] HUANG C, OGAWA R. Mechanotransduction in bone repair and regeneration. Faseb J. 2010;24(10):3625-3632. [34] JOSEPHSON TO, MORGAN EF. Harnessing mechanical cues in the cellular microenvironment for bone regeneration. Front Physiol. 2023; 14:1232698. [35] NAIR V, PATIL VS, TODKAR A, et al. Bone Morphogenetic Proteins: A Promising Approach for Enhancing Fracture Healing. Cureus. 2024; 16(8):e66619. [36] MARIDAS DE, FEIGENSON M, RENTHAL NE, et al. Bone morphogenetic proteins. Principl Bone Biol. 2020:1189-1197. [37] KODAMA N, MATSUBARA T, YOSHIMURA A, et al. BMP3b regulates bone mass by inhibiting BMP signaling. Bone. 2024;190:117303. [38] BEGAM H, NANDI SK, KUNDU B, et al. Strategies for delivering bone morphogenetic protein for bone healing. Mater Sci Eng C Mater Biol Appl. 2017;70(Pt 1):856-869. [39] ROSEN V. BMP2 signaling in bone development and repair. Cytokine Growth Factor Rev. 2009;20(5-6):475-480. [40] ZOU ML, CHEN ZH, TENG YY, et al. The Smad Dependent TGF-β and BMP Signaling Pathway in Bone Remodeling and Therapies. Front Mol Biosci. 2021;8:593310. [41] CHEN G, DENG C, LI YP. TGF-β and BMP signaling in osteoblast differentiation and bone formation. Int J Biol Sci. 2012;8(2):272-288. [42] WU M, WU S, CHEN W, et al. The roles and regulatory mechanisms of TGF-β and BMP signaling in bone and cartilage development, homeostasis and disease. Cell Res. 2024;34(2):101-123. [43] MITSUI N, SUZUKI N, MAENO M, et al. Optimal compressive force induces bone formation via increasing bone morphogenetic proteins production and decreasing their antagonists production by Saos-2 cells. Life Sci. 2006;78(23):2697-706. [44] DA SILVA MADALENO C, JATZLAU J, KNAUS P. BMP signalling in a mechanical context - Implications for bone biology. Bone. 2020;137: 115416. [45] RATH B, NAM J, DESCHNER J, et al. Biomechanical forces exert anabolic effects on osteoblasts by activation of SMAD 1/5/8 through type 1 BMP receptor. Biorheology. 2011;48(1):37-48. [46] SCHREIVOGEL S, KUCHIBHOTLA V, KNAUS P, et al. Load-induced osteogenic differentiation of mesenchymal stromal cells is caused by mechano-regulated autocrine signaling. J Tissue Eng Regen Med. 2019;13(11):1992-2008. [47] WANG D, WANG H, GAO F, et al. ClC-3 Promotes Osteogenic Differentiation in MC3T3-E1 Cell After Dynamic Compression. J Cell Biochem. 2017;118(6):1606-1613. [48] PÉREZ-LOZANO ML, SUDRE L, VAN EEGHER S, et al. Gremlin-1 and BMP-4 Overexpressed in Osteoarthritis Drive an Osteochondral-Remodeling Program in Osteoblasts and Hypertrophic Chondrocytes. Int J Mol Sci. 2022;23(4):2084. [49] WEI Q, HOLLE A, LI J, et al. BMP-2 Signaling and Mechanotransduction Synergize to Drive Osteogenic Differentiation via YAP/TAZ. Adv Sci (Weinh). 2020;7(15):1902931. [50] MURUGAIYAN K, AMIRTHALINGAM S, HWANG NS, et al. Role of FGF-18 in Bone Regeneration. J Funct Biomater. 2023;14(1):36. [51] LI HZ, ZHANG JL, YUAN DL, et al. Role of signaling pathways in age-related orthopedic diseases: focus on the fibroblast growth factor family. Mil Med Res. 2024;11(1):40. [52] ZHANG J, LIU Z, LI Y, et al. FGF2: a key regulator augmenting tendon-to-bone healing and cartilage repair. Regen Med. 2020;15(9):2129-42. [53] ESWARAKUMAR V P, LAX I, SCHLESSINGER J. Cellular signaling by fibroblast growth factor receptors. Cytokine Growth Factor Rev. 2005; 16(2):139-149. [54] MURALI SK, ROSCHGER P, ZEITZ U, et al. FGF23 Regulates Bone Mineralization in a 1,25(OH)2 D3 and Klotho-Independent Manner. J Bone Miner Res. 2016;31(1):129-142. [55] OGURA H, NAKAMURA T, ISHII T, et al. Mechanical stress-induced FGF-2 promotes proliferation and consequently induces osteoblast differentiation in mesenchymal stem cells. Biochem Biophys Res Commun. 2023;684:149145. [56] NAKAJIMA R, YAMAGUCHI M, KOJIMA T, et al. Effects of compression force on fibroblast growth factor-2 and receptor activator of nuclear factor kappa B ligand production by periodontal ligament cells in vitro. J Periodontal Res. 2008;43(2):168-173. [57] UDA Y, AZAB E, SUN N, et al. Osteocyte Mechanobiology. Curr Osteoporos Rep. 2017;15(4):318-25. [58] 李亚洁,赵海英,荆蕾蕾,等.miR-29b、PTEN表达与胫骨干骨折延迟愈合的相关性分析[J].中国骨与关节损伤杂志,2021,36(6):626-628. [59] ZHANG M, YU W, NIIBE K, et al. The Effects of Platelet-Derived Growth Factor-BB on Bone Marrow Stromal Cell-Mediated Vascularized Bone Regeneration. Stem Cells Int. 2018;2018:3272098. [60] 赵维维,杨大春,孙雄山.肌微管素相关蛋白7在小鼠血管平滑肌细胞增殖和迁移中的作用及机制[J].解放军医学杂志,2022,47(6): 545-554. [61] WANG W, ZHUANG H, LEVITZ CL, et al. The increased level of PDGF-A contributes to the increased proliferation induced by mechanical stimulation in osteoblastic cells. Biochem Mol Biol Int. 1997;43(2):339-346. [62] GILLMAN CE, JAYASURIYA AC. FDA-approved bone grafts and bone graft substitute devices in bone regeneration. Mater Sci Eng C Mater Biol Appl. 2021;130:112466. [63] CAPLAN AI, CORREA D. PDGF in bone formation and regeneration: new insights into a novel mechanism involving MSCs. J Orthop Res. 2011;29(12):1795-1803. [64] SHAH P, KEPPLER L, RUTKOWSKI J. A review of platelet derived growth factor playing pivotal role in bone regeneration. J Oral Implantol. 2014;40(3):330-340. [65] SHA L, ZHAO Y, LI S, et al. Insights to Ang/Tie signaling pathway: another rosy dawn for treating retinal and choroidal vascular diseases. J Transl Med. 2024;22(1):898. [66] 朱振华,左志城,周聚普,等.VEGF/Akt信号通路在骨折大鼠愈合中作用机制及对炎症因子IL-6、TNF-α的影响[J].中国老年学杂志, 2024,44(3):696-700. [67] MENGER MM, LASCHKE MW, NUSSLER AK, et al. The vascularization paradox of non-union formation. Angiogenesis. 2022;25(3):279-290. [68] MIYAGAWA A, CHIBA M, HAYASHI H, et al. Compressive force induces VEGF production in periodontal tissues. J Dent Res. 2009;88(8):752-756. [69] ZHAN JW, WANG SQ, FENG MS, et al. Effects of Axial Compression and Distraction on Vascular Bud and VEGFA Expression in the Vertebral Endplate of an Ex Vivo Rabbit Spinal Motion Segment Culture Model. Spine (Phila Pa 1976). 2021;46(7):421-432. [70] GUERRA A, BELINHA J, SALGADO C, et al. Computational Insights into the Interplay of Mechanical Forces in Angiogenesis. Biomedicines. 2024;12(5):1045. [71] 芮泽,张喜善,张辉,等.持续性压力对VEGF分泌的影响[Z].第21届中国康协肢残康复学术年会暨第二届“泰山杯”全国骨科青年科技创新论坛论文集.山东泰安. 2012:218. [72] 石笑.周期性动态压力及富血小板纤维蛋白对牙周膜干细胞血管内皮向分化的影响及机制研究[D].西安:中国人民解放军空军军医大学,2020. [73] 钟刚,裴福兴,黄富国,等.不同压力刺激耦合VEGF基因转染促进骨折愈合的试验研究[Z].中国康复医学会修复重建外科专业委员会第19次学术交流会暨中国医师协会烧伤科医师分会2012年年会论文集. 北京. 2012:69-70. [74] TSENG HW, SAMUEL SG, SCHRODER K, et al. Inflammasomes and the IL-1 Family in Bone Homeostasis and Disease. Curr Osteoporos Rep. 2022;20(3):170-185. [75] SIMS NA. Influences of the IL-6 cytokine family on bone structure and function. Cytokine. 2021;146:155655. [76] ZHANG Y, LI X, CHIHARA T, et al. Effect of TNF-α and IL-6 on Compact Bone-Derived Cells. Tissue Eng Regen Med. 2021;18(3):441-451. [77] MCGREGOR NE, MURAT M, ELANGO J, et al. IL-6 exhibits both cis- and trans-signaling in osteocytes and osteoblasts, but only trans-signaling promotes bone formation and osteoclastogenesis. J Biol Chem. 2019; 294(19):7850-7863. [78] GADOMSKI S, FIELDING C, GARCíA-GARCíA A, et al. A cholinergic neuroskeletal interface promotes bone formation during postnatal growth and exercise. Cell Stem Cell. 2022;29(4):528-544.e9. [79] YANG A, LU Y, XING J, et al. IL-8 Enhances Therapeutic Effects of BMSCs on Bone Regeneration via CXCR2-Mediated PI3k/Akt Signaling Pathway. Cell Physiol Biochem. 2018;48(1):361-370. [80] LIN D, CHAI Y, MA Y, et al. Rapid initiation of guided bone regeneration driven by spatiotemporal delivery of IL-8 and BMP-2 from hierarchical MBG-based scaffold. Biomaterials. 2019;196:122-137. [81] MAHON OR, BROWE DC, GONZALEZ-FERNANDEZ T, et al. Nano-particle mediated M2 macrophage polarization enhances bone formation and MSC osteogenesis in an IL-10 dependent manner. Biomaterials. 2020;239:119833. [82] CHEN X, WAN Z, YANG L, et al. Exosomes derived from reparative M2-like macrophages prevent bone loss in murine periodontitis models via IL-10 mRNA. J Nanobiotechnology. 2022;20(1):110. [83] JUNG YK, KIM GW, PARK HR, et al. Role of interleukin-10 in endochondral bone formation in mice: anabolic effect via the bone morphogenetic protein/Smad pathway. Arthritis Rheum. 2013;65(12): 3153-3164. [84] YIN J, HAO Z, MA Y, et al. Concomitant activation of the PI3K/Akt and ERK1/2 signalling is involved in cyclic compressive force-induced IL-6 secretion in MLO-Y4 cells. Cell Biol Int. 2014;38(5):591-598. [85] PROFF A, NAZET U, SCHRÖDER A, et al. Mechanical Stress Induces Sodium Entry and Osmoprotective Responses in Murine Synovial Fibroblasts. Cells. 2024;13(6):496. [86] GARCíA-LóPEZ S, MEIKLE M C, VILLANUEVA RE, et al. Mechanical deformation inhibits IL-10 and stimulates IL-12 production by mouse calvarial osteoblasts in vitro. Arch Oral Biol. 2005;50(4):449-452. [87] ZHANG F, WANG CL, KOYAMA Y, et al. Compressive force stimulates the gene expression of IL-17s and their receptors in MC3T3-E1 cells. Connect Tissue Res. 2010;51(5):359-369. [88] FAHY N, MENZEL U, ALINI M, et al. Shear and Dynamic Compression Modulates the Inflammatory Phenotype of Human Monocytes in vitro. Front Immunol. 2019:10:383. [89] CHATMAHAMONGKOL C, PRAVITHARANGUL A, SUTTAPREYASRI S, et al. The effect of compressive force combined with mechanical vibration on human alveolar bone osteoblasts. J Oral Biol Craniofac Res. 2019;9(1):81-85. [90] 王鑫,吾布力卡斯木•米吉提,黄金勇,等.肿瘤坏死因子α对骨组织细胞的调节[J].中国组织工程研究,2024,28(21):3400-3406. [91] WU Y, JING Z, DENG D, et al. Dkk-1-TNF-α crosstalk regulates MC3T3E1 pre-osteoblast proliferation and differentiation under mechanical stress through the ERK signaling pathway. Mol Cell Biochem. 2023; 478(10):2191-2206. [92] KITAURA H, KIMURA K, ISHIDA M, et al. Effect of cytokines on osteoclast formation and bone resorption during mechanical force loading of the periodontal membrane. ScientificWorldJournal. 2014;2014:617032. [93] ZHANG C, LIN S, LI T, et al. Mechanical force-mediated pathological cartilage thinning is regulated by necroptosis and apoptosis. Osteoarthritis Cartilage. 2017;25(8):1324-1334. [94] 杨青,吴磊,刘洋,等.开放性骨折感染患者病原菌分布及血清促炎细胞因子水平的变化[J].中华医院感染学杂志,2019,29(16): 2482-2485+2499. |
| [1] | Jiang Xinghai, Song Yulin, Li Dejin, Shao Jianmin, Xu Junzhi, Liu Huakai, Wu Yingguo, Shen Yuehui, Feng Sicheng. Vascular endothelial growth factor 165 genes transfected into bone marrow mesenchymal stem cells to construct a vascularized amphiphilic peptide gel module [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1903-1911. |
| [2] | Yang Lixia, Diao Liqin, Li Hua, Feng Yachan, Liu Xin, Yu Yuexin, Dou Xixi, Gu Huifeng, Xu Lanju. Regulatory mechanism of recombinant type III humanized collagen protein improving photoaging skin in rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(8): 1988-2000. |
| [3] | Peng Tuanhui, Song Hongming, Yang Ling, Ding Xiaoge, Meng Pengjun. Effects of long-term endurance exercise on kl/FGF23 axis and calcium-phosphorus metabolism in naturally aging mice [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1089-1095. |
| [4] | Sun Yajie, Zhao Xinchen, Bo Shuangling. Spatiotemporal expression of bone morphologic protein 7 in mouse kidney development [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(5): 1156-1161. |
| [5] | Chen Xiaoqing, Bian Luyao, Lu Xingyu, Yang Tao, Li Xiang Hai. Thread embedding pretreatment at Xinshu (BL 15) improves cardiac function of acute myocardial ischemia rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(4): 882-891. |
| [6] | Wang Zhengye, Liu Wanlin, Zhao Zhenqun. Mechanism by which vascular endothelial growth factor A targets regulation of angiogenesis in the treatment of steroid-induced osteonecrosis of the femoral head [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(3): 671-679. |
| [7] | Bai Xiangyu, Huo Feng, Hao Yan, Wang Zecheng, Guo Xiaoyu. Platelet-derived growth factor BB-loaded chitosan/reduced graphene oxide scaffold for repairing alveolar bone defects [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 329-337. |
| [8] | Zhou Shibo, Yu Xing, Chen Hailong, Xiong Yang. Nanocrystalline collagen-based bone combined with Bushen Zhuangjin Decoction repairs bone defects in osteoporotic rats [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 354-361. |
| [9] | Li Congcong, Wufanbieke·Baheti, Zhao Li, Chen Xiaotao, Kong Chuifan, Yu Min. Physicochemical properties and biocompatibility of hydroxyapatite/graphene oxide/interleukin-4 composite coating materials [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(2): 404-413. |
| [10] | Sun Huiwen, Guo Qiangqiang, Wang Wei, Wu Jie, Xi Kun, Gu Yong. Engineered stem cell bionic periosteum coordinates immune inflammation and vascularization to promote bone regeneration [J]. Chinese Journal of Tissue Engineering Research, 2026, 30(1): 21-33. |
| [11] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [12] | Yu Shuai, Liu Jiawei, Zhu Bin, Pan Tan, Li Xinglong, Sun Guangfeng, Yu Haiyang, Ding Ya, Wang Hongliang. Hot issues and application prospects of small molecule drugs in treatment of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1913-1922. |
| [13] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [14] | Chen Shuai, Jin Jie, Han Huawei, Tian Ningsheng, Li Zhiwei . Causal relationship between circulating inflammatory cytokines and bone mineral density based on two-sample Mendelian randomization [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1556-1564. |
| [15] | De Ji, Suo Langda, Wei Yuchen, Wang Bin, Awangcuoji, Renqingcuomu, Cui Jiuzeng, Zhang Lei, Ba Gui. Comprehensive analysis of genes related to endometrial receptivity and alternative splicing events in northwest Tibetan cashmere goats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1429-1436. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||