Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (32): 6997-7003.doi: 10.12307/2025.948
Previous Articles Next Articles
Visual analysis of dynamic evolution of research topics in the field of physical activity and hippocampal tissue
Deng Qing1, 2, Wang Qingjun3, Zhang Yeting4
- 1School of Physical Education, 3School of Journalism and Communication, Nanjing Normal University, Nanjing 210012, Jiangsu Province, China; 2School of Physical Education, Nanjing Xiaozhuang University, Nanjing 210017, Jiangsu Province, China; 4School of Aviation Safety and Security, Civil Aviation Flight University of China, Guanghan 618307, Sichuan Province, China
-
Received:2024-10-14Accepted:2024-12-12Online:2025-11-18Published:2025-04-29 -
Contact:Zhang Yeting, MD, Lecturer, School of Aviation Safety and Security, Civil Aviation Flight University of China, Guanghan 618307, Sichuan Province, China -
About author:Deng Qing, MD, Lecturer, School of Physical Education, Nanjing Normal University, Nanjing 210012, Jiangsu Province, China; School of Physical Education, Nanjing Xiaozhuang University, Nanjing 210017, Jiangsu Province, China -
Supported by:Sichuan Provincial Science and Technology Department Project, No. 2020YFH0184 (to ZYT); Central University Basic Research Business Expenses Special Fund, No. PHD2023-003 (to ZYT)
CLC Number:
Cite this article
Deng Qing, Wang Qingjun, Zhang Yeting. Visual analysis of dynamic evolution of research topics in the field of physical activity and hippocampal tissue[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(32): 6997-7003.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
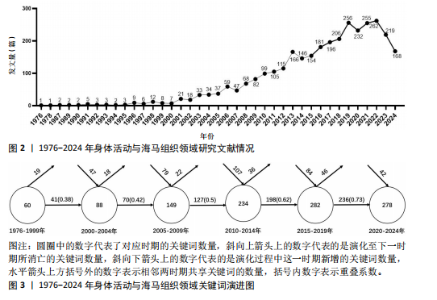
2.1 年发文量分析 基于Web of Science核心数据库收录论文统计分析发现,1993-2024年身体活动与海马组织领域共发表的核心研究论文3 225篇,2022年的发表量最多,为262篇。身体活动与海马组织领域的文献数量呈明显增长趋势(图2)。2000年之前,该领域研究文献数量十分稀少;2001-2012年,该领域相关文献数量逐渐增加;2013年后发文量迅速增多,反映出该领域的研究热度逐步加强;2023年开始该领域发文量虽然有所下降,但是2018年以来发文量均大于200篇,反映出该领域研究热度仍旧强劲。 2.2 关键词分析 分析关键词可以反映出论文研究的重点及核心主题[14]。身体活动与海马组织研究领域的关键词数量众多,直接进行分析可能会导致信息杂乱,为了避免这种情况的发生,通过对SciMAT软件的数据和网络精简阈值进行设置,能够去除次要信息,突出主要信息,从而利于获取清晰的图谱[15]。 2.2.1 关键词主题覆盖图 关键词主题覆盖图通过关键词数来表征主题数量,通过数据流来展示研究主题的新旧更替及稳定性情况[16]。图3为SciMAT生成的关键词覆盖图,圆圈中的数字代表了对应时期的关键词数量,斜向上箭头上的数字代表的是演化至下一时期所消亡的关键词数量,斜向下箭头上的数字代表的是演化过程中这一时期新增的关键词数量,水平箭头上方括号外的数字表示相邻两时期共享关键词的数量,括号内数字表示重叠系数(即连续两个时期的共享关键词数量占所有关键词数量的比重)。重叠系数的大小代表了相关研究之间继承性的强弱[13]。如图3所示,左起分别代表6个时期身体活动与海马组织领域关键词变化趋势。6个时期的关键词数量分别为60,88,149,234,282和278,总体呈增长态势,这表明该领域研究范围的不断拓宽与研究主题的日渐丰富。6个研究阶段共享的关词数量依次为41,70,127,198和236,重叠系数依次为0.38,0.42,0.5,0.62和0.73,同样呈现增长趋势,由此可知1976-2024年身体活动与海马组织领域研究的继承性逐渐加强,研究方向较为稳定。从新生词和消亡词的变化情况来看,1976-1999年向2000-2004年的演化过程中,有消亡19个关键词、"
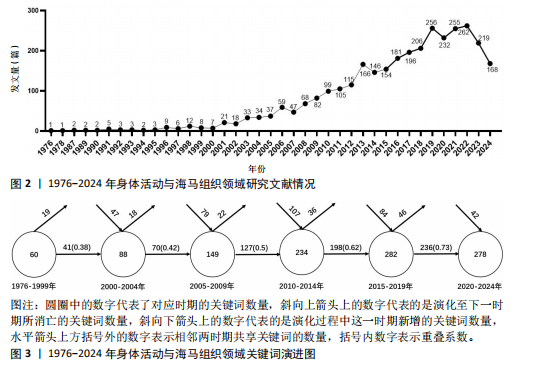

新生47个关键词;2000-2004年向2005-2009年的演化过程中,消亡关键词为18个,新生关键词有79个;2005-2009年向2010-2014年的发展过程中,有22个消亡关键词,而新生关键词高达107个;2010-2014年向2015-2019年的发展过程中,消亡36个关键词、新生84个关键词;2015-2019年向2020-2024年的发展过程中,消亡46个关键词,而新生关键词只有42个 (2024年数据不全)。基本上每个时期新生关键词的数量均大于消亡关键词的数量,这预示新旧研究之间的交替不断发生,说明身体活动与海马组织领域相关研究活跃度高,但值得注意的是最近几年新生关键词数量大幅降低,这也可能预示着此领域的研究逐渐成熟但缺乏新的创新与突破点。总体来说,身体活动与海马组织领域的研究呈现出蓬勃发展的态势,相关研究日趋深入,未来发展空间较大。 2.2.2 研究主题演化状态分析 图4呈现了1976-1999年、2000-2004年、2005-2009年、2010-2014年、2015-2019年和2020-2024年6个阶段身体活动与海马组织领域研究主题演化状态。在战略坐标图中,各时期4个象限的主题聚类分别有不同的性质 [17]: 主题聚类位于第1象限,中心度(Centrality)和密度(Density)值均为正数值,表明该主题内部联系紧密,发展程度高;主题聚类位于第2象限,中心度值为负数值,密度值为正数值,表明该主题成熟度高但外部联系较弱,一般其专业性较强;主题聚类位于第3象限,中心度和密度值均为负数值,表明该主题是处于边缘位置的薄弱研究,往往是新生或衰退的主题;主题聚类位于第4象限,中心度值为正数值,密度值为负数值,表明该主题虽然处在核心地位,发展潜力大,但成熟度不高,仍然对研究领域有很大的影响力。将得到的29个相关研究主题聚类按不同战略区域进行划分,具体见表1。 (1)传统主题演化状态:在身体活动与海马组织研究领域发展的第一个时间段,也就是1976-1999年期间,共有MESSENGER-RNA (mRNA)、ENVIRONMENT(环境)和"


BEHAVIOR(行为)3个主题聚类,通过分析这3个主题聚类的走向,可以理清传统主题演化的状态。 MESSENGER-RNA(mRNA)在1976-1999年为最大主题聚类,发文量最多,该主题位于第一象限,中心度高,密度相对较低,发展潜力大,是该时期的引擎主题。在2000-2004年该主题向第二象限移动,在这一时期,该主题开始具有较高的成熟度。但是在2005-2009年,该主题位于第四象限,表明在这一时期该主题虽然成熟度降低,但是仍然处于核心地位。在随后的演化中,该主题最终演化为NEUROTROPHIC-FACTOR(神经营养因子)主题聚类。ENVIRONMENT(环境)在1976-1999年位于第一象限,密度较高,但中心度较低。BEHAVIOR(行为) 在1976-1999年位于第三象限,其属于边缘主题。然而,这两个主题在2000-2004年这一阶段共同演化为GROWTH-FACTOR(生长因子)这一主题。 (2)现代主题演化现状:在身体活动与海马组织研究领域发展的最近一个时间段,也就是2020-2024年期间,共有NEUROTROPHIC-FACTOR(神经营养因子)、AEROBIC-EXERCISE(有氧运动)、MOUSE-MODEL(模型鼠)、IMPAIRMENT(障碍)和COGNITIVE-IMPAIRMENT(认知障碍)5个主题聚类,通过分析这5个主题聚类的走向,可以理清现代主题演化的现状。 位于第一象限的主题词包括NEUROTROPHIC-FACTOR(神经营养因子)和AEROBIC-EXERCISE(有氧运动)。这些主题其内部连接程度和外部连接程度都较高,有着较强的稳定性和向外扩散的能力,表明这些研究方向相对成熟,是此领域在2020-2024年的核心研究主题方向,也是此领域未来研究的重要方向。在神经营养因子主题中,最主要的研究对象为脑源性神经营养因子,另外还包括睫状神经营养因子和胶质细胞源性神经营养因子等,研究内容涉及身体活动对海马组织相关神经营养因子的基因及蛋白表达的影响[18-20]。在有氧运动主题中,主要研究的是有氧运动对海马的体积、可塑性、结构和功能的影响,以及探究有氧运动对海马依赖性的联想记忆和模式分离的影响[21-22];另外对于有氧运动形式主要涉及急性有氧运动、有氧运动能力、长期有氧运动、规律有氧运动和定期有氧运动等[22-24]。 位于第二象限的主题词为MOUSE-MODEL(模型鼠),该主题外联度较高但是内联度较低,说明该主题内部连接比较松散,但是与其他研究方向的关联较为紧密。此象限的主题容易游离、转变成其他相关方向的聚类,因此是该领域在2020-2024年的次级研究主题方向。在模型鼠主题中,涉及的疾病模型鼠主要包括慢性不可预测应激诱导的抑郁鼠模型、1-甲基-4-苯基-1236-四氢吡啶诱导的帕金森症小鼠模型、Tau蛋白病小鼠模型、Tg2576阿尔茨海默病小鼠模型、APPswe/PS1dE9转基因阿尔茨海默病模型和APP/PS1转基因阿尔茨海默病鼠模型等模型鼠,由此可见,阿尔茨海默病、帕金森症和抑郁症等是该领域重点关注的病理鼠模型[25-26];另外,还涉及到不同运动干预方式下模型鼠的建立,不同运动模式(有氧和阻力)和强度(低和高)对小鼠认知能力、成年海马神经发生和突触可塑性的影响会有所区别,因此选择正确的运动干预方式也十分重要[27]。 位于第三象限的主题词为COGNITIVE-IMPAIRMENT(认知障碍),该主题的内联度和外联度均较低,该主题作为新演化出的主题,目前属于该领域在2020-2024年的边缘研究主题方向。在认知障碍主题中,主要涉及的病症包括轻度认知障碍、神经认知障碍、化疗引起的认知障碍、诱发性认知障碍、血管性认知障碍、健忘轻度认知障碍、癌症相关认知障碍、与衰老相关的认知障碍、血管性认知障碍和痴呆等,该主题研究的是身体活动对这些认知障碍的预防和治疗作用[28-30]。可见认知障碍主题研究的病症种类较多较为分散,这可能是该主题中心度和密度较低的原因。 位于第四象限的主题词为IMPAIRMENT(障碍)。该主题外联度较低但是内联度较高,说明其独立性较强,但是外部连接相对较弱,因此是该领域在2020-2024年的独立研究主题方向。虽然如此,但由于其内部稳定性非常强,其战略地位也十分重要,很可能在未来演变成该领域的核心研究主题。在障碍主题中,涉及的主要障碍类型包括工作记忆障碍、空间学习障碍、与年龄相关的记忆障碍以及执行功能障碍等认知功能障碍,身体活动对具体的认知障碍类型的研究是这一主题最重要的研究内容[31-32]。另外还包括身体活动对运动功能障碍、甲状腺功能减退、自噬缺陷、行为障碍、应激损伤以及脑损伤等疾病的影响研究[33-35]。由此可见,关于海马组织相关障碍的研究具有广泛化和精细化的趋势。 2.2.3 主题演化路径 图5为1976-2024年主题演化路径图,图中节点表示聚类主题,节点大小与主题相关文献量呈正比;相邻时期节点间的实线表示主题继承,虚线表示主题分化,线的颜色深浅、粗细与主题相似度呈正比,连线颜色深且粗,两个主题的关联强度高,演化能力强;孤立点表示发展成熟的、专业性较强的主题。随着时间的推移,身体活动与海马组织研究领域在个时期内节点的数量呈现增长趋势,每个时期节点数量分别为3,4,8,4,5和5,每个时期内节点的路径大体呈现出逐渐增多、广泛交叉的趋势,演化关系较为复杂。 根据各研究阶段演化情况,身体活动与海马组织研究领域可分为mRNA、行为、环境和认知功能4个主要演化方向,并形成了7条子演化路径。 (1)mRNA演化路径:主要包括以下2条子路径:①mRNA→mRNA→神经营养因子;②mRNA→神经营养因子→神经营养因子。这2条子路径分别在2010-2014年和2000-2004年由mRNA演化为神经营养因子。mRNA由DNA的一条链作为模板转录而来,其携带着的遗传信息能够指导蛋白质的合成。在该领域中,主要涉及的mRNA包括脑源性神经营养因子 mRNA、酪氨酸激酶B mRNA、过氧化物酶体增殖物激活受体γ辅激活因子1α mRNA、神经营养因子3 mRNA、前脑啡肽原mRNA以及Arc蛋白mRNA等。许多研究已发现,身体活动能够显著增加实验鼠海马组织脑源性神经营养因子mRNA表达,而内源性脑源性神经营养因子 mRNA表达提高会诱导信号转导级联从而引起下游信号转导发生(如环腺苷酸反应元件结合蛋白mRNA表达的增加),这会对神经元功能会产生积极影响[36-38]。虽然mRNA这一主题聚类最终演化为神经营养因子,但是mRNA一直是神经营养因子这一主题聚类的重要组成成分。在现代主题演化现状分析中已知神经营养因子主题聚类具有最高的密度和中心度,具有很高的发展程度。营养因子是一类对细胞生长、分化和功能发挥具有重要调控作用的生物分"


子,能够与特定的受体结合,从而激活或抑制细胞内的信号转导途径其在海马组织的发育、维持和功能发挥中扮演着至关重要的角色,对于人类的认知和行为具有重要的影响[39]。在神经营养因子主题中,脑源性神经营养因子无疑是最受关注的对象,大量研究报道了不同运动方式对不同人群、不同实验鼠模型海马组织脑源性神经营养因子的有益影响,并报道了脑源性神经营养因子与记忆功能和海马神经可塑性之间的关系[40-41]。同时,也有研究发现人体血清中的脑源性神经营养因子不会长期升高,甚至可能在高水平身体活动人群中被长期抑制[42]。身体活动对神经营养因子的影响是十分复杂的过程,未来关于这一领域的研究将会是重要的方向之一,因此,十分值得学者们关注。 (2)行为演化路径及环境演化路径:这2条演化路径在2000-2004年便已融合成形同的演化路径。主要包括以下4条子路径:①行为/环境→生长因子→增长→老年人→有氧运动;②行为/环境→生长因子→神经元→模型鼠;③行为/环境→生长因子→神经元→障碍;④行为/环境→生长因子→神经元→认知障碍。第一条路径主要探究的有氧运动对老年人海马组织生长因子及其受体的影响,探究老年人接受有氧运动干预后焦虑等行为反应;第二条路径主要关注的是不同身体活动干预方式对模型鼠海马组织神经元、生长因子表达等的影响;第三条路径主要关注的是不同身体活动干预方式对学习记忆障碍者海马组织神经元、生长因子表达等的影响;第四条路径主要关注的是不同身体活动干预方式对轻度认知障碍等患者海马组织神经元、生长因子表达等的影响。上述研究路径提示,在探究身体活动对海马组织影响的过程中,研究的对象主要涉及老年人、轻度认知障碍患者、学习记忆障碍者及相应的病理模型鼠,而老年人(2015-2019年位于第一象限)及相应的病理模型鼠(2020-2024年位于第二象限)则是重点研究对象。海马组织中的神经元,尤其是中间神经元,对于记忆和学习功能至关重要,这些神经元通过复杂的抑制性回路调节大脑活动,从而影响认知过程[43]。生长因子对海马神经元的生长、分化、突触形成和功能维持等方面具有重要的影响,这些生长因子通过与相应的受体结合,激活下游信号通路,从而调控海马神经元的生物学行为[44]。许多研究已发现,适当的身体活动能够增加海马组织相关区域内的生长因子的表达,从而诱导海马神经发生,进而对几种神经系统疾病的记忆和认知恢复具有重要作用[45-46]。认知障碍作为新发展出来的主题,虽然位于第四象限,却是由上一阶段位于第一象限的神经元主题演化而来,未来也很有可能会发展成为较为成熟的主题,从而成为该领域未来研究的重要方向之一,因此,也十分值得学者们关注。 (3)认知功能演化路径:主要包括以下一条路径,即认知功能→老年人→有氧运动。该演化路径主要探究的是有氧运动对老年人认知功能的影响。在过去的几十年里,越来越多的来自动物和人类模型的研究表明,身体活动对衰老的大脑有益,对海马体积、激活和与记忆相关的认知过程有良好的改善作用[47]。通过使用结构磁共振成像技术研究运动对海马体长期体积变化的影响,发现单次运动可导致健康老年人海马体的微结构改变,而这些差异可能与海马细胞外空间和胶质、突触和树突的变化有关[48]。 探究有氧运动结合不同认知干预手段对老年人认知的影响已成为新的关注点,如有学者发现为期4周的记忆训练和有氧运动干预足以提高老年人的记忆、注意力和推理能力[49];有氧运动结合视频游戏干预方式可以通过不同的结构和功能途径诱导老年人海马的可塑性[50]。值得注意的是,有氧运动的强度水平差异很大。中等强度活动(如快走)通常需要3.0-6.0代谢当量,而高强度活动(如跑步)则需要6.0或更高的代谢当量[21]。目前在该领域,使用有氧运动干预的试验通常采用的是中等到大强度的活动,然而,即使是轻度到中等强度的活动,也可能会引起有益的身体反应。因此,与其他有氧运动参数(如运动的时间、频率或类型)相比,有氧运动的强度是否对海马组织有重要影响,是未来研究的重要方向之一。"

| [1] MICHELLE WV, CARMEN S, SEUNGWOO Y, et al. Exercise and Hippocampal Memory Systems. Trends Cogn Sci. 2019;23(4):318-333. [2] KIRK IE, DESTINY LM, KATHRYN AR. The aging hippocampus: interactions between exercise, depression, and BDNF. Neuroscientist. 2012; 18(1):82-97. [3] FATEMEH P, RAHIM M, MASOUD R. Exercise and Syzygium aromaticum reverse memory deficits, apoptosis and mitochondrial dysfunction of the hippocampus in Alzheimer’s disease. J Ethnopharmacol. 2021;286(25):114871. [4] C’IANA C, HYO YOUL M, HENRIETTE VP. On the Run for Hippocampal Plasticity. Cold Spring Harb Perspect Med. 2017;8(4):a029736. [5] EMRAH D, HENRIETTE VP, MICHAEL S. Can physical exercise in old age improve memory and hippocampal function? Brain. 2016;139(3):662-673. [6] ROBERT RK, BRADLEY RK. The effects of peripheral hormone responses to exercise on adult hippocampal neurogenesis. Front Endocrinol (Lausanne). 2023;14(24):1202349. [7] KAIYIN C, CHAOYANG L, GUOLIANG F. Aerobic Exercise Delays Alzheimer’s Disease by Regulating Mitochondrial Proteostasis in the Cerebral Cortex and Hippocampus. Life (Basel). 2023;13(5):1204. [8] DOMINGOS C, PÊGO JM, SANTOS NC. Effects of physical activity on brain function and structure in older adults: A systematic review. Behav Brain Res. 2020;402:113061. [9] DE SNOO ML, MILLER AMP, RAMSARAN AI, et al. Exercise accelerates place cell representational drift. Curr Biol. 2023;33(3):R96-R97. [10] YE L, JIAN Z, XIYAO G, et al. Mapping the current trends and hotspots of adult hippocampal neurogenesis from 2004-2023: a bibliometric analysis. Front Neurosci. 2024;18:1416738. [11] RAMPASSO IS, SANTANA M, SERAFIM MP, et al. Anholon R. Trends in remote work: A science mapping study. Work. 2022;71(2):441-450. [12] 陈晓鹏, 严晓燕, 孙洋, 等. 基于SciMAT的防护服装研究动态演进分析[J]. 服装学报,2023, 8(6):521-528. [13] 夏洋, 李文梅. 近20年国际学业情绪研究主题动态演化路径分析[J]. 当代外语研究,2023, 23(5):94-102+132. [14] 李丽霞, 任卓明, 张子柯. 基于关键词的知识图谱挖掘信息技术学科演化趋势[J]. 电子科技大学学报,2020,49(5):780-787. [15] 陶文兵, 金海. 一种新的基于图谱理论的图像阈值分割方法[J]. 计算机学报,2007,30(1):110-119. [16] 董雪季, 王晓慧. 国际科学计量学研究主题动态演化路径分析[J]. 数字图书馆论坛,2018(10): 9-17. [17] CARRASCO-GARRIDO C, DE-PABLOS-HEREDERO C, RODRíGUEZ-SÁNCHEZ J. Exploring hybrid telework: A bibliometric analysis. Heliyon. 2023;9(12): e22472. [18] EVA S, BENJAMIN R, OLIVER G, et al. Effects of exergaming on hippocampal volume and brain-derived neurotrophic factor levels in Parkinson’s disease. Eur J Neurol. 2021;29(2):441-449. [19] YUKI T, KAZUYA S, SONG-GYU R, et al. Short-term running exercise alters DNA methylation patterns in neuronal nitric oxide synthase and brain-derived neurotrophic factor genes in the mouse hippocampus and reduces anxiety-like behaviors. FASEB J. 2021;35(8):e21767. [20] AGUIAR AS JR, STRAGIER E, DA LUZ SCHEFFER D, et al. Effects of exercise on mitochondrial function, neuroplasticity and anxio-depressive behavior of mice. Neuroscience. 2014;271:56-63. [21] AGHJAYAN SL, LESNOVSKAYA A, ESTEBAN-CORNEJO I, et al. Aerobic exercise, cardiorespiratory fitness, and the human hippocampus. Hippocampus. 2021;31(8):817-844. [22] HENDRIKSE J, CHYE Y, THOMPSON S, et al. Regular aerobic exercise is positively associated with hippocampal structure and function in young and middle-aged adults. Hippocampus. 2022;32(3): 137-152. [23] CHOI SH, BYLYKBASHI E, CHATILA ZK, et al. Combined adult neurogenesis and BDNF mimic exercise effects on cognition in an Alzheimer’s mouse model. Science. 2018;361(6406): eaan8821. [24] HANNA C, HAMILTON J, ARNAVUT E, et al. Brain Mapping the Effects of Chronic Aerobic Exercise in the Rat Brain Using FDG PET. J Pers Med. 2022; 12(6):860. [25] HAN P, GU BY, MU LW, et al. Moderate-Intensity Treadmill Exercise Regulates GSK3α/β Activity in the Cortex and Hippocampus of APP/PS1 Transgenic Mice. J Integr Neurosci. 2024;23(7):136. [26] LI Y, LUO YM, ZHU PL, et al. Running exercise improves astrocyte loss, morphological complexity and astrocyte-contacted synapses in the hippocampus of CUS-induced depression model mice. Pharmacol Biochem Behav. 2024; 239:173750. [27] JIANG HL, KIMURA Y, INOUE S, et al. Effects of different exercise modes and intensities on cognitive performance, adult hippocampal neurogenesis, and synaptic plasticity in mice. Exp Brain Res. 2024;242(7):1709-1719. [28] KHAN MB, ALAM H, SIDDIQUI S, et al. Exercise Improves Cerebral Blood Flow and Functional Outcomes in an Experimental Mouse Model of Vascular Cognitive Impairment and Dementia (VCID). Transl Stroke Res. 2024;15(2):446-461. [29] TAO X, SUN RF, HAN CL, et al. Cognitive-motor dual task: An effective rehabilitation method in aging-related cognitive impairment. Front Aging Neurosci. 2022;14:1051056. [30] WANG R, ZHANG HY, LI HJ, et al. The influence of exercise interventions on cognitive functions in patients with amnestic mild cognitive impairment: A systematic review and meta-analysis. Front Public Health. 2022;10:1046841. [31] JIN Y, LI X, WEI CL, et al. Effects of exercise-targeted hippocampal PDE-4 methylation on synaptic plasticity and spatial learning/memory impairments in D-galactose-induced aging rats. Exp Brain Res. 2024;242(2):309-320. [32] SUN GC, LEE YJ, LEE YC, et al. Exercise prevents the impairment of learning and memory in prenatally phthalate-exposed male rats by improving the expression of plasticity-related proteins. Behav Brain Res. 2021;413:113444. [33] KIM TW, PARK SS, KIM SH, et al. Exercise before pregnancy exerts protective effect on prenatal stress-induced impairment of memory, neurogenesis, and mitochondrial function in offspring. J Exerc Rehabil. 2024;20(1):2-10. [34] CUSTODIO RJP, KIM HJ, KIM J, et al. Hippocampal dentate gyri proteomics reveals Wnt signaling involvement in the behavioral impairment in the THRSP-overexpressing ADHD mouse model. Commun Biol. 2023;6(1):55. [35] MO FF, ZHANG HW, TANG YX, et al. Pyruvate accumulation may contribute to acceleration-induced impairment of physical and cognitive abilities: an experimental study. Biosci Rep. 2021; 41(4):BSR20204284. [36] PARNPIANSIL P, JUTAPAKDEEGUL N, CHENTANEZ T, et al. Exercise during pregnancy increases hippocampal brain-derived neurotrophic factor mRNA expression and spatial learning in neonatal rat pup. Neurosci Lett. 2003;352(1):45-48. [37] TAKAMATSU Y, INOUE T, NISHIO T, et al. Potential effect of physical exercise on the downregulation of BDNF mRNA expression in rat hippocampus following intracerebral hemorrhage. Neurosci Lett. 2024;824:137670. [38] SOLVSTEN CAE, DAUGAARD TF, LUO Y, et al. The Effects of Voluntary Physical Exercise-Activated Neurotrophic Signaling in Rat Hippocampus on mRNA Levels of Downstream Signaling Molecules. J Mol Neurosci. 2017;62(2):142-153. [39] TRAN PV, CARLSON ES, FRETHAM SJB, et al. Early-Life Iron Deficiency Anemia Alters Neurotrophic Factor Expression and Hippocampal Neuron Differentiation in Male Rats. J Nutr. 2008;138(12): 2495-2501. [40] BOSCH BM, BRINGARD A, LOGRIECO MG, et al. A single session of moderate intensity exercise influences memory, endocannabinoids and brain derived neurotrophic factor levels in men. Sci Rep. 2021;11(1):14371. [41] LIANG ZQ, ZHANG Z, QI S, et al. Effects of a Single Bout of Endurance Exercise on Brain-Derived Neurotrophic Factor in Humans: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Biology (Basel). 2023;12(1):126. [42] SPARTANO NL, HIMALI JJ, TRINQUART L, et al. Accelerometer-Measured, Habitual Physical Activity and Circulating Brain-Derived Neurotrophic Factor: A Cross-Sectional Study. J Alzheimers Dis. 2022;85(2):805-814. [43] VASUDEVAN K, HASSELL JE JR, MAREN S. Hippocampal Engrams and Contextual Memory. Adv Neurobiol. 2024;38:45-66. [44] LEITER O, BRICI D, FLETCHER SJ, et al. Platelet-derived exerkine CXCL4/platelet factor 4 rejuvenates hippocampal neurogenesis and restores cognitive function in aged mice. Nat Commun. 2023;14(1):4375. [45] NIU XJ, ZHAO YH, YANG N, et al. Proteasome activation by insulin-like growth factor-1/nuclear factor erythroid 2-related factor 2 signaling promotes exercise-induced neurogenesis. Stem Cells. 2020;38(2):246-260. [46] HALL JM, GOMEZ-PINILLA F, SAVAGE LM. Nerve Growth Factor Is Responsible for Exercise-Induced Recovery of Septohippocampal Cholinergic Structure and Function. Front Neurosci. 2018;12:773. [47] VARMA VR, TANG X, CARLSON MC. Hippocampal Sub-Regional Shape and Physical Activity in Older Adults. Hippocampus. 2016;26(8):1051-1060. [48] CALLOW DD, WON J, ALFINI AJ, et al. Microstructural Plasticity in the Hippocampus of Healthy Older Adults after Acute Exercise. Med Sci Sports Exerc. 2021;53(9):1928-1936. [49] MCEWEN SC, SIDDARTH P, ABEDELSATER B, et al. Simultaneous Aerobic Exercise and Memory Training Program in Older Adults with Subjective Memory Impairments. J Alzheimers Dis. 2018; 62(2):795-806. [50] CUI XY, GUI WJ, MIAO JW, et al. A Combined Intervention of Aerobic Exercise and Video Game in Older Adults: The Efficacy and Neural Basis on Improving Mnemonic Discrimination. J Gerontol A Biol Sci Med Sci. 2023;78(8):1436-1444. |
| [1] | Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [2] | Liang Haobo, Wang Zeyu, Ma Wenlong, Liu Hao, Liu Youwen. Hot issues in the field of joint revision: infection, rehabilitation nursing, bone defect, and prosthesis loosening [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1963-1971. |
| [3] | Li Kaiying, Wei Xiaoge, Song Fei, Yang Nan, Zhao Zhenning, Wang Yan, Mu Jing, Ma Huisheng. Mechanism of Lijin manipulation regulating scar formation in skeletal muscle injury repair in rabbits [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1600-1608. |
| [4] | Wang Yida, Liu Jun, Wang Xiaoling, Wang Liyan, Yang Chengru, Zhang Xuexiao. Effects of wearable electronic device-based interventions on physical activity and sedentary behavior in healthy adolescents: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1693-1704. |
| [5] | Li Dijun, Jiu Jingwei, Liu Haifeng, Yan Lei, Li Songyan, Wang Bin. Three-dimensional gelatin microspheres loaded human umbilical cord mesenchymal stem cells for chronic tendinopathy repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1356-1362. |
| [6] | Aikepaer · Aierken, Chen Xiaotao, Wufanbieke · Baheti. Osteogenesis-induced exosomes derived from human periodontal ligament stem cells promote osteogenic differentiation of human periodontal ligament stem cells in an inflammatory microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1388-1394. |
| [7] | Xie Liugang, Cui Shuke, Guo Nannan, Li Aoyu, Zhang Jingrui. Research hotspots and frontiers of stem cells for Alzheimer’s disease [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1475-1485. |
| [8] | Chang Jinxia, Liu Yufei, Niu Shaohui, Wang Chang, Cao Jianchun. Visualization analysis of macrophage polarization in tissue repair process [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1486-1496. |
| [9] | Li Jialin, Zhang Yaodong, Lou Yanru, Yu Yang, Yang Rui. Molecular mechanisms underlying role of mesenchymal stem cell secretome [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1512-1522. |
| [10] | Cao Yue, Ye Xinjian, Li Biyao, Zhang Yining, Feng Jianying. Effect of extracellular vesicles for diagnosis and therapy of oral squamous cell carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1523-1530. |
| [11] | Sun Yuting, Wu Jiayuan, Zhang Jian. Physical factors and action mechanisms affecting osteogenic/odontogenic differentiation of dental pulp stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1531-1540. |
| [12] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [13] | Li Shuai, Liu Hua, Shang Yonghui, Liu Yicong, Zhao Qihang, Liu Wen. Stress distribution on the maxilla when wearing the Twin-block appliance for Class II malocclusion [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 881-887. |
| [14] | Ding Zhili, Huang Jie, Jiang Qiang, Li Tusheng, Liu Jiang, Ding Yu. Constructing rabbit intervertebral disc degeneration models by different methods under X-ray guidance: a comparative study [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 995-1002. |
| [15] | Li Huijun, Li Huangyan, Zhang Yeting. Physical activity and cognition in older adults: research hotspot and topic evolution [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1073-1080. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||