Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (3): 563-571.doi: 10.12307/2024.697
Previous Articles Next Articles
Regulation of osteogenic effects by bone morphogenetic protein/Wnt signaling pathway: revealing molecular mechanisms of bone formation and remodeling
Liu Haowen, Qiao Weiping, Meng Zhicheng, Li Kaijie, Han Xuan, Shi Pengbo
- Zone One, Department of Orthopedics and Traumatology, First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China
-
Received:2023-10-12Accepted:2023-12-27Online:2025-01-28Published:2024-06-04 -
Contact:Qiao Weiping, MD, Associate chief physician, Zone One, Department of Orthopedics and Traumatology, First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China -
About author:Liu Haowen, Master, Zone One, Department of Orthopedics and Traumatology, First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, Henan Province, China
CLC Number:
Cite this article
Liu Haowen, Qiao Weiping, Meng Zhicheng, Li Kaijie, Han Xuan, Shi Pengbo. Regulation of osteogenic effects by bone morphogenetic protein/Wnt signaling pathway: revealing molecular mechanisms of bone formation and remodeling[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 563-571.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

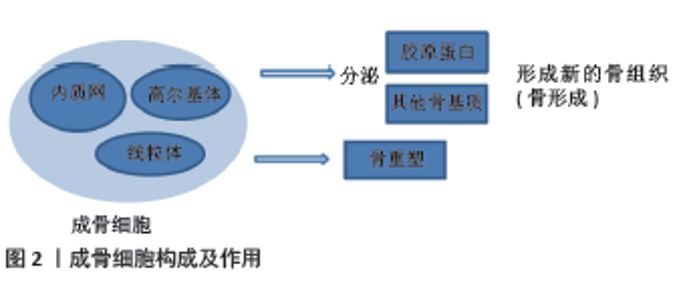
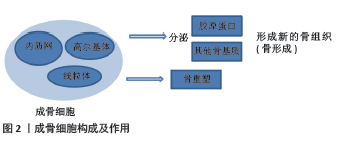
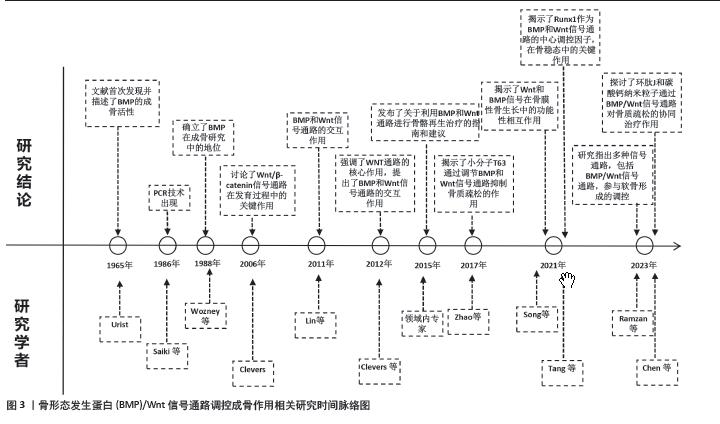
DONG等[7]研究了成骨细胞/骨细胞分泌的白细胞介素11对骨生成和全身脂肪生成的影响,发现白细胞介素11能够通过调节成骨细胞和脂肪细胞的分化,从而影响骨生成和脂肪生成。此外,KIM等[8]研究了成骨细胞谱系对造血功能的支持在健康和疾病状态下的作用,发现成骨细胞能够通过分泌细胞因子和生长因子等支持造血干细胞的增殖和分化,从而为造血系统提供保护。在成骨细胞的分化过程中,自噬和信号通路起到了重要的作用。YOSHIDA等[9]研究了自噬在成骨细胞中的作用,发现成骨细胞中自噬水平升高能够降解NOTCH细胞内结构域,从而促进成骨细胞分化,缓解骨质疏松。此外,CAO等[10]研究了Nox4在成骨细胞分化中的作用及机制,发现Nox4能够通过转化生长因子β信号通路促进成骨细胞分化。LIU等[11]研究了Runt相关转录因子2(Runt-related transcription factor 2,Runx2)在成骨细胞分化中的作用及机制,发现RUNX2能够通过BMP4信号通路调节成骨细胞分化。总的来说,这些研究表明成骨细胞在骨骼发育、骨折修复、造血功能支持以及脂肪生成等多个方面都具有重要的作用。同时,自噬和信号通路在成骨细胞的分化过程中起到了关键的调控作用。成骨细胞还与一些疾病的发生和发展密切相关。例如,在前列腺癌骨转移的过程中,成骨细胞可以通过释放骨特异性蛋白和细胞间通信因子,调节和影响免疫细胞的功能,参与骨骼与免疫系统的相互作用。YU等[12]研究了视黄酸受体激活对前列腺癌骨转移的影响及机制,发现视黄酸受体激活能够通过阻断内皮细胞向成骨细胞的转变,减少前列腺癌骨转移的骨质病变。此外,在骨质疏松等疾病中,成骨细胞的分化和活性会受到影响,导致骨骼的质量下降。 总之,这些研究表明成骨细胞在多个方面都具有重要的作用,自噬和信号通路在成骨细胞的分化过程中起到了关键的调控作用。未来,可进一步探索成骨细胞在疾病发生和发展中的作用,并寻找新的治疗方法来干预成骨细胞的分化过程,以治疗相关疾病。 2.2 BMP/Wnt信号通路调控成骨 2.2.1 BMP信号通路调控成骨 BMP信号通路是一种重要的细胞信号传导网络,参与多种生物学过程的调控,并在骨骼发育和再生中发挥关键作用。BMP蛋白是BMP信号通路的主要调节因子之一,BMP蛋白属于转化生长因子β超家族,具有促进成骨、诱导骨髓干细胞分化为成骨细胞等功能。BMP蛋白通过与细胞表面上的受体结合,启动BMP信号通路。BMP蛋白与细胞表面上的BMP受体结合后,激活了BMP信号通路。如Smad蛋白(mothers against decapentaplegic homolog and Small Mothers against decapentaplegic,SMAD)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)。这些下游分子进一步调控成骨相关基因的表达,如Runx2,Osx(Oct4,Sox2和Nanog)和Ⅰ型胶原α1链(type I collagen alpha 1 chain,Col1a1),从而促进成骨细胞的分化和成熟。而BMP信号通路主要通过诱导间充质干细胞向成骨细胞分化来调控成骨过程。 赵怡心等[13]研究了激活BMP信号的骨细胞对骨髓基质细胞成骨及成脂分化的作用,发现激活BMP信号的骨细胞可以促进骨髓基质细胞的成骨分化,抑制其成脂分化。刘雷等[14]研究了脂联素通过调节BMP信号通路促进骨髓干细胞成骨分化的作用,发现脂联素可以通过调节BMP信号通路,促进骨髓干细胞的成骨分化。张阳等[15] 研究了BMP9通过p38MAPK信号通路对成骨细胞自噬和凋亡的作用,发现BMP9能够通过激活p38MAPK信号通路,促进成骨细胞自噬并抑制其凋亡。由此可以看出,BMP信号通路在成骨过程中起着关键的调控作用,通过诱导间充质干细胞向成骨细胞分化、促进成骨相关基因的表达以及与其他信号通路相互作用来共同调控成骨过程。同时,也有研究指出这些信号通路的深入研究还有助于更好地理解成骨的生物学机制,并为开发新的治疗骨质疏松等疾病的药物提供理论基础。周芬等[16]基于BMP2/Smad1/Runx2/Osterix信号通路,探讨了健骨颗粒氯仿萃取部位对体外成骨细胞分化的影响,发现健骨颗粒氯仿萃取部位能够通过激活BMP2/Smad1/Runx2/Osterix信号通路,促进成骨细胞分化。夏荃等[17]研究了BMP-Smad信号通路在小鼠胚胎干细胞诱导分化成骨细胞方案优化中的应用,发现通过优化BMP-Smad信号通路的激活条件,可以提高小鼠胚胎干细胞向成骨细胞的分化效率。 这些研究一致表明,BMP信号通路在成骨过程中起到了核心的调控作用,不仅影响骨髓基质细胞和干细胞的分化方向,还调节成骨细胞的功能,如自噬和凋亡。且BMP信号通路并不是单独起作用的,它与其他信号通路(如p38MAPK)有交互作用,共同调控成骨过程。同时,也可以看出,BMP信号通路的调节可以作为开发新药物的靶点,可通过激活BMP信号通路来促进成骨分化,或者通过优化其激活条件提高干细胞的成骨分化效率。另外,从研究中也可以看出中药的潜在价值,中药健骨颗粒的某些部位能够通过激活特定的信号通路来促进成骨细胞分化,这为中药在骨骼相关疾病中的治疗提供了理论依据。同时,值得关注的是在非激活状态下,BMP受体处于沉默状态,通过抑制SMAD蛋白的磷酸化和活化来抑制信号转导。 当BMP蛋白与BMP受体结合时,受体激活并传递信号到细胞内部。激活的BMP受体进一步磷酸化和活化SMAD蛋白,这些SMAD蛋白包括R-SMAD和Co-SMAD。BMP信号通路通过激活BMP受体并磷酸化SMAD蛋白,进而调节特定的基因表达,促进前成骨细胞向成骨细胞的分化。磷酸化的SMAD蛋白会形成复合物进入细胞核,与DNA结合并激活靶基因,从而调控成骨细胞的功能和特性。此外,BMP信号通路还能够增强成骨细胞的增殖能力,通过促进干细胞的自我更新和增殖,进而增加成骨细胞的数量。BMP信号通路的激活可以调节成骨细胞合成和沉积骨基质的能力。成骨细胞合成骨基质所需的胶原蛋白、骨硫蛋白等成分,在BMP信号通路的作用下得到增强。BMP信号通路通过调节转录因子和调节基因的表达,促进骨基质所需蛋白的合成,并通过细胞外基质分泌途径将其沉积到骨组织中。BMP信号通路还参与调控成骨细胞的功能维持和活化过程,它可以通过激活AKT和ERK等信号通路,促进成骨细胞的增殖和生存。同时,BMP信号通路还可以激活特定的转录因子,如RUNX2和Osterix,这些转录因子是成骨细胞分化和功能维持的关键因子,它们通过调控DNA结合蛋白和调节基因的表达来维持和调节成骨细胞的功能。 2.2.2 Wnt信号通路调控成骨 Wnt信号通路是一种重要的细胞信号传导机制,参与了多个器官发育和成年组织的正常功能调控,它得名于最初在果蝇中发现的一个基因簇,其中包含了编码Wnt蛋白的基因。Wnt信号通路在成骨过程中扮演着重要的调控角色,发挥着重要的调控作用。Wnt是一种分泌型蛋白,通过与受体Frizzled和低密度脂蛋白受体相关蛋白5/6(low-density lipoprotein receptor-related protein 5/6,LRP5/6)结合来激活下游信号分子,如β-连环蛋白(β-catenin)。β-连环蛋白进入细胞核后,与TCF/LEF(T细胞因子/淋巴增强因子)转录因子结合,激活成骨相关基因的表达,如Runx2、Osx和Col1a1,从而促进成骨细胞的分化和成熟。通过与受体和下游分子的相互作用,Wnt蛋白能够激活信号传导通路,影响成骨细胞的增殖、分化和功能,以调控骨组织的形成和维持。 首先,Wnt信号通路通过促进成骨细胞的增殖来参与骨形成。Wnt蛋白的存在可刺激成骨细胞的增殖,并且它的活性往往与骨密度增加相关。杨洲等[18]研究了Wnt信号通路在骨稳态中的作用,发现Wnt信号通路在维持骨稳态中起着重要作用,通过调控Wnt信号通路可以改善骨质疏松等骨骼疾病的症状。王欣等[19]研究了Wnt通过非经典通路调控RUNX家族转录因子2促进软骨分化的作用,发现Wnt可以通过非经典通路调控RUNX家族转录因子2,促进软骨细胞的分化。激活Wnt信号通路后,细胞内的β-catenin会积累并转入细胞核,与转录因子TCF/LEF结合,促进增殖相关基因的转录,这些基因包括促进细胞周期进程的因子,如c-myc和cyclin D1等。因此,Wnt信号通路的激活可以增加成骨细胞的增殖速度,从而增加骨组织的形成。吕威等[20]发现姜黄素可以通过调控Wnt通路,促进牙周膜干细胞的成骨分化。施彦龙等[21]研究了骨髓间充质干细胞外泌体与Wnt信号通路在骨质疏松症的协同作用,发现骨髓间充质干细胞外泌体可以与Wnt信号通路协同作用,改善骨质疏松症的症状。叶茂等[22]研究了骨骼肌生长发育及再生过程中Wnt信号网络的作用机制,发现Wnt信号网络在骨骼肌生长发育及再生过程中发挥着重要作用。张钰英等[23]研究了非经典Wnt信号在骨稳态中的作用,发现非经典Wnt信号在维持骨稳态中起着重要作用。这些研究均揭示Wnt信号通路在骨骼发育和维护中发挥着重要作用,可以通过调控Wnt信号通路来治疗骨骼疾病,且不同的治疗方法可以通过不同的机制来调控Wnt信号通路。 其次,Wnt信号通路通过调节成骨细胞的分化来参与骨形成。成骨细胞是负责生成和分泌骨基质的细胞类型。张顺等[24]研究表明,Wnt信号通路的激活可以促进成骨前体细胞向成骨细胞的分化。在成骨细胞的分化过程中,Wnt蛋白通过调节一系列转录因子的表达来影响细胞命运,其中Runx2和Osterix是两个重要的转录因子,在成骨细胞的分化中起着关键作用。Wnt信号通路的激活可以促进Runx2和Osterix的表达,从而促进成骨细胞的分化为骨细胞,并启动骨基质的合成和沉积。 最后,Wnt信号通路在成骨作用中的调控作用也受很多因素的影响。不同患者的治疗方法的不同会在一定程度上影响其调控作用效果。有研究指出,针刺、运动及药物等不同干预手段对其均有一定的影响。郭迪等[25]的研究探讨了针刺对绝经后骨质疏松骨折大鼠的骨密度和骨代谢的影响,发现针刺可以通过调节Wnt信号通路,改善骨质疏松骨折大鼠的骨密度和骨代谢。方雨婷等[26]的研究揭示了Wnt信号通路在膝骨关节炎软骨退变中的重要作用,并发现通过调控Wnt信号通路可以改善膝骨关节炎的症状。杨念恩等[27]发现不同冲击性负荷运动可以通过调控Wnt信号通路,影响小鼠的骨合成代谢。此外,段嘉豪等[28]研究了三花接骨散对成骨细胞Wnt/β-Catenin信号通路的影响,发现三花接骨散能够通过激活Wnt/B-Catenin信号通路,促进成骨细胞分化。宋琳琳等[29]的研究探讨了地佐辛对成骨细胞MC3T3-E1增殖、分化及对Wnt/B-Catenin信号通路的影响,发现地佐辛能够通过激活Wnt/β-Catenin信号通路,促进成骨细胞增殖和分化。冯阳阳等[30]的研究基于Wnt信号通路探讨了原花青素改善骨质疏松症的作用与分子机制,发现原花青素可以通过调节Wnt信号通路,改善骨质疏松症的症状。朱鹏等[31]研究了盘龙七片对膝骨关节炎大鼠关节软骨的保护作用及对Wnt通路的调控机制,发现盘龙七片可以通过调控Wnt通路,保护膝骨关节炎大鼠的关节软骨。任树军等[32]研究了生髓健骨胶囊对酒精性骨质疏松大鼠Wnt信号通路的影响,发现生髓健骨胶囊可以通过调控Wnt信号通路,改善酒精性骨质疏松大鼠的症状。 总之,Wnt信号通路在成骨作用中的调控作用受不同干预手段的影响,不同的治疗方法可以通过不同的机制来调控Wnt信号通路。由此也可以看出骨骼疾病发病机制的复杂性,需深入研究不同信号通路之间的相互作用,以更好地理解和治疗骨骼疾病。 2.2.3 BMP/Wnt信号通路交互 BMP和Wnt信号通路之间存在交互作用,共同调控成骨过程。BMP和Wnt信号通路在成骨过程中起着重要的调控作用。近年来,很多学者对BMP/Wnt信号通路调控成骨作用进行了相关研究。自2011年以来,相关的研究出现了爆炸式的增长[33-43],这一点从BMP/Wnt信号通路调控成骨作用相关研究时间脉络的表1和图3也可以看出,BMP和Wnt信号通路的交互作用,为骨骼相关疾病的治疗提供新的思路和方法。"


由此可见,BMP和Wnt信号通路是两个在调控成骨细胞分化过程中起关键作用的途径,这两个信号通路之间存在着复杂的交互关系,共同调控成骨细胞的增殖、分化和骨基质合成。BMP可以诱导Wnt信号通路的激活,而Wnt也可以促进BMP信号通路的激活,这种交互作用可以通过调节下游分子的表达来实现,如Smad蛋白和β-连环蛋白。此外,BMP和Wnt信号通路还可以与其他信号通路相互作用,如成纤维细胞生长因子、胰岛素样生长因子和血小板衍生生长因子共同调控成骨细胞的分化和成熟。同时,BMP和Wnt信号通路可以通过相互作用来协同促进成骨细胞的分化。在成骨细胞前体细胞中,BMP信号通路激活Smad蛋白家族成员并启动基因表达,如启动Osterix等重要转录因子的表达。同时,Wnt信号通路也可以激活β-半乳糖苷酶链(Dishevelled)和TCF/LEF(T-cell factor/lymphoid enhancer-binding factor)等关键分子,进而激活成骨细胞特征基因的表达,如Runx2和碱性磷酸酶等。 因此,BMP和Wnt信号通路通过相互作用协同促进成骨细胞分化。BMP和Wnt信号通路也可以相互影响转录因子的表达,从而调节成骨细胞分化。BMP信号通路可以通过Smad蛋白家族促进Wnt信号通路的激活,进一步增强β-半乳糖苷酶链和TCF/LEF等关键分子的表达。而Wnt信号通路可以通过激活β-半乳糖苷酶链和TCF/LEF等关键分子,进而增强BMP信号通路中转录因子的表达,如Osterix。因此,BMP和Wnt信号通路通过相互调节转录因子的表达,实现对成骨细胞分化的调控。 BMP和Wnt信号通路也可以相互影响骨基质的合成。BMP信号通路通过激活Smad蛋白家族,促进成骨细胞合成和分泌骨基质蛋白,如碱性磷酸酶、胶原蛋白和骨钙蛋白等。王晓等[44]研究了壳聚糖/海藻酸钠水凝胶顺序释放BMP/Wnt信号通路激活剂促成骨细胞分化的体外实验,发现通过壳聚糖/海藻酸钠水凝胶顺序释放BMP/Wnt信号通路激活剂,可以有效地促进成骨细胞的分化。同时,Wnt信号通路可以通过激活β-半乳糖苷酶链等关键分子,增强成骨细胞合成和分泌骨基质蛋白的能力。 因此,BMP和Wnt信号通路通过相互影响骨基质的合成,共同参与调控成骨细胞分化。BMP和Wnt信号通路通过诱导间充质干细胞向成骨细胞分化、促进成骨相关基因的表达以及与其他信号通路相互作用来共同调控成骨过程。这些信号通路的深入研究有助于更好地理解成骨的生物学机制,并为开发新的治疗骨质疏松等疾病的药物提供理论基础。 2.3 不同生理和病理条件下BMP/Wnt信号通路调控成骨 在生长发育期,BMP/Wnt信号通路对骨的发育和成长起着重要作用。BMPs是转化生长因子β超家族的一员,最早在1960s从矿化的骨骼中提取出来,并发现其能够诱导异位骨的生长。BMPs是分泌型蛋白,存在于细胞外,并且可以在血清中检测到。细胞外的BMPs与细胞膜上的BMP受体(BMPR)结合后导致受体激酶的激活,活化的受体会磷酸化细胞内的Smadl/5/8,其与Smad4形成复合物后进入到细胞核内,结合到DNA序列上,从而调节BMP靶基因的转录。在骨的发育和成长过程中,BMP-Smad信号通路起着重要的调节作用,这个通路不仅参与调节干细胞的自我更新和分化,还参与调节细胞的增殖、迁移和凋亡,以及胚胎发育和出生后组织体内稳态的维持。BMP-Smad信号通路在肿瘤发生中也起着十分重要的作用。人和小鼠的遗传学研究已证明BMPs在成骨的增殖、分化和骨的形成中起着重要作用。 Wnt信号通路的激活始于Wnt配体与细胞表面受体(如LRP5/6和Frizzled)的结合,这一结合导致β-catenin的积累和活化,进而影响细胞的命运决定。在骨发育和骨形成过程中,Wnt信号通路主要通过以下两种方式发挥作用:①通过影响成骨细胞的分化和矿化:Wnt信号通路的激活可以促进成骨细胞的分化和矿化。在骨形成过程中,成骨细胞负责合成和分泌大量的骨基质,包括胶原蛋白和骨钙素等。Wnt信号通路的激活可以促进成骨细胞的分化和矿化,从而加速骨的形成过程。②通过影响破骨细胞的生成和活性:Wnt信号通路也可以影响破骨细胞的生成和活性。破骨细胞是负责骨吸收和再吸收的细胞,它们通过分泌酸性物质和蛋白酶来降解骨基质。在骨发育和骨形成过程中,Wnt信号通路的激活可以通过抑制破骨细胞的生成和活性来促进骨的形成。此外,Wnt信号通路还可以通过调节其他细胞因子的表达来影响骨的发育和成长。例如,Wnt信号通路的激活可以上调生长因子的表达,如BMPs和胰岛素生长因子,从而促进细胞的增殖和分化。同时,Wnt信号通路的激活还可以抑制细胞凋亡和衰老过程,从而维持细胞的活性和功能。 庞兰等[45]研究了利培酮通过影响Wnt信号通路诱导人成骨细胞系hFob1.19凋亡的作用,他们发现利培酮能够通过抑制Wnt信号通路,诱导人成骨细胞系hFob1.19凋亡。因此,在骨折愈合和骨损伤的治疗中,调节BMP/Wnt信号通路的活性和表达水平可以促进骨组织的愈合和修复。在骨质疏松症的发生和发展中,BMP/Wnt信号通路的调控发生了改变。在骨质疏松的情况下,BMP/Wnt信号通路的平衡被打破,导致成骨细胞的分化和矿化受到抑制,而破骨细胞的生成和活性被增强,这导致骨量减少和骨骼微结构的破坏,从而增加了骨折的风险。在骨质疏松的情况下,BMP信号通路的抑制可以减少成骨细胞的分化和矿化,从而降低骨的形成。BMP信号通路的抑制还可以增强破骨细胞的生成和活性,从而加速骨的吸收和再吸收。BMP信号通路可以调节多种骨代谢相关因子的表达,如胰岛素样生长因子和转化生长因子等,从而影响骨的发育和形成。研究发现,BMP信号通路在骨质疏松症患者中的活性降低,导致成骨细胞的功能受阻、骨吸收增加,从而导致骨密度减少。相反,Wnt信号通路在骨质疏松症中可能过度活化,导致骨吸收失衡。张帆等[46]发现Wnt/β-catenin信号通路在骨质疏松中发挥重要作用,能够调节成骨细胞和破骨细胞的平衡。因此,调节BMP/Wnt信号通路的活性和平衡,可以作为治疗骨质疏松症的重要策略。 在骨肿瘤的发生和发展中,BMP/Wnt信号通路的异常调节起到重要作用。BMP信号通路在骨肿瘤中的活性和表达水平增加,促进了肿瘤细胞的增殖和侵袭,Wnt信号通路的过度活化也与肿瘤的发生和发展密切相关。BMP信号通路可以抑制肿瘤细胞的生长和转移,从而抑制肿瘤的发展。另一方面,通过调节BMP信号通路可以增强免疫细胞的活性,提高肿瘤治疗的效果。Wnt5a是非典型Wnt通路的重要成员,可与不同的受体结合,参与激活多个非典型的Wnt信号通路。Wnt5a信号通路在正常发育过程发挥着重要的作用,包括增殖、分化和迁移等。Wnt5a信号的异常激活或抑制则成为肿瘤发生发展中重要的一部分,可作为致癌基因或抑癌基因在不同的肿瘤中发挥不同的作用。因此,在骨肿瘤的治疗中,调节BMP/Wnt信号通路的异常活性可能有助于抑制肿瘤生长和扩散。尽管BMP/Wnt信号通路在骨的发育和骨肿瘤发展中的作用已经得到广泛关注,但其具体的分子机制仍然不完全清楚。未来的研究需要进一步深入探究这些信号通路的分子细节,包括信号转导途径中的各种蛋白质相互作用和基因调控机制。 不同生理和病理条件下BMP/Wnt信号通路调控见表2。"


2.4 BMP/Wnt信号通路与其他信号通路相互作用 BMP/Wnt信号通路与其他信号通路相互作用对成骨的调控情况是非常复杂的,不同信号通路之间存在着复杂的交叉调控网络。这个网络涉及多个通路的交互作用,包括协同、拮抗和时空特异性的调控,形成了一个高度精致且复杂的系统。深入了解这一调控网络对于骨骼疾病的治疗和个性化医疗策略的设计具有重要的临床价值。 王磊等[47]分析了软骨形成过程中参与Hedgehog信号通路的microRNA,发现microRNA在软骨形成过程中发挥重要作用,能够调节Hedgehog信号通路的活性。刘鸣等[48]研究了人骨形态发生蛋白4@MSNs调控Wnt/β-连环蛋白信号促进骨髓间充质干细胞成骨分化,发现人骨形态发生蛋白4@MSNs可以通过调控Wnt/β-连环蛋白信号,促进骨髓间充质干细胞的成骨分化。史正亮等[49]研究了lncRNA ANCR调节骨质疏松大鼠脂肪源性干细胞分化成骨细胞及对Wnt信号通路的作用机制,发现lncRNA ANCR可以调节骨质疏松大鼠脂肪源性干细胞分化成骨细胞的过程,并影响Wnt信号通路的活性。 ZHANG 等[50]研究探讨了G蛋白偶联受体35(G protein- coupled receptor 35,GPR35)通过Wnt/GSK3β/β-catenin信号通路调控成骨细胞分化的机制,发现GPR35可以通过激活Wnt/GSK3β/β-catenin信号通路,促进成骨细胞的分化。韦杰合等[51]研究了微小218-5p调控Wnt家族成员2B抑制骨肉瘤细胞143B的增殖、迁移和侵袭的作用,发现微小218-5p可以通过调控Wnt家族成员2B,抑制骨肉瘤细胞143B的增殖、迁移和侵袭。FAN等[52]发现miR-137可以通过NOTCH1/LSD1/BMP2共同调控网络,抑制人脂肪干细胞的成骨分化。TANG等[53]探讨了Runx1通过协调BMP和Wnt信号通路调控成骨细胞分化以维持骨稳态的机制,发现Runx1可以协调BMP和Wnt信号通路,促进成骨细胞的分化,从而维持骨稳态。ZHOU等[54]的研究探讨了刺猬信号通路在调控骨形成和稳态中的作用机制,发现刺猬信号通路可以通过调控成骨细胞和破骨细胞的活性,参与骨形成和稳态的调控。这些研究揭示多种信号通路在骨骼发育和维护、软骨形成以及成骨细胞的分化中发挥着重要作用。BMP/Wnt信号通路与其他信号通路(如转化生长因子β、成纤维细胞生长、Hh和Notch等)之间存在密切的交互作用,这种交互形成了复杂的调控网络,共同影响成骨过程。不同信号通路之间既有协同作用,也有拮抗作用,这种平衡确保了成骨过程的精确调控。如Runx1能够协调BMP和Wnt信号通路,而刺猬信号通路则通过调控成骨细胞和破骨细胞的活性来参与骨形成和稳态的调控。同时,也可以看出,非编码RNA的调控作用,如lncRNA ANCR和miR-137等非编码RNA也被发现参与成骨过程的调控,进一步丰富了骨骼生物学的理论内容。 另外,饶艳玲等[55]研究了青娥丸调控Wnt1/β-catenin信号通路治疗糖尿病性骨质疏松症,发现青娥丸可以通过调控Wnt1/β-catenin信号通路,有效治疗糖尿病性骨质疏松症。SHEN等[56]探讨了中药金樱子通过激活Wnt/β-catenin信号通路促进骨髓间充质干细胞成骨分化的机制,发现金樱子可以激活Wnt/β-catenin信号通路,促进骨髓间充质干细胞的成骨分化。李蕊等[57]研究了黄芪多糖通过调控Wnt信号通路对关节炎大鼠软骨细胞凋亡及CHRNA7/MMP水平的影响,发现黄芪多糖可以通过调控Wnt信号通路,减少关节炎大鼠软骨细胞的凋亡,降低CHRNA7/MMP水平。WANG等[58]的研究探讨了仙茅多糖COP70-1通过激活BMP和Wnt信号通路刺激MC3T3-E1细胞成骨分化的机制,发现仙茅多糖COP70-1可以通过激活BMP和Wnt信号通路,促进MC3T3-E1细胞的成骨分化。袁孟绮等[59]发现Sdccag3可以通过Wnt通路影响高脂血症大鼠种植体骨结合的过程。俞云飞等[60]研究了活血接骨方对骨髓间充质干细胞成骨分化中Wnt信号通路及Sclerostin基因的影响,发现活血接骨方可以通过调控Wnt信号通路和Sclerostin基因,促进骨髓间充质干细胞的成骨分化。JIAN等[61]探讨了淫羊藿苷元-7-O-β-D-葡萄糖苷通过调节BMP/Wnt信号通路刺激成骨细胞分化的机制,发现淫羊藿苷元-7-O-β-D-葡萄糖苷可以通过调节BMP/Wnt信号通路,促进成骨细胞的分化。由此可以看出,中药和天然化合物的调控作用,如活血接骨方、淫羊藿苷元-7-O-β-D-葡萄糖苷等中药和天然化合物可以通过调控这些信号通路来影响成骨过程。可见,中药可以通过调控BMP/Wnt信号通路来影响成骨过程,这对中药在骨骼相关疾病中的治疗作用提供了理论支撑。中药作为多组分、多靶点的药物,可能在这些复杂的信号通路调控网络中发挥独特优势。可考虑结合中药和西药,实现多通路、多靶点的综合治疗。 为了更好地理解BMP/Wnt信号通路与其他信号通路的相互作用,未来的研究需要综合运用多种研究方法和技术,包括基因组学、蛋白质组学、生物化学、细胞生物学等。同时,需要结合临床实践,探讨这些相互作用在疾病发生和发展中的作用,以及如何利用这些相互作用进行疾病的治疗和预防。 2.5 BMP/Wnt信号通路研究的临床转化意义 BMP/Wnt信号通路是骨代谢中的重要调节途径之一,对于骨骼的正常发育和形成起着关键的调控作用。其中,BMP信号通路主要通过促进成骨细胞的分化和矿化来促进骨的形成,而Wnt信号通路则通过调节成骨细胞和破骨细胞的平衡来维持骨骼的正常发育和形成。近年来,对于BMP/Wnt信号通路调控成骨作用的研究取得了重要的进展。首先,研究发现BMP/Wnt信号通路的激活可以促进成骨细胞的分化和矿化,这对于骨质疏松等骨骼疾病的防治具有重要的意义。例如,通过给予患者BMP-2等生长因子,可以促进骨骼的形成和增强骨骼的强度,从而降低骨折的风险。此外,Wnt信号通路的调节也被发现可以影响骨质疏松等疾病的发生。例如,通过调节Wnt信号通路的活性可以抑制破骨细胞的生成和活性,从而减少骨的吸收和再吸收。除了骨质疏松等疾病的治疗,BMP/Wnt信号通路调控成骨作用的研究还涉及到其他骨骼疾病的防治。例如,通过调节BMP/Wnt信号通路的活性可以促进骨折的愈合和修复,以及防治骨关节炎等疾病。此外,BMP/Wnt信号通路还涉及到其他疾病的发生和治疗。例如,在癌症等疾病中,BMP/Wnt信号通路的调节可以影响肿瘤细胞的生长和转移,从而为癌症的治疗提供新的思路和方法。 总之,BMP/Wnt信号通路调控成骨作用的研究进展对于临床转化具有重要的意义,可以为骨质疏松等骨骼疾病和其他疾病的防治提供新的思路和方法。然而,需要进一步的研究来深入理解BMP/Wnt信号通路的分子机制和作用,以更好地应用于临床实践。"

| [1] VLASHI R, ZHANG X, WU M, et al. Wnt signaling: essential roles in osteoblast differentiation, bone metabolism and therapeutic implications for bone and skeletal disorders. Genes Dis. 2022;10(4):1291-1317. [2] NISHIMURA R, HATA K, KIDA J. Regulation of osteoblasts and chondrocytes by Wnt signaling. Clin Calcium. 2019;29(3):299-307. [3] LIN GL, HANKENSON KD. Integration of BMP, Wnt, and notch signaling pathways in osteoblast differentiation. J Cell Biochem. 2011;112(12):3491-3501. [4] GAO Y, CHEN N, FU Z, et al. Progress of Wnt Signaling Pathway in Osteoporosis. Biomolecules. 2023;13(3):483. [5] WU M, CHEN G, LI YP. TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease. Bone Res. 2016;4: 16009. [6] BLANCO CALVO M, BOLÓS FERNÁNDEZ V, et al. Biology of BMP signalling and cancer. Clin Transl Oncol. 2009;11(3):126-137. [7] DONG B, HIASA M, HIGA Y, et al. Osteoblast/osteocyte-derived interleukin-11 regulates osteogenesis and systemic adipogenesis. Nat Commun. 2022;13(1): 7194. [8] KIM MJ, VALDERRÁBANO RJ, WU JY. Osteoblast lineage support of hematopoiesis in health and disease. J Bone Miner Res. 2022;37(10):1823-1842. [9] YOSHIDA G, KAWABATA T, TAKAMATSU H, et al. Degradation of the NOTCH intracellular domain by elevated autophagy in osteoblasts promotes osteoblast differentiation and alleviates osteoporosis. Autophagy. 2022;18(10):2323-2332. [10] CAO Z, LIU G, ZHANG H, et al. Nox4 promotes osteoblast differentiation through TGF-beta signal pathway. Free Radic Biol Med. 2022;193(Pt 2):595-609. [11] LIU DD, ZHANG CY, LIU Y, et al. RUNX2 regulates osteoblast differentiation via the BMP4 signaling pathway. J Dent Res. 2022;101(10):1227-1237. [12] YU G, CORN PG, SHEN P, et al. Retinoic acid receptor activation reduces metastatic prostate cancer bone lesions by blocking the endothelial-to-osteoblast transition. Cancer Res. 2022;82(17):3158-3171. [13] 赵怡心,曾继涛,涂小林,等.激活BMP信号的骨细胞对骨髓基质细胞成骨及成脂分化的作用研究[J].中国骨质疏松杂志,2021,27(5):694-698, 708. [14] 刘雷,毛文,郑一舟,等.脂联素通过调节BMP信号通路促进骨髓干细胞成骨分化[J].中国骨质疏松杂志,2022,28(9):1266-1271. [15] 张阳,马菁菁,喻哲昊,等.BMP9通过P38MAPK信号通路对成骨细胞自噬和凋亡的作用研究[J].医学分子生物学杂志,2023,20(4):339-345. [16] 周芬,孙雨晴,孙攀,等.基于BMP2/Smad1/Runx2/Osterix信号通路探讨健骨颗粒氯仿萃取部位对体外成骨细胞分化的影响[J].康复学报,2022,32(3): 224-231. [17] 夏荃,鲍倩,蒋德菊,等.BMP-Smad信号通路在小鼠胚胎干细胞诱导分化成骨细胞方案优化中的应用[J].广东医学,2018,39(6):822-827. [18] 杨洲,高静媛,田发明. Wnt信号通路在骨稳态中的作用[J].中国骨质疏松杂志,2022,28(1):109-113. [19] 王欣,柳辉,杨夏晴,等.Wnt通过非经典通路调控RUNX家族转录因子2促进软骨分化[J].中华实验外科杂志,2022,39(7):1233-1235. [20] 吕威,王鹤丹,苑春丽.姜黄素通过调控Wnt通路改善牙周膜干细胞成骨分化能力[J].实用口腔医学杂志,2021,37(1):15-18. [21] 施彦龙,李应福,谢兴文,等.骨髓间充质干细胞外泌体与Wnt信号通路在骨质疏松症的协同作用[J].中华骨质疏松和骨矿盐疾病杂志,2021,14(3): 295-301. [22] 叶茂,宋志文,金成龙,等.骨骼肌生长发育及再生过程中 Wnt信号网络的作用机制[J].动物营养学报,2020,32(8):3560-3567. [23] 张钰英,邢磊,田发明.非经典Wnt信号在骨稳态中的作用[J].中华骨质疏松和骨矿盐疾病杂志,2020,13(1):86-94. [24] 张顺,田爱现,张杨,等.Wnt经典信号通路在酸性pH抑制成骨细胞功能中的作用[J].天津医科大学学报,2021,27(3): 217-221,228. [25] 郭迪,高志攀,张亚平,等.针刺通过Wnt信号通路对绝经后骨质疏松骨折大鼠骨密度和骨代谢的作用研究[J].中国骨质疏松杂志,2023,29(3):349-355, 384. [26] 方雨婷,柳直,姚五平,等.Wnt信号通路在膝关节骨关节炎软骨退变的作用[J].中国骨与关节杂志,2022,11(10):782-785. [27] 杨念恩,王娜.不同冲击性负荷运动对小鼠Wnt信号通路及骨合成代谢的影响[J].山东体育学院学报,2021,37(2):88-94. [28] 段嘉豪,谭旭仪,卢敏,等.三花接骨散对成骨细胞Wnt/β-Catenin信号通路的影响[J].中国组织工程研究,2023,27(20):3230-3235. [29] 宋琳琳,孙娜,王震生,等.地佐辛对成骨细胞MC3T3-E1增殖、分化及对Wnt/β-catenin信号通路的影响[J].中国医院用药评价与分析,2022,22(8): 939-943. [30] 冯阳阳,赵程锦,周煜虎,等.基于Wnt信号通路探讨原花青素改善骨质疏松症的作用与分子机制[J].医学分子生物学杂志,2023,20(2):103-109. [31] 朱鹏,薛欣,赵晨,等.盘龙七片对膝骨关节炎大鼠关节软骨的保护作用及对Wnt通路的调控机制[J].西部医学,2020,32(8):1110-1114, 1121. [32] 任树军,梁彦林,王墉琦,等.生髓健骨胶囊对酒精性骨质疏松大鼠Wnt信号通路的影响[J].时珍国医国药,2020,31(3):579-582. [33] URIST MR. Bone: formation by autoinduction. Science. 1965;150(3698):893-899. [34] SAIKI RK, BUGAWAN TL, HORN GT, et al. Analysis of enzymatically amplified β-globin and HLA-DQα DNA with allele-specific oligonucleotide probes. Nature. 1986;324(6093):163-166. [35] WOZNEY JM, ROSEN V, CELESTE AJ, et al. Novel regulators of bone formation: molecular clones and activities. Science. 1988;242(4885):1528-1534. [36] CLEVERS H. Wnt/β-catenin signaling in development and disease. Cell. 2006; 127(3):469-480. [37] LIN GL, HANKENSON KD. Integration of BMP, Wnt, and notch signaling pathways in osteoblast differentiation. J Cell Biochem. 2011;112(12):3491-3501. [38] CLEVERS H, NUSSE R. Wnt/β-catenin signaling and disease. Cell. 2012;149(6): 1192-1205. [39] ZHAO X, CHEN J, ZHANG G, et al. Small molecule T63 suppresses osteoporosis by modulating osteoblast differentiation via BMP and Wnt signaling pathways. Sci Rep. 2017;7(1):10397. [40] SONG D, HE G, SHI Y, et al. Functional interaction between Wnt and Bmp signaling in periosteal bone growth. Sci Rep. 2021;11(1):10782. [41] TANG CY, WU M, ZHAO D, et al. Runx1 is a central regulator of osteogenesis for bone homeostasis by orchestrating BMP and Wnt signaling pathways. PLoS Genet. 2021;17(1):e1009233. [42] RAMZAN F, SALIM A, KHAN I. Signaling pathways regulating cartilage formation[M]//Cartilage: From Biology to Biofabrication. Singapore: Springer Nature Singapore. 2023:125-154. [43] CHEN J, LI W, LEE YY, et al. The synergistic treatment of cyclolinopeptide J and calcium carbonate nanoparticles for osteoporosis via BMP/Wnt signaling: in vivo and in vitro. J Funct Foods. 2023;110:105826. [44] 王晓,郝新青,王小萌,等.壳聚糖/海藻酸钠水凝胶顺序释放BMP/Wnt信号通路激活剂促成骨细胞分化的体外实验研究[J].口腔颌面外科杂志, 2021,31(1):9-15. [45] 庞兰,李佩璠,郑蕾,等.利培酮通过影响Wnt/β-catenin信号通路诱导人成骨细胞系hFob1.19凋亡[J].基础医学与临床,2023,43(3):374-379. [46] 张帆,梁清洋,韩超,等.Wnt/β-catenin信号通路调控成骨细胞、破骨细胞在骨质疏松中的作用探讨[J].中国骨质疏松杂志,2021,27(10):1540-1544. [47] 王磊,刘燕芳,王帅,等.软骨形成过程中参与Hedgehog信号通路的microRNA的分析[J].基因组学与应用生物学,2017,36(1):143-149. [48] 刘鸣,王丹,潘军伟,等.人骨形态发生蛋白4@MSNs调控Wnt/β-连环蛋白信号促进骨髓间充质干细胞成骨分化[J].中华实验外科杂志,2023,40(3): 505-508. [49] 史正亮,张华,范志勇,等.lncRNA ANCR调节骨质疏松大鼠脂肪源性干细胞分化成骨细胞及对Wnt信号通路的作用机制[J].中国骨质疏松杂志,2021, 27(9):1249-1253, 1268. [50] ZHANG Y, SHI T, HE Y. GPR35 regulates osteogenesis via the Wnt/GSK3β/β-catenin signaling pathway. Biochem Biophys Res Commun. 2021;556:171-178. [51] 韦杰合,韦仁杰,周业修.微小218-5p调控Wnt家族成员2B抑制骨肉瘤细胞143B的增殖、迁移和侵袭[J].安徽医药,2021,25(1):13-16. [52] FAN C, MA X, WANG Y, et al. A NOTCH1/LSD1/BMP2 co-regulatory network mediated by miR-137 negatively regulates osteogenesis of human adipose-derived stem cells. BioMed Central. Stem Cell Res Ther. 2021;12(1):417. [53] TANG C Y, WU M, ZHAO D, et al. Runx1 is a central regulator of osteogenesis for bone homeostasis by orchestrating BMP and Wnt signaling pathways. PLoS Genet. 2021;17(1):e1009233. [54] ZHOU H, ZHANG L, CHEN Y, et al. Research progress on the hedgehog signalling pathway in regulating bone formation and homeostasis. Cell Proliferation. 2022;55(1):e13162. [55] 饶艳玲,黄威.青娥丸调控Wnt1/β-catenin信号通路治疗糖尿病性骨质疏松症[J].中国骨质疏松杂志,2023,29(8):1167-1171,1181. [56] SHEN YW, LI Y, LI Z, et al. Rhizoma drynariae promotes the osteogenic differentiation of bone mesenchymal stem cells by activating the Wnt/β-catenin signaling pathway. J Orthop Surg Res. 2021;16(1):334. [57] 李蕊,马辉,史胜奇.黄芪多糖通过调控Wnt信号通路对关节炎大鼠软骨细胞凋亡及CHRNA7/MMP水平的影响[J].辽宁中医杂志,2023,50(3):188-192. [58] WANG J, YANG J, TANG Z, et al. Curculigo orchioides polysaccharide COP70-1 stimulates osteogenic differentiation of MC3T3-E1 cells by activating the BMP and Wnt signaling pathways. Int J Biol Macromol. 2023;248:125879. [59] 袁孟绮,霍凤蕾,任会萍,等.Sdccag3通过Wnt通路对高脂血症大鼠种植体骨结合的影响[J].山东大学学报(医学版),2022,60(7):66-73. [60] 俞云飞,王建伟,冯骅,等.活血接骨方对骨髓间充质干细胞成骨分化中Wnt信号通路及Sclerostin基因的影响[J].世界科学技术-中医药现代化,2021, 23(4):1021-1029. [61] JIAN J, SUN L, CHENG X, et al. Calycosin-7-O-β-d-glucopyranoside stimulates osteoblast differentiation through regulating the BMP/Wnt signaling pathways. Acta Pharmaceutica Sinica B. 2015;5(5):454-460. |
| [1] | Huang Haobo, Liang Xinyuan, Ye Guozhong, Xie Qingxiang, Su Boyuan. Suture tape and headless compression screws in treatment of Lisfranc injury with comminuted fractures of the first and second proximal metatarsal bones [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1803-1809. |
| [2] | Zhou Jiajun, Ma Fei, Leng Yebo, Xu Shicai, He Baoqiang, Li Yang, Liao Yehui, Tang Qiang, Tang Chao, Wang Qing, Zhong Dejun. Assessing distribution characteristics and clinical significance of vertebral fractures in patients with osteoporosis based on whole spine MRI [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1883-1889. |
| [3] | Han Haihui, Ran Lei, Meng Xiaohui, Xin Pengfei, Xiang Zheng, Bian Yanqin, Shi Qi, Xiao Lianbo. Targeting fibroblast growth factor receptor 1 signaling to improve bone destruction in rheumatoid arthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1905-1912. |
| [4] | Zhao Jiyu, Wang Shaowei. Forkhead box transcription factor O1 signaling pathway in bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1923-1930. |
| [5] | Wang Wentao, Hou Zhenyang, Wang Yijun, Xu Yaozeng. Apelin-13 alleviates systemic inflammatory bone loss by inhibiting macrophage M1 polarization [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1548-1555. |
| [6] | Chen Shuai, Jin Jie, Han Huawei, Tian Ningsheng, Li Zhiwei . Causal relationship between circulating inflammatory cytokines and bone mineral density based on two-sample Mendelian randomization [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1556-1564. |
| [7] | Cai Yaohao, Lang Lyu, Li Hong. Assessing the bone mass of the residual alveolar ridge in the first molar for implant placement by cone-beam computed tomography [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1572-1577. |
| [8] | Li Jun, Gong Jingjing, Sun Guobin, Guo Rui, Ding Yang, Qiang Lijuan, Zhang Xiaoli, Fang Zhanhai . miR-27a-3p promotes the proliferation of human hypertrophic scar fibroblasts by regulating mitogen-activated protein kinase signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1609-1617. |
| [9] | Zhu Hanmin, Wang Song, Xiao Wenlin, Zhang Wenjing, Zhou Xi, He Ye, Li Wei, . Mitophagy regulates bone metabolism [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1676-1683. |
| [10] | Zhao Jiacheng, Ren Shiqi, Zhu Qin, Liu Jiajia, Zhu Xiang, Yang Yang. Bioinformatics analysis of potential biomarkers for primary osteoporosis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1741-1750. |
| [11] | Hu Taotao, Liu Bing, Chen Cheng, Yin Zongyin, Kan Daohong, Ni Jie, Ye Lingxiao, Zheng Xiangbing, Yan Min, Zou Yong. Human amniotic mesenchymal stem cells overexpressing neuregulin-1 promote skin wound healing in mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1343-1349. |
| [12] | Jin Kai, Tang Ting, Li Meile, Xie Yuan. Effects of conditioned medium and exosomes of human umbilical cord mesenchymal stem cells on proliferation, migration, invasion, and apoptosis of hepatocellular carcinoma cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1350-1355. |
| [13] | Liu Qi, Li Linzhen, Li Yusheng, Jiao Hongzhuo, Yang Cheng, Zhang Juntao. Icariin-containing serum promotes chondrocyte proliferation and chondrogenic differentiation of stem cells in the co-culture system of three kinds of cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1371-1379. |
| [14] | Huang Ting, Zheng Xiaohan, Zhong Yuanji, Wei Yanzhao, Wei Xufang, Cao Xudong, Feng Xiaoli, Zhao Zhenqiang. Effects of macrophage migration inhibitory factor on survival, proliferation, and differentiation of human embryonic stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1380-1387. |
| [15] | Aikepaer · Aierken, Chen Xiaotao, Wufanbieke · Baheti. Osteogenesis-induced exosomes derived from human periodontal ligament stem cells promote osteogenic differentiation of human periodontal ligament stem cells in an inflammatory microenvironment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1388-1394. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||