Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (4): 856-865.doi: 10.12307/2024.590
Previous Articles Next Articles
Role and mechanism of biomimetic remineralization therapy for early enamel demineralization
Lin Xiaohui, Yang Mengyuan, Li Chunnian
- School and Hospital of Stomatology, Hebei Medical University & Hebei Key Laboratory of Stomatology, The Oral Disease Clinical Medicinal Research Institution of Hebei, Shijiazhuang 050017, Hebei Province, China
-
Received:2023-11-21Accepted:2024-01-06Online:2025-02-08Published:2024-06-04 -
Contact:Li Chunnian, Master, Chief physician, School and Hospital of Stomatology, Hebei Medical University & Hebei Key Laboratory of Stomatology, The Oral Disease Clinical Medicinal Research Institution of Hebei, Shijiazhuang 050017, Hebei Province, China -
About author:Lin Xiaohui, Master candidate, School and Hospital of Stomatology, Hebei Medical University & Hebei Key Laboratory of Stomatology, The Oral Disease Clinical Medicinal Research Institution of Hebei, Shijiazhuang 050017, Hebei Province, China -
Supported by:Key Science and Technology Research Program of Hebei Medical Science, No. 20220179 (to LCN)
CLC Number:
Cite this article
Lin Xiaohui, Yang Mengyuan, Li Chunnian. Role and mechanism of biomimetic remineralization therapy for early enamel demineralization[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 856-865.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
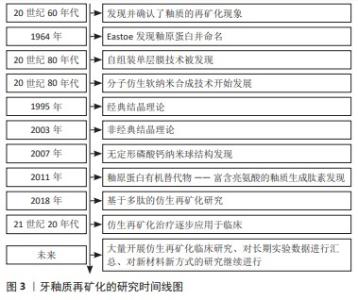
2.1 牙釉质再矿化的研究历程 自20世纪60年代釉质的再矿化现象被发现后,对于这种应对早期釉质龋的治疗措施的研究逐步发展并应用于临床。釉原蛋白于1964年被Eastoe发现并初次命名,与此同时仿生技术逐步开始发展。在20世纪80年代,自组装单层膜技术被发现,分子仿生纳米合成技术开始发展。经典结晶理论和非经典结晶理论分别在1995和2003年被提出。在20世纪初,无定型磷酸钙的纳米球结构被发现,证实其具有与蛋白分子结构结合能力。在2011年,富含亮氨酸的釉质生成肽素被发现,挖掘出其存在替代釉原蛋白发挥作用的可能。在2018年,基于多肽的仿生再矿化研究开始进展。进入21世纪20年代后,各种再矿化治疗方式开始应用于临床,大量临床数据开始被汇总整理。牙釉质再矿化研究历史如图3所示。"
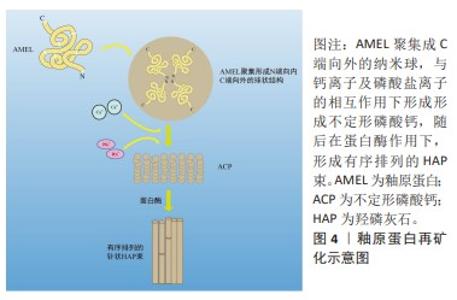
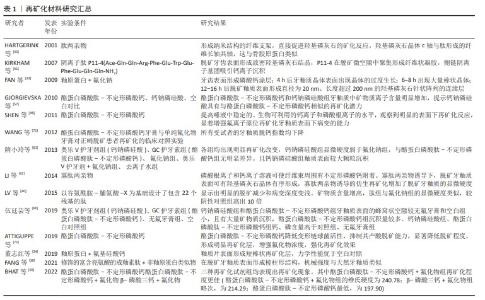
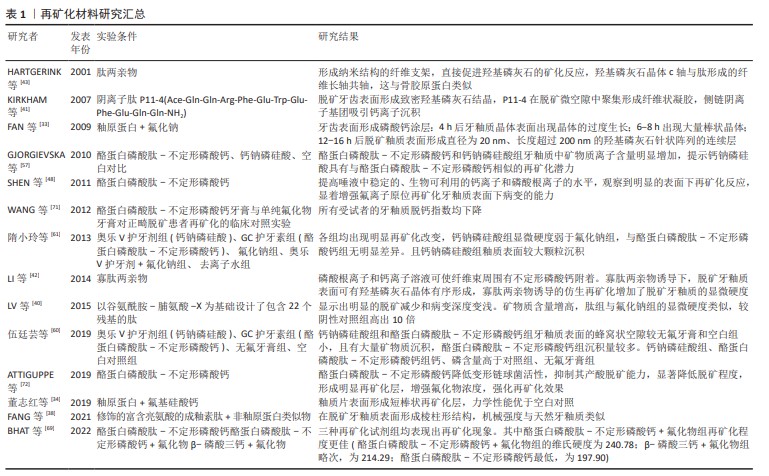
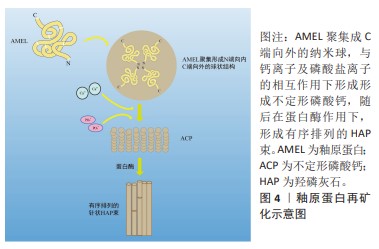
2.2 牙釉质矿化的生理机制 牙釉质在机体调控下由成釉细胞结合相关蛋白质形成,其中釉原蛋白(ameLogenin,AMEL)占牙釉质的有机基质的90%,成为釉质形成的主要结构骨架。在釉质生成过程中,釉原蛋白是扩展牙釉质基质的关键。成釉细胞逆向运动时,釉原蛋白使牙釉质带适应性持续伸长,并通过自身体积占据晶体间的空间以防止牙釉质带相邻融合[19],以上作用中釉原蛋白以间接作用为主,并不直接使牙釉质带成核或定向[20]。因此成釉细胞与相关蛋白的高精度协作产生的结构精密的釉质晶体是牙釉质具有其特殊力学性能的关键,相关蛋白的基因缺陷易导致人类釉质形成不全(amelogenesis imperfecta,AI)的发生。根据上述成釉过程的启发,成釉蛋白和参与成釉过程的相关酶组成的仿生矿化系统已经被用于脱矿牙釉质的修复研究。蛋白质具有难以制造和保存的特点,不定形磷酸钙仿生系统由于其稳定特性得到了广泛研究。同时,磷酸钙的加入进一步简化了仿生系统,其流动性可进入病变深层,成核形成不定形磷酸钙,最后转化为羟磷灰石。 牙釉质生理性矿化过程分为分泌前期、分泌期、过渡期、矿化期4个阶段[21],在分泌过程中,观察到1.0-2.0 nm的矿物质在成釉细胞分泌的有机基质中聚集成大小约5 nm的不定形磷酸钙颗粒,此时基质内主要物质为N端釉原蛋白裂解产物,由3-10个直径约5 nm的矿物质颗粒形成不定形磷酸钙的模板,当其厚度达4-6 μm时,矿化前沿形成棒状及棒间结构[20,22]。此阶段分泌的釉原蛋白、釉蛋白(enamelin,ENAM)、成釉蛋白(ameloblastin,AMBN)都属于分泌型钙结合磷蛋白(secretory calcium-binding phosphoproteins,SCPPs),这些蛋白质的磷酸化可以促进矿化物成核和形成稳定的不定形磷酸钙。同时,牙釉质的生成和矿化过时刻存在相关蛋白酶的参与,精确的蛋白水解机制在釉质生成和矿化过程中至关重要。牙釉质特异性蛋白酶——基质金属蛋白酶20 指导羟基磷灰石晶体形态并增强其结晶度,在釉质形成早期与 分泌型钙结合磷蛋白共表达。分泌型钙结合磷蛋白分泌后立即被 基质金属蛋白酶20 水解成更稳定的过渡状态,以抑制磷酸钙与蛋白质的结合[21,23]。基质金属蛋白酶20突变常导致低矿化牙釉质变薄且结构紊乱,呈现易断裂状态[24]。经过蛋白质的水解,不定形磷酸钙逐渐转化为羟基磷灰石,矿化晶体占据更多空间使牙釉质硬度逐渐增强[20-21]。 2.3 仿生再矿化的应用 脱矿牙釉质的再矿化取决于环境中钙离子、磷酸盐和氟化物的存在[25]。基于各种成釉蛋白的相关机制,仿生再矿化技术正在进行各种初步实验验证,与生理性过程中蛋白作用相似的有机物已被用于仿生技术当中[3],有研究证实,将羧甲基壳聚糖与阿仑膦酸盐偶联后与不定形磷酸钙形成复合纳米颗粒,在次氯酸钠和甘氨酸等作用下有序排列,在酸蚀釉质表面上实现定向和有序的仿生再矿化[26]。釉质细胞外基质蛋白主要由釉原蛋白、非釉原蛋白和相关蛋白酶类3种蛋白组成,其中釉原蛋白在釉质发育分泌期大量存在,占上述蛋白含量约90%,其主要分布于釉质晶体缝隙中,具有调控晶体生长方向和速度的作用,在釉质成熟期时全部被丝氨酸蛋白酶分解,为釉质晶体的扩展提供生长空间;非釉原蛋白包括釉蛋白、成釉蛋白和釉丛蛋白等,对晶体成核和晶体生长形态的改变有关;由丝氨酸蛋白酶和金属蛋白酶等组成的釉基质蛋白酶与釉原蛋白和非釉原蛋白的剪接修饰有关。目前牙釉质早期脱矿的仿生再矿化材料包括釉原蛋白、非釉原蛋白、釉原蛋白肽、不定形磷酸钙、钙钠磷硅酸和磷酸三钙等,部分材料如酪蛋白磷酸肽-不定形磷酸钙复合物、钙钠磷硅酸等以护牙素及牙膏等形式初步应用于临床。 2.3.1 釉原蛋白 釉原蛋白自身具有非结构化特点,多以一级结构即肽链的形式存在,称为内在无序化结构蛋白(intrinsically disordered/unstructured protein family,IDPs),这些区域不存在α-螺旋及β-折叠。这些无序区域与识别功能有关,可通过蛋白间的相互作用调节蛋白自身的折叠和稳定状态,以影响蛋白质的结构与功能。从以往研究可知,釉原蛋白与牙釉质棱柱状微观结构及磷灰石带的形成有关,证明其在牙釉质形成过程中诱导框架生成作用[27]。釉原蛋白的分子活性区域由富含酪氨酸的N端、富含脯氨酸的疏水性区域和亲水性C端组成,其中N端结构域可与其他相关蛋白及磷灰石晶体结合,是釉原蛋白上唯一含有磷酸基团的部位,二级结构主要为β-sheet,C端结构域则与诱导无序不定形磷酸钙向有序晶体转化密切相关,二级结构为不规则螺旋[21,28]。有研究证实,发生于成釉阶段早期的磷酸化反应对釉质形成相关蛋白的结构形成和蛋白质-矿物质相互作用存在促进作用。通常,釉原蛋白在与钙离子及磷酸盐离子的相互作用下形成微型纳米条带,基质金属蛋白酶2继而切除C端,在矿物离子作用下形成不定形磷酸钙,随后在蛋白酶作用下,形成有序排列的羟基磷灰石束[27],见图4。 在过饱和状态中,釉原蛋白在不同的环境条件及不同种酶作用下,可形成各异的晶体结构。富含亮氨酸的釉质生成肽素(Leucine rich amelogeninpeptide,LRAP)与羟基磷灰石结合,在釉质生成和结构中起重要作用,已被证明其与间充质增殖有关[29]。结果形成的大量C端在外、N端向内的球形结构是牙釉质发育的重要基本结构,这种特殊性结构使得C端较N端受到更多刺激[30]。表面的亲水性和内部稳定的结构特性将不定形磷酸钙排列为带状并进一步将不定形磷酸钙条带合并为平行排列的羟基磷灰石晶体。通常情况下,羟基磷灰石晶体呈现为针状[26]。有研究在体外环境中,将经酸蚀处理的人类磨牙放入存在无机焦磷酸盐的过饱和磷酸钙中,当富含亮氨酸的釉质生成肽素不存在时,磨牙表面出现不规则的多方向生长的羟基磷灰石晶体,这种再矿化晶体附着力和硬度均较弱,而加入富含亮氨酸的釉质生成肽素后,在酸蚀磨牙表面出现了与天然牙釉类似的有序排列的针状羟基磷灰石晶体束,由此形成了致密的再矿化层[31]。在体外环境中,非磷酸化的富含亮氨酸的釉质生成肽素可引导釉柱的顺序形成方向,有效地指导羟磷灰石结晶的针状结构有序形成,以增强新形成牙釉质的结构强度[32]。但是,当以上蛋白质作用于脱矿牙釉质表面使其再矿化时,由于有机含量过高,牙釉质仍无法获得足够精细的结构,导致硬度不足。此时可使用蛋白酶进行蛋白切割以避免磷灰石晶体内被蛋白质闭塞,使得磷灰石晶体发生进一步硬化[23]。 有研究模仿了成釉细胞同时分泌釉原蛋白和基质金属蛋白酶20的过程,将其同时添加到壳聚糖中进行再矿化实验,发现新结晶釉质较未添加基质金属蛋白酶20的釉质晶体更加均匀,晶体方向一致性更强,即代表其拥有更强的机械强度[23]。但与此同时研究者们发现,釉原蛋白和基质金属蛋白酶20的结合过程复杂,相关材料成本价格高昂,仍需进一步研究以简化蛋白与酶的结合过程以减少再矿化成本并简化过程。FAN等[33]利用釉原蛋白的仿生沉积方法在脱矿牙釉质表面实现再矿化,观察到针状氟化羟基磷灰石的定向束于牙釉质表面形成,除此之外,该研究发现釉原蛋白的最低再矿化浓度为33 μg/mL。 董志红等[34]在牙釉质小片上涂布氟基硅酸钙粉末,经柠檬酸脱矿后,置于pH值7.4-7.6的釉原蛋白再矿化溶液中,结果显示釉质片表面形成短棒状再矿化层,力学性能优于空白对照组,提示氟基牙膏应搭配釉原蛋白再矿化剂使用以充分发挥再矿化作用。 总之,釉原蛋白的诱导框架生成作用对釉质矿化具有积极影响,从纳米球到纳米条带再到规则羟基磷灰石晶体是诱导矿化的必要途径,同时基质金属蛋白酶20等酶类和富含亮氨酸的釉质生成肽素等作用也是该阶段的必要环节。釉原蛋白仿生再矿化虽效果出众,但过程繁杂,成本高昂,需研究简化步骤或寻找替代物,以使过程便捷并降低成本。同时,与氟化物的结合使用也是可行的,但需注意氟化物的比例与用量,避免造成氟中毒等情况出现。 "
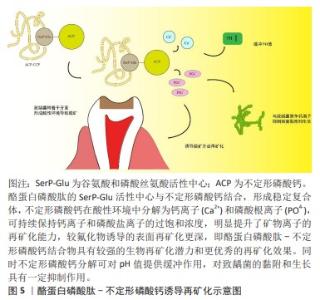
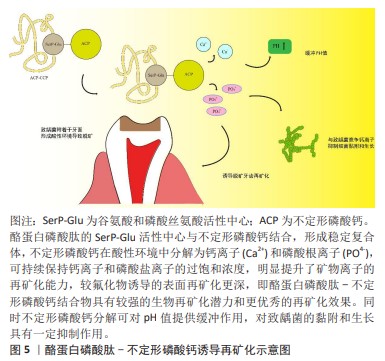
2.3.2 非釉原蛋白 主要由两种蛋白组成,即成釉蛋白和釉蛋白,它们分别由成釉蛋白和釉蛋白基因表达,人类的成釉蛋白和釉蛋白基因在4q13.2染色体上被发现,二者分别分泌产生421和1 103个氨基酸,经过蛋白酶类的加工修饰,在釉质形成和矿化过程中发挥重要作用,目前已被证实成釉蛋白和釉蛋白基因的沉默将导致釉质发育不全等相关疾病发生[35]。NANCI等[36]的研究发现,非釉质蛋白在成釉细胞膜外存在短暂的新分泌蛋白堆积矿化,虽然存量较少,但在糖基化和磷酸化作用下,表现出矿化前沿的状态,为釉质的增量打下基础。成釉蛋白在釉质生成过程中被基质金属蛋白酶20切割,切割产物是牙釉质基质中含量最丰富的非釉原蛋白之一。有实验证实了基质金属蛋白酶20可以在体内和体外处理釉质[37]。目前研究发现,以富含亮氨酸的釉原蛋白和非釉原蛋白的仿制物相结合,组成仿生牙釉质基质蛋白,以此为环境在脱矿牙釉质表面生成了类似新生牙釉质的高强度晶体[38],该类实验揭示了在由成釉相关蛋白为主的液体环境中促进脱矿釉质仿生再矿化的研究策略。非釉原蛋白目前仿生再矿化相关实验数量较少,多与其他成分相结合以发挥辅助矿化作用,应作为仿生再矿化材料基本成分添加。 2.3.3 釉原蛋白肽 釉原蛋白目前作为牙釉质脱矿仿生再矿化的研究热点,已在体外实验及初步临床应用中取得进展,但因其具有成本价格高昂等特点,难以实现大面积的临床应用。利用釉原蛋白的各种功能区域重新拼接成的合成肽,可突出表现其功能区域,对不利片段采取沉默或替代方式,以达到发挥功能的同时减少成本的目的。 有研究提取了釉原蛋白C端和N端的肽,形成合成肽,利用猪的脱矿牙浸入添加了合成肽的再矿化培养基后与加入氟化物组比较,结果发现虽然加入氟化物的再矿化培养基组增重略低,但合成肽组表现出更高的矿化增益[39]。WANG等[3]的文章中提到,目前可利用连接肽GGGGS将位于釉原蛋白蛋白C端的Ame-CT16和HA6-1结合,形成SVSVGMKPSPRR-GGGGS-LEAWPATDKTKREEVD,有利于定向形成高强度的矿化牙釉质。LV等[40]通过分析多物种的釉质蛋白氨基酸序列,鉴定出谷氨酰胺(GIn)-脯氨酸(Pro)-X这一高度保守的序列,以此为基础设计了包含22个残基的肽,将其合成一种新型肽,与氟化钠、HEPES缓冲液相对比,进行显微硬度测试、横向纤维射线照相等方式进行对比研究,结果发现,这种新型肽具有和氟化钠相当的促进已脱矿釉质再矿化性能。还有研究利用一种寡聚 β 片层阴离子肽P11-4(Ace-Gln-Gln-Arg-Phe-Glu-Trp-Glu-Phe-Glu-Gln-Gln-NH2),在特定环境下,在脱矿牙齿表面形成了致密羟基磷灰石结晶,这可能与阴离子肽P11-4在脱矿微空隙中聚集形成纤维状凝胶,侧链阴离子基团吸引钙离子沉积有关,另外,该肽可组成纤维支架,诱导羟基磷灰石成核并结晶[41]。 LI等[42]进行实验成功制备了一种新型的寡肽两亲物(oligopeptide amphiphile,OPA),在含钙离子和中性酸性条件下可通过自组装形成纳米纤维,当反复暴露于含有磷酸根离子和钙离子的溶液中,可发现纤维束周围有不定形磷酸钙附着。在寡肽两亲物诱导下,脱矿牙釉质表面可有羟基磷灰石晶体有序形成。HARTGERINK等[43]通过标准固相化学合成,最终对肽的NH2末端进行烷基化以合成肽两亲物(peptide-amphiphile,PA),利用pH诱导肽两亲物使其自组装形成纳米结构的纤维支架,这种支架类似于细胞外基质,可直接促进羟基磷灰石的矿化反应,其中羟基磷灰石晶体c轴与肽形成的纤维长轴共轴,这与骨胶原蛋白类似。由此可见,釉原蛋白肽可通过诱导定向形成高强度矿化牙釉质,并具有工艺相对简便,价格较低廉的特点。但同样存在实验数据较少等特点,需进一步增加研究数量,提供更多临床研究数据以增强结论可靠性。 2.3.4 磷酸钙 是一种在生物矿化过程中具有重要意义的无机化合物。羟基磷灰石[Ca10(PO4)6(OH)2]是人体牙齿与骨骼的重要成分,也是目前生物矿化研究热点之一。在经典成核理论当中,人们认为晶体形成是由溶液中的离子直接组装成核而进一步形成晶体[44]。 过去的30年中,不定形磷酸钙因其结构具有不稳定性,难以作为仿生再矿化的合适材料。经基础研究发现,在正常生理过程中,不定形磷酸钙前体的形成是羟基磷灰石成核前提。Ca9(PO4)6可作为不定形磷酸钙最初的诱导模块。经过XIE等[45]利用电导和电位方法,研究羟基磷灰石的成核途径,发现 [Ca-(HPO4)1+x·nH2O]2x是磷酸钙诱导成核的前驱物质,当其缺钙状态得到补充时,会向着[Ca-(HPO4)·mH2O]发生转变,后期通过去质子化进一步成核。这项研究揭示了生物再矿化过程中晶体成核前的关键一步。为后续再矿化研究奠定了基础。 酪蛋白磷酸肽-不定形磷酸钙复合物:在以往的研究中发现,奶酪等乳制品具有防龋作用,这与酪蛋白磷酸蛋白中的钙磷成分有关[46]。乳制品在胰蛋白酶的消化作用下,可产生酪蛋白磷酸肽,其内含由谷氨酸和磷酸丝氨酸连续组成的活性中心,其通过该中心与不定形磷酸钙紧密结合,形成稳定复合体。酪蛋白磷酸肽与不定形磷酸钙的结合进一步提高了环境中钙离子稳定性,不定形磷酸钙在酸性环境中分解为钙离子(Ca2+)和磷酸根离子(PO4-),可持续保持钙离子和磷酸盐离子的过饱和浓度,明显提升了矿物离子的再矿化能力,较氟化物诱导的表面再矿化更深,即酪蛋白磷酸肽-不定形磷酸钙结合物具有较强的生物再矿化潜力和更优秀的再矿化效果[47]。同时不定形磷酸钙分解可对pH值提供缓冲作用,见图5。 SHEN等[48]的研究中发现酪蛋白磷酸肽-不定形磷酸钙可以显著增高唾液中的无机磷酸盐及钙离子浓度,达到更高水平的仿生再矿化效果,且脱矿釉质表面以下的再矿化在与同实验其他组别对比中处于最高水平。同时有研究显示,酪蛋白磷酸肽-不定形磷酸钙对正畸治疗后出现的脱矿性白斑具有卓越疗效[49]。 与此同时,多项研究发现酪蛋白磷酸肽-不定形磷酸钙可降低唾液中变形链球菌的水平。理论推测,酪蛋白磷酸肽-不定形磷酸钙的抑菌作用主要体现在缓冲、降低黏附和抑菌3个方面。缓冲能力体现于酪蛋白磷酸肽-不定形磷酸钙可提高唾液pH值,削减酸性环境对牙釉质的持续破坏作用[50]。细菌生物膜的形成是釉质脱矿的重要因素之一,近期一项研究显示,体积分数3%的酪蛋白磷酸肽-不定形磷酸钙玻璃离子水门汀可抑制将近50%的细菌生物膜形成,这可能与其影响获得性膜与细菌相互黏附的能力有关[51],此为酪蛋白磷酸肽-不定形磷酸钙的影响细菌黏附能力。此外,有研究显示,当钙离子浓度高于1 mmol/L时,环境中的链球菌将发生不可逆性裂解[52],这将引起酪蛋白磷酸肽-不定形磷酸钙加入后的稳定钙离子浓度上升至一定数值时的致龋菌数量减少,即抑菌作用[53]。POGGIO等[54]通过对比研究发现酪蛋白磷酸肽-不定形磷酸钙对酸性饮料造成的牙齿表面脱矿具有预防作用。为方便携带与运输,酪蛋白磷酸肽-不定形磷酸钙牙膏、口香糖以及食品已相继问世,有研究发现在酸奶中加入酪蛋白磷酸肽-不定形磷酸钙,可降低患龋率和增加再矿化,含酪蛋白磷酸肽-不定形磷酸钙口香糖可促进龈上菌斑内血红链球菌等有益菌生长以维持菌群稳定[55]。以上具体临床效果还需进一步实验研究论证。 钙钠磷硅酸:近些年的研究发现,除酪蛋白磷酸肽-不定形磷酸钙之外,磷酸钙系统中还存在其他几种促再矿化物质,钙钠磷硅酸即其中之一。钙钠磷硅酸本质为生物活性玻璃,与唾液接触后立即释放出磷酸根离子、钙离子、钠离子等矿物质离子,在脱矿牙面形成羟基磷灰石晶体层,以发挥再矿化作用[56]。GJORGIEVSKA等[57]的研究中对连续脱矿3个周期的牙釉质使用3种不同主要成分的牙膏(酪蛋白磷酸肽-不定形磷酸钙、钙钠磷硅酸、空白对照)对照实验发现,酪蛋白磷酸肽-不定形磷酸钙和钙钠磷硅酸组牙釉质中Ca,P,Si和Zn的含量明显增加,提示钙钠磷硅酸具有与酪蛋白磷酸肽-不定形磷酸钙相似的再矿化潜力。研究显示,钙钠磷硅酸可附着于牙釉质表面持续发挥再矿化作用。但有实验将脱矿牛牙分别置入7.5%钙钠磷硅酸和低、中、高浓度氟化剂中,结果显示钙钠磷硅酸组与高浓度氟组相比再矿化效果较差[58]。此外,目前对钙钠磷硅酸的研究热点集中于其对牙本质小管的封闭作用,使得钙钠磷硅酸具有和Nd:YAG相似的牙齿脱敏效果[59]。尽管根据当前研究结论,钙钠磷硅酸的再矿化能力略逊于氟化物和酪蛋白磷酸肽-不定形磷酸钙[60-61],但其封闭作用以及良好的生物安全性,对低龄患龋儿童和高氟地区患者的治疗具有重要意义。 磷酸三钙:磷酸三钙作为一种合成无机生物材料,具有良好的生物活性及生物相容性,体外实验证实了β-磷酸三钙的生物安全性[62],磷酸三钙在人体中通常以α-磷酸三钙和β-磷酸三钙两种形式存在,可通过自身溶解提供少量钙、磷离子,其中β-磷酸三钙溶解度较低,需活化后使用,有实验发现用富马酸对β-磷酸三钙进行活化后处理离体牙比单纯的β-磷酸三钙处理获得了更强的显微硬度,证实活化后的β-磷酸三钙再矿化潜力更佳。在BHADORIA等[63]最近的研究中,将氟化物分别加入磷酸三钙与酪蛋白磷酸肽-不定形磷酸钙,对人恒牙及乳牙进行再矿化实验,通过测定平均显微硬度发现,功能化磷酸三钙组较后者具有更强的再矿化潜力。但目前磷酸三钙相较前两种再矿化剂实验研究及临床使用较少,需增加研究数据以明确其再矿化能力,同时因β-磷酸三钙溶解度低,需活化后使用,可尝试不同活化物质与其反应,测试最佳矿化结果。内含无氟磷酸三钙的Vussen S和Pureen牙膏在两项临床试验中分别表现出抑制龋坏和改善牙本质敏感的积极结果[64-65]。磷酸三钙被加入在ClinproTM White Varnish 氟保护漆中并应用于临床,该保护漆因其使用便捷、隐形美观等特性获得口腔医生及患者的信赖。 以上结果中各个材料均各有利弊。根据以往研究发现,传统的单纯氟化物矿化制剂使用便捷,但在唾液中的氟离子含量不稳定,即使其内部添加了钙磷离子,但其利用率仍然较低,且过量使用容易引起中毒反应[66]。磷酸钙添加剂类再矿化剂因生物相容性强且便捷、美观应用相对广泛,但经常使用会导致牙石生成风险增加。SINGAL,SHARDA等[67]通过挖掘多个数据库,筛选出26个研究进行Meta分析发现,单纯的酪蛋白磷酸肽-不定形磷酸钙引导再矿化难以达到理想效果,需与氟化剂联合以发挥最大功效。其他研究也发现,酪蛋白磷酸肽-不定形磷酸钙与氟化物或Er,Cr:YSGG激光结合使用效果优于单独使用[68-69]。釉原蛋白再矿化符合生理性牙釉质再矿化机制,经过自组装和蛋白酶解等过程调控牙釉质生物矿化,无明显不利影响,在酸性溶液中的不对称结构使其加强了扩展性,增加了蛋白质间或蛋白质与矿物质间的相互作用。多项研究证实釉原蛋白仿生再矿化效果显著,其蛋白结构决定了其溶解性较低,易以固态或凝胶状存在,便于携带、保存和使用[70]。但目前实验及应用成本高和过程相对复杂使得釉原蛋白难以广泛应用,进一步研究应着手于降低釉原蛋白合成成本或寻求替代物。同时,釉原蛋白与酪蛋白磷酸肽-不定形磷酸钙都是目前多项研究证实的再矿化试剂,然而二者再矿化能力比较实验仍为空白,应采取体外实验验证并对比二者再矿化效果,为临床进一步应用提供数据支持。 "
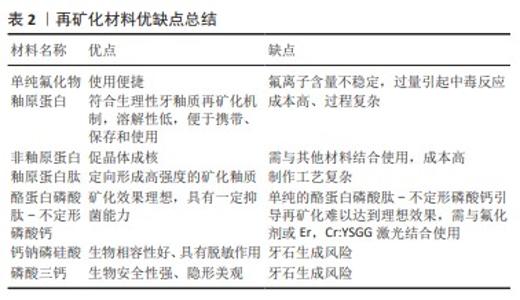
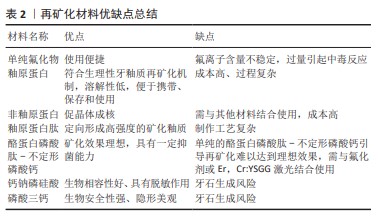
通过总结上述相关研究结果发现,釉原蛋白+氟化物可在脱矿牙釉质表面形成明显再矿化,非釉原蛋白相似物具有一定的再矿化效果,但再矿化层局限于脱矿釉质表面。釉原蛋白肽可作为支架诱导羟基磷灰石成核结晶。酪蛋白磷酸肽-不定形磷酸钙通过稳定提高唾液中生物可利用的离子浓度和降低变形链球菌活性可起到再矿化效果,且表面下层出现再矿化,与氟化物同时使用效果更佳。 表2对单纯氟化物、釉原蛋白、非釉原蛋白、釉原蛋白肽、酪蛋白磷酸肽-不定形磷酸钙、钙钠磷硅酸及磷酸三钙的优缺点进行了归纳总结。氟化物虽然为最早发现的再矿化物,临床使用也趋近成熟,但氟离子含量不稳定,青少年出现过量中毒、氟牙症等风险仍然存在。釉原蛋白、非釉原蛋白及釉原蛋白肽等仿生材料符合牙釉质矿化生理机制,矿化效果理想,可定向形成高强度釉质,但目前制备工艺尚不完善,制作成本较高,过程相对复杂。磷酸盐类再矿化材料目前也已初步应用于临床,矿化效果尚可,且与氟化物相比生物相容性强,但单纯使用效果不佳,且存在牙石生成风险。釉原蛋白的研究重点在于降低制作成本,或尝试合成合适的替代物。"
| [1] PEPLA E, BESHARAT LK, PALAIA G, et al. Nano-hydroxyapatite and its applications in preventive, restorative and regenerative dentistry: a review of literature. Ann Stomatol (Roma). 2014;5(3):108-114. [2] DALIR AE, ILBEYGI TS, ABDALI DP, et al. Strategies and challenges in the treatment of dental enamel. Cells Tissues Organs. 2023;212(6):485-498. [3] WANG J, LIU Z, REN B, et al. Biomimetic mineralisation systems for in situ enamel restoration inspired by amelogenesis. J Mater Sci Mater Med. 2021;32(9):115. [4] 郭飞扬,花放.正畸釉质脱矿微创治疗的研究进展[J].口腔医学研究,2021,37(4):288-291. [5] PIESIAK-PAŃCZYSZYN D, ZAKRZEWSKI W, PISZKO A, et al. Review on fluoride varnishes currently recommended in dental prophylaxis. Polim Med. 2023;53(2):141-151. [6] HE S, CHOONG E, DUANGTHIP D, et al. Clinical interventions with various agents to prevent early childhood caries: a systematic review with network meta-analysis. Int J Paediatr Dent. 2023;33(5):507-520. [7] HE J, STENHAGEN I, DRAGLAND I S, et al. Preparation of a fluorinated dental resin system and its anti-adhesive properties against S. mutans. Dent Mater. 2023;39(4):402-409. [8] HAMOUDI WK, SHAKIR ZS, ISMAIL RA, et al. The combination of laser and nanoparticles for enamel protection: an in vitro study. J Lasers Med Sci. 2021;12:e82. [9] LUK K, NIU JY, GUTKNECHT N, et al. Preventing enamel caries using carbon dioxide laser and silver diamine fluoride. Photobiomodul Photomed Laser Surg. 2021;39(4):297-302. [10] CASARIN HH, MATTOS VS, DE CASTRO NJ, et al. Chemical and morphological changes of femtosecond laser-irradiated enamel using subablative parameters. Microsc Res Tech. 2021;84(10):2399-2408. [11] SOVERAL M, MACHADO V, BOTELHO J, et al. Effect of resin infiltration on enamel: a systematic review and meta-analysis. J Funct Biomater. 2021;12(3):48. [12] IBRAHIM D, VENKITESWARAN A, HASMUN N N. The penetration depth of resin infiltration into enamel: a systematic review. J Int Soc Prev Community Dent. 2023;13(3):194-207. [13] DAWASAZ AA, TOGOO RA, MAHMOOD Z, et al. Remineralization of dentinal lesions using biomimetic agents: a systematic review and meta-analysis. Biomimetics (Basel). 2023;8(2):159. [14] XU J, SHI H, LUO J, et al. Advanced materials for enamel remineralization. Front Bioeng Biotechnol. 2022;10:985881. [15] YU K, ZHANG Q, DAI Z, et al. Smart dental materials intelligently responding to oral ph to combat caries: a literature review. Polymers (Basel). 2023;15(12):2611. [16] JAYASUDHA, BASWARAJ, Navin KN, et al. Enamel regeneration - current progress and challenges. J Clin Diagn Res. 2014,8(9):E6-E9. [17] 李全利.牙釉质再矿化的过去、现在与未来[J].口腔材料器械杂志, 2023,32(2):77-85. [18] JIN Y, ZHOU J, ZHAO X, et al. When 2D nanomaterials meet biomolecules: design strategies and hybrid nanostructures for bone tissue engineering. J Mater Chem B. 2022;10(44):9040-9053. [19] SMITH CE, HU Y, HU JC, et al. Ultrastructure of early amelogenesis in wild-type, Amelx(-/-), and Enam(-/-) mice: enamel ribbon initiation on dentin mineral and ribbon orientation by ameloblasts. Mol Genet Genomic Med.2016;4(6):662-683. [20] JOKISAARI JR, WANG C, QIAO Q, et al. Particle-attachment-mediated and matrix/lattice-guided enamel apatite crystal growth. ACS Nano. 2019;13(3):3151-3161. [21] RUAN Q, MORADIAN-OLDAK J. Amelogenin and enamel biomimetics. J Mater Chem B. 2015;3:3112-3129. [22] WARSHAWSKY H, JOSEPHSEN K, THYLSTRUP A, et al. The development of enamel structure in rat incisors as compared to the teeth of monkey and man. Anat Rec. 1981;200(4):371-399. [23] PRAJAPATI S, RUAN Q, MUKHERJEE K, et al. The presence of MMP-20 reinforces biomimetic enamel regrowth. J Dent Res. 2018;97(1):84-90. [24] LI H, HU X, ZEN A, et al. Transcriptomic network regulation of rat tooth germ from bell differentiation stage to secretory stage: MAPK signaling pathway is crucial to extracellular matrix remodeling. Biomed Res Int. 2023;2023:4038278. [25] ABDALLA MM, BIJLE MN, ABDALLAH N, et al. Enamel remineralization potential and antimicrobial effect of a fluoride varnish containing calcium strontium silicate. J Dent. 2023;138:104731. [26] WANG H, XIAO Z, YANG J, et al. Oriented and ordered biomimetic remineralization of the surface of demineralized dental enamel using HAP@ACP nanoparticles guided by glycine. Sci Rep. 2017;7:40701. [27] HABELITZ S, BAI Y. Mechanisms of enamel mineralization guided by amelogenin nanoribbons. J Dent Res. 2021;100(13):1434-1443. [28] SHAW WJ, TARASEVICH BJ, BUCHKO GW, et al. Controls of nature: secondary, tertiary, and quaternary structure of the enamel protein amelogenin in solution and on hydroxyapatite. J Struct Biol. 2020; 212(3):107630. [29] ZHONG X, LAI TT, CHEN L, et al. Self-assembly and mineralization of full-length human amelogenin and its functional fragments in vitro. Hua Xi Kou Qiang Yi Xue Za Zhi. 2021;39(4):419-424. [30] BUCHKO GW, JAYASINHA AR, TAO J, et al. Identification of major matrix metalloproteinase-20 proteolytic processing products of murine amelogenin and tyrosine-rich amelogenin peptide using a nuclear magnetic resonance spectroscopy based method. Arch Oral Biol. 2018;93:187-194. [31] KWAK SY, LITMAN A, MARGOLIS HC, et al. Biomimetic enamel regeneration mediated by leucine-rich amelogenin peptide. J Dent Res. 2017;96(5):524-530. [32] SHAFIEI F, HOSSEIN BG, FARAJOLLAHI MM, et al. Leucine-rich amelogenin peptide (LRAP) as a surface primer for biomimetic remineralization of superficial enamel defects: an in vitro study. Scanning. 2015;37(3):179-185. [33] FAN Y, SUN Z, MORADIAN-OLDAK J. Controlled remineralization of enamel in the presence of amelogenin and fluoride. Biomaterials. 2009; 30(4):478-483. [34] 董志红,陈渝,宋慧谨,等.釉原蛋白诱导氟基硅酸钙仿生矿化牙齿性能研究[J].成都大学学报(自然科学版),2019,38(2):130-133. [35] INOUE A, KIYOSHIMA T, YOSHIZAKI K, et al. Deletion of epithelial cell-specific p130Cas impairs the maturation stage of amelogenesis. Bone. 2022; 154:116210. [36] NANCI A, HASHIMOTO J, ZALZAL S, et al. Transient accumulation of proteins at interrod and rod enamel growth sites. Adv Dent Res. 1996; 10(2):135-149. [37] IWATA T, YAMAKOSHI Y, HU JC, et al. Processing of ameloblastin by MMP-20. J Dent Res. 2007;86(2):153-157. [38] FANG Z, GUO M, ZHOU Q, et al. Enamel-like tissue regeneration by using biomimetic enamel matrix proteins. Int J Biol Macromol. 2021; 183:2131-2141. [39] CHU J, FENG X, GUO H, et al. Remineralization efficacy of an amelogenin-based synthetic peptide on carious lesions. Front Physiol. 2018;9:842. [40] LV X, YANG Y, HAN S, et al. Potential of an amelogenin based peptide in promoting reminerlization of initial enamel caries. Arch Oral Biol. 2015; 60(10):1482-1487. [41] KIRKHAM J, FIRTH A, VERNALS D, et al. Self-assembling peptide scaffolds promote enamel remineralization. J Dent Res. 2007;86(5): 426-430. [42] LI Q L, NING TY, CAO Y, et al. A novel self-assembled oligopeptide amphiphile for biomimetic mineralization of enamel. BMC Biotechnol. 2014;14:32. [43] HARTGERINK JD, BENIASH E, STUPP SI. Self-assembly and mineralization of peptide-amphiphile nanofibers. Science. 2001;294(5547):1684-1688. [44] GEBAUER D, GALE JD, CÖLFEN H. Crystal nucleation and growth of inorganic ionic materials from aqueous solution: selected recent developments, and implications. Small. 2022;18(28):e2107735. [45] XIE B, HALTER T J, BORAH B M, et al. Tracking amorphous precursor formation and transformation during induction stages of nucleation. Cryst Growth Des. 2014;14(4):1659-1665. [46] CASTRO RJ, MALTZ M, ARTHUR R A, et al. Anti-caries effect of fluoridated milk-based drink consumed by older adults on an in vitro root caries experimental model. Arch Oral Biol. 2020;118:104878. [47] RAMADOSS R, PADMANABAN R, SUBRAMANIAN B. Role of bioglass in enamel remineralization: existing strategies and future prospects-a narrative review. J Biomed Mater Res B Appl Biomater. 2022;110(1): 45-66. [48] SHEN P, MANTON DJ, COCHRANE NJ, et al. Effect of added calcium phosphate on enamel remineralization by fluoride in a randomized controlled in situ trial. J Dent. 2011;39(7):518-525. [49] INDRAPRIYADHARSHINI K, MADAN K P, SHARMA K, et al. Remineralizing potential of CPP-ACP in white spot lesions - A systematic review. Indian J Dent Res. 2018;29(4):487-496. [50] PRATHIMA GS, NARMATHA M, SELVABALAJI A, et al. Effects of Xylitol and CPP-ACP chewing gum on salivary properties of children with molar incisor hypomineralization. Int J Clin Pediatr Dent. 2021;14(3):412-415. [51] DASHPER SG, CATMULL DV, LIU SW, et al. Casein phosphopeptide-amorphous calcium phosphate reduces streptococcus mutans biofilm development on glass ionomer cement and disrupts established biofilms. PLoS One. 2016;11(9):e162322. [52] HOSIDA TY, PESSAN JP, CAVAZANA TP, et al. Effects of sodium hexametaphosphate and fluoride on the ph and inorganic components of streptococcus mutans and candida albicans biofilm after sucrose exposure. Antibiotics (Basel). 2022;11(8):1044. [53] ERSAN Z, YAZICIOGLU I, SERIN AB, et al. The effects of disinfection with Er, Cr:YSGG laser, application of CPP-ACP and sodium hypochlorite on shear bond strength. Niger J Clin Pract. 2022;25(12):1949-1954. [54] POGGIO C, LOMBARDINI M, VIGORELLI P, et al. Analysis of dentin/enamel remineralization by a CPP-ACP paste: aFM and SEM study. Scanning. 2013; 35(6):366-374. [55] FERNANDO JR, BUTLER CA, ADAMS GG, et al. The prebiotic effect of CPP-ACP sugar-free chewing gum. J Dent. 2019;91:103225. [56] DAI LL, MEI ML, CHU CH, et al. Remineralizing effect of a new strontium-doped bioactive glass and fluoride on demineralized enamel and dentine. J Dent. 2021;108:103633. [57] GJORGIEVSKA ES, NICHOLSON JW. A preliminary study of enamel remineralization by dentifrices based on Recalden (CPP-ACP) and Novamin (calcium-sodium-phosphosilicate). Acta Odontol Latinoam. 2010;23(3):234-239. [58] DIAMANTI I, KOLETSI-KOUNARI H, MAMAI-HOMATA E, et al. Effect of fluoride and of calcium sodium phosphosilicate toothpastes on pre-softened dentin demineralization and remineralization in vitro. J Dent. 2010;38(8):671-677. [59] MAXIMIANO V, MACHADO AC, YOSHIDA ML, et al. Nd:YAG laser and calcium sodium phosphosilicate prophylaxis paste in the treatment of dentin hypersensitivity: a double-blind randomized clinical study. Clin Oral Investig. 2019;23(8):3331-3338. [60] 伍廷芸,王德堂,朱友家,等.不同非含氟护牙剂对牙釉质酸蚀后再矿化效果影响的体内试验[J].中国组织工程研究,2019,23(18): 2842-2846. [61] 隋小玲,刘源,杨燃,等.奥乐V护牙剂对早期釉质龋再矿化作用的研究[J].华西口腔医学杂志,2013,31(2):141-144. [62] AKBABA GB, TÜRKEZ H. Investigation of the genotoxicity of aluminum oxide, β-tricalcium phosphate, and zinc oxide nanoparticles in vitro. Int J Toxicol. 2018;37(3):216-222. [63] BHADORIA N, GUNWAL MK, KUKREJA R, et al. An in vitro evaluation of remineralization potential of functionalized tricalcium phosphate paste and cpp-acpf on artificial white spot lesion in primary and permanent enamel. Int J Clin Pediatr Dent. 2020;13(6):579-584. [64] JANG JH, OH S, KIM HJ, et al. A randomized clinical trial for comparing the efficacy of desensitizing toothpastes on the relief of dentin hypersensitivity. Sci Rep. 2023;13(1):5271. [65] LIMEBACK H, ENAX J, MEYER F. Improving oral health with fluoride-free calcium-phosphate-based biomimetic toothpastes: an update of the clinical evidence. Biomimetics (Basel). 2023;8(4):331. [66] O’HAGAN-WONG K, ENAX J, MEYER F, et al. The use of hydroxyapatite toothpaste to prevent dental caries. Odontology. 2022;110(2):223-230. [67] SINGAL K, SHARDA S, GUPTA A, et al. Effectiveness-of calcium Phosphate derivative agents on the prevention and remineralization of caries among children- A systematic review & meta-analysis of randomized controlled trials. J Evid Based Dent Pract. 2022;22(3):101746. [68] CHENG L, YUAN R, FAN H, et al. The effect of the Er, Cr:YSGG laser combined casein phosphopeptide amorphous calcium phosphate for enamel remineralisation: a systematic review and meta-analysis of in vitro studies. Lasers Med Sci. 2023;38(1):201. [69] BHAT DV, AWCHAT KL, SINGH P, et al. Evaluation of remineralizing potential of CPP-ACP, CPP-ACP + F and β-TCP + F and their effect on microhardness of enamel using vickers microhardness test: an in vitro study. Int J Clin Pediatr Dent. 2022;15(Suppl 2):S221-S225. [70] LI X, YU Z, JIANG S, et al. An amelogenin-based peptide hydrogel promoted the odontogenic differentiation of human dental pulp cells. Regen Biomater. 2022;9:c39. [71] WANG JX, YAN Y, WANG XJ. Clinical evaluation of remineralization potential of casein phosphopeptide amorphous calcium phosphate nanocomplexes for enamel decalcification in orthodontics. Chin Med J (Engl). 2012;125(22):4018-4021. [72] ATTIGUPPE P, MALIK N, BALLAL S, et al. CPP-ACP and fluoride: a synergism to combat caries. Int J Clin Pediatr Dent. 2019;12(2):120-125. |
| [1] | Ma Lisha, He Huiyu, Wufanbieke·Baheti, Lyu Shangyi, Han Xiangzhen. effect of graphene oxide/hydroxyapatite composite coating on immune activity of RAW264.7 macrophages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2023-2029. |
| [2] | Dumanbieke·Amantai, He Huiyu, Han Xiangzhen. Hydroxyapatite-graphene oxide composite coating promotes bone defect repair in rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2030-2037. |
| [3] | Li Zhiyao, Hu Zheng, Li Xuan, Lu Peijun. Effects of enamel adhesives with different components on Porphyromonas gingivalis and Streptococcus mutans [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 329-335. |
| [4] | Xu Yinghua, Liu Jing, You Quan, Wen Zhihao, Gao Lu. Effect of neodymium-doped:yttrium aluminum perovskite laser combined with two kinds of remineralizers on remineralization of early enamel caries [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(3): 360-365. |
| [5] | Meng Maohua, Li Ying, Chen Xin, Cheng Lu, Dong Qiang. Effects and mechanisms of enamel matrix derivatives on osteogenic differentiation of bone marrow mesenchymal stem cells [J]. Chinese Journal of Tissue Engineering Research, 2021, 25(13): 2108-2113. |
| [6] | Yang Liuqing, Xie Lili, Liang Jianmei. The use of epigallocatechin gallate prevents white spot lesions during orthodontic treatment with fixed appliances [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(26): 4141-4145. |
| [7] | Ding Jie, Li Xinying, Li Peng. Stress relaxation and creep test of modified glass ionomer cement [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(22): 3515-3520. |
| [8] | Liu Min, Wang Ruijie, Song Danyang, Yang Sui, Tan Tao, Wang Lei, Wang Yixiang. The C-terminus of the amelogenin peptide promotes the proliferation of ALC ameloblasts through accelerating cell cycle [J]. Chinese Journal of Tissue Engineering Research, 2020, 24(1): 99-105. |
| [9] | Nie Tinghong, Sun Yingchun, Gao Lirong, Song Guanjie. Infiltration resin versus microabrasion technique for repairing white spot lesions after orthodontics [J]. Chinese Journal of Tissue Engineering Research, 2019, 23(22): 3522-3529. |
| [10] | Zhao Yulong, Yang Desheng, Xu Fan, Li Yanfeng. Effects of two toothpastes used at different time on enamel remineralization and acid resistance [J]. Chinese Journal of Tissue Engineering Research, 2018, 22(34): 5490-5495. |
| [11] | Zhu Xi-hua1, Wu Qian-wen2, Huang Hui3 . Effect of enamel matrix proteins on the growth of apatite coating on dual thermo-etching modified titanium [J]. Chinese Journal of Tissue Engineering Research, 2017, 21(2): 249-253. |
| [12] | Zhao Yu-long, Yang De-sheng. Brushing abrasion of eroded enamel using bioactive glass toothpaste in different time after acid etching [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(25): 4022-4026. |
| [13] | Wang Shuang, Feng Pei-xun, Chen Yue, Zhang Hai-juan, Li Sha, Bao Qing-hong, Guan Li-min . Effect of enamel matrix derivatives on the differentiation and proliferation of human periodontal ligament stem cells [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(23): 3716-3722. |
| [14] | Huang Xue-hua, He Ke. Influence of three types of toothbrushes on enamel decalcification in orthodontic patients: a comparative study [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(12): 1832-1836. |
| [15] | Tang Pei-juan, Wang Chang-lei, Gong Chun-mei, Tang Pei-qian, Hao Jian-zhong. c-fos/c-jun regulates extracellular matrix metalloproteinase 20 expression in ameloblasts [J]. Chinese Journal of Tissue Engineering Research, 2015, 19(11): 1673-1677. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||