Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (20): 4341-4350.doi: 10.12307/2025.676
Previous Articles Next Articles
Potential biological mechanisms of exercise-induced improvements in physiological function of patients with multiple sclerosis
Shen Chuang1, Lin Song2, Cheng Ruijuan3
- 1School of Physical Education, 2Department of Science and Technology, Chongqing University of Posts and Telecommunications, Chongqing 400065, China; 3Department of Rheumatology and Immunology, West China Hospital, Sichuan University, Chengdu 610041, Sichuan Province, China
-
Received:2024-07-22Accepted:2024-09-05Online:2025-07-18Published:2024-12-25 -
Contact:Cheng Ruijuan, MD, Attending physician, Department of Rheumatology and Immunology, West China Hospital, Sichuan University, Chengdu 610041, Sichuan Province, China -
About author:Shen Chuang, MS, Lecturer, School of Physical Education, Chongqing University of Posts and Telecommunications, Chongqing 400065, China -
Supported by:the Natural Science Foundation of Sichuan Province, No. 2023NSFSC1752 (to CRJ); the Doctoral Start-up Fund Project of Chongqing University of Posts and Telecommunications, No. A2022-15 (to LS)
CLC Number:
Cite this article
Shen Chuang, Lin Song, Cheng Ruijuan. Potential biological mechanisms of exercise-induced improvements in physiological function of patients with multiple sclerosis[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(20): 4341-4350.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
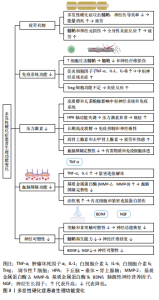
2.2 多发性硬化概述 多发性硬化症是一种慢性中枢神经系统疾病,特征是免疫系统异常攻击神经纤维髓鞘,导致炎症、脱髓鞘和神经元损伤[1]。多发性硬化症的病因尚不完全明确,但通常认为是由遗传易感性和环境因素共同作用引起的[1-2]。多发性硬化症主要影响年轻成人,特别是女性,其发病高峰年龄在20-40岁之间[3]。多发性硬化症的临床表现多种多样,取决于中枢神经系统受损的部位和程度,常见症状包括视觉障碍、肢体无力、感觉异常、共济失调、疲劳、认知障碍和情绪问题[4]。根据疾病的进展模式,多发性硬化症可以分为复发-缓解型、继发进展型、原发进展型和进展-复发型[5]。 多发性硬化症的病理机制主要包括免疫介导的炎症和神经退行性变,自身免疫反应导致T细胞和B细胞穿过血脑屏障,攻击髓鞘和轴突[13-14];炎症递质(如细胞因子和趋化因子)和基质金属蛋白酶破坏血脑屏障的完整性,进一步加剧神经损伤[14];髓鞘的损伤阻碍了神经信号的传导,导致各种神经功能障碍[13];随着疾病的进展,神经元和少突胶质细胞的丧失导致不可逆的神经退行性变[13]。 多发性硬化症的诊断主要依赖于临床表现、MRI和脑脊液检查[4],MRI可以显示中枢神经系统中的病变区域,脑脊液检查则有助于检测炎症标志物[15]。当前,多发性硬化症的治疗目标是减缓疾病进展、减少复发频率和缓解症状[15]。 2.3 多发性硬化症患者生理功能变化 多发性硬化症患者的疲劳机制主要涉及神经传导效率降低、慢性炎症增加及心理和情绪因素。神经传导效率降低由于髓鞘损伤和神经轴突受损,导致神经信号传递延迟,增加了完成任务所需的能量消耗。慢性炎症加重了疲劳感,通过促炎细胞因子的释放和氧化应激导致神经损伤和疾病进展。此外,多发性硬化症患者常受心理问题和生活方式限制影响,如长期静态生活和缺乏运动,进一步加重了他们的疲劳感。图3表示了多发性硬化症患者生理功能变化。 2.3.1 多发性硬化症患者的疲劳机制神经传导效率降低:多发性硬化症是一种自身免疫性疾病,免疫系统攻击中枢神经系统的髓鞘,导致神经传导效率降低,这种神经传导的破坏会导致患者的疲劳感增加。此外,慢性炎症过程也在疲劳的产生中起到了重要作用[16]。在多发性硬化症中,髓鞘的破坏和神经轴突的损伤导致神经传导效率下降,神经信号在传递过程中丧失或延迟,这种神经传导效率的降低意味着患者在完成相同任务时需要耗费更多的能量,导致更快的疲劳[16-17]。 慢性炎症增加:慢性炎症是多发性硬化症的一个主要特征,这种慢性炎症反应不仅导致髓鞘和神经元的损伤,还可能引发全身性炎症反应,进一步加重患者的疲劳感。研究表明,炎症因子的增加(如白细胞介素1、白细胞介素6和肿瘤坏死因子α)与多发性硬化症患者的疲劳程度密切相关[18]。此外,氧化应激对多发性硬化症进展具有重要影响,慢性炎症和氧化应激会加剧神经损伤和疾病进展[19]。 心理和情绪因素:心理和情绪因素在多发性硬化症患者的疲劳中也发挥着重要作用。长期面对疾病的痛苦、焦虑和抑郁等心理问题会加重疲劳感。情绪疲劳与身体疲劳往往相互影响,使得多发性硬化症患者感受到更为严重的疲惫感[20]。多发性硬化症患者常常由于疾病的限制而减少身体活动,生活方式变得更加静态,长时间的久坐和缺乏运动会导致肌肉力量和耐力的下降,进一步加重疲劳感。此外,缺乏规律的运动还会影响患者的心肺功能和整体健康状态,使其更易感到疲劳[21]。 2.3.2 多发性硬化症患者的免疫系统功能下降免疫系统异常激活:在多发性硬化症中,免疫系统错误地将髓鞘视为外来物质进行攻击,导致髓鞘的破坏"
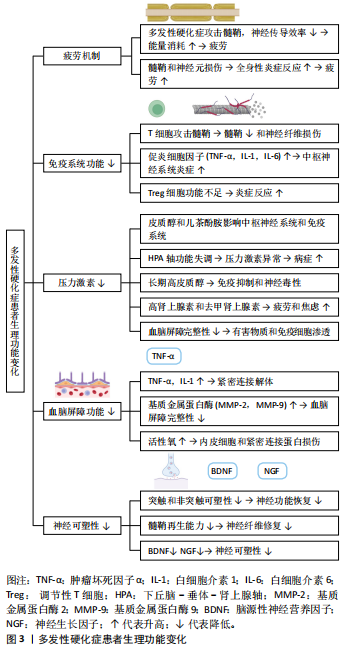
和神经纤维损伤。T细胞在这一过程中起到关键作用[22],正常情况下T细胞在免疫系统中负责识别和攻击病原体,但在多发性硬化症患者中T细胞对髓鞘成分的耐受性减弱,导致其活化并穿过血脑屏障,攻击中枢神经系统中的髓鞘。 炎症反应增强:多发性硬化症患者的免疫系统功能下降还表现为炎症反应的增强。研究表明,多发性硬化症患者体内的促炎细胞因子水平显著升高,如肿瘤坏死因子α、白细胞介素1和白细胞介素6,这些促炎细胞因子不仅直接导致髓鞘和神经元的损伤,还通过进一步激活免疫细胞形成恶性循环,持续加剧中枢神经系统的炎症反应[23]。 免疫调节能力减弱:正常情况下免疫系统具有精细的调节机制,以确保免疫反应的适当性。然而,在多发性硬化症患者中免疫调节能力减弱,表现为调节性T细胞(Treg)和抗炎细胞因子的功能不足。一项研究显示,多发性硬化症患者的调节性T细胞功能受损,导致炎症反应的失控和疾病的进展[24];此外,多发性硬化症患者的抗炎细胞因子水平显著降低,进一步加剧了免疫系统的失衡[24],这些发现强调了Treg细胞和抗炎细胞因子在多发性硬化症免疫调节中的关键作用。另外,Treg细胞在维持免疫耐受性和抑制过度的免疫反应中发挥重要作用,但在多发性硬化症患者中Treg细胞的数量和功能显著降低,导致免疫系统无法有效控制炎症反应[25]。 免疫系统功能下降的机制:多发性硬化症患者免疫系统功能下降的机制复杂多样,包括基因易感性、环境因素和免疫系统自身的异常。基因易感性在多发性硬化症的发生中起到重要作用。研究发现,多种与免疫功能相关的基因变异与多发性硬化症风险增加有关。研究表明,与免疫相关的基因如CD6、CD40、CD58和白细胞介素7受体等基因的变异与多发性硬化症的易感性密切相关[26-27]。 有研究通过贝叶斯框架和组织特异性评估发现了多个与多发性硬化症相关的风险基因,这些基因在不同组织中表现出显著的基因表达差异,进一步支持了这些基因在多发性硬化症发病机制中的重要作用[28]。环境因素如感染、维生素D缺乏和吸烟等也被认为是多发性硬化症发病的诱因[29]。这些因素共同作用,导致免疫系统的异常激活和调节能力的减弱。 2.3.3 多发性硬化症患者的压力激素水平 多发性硬化症患者的压力激素水平在疾病的进展和症状管理中发挥着重要作用。压力激素,如皮质醇和儿茶酚胺(如肾上腺素和去甲肾上腺素),对中枢神经系统和免疫系统都有显著影响[30]。研究表明,多发性硬化症患者的压力激素水平异常可能会加剧疾病症状,影响患者的生活质量[30]。压力激素由下丘脑-垂体-肾上腺轴调控,主要在应对身体的急性和慢性应激反应中发挥作用[31]。压力激素通过多种途径影响中枢神经系统和免疫系统,皮质醇是一种主要的应激激素,具有抗炎和免疫抑制作用,而儿茶酚胺则通过激活交感神经系统提高心率和血压,增强身体的应激反应[31]。 多发性硬化症患者常常面临更高的心理和生理压力,这可能导致下丘脑-垂体-肾上腺轴功能失调,进而影响压力激素水平。研究发现,多发性硬化症患者的皮质醇水平异常升高或波动,这与慢性病程和频繁的疾病复发有关[32]。长期高水平的皮质醇不仅会抑制免疫系统功能,还可能导致神经毒性,加重中枢神经系统的损伤[33]。儿茶酚胺水平变化也在多发性硬化症患者中被检测到,高水平的肾上腺素和去甲肾上腺素可能导致交感神经系统过度激活,加重患者的疲劳感和焦虑情绪,进一步影响疾病的管理和生活质量[34]。 压力激素水平的异常变化对多发性硬化症患者的影响是多方面的:高水平的皮质醇和儿茶酚胺会加重中枢神经系统的炎症反应,导致髓鞘和神经元的进一步损伤[35];长期的应激状态会导致免疫系统功能的失调,降低机体对感染和其他疾病的抵抗力[35];压力激素水平的波动还会影响患者的情绪和认知功能,导致抑郁、焦虑和认知障碍的发生[35]。 2.3.4 多发性硬化症患者的血脑屏障功能下降 在多发性硬化症的发病机制中,血脑屏障功能改变起着至关重要的作用[1]。血脑屏障是中枢神经系统与血液循环系统之间的选择性屏障,负责保护大脑免受有害物质的侵害,并维持神经环境的稳定[1]。 血脑屏障主要由脑微血管内皮细胞、基底膜、星形胶质细胞和紧密连接组成[36]。内皮细胞之间的紧密连接阻止了大部分大分子和细胞进入中枢神经系统,同时允许必要的营养物质和代谢废物通过特定的运输机制进出大脑[36],这些紧密连接确保了大脑环境的稳定性,并对神经系统的健康至关重要。然而,在多发性硬化症患者中,血脑屏障功能常常受到影响,导致其通透性增加,此时内皮细胞的紧密连接可能受到破坏,使得免疫细胞、病原体及其他有害物质可以穿越血脑屏障,进入中枢神经系统[37],这种屏障功能的下降可能导致炎症反应加剧,并对神经组织造成进一步的损伤。 多发性硬化症患者的血脑屏障完整性受到破坏,导致有害物质和免疫细胞渗透进入中枢神经系统,这种屏障功能的损伤主要由炎症递质、基质金属蛋白酶和氧化应激等机制引起。其中,炎症递质(如细胞因子和趋化因子)能够破坏血脑屏障的紧密连接,增加其通透性,例如肿瘤坏死因子α和白细胞介素1水平在多发性硬化症患者中升高,促进内皮细胞的活化和紧密连接的解体[36-38]。基质金属蛋白酶(如基质金属蛋白酶2和基质金属蛋白酶9)水平在多发性硬化症患者中显著增加,这些酶能够降解紧密连接蛋白和基底膜成分,进一步破坏血脑屏障的完整性[38]。氧化应激是多发性硬化症病理过程中的一个重要因素,活性氧的增加能够损伤内皮细胞和紧密连接蛋白,导致血脑屏障的通透性增加[38]。另外,血脑屏障功能障碍的直接后果是免疫细胞(如T细胞和B细胞)和血清成分(如补体蛋白)能够进入中枢神经系统,导致炎症反应和髓鞘损伤[39],这种免疫介导的攻击不仅加重了神经元损伤,还进一步破坏血脑屏障的完整性,形成一个恶性循环[39-40]。 2.3.5 多发性硬化症患者的神经可塑性下降 神经可塑性指的是中枢神经系统在面对损伤或功能障碍时,通过结构和功能的改变来适应和恢复的能力[41]。对于多发性硬化症患者来说,神经可塑性是一个关键的保护机制,能够部分抵消髓鞘和神经元损伤带来的负面影响,提高患者的功能恢复和生活质量[41]。 神经可塑性包括突触可塑性和非突触可塑性[42-43]。突触可塑性是指突触连接强度和数量的变化,而非突触可塑性则涉及神经元和胶质细胞的结构变化及新生神经元的生成[42]。在多发性硬化症患者中,突触可塑性可以通过突触重组和新突触形成来补偿损伤[42-44]。长时程增强和长时程抑制是突触可塑性的两种主要形式,在学习和记忆过程中发挥重要作用[45]。非突触可塑性包括神经元轴突的再生和髓鞘的再生[43]。髓鞘再生(或称髓鞘重建)是由少突胶质细胞前体细胞分化为成熟少突胶质细胞,并形成新的髓鞘来修复受损的神经纤维[43]。具体来说,少突胶质细胞前体细胞会增殖并迁移到损伤部位,随后经历一系列的分化过程,转变为成熟的少突胶质细胞,而成熟的少突胶质细胞能够产生新的髓鞘,这种髓鞘覆盖在神经纤维的轴突上,为神经信号传导提供绝缘保护[46]。新的髓鞘不仅有助于恢复神经纤维的功能,还能提升神经系统的整体传导效率[47]。髓鞘再生对于神经系统的修复和功能恢复具有重要意义。 神经可塑性在多发性硬化症患者的恢复过程中起着至关重要作用。尽管多发性硬化症患者的中枢神经系统受到广泛的炎症和脱髓鞘损伤,但神经可塑性机制能够在一定程度上促进功能恢复[48],神经营养因子(如脑源性神经营养因子、神经生长因子)在神经可塑性中发挥关键作用[49]。研究表明,脑源性神经营养因子水平的增加与多发性硬化症患者的认知和运动功能改善密切相关[49]。 2.4 运动对多发性硬化症患者生理功能的改善机制 运动对多发性硬化症患者有多方面积极影响:①适度持续的运动有助于减缓疲劳感,挑战了传统观念认为运动可能加剧疲劳的观点;②运动通过调节细胞因子如白细胞介素6、干扰素γ等增强免疫系统功能,减少炎症因子的释放,有助于免疫平衡,但不同类型和强度运动的具体调节机制仍需进一步探索;③运动也可能通过调节压力激素水平、改变Th2细胞因子来减少脱髓鞘过程;④运动还改善了血脑屏障功能,提升了抗氧化能力并降低炎症因子水平,但其长期影响仍需进一步验证;⑤运动对多发性硬化症患者的神经可塑性有益,改善了大脑结构、功能和连接性,显著提升了身体和认知表现,但关于最佳运动类型和强度的研究仍在探索中。图4展示了运动对多发性硬化症患者生理影响的机制。 2.4.1 运动延缓多发性硬化症患者的疲劳 研究显示,运动对多发性硬化症患者的影响因个体耐受能力和运动强度的不同而异。适当强度的运动通常不会引起疲劳感的增加,反而有助于管理和缓解疲劳[50];然而,当运动强度或运动量超过患者的耐受能力时可能会加重疲劳感[51],这一发现挑战了运动可能加剧多发性硬化症患者疲劳的单一假设。造成多发性硬化症患者在运动中感到疲劳的原因众多,其中一个关键因素是多发性硬化症患者通常生活较为不活跃,并且会在家中静坐较长时间[52]。长时间的不活动不仅可能增加患者在后续运动时的疲劳感,还可能降低他们的整体体能表现[53]。具体来说,缺乏运动导致体能下降,会使得多发性硬化症患者在进行日常活动时更加容易感到疲劳,这种疲劳感与运动强度和类型的关系密切[53]。研究表明,不同类型运动对多发性硬化症患者生理功能具有不同的影响,例如:有氧运动(如步行、游泳和骑自行车)可以增强心血管健康,改善耐力和体能[54];力量训练(如举重和阻力训练)则有助于增强肌肉力量和耐力,同时改善关节的稳定性[55]。柔韧性训练(如瑜伽和拉伸)可以提高灵活性,减少运动过程中由于肌肉紧张导致的疲劳感[56]。每种类型的运动在改善多发性硬化症患者生理功能方面发挥了不同的作用,因此,结合这些运动类型可能会带来更好的效果。"
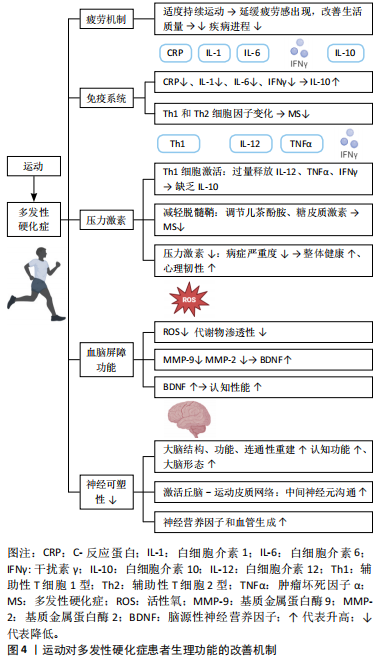

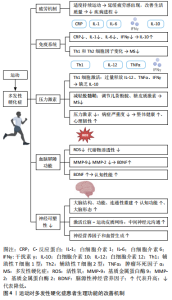
关于运动强度,低强度的运动,如缓步走和简单的拉伸运动,对于刚开始运动的多发性硬化症患者较为适合,可以减少运动中的不适感和疲劳[57];中等强度的运动,如中速跑步或健身操,可以有效提升体能和耐力;而高强度的运动,如高强度间歇训练,虽然对体能要求较高,但在逐渐适应后能显著改善患者的心肺功能和整体体能。适当的运动强度应根据个体的身体状况和耐受能力来调整,以避免过度疲劳[58]。另一方面,持续参与运动可以促使多发性硬化症患者逐渐适应,进而有效延缓疲劳感的出现[8]。以上结果说明,适度并持续的运动对于多发性硬化症患者来说是一种重要的非药物治疗方式,能够改善生活质量并减缓疾病进程。 综上所述,运动可延缓多发性硬化症患者的疲劳感,但后续研究应集中于探索不同类型和强度运动对多发性硬化症患者疲劳管理的具体效果,以及如何制定个性化的运动计划,以最大化其益处。 2.4.2 运动通过细胞因子调节强化多发性硬化症患者的免疫系统功能 运动通过调节和调控细胞因子增强免疫系统功能[59]。SMITH等[9]研究了为期6个月有氧训练对多发性硬化症患者干扰素γ细胞因子分泌的影响,发现患者干扰素γ水平有所下降,表明有氧训练能够有效降低炎症因子水平。有研究发现为期12周的阻力训练对多发性硬化症患者的白细胞介素6水平也有显著影响,观察到白细胞介素6水平下降[60],进一步支持了运动在调节炎症因子方面的积极作用。短期运动已被证明通过调节细胞因子(如C-反应蛋白、白细胞介素1、白细胞介素6、干扰素γ)来维持免疫平衡,同时增加白细胞介素10的水平[61],说明运动可以通过多种途径改善免疫系统功能。然而,尚不清楚不同类型和强度运动对细胞因子的具体调节机制,因此,后续研究应集中于探讨不同运动方式对免疫调节的详细机制和长期效果。 细胞因子调节可能对多发性硬化症的预防和治疗具有重要意义[62]。短期运动通过细胞因子的释放诱导免疫系统的平衡,帮助应对过程中发生的免疫系统紊乱[63]。研究表明,规律的有氧运动会引起Th1和Th2家族细胞因子水平的变化,可能有助于多发性硬化症的治疗和控制[64]。然而,这种调节机制尚未完全证实,需进一步探讨这些细胞因子在运动调节中的具体作用机制和临床意义,将有助于制定更加有效的多发性硬化症治疗方案。 总之,运动能够通过调节细胞因子(如白细胞介素6、干扰素γ、C-反应蛋白等)来增强免疫系统功能,对多发性硬化症患者有积极作用。不同类型的运动(如有氧训练、阻力训练)能够降低炎症因子的水平,维持免疫平衡,然而,不同类型和强度运动对细胞因子的具体调节机制尚不明确,需要进一步研究。 2.4.3 运动调节多发性硬化症患者的压力激素水平 在多发性硬化症中内分泌腺和免疫系统之间存在复杂的关系[65]。多发性硬化症的病理机制涉及Th1细胞的激活,导致白细胞介素12、肿瘤坏死因子α和干扰素γ的过量释放以及白细胞介素10的缺乏[66],然而尚不清楚具体的调节机制。运动调节多发性硬化症患者的压力激素水平受到轴刺激及其对免疫系统的影响[67],压力激素可以通过改变Th2细胞因子来减少多发性硬化症中的脱髓鞘[68],表明压力激素在多发性硬化症的免疫调节中可能发挥着重要作用。细胞因子亦在免疫反应中至关重要,并受到激素和神经因素的影响。儿茶酚胺和糖皮质激素这两种类型的压力激素在细胞因子的生产和释放中尤为重要,压力激素调节系统可以影响免疫系统,调节这些压力激素可以通过调节Th2细胞因子来减少多发性硬化症中的脱髓鞘程度[69]。 运动也可以通过调节压力激素来影响多发性硬化症的进程。有研究表明,运动能够显著减少与压力相关的激素水平,从而减轻疾病症状的严重程度[10]。运动不仅能直接减少压力,还能通过提高整体身体健康和心理韧性,间接地改善多发性硬化症患者的生活质量和疾病进程[10]。 总体而言,在多发性硬化症中,内分泌腺和免疫系统之间存在复杂关系,涉及Th1细胞的激活,导致白细胞介素12、肿瘤坏死因子α和干扰素γ的过量释放及白细胞介素10的缺乏,但具体调节机制尚不清楚。压力激素在多发性硬化症的免疫调节中可能发挥重要作用,而运动能显著减少与压力相关的激素水平,减轻多发性硬化症症状。然而,当前对运动调节多发性硬化症患者压力激素水平的研究较少,需进一步探索运动干预的优化方案。 2.4.4 运动改善多发性硬化症患者的血脑屏障功能 研究表明,运动对改善多发性硬化症患者的血脑屏障功能具有潜在益处[70]。定期高强度间歇运动提高了抗氧化能力,并减少了活性氧物种的水平[11]。高强度间歇训练可显著降低多发性硬化症患者血脑屏障生理指标基质金属蛋白酶2和基质金属蛋白酶9的表达[71]。在炎症过程中起重要作用的生理因素如基质金属蛋白酶2,可能因运动的抗炎特性而减少[71]。多发性硬化症导致患者血脑屏障的渗透性发生了变化,运动可以减少参与这一过程的因素(如基质金属蛋白酶2),从而改善患者认知功能[71]。 运动还能够增加神经营养因子的水平(如脑源性神经营养因子)改善多发性硬化症患者认知性能[72],然而,尚不清楚运动强度和持续时间对多发性硬化症患者神经营养因子水平的具体影响,因此,后续研究应集中于探讨不同运动方案对脑源性神经营养因子等神经营养因子的影响。研究表明,水中运动可降低儿茶酚胺水平,证实了运动对交感和副交感状态的影响[73],说明运动不仅有助于改善血脑屏障功能,还可能通过调节神经递质水平改善多发性硬化症患者的整体健康状态。 运动、炎症、身体代谢状态和体质量等因素均能够影响神经营养因子(如脑源性神经营养因子)的表达水平[70]。在许多神经疾病如阿尔茨海默病、帕金森病、多发性硬化症和亨廷顿病中,患者大脑中发生了大量的神经退行性病变,伴随着神经元核和神经元结构的死亡[74]。许多研究表明,体力活动和丰富环境(如营养或认知干预的结合)可以帮助减少、抑制或延缓神经退行性疾病的进展[75]。此外,脑源性神经营养因子在保护这些神经元方面非常重要。自然干预,如运动、激素平衡(如皮质醇和睾酮等类固醇激素)和营养干预(如禁食、低热量摄入、低碳水化合物饮食、选择性营养摄入)可以增加神经营养因子水平,有助于大脑的可塑性[76]。因此,未来研究应进一步探索这些干预方法对改善多发性硬化症患者的神经保护效果及潜在机制。 综上所述,运动能够改善多发性硬化症患者的血脑屏障功能,主要表现在提高了抗氧化能力、减少活性氧水平、降低基质金属蛋白酶2和基质金属蛋白酶9等血脑屏障生理指标,从而改善患者认知功能。然而,尚不清楚上述情况是否对多发性硬化症患者的长期健康产生积极影响。运动还可以增加脑源性神经营养因子的水平,进一步改善多发性硬化症患者的认知性能,但运动的强度和持续时间对脑源性神经营养因子具体影响有待进一步研究。运动还能够通过调节神经递质水平、炎症过程和代谢状态,整体改善多发性硬化症患者的健康状况。 2.4.5 运动改善多发性硬化症患者的神经可塑性 运动对多发性硬化症患者的中枢神经具有显著的有益影响[12,77]。DE LUIGI等[78]研究表明,长期步行对多发性硬化症患者的认知功能和大脑形态有积极影响,说明运动在改善认知功能方面具有显著效果。JI等[79-80]通过成像技术研究发现运动能够有效诱导大脑变化,表明运动通过激活不同的脑区显著改善脑功能。运动还会激活丘脑-运动皮质网络,改善中间神经元的沟通,并与大脑结构和分子/细胞水平的变化有关,如多发性硬化症患者神经营养因子和血管生成的增加[81]。然而,尚不清楚哪些运动类型和强度对多发性硬化症患者群体效果最佳。因此,后续研究应集中于探索不同运动方案对多发性硬化症患者神经可塑性的具体影响,以及如何优化这些方案以最大化治疗效果。"

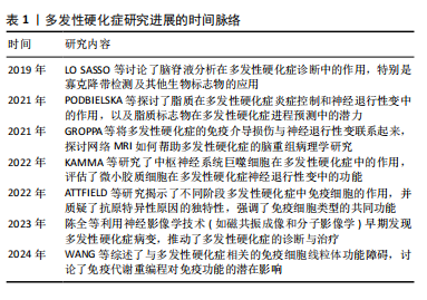
| [1] ATTFIELD KE, JENSEN LT, KAUFMANN M, et al. The immunology of multiple sclerosis. Nat Rev Immunol. 2022;22(12):734-750. [2] WANG PF, JIANG F, ZENG QM, et al. Mitochondrial and metabolic dysfunction of peripheral immune cells in multiple sclerosis. J Neuroinflammation. 2024;21(1):28. [3] RANSOHOFF RM. Immune-cell crosstalk in multiple sclerosis. Nature. 2018;563(7730):194-195. [4] 陈全,彭永,甘棋心,等.多发性硬化的影像学研究进展[J].国际神经病学神经外科学杂志,2023,50(3):91-96. [5] GROPPA S, GONZALEZ-ESCAMILLA G, ESHAGHI A, et al. Linking immune-mediated damage to neurodegeneration in multiple sclerosis: could network-based MRI help? Brain Commun. 2021;3(4):fcab237. [6] FRIESE MA, JAKOBSEN KB, FRIIS L, et al. Opposing effects of HLA class I molecules in tuning autoreactive CD8+ T cells in multiple sclerosis. Nat Med. 2008;14(11):1227-1235. [7] GHAZIPURA M, MACREA M, HERMAN D, et al. Tocilizumab in Patients with Systemic Sclerosis-associated Interstitial Lung Disease: A Systematic Review and Meta-Analysis. Ann Am Thorac Soc. 2024; 21(2):328-337. [8] DALGAS U, LANGESKOV-CHRISTENSEN M, STENAGER E, et al. Exercise as Medicine in Multiple Sclerosis-Time for a Paradigm Shift: Preventive, Symptomatic, and Disease-Modifying Aspects and Perspectives. Curr Neurol Neurosci Rep. 2019;19(11):88. [9] SMITH JK, DYKES R, CHI DS. The Effect of Long-Term Exercise on the Production of Osteoclastogenic and Antiosteoclastogenic Cytokines by Peripheral Blood Mononuclear Cells and on Serum Markers of Bone Metabolism. J Osteoporos. 2016;2016:5925380. [10] NIGHTINGALE S, FANNING J, ROBISON J. Bi-directional relationships between physical activity and stress in college aged students: a brief report. J Behav Med. 2024;47(1):153-159. [11] BOGDANIS GC, STAVRINOU P, FATOUROS IG, et al. Short-term high-intensity interval exercise training attenuates oxidative stress responses and improves antioxidant status in healthy humans. Food Chem Toxicol. 2013;61:171-177. [12] GUO LY, LOZINSKI B, YONG VW. Exercise in multiple sclerosis and its models: Focus on the central nervous system outcomes. J Neurosci Res. 2020;98(3):509-523. [13] PODBIELSKA M, O’KEEFFE J, POKRYSZKO-DRAGAN A. New Insights into Multiple Sclerosis Mechanisms: Lipids on the Track to Control Inflammation and Neurodegeneration. Int J Mol Sci. 2021;22(14):7319. [14] KAMMA E, LASISI W, LIBNER C, et al. Central nervous system macrophages in progressive multiple sclerosis: relationship to neurodegeneration and therapeutics. J Neuroinflammation. 2022; 19(1):45. [15] LO SASSO B, AGNELLO L, BIVONA G, et al. Cerebrospinal Fluid Analysis in Multiple Sclerosis Diagnosis: An Update. Medicina (Kaunas). 2019; 55(6):245. [16] MANJALY ZM, HARRISON NA, CRITCHLEY HD, et al. Pathophysiological and cognitive mechanisms of fatigue in multiple sclerosis. J Neurol Neurosurg Psychiatry. 2019;90(6):642-651. [17] BRALEY TJ, CHERVIN RD. Fatigue in multiple sclerosis: mechanisms, evaluation, and treatment. Sleep. 2010;33(8):1061-1067. [18] OLIVA RAMIREZ A, KEENAN A, KALAU O, et al. Prevalence and burden of multiple sclerosis-related fatigue: a systematic literature review. BMC Neurol. 2021;21(1):468. [19] KONG J, FAN R, ZHANG Y, et al. Oxidative stress in the brain-lung crosstalk: cellular and molecular perspectives. Front Aging Neurosci. 2024;16:1389454. [20] MORDILLO-MATEOS L, SOTO-LEON V, TORRES-PAREJA M, et al. Fatigue in Multiple Sclerosis: General and Perceived Fatigue Does Not Depend on Corticospinal Tract Dysfunction. Front Neurol. 2019;10:339. [21] KOTTERBA S, NEUSSER T, NORENBERG C, et al. Sleep quality, daytime sleepiness, fatigue, and quality of life in patients with multiple sclerosis treated with interferon beta-1b: results from a prospective observational cohort study. BMC Neurol. 2018;18(1):123. [22] ZHONG Y, STAUSS HJ. Targeted Therapy of Multiple Sclerosis: A Case for Antigen-Specific Tregs. Cells. 2024;13(10):797. [23] GOVINDARAJAN V, DE RIVERO VACCARI JP, KEANE RW. Role of inflammasomes in multiple sclerosis and their potential as therapeutic targets. J Neuroinflammation. 2020;17(1):260. [24] KNOX T, SAHAKIAN E, BANIK D, et al. Selective HDAC6 inhibitors improve anti-PD-1 immune checkpoint blockade therapy by decreasing the anti-inflammatory phenotype of macrophages and down-regulation of immunosuppressive proteins in tumor cells. Sci Rep. 2019;9(1):6136. [25] RASOULI J, CIRIC B, IMITOLA J, et al. Expression of GM-CSF in T Cells Is Increased in Multiple Sclerosis and Suppressed by IFN-β Therapy. J Immunol. 2015;194(11):5085-5093. [26] PARNELL GP, BOOTH DR. The Multiple Sclerosis (MS) Genetic Risk Factors Indicate both Acquired and Innate Immune Cell Subsets Contribute to MS Pathogenesis and Identify Novel Therapeutic Opportunities. Front Immunol. 2017;8:425. [27] GOODIN DS, KHANKHANIAN P, GOURRAUD PA, et al. Genetic susceptibility to multiple sclerosis: interactions between conserved extended haplotypes of the MHC and other susceptibility regions. BMC Med Genomics. 2021;14(1):183. [28] LIU A, MANUEL AM, DAI Y, et al. Prioritization of risk genes in multiple sclerosis by a refined Bayesian framework followed by tissue-specificity and cell type feature assessment. BMC Genomics. 2022;23(Suppl 4): 362. [29] 李瑾,潘頔,刘雅微,等.多发性硬化的表观遗传学研究进展[J].中国免疫学杂志,2023,39(8):1759-1762. [30] BRASANAC J, HETZER S, ASSEYER S, et al. Central stress processing, T-cell responsivity to stress hormones and disease severity in multiple sclerosis. Brain Commun. 2022;4(2):fcac086. [31] BURFORD NG, WEBSTER NA, CRUZ-TOPETE D. Hypothalamic-Pituitary-Adrenal Axis Modulation of Glucocorticoids in the Cardiovascular System. Int J Mol Sci. 2017;18(10):2150. [32] SCHEFFER M, BECKER J, DE AZEREDO LA, et al. Subjective and physiological stress measurement in a multiple sclerosis sample and the relation with executive functions performance. J Neural Transm (Vienna). 2019;126(5):613-622. [33] TAPP ZM, GODBOUT JP, KOKIKO-COCHRAN ON. A Tilted Axis: Maladaptive Inflammation and HPA Axis Dysfunction Contribute to Consequences of TBI. Front Neurol. 2019;10:345. [34] BASTOS DB, SARAFIM-SILVA BAM, SUNDEFELD M, et al. Circulating catecholamines are associated with biobehavioral factors and anxiety symptoms in head and neck cancer patients. PLoS One. 2018; 13(8):e0202515. [35] CHEN Q, WANG L, ZHANG Y, et al. Corneal Epithelial Dendritic Cells: An Objective Indicator for Ocular Surface Inflammation in Patients with Obstructive Meibomian Gland Dysfunction? Ocul Immunol Inflamm. 2024;32(1):79-88. [36] HAWKINS BT, LUNDEEN TF, NORWOOD KM, et al. Increased blood-brain barrier permeability and altered tight junctions in experimental diabetes in the rat: contribution of hyperglycaemia and matrix metalloproteinases. Diabetologia. 2007;50(1):202-211. [37] ZIERFUSS B, LAROCHELLE C, PRAT A. Blood-brain barrier dysfunction in multiple sclerosis: causes, consequences, and potential effects of therapies. Lancet Neurol. 2024;23(1):95-109. [38] STAMATOVIC SM, SHAKUI P, KEEP RF, et al. Monocyte chemoattractant protein-1 regulation of blood-brain barrier permeability. J Cereb Blood Flow Metab. 2005;25(5):593-606. [39] GREENE C, HANLEY N, CAMPBELL M. Claudin-5: gatekeeper of neurological function. Fluids Barriers CNS. 2019;16(1):3. [40] TAKATA F, NAKAGAWA S, MATSUMOTO J, et al. Blood-Brain Barrier Dysfunction Amplifies the Development of Neuroinflammation: Understanding of Cellular Events in Brain Microvascular Endothelial Cells for Prevention and Treatment of BBB Dysfunction. Front Cell Neurosci. 2021;15:661838. [41] PELLETIER R, HIGGINS J, BOURBONNAIS D. Is neuroplasticity in the central nervous system the missing link to our understanding of chronic musculoskeletal disorders? BMC Musculoskelet Disord. 2015;16:25. [42] HANSEL C, LINDEN DJ, D’ANGELO E. Beyond parallel fiber LTD: the diversity of synaptic and non-synaptic plasticity in the cerebellum. Nat Neurosci. 2001;4(5):467-475. [43] EMERY B, AGALLIU D, CAHOY JD, et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 2009;138(1):172-185. [44] FERRAND R, BARONIG M, UNGER F, et al. Non-synaptic plasticity enables memory-dependent local learning. bioRxiv. 2023. doi.org/10.1101/2023.11.14.567001. [45] 孔健达,朱磊.长时程增强相关代谢产物的作用机制及其运动效应[J].神经解剖学杂志,2023,39(6):733-736. [46] XIA W, FANCY SPJ. Mechanisms of oligodendrocyte progenitor developmental migration. Dev Neurobiol. 2021;81(8):985-996. [47] ZHOU Y, ZHANG J. Neuronal activity and remyelination: new insights into the molecular mechanisms and therapeutic advancements. Front Cell Dev Biol. 2023;11:1221890. [48] NOCITI V, ROMOZZI M. The Role of BDNF in Multiple Sclerosis Neuroinflammation. Int J Mol Sci. 2023;24(9):8447. [49] KSIAZEK-WINIAREK DJ, SZPAKOWSKI P, GLABINSKI A. Neural Plasticity in Multiple Sclerosis: The Functional and Molecular Background. Neural Plast. 2015;2015:307175. [50] WENDER CLA, MANNINEN M, O’CONNOR PJ. The Effect of Chronic Exercise on Energy and Fatigue States: A Systematic Review and Meta-Analysis of Randomized Trials. Front Psychol. 2022;13:907637. [51] RAZAZIAN N, KAZEMINIA M, MOAYEDI H, et al. The impact of physical exercise on the fatigue symptoms in patients with multiple sclerosis: a systematic review and meta-analysis. BMC Neurol. 2020;20(1):93. [52] MACDONALD E, BUCHAN D, CEREXHE L, et al. Accelerometer measured physical activity and sedentary time in individuals with multiple sclerosis versus age matched controls: A systematic review and meta-analysis. Mult Scler Relat Disord. 2023;69:104462. [53] HALABCHI F, ALIZADEH Z, SAHRAIAN MA, et al. Exercise prescription for patients with multiple sclerosis; potential benefits and practical recommendations. BMC Neurol. 2017;17(1):185. [54] PROSCHINGER S, KUHWAND P, RADEMACHER A, et al. Fitness, physical activity, and exercise in multiple sclerosis: a systematic review on current evidence for interactions with disease activity and progression. J Neurol. 2022;269(6):2922-2940. [55] MANCA A, DVIR Z, DRAGONE D, et al. Time course of strength adaptations following high-intensity resistance training in individuals with multiple sclerosis. Eur J Appl Physiol. 2017;117(4):731-743.
[56] FASCZEWSKI KS, GARNER LM, CLARK LA, et al. Medical Therapeutic Yoga for multiple sclerosis: examining self-efficacy for physical activity, motivation for physical activity, and quality of life outcomes. Disabil Rehabil. 2022;44(1):106-113. [57] REYNOLDS ER, ASHBAUGH AD, HOCKENBERRY BJ, et al. Multiple Sclerosis and Exercise: A Literature Review. Curr Sports Med Rep. 2018;17(1):31-35. [58] KEMI OJ, HARAM PM, LOENNECHEN JP, et al. Moderate vs. high exercise intensity: differential effects on aerobic fitness, cardiomyocyte contractility, and endothelial function. Cardiovasc Res. 2005;67(1):161-172. [59] FARAMARZI M, BANITALEBI E, RAISI Z, et al. Effect of combined exercise training on pentraxins and pro- inflammatory cytokines in people with multiple sclerosis as a function of disability status. Cytokine. 2020;134:155196. [60] MOGHADASI M, EDALATMANESH M, MOEINI A, et al. Effect of 8 weeks resistance training on plasma levels of nerve growth factor and interlukin-6 in female patients with multiple sclerosis. 2015;18(3):527-537. [61] AFZAL R, DOWLING JK, MCCOY CE. Impact of Exercise on Immunometabolism in Multiple Sclerosis. J Clin Med. 2020;9(9):3038. [62] ASANO M, FINLAYSON ML. Meta-analysis of three different types of fatigue management interventions for people with multiple sclerosis: exercise, education, and medication. Mult Scler Int. 2014;2014:798285. [63] FASCZEWSKI KS, GILL DL, ROTHBERGER SM. Physical activity motivation and benefits in people with multiple sclerosis. Disabil Rehabil. 2018; 40(13):1517-1523. [64] PAU M, PORTA M, COGHE G, et al. Does Multiple Sclerosis Differently Impact Physical Activity in Women and Man? A Quantitative Study Based on Wearable Accelerometers. Int J Environ Res Public Health. 2020;17(23):8848. [65] MOYNIHAN J, MOORE H. Endocrine system dynamics and MS epidemiology. Med Hypotheses. 2010;74(5):814-817. [66] KASKOW BJ, BAECHER-ALLAN C. Effector T Cells in Multiple Sclerosis. Cold Spring Harb Perspect Med. 2018;8(4):a029025. [67] YSRRAELIT MC, GAITÁN MI, LOPEZ AS, et al. Impaired hypothalamic-pituitary-adrenal axis activity in patients with multiple sclerosis. Neurology. 2008;71(24):1948-1954. [68] KARAGKOUNI A, ALEVIZOS M, THEOHARIDES TC. Effect of stress on brain inflammation and multiple sclerosis. Autoimmun Rev. 2013; 12(10):947-953. [69] DECKX N, LEE WP, BERNEMAN ZN, et al. Neuroendocrine immunoregulation in multiple sclerosis. Clin Dev Immunol. 2013; 2013:705232. [70] MOKHTARZADE M, MOTL R, NEGARESH R, et al. Exercise-induced changes in neurotrophic factors and markers of blood-brain barrier permeability are moderated by weight status in multiple sclerosis. Neuropeptides. 2018;70:93-100. [71] ZIMMER P, BLOCH W, SCHENK A, et al. High-intensity interval exercise improves cognitive performance and reduces matrix metalloproteinases-2 serum levels in persons with multiple sclerosis: A randomized controlled trial. Mult Scler. 2018;24(12):1635-1644. [72] SHOBEIRI P, KARIMI A, MOMTAZMANESH S, et al. Exercise-induced increase in blood-based brain-derived neurotrophic factor (BDNF) in people with multiple sclerosis: A systematic review and meta-analysis of exercise intervention trials. PLoS One. 2022;17(3):e0264557. [73] BANSI J, BLOCH W, GAMPER U, et al. Training in MS: influence of two different endurance training protocols (aquatic versus overland) on cytokine and neurotrophin concentrations during three week randomized controlled trial. Mult Scler. 2013;19(5):613-621. [74] MANOHARAN S, GUILLEMIN GJ, ABIRAMASUNDARI RS, et al. The Role of Reactive Oxygen Species in the Pathogenesis of Alzheimer’s Disease, Parkinson’s Disease, and Huntington’s Disease: A Mini Review. Oxid Med Cell Longev. 2016;2016:8590578. [75] BHATTI GK, REDDY AP, REDDY PH, et al. Lifestyle Modifications and Nutritional Interventions in Aging-Associated Cognitive Decline and Alzheimer’s Disease. Front Aging Neurosci. 2019;11:369. [76] WATERHOUSE EG, XU B. New insights into the role of brain-derived neurotrophic factor in synaptic plasticity. Mol Cell Neurosci. 2009; 42(2):81-89. [77] WHITE LJ, CASTELLANO V. Exercise and brain health--implications for multiple sclerosis: Part 1--neuronal growth factors. Sports Med. 2008;38(2):91-100. [78] DE LUIGI AJ, BELL KR, BRAMHALL JP, et al. Consensus statement: An evidence-based review of exercise, rehabilitation, rest, and return to activity protocols for the treatment of concussion and mild traumatic brain injury. PM R. 2023;15(12):1605-1642. [79] JI L, STEFFENS DC, WANG L. Effects of physical exercise on the aging brain across imaging modalities: A meta-analysis of neuroimaging studies in randomized controlled trials. Int J Geriatr Psychiatry. 2021; 36(8):1148-1157. [80] RASOVA K, PROCHAZKOVA M, TINTERA J, et al. Motor programme activating therapy influences adaptive brain functions in multiple sclerosis: clinical and MRI study. Int J Rehabil Res. 2015;38(1):49-54. [81] DIECHMANN MD, CAMPBELL E, COULTER E, et al. Effects of Exercise Training on Neurotrophic Factors and Subsequent Neuroprotection in Persons with Multiple Sclerosis-A Systematic Review and Meta-Analysis. Brain Sci. 2021;11(11):1499. |
| [1] | Sun Yundi, Cheng Lulu, Wan Haili, Chang Ying, Xiong Wenjuan, Xia Yuan. Effect of neuromuscular exercise for knee osteoarthritis pain and function: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(9): 1945-1952. |
| [2] | Wang Qiuyue, Jin Pan, Pu Rui . Exercise intervention and the role of pyroptosis in osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1667-1675. |
| [3] | Wang Juan, Wang Guanglan, Zuo Huiwu. Efficacy of exercise therapy in the treatment of anterior cruciate ligament reconstruction patients: #br# a network meta-analysis #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1714-1726. |
| [4] | Zheng Huakun, Yin Mingyue, Liu Qian. Effects of interval and continuous training on the quality of life in physically inactive adults: a meta-analysis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(8): 1727-1740. |
| [5] | Lou Guo, Zhang Min, Fu Changxi. Exercise preconditioning for eight weeks enhances therapeutic effect of adipose-derived stem cells in rats with myocardial infarction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1363-1370. |
| [6] | Zheng Rongfa, Mo Weibin, Huang Peng, Chen Junji, Liang Ting, Zi Fangyu, Li Guofeng. Effects of electroacupuncture on the expression of metabolic enzymes and autophagy genes in gastrocnemius muscle tissues of exercising rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1127-1136. |
| [7] | Zhao Xiaoxuan, Liu Shuaiyi, Li Qi, Xing Zheng, Li Qingwen, Chu Xiaolei. Different exercise modalities promote functional recovery after peripheral nerve injury [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1248-1256. |
| [8] | Chen Yilin, Jiang Xiaobo, Qu Honglin, Liu Ruilian. General pattern of GSK3/Nrf2-regulated biological rhythms in organismal aging [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1257-1264. |
| [9] | Zhang Wenhua, Li Xun, Zhang Weichao, Li Xinying, Ma Guoao, Wang Xiaoqiang . Promoting myogenesis based on the SphK1/S1P/S1PR2 signaling pathway: a new perspective on improving skeletal muscle health through exercise [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1265-1275. |
| [10] | Ma Haoyu, Qiao Hongchao, Hao Qianqian, Shi Dongbo. Causal effects of different exercise intensities on the risk of osteoarthritis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(6): 1305-1311. |
| [11] | Wang Dongyang, Yang Qiaohui, Lin Xinchao. Relationship between vitamin D levels and reproductive characteristics and exercise dietary situation in postmenopausal women [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 1021-1025. |
| [12] | Yu Qinghe, Cai Ziming, Wu Jintao, Ma Pengfei, Zhang Xin, Zhou Longqian, Wang Yakun, Lin Xiaoqin, Lin Wenping. Vanillic acid inhibits inflammatory response and extracellular matrix degradation of endplate chondrocytes [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6391-9397. |
| [13] | Fan Jiaxin, Jia Xiang, Xu Tianjie, Liu Kainan, Guo Xiaoling, Zhang Hui, Wang Qian . Metformin inhibits ferroptosis and improves cartilage damage in osteoarthritis model rats [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6398-6408. |
| [14] | Zhou Ying, Tian Yong, Zhong Zhimei, Gu Yongxiang, Fang Hao. Inhibition of tumor necrosis factor receptor associated factor 6 regulates mTORC1/ULK1 signaling and promotes autophagy to improve myocardial injury in sepsis mice [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6434-6440. |
| [15] | Wang Jiaqian, , Jiang Changjun, Peng Yi, Ma Mi, Li Junhan. Study on the role of aerobic exercise in regulating the CNPY2-mediated AKT/GSK3β pathway for improving non-alcoholic fatty liver [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6441-6448. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||