Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (20): 4316-4324.doi: 10.12307/2025.691
Previous Articles Next Articles
Copper metabolism and diagnosis and treatment of oral diseases
Gao Hongli, Qin Yufeng, Zhang Yuehan, Shu Jiayu, Chen Helin
- College of Stomatology of Guizhou Medical University/Stomatological Hospital of Guizhou Medical University, Guiyang 550004, Guizhou Province, China
-
Received:2024-07-11Accepted:2024-09-06Online:2025-07-18Published:2024-12-23 -
Contact:Chen Helin, MD, Associate chief physician, Master’s supervisor, College of Stomatology of Guizhou Medical University/Stomatological Hospital of Guizhou Medical University, Guiyang 550004, Guizhou Province, China -
About author:Gao Hongli, Master candidate, College of Stomatology of Guizhou Medical University/Stomatological Hospital of Guizhou Medical University, Guiyang 550004, Guizhou Province, China -
Supported by:the National Natural Science Foundation of China (Regional Program), No. 82160186 (to CHL); Plan Project of Guizhou Provincial Science and Technology Department, No. Qiankehejichu-ZK[2021]General 433 (to CHL)
CLC Number:
Cite this article
Gao Hongli, Qin Yufeng, Zhang Yuehan, Shu Jiayu, Chen Helin. Copper metabolism and diagnosis and treatment of oral diseases[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(20): 4316-4324.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
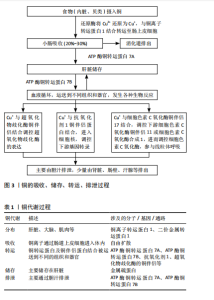
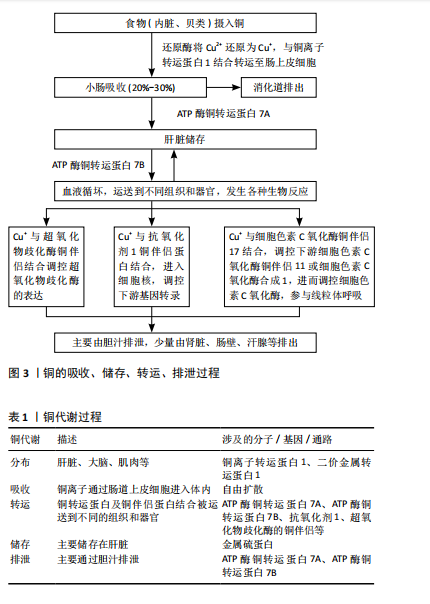
2.1 铜的分布、吸收、转运 铜是人和动物体内必需的微量元素,主要分布在肝脏、大脑、肌肉、肾脏等器官中[7],在口腔唾液中也可检测到铜[11]。人所需铜主要通过食物获取,如生蚝、坚果等。铜的吸收主要发生在小肠,铜通过自由扩散进入肠黏膜细胞,被肠道黏膜吸收后部分迅速进入血液循环,并很快沉积在肝脏,另有一部分则与金属硫蛋白结合,存储于肠黏膜上皮细胞内[12]。进入血液循环的铜可通过与铜转运蛋白及铜伴侣结合被运送到不同的组织和器官,参与各种生物化学反应[13]。铜转运蛋白包括铜离子转运蛋白家族、ATP酶铜转运蛋白7A、ATP酶铜转运蛋白7B,其中铜离子转运蛋白1可特异性地将细胞外的Cu+转运进入细胞内,是具有铜离子特异性及高亲和性的铜离子转运蛋白[12];ATP酶铜转运蛋白7A和7B是细胞输出铜的主要转运蛋白,位于高尔基体反面网络中,两者具有不同的表达模式,ATP酶铜转运蛋白7A主要在小肠中表达,而ATP酶铜转运蛋白7B主要在肝脏中表达[14]。铜伴侣蛋白包括抗氧化剂1,它是具有铜依赖性的金属伴侣蛋白,主要位于细胞质和细胞核内,与进入细胞内的铜离子结合,将铜转运到ATP酶铜转运蛋白7A或ATP酶铜转运蛋白7B的氨基末端[15];除了抗氧化剂1外,还有超氧化物歧化酶的铜伴侣、细胞色素C氧化酶铜伴侣17等铜伴侣蛋白参与铜的转运[2]。铜的主要储存部位是肝脏,主要通过胆汁排泄,少量由肾脏、肠壁、汗腺等排出[2]。铜的吸收、储存、转运、排泄过程见图3。铜代谢过程总结见表1。"

2.2 铜调控机体代谢的机制 2.2.1 铜调控血管生成 血管生成是指在已有的血管网络基础上,生成新的血管结构[16]。生理性血管生成的过程受到多种信号通路及分子的严格调控,包括缺氧诱导因子、血管内皮生长因子、Notch信号通路等,最终促使形成成熟的具有功能的新生血管网络[17]。生成的血管具有运输氧气、营养物质以及代谢产物等作用,此外,血管中的内皮细胞及壁细胞可通过直接或间接作用调控组织微环境的稳态,在正常组织发育以及肿瘤等疾病进展中发挥重要作用[17]。 铜可与血管生成素直接结合或与低氧诱导因子1结合促进白细胞介素1,6,8、碱性成纤维细胞生长因子和血管内皮生长因子表达,从而刺激血管生成[18]。铜缺乏可通过抑制血管生成[14],造成局部营养、氧气供应不足以及代谢产物的堆积,从而导致细胞损伤和死亡、组织缺血及坏死、炎症反应加重等情况[19]。肿瘤细胞迅速增殖和转移需要血管提供氧气和营养物质,因此抗血管生成是目前治疗恶性肿瘤的重要策略之一,铜有望成为抗肿瘤治疗新靶点[9]。 2.2.2 铜调控氧化应激 氧化应激是体内氧化作用与抗氧化作用失衡的一种状态,氧化作用过强,可导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,被认为是机体衰老的重要病理机制[20]。活性氧是生理条件下细胞呼吸和有氧呼吸的副产物[21]。低浓度的活性氧在体内细胞信号传导中发挥重要作用,但高浓度的活性氧可引起氧化应激,引起细胞结构和功能损伤,甚至增加癌变的风险[22]。 铜过量或缺乏均可引起细胞内的氧化应激。有研究表明细胞内铜超载刺激活性氧产生[23],诱导氧化应激,导致线粒体膜通透性改变、DNA损伤,促进凋亡蛋白表达;而铜缺乏限制了多种铜依赖的抗氧化酶的活性,包括超氧化物歧化酶1、过氧化氢酶和谷胱甘肽过氧化物酶,酶活性降低会使细胞内活性氧蓄积从而诱导氧化应激发生[8]。 过多的活性氧引起氧化应激,干扰细胞周期进程,诱导牙龈成纤维细胞凋亡,促进破骨细胞的形成,导致牙槽骨吸收和牙周组织损伤,进一步加重牙周炎[20]。 2.2.3 铜调控蛋白酶体活性 蛋白酶体是一个26S复合物,由一个20S蛋白水解核心和两个末端19S调节帽组成,存在于真核细胞的细胞核和细胞质中,负责真核细胞中蛋白质的选择性蛋白水解加工,参与调控细胞周期、凋亡、增殖、分化和信号传导等生理过程[24]。 铜与蛋白酶体相互作用主要通过两种方式:一是铜复合物可通过非共价键与20S蛋白酶体亚基结合,抑制蛋白酶体的激活[25];二是铜离子通过泛素修饰系统的E2结合酶分支的正变构激活,促进蛋白质的泛素化[24]。泛素-蛋白酶体系统是细胞内蛋白主要降解系统之一[24],主要降解细胞内大多数可溶的、错误折叠的、损坏的、多余的蛋白质[26]。通过酶促级联反应催化泛素分子标记待降解蛋白,随后由蛋白酶体识别并降解目标蛋白质,泛素修饰系统包括3种酶:E1激活酶、E2结合酶、E3泛素连接酶,而Cu+通过E2结合酶的正变构激活促进多种蛋白质的泛素化和降解,铜可通过蛋白质降解促进细胞死亡[24]。然而也有研究表明,铜可作为泛素-蛋白酶体系统抑制剂,降低泛素标记稳定性,抑制E1、E2、E3蛋白酶体活性,干扰泛素分子与靶蛋白连接,发挥抗肿瘤细胞活性作用[27],这为肿瘤的治疗方案提供一定的基础。 2.2.4 铜调控细胞凋亡 细胞凋亡是由多种基因严格控制的细胞自主且有序的死亡方式,以维持内环境的稳态,其主要特点为依赖半胱氨酸蛋白酶参与、DNA的降解、染色体浓聚、细胞皱缩和凋亡小体形成等,而凋亡过程的紊乱可能与多种疾病的发生有直接或者间接的关系,如肿瘤、神经系统疾病等[28]。 铜经由内质网未折叠蛋白反应、内质网应激和氧化应激诱导细胞凋亡,也可经由自噬和线粒体自噬通路诱导细胞凋亡[29]。此外,X连锁细胞凋亡抑制蛋白可结合并抑制半胱天冬酶3,7和9的活性进而调节细胞凋亡的发生[30]。铜与X连锁细胞凋亡抑制蛋白有很强的结合亲和力,二者结合可诱导X连锁细胞凋亡抑制蛋白构象发生可逆变化,从而削弱抑制细胞凋亡的能力,而且铜-X连锁细胞凋亡抑制蛋白复合物的结构不稳定,使其易于被泛素化的蛋白酶体降解,降低细胞凋亡的阈值[31]。 2.2.5 铜调控细胞自噬 自噬是真核生物中广泛存在的一种生物学机制,它将未折叠或聚集的蛋白质和受损的细胞器输送到溶酶体进行降解[32],可通过调控细胞凋亡、炎症、病原体清除、免疫反应等细胞过程,在发病机制中起调节作用。 细胞内铜超载可通过激活丝氨酸/苏氨酸蛋白激酶1和2复合体依赖的信号转导途径诱导自噬[33],还可通过活性氧途径促进自噬相关基因的转录和翻译而诱导自噬[32]。研究表明,细胞的自噬机制受损会导致氧化应激、基因组不稳定、慢性组织损伤、炎症和肿瘤的发生,对口腔疾病如口腔癌、根尖周病变、唇腭裂、口腔黏膜下纤维化变性等有双重作用,但其确切机制尚不清楚[34]。 2.2.6 铜死亡 铜死亡是一种铜离子诱导的不同于细胞凋亡、自噬等新型的、独特的细胞死亡方式。当细胞内铜离子积累后,一方面,过量的铜离子可与硫辛酰化蛋白结合促使其发生寡聚化并异常聚集,另一方面可降低铁-硫簇蛋白水平,二者共同作用导致蛋白质毒性应激反应,最终诱导细胞死亡[35]。近来关于铜死亡与多种肿瘤疾病在机制方面的研究逐渐深入,如口腔鳞状细胞癌、肝癌、肺癌、乳腺癌等,为其治疗策略提供了新的方向。 2.2.7 铜与免疫功能 铜在免疫系统的发育和维持中发挥着重要作用,但确切的作用机制尚不清楚。有研究表明铜缺乏时白细胞介素2减少,从而抑制T细胞活化和增殖。铜可以通过刺激白细胞介素6/JAK/STAT3信号通路上调程序性细胞死亡配体1的表达从而调节T细胞介导的抗肿瘤免疫[36-37]。 铜代谢调控机制及障碍研究进展总结见表2。 铜代谢调控机制及障碍引发常见疾病总结见表3。 铜调控机体代谢的机制包括氧化应激、蛋白酶体活性、细胞凋亡、自噬、铜死亡等,各调控机制间并非独立存在,而是相互联系。有研究表明发生氧化应激可诱导细胞凋亡,触发细胞自噬[27]。铜过量时,活性氧浓度提高,诱导氧化应激,可使线粒体膜受损,DNA发生双链结构断裂和碱基氧化,引起DNA损伤,细胞周期受阻滞,增加"


促凋亡蛋白表达;还可上调微管相关蛋白1A/1B-轻链3(microtubule-associated-proteinlight-chain-3,LC3)、Beclin 1、自噬相关基因ATG7表达,促使自噬空泡形成,启动自噬通路[27]。蛋白酶体参与调控细胞周期、凋亡、增殖、分化和信号传导等生理过程[24],细胞内铜含量的升高可抑制泛素-蛋白酶体系统的活性,蛋白酶体被抑制时,细胞色素C进入胞浆,激活半胱氨酰天冬氨酸特异性蛋白酶级联反应,促使细胞凋亡[9]。铜经由内质网未折叠蛋白反应、内质网应激和氧化应激诱导细胞凋亡,也可经由自噬和线粒体自噬通路诱导细胞凋亡[29]。而铜死亡是区别于细胞凋亡、自噬等的一种细胞死亡方式,铜超载导致脂酰化蛋白的异常寡聚,铁-硫簇蛋白水平降低,蛋白毒性应激,导致细胞死亡[4]。深入研究铜代谢调控机制及其之间的关联,对于疾病的预防和治疗具有重要意义。 2.3 铜与口腔相关疾病 2.3.1 口腔鳞状细胞癌 口腔鳞状细胞癌是口腔最常见的"


恶性肿瘤,占所有口腔癌的90%[44]。口腔鳞状细胞癌的发病机制复杂,内在因素和外在因素的共同作用导致口腔鳞状细胞癌的发生,如基因、维生素缺乏、烟草、职业暴露、环境污染、细菌和病毒感染等[44-45]。铜作为人体必需的微量元素,参与了血浆铜蓝蛋白、血管内皮生长因子、转铜蛋白等蛋白的合成,通过铜依赖的氧化应激和调控血管生成在口腔鳞癌的发生发展中发挥重要作用。 有研究发现口腔鳞状细胞癌患者唾液中铜含量显著高于正常人群,且铜含量水平与口腔鳞状细胞癌患者黏膜细胞形态异质性显著相关[45]。流行病学调查数据也显示口腔恶性肿瘤患者血清中铜蓝蛋白水平是正常人群的4-8倍[46]。铜蓝蛋白是一种含铜且具有氧化酶的球蛋白,具有胺氧化酶活性,通过铜依赖的胺氧化酶途径在肿瘤生长和血管生成中发挥重要作用[47],并且癌细胞还能从血浆中的非铜蓝蛋白中吸收铜,因此癌细胞的铜浓度显著高于正常细胞,铜离子可参与氧化还原反应,在游离氧代谢物的产生中发挥重要作用[46],产生的活性自由基团可促进癌症的发生和发展,与细胞成分结合,导致脂肪过氧化、蛋白质氧化和核酸破坏。因此,铜水平的升高可以显著增加口腔癌的易感性。 铜配合物治疗口腔癌是当前的研究热点,其主要作用机制有2种:一是通过铜配合物或铜离子载体增加癌细胞内铜浓度,提高肿瘤细胞中活性氧水平,抑制蛋白酶体活性,诱导细胞凋亡,从而发挥对肿瘤细胞的毒性作用[9,48];二是通过铜螯合剂与肿瘤细胞中的铜离子结合,大量降低细胞中铜浓度,进而抑制新血管生成[9,49]。碘化氯P6铜配合物(Iodinated chlorin p6 copper complex,Icp-6-Cu)是一种新发现的叶绿素衍生物,本身不具备细胞毒性,当其与X射线联合使用时,可对口腔癌细胞系NT8e和4451产生抑制作用,当浓度达到一定水平后,可提高细胞内活性氧水平,显著增强X射线对口腔癌细胞的杀伤力,提高癌细胞对放疗的敏感性[9]。姜黄素是从姜黄中提纯的具有抗癌活性的药物,与Cu2+结合可进一步促进肿瘤细胞凋亡、抑制血管生成[50-51]。四硫代钼酸是一种强铜螯合剂,可降低细胞内铜含量,顺铂作为目前临床最常用的抗肿瘤药物之一,与四硫代钼酸联合应用可以增强顺铂对口腔鳞状细胞癌的治疗效果[9]。铜与双硫仑络合通过下调癌症标志和免疫检查点来治疗疾病[52]。口腔癌具有高隐匿性、预后差和易复发等特点,而铜可显著提高口腔鳞状细胞癌的治疗效果,有望成为口腔鳞状细胞癌治疗的新靶点。 2.3.2 牙周炎 慢性牙周炎是最常见的口腔疾病之一,是由细菌及其毒素引起的慢性感染性炎症性疾病,临床表现为牙齿支持组织的完整性受损、牙槽骨吸收、牙周袋形成,最终导致牙齿的松动和脱落;此外,牙周炎还与某些慢性疾病有关,如心血管疾病、糖尿病、慢性肾病和肝损伤等[20]。 研究表明,牙周炎患者体内铜水平显著上升[53],升高的铜可通过以下几方面调控牙周炎进展。第一,铜过量可触发巨噬细胞线粒体自噬,溶酶体降解,发生氧化应激,导致细胞损伤或铜死亡,从而促进牙周炎进展[20,54],且有生信分析表明铜死亡特征基因二氢硫酰胺-S-琥珀酰转移酶及铜转运体溶质载体家族31成员1、ATP酶铜转运蛋白7B与牙周炎密切相关[55]。第二,铜是多种关键代谢酶的辅助因子[1-2],血清铜水平升高可改变胶原蛋白代谢而促进牙周炎[56]。第三,血清铜水平升高还可通过影响中性粒细胞、淋巴细胞的增殖及抗原特异性抗体的产生降低免疫反应,从而促进牙周炎进展[53]。因此铜稳态的平衡对牙周健康至关重要。 铜与其他药物相结合治疗重度牙周炎正被广泛关注。牙周炎的治疗一般为牙周系统治疗,轻者行龈上洁治术、龈下刮治术及根面平整术,定期维护;严重者配合抗生素类药物治疗,局部或全身用药,长期使用抗生素可能引发耐药性菌株的出现并破坏正常的菌群平衡,从而导致更为复杂的感染问题[57],因此在药物治疗方面学者们正在寻求新的思路。有研究者发现,镁铜合金可显著降低牙龈卟啉单胞菌和放线菌的存活率,在牙周骨移植物中使用镁铜合金对预防牙周手术后感染具有很大的潜力[58]。铜螯合剂通过抑制巨噬细胞线粒体自噬及溶酶体损伤,从而缓解牙周炎[54]。Shed-Cu-HA是通过结合Cu2+和透明质酸水凝胶的脱落乳牙干细胞衍生外泌体,对伴放线聚集杆菌有显著的抗菌作用,并可通过白细胞介素6/JAK2/STAT3通路有效抑制巨噬细胞炎症反应,用于动物实验发现其可促进牙周骨组织再生,因此该药物在牙周炎治疗中具有重要的应用前景[59]。CuS@MSN-SCS的纳米制剂,通过诱导由铜介导的活性氧信号通路杀灭细菌,或通过铜促血管生成和硫酸化壳聚糖介导的骨再生,最终加速牙周组织愈合[60]。Cu-NDs/IL凝胶具有促进渗透、杀死细菌和清除活性氧的作用,有望作为牙周炎的外用药物[10]。通过整合CuS纳米颗粒和明胶甲基丙烯酰基来生产混合水凝胶,可以采用近红外光触发的光热疗法杀死细菌,并且能促进成骨,是一种治疗牙周炎的新生物材料[61]。铜基纳米酶(铜单宁酸配位纳米片,CuTA NSs)和甘油三醇单硬脂酸酯/2,6-二叔丁基-4-甲基苯酚(TM/BHT)水凝胶自组装形成的TM/BHT/CuTA水凝胶体系,通过静电吸附和水解作用,释放CuTA纳米酶,具有抗牙菌斑特性,并可清除活性氧,此外,CuTA纳米酶可通过核转录因子E2相关因子2/核因子κB通路调节巨噬细胞从M1型到M2型的极化,从而减少促炎细胞因子,促进成骨,缓解牙周炎症,促进牙周组织再生[62]。Cu2+和Si4+可以反应形成碱性硅酸铜,促进成骨和血管生成,矿化硅藻材料在动物实验已发现可促进牙周韧带干细胞成骨分化,刺激成骨,故在牙周炎的临床治疗上有很大潜力和可能性[63]。 2.3.3 口腔黏膜下纤维化变性 口腔黏膜下纤维化变性是一种慢性口腔疾病,属于癌前病变,其病理特征是上皮上和上皮下的炎症反应,逐渐发展为黏膜下层的纤维弹性变化[64],临床表现为渐进性地张口困难。该病主要的病因为咀嚼槟榔,而槟榔的含铜量很高。槟榔的主要化学成分为槟榔碱,可增强铜的氧化还原反应,导致DNA裂解增强,最终诱导凋亡[65]。铜可通过非酶依赖性扩散过程被带入口腔黏膜角质形成细胞,上调赖氨酰氧化酶的活性,从而增加胶原蛋白的产生,促进口腔黏膜纤维化[66]。 有研究者收集并检测咀嚼槟榔志愿者的唾液和黏膜组织,结果显示铜含量均显著上升[67]。有研究者对健康者和口腔黏膜纤维下变性患者进行研究,并将口腔黏膜纤维下变性患者按临床分期进行分类,评估和比较不同临床分期的口腔黏膜下纤维化变性患者与健康对照组的血清铜水平,发现铜水平与口腔黏膜下纤维化程度呈正相关关系,血清铜可能是口腔黏膜纤维变性的重要原因[68]。利用铜螯合剂治疗口腔黏膜纤维化病变的有效性已在动物模型中得到证实[66],但应用于人体的临床研究目前尚无报道。 2.3.4 口腔扁平苔藓 口腔扁平苔藓是一种常见的口腔黏膜慢性炎性疾病,属于潜在的恶性疾患,好发于中年女性,主要表现为刺激痛、粗糙不适,临床上分为糜烂型和非糜烂型,皮肤和黏膜可单独或同时发病[69-70]。该病发病因素复杂,目前有研究指出口腔扁平苔藓的发生发展与T淋巴细胞介导的免疫应答功能有关,CD4+ T淋巴细胞可分化为Th1、Th2细胞亚群,CD4+ T细胞被抗原激活后,Th1通过释放γ-干扰素、白细胞介素2、肿瘤坏死因子α等致炎因子,介导炎症反应有关的免疫应答;Th2通过分泌白细胞介素4等抗炎因子,促进B细胞增殖并合成抗体,增强体液免疫功能,发挥抗炎作用。有研究表明口腔扁平苔藓患者血清中的γ-干扰素、白细胞介素4水平高于健康者,提示口腔扁平苔藓患者存在Th1、Th2细胞免疫应答紊乱情况[70]。 有学者研究不同年龄段和性别的口腔扁平苔藓患者与健康者血清中铜含量,发现口腔扁平苔藓患者与健康人的铜含量有一定的差别[71];不同年龄的口腔扁平苔藓患者的铜含量也有差异,年龄越大,口腔扁平苔藓患者血清中铜含量越高;性别对口腔扁平苔藓患者体内铜含量也有影响,这提示口腔扁平苔藓患者铜稳态异常。铜可调控免疫系统功能,铜过载可促进CD4+ T细胞增殖,并促进Th1释放γ-干扰素、白细胞介素2、肿瘤坏死因子α[36];铜缺乏可引起白细胞介素2和外周血中性粒细胞减少,造成免疫反应异常[37],补充铜后则逆转了这种变化,提示铜可能促进口腔扁平苔藓的发生发展,但还需进一步的临床研究以明确铜在口腔扁平苔藓中的作用和机制。 2.3.5 口腔溃疡 口腔复发性阿弗他溃疡是口腔黏膜疾病中发病率最高的一种疾病,好发于唇、颊、舌缘等无角化或角化较差的部位,发病年龄一般在10-30岁之间,女性较多。复发性阿弗他溃疡分为轻型、重型、疱疹样型,并可根据病情的进展分为始发期、溃疡期、愈合期、间歇期[72]。复发性阿弗他溃疡病因尚不完全明确,与免疫、遗传、微量元素缺乏等均有关。有研究将复发性阿弗他溃疡患者根据其临床表现分为始发期、溃疡期、愈合期、间歇期,并与健康者对比血清中铜的含量[72],发现各期复发性阿弗他溃疡患者血清铜的含量均显著高于正常人。复发性阿弗他溃疡患者血清铜升高,可能造成铜利用发生障碍,铜利用障碍导致含铜酶活性降低,从而影响溃疡的愈合[73]。 2.3.6 牙髓炎 牙髓炎是牙髓组织对细菌感染、机械创伤、医源性损伤等外界刺激发生的炎症反应,常见由龋病发展而来[74]。有研究者选取不可逆牙髓炎患者及牙髓健康者对铜超氧化物歧化酶mRNA的表达进行qRT-PCR分析,发现牙髓炎患者的铜超氧化物歧化酶转录水平显著升高,提示铜可能参与调控牙髓炎进展[75]。另外,有研究发现纳米氧化铜可杀灭口腔内厌氧菌,可用于预防龋齿和牙髓炎[76]。 口腔常见疾病与铜的关系总结见表4。 铜、铁、镁、锌等金属元素是人体内必需的微量元素。铜以Cu2+的形式参与多种酶的催化反应,并且具有抗炎作用[77];铁以Fe2+、Fe3+的形式参与氧化还原反应,负责运输氧气到全身组织;镁主要以Mg2+形式位于细胞内,参与细胞过程,包括能量代谢、信号通路等的调节,并且常以离子化合物的形式发挥优异的抗炎活性[77];锌以Zn2+形式存在,在体内平衡、免疫功能、氧化应激、细胞凋亡和衰老等方面起着至关重要的作用[77]。人体内微量元素的浓度是处于动态平衡的,彼此相对独立又互相影响。铜与其他元素之间存在着一定的联系,在一项研究中发现复发性阿弗他溃疡的发生发展与血清中铜锌含量有关[72];铁死亡与口腔癌、牙周炎、唾液腺功能障碍等相关[78];近来铜死亡与口腔癌、牙周炎的关系的研究备受"

| [1] ARREDONDO M, NÚÑEZ MT. Iron and copper metabolism. Mol Aspects Med. 2005;26(4-5):313-327. [2] CHEN L, MIN J, WANG F. Copper homeostasis and cuproptosis in health and disease. Signal Transduct Target Ther. 2022;7(1):378. [3] 邓智文.多酚-铜材料在组织修复中的应用[D].成都:四川大学, 2021. [4] TSVETKOV P, COY S, PETROVA B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022;375(6586):1254-1261. [5] 向思佳,刘扬中.微量元素铜与人体生理功能和疾病[J].大学化学, 2022,37(3):7-13. [6] CZŁONKOWSKA A, LITWIN T, DUSEK P, et al. Wilson disease. Nat Rev Dis Primers. 2018;4(1):21. [7] WANG Y, PEI P, YANG K, et al. Copper in colorectal cancer: From copper-related mechanisms to clinical cancer therapies. Clin Transl Med. 2024; 14(6):e1724. [8] ZHANG B, BURKE R. Copper homeostasis and the ubiquitin proteasome system. Metallomics. 2023;15(3):mfad010. [9] 王晨辰,许驭.铜死亡应用于口腔癌诊断治疗的研究进展[J].口腔医学研究,2023,39(9):771-774. [10] GAO Y, ZHANG W, XUE R, et al. An ionic gel incorporating copper nanodots with antibacterial and antioxidant dual functions for deep tissue penetration treatment of periodontitis in rats. Biomater Sci. 2023;11(10):3547-3560. [11] SEJDINI M, MEQA K, BERISHA N, et al. The Effect of Ca and Mg Concentrations and Quantity and Their Correlation with Caries Intensity in School-Age Children. Int J Dent. 2018;2018:2759040. [12] 宋明明,黄凯,朱连勤.铜吸收与代谢的研究进展[J].饲料博览, 2014(9):14-17. [13] BERTINATO J, L’ABBÉ MR. Maintaining copper homeostasis: regulation of copper-trafficking proteins in response to copper deficiency or overload. J Nutr Biochem. 2004;15(6):316-322. [14] LIU T, LIU Y, ZHANG F, et al. Copper homeostasis dysregulation promoting cell damage and the association with liver diseases. Chin Med J (Engl). 2023;136(14):1653-1662. [15] 卫浩,许德晨,崔杨,等.铜转运蛋白hCtr1结合Cu(I)并转运至铜伴侣蛋白Atox1[J].中国科学技术大学学报,2019,49(6):458-464. [16] POTENTE M, GERHARDT H, CARMELIET P. Basic and therapeutic aspects of angiogenesis. Cell. 2011;146(6):873-887. [17] 罗山强,李嘉钖,孙嘉星,等.肿瘤血管生成机制及抗血管生成疗法研究进展[J/OL].空军军医大学学报,1-14[2024-06-30].http://kns.cnki.net/kcms/detail/61.1526.R.20240520.1657.016.html. [18] LI Y. Copper homeostasis: Emerging target for cancer treatment. IUBMB Life. 2020;72(9):1900-1908. [19] 乔屹,张纯,马燕娥,等.中空硫化铜纳米粒负载去铁胺在光热抗菌及促血管生成方面的研究[J].药学学报,2023,58(9):2794-2801. [20] 马浩楠,于维先.氧化应激在牙周炎影响全身疾病过程中的作用研究[J].现代口腔医学杂志,2024,38(2):136-139. [21] GERA J, BUDAKOTI P, SUHAG M, et al. Physiological ROS controls Upd3-dependent modeling of ECM to support cardiac function in Drosophila. Sci Adv. 2022;8(7):eabj4991. [22] HUANG R, CHEN H, LIANG J, et al. Dual Role of Reactive Oxygen Species and their Application in Cancer Therapy. J Cancer. 2021;12(18): 5543-5561. [23] ROCHFORD G, MOLPHY Z, KAVANAGH K, et al. Cu(ii) phenanthroline-phenazine complexes dysregulate mitochondrial function and stimulate apoptosis. Metallomics. 2020;12(1):65-78. [24] LI Y, DU Y, ZHOU Y, et al. Iron and copper: critical executioners of ferroptosis, cuproptosis and other forms of cell death. Cell Commun Signal. 2023;21(1):327. [25] HINDO SS, FREZZA M, TOMCO D, et al. Metals in anticancer therapy: copper(II) complexes as inhibitors of the 20S proteasome. Eur J Med Chem. 2009;44(11):4353-4361. [26] 赵丹,袁宏,史洪博.泛素化蛋白质的降解路径选择[J].大连医科大学学报,2022,44(2):169-174. [27] 梁欣奕,马佳乐,赵双梅,等.铜死亡的作用机制及抗肿瘤研究进展[J/OL].中医学报,1-9[2024-06-02].http://kns.cnki.net/kcms/detail/41.1411.R.20230921.1917.004.html. [28] 刘芹.吸烟对口腔黏膜上皮细胞自噬及凋亡水平的影响[D].南京:南京大学,2021. [29] 林锦贤,王攀,吴欣谋,等.铜稳态失调诱导调节性细胞死亡及其调控的研究进展[J].江苏大学学报(医学版),2022,32(4):306-317. [30] XU J, HUA X, YANG R, et al. XIAP Interaction with E2F1 and Sp1 via its BIR2 and BIR3 domains specific activated MMP2 to promote bladder cancer invasion. Oncogenesis. 2019;8(12):71. [31] KALITA J, KUMAR V, MISRA UK. A Study on Apoptosis and Anti-apoptotic Status in Wilson Disease. Mol Neurobiol. 2016;53(10):6659-6667. [32] YANG F, LIAO J, PEI R, et al. Autophagy attenuates copper-induced mitochondrial dysfunction by regulating oxidative stress in chicken hepatocytes. Chemosphere. 2018;204:36-43. [33] TSANG T, POSIMO JM, GUDIEL AA, et al. Copper is an essential regulator of the autophagic kinases ULK1/2 to drive lung adenocarcinoma. Nat Cell Biol. 2020;22(4):412-424. [34] 王哲,何苇.细胞自噬与口腔疾病关系的研究进展[J].临床口腔医学杂志,2023,39(9):569-572. [35] 雷海桃,王海东,王金海,等.铜死亡调控机制的研究进展[J].中国病理生理杂志,2023,39(8):1491-1498. [36] LAN L, FENG Z, LIU X, et al. The roles of essential trace elements in T cell biology. J Cell Mol Med. 2024;28(10):e18390. [37] PERCIVAL SS. Copper and immunity. Am J Clin Nutr. 1998;67(5 Suppl): 1064S-1068S. [38] TISATO F, MARZANO C, PORCHIA M, et al. Copper in diseases and treatments, and copper-based anticancer strategies. Med Res Rev. 2010;30(4):708-749.
[39] SHAO J, LI M, GUO Z, et al. TPP-related mitochondrial targeting copper (II) complex induces p53-dependent apoptosis in hepatoma cells through ROS-mediated activation of Drp1. Cell Commun Signal. 2019;17(1):149. [40] ZHAO G, SUN H, ZHANG T, et al. Copper induce zebrafish retinal developmental defects via triggering stresses and apoptosis. Cell Commun Signal. 2020;18(1):45. [41] LUO Q, SONG Y, KANG J, et al. mtROS-mediated Akt/AMPK/mTOR pathway was involved in Copper-induced autophagy and it attenuates Copper-induced apoptosis in RAW264.7 mouse monocytes. Redox Biol. 2021;41:101912. [42] KELLEY DS, DAUDU PA, TAYLOR PC, et al. Effects of low-copper diets on human immune response. Am J Clin Nutr. 1995;62(2):412-416. [43] VOLI F, VALLI E, LERRA L, et al. Intratumoral Copper Modulates PD-L1 Expression and Influences Tumor Immune Evasion. Cancer Res. 2020;80(19):4129-4144. [44] KESHANI F, MAHMOODI A, GHOLAMI M, et al. Assessment of biochemical factors in blood serum of patients with oral squamous cell carcinoma. Dent Res J (Isfahan). 2023;20:81. [45] TORABINIA N, AGHAKOUCHAKZADEH A, KARGAHI N, et al. Evaluation of copper salivary level in oral squamous cell carcinoma, occupationally copper exposed, and its normal population and its association with cytomorphologic changes of oral mucosa. Dent Res J (Isfahan). 2023; 20:80. [46] AYINAMPUDI BK, NARSIMHAN M. Salivary copper and zinc levels in oral pre-malignant and malignant lesions. J Oral Maxillofac Pathol. 2012;16(2):178-182. [47] 谢奇斌,洪流,杨万里,等.铜蓝蛋白在肿瘤发生发展中的功能和作用研究进展[J].现代肿瘤医学,2023,31(23):4440-4444. [48] CHEN X, ZHANG X, CHEN J, et al. Hinokitiol copper complex inhibits proteasomal deubiquitination and induces paraptosis-like cell death in human cancer cells. Eur J Pharmacol. 2017;815:147-155. [49] SHOBHA DEVI C, THULASIRAM B, AERVA RR, et al. Recent Advances in Copper Intercalators as Anticancer Agents. J Fluoresc. 2018;28(5): 1195-1205. [50] ZHOU S, LI J, YU J, et al. Unique flower-like Cur-metal complexes loaded liposomes for primary and metastatic breast cancer therapy. Mater Sci Eng C Mater Biol Appl. 2021;121:111835. [51] PRASAD S, DUBOURDIEU D, SRIVASTAVA A, et al. Metal-Curcumin Complexes in Therapeutics: An Approach to Enhance Pharmacological Effects of Curcumin. Int J Mol Sci. 2021;22(13):7094. [52] CHEN SY, CHANG YL, LIU ST, et al. Differential Cytotoxicity Mechanisms of Copper Complexed with Disulfiram in Oral Cancer Cells. Int J Mol Sci. 2021;22(7):3711. [53] THOMAS B, GAUTAM A, PRASAD BR, et al. Evaluation of micronutrient (zinc, copper and iron) levels in periodontitis patients with and without diabetes mellitus type 2: a biochemical study. Indian J Dent Res. 2013; 24(4):468-473. [54] ZHANG L, TSAI IC, NI Z, et al. Copper Chelation Therapy Attenuates Periodontitis Inflammation through the Cuproptosis/Autophagy/Lysosome Axis. Int J Mol Sci. 2024;25(11):5890. [55] LIU S, GE J, CHU Y, et al. Corrigendum: Identification of hub cuproptosis related genes and immune cell infiltration characteristics in periodontitis. Front Immunol. 2023;14:1281051. [56] 李雪.对组织蛋白酶B慢性激活NF-κB信号通路调控成纤维细胞表达胶原蛋白的机制研究[D].长春:吉林大学,2017. [57] 王新林,唐文珺,姜亦洋,等.抗菌光动力疗法辅助龈下刮治治疗慢性牙周炎临床效果观察[J].口腔疾病防治,2024,32(6):451-456. [58] ZHAO X, WAN P, WANG H, et al. An Antibacterial Strategy of Mg-Cu Bone Grafting in Infection-Mediated Periodontics. Biomed Res Int. 2020;2020:7289208. [59] YU Y, LI X, YING Q, et al. Synergistic Effects of Shed-Derived Exosomes, Cu2+, and an Injectable Hyaluronic Acid Hydrogel on Antibacterial, Anti-inflammatory, and Osteogenic Activity for Periodontal Bone Regeneration. ACS Appl Mater Interfaces. 2024;16(26):33053-33069. [60] CHEN X, HUANG N, WANG D, et al. Sulfated Chitosan-Modified CuS Nanocluster: A Versatile Nanoformulation for Simultaneous Antibacterial and Bone Regenerative Therapy in Periodontitis. ACS Nano. 2024;18(22):14312-14326. [61] YANG Y, XU C, XU S, et al. Injectable hydrogels activated with copper sulfide nanoparticles for enhancing spatiotemporal sterilization and osteogenesis in periodontal therapy. Biomater Sci. 2024. doi: 10.1039/d3bm02134c. [62] XU Y, LUO Y, WENG Z, et al. Microenvironment-Responsive Metal-Phenolic Nanozyme Release Platform with Antibacterial, ROS Scavenging, and Osteogenesis for Periodontitis. ACS Nano. 2023;17(19): 18732-18746. [63] QIU X, FENG C, WANG W, et al. Copper-deposited diatom-biosilica enhanced osteogenic potential in periodontal ligament stem cells and rat cranium. J Biomed Mater Res B Appl Biomater. 2023;111(6):1286-1298. [64] MEHROTRA R, PANDYA S, CHAUDHARY AK, et al. Lipid profile in oral submucous fibrosis. Lipids Health Dis. 2009;8:29. [65] JANI YV, CHAUDHARY AR, DUDHIA BB, et al. Evaluation of role of trace elements in oral submucous fibrosis patients: A study on Gujarati population. J Oral Maxillofac Pathol. 2017;21(3):455. [66] SACHDEV PK, FREELAND-GRAVES J, BERETVAS SN, et al. Zinc, Copper, and Iron in Oral Submucous Fibrosis: A Meta-Analysis. Int J Dent. 2018;2018:3472087. [67] TILAKARATNE WM, KLINIKOWSKI MF, SAKU T, et al. Oral submucous fibrosis: review on aetiology and pathogenesis. Oral Oncol. 2006; 42(6):561-568. [68] TADAKAMADLA J, KUMAR S, GP M. Evaluation of serum copper and iron levels among oral submucous fibrosis patients. Med Oral Patol Oral Cir Bucal. 2011;16(7):e870-e873. [69] 陆胜男,石慧,章婷,等.老年人口腔扁平苔藓发病机制以及治疗研究进展[J].实用老年医学,2023,37(12):1274-1277. [70] 赵湘,葛化冰.口腔扁平苔藓患者血清中γ干扰素、白细胞介素4表达水平对免疫应答的调节作用[J].上海口腔医学,2023,32(3): 271-275. [71] 祁元明,石爱梅,刘兰琦.口腔扁平苔藓患者血清铜、锌、铁含量的测定[J].河南医科大学学报,1995(1):39-41. [72] 黄素贞,殷拥军,于在湖,等.复发性口腔溃疡患者血清锌铜含量检测[J].中华口腔医学杂志,1998(1):29. [73] 王安训,丁学强,许鸿生.血清铜与复发性口腔溃疡关系的Meta分析[J].中山医科大学学报,1998(1):72-74. [74] 刘红艳,郑思怡,韦曦.不可复性牙髓炎的活髓保存治疗:生物学基础与临床进展[J].口腔医学,2024,44(6):401-407. [75] BÖDÖR C, MATOLCSY A, BERNÁTH M. Elevated expression of Cu, Zn-SOD and Mn-SOD mRNA in inflamed dental pulp tissue. Int Endod J. 2007;40(2):128-132. [76] AMIRI M, ETEMADIFAR Z, DANESHKAZEMI A, et al. Antimicrobial Effect of Copper Oxide Nanoparticles on Some Oral Bacteria and Candida Species. J Dent Biomater. 2017;4(1):347-352. [77] 江纯静,杨成雪,喻正文,等.金属离子抗炎作用的分子机制[J].中国组织工程研究,2024,28(10):1626-1633. [78] 傅豫,何薇,黄兰.铁死亡在口腔疾病中的研究进展[J].国际口腔医学杂志,2024,51(1):36-44. |
| [1] | Cao Yue, Ye Xinjian, Li Biyao, Zhang Yining, Feng Jianying. Effect of extracellular vesicles for diagnosis and therapy of oral squamous cell carcinoma [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(7): 1523-1530. |
| [2] | Bai Jing, Zhang Xue, Ren Yan, Li Yuehui, Tian Xiaoyu. Effect of lncRNA-TNFRSF13C on hypoxia-inducible factor 1alpha in periodontal cells by modulation of #br# miR-1246 #br# [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(5): 928-935. |
| [3] | Zhao Zengbo, Li Chenxi, Dou Chenlei, Ma Na, Zhou Guanjun. Anti-inflammatory and osteogenic effects of chitosan/sodium glycerophosphate/sodium alginate/leonurine hydrogel [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 678-685. |
| [4] | Zhu Menghan, Yang Xuetao, Sun Yimin, Wang Chenglin. Anti-inflammatory peptides for oral inflammatory diseases: regulation of inflammatory response to reduce tissue destruction and structural loss [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(30): 6529-6537. |
| [5] | Li Zeming, Zhang Yuntao, Wang Maolin, Hou Yudong. Role and mechanism of hypoxia-inducible factor 1 alpha regulating bone homeostasis in oral and maxillofacial diseases [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(26): 5680-5687. |
| [6] | Ji Mingyi, Ji Xinyi, Xu Junfeng. Mechanism by which melatonin promotes bone regeneration and its application in oral implantation [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(18): 3868-3876. |
| [7] | He Li, , Ren Lu, , Jiang Xiaoxi, , Liu Xuqian, , Li Chunhui, . Effects of 1,8-cineole on inflammatory response in a rat model of experimental periodontitis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3605-3613. |
| [8] | Luo Yuncai, Meng Maohua, , Li Ying, , Wang Huan, Lu Jing, Shu Jiayu, Li Wenjie, Sun Jinyi, Dong Qiang, . Copper influences the occurrence and development of diabetic complications [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(17): 3641-3649. |
| [9] | Jiang Zhiliang, Luo Yaxin, Hu Zhengqi, Yang Li, Yang Chanchan, Chen Hong, Liu Xiaoyi, Huang Yan, Yang Kun. Effects of periodontal ligament stem cells-derived exosomes on biological characteristics of periodontal ligament stem cells in an inflammatory environment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(13): 2744-2752. |
| [10] | Sun Huanhuan, Zhao Fei, Tao Ran, Liu Bing. The molecular mechanism of necroptosis and its correlation with periodontitis [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(12): 2569-2574. |
| [11] | Mao Jiaqi, Zhao Liru, Yang Dongru, Hu Yongqing, Dai Bowen, Li Shujuan. Osteogenic ability and autophagy level between normal and inflammatory periodontal ligament stem cells [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(1): 74-79. |
| [12] | Liu Chunli, Yan Yujuan, Mo Liwen, Wu Zhijie, Zhang Li. Puerarin inhibits the differentiation of Raw264.7 cells into osteoclasts through the Notch signaling pathway [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(35): 5636-5641. |
| [13] | Han Yue, Wang Yufei, Liu Wanqing, Dong Ming, Niu Weidong. Effects of icariin on proliferation and differentiation of MC3T3-E1 cells in an inflammatory environment [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(23): 3709-3714. |
| [14] | Ge Ruiyang, Ni Can, Yang Kun, Yan Fuhua. The role of macrophage polarization in the pathogenesis and treatment of periodontitis [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(20): 3246-3251. |
| [15] | Bian Zhihong, Zhang Yuntao, Li Zeming, Hou Yudong. Potential of shikonin and its derivatives in oral soft and hard tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2024, 28(17): 2747-2752. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||