Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (16): 3503-3512.doi: 10.12307/2025.415
Previous Articles Next Articles
Application of solid collagen-based materials in medical devices
Hu Zhangjie1, Zhang Baoguan2, Zhang Zhiwu1
- 1Zhejiang Chumsun Biological Products Co., Ltd., Hangzhou 311100, Zhejiang Province, China; 2Shanghai Guangming Middle School, Shanghai 200021, China
-
Received:2024-03-05Accepted:2024-04-09Online:2025-06-08Published:2024-09-06 -
Contact:Zhang Zhiwu, PhD, Licensed pharmacist, Zhejiang Chumsun Biological Products Co., Ltd., Hangzhou 311100, Zhejiang Province, China -
About author:Hu Zhangjie, Master, Technician, Zhejiang Chumsun Biological Products Co., Ltd., Hangzhou 311100, Zhejiang Province, China
CLC Number:
Cite this article
Hu Zhangjie, Zhang Baoguan, Zhang Zhiwu. Application of solid collagen-based materials in medical devices[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3503-3512.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
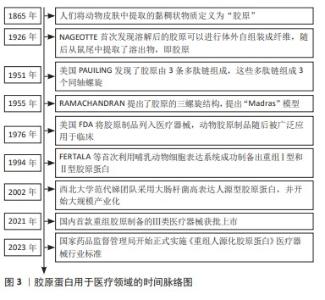
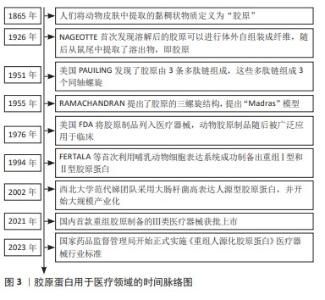
2.1 胶原蛋白用于医疗器械领域的研究历程 见图3。 胶原蛋白的发现可以追溯至19世纪,1865年人们将动物皮肤中提取的黏稠状物质定义为“胶原”[2],自此人们开始不断对胶原进行结构解析和功能探索。1926年,JEAN NAGEOTTE首次发现酸溶性胶原可以在体外自组装成纤维,随后在鼠尾提取了可溶物,即为胶原。1951年,美国PAUILING发现了胶原由3条多肽链组成,这些多肽链组成3个同轴螺旋。1955年被认为是胶原结构确定之年,RAMACHANDRAN提出了胶原的三螺旋结构,提出“Madras”模型[3]。随着对胶原材料安全性和功能性进行了大量研究,1976年美国FDA将胶原制品列入医疗器械进行管理,动物胶原制品随后被广泛应用于普通外科、骨科、牙科和神经外科等领域。同时期重组DNA技术开始兴起,研究人员开始进行重组胶原的研究,1994年,FERTALA等[4]首次利用哺乳动物细胞表达系统成功制备出重组Ⅰ型和Ⅱ型胶原蛋白,但生产成本较高难以实现;2002年,国内西北大学范代娣团队采用大肠杆菌高密度培养生产人源型胶原蛋白,蛋白表达量可达29.4%[5],并将该技术进行大规模产业化。经过多年产业发展,中国在重组胶原领域已达国际领先水平,在2021年第一款重组胶原制备的Ⅲ类医疗器械获批上市,随后为了规范产业发展,国家药监局先后出台了多项行业标准,《重组人源化胶原蛋白》医疗器械行业标准于2023年正式实施。据国家药品监督管理局注册信息显示,2023年的重组胶原注册证新增260张,均属于境内二类注册证,可见发展非常迅速。 "
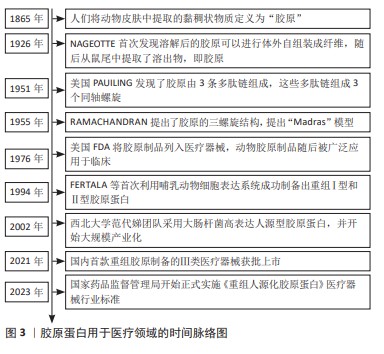
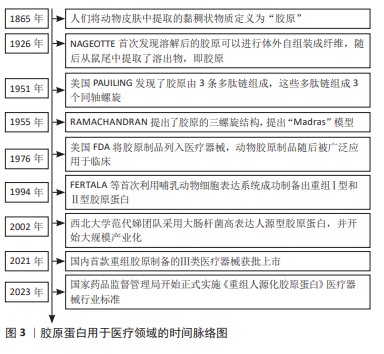
2.1 胶原蛋白用于医疗器械领域的研究历程 见图3。 胶原蛋白的发现可以追溯至19世纪,1865年人们将动物皮肤中提取的黏稠状物质定义为“胶原”[2],自此人们开始不断对胶原进行结构解析和功能探索。1926年,JEAN NAGEOTTE首次发现酸溶性胶原可以在体外自组装成纤维,随后在鼠尾提取了可溶物,即为胶原。1951年,美国PAUILING发现了胶原由3条多肽链组成,这些多肽链组成3个同轴螺旋。1955年被认为是胶原结构确定之年,RAMACHANDRAN提出了胶原的三螺旋结构,提出“Madras”模型[3]。随着对胶原材料安全性和功能性进行了大量研究,1976年美国FDA将胶原制品列入医疗器械进行管理,动物胶原制品随后被广泛应用于普通外科、骨科、牙科和神经外科等领域。同时期重组DNA技术开始兴起,研究人员开始进行重组胶原的研究,1994年,FERTALA等[4]首次利用哺乳动物细胞表达系统成功制备出重组Ⅰ型和Ⅱ型胶原蛋白,但生产成本较高难以实现;2002年,国内西北大学范代娣团队采用大肠杆菌高密度培养生产人源型胶原蛋白,蛋白表达量可达29.4%[5],并将该技术进行大规模产业化。经过多年产业发展,中国在重组胶原领域已达国际领先水平,在2021年第一款重组胶原制备的Ⅲ类医疗器械获批上市,随后为了规范产业发展,国家药监局先后出台了多项行业标准,《重组人源化胶原蛋白》医疗器械行业标准于2023年正式实施。据国家药品监督管理局注册信息显示,2023年的重组胶原注册证新增260张,均属于境内二类注册证,可见发展非常迅速。 "
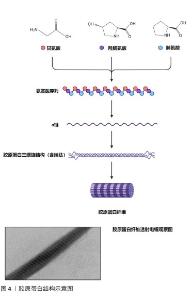
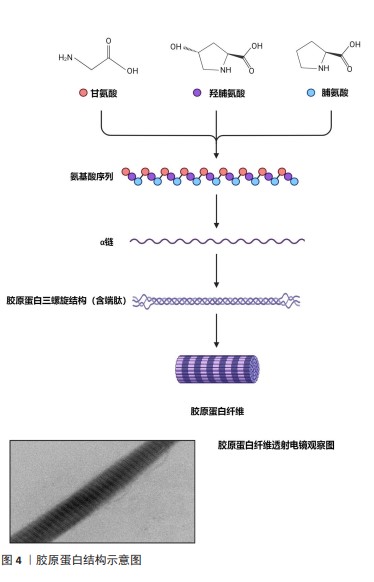
2.2 胶原蛋白来源与提取 胶原蛋白是所有哺乳动物体内最丰富和分布最广的纤维状结构蛋白,占体内蛋白含量的25%-35%。已鉴定出至少46条不同多肽链组成的29种不同类型胶原蛋白[6]。用于商业化医疗器械的胶原原料可根据来源分为自然胶原和合成胶原。自然胶原主要通过猪、牛和其他哺乳动物的皮肤、肌腱等组织中提取纯化制得,提取方法主要分为酸法、碱法、盐法、酶法等。由于碱法和盐法提取存在蛋白易变性和提取率低等问题,生产较多采用酸法和酶法结合提取胶原,酸溶胀有利于胶原的提取,酶解去除端肽有助于降低胶原免疫风险[7]。此外,从海洋生物中提取的胶原(如鱼胶原等)因其氨基酸组成和生物相容性接近于牛或猪胶原,并且原料(鱼鳞、鱼皮)成本低廉和能有效避免陆生生物人畜共患病的风险[8],近年来备受众多原料厂商关注。海洋生物种类丰富以及生活环境多样性造就了水产胶原多样化的结构和性能,为胶原基产品的创制和应用提供更大的选择空间的同时,目前存在来源不明确和品类较难统一的问题,原料溯源和监管难度较大。另外,海洋生物胶原通常热变性温度低于陆生生物,热稳定性较差,一定程度限制了其在医疗器械领域的应用[9]。 重组胶原通过采用合成生物学技术,将人源胶原蛋白的基因片段借助工具酶拼接至适合载体上并转移至宿主细胞中诱导表达得到。大肠杆菌和酵母作为宿主表达系统因遗传背景清晰、表达量高、生产周期短和成本低等优势生产上应用最多,但缺乏翻译后羟基化修饰过程,表达的蛋白缺乏活性。针对该情况,研究者通过在宿主表达系统中胶原和羟化酶基因进行共表达,已成功制备出具有一定三螺旋结构和热稳定性的胶原蛋白[10]。重组胶原具有基因可塑性强、亲水性好、无病毒隐患和排异反应低优势,在医疗器械领域已有应用,但重组胶原的立体螺旋构象与自然胶原相比仍有一定距离,值得被深入开发。 2.3 胶原蛋白的结构特征 胶原蛋白由三螺旋区和两端的非螺旋区组成,三螺旋构区由3条平行的左手螺旋α链组成,每条链约有1 014个氨基酸,由(Gly-X-Y)n重复排列的三聚体结构组成,Gly即为甘氨酸,在肽链中的含量约为1/3,其中X和Y通常为脯氨酸和4-羟基羟脯氨酸,这2个氨基酸参与多肽链之间的氢键、范德华力和共价键的形成,使得3条α链相互缠绕形成稳定的右手螺旋结构,被称为原胶原[11]。原胶原通过共价键交联,以一条线形式首尾相接并按规则平行排列成束,首尾相错1/4,形成稳定的胶原蛋白原纤维,纤维表面具有明暗相间的D周期性条带(图4),并且在轴向和横向上进一步有序自组装形成聚集性胶原纤维束[1,12]。 "

2.4 胶原蛋白的生物学特性 2.4.1 生物相容性 胶原蛋白作为细胞外基质蛋白主要成分,其生物相容性主要体现在与宿主细胞及组织之间的相互作用上,无论是在被吸收前作为新组织的骨架还是被吸收同化成为宿主一部分,胶原蛋白都与细胞和组织有良好的相互作用。生物材料相容性评价方法有很多种,其中常用的有体内植入法和体外复合细胞培养法。迟妍妍等[13]将牛源胶原蛋白海绵植入于新西兰兔肌肉中,在整个材料植入和降解周期内无明显纤维囊结构形成,植入剂部位未见组织坏死情况,显示胶原蛋白海绵良好的生物相容性。黎洪棉等[14]采用兔皮下脂肪干细胞与海绵状Ⅰ型胶原蛋白进行共培养,发现干细胞在胶原蛋白海绵上生长良好,无细胞毒性,表明胶原蛋白海绵具有良好的体外细胞生物相容性。 2.4.2 促进细胞增殖和黏附 胶原蛋白作为细胞外基质蛋白,不仅为结缔组织提供必要的结构支持,而且密切参与控制一系列细胞功能。所有的胶原蛋白都具有三螺旋结构,通过该区域与细胞表面受体进行相互作用,包括整合素、盘状结构域受体、免疫球蛋白受体和白细胞受体复合物等,从而调节细胞的信号、迁移、存活和分化[15]。整合素是众所周知的细胞表面异二聚体受体,目前已鉴定出4种类型的整合素能与胶原结合,分别为a1β1、a2β1、a10β1和a11β1。胶原蛋白能够与a1β1和a2β1整合素结合,促进细胞的黏附。其中,a2β1受体可介导Ⅰ型胶原蛋白纤维上的细胞黏附、扩散并促进胶原蛋白合成,而a1β1仅在Ⅰ型胶原蛋白单体中激活MAPK信号通路促进细胞增殖。a10β1受体在软骨组织中高度表达,主要与Ⅱ型胶原蛋白结合促进间充质干细胞的分化和骨生长。a11β1受体最早被证明可促进细胞附着于Ⅰ型胶原蛋白,近年来被识别为一种新的ⅩⅢ型胶原蛋白受体,在维持骨稳态中发挥作用[16-17]。 2.4.3 促进血小板活化 胶原蛋白是血小板的强激活剂,在止血和血栓形成中发挥着重要作用。胶原蛋白的止血作用在于其促进血小板活化能力,Ⅰ、Ⅲ、Ⅳ和Ⅵ型胶原能够直接通过整合素α2β1和Ⅵ型糖蛋白或间接通过血管性血友病因子与血小板结合,局部刺激血小板的黏附和聚集,同时激活凝血系统,产生凝血因子和凝血酶,从而诱导原纤维蛋白转化为纤维蛋白并进一步聚集形成纤维蛋白多聚体,形成血栓,快速促进血液凝固[18-19]。 2.4.4 生物可降解性 胶原蛋白因结构相对复杂且具备特殊的三螺旋稳定结构,一般不易被普通蛋白酶所降解,只有在高温和极端酸碱条件下才会解旋而水解。结构完整的胶原蛋白只能被胶原酶在体温环境下有效解旋,使其成为易被蛋白酶水解的单股肽链[20]。胶原蛋白的螺旋结构一旦被破坏,肽链将被彻底水解成小分子多肽和氨基酸,小分子多肽和氨基酸可以进入血液循环系统被机体重新利用或代谢排除。为了延长胶原在体内的降解时间,常用外源性化学、物理或生物方式对胶原分子进行交联,以加强胶原纤维之间的连接,可进一步提高胶原分子稳定性,最大限度延长降解时间[21]。 2.4.5 低免疫原性 胶原蛋白作为良好医用生物材料,在有效性得到广泛认可的同时,其免疫原性的研究日益受到重视。在1954年之前,胶原蛋白甚至被认为不具有抗原性,后续人们测定了多种胶原产品的免疫原性,发现非胶原成分、降解或变性产物都会引起免疫反应。经研究发现,胶原有3种类型的抗原因子,第1类是由胶原蛋白两端非螺旋区域的端肽引起的,第2类是由胶原三螺旋的构象引起的,第3类是由α链螺旋区的氨基酸序列引起的[22]。 目前大多数动物源胶原基医疗器械制品均通过酶切方式完全去除端肽,提取去端肽胶原蛋白,仅保留了胶原分子三股螺旋和氨基酸序列内部微弱的免疫原性,不足以发生明显的排斥反应。此外,利用合成生物学方法将人胶原蛋白全序列导入至宿主细胞DNA中,从而表达和提取出与人体胶原蛋白高度同源的重组胶原,可进一步降低免疫排异风险[10]。"


2.5 固态胶原基医疗器械制剂形式与工艺 2.5.1 胶原海绵 胶原蛋白最常见的固态制剂类型为胶原蛋白海绵,通常以干质量0.1%-5%的胶原蛋白溶液冷冻干燥制备而成,呈现出白色或类白色多孔蜂窝状结构,具有良好的机械强度、吸水性、可膨胀性和可降解性,常作为组织支架应用于伤口愈合、止血、骨修复、神经外科等领域[11]。 冷冻干燥法是通过将均质分散液冷冻后在高真空度状态下使固态溶剂升华,原液相的位置获得形成孔隙而获得海绵的一类方法。海绵的孔隙率影响其吸液能力,孔径尺寸影响细胞的浸润、迁移和增殖能力,这些参数均可通过改变胶原蛋白含量和冷冻干燥参数来进行控制。DOILLON等[23]采用扫描电镜观测不同冷冻温度下胶原海绵的微观结构,发现-20 ℃冷冻温度下的海绵片状结构且孔隙较大,而-80 ℃温度下形成纤维结构且孔隙较小,并阐述该现象与冰晶生长速率有关。许多商业化胶原海绵外观差别不明显,但实际上孔隙率和孔径尺寸相差很大,针对不同适应证对孔隙率和孔径的要求值得进一步探讨,便于临床区分使用和质量控制。胶原海绵冷冻过程中常出现因顶部与底部冰晶生长速率不同形成的海绵正反面不均匀,甚至可能出现结晶花纹,影响性能与美观。JIANG等[24]通过“两步冷冻法”替代-80 ℃直接冷冻,预先在容器底部冷冻一层冰层,再倒入胶原溶液进行冷冻,发现两步冷冻法制备的海绵正反面形态比直接冷冻制备的海绵更加均匀。DAVIDENKO等[25]开发了不同构造的模具,利用冷冻过程中传热差异使胶原蛋白悬浮液产生单轴和多个方向的温度梯度,从而生产出具有复杂孔径和孔径排列各向异性的胶原蛋白海绵,可满足3D定制化要求,在再生和修复各种受损的各向异性组织应用中具有巨大潜力。 此外,纯胶原蛋白海绵存在力学性能不佳、降解时间过快等缺陷,极大限制了临床使用。通过交联方式提高海绵力学强度和延长降解时间成为普遍选择。SUN等[26]通过不同化学交联剂对罗非鱼胶原蛋白进行改性交联,交联后胶原海绵吸液能力、力学性能和耐酶解能力显著提升。WANG等[27]通过紫外照射和脱水热处理能略微提高胶原海绵拉伸强度和热稳定性,但胶原存在不同程度的变性。物理交联与化学交联存在各自缺陷,如物理交联出现交联可控性差、性能提升不明显等问题,化学交联剂存在潜在细胞毒性、交联剂难以去除等问题。近来,开发天然交联剂(如海藻酸[28]、壳聚糖等[29])和通过生物酶交联(如谷氨酰胺酶[30]、赖氨酰氧化酶等)成为研究热点方向[29]。 2.5.2 胶原粉 胶原粉,也称胶原纤维,由一系列不规则的细小胶原颗粒或纤维构成,常用于伤口愈合和止血。相效果更加明显,并且能很好地运用于不平整、不规则伤口表面和较难触及的深度创伤[31]。此外,胶原粉具有粒径小、与组织黏合度高等优势,更适合用于微创植入类手术。 胶原粉制备工艺主要通过机械粉碎、液氮冷冻粉碎和喷雾干燥法制备而成。传统机械粉碎法通过将提纯后胶原干燥后通过研磨制粒获得,更改制粒参数要求可以满足到不同粒径范围要求。根据粒径大小可分为较粗的胶原纤维与较细的胶原粉末,扫描电镜观察可见胶原粉末失去了纤维性,展现出形成团聚体的倾向,胶原纤维则保留了纤维性,颗粒大小与外观差异直接导致它们在水中的溶解度区别较大[32],因此胶原粉的粒径控制显得尤为重要。液氮冷冻粉碎法是利用物料的低温脆性,能最大程度保留胶原的结构和生物特性,例如:YANG等[33]通过液氮冷冻粉碎法制备罗非鱼鱼皮胶原粉,低温环境保证了胶原的三螺旋结构和活性,但这种方法成本较高、生产效率低,目前工业实现规模化较为困难。喷雾干燥法将胶原溶液雾化,在热空气干燥下将水分蒸发,从而形成干燥粉末。林海[34]通过喷雾干燥法制得猪皮胶原粉,颗粒尺寸保持在5 μm以下,该方法在颗粒均匀性方面要优于机械粉碎和液氮冷冻干燥,通过该法可以得到细小颗粒状微粒,适合大规模工业生产,但会存在热干燥导致胶原变性降解的风险。 2.5.3 胶原膜 胶原膜的胶原纤维交织缠绕更为紧密,它的抗拉伸强度、弹性均优于胶原海绵,被在临床上用于引导骨组织再生已有30年历史[35]。胶原膜具有良好的物理屏障作用,阻止快速增殖的上皮细胞迁移,并允许具有再生能力的细胞重新填充缺损区域[36]。而且,胶原膜作为可吸收膜不需要进行二次手术取出,避免了伤口开裂和感染,被广泛应用于牙周再生和缺损组织修复。 目前制备胶原膜常用的路径可分为3种,包括浇铸成膜、冷冻干燥法及静电纺丝成膜[35]。浇铸成膜较为简单,将胶原蛋白溶液倒入模具或者容器中,自然风干或者加热干燥即可得到胶原膜。田振华等[37]在胶原蛋白溶液配伍氧化羧甲基纤维素钠,自然干燥得到结构更加紧实、良好的改性胶原膜。冷冻干燥法与胶原蛋白海绵制备工艺类似,可以通过减少预冻前液体厚度来实现,最终呈现为蜂窝多孔装结构,但存在厚度均一性难以控制、冷冻过程中容易出现裂纹等问题。LEE等[38]结合风干法和冷冻干燥法新开发了一款多层胶原膜,胶原蛋白层分别通过风干和冷冻干燥制成致密层和多孔层,致密层发挥屏障作用,多孔层可为细胞生长提供支架。静电纺丝是一种利用高压电场制备超精细纤维的纺丝方法,具有成本低、生产设备简单、工艺可控等优点。利用静电纺丝技术制备的纳米纤维膜具备比表面积大、孔隙率高等结构特征,与天然组织细胞外基质的纳米丝状结构类似,能够更好地促进组织再生[39]。韩红帅等[40]利用静电纺丝技术制备胶原基纳米纤维膜,纤维直径分布均匀、拉伸强度良好,有作为细胞支架的潜力。吹纺是一项制备纳米纤维膜的新技术,通过高压气流喷射胶原溶液产生溶液射流,随着溶剂快速蒸发形成纳米纤维。ZHENG等[41]通过吹纺技术制备了胶原纳米纤维膜,与电纺胶原膜不同,吹纺纤维膜蓬松、海绵状、孔隙率高,并且吹纺设备更为简单,适合大规模生产,具有广阔前景。 上述方法仅限于通过可溶性胶原蛋分子进行制备,而不溶性胶原纤维是天然交联的胶原原纤维聚集体,自组装程度和机械强度更接近天然细胞外基质,值得被应用于胶原膜制备过程中。YANG等[42]最新将反向旋转挤出技术用于胶原膜的制备,通过较大压力挤出不溶性胶原纤维并通过控制旋转锥体速度制备出具有各向异性的胶原纤维膜,结果显示该膜胶原纤维排列和机械性能方面能仿生天然肌腱组织,为进一步优化胶原膜提供了新的制备思路。 2.5.4 胶原凝胶 胶原分子在生理环境下能自组装形成胶原纤维,并包裹水溶液形成固态凝胶。凝胶内部是由交联的共价键和氢键或离子键形式的弱内聚力连接在一起的三维聚合物网络,能吸收大量的水或生物液体[43]。与胶原分子相比,聚集的胶原纤维形成的凝胶降解速率更慢,网络结构可以模拟天然组织中的三维细胞外基质环境,具有在组织再生过程中引导细胞迁移、生长的潜力。 透析法是制备凝胶最简单的方法,通过使胶原蛋白溶液的酸碱度发生改变,从而使胶原蛋白分子自聚集形成凝胶。SKOPINSKA-WISNIEWSKA等[44]利用透析法制备中性胶原凝胶,胶原蛋白在酸性条件下可溶,但无法形成有序结构,随着透析中和过程中胶原蛋白分子逐渐聚集和排列成原纤维,凝胶内部结构逐渐紧密。为了提高胶原凝胶的力学性能,通常制备过程中采用多种方法对胶原蛋白分子进行交联,增强分子间相互作用力,可分为物理法和化学法。 物理法通常包括热改性、辐照交联等。热改性通过加热使胶原原有结构遭到破坏,导致疏水结构暴露,从而引发凝胶化过程。紫外线辐射是胶原基生物材料制备的常用方法,紫外线通过促使胶原多肽链内和链间结合水释放松弛胶原三螺旋结构构象,从而暴露光敏基团引起多肽链降解,暴露疏水基团引发凝胶化。XU等[45]采用紫外线辐射方式诱导胶原纤维聚集和凝胶化,胶原凝胶的热稳定性、机械强度和细胞生长促进能力明显提升,但胶原交联同时部分胶原被降解为胶原肽。目前物理法交联程度低,对凝胶性能改进有限,并且会导致胶原变性,因此仅作为协同方法与其他方法共同使用。 化学交联法主要引入化学交联剂,通过新的共价键或化学键的形成稳定凝胶网格结构,包括戊二醛、碳酰二亚胺、京尼平等。化学交联对凝胶性能的提升要优于物理交联,但交联剂的带入提高了凝胶的细胞毒性和免疫风险。近年来多种低毒新型交联剂被开发用于凝胶的制备,例如:DUAN等[46]利用生物相容良好的儿茶酚衍生物与胶原蛋白ε-氨基相互作用,大幅度提高了凝胶的弹性模量和抗酶性;LOTZ等[47]利用无细胞毒性的聚乙二醇衍生物在人成纤维细胞接种的胶原蛋白凝胶中实现交联,细胞增殖能力与未交联的胶原凝胶相当。光化学交联法是一种新兴技术,通过光敏交联剂与胶原分子结合,在激发光下光敏基团相互交联,从而形成凝胶。CHAN等[48]通过玫瑰红光敏剂制备胶原凝胶,凝胶的交联效率与玫瑰红浓度和激发光能量相关,呈剂量依赖性。与常规交联方法相比,光化学交联法进一步提高了凝胶制备和使用的可控性、灵活性。 2.5.5 脱细胞基质 脱细胞基质支架是通过去除人或动物组织中的具有免疫原性的细胞成分,特别是DNA和RNA,仅保留细胞外基质的人或动物组织的衍生支架,其主要成分为胶原蛋白,可根据具体应用场景和需求将脱细胞基质制成粉末、膜片和凝胶等形式[49-50]。脱细胞基质能在体外促进多种细胞群的生长和分化,在植入人体后能随着时间的延长逐渐被患者自身组织所取代,促进缺损组织再生。 脱细胞基质的主要制备方法包括物理法、化学法和生物酶法。物理方法主要通过物理方法破坏细胞膜,释放细胞内容物,包括反复冻融法、超声破碎法、超临界CO2法和高静水压法等。化学法通过洗脱剂破坏细胞膜,从而达到去除细胞的目的,常见的有酸碱溶液、洗涤剂和高渗/低渗溶液等。生物酶法通过核酸酶和蛋白酶可去除DNA、RNA以及其他引起免疫原性的抗原物质。其中,化学法脱细胞效果最佳,但会破坏细胞外基质的超微结构,并且有化学试剂残留;物理法对组织结构的破坏小,但细胞完全清除较为困难;生物酶法酶的特异性减少了对其他生物活性的损害,但需要更长时间清除酶试剂残留[51-52]。杨彩仙[49]比较胰蛋白酶法和高渗盐水法制备的脱细胞基质性能的差异,发现酶处理的脱细胞真皮基质更接近与正常皮肤,并且对基质化学组成基本无影响,无细胞毒性,有利于细胞长入基质内部;而高渗盐水脱细胞基质的纤维蛋白保留效果优于酶脱细胞基质,但胶原成分的破坏高于酶脱细胞基质。为了更好地去除组织细胞及减少对细胞外基质的损伤,通常以2种或2种以上方法结合起来进行脱细胞处理[53]。 "

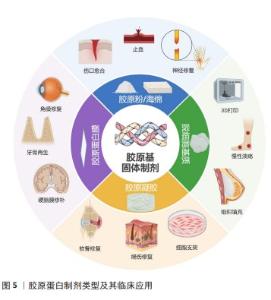
2.6 固态胶原基医疗器械的应用领域 见图5。 2.6.1 伤口愈合 胶原蛋白作为伤口敷料有多种优点有助于伤口愈合,包括以下几点:低免疫原性;快速止血;良好的吸水性能够吸收大量组织渗出液,紧密地黏附在湿润的伤口上,在保持湿润的环境同时防止机械创伤和细菌感染[54];作为胶原酶竞争性底物,可以减少组织的酶促降解,并且降解产物可进一步降低Ⅰ型胶原酶的活性[55-56];胶原蛋白网格结构驱化成纤维细胞、巨噬细胞和上皮细胞参与伤口愈合;可促进胶原蛋白沉积和血管生成,从而加快伤口愈合。SONG等[57]通过Meta分析了11项临床随机对照试验,与标准伤口护理相比,胶原蛋白敷料组具有更高的伤口愈合率和愈合速度。 伤口敷料已经大规模应用,几乎涵盖所有固态制剂类型。胶原海绵具有良好的吸水性、可膨胀性和可降解性,可为伤口提供良好的支架作用,应用最为广泛;胶原膜具有良好的屏障作用,可减少感染风险,并且易于去除,不会对新生组织组织造成伤口,主要用于治疗压疮、静脉性溃疡等慢性创面;胶原蛋白凝胶可保持伤口湿润的环境,湿润的环境更加有利于细胞的生长,并且具有良好的透气性。为了更快地促进伤口愈合,研究人员会将一些生长因子或者其他有促进伤口的活性物质添加在敷料中,比如在含有表皮生长因子的胶原凝胶基质可以加快静脉性退步溃疡的愈合[58];YAO等[59]将重组碱性成纤维细胞生长因子负载可吸收胶原海绵上,显著增加了完全伤口闭合发生率,缩短了完全愈合时间。此外,针对开放性伤口易感染的问题,也会将一些抗菌剂加入至敷料中,如SUN等[60]用罗非鱼胶原蛋白和壳聚糖开发了一种新型双层伤口敷料,可以降低炎症细胞因子并上调生长因子,还可促进胶原蛋白合成和成纤维细胞增殖,从而加速伤口愈合。 "
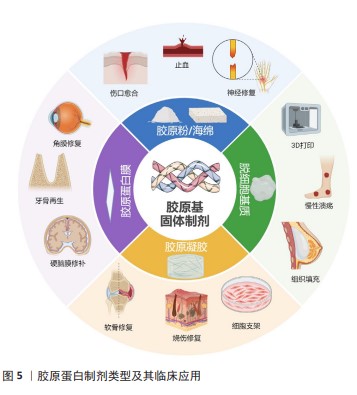
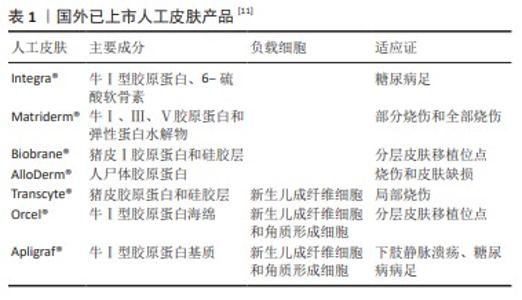
2.6.2 人工皮肤 伤口敷料主要以促进伤口愈合为主,而人工皮肤适用于修复和替代缺损的皮肤组织。国外已成功商业化多款人工皮肤用于临床,如表1所示。Apligraf?是世界上首款获得批准的包含人体活细胞成分的人工皮肤,被批准用于治疗静脉溃疡,是一种双层生物工程皮肤替代物,通过培养的新生儿成纤维细胞与牛Ⅰ型胶原蛋白结合形成新真皮,特别适用于治疗长期(> 1年)难治性溃疡、大溃疡和深度溃疡[61]。 AlloDerm?是一种由美国Life cell公司开发的异体真皮无细胞基质产品,由盐处理的人类尸体皮肤制成,在使用前经过脱细胞、冷冻干燥等工艺保留了真皮许多复杂结构,质地与正常真皮相同,不存在抗原识别[62]。与Apligraf?相比,AlloDerm?的结构更接近人体真皮结构,但缺乏活的成纤维细胞,可能会延缓真皮重建,并且源自人尸体皮肤,原料来源极为有限,国内进行类似产品开发难度相对较高。Integra?真皮再生模板是最具有代表性的皮肤组织工程真皮替代物。 Integra?是一种双层膜,真皮介质层为胶原蛋白/糖胺聚糖通过戊二醛交联形成的交联层,表皮层为薄的半渗透硅胶片[63]。表皮层仅为临时表皮替代物,可防止液体流出,起到控制热量和水分的作用。真皮介质层为发挥创面修复作用,首先抑制血小板聚集,最大限度地减少免疫反应和炎症反应,并允许成纤维细胞和内皮细胞在真皮基质中生长成新真皮。一项临床试验表明,216例烧伤患者平均烧伤面积为36.5%,将Integra?用于烧伤创面两三周后真皮层再生[64]。2.6.3 止血 1983年,COLN等[65]通过实验性脾裂伤评价了不同止血材料的性能,发现胶原蛋白海绵的止血性能最佳,之后胶原蛋白海绵开始进入临床应用。胶原海绵疏松的纤维网状结构为血小板和凝血因子的附着提供了空间,使得凝血因子集聚在创面附近,加速凝血块的形成,有效阻止血液外流,从而快速止血[66]。何坤等[67]通过将胶原蛋白海绵与常见的纤维素止血材料进行比较发现,胶原蛋白海绵凝血效果和溶解度方面均优于羟乙基纤维素海绵和羧甲基纤维素钠海绵。Avitene?微纤维止血粉是基于牛胶原蛋白的可吸收止血粉,是胶原基止血粉的典型产品,已在国内外使用超过40年,在肝脏、骨科、脾脏、口腔和耳鼻喉科手术中均具有良好的止血效果[68]。然而一项研究显示,Avitene?处理的动物血清表现出较高的抗体水平,在源自真皮胶原的医疗器械比较中最具有免疫原性[69]。相较于动物源胶原,重组胶原在免疫原性方面有特殊优势,如HE等[70]通过毕赤酵母提取重组胶原制备冻干交联止血海绵,其能在体内完全降解,体外促凝效果明显优于天然胶原海绵,并且没有刺激、致敏、急性毒性、溶血或明显的免疫反应。 近年来,胶原蛋白与天然产物及其衍生物配伍形成的复合材料在止血领域备受关注,包括壳聚糖、纤维蛋白、海藻酸盐、纤维素和传统中药材提取物等[18]。JIN等[71]利用羟甲基壳聚糖、海藻酸钠和胶原蛋白为原料制备了一种复合微球,具有高吸水性、促进血小板聚集、活化巨噬细胞吞噬和抗菌活性等优点,被广泛用于外用止血,然而单组份无法提供所有特性。 2.6.4 骨骼填充 多种原因如创伤、感染、骨质疏松、恶性肿瘤等均可引起骨缺损,骨缺损手术难度高,治疗花费大及周期长,治疗过程中也伴随着各种并发症和功能障碍,成为骨科难以解决的难题之一[72]。胶原蛋白具有良好的生物相容性和骨传导性,有利于促进细胞的黏附、生长增殖和分化,可促进骨组织再生修复。EL-JAWHARI等[73]通过含有胶原蛋白牛骨支架(Orthoss?collagen)与不含胶原蛋白的牛骨支架进行多能基质细胞培养对比,发现含胶原蛋白的支架可容纳大量淋巴细胞和骨髓单核细胞,在支持多能基质细胞附着中表现出色,突出了胶原蛋白在骨修复应用中的重要性。 另外,由于胶原蛋白本身不具有骨诱导性[74],为了实现有效的骨替代和足够组织血管化,胶原复合材料成为有前景的应用方向。在胶原基材料中加入活性物质,比如血管生长因子、成骨细胞和抗生素等,如ZHANG等[75]将羟基磷灰石和胶原蛋白采用脱氢热的方法进行交联,细胞实验和动物实验均证明该材料具有较高的生物相容性,能在体内有效发挥诱导成骨作用。第一个装有重组人骨形态发生蛋白2的胶原蛋白移植物Infuse Bone?于2002年获得FDA批准,该产品由重组人骨形态发生蛋白2和可吸收胶原蛋白海绵组成。一项胫骨骨折临床试验显示,重组人骨形态发生蛋白2与胶原蛋白海绵作为植入物可减少二次干预的频率和手术的整体侵入性,加速骨折处和伤口处愈合,减少胫骨开发性骨折的感染率[76]。 "
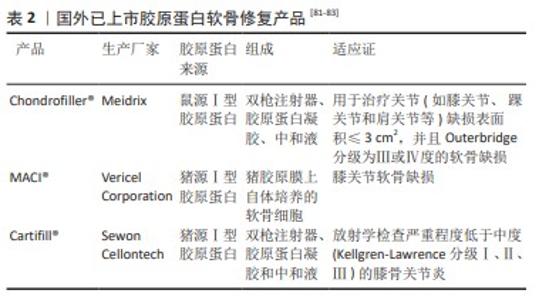
2.6.5 软骨修复 关节软骨处因缺乏血管自我修复能力有限,损伤后再生困难,未经治疗的软骨损失会进一步导致关节炎。胶原蛋白凝胶由于细胞外基质的结构和良好的生物相容性被认为是软骨再生的优异材料。2009年,ERGGELET等[77]首次发表无细胞基质软骨再生技术,属于基质诱导自身软骨再生。胶原蛋白凝胶的间隙结构可以为细胞迁移作为指导,并选择性地招募趋化细胞,常被用作自身软骨再生基质[78]。YANG等[79]通过比较胶原凝胶、京尼平交联胶原凝胶和透明酸钠凝胶的软骨诱导能力,显示早期胶原凝胶组更容易发现细胞聚集,并且软骨诱导能力优于交联胶原和透明质酸钠凝胶。一项前瞻性多中心临床研究显示,Ⅰ型胶原蛋白凝胶能明显改善膝关节缺损,显著改善患者肢体功能并减少术后疼痛[80]。 目前国内外针对软骨修复的胶原植入类商业化产品较少,如表2所示,急需被进一步开发。其中Chondrofiller?凝胶是一种可吸收的鼠源Ⅰ型胶原蛋白,可以作为软骨缺损区域的保护层,一旦将凝胶植入缺损部位,周围的干细胞和软骨细胞就会迁移胶原蛋白基质中,从而刺激软骨的愈合。临床研究显示,对于髋臼软骨损伤> 2 cm2的21例患者在髋关节镜检查期间使用Chondrofiller?治疗软骨损失,随访3-5年后17例患者获得了良好或有效的效果[81]。 2.6.6 牙周再生 拔牙或者缺失引起的颌部严重骨缺损通常会导致原始牙槽嵴尺寸恶化。引导骨再生技术是在口腔颌面重建手术中一种成熟的技术,已被证明对于骨缺损部位恢复骨量非常有效,这对于促进后续牙种植体至关重要[84]。在口腔种植手术中使用胶原膜进行引导骨再生已经非常普遍,临床使用中最典型的胶原膜产品是BioMend?,它是由戊二醛交联的牛Ⅰ型胶原纤维组织,约8周内可被吸收,可吸收性避免了二次手术,减少了伤口创伤和手术椅时间;在防止上皮细胞迁移的同时,允许必要的营养物质通过;良好的抗撕裂性、可缝合性和柔韧性,即使在水合情况下也易于处理,便于牙科手术进行[85]。 Bio-Gide?也是一款常用的纯天然胶原膜,无交联或其他成分,常用于牙周骨缺损治疗。Bio-Gide?通过两层独特结构支持骨再生和软组织再生,膜的多孔层朝向骨组织,便于骨细胞的长入;致密层可以阻挡结缔组织向骨缺损区内生长。一般Bio-Gide?胶原膜会与Bio-Oss骨粉联合使用,研究显示二者联合能刺激大量新骨和牙骨质形成,并且效果超过任一单一材料使用[86]。此外,新型的胶原膜也不断被开发,ALLAN等[87]开发了一款新型纯胶原膜GelGroTM,具有不同纤维排列的双层结构且不含异种抗原α-半乳糖苷,在皮质骨缺损模型研究中发现CelGroTM具有较强的骨重塑活性,并且与Bio-Gide?相比在骨缺陷界面处表现出更好的皮质排列和减少的孔隙率。 2.6.7 神经损伤修复 在周围神经系统中,胶原蛋白以施万细胞周围基底层内膜的间质纤维(Ⅰ型胶原蛋白)和非原纤维成分(Ⅳ型胶原)存在。神经组织工程学的重点是恢复脊髓和大脑中受损的周围神经或中枢神经组织。多种合成或天然材料的神经导管已应用于神经外科,其中Ⅰ型胶原蛋白神经导管最为流行。胶原蛋白神经导管可包裹受伤的神经组织,作为轴突在整个神经间隙再生中的桥梁,有助于对齐再生轴突[88];还可以起到屏障作用,防止瘢痕产生的同时作为营养物质交换的介质,并且经过6-12个月的吸收,逐渐被再生轴突和宿主细胞所替代。 NeuraGen?胶原蛋白神经导管由Integra公司开发,并在2001年获得FDA批准,在临床上用于治疗周围神经缺损。一项回顾性研究对使用NeuraGen?胶原导管的患者进行神经恢复定量测试,发现35%-45%的患者报告感觉或运动功能有所改善[89]。胶原神经导管目前已经已在临床良好地应用了数十年,目前唯一的缺点是这些导管无法修复超过3 cm的神经间隙和直径> 2.3 mm的神经[90],因此,改良胶原神经导管应用长度一直是热点研究方向。另外,在神经导管基础上引入干细胞、神经营养因子能进一步促进周围神经组织的修复,例如:MATHOT等[91]试图将人类脂肪间充质干细胞引入NeuraGen?导管中,干细胞生长取得良好表现;MADDURI等[92]开发了可以释放神经营养因子与神经生长因子的胶原导管,但这些具有创新性的应用仍停留在临床前模型测试阶段,需要通过各类实验验证其可行性与安全性。 "
| [1] ZHAO C, XIAO Y, LING S, et al. Structure of Collagen. Methods Mol Biol. 2021;2347:17-25. [2] VAN DER REST M, GARRONE R. Collagen family of proteins. FASEB J. 1991;5(13):2814-2823. [3] 张贵锋,高建萍,徐丽明,等.胶原的百年研究历程回顾与展望[J].生物学杂志,2023,40(1):1-8. [4] FERTALA A, SIERON AL, HOJIMA Y, et al. Self-assembly into fibrils of collagen II by enzymic cleavage of recombinant procollagen II. Lag period, critical concentration, and morphology of fibrils differ from collagen I. J Biol Chem. 1994;269(15):11584-11589. [5] 范代娣,段明瑞,米钰,等.重组E.coli工程菌高密度培养生产人源型胶原蛋白[J].化工学报,2002,53(7):752-754. [6] SHOULDERS MD, RAINES RT. Collagen structure and stability. Annu Rev Biochem. 2009;78:929-958. [7] 王璐,但年华,但卫华.Ⅰ型胶原的制备与性能表征[J].生物医学工程与临床,2018,22(1):104-109. [8] 朱必康,罗善超,罗世兴.鱼皮胶原在组织工程中的研究进展与主要应用[J].中国组织工程研究,2021,25(28):4561-45. [9] 赵然,曹敏杰,王晶,等.水产动物源胶原蛋白的提取及应用研究进展[J].食品安全质量检测学报,2020,11(22):8157-8165. [10] 傅容湛,范代娣,杨婉娟,等.重组胶原蛋白的产业发展历程和生物医学应用前景展望[J].生物工程学报,2022,38(9):3228-3242. [11] CHOWDHURY SR, MH BUSRA MF, LOKANATHAN Y, et al. Collagen Type I: A Versatile Biomaterial. Adv Exp Med Biol. 2018;1077:389-414. [12] BELLA J. Collagen structure: new tricks from a very old dog. Biochem J. 2016;473(8):1001-1025. [13] 迟妍妍,乐尧金,刘旭昭,等.胶原蛋白海绵的生物特性及体内降解吸收[J].中国组织工程研究,2014,18(34):5515-5519. [14] 黎洪棉,高建华,鲁峰,等.海绵状Ⅰ型胶原蛋白与兔脂肪干细胞的生物相容性[J].中国组织工程研究与临床康复,2009,13(25):4829-4833. [15] ELANGO J, HOU C, BAO B, et al. The Molecular Interaction of Collagen with Cell Receptors for Biological Function. Polymers (Basel). 2022; 14(5):876. [16] HEINO J. Cellular signaling by collagen-binding integrins. Adv Exp Med Biol. 2014;819:143-155. [17] KOIVUNEN J, TU H, KEMPPAINEN A, et al. Integrin α11β1 is a receptor for collagen XIII. Cell Tissue Res. 2021;383(3):1135-1153. [18] 闫星雨,但年华,陈一宁,等.胶原基复合止血材料的研究进展及展望[J].材料导报,2023,37(5):240-248. [19] FARNDALE RW, SIXMA JJ, BARNES MJ, et al. The role of collagen in thrombosis and hemostasis. J Thromb Haemost. 2004;2(4):561-573. [20] 宋易航,王楚浩,方柏山.胶原酶研究进展与应用[J].化工学报, 2019,70(9):3213-3227. [21] GU L, SHAN T, MA YX, et al. Novel Biomedical Applications of Crosslinked Collagen. Trends Biotechnol. 2019;37(5):464-491. [22] 杜晓丹.胶原类医疗器械产品的免疫原性研究[D].北京:中国药品生物制品检定所,2008. [23] DOILLON CJ, WHYNE CF, BRANDWEIN S, et al. Collagen-based wound dressings: control of the pore structure and morphology. J Biomed Mater Res. 1986;20(8):1219-1228. [24] JIANG X, WANG Y, FAN D, et al. A novel human-like collagen hemostatic sponge with uniform morphology, good biodegradability and biocompatibility. J Biomater Appl. 2017;31(8):1099-1107. [25] DAVIDENKO N, GIBB T, SCHUSTER C, et al. Biomimetic collagen scaffolds with anisotropic pore architecture. Acta Biomater. 2012;8(2):667-676. [26] SUN L, LI B, JIANG D, et al. Nile tilapia skin collagen sponge modified with chemical cross-linkers as a biomedical hemostatic material. Colloids Surf B Biointerfaces. 2017;159:89-96. [27] WANG W, ZHANG Y, YE R, et al. Physical crosslinkings of edible collagen casing. Int J Biol Macromol. 2015;81:920-925. [28] MITRA T, SAILAKSHMI G, GNANAMANI A, et al. Preparation and characterization of a thermostable and biodegradable biopolymers using natural cross-linker. Int J Biol Macromol. 2011;48(2):276-285. [29] ADAMIAK K, SIONKOWSKA A. Current methods of collagen cross-linking: Review. Int J Biol Macromol. 2020;161:550-560. [30] STACHEL I, SCHWARZENBOLZ U, HENLE T, et al. Cross-linking of type I collagen with microbial transglutaminase: identification of cross-linking sites. Biomacromolecules. 2010;11(3):698-705. [31] 陈凯丽.罗非鱼胶原蛋白粉剂的低温制备工艺及促伤口愈合性能研究与评价[D].烟台:烟台大学,2022. [32] WOLF K, SOBRAL P, TELIS V. Physicochemical characterization of collagen fibers and collagen powder for self-composite film production. Food Hydrocolloid. 2009;23(7):1886-1894. [33] YANG L, CHEN K, LIU P, et al. Preparation of Nile tilapia skin collagen powder by low-temperature and comprehensive evaluation of hemostasis and wound healing. Int J Artif Organs. 2023;46(2):99-112. [34] 林海.医用胶原蛋白粉剂及胶原基复合膜的研制与性能表征[D].成都:四川大学,2006. [35] CALCIOLARI E, RAVANETTI F, STRANGE A, et al. Degradation pattern of a porcine collagen membrane in an in vivo model of guided bone regeneration. J Periodontal Res. 2018;53(3):430-439. [36] 顾安琪,周文洁,王跃平.胶原膜在引导骨再生技术中的应用和改良研究进展[J].中国口腔颌面外科杂志,2023,21(6):615-620. [37] 田振华,王颖.氧化羧甲基纤维素钠改性胶原膜的制备及表征[J].皮革科学与工程,2020,30(4):7-12. [38] LEE JE, PARK JC, LEE KH, et al. Laminin modified infection-preventing collagen membrane containing silver sulfadiazine-hyaluronan microparticles. Artif Organs. 2002;26(6):521-528. [39] 周喻,张静怡,吴文惠.生物医药工程材料胶原蛋白静电纺丝制品的应用进展[J].中国生物制品学杂志,2018,31(3):323-327. [40] 韩洪帅,宋秘钊,李家鑫,等.胶原蛋白的提取及其纳米纤维的制备与表征[J].食品工业科技,2023,44(19):182-190. [41] ZHENG J, YANG CY, WANG X. Blow-Spun Collagen Nanofibrous Spongy Membrane: Preparation and Characterization. Tissue Eng Part C Methods. 2022;28(1):3-11. [42] YANG S, SHI X, LI X, et al. Oriented collagen fiber membranes formed through counter-rotating extrusion and their application in tendon regeneration. Biomaterials. 2019;207:61-75. [43] 田振华,何静瑄,王颖.胶原自组装与化学交联制备水凝胶及其性能表征[J].陕西科技大学学报,2021,39(3):1-6+13. [44] SKOPINSKA-WISNIEWSKA J, OLSZEWSKI K, BAJEK A, et al. Dialysis as a method of obtaining neutral collagen gels. Mater Sci Eng C Mater Biol Appl. 2014;40:65-70. [45] XU C, WEI X, SHU F, et al. Induction of fiber-like aggregation and gelation of collagen by ultraviolet irradiation at low temperature. Int J Biol Macromol. 2020;153:232-239. [46] DUAN L, YUAN Q, XIANG H, et al. Fabrication and characterization of a novel collagen-catechol hydrogel. J Biomater Appl. 2018;32(7):862-870. [47] LOTZ C, SCHMID FF, OECHSLE E, et al. Cross-linked Collagen Hydrogel Matrix Resisting Contraction To Facilitate Full-Thickness Skin Equivalents. ACS Appl Mater Interfaces. 2017;9(24):20417-20425. [48] CHAN BP, HUI TY, CHAN OC, et al. Photochemical cross-linking for collagen-based scaffolds: a study on optical properties, mechanical properties, stability, and hematocompatibility. Tissue Eng. 2007;13(1): 73-85. [49] 杨彩仙.Trypsin酶和高渗盐水对真皮脱细胞基质性能影响的实验研究[D].太原:太原理工大学,2021. [50] GIEREK M, ŁABUŚ W, KITALA D, et al. Human Acellular Dermal Matrix in Reconstructive Surgery-A Review. Biomedicines. 2022;10(11):2870. [51] 蒋鸿辉,孔媛媛,刘婧,等.制备脱细胞基质生物墨水在心血管疾病领域中的应用[J].中国组织工程研究,2023,27(30):4904-4911. [52] 何晶,敖强.制备细胞外基质材料组织脱细胞方法的研究与热点[J].中国组织工程研究,2020,24(34):5413-5420. [53] 杨顺,赵明月,涂希玲,等.脱细胞基质复合支架在组织再生中的应用[J].中国组织工程研究,2023,27(30):4856-4861. [54] CHATTOPADHYAY S, RAINES RT. Review collagen-based biomaterials for wound healing. Biopolymers. 2014;101(8):821-833. [55] METZMACHER I, RUTH P, ABEL M, et al. In vitro binding of matrix metalloproteinase-2 (MMP-2), MMP-9, and bacterial collagenase on collagenous wound dressings. Wound Repair Regen. 2007;15(4): 549-555. [56] TAM EM, WU YI, BUTLER GS, et al. Collagen binding properties of the membrane type-1 matrix metalloproteinase (MT1-MMP) hemopexin C domain. The ectodomain of the 44-kDa autocatalytic product of MT1-MMP inhibits cell invasion by disrupting native type I collagen cleavage. J Biol Chem. 2002;277(41):39005-39014. [57] SONG M, LIU Y, HUI L. Preparation and characterization of acellular adipose tissue matrix using a combination of physical and chemical treatments. Mol Med Rep. 2018;17(1):138-146. [58] DOERLER M, EMING S, DISSEMOND J, et al. A novel epidermal growth factor--containing wound dressing for the treatment of hard-to-heal venous leg ulcers. Adv Skin Wound Care. 2014;27(10):456-460. [59] YAO CC, YAO P, WU H, et al. Absorbable collagen sponge combined with recombinant human basic fibroblast growth factor promotes nerve regeneration in rat sciatic nerve. J Mater Sci Mater Med. 2007; 18(10):1969-1972. [60] SUN L, LI L, WANG Y, et al. A collagen-based bi-layered composite dressing for accelerated wound healing. J Tissue Viability. 2022;31(1): 180-189. [61] KIRSNER RS. The use of Apligraf in acute wounds. J Dermatol. 1998; 25(12):805-811. [62] JANSEN LA, DE CAIGNY P, GUAY NA, et al. The evidence base for the acellular dermal matrix AlloDerm: a systematic review. Ann Plast Surg. 2013;70(5):587-594. [63] YANNAS IV, BURKE JF, ORGILL DP, et al. Wound tissue can utilize a polymeric template to synthesize a functional extension of skin. Science. 1982;215(4529):174-176. [64] HEIMBACH DM, WARDEN GD, LUTERMAN A, et al. Multicenter postapproval clinical trial of Integra dermal regeneration template for burn treatment. J Burn Care Rehabil. 2003;24(1):42-48. [65] COLN D, HORTON J, OGDEN ME, et al. Evaluation of hemostatic agents in experimental splenic lacerations. Am J Surg. 1983;145(2):256-259. [66] 王运智.两种鱼皮胶原止血海绵理化性能研究与生物学评价[D].烟台:烟台大学,2019. [67] 何坤,崔含蕊,毛战强,等.胶原蛋白海绵与常见纤维素海绵止血材料的理化性质及凝血效果对比研究[J].中国医学装备,2023, 20(10):201-205. [68] CZIPERLE DJ. Avitene™ Microfibrillar Collagen Hemostat for Adjunctive Hemostasis in Surgical Procedures: A Systematic Literature Review. Med Devices (Auckl). 2021;14:155-163. [69] DELUSTRO F, CONDELL RA, NGUYEN MA, et al. A comparative study of the biologic and immunologic response to medical devices derived from dermal collagen. J Biomed Mater Res. 1986;20(1):109-120. [70] HE Y, WANG J, SI Y, et al. A novel gene recombinant collagen hemostatic sponge with excellent biocompatibility and hemostatic effect. Int J Biol Macromol. 2021;178:296-305. [71] JIN J, JI Z, XU M, et al. Microspheres of Carboxymethyl Chitosan, Sodium Alginate, and Collagen as a Hemostatic Agent in Vivo. ACS Biomater Sci Eng. 2018;4(7):2541-2551. [72] 孔祥宇,王兴,裴志伟,等.生物支架材料及打印技术修复骨缺损[J].中国组织工程研究,2024,28(3):479-485. [73] EL-JAWHARI JJ, SANJURJO-RODRÍGUEZ C, JONES E, et al. Collagen-containing scaffolds enhance attachment and proliferation of non-cultured bone marrow multipotential stromal cells. J Orthop Res. 2016;34(4):597-606. [74] RICO-LLANOS GA, BORREGO-GONZÁLEZ S, MONCAYO-DONOSO M, et al. Collagen Type I Biomaterials as Scaffolds for Bone Tissue Engineering. Polymers (Basel). 2021;13(4):599. [75] ZHANG Z, MA Z, ZHANG Y, et al. Dehydrothermally crosslinked collagen/hydroxyapatite composite for enhanced in vivo bone repair. Colloids Surf B Biointerfaces. 2018;163:394-401. [76] GOVENDER S, CSIMMA C, GENANT HK, et al. Recombinant human bone morphogenetic protein-2 for treatment of open tibial fractures: a prospective, controlled, randomized study of four hundred and fifty patients. J Bone Joint Surg Am. 2002;84(12):2123-2134. [77] ERGGELET C, ENDRES M, NEUMANN K, et al. Formation of cartilage repair tissue in articular cartilage defects pretreated with microfracture and covered with cell-free polymer-based implants. J Orthop Res. 2009;27(10):1353-1360. [78] SUN L, XU Y, HAN Y, et al. Collagen-Based Hydrogels for Cartilage Regeneration. Orthop Surg. 2023;15(12):3026-3045. [79] YANG J, TANG Z, LIU Y, et al. Comparison of chondro-inductivity between collagen and hyaluronic acid hydrogel based on chemical/physical microenvironment. Int J Biol Macromol. 2021;182: 1941-1952. [80] SCHNEIDER U, RACKWITZ L, ANDEREYA S, et al. A prospective multicenter study on the outcome of type I collagen hydrogel-based autologous chondrocyte implantation (CaReS) for the repair of articular cartilage defects in the knee. Am J Sports Med. 2011;39(12): 2558-2565. [81] MAZEK J, GNATOWSKI M, SALAS AP, et al. Arthroscopic utilization of ChondroFiller gel for the treatment of hip articular cartilage defects: a cohort study with 12- to 60-month follow-up. J Hip Preserv Surg. 2021;8(1):22-27. [82] KIM MS, KOH IJ, IN Y. Porcine-Derived Collagen-Augmented Chondrogenesis Technique for Treating Knee Cartilage Defects. JBJS Essent Surg Tech. 2021;11(3):e20.00028. [83] FLANIGAN DC, SHERMAN SL, CHILELLI B, et al. Consensus on Rehabilitation Guidelines among Orthopedic Surgeons in the United States following Use of Third-Generation Articular Cartilage Repair (MACI) for Treatment of Knee Cartilage Lesions. Cartilage. 2021; 13(1_suppl):1782S-1790S. [84] PILIPCHUK SP, PLONKA AB, MONJE A, et al. Tissue engineering for bone regeneration and osseointegration in the oral cavity. Dent Mater. 2015;31(4):317-338. [85] KISHORE DT, BANDIWADEKAR T, PADMA R, et al. Evaluation of relative efficacy of β-tricalcium phosphate with and without type I resorbable collagen membrane in periodontal infrabony defects: a clinical and radiographic study. J Contemp Dent Pract. 2013;14(2):193-201. [86] CAMELO M, NEVINS ML, LYNCH SE, et al. Periodontal regeneration with an autogenous bone-Bio-Oss composite graft and a Bio-Gide membrane. Int J Periodontics Restorative Dent. 2001;21(2):109-119. [87] ALLAN B, RUAN R, LANDAO-BASSONGA E, et al. Collagen Membrane for Guided Bone Regeneration in Dental and Orthopedic Applications. Tissue Eng Part A. 2021;27(5-6):372-381. [88] LI ST, ARCHIBALD SJ, KRARUP C, et al. Peripheral nerve repair with collagen conduits. Clin Mater. 1992;9(3-4):195-200. [89] WANGENSTEEN KJ, KALLIAINEN LK. Collagen tube conduits in peripheral nerve repair: a retrospective analysis. Hand (N Y). 2010;5(3):273-277. [90] MOORE AM, KASUKURTHI R, MAGILL CK, et al. Limitations of conduits in peripheral nerve repairs. Hand (N Y). 2009;4(2):180-186. [91] MATHOT F, RBIA N, THALER R, et al. Introducing human adipose-derived mesenchymal stem cells to Avance® nerve grafts and NeuraGen® nerve guides. J Plast Reconstr Aesthet Surg. 2020;73(8): 1473-1481. [92] MADDURI S, FELDMAN K, TERVOORT T, et al. Collagen nerve conduits releasing the neurotrophic factors GDNF and NGF. J Control Release. 2010;143(2):168-174. |
| [1] | Chen Jing, Zhang Nan, Meng Qinghua, Bao Chunyu. Material characterization of finite element computational models of knee joints at different ages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7369-7375. |
| [2] | Chen Senlin, Zhu Zhou, Wan Qianbing. Application of Janus micro/nanoparticles in biomedicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6101-6109. |
| [3] | Lan Xiaoqian, Feng Guangli, Qin Shiyi, Zhong Lianmei, Li Qing. New ideas and opportunities for polyurethane materials in peripheral nerve repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6127-6137. |
| [4] | Zhao Yue, Xu Yan, Zhou Jianping, Zhang Xujing, Chen Yutong, Jin Zhengyang, Yin Zhitao. Differences in structural design between traditional and bionic scaffolds in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3458-3468. |
| [5] | Feng Shuqi, Zhang Shiyong, Yao Keyi, Tang Yufei, Wang Kai, Zhou Xuemei, Xiang Lin. Application of photoresponsive nanomaterials in bone tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3469-3475. |
| [6] | He Rui, Li Chongyi, Wang Ruiyao, Zeng Dan, Fan Daidi. Application of MXene-based hydrogels in wound repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3486-3493. |
| [7] | Ye Chao, Liu Xiaohong. Regulatory strategies for foreign body reactions in biomaterials [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3513-3520. |
| [8] | Xiao Wenqian, Han Hongjuan, Yang Haocheng, Li Bo, He Binyan. Field-driven medical micro-robots: application prospect of continuously optimizing material preparation process [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2097-2104. |
| [9] | Chen Jiahan, Feng Chao, Huang Xiaoxia, Niu Minghui, Wang Xin, Teng Yong. Two-dimensional black phosphorus materials for bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2124-2131. |
| [10] | Liu Haoyang, Xie Qiang, Shen Mengran, Ren Yansong, Ma Jinhui, Wang Bailiang, Yue Debo, Wang Weiguo . Application, research hotspots, and shortcomings of degradable zinc-based alloys in bone defect repair and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 839-845. |
| [11] | Chen Yilong, Zhang Xu, Li Hong. Mechanical analysis of fiber post combined with different crown restorations for endodontically treated non-carious cervical lesions [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 866-871. |
| [12] | Yu Ming, Wang Wen. Posterior cruciate ligament tibial attachment point avulsion fracture: materials, implants, and internal fixation techniques in arthroscopic treatment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 872-880. |
| [13] | Gao Xilin, Wu Si Zhang Chao Zhu Liguo, Fu Bifeng, Wang Ping. Mechanotransduction proteins in intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 579-589. |
| [14] | Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [15] | Cheng Weilu, Wang Zehua, Zhang Yidan, Liu Yinghui. Application and regulatory challenges of organoid technology in medical field [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(1): 202-210. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||