Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (16): 3513-3520.doi: 10.12307/2025.414
Regulatory strategies for foreign body reactions in biomaterials
Ye Chao, Liu Xiaohong
- Department of Cardiovascular Surgery, Changhai Hospital Affiliated to Naval Medical University, Shanghai 200433, China
-
Received:2024-02-29Accepted:2024-04-03Online:2025-06-08Published:2024-09-06 -
Contact:Ye Chao, Master candidate, Department of Cardiovascular Surgery, Changhai Hospital Affiliated to Naval Medical University, Shanghai 200433, China -
About author:Liu Xiaohong, MD, Professor, Department of Cardiovascular Surgery, Changhai Hospital Affiliated to Naval Medical University, Shanghai 200433, China -
Supported by:National Natural Science Foundation of China, No. 82270379 (to LXH)
CLC Number:
Cite this article
Ye Chao, Liu Xiaohong. Regulatory strategies for foreign body reactions in biomaterials[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3513-3520.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks

2.1 生物材料异物反应的发生机制 异物反应是一个复杂的过程,涉及多种细胞类型和分子的相互作用(图3)。植入物植入后最先发生的是血浆蛋白(主要包括白蛋白和纤维蛋白原)在材料表面的吸附,这种吸附会导致蛋白质的构象发生变化,从而触发先天免疫系统中的细胞对异物进行识别。参与主导异物反应的炎性细胞主要包括中性粒细胞、单核细胞和巨噬细胞。中性粒细胞是最先到达炎症部位的细胞,在植入后的2 d内就会被招募到植入部位,能分泌多种生长因子和基质金属蛋白酶,以促进细胞外基质的重塑[8]。急性炎症的早期阶段通常会持续约1周,但若存在异物,此炎症可能会变为持续状态并发展成慢性炎症[9],此阶段以单核细胞浸润和由单核细胞分化形成的巨噬细胞活化为特征,大致持续3周。巨噬细胞是纤维包膜形成的关键成分[10],其具有极高的可塑性,能够在微环境的影响下分化为促炎“M1”型和的抗炎“M2”型巨噬细胞[11]。M1型巨噬细胞分泌促炎细胞因子(如白细胞介素1)和趋化因子,而M2型巨噬细胞则会上调抗炎途径和促进组织重塑。在免疫反应的初期,M1型的巨噬细胞占主导地位,随着慢性炎症的缓解,巨噬细胞逐渐转变为M2型并参与伤口的自然愈合过程。当植入物持续存在时,愈合过程会被延迟,M1型巨噬细胞会继续增殖并融合形成异物巨细胞[12]。异物巨细胞不能吞噬过大的物体,但能够促进活性氧和细胞外基质降解蛋白酶的生成[13],从而损坏植入物和周围组织。同时,异物巨细胞还能调节植入物周围的细胞因子浓度,比如血小板源性生长因子的浓度,以此吸引成纤维细胞,从而推进纤维化的形成[14],这一过程可能导致生物材料表面发生过量的细胞外基质沉积[15],损害植入物的功能并缩短其使用寿命。 "

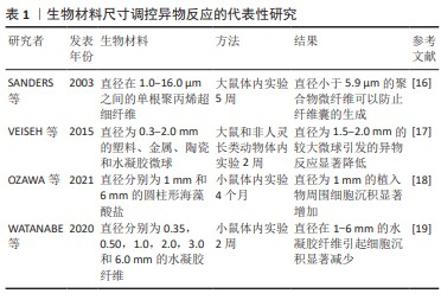
2.2 生物材料异物反应的调控策略 2.2.1 基于生物材料表面改性的调控策略 生物材料的表面属性会直接影响蛋白质间的交互以及免疫细胞的反应。通过调整生物材料的表面特性,例如尺寸、形状、粗糙度、表面电荷、亲水性以及机械刚度,能够减轻其对免疫系统的刺激,进而降低异物反应发生的风险。 基于生物材料的尺寸和形状的调控策略:植入物的尺寸和形状显著地影响了异物反应。SANDERS等[16]将直径在1.0-16.0 μm之间的单根聚丙烯超细纤维植入大鼠皮下,5周后评估异物反应,发现直径小于5.9 μm的聚合物微纤维可以防止纤维囊的生成。由微小纤维引起的细胞外基质变形较小,这可能有助于防止细胞迁移到植入物产生的空隙中。VEISEH等[17]对不同大小和形状的材料(如塑料、金属、陶瓷和水凝胶)进行了异物反应评估,将直径为0.3-2.0 mm的微球分别植入啮齿动物和非人灵长类动物的腹膜内和皮下,2周后发现当植入物材料、植入物种类和植入部位相同时,直径为1.5-2.0 mm的较大微球引发的异物反应显著降低,认为这种效应可能是由于较小微球表面较高的曲率引发的。OZAWA等[18]在小鼠皮下植入圆柱形海藻酸盐植入物(直径分别为1 mm和6mm),发现直径为1 mm的植入物周围细胞沉积显著增加,其表面形成较厚的纤维化层。WATANABE等[19]研究发现,与更小的水凝胶纤维相比,直径在1-6 mm的水凝胶纤维引起细胞沉积显著减少。HUH等[20]的研究发现,不同大小的盘状硅胶植入物引起的炎症反应和纤维囊厚度相似。大多数研究一致认为植入物的尺寸影响异物反应(表1),观察结果的差异可能是由于不同的实验设置、材料和表面属性造成的。 VEISEH等[17]的研究发现,相较于盘状植入物,球形植入物引发的异物反应更为轻微。在设计植入物形状时,避免锐角和不连续性是需要考虑的重要因素。锐角由于界面应力大可能会引发更密集的纤维化反应,进而可能导致严重的组织损伤。在微观尺度上,植入物的高度或者纤维直径小于6 μm可能有助于防止纤维化囊的生成。在宏观尺度上,相比于较大的球形或圆柱形植入物,较小的球形或圆柱形植入物引发的异物反应相对较强。总的来说,这些结果验证了在设计植入物时需要考虑植入物的尺寸,避免尖锐的不连续形状和锐角。理想的植入物尺寸和形状应该根据植入物需要发挥作用的具体空间来确定。 基于生物材料的表面形貌和粗糙度的调控策略:植入物的表面形态和粗糙度能调控表面吸附蛋白的密度和构象和活性[21],进而诱导炎症细胞因子的分泌和巨噬细胞的融合。IVANOVA等[22]使用表面选择性激光烧结的方法将不同大小的聚交酯颗粒(大部分100-200 μm、中部分56-100 μm和小部分< 56 μm)制成表面粗糙度小于2 μm的植入物,分别植入兔耳缘皮肤袋中(皮肤真皮和耳软骨软骨周围),2个月后发现,由大颗粒制成的植入物引发了较为温和的炎症反应,并且在组织周围形成纤维囊的速度较慢。LAMICHHANE等[23]的研究发现,与平整的(粗糙度0.17 μm)和膨胀的(粗糙度0.37 μm)聚四氟乙烯相比,表面粗糙度为1.08 μm的静电纺丝聚四氟乙烯减少了巨噬细胞的附着和异物巨细胞的形成。MAJD等[24]在聚二甲基硅氧烷材料表面制备了具有不同微米间距、微米长度的点状纤连蛋白涂层,植入大鼠皮下30 d后发现,与无涂层圆盘相比,具有4 μm×2 μm纤连蛋白微点涂层的材料在表面巨噬细胞的黏附、肌成纤维细胞激活以及纤维囊膜厚度方面均显著下降。聚己内酯以良好的生物相容性、缓慢的降解动态、低成本和易于改性的特性,在组织工程支架领域中得到了广泛应用[25]。ZHENG等[26]的研究表明,相较于光滑的聚己内酯表面,在大鼠皮下植入近红外光照射下形成微槽的聚己内酯膜能够促进巨噬细胞的延伸,进而增加M2表型的极化。乳房假体植入物的临床数据表明,与非纹理的同类产品相比,将微尺度纹理引入硅胶乳房植入物的表面后在临床随访中的囊膜形成率较低[27]。 通过调整表面特征的高度和深度可以调节细胞黏附模式,进而影响异物反应的发生。粗糙度小于1 μm对缓解异物反应的影响几乎可以忽略不计,但是在1-4 μm范围内的表面特性则表现出改善植入物整合的可能性。直径小于免疫细胞大小的限制性空间可以限制炎症细胞在材料表面的扩散和活化[28]。尽管调整表面的形态可以减轻异物反应,但保持设备的整体机械性能和功能特性是至关重要的。 基于生物材料的表面电荷的调控策略:在异物反应的各个阶段,材料表面的电荷对蛋白质的吸附以及免疫细胞与材料的交互都会对材料的异物反应产生影响。吸附是由材料表面上的总电荷所决定的,而不是由原子级的静电作用决定的。材料和流体界面处的电荷取决于材料表面等电点与周围流体的pH值间的平衡[29]。低于或高于表面等电点的pH值会使表面分别呈现出正电荷或负电荷,带负电荷的细胞和带电材料表面之间的静电相互作用加剧了生物材料的异物反应。LEE等[30]对带有不同电荷的水凝胶引发的异物反应进行了比较,发现具有正电荷的水凝胶可能会引发急性炎症反应,表现为免疫细胞的大量渗透、胶原的积聚以及新生血管的形成;而带有负电荷的水凝胶则引发较轻的炎症反应、胶原沉积和有限的新生血管形成。在另一项体外实验中,该研究团队测试了用2价阳离子修饰后的纳米结构钛表面对巨噬细胞附着和增殖的影响,相比于未经修饰的纳米结构表面,处理后的材料表面孵育24 h后的细胞黏附情况显著减少,巨噬细胞M2表型的极化有所增加[29]。中性的净电荷能避免蛋白质吸附在材料表面上[31]。两性离子材料包含带正负电荷的部分,其特殊的结构使得电荷保持中性平衡,通过与水分子的静电作用形成一个水合层,有效防止了蛋白质在材料表面的吸附[32]。最近,磷酰胆碱、羧基甜菜碱、磺基甜菜碱等两性离子材料因具备超低沉积的特质已经引起了广泛关注[33]。 将表面电荷作为一个单一因素进行分离和研究,避免其他特性(如表面润湿性)可能具有挑战性[34]。相比于带正电的材料表面,带负电的材料表面似乎会引发更轻微的异物反应,造成的纤维胶囊沉积更薄,新血管的形成也更有限。中性电荷的表面则能有效抑制蛋白质的吸附,显著减少异物反应程度。 基于生物材料表面湿润性的调控策略:拥有亲水表面的材料能有效调节蛋白质的吸附,进而影响异物反应。THEVENOT等[35]研究发现,官能团如羧基(-COOH)、羟基(-OH)和胺基(-NH2)能够提升材料的亲水性。采用表面改性技术,例如紫外线、等离子体处理或离子束注入,可以提高材料表面的亲水性。DUAN等[36]的研究发现,将具有亲水性-NH2基团的聚-D赖氨酸接枝到不饱和聚氨酯膜上,可以激活M2表型信号的下游信号传导途径,诱导巨噬细胞向M2表型极化。VISALAKSHA等[37]的研究发现,加入亲水性的羧酸部分会使材料对白蛋白的亲和力上升,同时增加了M2型巨噬细胞的抗炎细胞因子表达;添加疏水性的甲基部分会增强材料对调理素IgG 2的亲和力,进而提升M1型巨噬细胞的促炎细胞因子表达。QIAN等[38]使用肝素二糖逐层处理聚己内酯纳米纤维的表面,植入大鼠皮下28 d后发现,与未修饰的聚己内酯相比,处理后的聚己内酯表面巨噬细胞的黏附显著下降,表明肝素的亲水特性可以在炎症的早期阶段减少非特异性的蛋白质交互作用。除了功能化之外,纤维的排列与孔隙率也可对纤维材料的润湿性产生影响。相对于孔隙度较低的素材,具有较高孔隙度的聚对苯二甲酸乙二醇酯纺丝织物植入物表现出更强的亲水性,并且在体外实验中降低了细胞的增殖能力[39]。 总的来说,以上的研究充分揭示了表面润湿性对于材料生物相容性的重要作用,在设计植入物时需要考虑到具有机械和化学稳定官能团的亲水性表面,通过诱导巨噬细胞极化可以调控蛋白质的吸附,从而加速组织的修复过程。 "
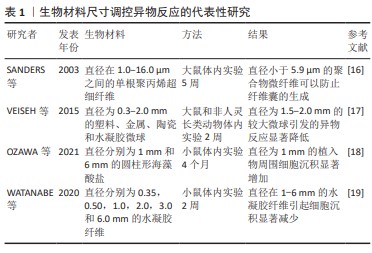
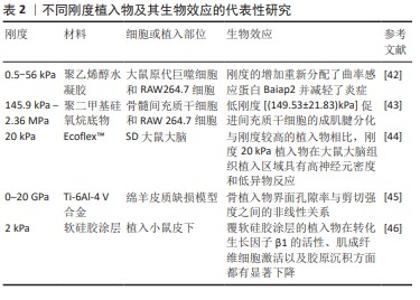
基于生物材料的刚度的调控策略:植入物刚度是影响异物反应的重要因素(表2)。合适的植入材料应具有与周围组织相似的机械性能,植入物与周围组织之间的刚度不匹配会导致植入物失效[40]。植入材料的刚度在决定其物理特性和免疫反应方面起着至关重要的作用,这通常以弹性模量为特征。植入物如果具有与周围组织相近的弹性模量,则有可能避免强烈的免疫反应。在生物和非生物交界处,弹性模量的不匹配会成为形成纤维瘢痕的关键因素之一[41]。NI等[42]的研究发现,巨噬细胞刚度感应在早期黏附阶段的潜在机制通常涉及细胞膜在不同刚度基质上的变形。巨噬细胞通过黏附和改变膜曲率对底物施加牵引应力,这导致曲率感应蛋白Baiap2分布不均匀,进一步导致细胞骨架的重塑和炎症的抑制。低刚度[(149.53±21.83) kPa]的聚二甲基硅氧烷底物通过抑制ERK 1/2信号传导促进间充质干细胞的成肌腱分化,而在软底物上培养的巨噬细胞倾向于产生更多的活性氧并极化为M1巨噬细胞,从而阻碍间充质干细胞的成肌腱分化[43]。目前常用的脑部植入体主要为硅质植入体,其刚度(1-30 kPa)远高于脑组织,这可能引发急性异物反应,对脑功能造成影响。为了匹配刚度,ZHANG等[44]制造了一种具有20 kPa弹性模量的机械匹配大脑植入物,置入大鼠大脑组织的3周和9周观察期内,该植入物显示出显著的高神经元密度和低异物反应。KELLY等[45]研究了刚度、孔隙率和生物相容性之间的关系,发现多孔钛植入物的强度和弹性模量随着孔隙率的增加而降低,骨体积/总体积和可用空隙中骨体积的比值增加,同时发现骨整合与孔隙率之间存在非线性关系。LODYGA等[46]将软硅胶涂层(刚度为2 kPa)应用到硬质硅胶植入物(刚度为2 MPa)上,植入小鼠皮下30 d后发现,相较于未经涂覆的植入物,涂覆软硅胶涂层的植入物在转化生长因子β1活性、肌成纤维细胞激活以及胶原沉积方面都有显著下降。 在异物反应过程中,植入材料的机械信号通过调节细胞机械传感器将细胞外机械信号转化为生物信号,从而影响纤维囊的形成。然而在不同疾病模型中,植入物的刚度与异物反应之间的复杂关系尚未完全明了,因此需要深入研究植入物刚度对异物反应的潜在机制,其临床意义值得重视[47]。"

2.2.2 基于药物递送的调控策略 转化生长因子β1是促纤维化的细胞因子,抑制这一因子可减轻植入物的纤维化程度。PARK等[48]在大鼠皮下植入可以控制释放转化生长因子β1 抑制剂曲尼司特的硅胶植入物,12周后发现,与未经处理的硅胶植入物相比,处理后硅胶植入物纤维囊厚度和胶原蛋白密度显著降低。吡非尼酮是通过下调转化生长因子β1表达来治疗特发性肺纤维化的药物,研究表明,在乳房下同时植入硅胶植入物和吡非尼酮能使植入部位周围的胶原含量减少50%[49]。糖皮质激素通过降低转化生长因子β1水平和减少肌成纤维细胞数量,有效抑制新血管生成[50]。FITZGERALD[51]将掺有地塞米松的硅胶微通道植入物植入大鼠坐骨神经1年,与未释放任何药物的对照装置相比,含有地塞米松的再生微通道植入物纤维包膜厚度显著减小。PAKSHIR等[52]应用低分子质量、无聚合物的类固醇涂层,在大鼠皮下植入模型中以控制释放地塞米松的方式抑制促炎巨噬细胞活化,植入后至少45 d内,成纤维细胞的活化、胶原沉积和纤维化包膜的形成受到抑制。CHANDORKAR等[53]在小鼠皮下植入了可生物降解的水杨酸-聚酯,在植入后的第2,4和16周发现,与广泛使用的聚乳酸-羟基乙酸共聚物相比,水杨酸-聚酯引发的异物反应较低。常见的抗炎药阿司匹林可以降低炎症小体活化,从而显著减轻异物反应[54]。CHEN等[55]研究发现,用趋化因子CXCL12包被胰岛或用掺入趋化因子的海藻酸盐对胰岛进行微胶囊化,能抵抗纤维化并促进胰岛的存活。DESAI等[56]在治疗1型糖尿病的微囊化细胞疗法研究中将药物洗脱技术和优化的材料设计相结合,显著提升了植入物的性能。FARAH等[57]将致密晶格结构制备的抗炎药物晶体与装载有胰岛素产生细胞的海藻酸微球相结合,分别抑制啮齿动物和非人灵长类动物的异物反应至少1.3年和6个月,同时还发现集落刺激因子1受体在异物反应相关炎症中发挥独特作用。使用植入物封装和全身递送的小分子化合物抑制集落刺激因子1受体,能降低植入材料周围的巨噬细胞活性和纤维化,同时不影响伤口愈合。综上,通过可控药物引起的持续化学作用可减缓或抑制巨噬细胞的促纤维化过程,进而减轻异物反应。 2.2.3 基于生物材料仿生表面修饰的调控策略 借鉴自然的仿生表面修饰是一种极具潜力的调控异物反应策略,它可以使植入物避免免疫系统的识别并促进组织与植入物的整合。在这一部分将介绍近期对植入性生物材料进行仿生处理的方法。 两性离子涂层已被证明是减轻植入性设备异物反应的有效策略。YANG等[58]在神经微电极上涂覆了聚甲基丙烯酸磺基甜菜碱制成的两性离子层,在短期植入实验中发现,相较于未涂覆的对照,涂覆的微电极能显著降低成纤维细胞和小胶质细胞的附着。DONG等[59]发现由聚磺酸甜菜碱和聚羧基甜菜碱水凝胶组成的两性离子弹性体网络水凝胶,在小鼠皮下植入后可抵抗纤维包膜的形成长达 1 年。LI等[60]受磷丝氨酸介导的天然免疫耐受现象启发,研发了两性磷丝氨酸水凝胶圆盘,在富含纤维蛋白原的培养环境中该水凝胶展现出了优秀的抗黏附性。三氮唑-两性离子水凝胶适用于胰岛包裹及移植,具有优于传统两性离子水凝胶的机械稳定性,并且维持了类似的抗生物结垢能力,这种材料能促进新生血管形成,增强氧气和营养交换,有效减轻异物反应[61]。VEGAS等[62]创建了一个广泛的组合藻酸盐水凝胶库,以评估化学修饰材料在非人灵长类动物中减轻异物反应的效果,实验发现含有改性三唑衍生物的海藻酸盐在材料表面表现出较低的免疫细胞募集率,并阻止了巨噬细胞的激活。2-甲基丙烯酰氧乙基磷酰胆碱是一种存在于生物膜中含有磷酰胆碱亲水基团的水溶性化合物,具有抵抗炎细胞黏附特性。KANG等[63]将2-甲基丙烯酰氧乙基磷酰胆碱修饰的硅胶乳房植入物植入到猪模型的肌肉下间隙,发现与未经修饰的同种植入物相比,修饰后的植入物在6个月内可以显著降低α平滑肌肌动蛋白和转化生长因子β水平,减少纤维组织的形成。 TAN等[64]的研究发现,相较于仅涂有纤维连接蛋白处理和无处理的聚醚砜封装膜,涂覆了细胞外基质蛋白质、纤维连接蛋白和白细胞介素4的聚醚砜封装膜植入小鼠皮下14 d后形成的纤维囊更薄。果胶是一种自然的多糖,可以阻断 Toll样受体信号[65],这是巨噬细胞被招募到植入部位的一个关键环节[66]。HU等[67]将低度甲酯化的果胶混合到交联的海藻酸载体细胞水凝胶中,植入小鼠皮下28 d后发现,与未经处理的水凝胶相比,该水凝胶的纤维包膜厚度显著降低。SONG等[68]将机械生长因子1(胰岛素生长因子1的另一种剪接结果)功能化在丝素蛋白修饰的聚己内酯纳米纤维支架上,相较于丝素蛋白修饰的聚己内酯支架和未经修饰的聚己内酯支架,该支架在大鼠皮下植入28 d后通过上调抗炎症信号级联(例如信号转导和转录激活蛋白6的激活)引起了更少的纤维组织形成和更高的M2/M1比例。 综上所述,这些研究确认了生物活性分子涂层在短期内可有效引导免疫应答朝向组织修复阶段。然而对于涂层的长期效应,现有研究尚未明确,因此需要在体外和体内进行更广泛的研究。生物材料仿生表面修饰调控异物反应的代表性研究,见表3。"

| [1] GUAN M, CHEN Y, WEI Y, et al. Long-lasting bactericidal activity through selective physical puncture and controlled ions release of polydopamine and silver nanoparticles-loaded TiO2 nanorods in vitro and in vivo. Int J Nanomedicine. 2019;14:2903-2914. [2] GULATI K, CHOPRA D, KOCAK-OZTUG NA, et al. Fit and forget: The future of dental implant therapy via nanotechnology. Adv Drug Deliv Rev. 2023;199:114900. [3] WANG Y, TAN P, WU Y, et al. Artificial intelligence-enhanced skin-like sensors based on flexible nanogenerators. View. 2022;3(5):20220026. [4] KAMP NJ, AL-KHATIB SM. The subcutaneous implantable cardioverter-defibrillator in review. Am Heart J. 2019;217:131-139. [5] ZHOU L, LYU J, LIU F, et al. Immunogenic PANoptosis-Initiated Cancer Sono-Immune Reediting Nanotherapy by Iteratively Boosting Cancer Immunity Cycle. Adv Mater. 2024;36(2):2305361. [6] WHITAKER R, HERNAEZ-ESTRADA B, HERNANDEZ RM, et al. Immunomodulatory Biomaterials for Tissue Repair. Chem Rev. 2021; 121(18):11305-11335. [7] PARKER JB, GRIFFIN MF, SPIELMAN AF, et al. Exploring the Overlooked Roles and Mechanisms of Fibroblasts in the Foreign Body Response. Adv Wound Care (New Rochelle). 2023;12(2):85-96. [8] ZHANG B, SU Y, ZHOU J, et al. Toward a Better Regeneration through Implant‐Mediated Immunomodulation: Harnessing the Immune Responses. Adv Sci. 2021;8(16):2100446. [9] TYLEK T, BLUM C, HRYNEVICH A, et al. Precisely defined fiber scaffolds with 40 μm porosity induce elongation driven M2-like polarization of human macrophages. Biofabrication. 2020;12(2):025007. [10] SCHOENENBERGER AD, TEMPFER H, LEHNER C, et al. Macromechanics and polycaprolactone fiber organization drive macrophage polarization and regulate inflammatory activation of tendon in vitro and in vivo. Biomaterials. 2020;249:120034. [11] DENG M, TAN J, HU C, et al. Modification of PLGA Scaffold by MSC-Derived Extracellular Matrix Combats Macrophage Inflammation to Initiate Bone Regeneration via TGF-β-Induced Protein. Adv Healthc Mater. 2021;10(12):e2100872. [12] CHU C, LIU L, RUNG S, et al. Modulation of foreign body reaction and macrophage phenotypes concerning microenvironment. J Biomed Mater Res A. 2020;108(1):127-135. [13] YUE L, SHI Y, SU X, et al. Matrix metalloproteinases inhibitors in idiopathic pulmonary fibrosis: Medicinal chemistry perspectives. Eur J Med Chem. 2021;224:113714. [14] NOSKOVICOVA N, HINZ B, PAKSHIR P. Implant Fibrosis and the Underappreciated Role of Myofibroblasts in the Foreign Body Reaction. Cells. 2021;10(7): 1794. [15] SCHUSTER R, ROCKEL JS, KAPOOR M, et al. The inflammatory speech of fibroblasts. Immunol Rev. 2021;302(1):126-146. [16] SANDERS JE, ROCHEFORT JR. Fibrous encapsulation of single polymer microfibers depends on their vertical dimension in subcutaneous tissue. J Biomed Mater Res A. 2003;67(4):1181-1187. [17] VEISEH O, DOLOFF JC, MA M, et al. Size- and shape-dependent foreign body immune response to materials implanted in rodents and non-human primates. Nat Mater. 2015;14(6):643-651. [18] OZAWA F, NAGATA S, ODA H, et al. Lotus-root-shaped cell-encapsulated construct as a retrieval graft for long-term transplantation of human iPSC-derived β-cells. iScience. 2021;24(4):102309. [19] WATANABE T, OKITSU T, OZAWA F, et al. Millimeter-thick xenoislet-laden fibers as retrievable transplants mitigate foreign body reactions for long-term glycemic control in diabetic mice. Biomaterials. 2020;255: 120162. [20] HUH BK, KIM BH, KIM CR, et al. Elastic net of polyurethane strands for sustained delivery of triamcinolone around silicone implants of various sizes. Mater Sci Eng C Mater Biol Appl. 2020;109:110565. [21] ZHOU L, LI K, LIU Y, et al. Living Cell-Derived Intelligent Nanobots for Precision Oncotherapy. Adv Funct Mater. 2024;34(10):2311857. [22] IVANOVA E, FAYZULLIN A, MINAEV N, et al. Surface Topography of PLA Implants Defines the Outcome of Foreign Body Reaction: An In Vivo Study. Polymers (Basel). 2023;15(20):4119. [23] LAMICHHANE S, ANDERSON JA, VIERHOUT T, et al. Polytetrafluoroethylene topographies determine the adhesion, activation, and foreign body giant cell formation of macrophages. J Biomed Mater Res A. 2017;105(9):2441-2450. [24] MAJD H, SCHERER SS, BOO S, et al. Novel micropatterns mechanically control fibrotic reactions at the surface of silicone implants. Biomaterials. 2015;54:136-147. [25] DWIVEDI R, KUMAR S, PANDEY R, et al. Polycaprolactone as biomaterial for bone scaffolds: Review of literature. J Oral Biol Craniofac Res. 2020; 10(1):381-388. [26] ZHENG X, XIN L, LUO Y, et al. Near-Infrared-Triggered Dynamic Surface Topography for Sequential Modulation of Macrophage Phenotypes. ACS Appl Mater Interfaces. 2019;11(46):43689-43697. [27] BARNSLEY GP, SIGURDSON LJ, BARNSLEY SE. Textured surface breast implants in the prevention of capsular contracture among breast augmentation patients: a meta-analysis of randomized controlled trials. Plast Reconstr Surg. 2006;117(7):2182-2190. [28] ROBOTTI F, BOTTAN S, FRASCHETTI F, et al. A micron-scale surface topography design reducing cell adhesion to implanted materials. Sci Rep. 2018;8(1):10887. [29] WILSON CJ, CLEGG RE, LEAVESLEY DI, et al. Mediation of biomaterial-cell interactions by adsorbed proteins: a review. Tissue Eng. 2005;11(1-2):1-18. [30] LEE CH, KIM YJ, JANG JH, et al. Modulating macrophage polarization with divalent cations in nanostructured titanium implant surfaces. Nanotechnology. 2016;27(8):085101. [31] WEI Q, BECHERER T, ANGIOLETTI-UBERTI S, et al. Protein interactions with polymer coatings and biomaterials. Angew Chem Int Ed Engl. 2014;53(31):8004-8031. [32] CHEN S, LIU L, JIANG S. Strong resistance of oligo(phosphorylcholine) self-assembled monolayers to protein adsorption. Langmuir. 2006; 22(6):2418-2421. [33] LEE SY, LEE Y, LE THI P, et al. Sulfobetaine methacrylate hydrogel-coated anti-fouling surfaces for implantable biomedical devices. Biomater Res. 2018;22:3. [34] XIE Y, HU C, FENG Y, et al. Osteoimmunomodulatory effects of biomaterial modification strategies on macrophage polarization and bone regeneration. Regen Biomater. 2020;7(3):233-245. [35] THEVENOT P, HU W, TANG L. Surface chemistry influences implant biocompatibility. Curr Top Med Chem. 2008;8(4):270-280. [36] DUAN Y, ZHENG H, LI Z, et al. Unsaturated polyurethane films grafted with enantiomeric polylysine promotes macrophage polarization to a M2 phenotype through PI3K/Akt1/mTOR axis. Biomaterials. 2020;246:120012. [37] VISALAKSHAN RM, MACGREGOR MN, SASIDHARAN S, et al. Biomaterial Surface Hydrophobicity-Mediated Serum Protein Adsorption and Immune Responses. ACS Appl Mater Interfaces. 2019;11(31):27615-27623. [38] QIAN Y, LI L, SONG Y, et al. Surface modification of nanofibrous matrices via layer-by-layer functionalized silk assembly for mitigating the foreign body reaction. Biomaterials. 2018;164:22-37. [39] GIRAULT E, BIGUENET F, EIDENSCHENK A, et al. Fibrous biomaterials: Effect of textile topography on foreign body reaction. J Biomed Mater Res B Appl Biomater. 2021;109(10):1512-1524. [40] WU L, ZHANG Z. Effects of implant and vocal fold stiffness on voice production after medialization laryngoplasty in an MRI-based vocal fold model. J Biomech. 2023;149:111483. [41] GORI M, VADALÀ G, GIANNITELLI SM, et al. Biomedical and Tissue Engineering Strategies to Control Foreign Body Reaction to Invasive Neural Electrodes. Front Bioeng Biotechnol. 2021;9:659033. [42] NI Y, QI H, ZHANG F, et al. Macrophages modulate stiffness-related foreign body responses through plasma membrane deformation. Proc Natl Acad Sci U S A. 2023;120(3):e2213837120. [43] SHENG R, LIU J, ZHANG W, et al. Material Stiffness in Cooperation with Macrophage Paracrine Signals Determines the Tenogenic Differentiation of Mesenchymal Stem Cells. Adv Sci. 2023;10(17):2206814. [44] ZHANG EN, CLÉMENT J, ALAMERI A, et al. Mechanically Matched Silicone Brain Implants Reduce Brain Foreign Body Response. Adv Mater Technol. 2021;6(3):2000909. [45] KELLY CN, WANG T, CROWLEY J, et al. High-strength, porous additively manufactured implants with optimized mechanical osseointegration. Biomaterials. 2021;279:121206. [46] LODYGA M, HINZ B. TGF-β1 - A truly transforming growth factor in fibrosis and immunity. Semin Cell Dev Biol. 2020;101:123-139. [47] LI R, FENG D, HAN S, et al. Macrophages and fibroblasts in foreign body reactions: How mechanical cues drive cell functions? Mater Today Bio. 2023;22:100783. [48] PARK S, PARK M, KIM BH, et al. Acute suppression of TGF-ß with local, sustained release of tranilast against the formation of fibrous capsules around silicone implants. J Control Release. 2015;200:125-137. [49] XIE X, DOLOFF JC, YESILYURT V, et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nat Biomed Eng. 2018;2(12):894-906. [50] MILLER M, CHO JY, MCELWAIN K, et al. Corticosteroids prevent myofibroblast accumulation and airway remodeling in mice. Am J Physiol Lung Cell Mol Physiol. 2006;290(1):L162-169. [51] FITZGERALD JJ. Suppression of scarring in peripheral nerve implants by drug elution. J Neural Eng. 2016;13(2):026006. [52] PAKSHIR P, YOUNESI F, WOOTTON KA, et al. Controlled release of low-molecular weight, polymer-free corticosteroid coatings suppresses fibrotic encapsulation of implanted medical devices. Biomaterials. 2022;286:121586. [53] CHANDORKAR Y, BHASKAR N, MADRAS G, et al. Long-term sustained release of salicylic acid from cross-linked biodegradable polyester induces a reduced foreign body response in mice. Biomacromolecules. 2015;16(2):636-649. [54] MALIK AF, HOQUE R, OUYANG X, et al. Inflammasome components Asc and caspase-1 mediate biomaterial-induced inflammation and foreign body response. Proc Natl Acad Sci U S A. 2011;108(50): 20095-20100. [55] CHEN T, YUAN J, DUNCANSON S, et al. Alginate encapsulant incorporating CXCL12 supports long-term allo- and xenoislet transplantation without systemic immune suppression. Am J Transplant. 2015;15(3):618-627. [56] DESAI T, SHEA LD. Advances in islet encapsulation technologies. Nat Rev Drug Discov. 2017;16(5):338-350. [57] FARAH S, DOLOFF JC, MÜLLER P, et al. Long-term implant fibrosis prevention in rodents and non-human primates using crystallized drug formulations. Nat Mater. 2019;18(8):892-904. [58] YANG Q, WU B, ELES JR, et al. Zwitterionic Polymer Coating Suppresses Microglial Encapsulation to Neural Implants In Vitro and In Vivo. Adv Biosyst. 2020;4(6):e1900287. [59] DONG D, TSAO C, HUNG HC, et al. High-strength and fibrous capsule-resistant zwitterionic elastomers. Sci Adv. 2021;7(1):eabc5442. [60] LI B, YUAN Z, JAIN P, et al. De novo design of functional zwitterionic biomimetic material for immunomodulation. Sci Adv. 2020;6(22): eaba0754. [61] CHEN X, YANG D. Functional zwitterionic biomaterials for administration of insulin. Biomater Sci. 2020;8(18):4906-4919. [62] VEGAS AJ, VEISEH O, DOLOFF JC, et al. Corrigendum: Combinatorial hydrogel library enables identification of materials that mitigate the foreign body response in primates. Nat Biotechnol. 2016;34(6): 666. [63] KANG S, KIM J, KIM S, et al. Efficient reduction of fibrous capsule formation around silicone breast implants densely grafted with 2-methacryloyloxyethyl phosphorylcholine (MPC) polymers by heat-induced polymerization. Biomater Sci. 2020;8(6):1580-1591. [64] TAN RP, HALLAHAN N, KOSOBRODOVA E, et al. Bioactivation of Encapsulation Membranes Reduces Fibrosis and Enhances Cell Survival. ACS Appl Mater Interfaces. 2020;12(51):56908-56923. [65] SAHASRABUDHE NM, BEUKEMA M, TIAN L, et al. Dietary Fiber Pectin Directly Blocks Toll-Like Receptor 2-1 and Prevents Doxorubicin-Induced Ileitis. Front Immunol. 2018;9:383. [66] FAN W, FU D, ZHANG L, et al. Enoxaparin sodium bone cement plays an anti-inflammatory immunomodulatory role by inducing the polarization of M2 macrophages. J Orthop Surg Res. 2023;18(1):380. [67] HU S, MARTINEZ-GARCIA FD, MOEUN BN, et al. An immune regulatory 3D-printed alginate-pectin construct for immunoisolation of insulin producing β-cells. Mater Sci Eng C Mater Biol Appl. 2021; 123:112009. [68] SONG Y, LI L, ZHAO W, et al. Surface modification of electrospun fibers with mechano-growth factor for mitigating the foreign-body reaction. Bioact Mater. 2021;6(9):2983-2998. [69] BADYLAK SF. TISSUE REGENERATION.A scaffold immune microenvironment. Science (New York, N.Y.). 2016;352(6283):298. |
| [1] | Ma Lisha, He Huiyu, Wufanbieke·Baheti, Lyu Shangyi, Han Xiangzhen. effect of graphene oxide/hydroxyapatite composite coating on immune activity of RAW264.7 macrophages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2023-2029. |
| [2] | Xiao Hui, Li Dongyan, Ji Jing, Wang Lizhen. Action mechanisms and application pathways of biomaterials in promoting corneal alkali burn repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2162-2170. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||