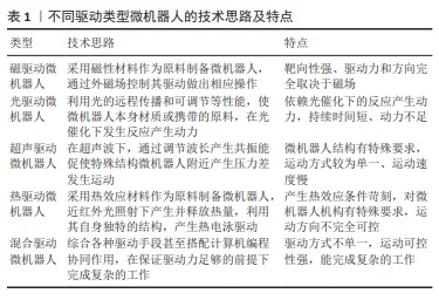
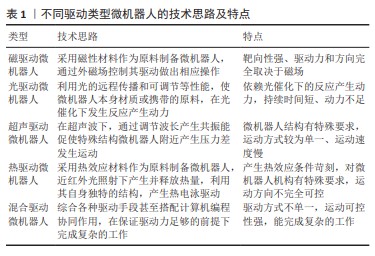
Chinese Journal of Tissue Engineering Research ›› 2025, Vol. 29 ›› Issue (10): 2097-2104.doi: 10.12307/2025.408
Previous Articles Next Articles
Field-driven medical micro-robots: application prospect of continuously optimizing material preparation process
Xiao Wenqian1, Han Hongjuan1, Yang Haocheng1, Li Bo1, He Binyan2
- 1Chongqing Engineering Laboratory of Nano/Micro Biomedical Detection Technology, Chongqing University of Science and Technology, Chongqing 401331, China; 2Operating Room, Mianyang Cancer Hospital, Mianyang 621000, Sichuan Province, China
-
Received:2024-01-19Accepted:2024-03-09Online:2025-04-08Published:2024-08-22 -
Contact:Li Bo, Professor, Chongqing Engineering Laboratory of Nano/Micro Biomedical Detection Technology, Chongqing University of Science and Technology, Chongqing 401331, China Corresponding author: He Binyan, Associate chief nurse, Operating Room, Mianyang Cancer Hospital, Mianyang 621000, Sichuan Province, China -
About author:Xiao Wenqian, PhD, Associate professor, Chongqing Engineering Laboratory of Nano/Micro Biomedical Detection Technology, Chongqing University of Science and Technology, Chongqing 401331, China -
Supported by:Chongqing Natural Science Foundation (General Project), No. cstc2021jcyj-msxmX0360 (to LB); Chongqing Natural Science Foundation (General Project), No. cstc2021jcyj-msxmX0707 (to XWQ); Science and Technology Project of Chongqing Municipal Education Commission, No. KJZD-K202301503 (to LB); Science and Technology Project of Chongqing Municipal Education Commission, No. KJQN202101534 (to XWQ); 2023-2024 Higher Education Science Research Project of Chongqing Higher Education Association, No. cqgj23114C (to LB)
CLC Number:
Cite this article
Xiao Wenqian, Han Hongjuan, Yang Haocheng, Li Bo, He Binyan. Field-driven medical micro-robots: application prospect of continuously optimizing material preparation process[J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2097-2104.
share this article
Add to citation manager EndNote|Reference Manager|ProCite|BibTeX|RefWorks
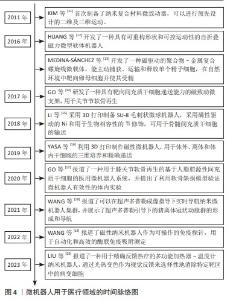
2.1 微机器人用于医疗领域的时间脉络 根据纳入文献结果显示,自20世纪90年代随着微电子机械系统的发展,微机器人开始出现[2-3]。2010年前关于场驱动微机器人用于医疗领域的报道较少,2011年后,KIM等[11]制备了可以在二维和三维方向上运动的微机器人。随着生物材料和组织工程的发展,基于自下而上构建块体组织的微支架也得到了迅速发展,开始有研究者通过超顺磁纳米粒子修饰制备微支架,磁控微机器人开始出现。HUANG等[12]开发了一种具有可重构形状和可控运动性的自折叠磁力微型软体机器人。MEDINA-SáNCHEZ等[13]开发了一种磁驱动的聚合物-金属复合螺旋线微载体。纳米机器人开始与其他功能复合,比如:磁性纳米机器人用于输送干细胞修复软骨,作为免疫探针用于自动化和高效的酶联免疫吸附测定,用于杀伤肿瘤细胞的可精确反馈热疗的加热器-温度计纳米机器人,极大地促进了微机器人在医疗领域中的应用[14-20]。微机器人用于医疗领域的时间脉络见图4。"

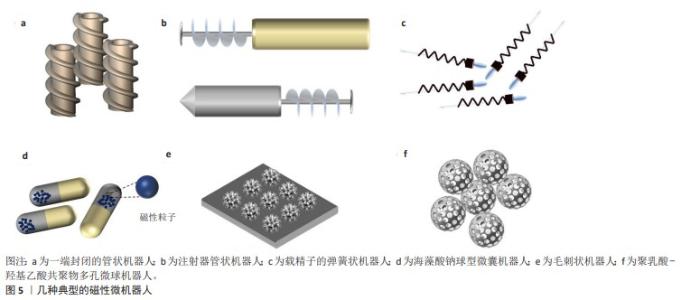
2.2.1 磁驱动微机器人 磁驱动可将外部磁场转化为机械能,具备显著的安全性、可控性、可靠性和效率优势,其适用范围广泛,响应速度快,无需机器人本身具备特殊表面或结构,能够有效消除工作距离限制,并保持机器人运动的高自由度。某些材料可以对外加磁场产生效应,如铁磁性材料、超顺磁材料、巨磁致伸缩材料等,铁磁性材料存在磁滞现象,表明铁磁材料在磁化之后仍被外部磁场磁化,当通过施加各种磁场作用时磁矩趋向于与外部磁场;当外部磁场消除时,顺磁性材料的磁性消失。利用这类材料通过不同工艺研制的微机器人被外部磁场磁化后,磁性物质之间的相互作用使它们能够动态形成各种模式,从而实现在无线驱动下完成各种复杂的工作[21-22]。 鉴于磁性医疗机器人通常要用于人体,需要具备较高的生物相容性,同时微机器人具备体积小、灵活性高以及可调控性强等特点,通常采用磁性纳米粒子修饰生物相容性较好的组织工程微支架,进而构建新型的磁驱动医疗微机器人。典型的微机器人具有管状,弹簧状或球状等结构,如图5所示。为了改善细胞保留率低和靶向准确率低等限制干细胞移植的问题,YASA等[16]研制了以磁性粒子修饰的一端封闭管状微转运体,用于在微流控通道内收集、运输和释放细胞。HUANG等[23]设计了一种类似注射器形状的微机器人,在磁场驱动下可以同时释放药物和载细胞的明胶微球,使其具备了多功能化。随着3D激光打印技术的日趋成熟,将其应用于磁驱动微机器人的制造成为一种重要的发展趋势[15],例如:利用3D打印技术可以批量制造弹簧状的微机器人,这类微机器人可作为高效的细胞和精子输送载体[13,24]。微机器人还可设计成具有多种功能的单元,YAN等[25]报道利用藻类模板制备螺旋游泳微机器人,在载细胞同时兼具有荧光和磁共振成像功能,可利用成像引导治疗。相比于这些规则形状结构的微机器人,球形结构在使用微创注射时具有更多的优势。ZHAO等[26]通过与微流控芯片制备了一种异质结构的海藻酸钠球形微囊,该微囊一半封闭有磁性颗粒另一半则用于封装细胞,可以受外部磁场控制和操纵,并且不需进行表面修饰。为了装载更多的细胞,LI等[15]提出了毛刺状磁性微机球器人,该微机器人由使用3D打印制备SU-8微单元,采用磁性驱动的Ni和用于生物相容性的Ti修饰,可用于骨髓间充质干细胞运输,该微机器人具有磁性驱动功能和良好的生物相容性。GO等[14,17]利用乳化法制备多孔聚乳酸-羟基乙酸共聚物微球并修饰超顺磁纳米粒子,制备了一种多孔微球载细胞机器人,载干细胞用于软骨修复。该团队为了进一步模拟细胞外基质的纳米纤维结构,利用相分离方法制备纳米纤维结构的微球并修饰超顺磁纳米粒子,也制备了一种微球机器人[27]。与3D打印技术相比,通过物理或化学方法更易于制备均相且对称的多孔微球,以此来模拟细胞外基质的纳米结构,经过磁性粒子的修饰后这种微球可以转化为磁性微机器人,该方法不需要昂贵的3D打印设备。3D打印技术更适合制备具有特殊结构的微机器人。受到材料及工艺的限制,大多数微机器人都属于硬质机器人范畴。受到自然界软体动物(如章鱼、毛虫等)的启发,科研工作者已经研发出了多种磁驱动软体微机器人[12,28]。TANG等[29]报道了一种基于磁性脱氧核糖核酸水凝胶的软机器人,它具有形状自适应特性,能够在受限和非结构化空间中进行磁驱动导航运动。HU等[30]提出了一种由硅橡胶和NdFeB制作的软体薄膜微机器人,通过定向充磁实现了可编程的多形态运动,根据所处环境不同,通过程序调整磁场可以完成爬行、滚动等多模式切换。一些天然生物体,比如海藻[31]、精子[32]、细菌经过杂化修饰超顺磁纳米粒子也可以制备成软体微机器人[33]。PARK等[33]报道的大肠杆菌杂化驱动微机器人,主要采用嵌入聚电解质微粒中的Fe3O4纳米粒子起到方向盘的作用,从而为生物混合微机器人提供对方向的定向控制。为了增强微机器人的灵活性完成更为复杂的操作,LI等[34]将磁性镍纳米线掺杂在光感水凝胶中,实现了根据磁场改变方向、光驱动行走的软体“小黄人”机器人,通过调节磁场和光照的频率,配合编程成功,让该微机器人完成了在轴向行走、翻滚、抓取等一系列复杂操作。但是,磁场效应在应用过程中会受到体内环境影响,为了尽可能地提高微机器人在体内的精准治疗,目前研究的应用场景多选择于血管、骨关节腔等相对阻力较小的部位,下一步的研究方向是在保持微机器人良好的生物相容性的同时,一方面尽可能提高材料的磁化强度,另一方面优化所配套的体外场驱动装置,能够满足于在这些局部范围实现对微机器人的精准操控,从而实现对该部位的精准小范围靶向治疗[35-36]。 2.2.2 光驱动微机器人 光能是一种方向可控、功率可变的无线能源。光驱动微/纳米机器人有许多优点,如远程控制能力和高时空分辨率[37]。光具有无线传播和远程传输能力,其辐射能量可调节。光驱动的微/纳米机器人主要基于光催化反应,光催化反应是由其附近的材料或电荷梯度或气泡的产生驱动的。光驱动的微/纳米机器人通常含有可以被光激活的驱动响应剂,借助光驱动微型机器人将光能转变为微机器人的动能,根据驱动原理的差异,通常可以将其分为自扩散、气泡驱动、自由泳等类别。根据光波的不同,光驱动微/纳米机器人可分为近红外光激活、紫外光激活和可见光激活3大类。MOU等[38]提出紫外光控制的TiO2微管分解H2O2水溶液,通过反应产生的气泡从而推动微机器人运动。ZHOU等[39]报道了一种由可见光驱动的Cu2O/Au微机器人,通过分解过氧化氢(H2O2)溶液实现在液体环境下自由泳运动。在此基础上,CAI等[40]给气泡驱动微机器人加入编码颗粒,从而提高了灵敏度及检测效率。当前,光催化反应中的化学驱动主要采用H2O2作为反应试剂,然而H2O2具有一定的毒性,因此其在生物医学领域的应用受到一定限制[41]。ZHANG等[42]提出了一种半球形结构的光驱动微机器人制备方法,通过将碳微球一分为二并在每个半球上制造由Au/WO3材料构成的“两面神”(Janus)型机器人,在光催化的作用下反应物产生浓度梯度进而分解水产生O2,O2在微机器人表面向四周扩散,产生的电泳力驱动微机器人的运动。此后,DAI等[43]开发了一种TiO2/Si Janus纳米树结构光驱动微机器人,其可以感应外部光源的照明方向,可以实现趋光和避光运动。尽管光驱动微机器人的研究已取得了一定的进展,但由于可见光难以穿透人体进入器官或组织内部,使得光驱动微机器人的研究仍处于体外实验阶段。 2.2.3 其他动力驱动微机器人 除了报道较多的磁驱动和光驱动微机器人外,还存在一些动力源,例如超声场、红外热驱动等。高频超声波是一种频率高于人类听力极限的声波,它可以利用产生的气泡聚集或微机器人本身的不对称性,在高频超声波下产生压力差,从而驱动微机器人运动。WANG等[44]利用高频超声场作为动力源制备出一种金属纳米线微机器人,在不同频段的声波下其能以200 μm/s的速度完成轴向运动或完成环状运行轨迹。在此基础上,ZHOU等[45]开发出球型微机器人,在高频超声下可绕轨旋转运动。 具有热效应的材料,通常也可通过建立热梯度的方式将热能转化为机械能,从而驱动微型机器人的运动[46]。WU等[47]报道了一种光热触发的微机器人,其主要材料是镀金多层聚合物,在近红外光照射下微机器人表面产生离子共振,释放出热量,由于其结构的不对称性内外热场分布不均匀,在热泳力的作用下推动微机器人移动。这种微机器人大多运用了Janus结构,Janus粒子具有2个或多个不同的结构域,这些结构域在成分或表面特征上是各向异性的,它们在单个粒子中集成了不同甚至不兼容的特性,使它们能够同时执行不同的功能和多个任务[48]。然而在仅依靠单一外场作为动力源的情况下,微机器人通常只能进行机械地重复单一的轨迹运动,由单一的高频超声、热梯度、光感等方式驱动的微机器人均面临动力不足、运动方式单一等问题。因此,科研人员也将更多的关注转向了多场混合驱动微机器人,在多场的联合控制下微机器人的各种复杂微操作得以实现[49]。 2.3 微机器人在医疗领域的应用前景 2.3.1 微机器人与肠道检测 自200多年前问世以来,内窥镜已经经历了多个阶段的发展。从早期的口腔光学内窥镜到光导纤维内窥镜,再到如今广泛应用的电子内窥镜,随着电子信息技术和其他科学的不断进步,内窥镜的功能和用途也发生了深刻的变革,其中的代表就是胶囊智能微机器人[50]。以色列的Given Imagining公司生产出一种PillCam SB系列胶囊内窥镜微影像诊断机器人,并且已经实现商业化应用,该机器人可以探测到常规胃肠镜不能探测的位置,还可以根据肠道蠕动的快慢调整拍摄的频率,当机器人在肠道内拍摄影像时医生将在第一时间收到影像资料,从而进行诊断[51]。随着研究的不断深入,各科研团队相继开发出了各种新型的胶囊微机器人。LIEN等[52]开发出了一款手持式磁控胶囊微机器人,可同时观察食道和胃,初步研究数据表明食道、胃、十二指肠整体检测完成率分别为100%,85.2%和86.1%。传统的胶囊微机器人主要通过肠道消化系统的蠕动进行诊断检查,难以对目标部位进行靶向诊断,将微胶囊与场驱动结合可以更加精准地检查目标部位。JIANG等[53]通过磁球辅助驱动胶囊微机器人通过幽门进入十二指肠,显著缩短了通过幽门的时间,提高小肠检查的完成率。总体而言,此类胶囊智能微机器人的工作原理是通过患者吞服进体内,然后在体内进行影像检测,最后通过粪便排出体外,但由于其体积较小,电池容量有限,只能维持6-8 h的工作时间,通常情况下进入大肠前电量就会耗尽。现有的方案是通过磁驱动辅助运动,在一定程度上缓解电量的消耗。因此,如何进一步提高工作时长和效率是此类机器人发展的关键。 2.3.2 微机器人与药物靶向输送 药物运输微机器人通过外场驱动方式运动,具有方向性更强、作用时间更久等优点,因此受到广泛关注[54]。这类微机器人的尺寸通常在纳米级别,具有优异的理化性能和大比表面积,它们并非独自完成任务,而是通过集群方式工作,整体携带的药物量较大。通过外场提供动力并控制方向,微机器人群能准确到达患者体内受损部位进行药物精确释放,实现靶向治疗的目的,这将有利于缩短患者康复时间,提高治疗效率[55]。 药物靶向微机器人的一个典型的应用领域是肿瘤治疗,微机器人在外部场的作用下能够迅速而准确地定位肿瘤细胞,同时包含药物的载体仅在肿瘤细胞附近释放药物,从而降低了抗癌药物可能带来的不良反应[56]。在此基础上,通过对外部场的控制可以随时对微机器人和肿瘤细胞进行监测,使得结合微机器人与生物技术的靶向药物运输与释放成为一种全新的抗肿瘤策略[57]。已有许多研究证明,微机器人在人体环境中可以实现药物的靶向输送。WANG等[58]开发出了一种多孔棒状金属微机器人,其独特的多孔结构能够支持运载更多的药物,在超声和磁场混合驱动下到达肿瘤细胞的位置,通过近红外释放药物实现了对单个肿瘤细胞的定点“爆破”。SUN等[59]利用松花粉制备出磁性微机器人,将阿霉素通过真空加载的方式填入微机器人的真空腔内,通过特有的协同行为到达癌细胞部位,在磁刺激下微机器人空腔内的转子产生流体释放出药物,最终将肿瘤细胞杀死。MARTEL课题组证实在外部磁场的驱动下,趋磁细菌微机器人成功将携带有药物的脂质体输送到肿瘤的低氧区[60]。随着微机器人技术的不断发展,不少关于其在活体中的研究得以开展并取得了一系列显著的成果,可以预见在未来靶向肿瘤治疗领域,微机器人将会扮演重要的角色。 2.3.3 微机器人与细胞靶向疗法 干细胞治疗作为一种修复受损组织或器官的方法,已经展现出了强大的治疗潜力,然而要实现最佳治疗效果,干细胞必须被精确地输送到目标组织。场驱动微机器人特别是其中的磁驱动微机器人,具备在流体环境中携带目标物体进行定向运动的能力,因此可以将干细胞疗法与磁驱动微机器人相结合,实现对相关组织的修复和再生。LI等[15]提出采用3D打印技术制备磁驱动毛刺微机器人,他们采用3D打印的SU-8毛刺微球,表面修饰Ni-Ti,材料中的Ni用于磁驱动,Ti有良好的生物相容性,体内实验证实可以在斑马鱼和裸鼠体内传递细胞。作者所在课题组制备了仿生细胞外基质的左旋聚乳酸微球分别修饰超顺磁纳米粒子和纳米微球,也可以用于体外传递细胞和裸鼠体内传递细胞[27,61]。此外,目前已有3D打印微机器人和细胞培养成功并携带其在人造血管或小鼠体内定向移动的报道[62]。 微型机器人在细胞治疗载体方面具有诸多优势,其中最显著的一点在于其体积小巧,可以采用微创注射的方式实现,这不仅能够有效减少患者的疼痛感和感染风险,同时也能够提高治疗效率并缩短患者术后的恢复时间[63]。为了进一步拓展这一功能,研究人员研发出了一款高精度微创治疗机器人,该机器人在磁场和声场的协同作用下能够将细胞精准运输至患者受损部位进行修复,成功诱导细胞分化,从而极大地提高了治疗效果[64]。GO等[14,17]用铁氧化物超顺磁纳米粒子修饰聚乳酸-羟基乙酸共聚物微球开发出的球型多孔微机器人,在关节腔模拟液内能够携带间充质干细胞在外磁场作用下定向移动,并且能有效抵抗关节滑液流动并锚定于缺损部位。但是,用于细胞递送的磁驱动微机器人也面临一些挑战,例如需要开发与之配套的精准磁控系统,此外微机器人的应用还依赖微创手术的发展。 2.3.4 其他医学用途展望 健康的人体能够通过正常的新陈代谢吸收所需的物质,同时排除有害物质。但是在某些情况下,人体可能会失去这种平衡,无法通过正常的新陈代谢排出有害物质,比如重金属中毒等,在这种情况下可以使用微机器人进入患者体内,有针对性地吸附人体内的有害物质,使人体重新恢复到平衡状态[65]。如果今后的微机器人更智能化,能配合外部计算机以及医生定期为人体内受损的细胞做清除、保养、修复等,那么人患病的概率将大幅度降低。血栓是威胁人类生命安全的“头号杀手”之一,特别是脑血栓,由于脑部的血管狭窄且脆弱,当检查出患者有血栓时,初期医生通常建议药物保守治疗搭配合理的饮食及生活习惯,但这个治疗过程时间长且见效慢,如果将微机器人引导至血管并配合携带的药物对血管中的血栓进行溶解保持血液畅通,这将会为治疗血栓开辟新路径[66]。此外,微机器人还可应用于体外诊断领域,例如:WANG等[19]报道磁性微机器人作为可操作的免疫测定探针,用于自动化和高效的酶联免疫吸附测定。现阶段,微机器人的尺寸已经达到纳米级别,通过将纳米技术、计算机技术与生物医学技术进行有效融合,微机器人有望在人体内清理“垃圾”、修复受损细胞、影像追踪、疏通血管治疗血栓等方面展现出更大的应用潜力。"

| [1] 丁海波,刘柯良,卫孟萧,等.微结构可控材料的制备及其在生物医学的应用[J].中国科学(化学),2021,51(11):1501-1510. [2] LI J, ESTEBAN-FERNÁNDEZ DE ÁVILA B, GAO W, et al. Micro/nanorobots for biomedicine: Delivery, surgery, sensing, and detoxification. Sci Robot. 2017;2(4):eaam6431. [3] 李杨民,汤晖,徐青松,等.面向生物医学应用的微操作机器人技术发展态势[J].机械工程学报,2011,47(23):1-13. [4] LI M, HU X, ZHAO Y, et al. An overview of recent progress in micro/nanorobots for biomedical applications. Adv Mater Technol. 2023; 8(11):2201928. [5] 荣烈润.纳米机器人浅谈[J].机电一体化,2007,13(1):6-8. [6] WANG Q, ZHANG L. External power-driven microrobotic swarm: From fundamental understanding to imaging-guided delivery. ACS Nano. 2021;15(1):149-174. [7] XIE H, SUN M, FAN X, et al. Reconfigurable magnetic microrobot swarm: Multimode transformation, locomotion, and manipulation. Sci Robot. 2019;4(28):eaav8006. [8] 周可,陈梦梦,付静,等.仿生无约束微纳米机器人在生物医学上的应用[J].生物医学工程学杂志,2021,38(5):1003-1009. [9] AGRAHARI V, AGRAHARI V, CHOU M-L, et al. Intelligent micro-/nanorobots as drug and cell carrier devices for biomedical therapeutic advancement: Promising development opportunities and translational challenges. Biomaterials. 2020;260:120163. [10] 金东东,俞江帆,黄天云,等.磁性微纳米尺度游动机器人:现状与应用前景[J].科学通报,2017,62(2):136-151. [11] KIM J, CHUNG SE, CHOI S-E, et al. Programming magnetic anisotropy in polymeric microactuators. Nat Mater. 2011;10(10):747-752. [12] HUANG HW, SAKAR MS, PETRUSKA AJ, et al. Soft micromachines with programmable motility and morphology. Nat Commun. 2016;7:12263. [13] MEDINA-SÁNCHEZ M, SCHWARZ L, MEYER AK, et al. Cellular cargo delivery: Toward assisted fertilization by sperm-carrying micromotors. Nano Lett. 2015;16:555-561. [14] GO G, HAN J, ZHEN J, et al. A magnetically actuated microscaffold containing mesenchymal stem cells for articular cartilage repair. Adv Healthc Mater. 2017;6(13):1601378. [15] LI J, LI X, LUO T, et al. Development of a magnetic microrobot for carrying and delivering targeted cells. Sci Robot. 2018;3(19):eaat8829. [16] YASA IC, TABAK AF, YASA O, et al. 3d-printed microrobotic transporters with recapitulated stem cell niche for programmable and active cell delivery. Adv Funct Mater. 2019;29(17):1808992. [17] GO G, JEONG SG, YOO A, et al. Human adipose-derived mesenchymal stem cell–based medical microrobot system for knee cartilage regeneration in vivo. Sci Robot. 2020;5:eaay6626. [18] WANG Q, CHAN KF, SCHWEIZER K, et al. Ultrasound doppler-guided real-time navigation of a magnetic microswarm for active endovascular delivery. Sci Adv. 2021;7(9):eabe5914. [19] WANG Y, LIU X, CHEN C, et al. Magnetic nanorobots as maneuverable immunoassay probes for automated and efficient enzyme linked immunosorbent assay. ACS Nano. 2022;16(1):180-191. [20] LIU J, LI L, CAO C, et al. Swarming multifunctional heater-thermometer nanorobots for precise feedback hyperthermia delivery. ACS Nano. 2023;17(17):16731-16742. [21] ZHOU H, MAYORGA-MARTINEZ CC, PANE S, et al. Magnetically driven micro and nanorobots. Chem Rev. 2021;121(8):4999-5041. [22] 李盼,王志超,冯静,等.磁驱动微纳机器人研究进展及关键技术[J].磁性材料及器件,2023,54(6):105-117. [23] HUANG TY, SAKAR MS, MAO A, et al. 3d printed microtransporters: Compound micromachines for spatiotemporally controlled delivery of therapeutic agents. Adv Mater. 2015;27(42):6644-6650. [24] TOTTORI S, ZHANG L, QIU F, et al. Magnetic helical micromachines: Fabrication, controlled swimming, and cargo transport. Adv Mater. 2012;24(6):811-816. [25] YAN X, ZHOU Q, VINCENT M, et al. Multifunctional biohybrid magnetite microrobots for imaging-guided therapy. Sci Robot. 2017; 2(12):eaaq1155. [26] ZHAO LB, PAN L, ZHANG K, et al. Generation of janus alginate hydrogel particles with magnetic anisotropy for cell encapsulation. Lab Chip. 2009;9(20):2981. [27] LI B, YANG H, CHENG K, et al. Development of magnetic poly(l-lactic acid) nanofibrous microspheres for transporting and delivering targeted cells. Colloid Surface B. 2023;223:113175. [28] 王成军,李帅.软体机器人研究现状[J].微纳电子技术,2019,56(12): 948-955. [29] TANG J, YAO C, GU Z, et al. Super-soft and super-elastic DNA robot with magnetically driven navigational locomotion for cell delivery in confined space. Angew Chem Int Edit. 2020;59(6):2490-2495. [30] HU W, LUM GZ, MASTRANGELI M, et al. Small-scale soft-bodied robot with multimodal locomotion. Nature. 2018;554(7690):81-85. [31] YAN X, ZHOU Q, YU J, et al. Magnetite nanostructured porous hollow helical microswimmers for targeted delivery. Adv Funct Mater. 2015; 25(33):5333-5342. [32] MAGDANZ V, KHALIL ISM, SIMMCHEN J, et al. Ironsperm: Sperm-templated soft magnetic microrobots. Science Adv. 2020;6(28): eaba5855. [33] PARK BW, ZHUANG J, YASA O, et al. Multifunctional bacteria-driven microswimmers for targeted active drug delivery. ACS Nano. 2017; 11(9):8910-8923. [34] LI C, LAU GC, YUAN H, et al. Fast and programmable locomotion of hydrogel-metal hybrids under light and magnetic fields. Sci Robot. 2020;5(49):eabb9822.
[35] FAN Q, LU J, JIA J, et al. 2D magnetic manipulation of a micro-robot in glycerin using six pairs of magnetic coils. Micromachines. 2022; 13(12):2144.
[36] 孙浩然,王林,于世民,等.磁驱微纳机器人用细胞原位培养系统的设计[J].机械工程学报,2022,58(1):1-9.[37] ZHANG S, ELSAYED M, PENG R, et al. Reconfigurable multi-component micromachines driven by optoelectronic tweezers. Nat Commun. 2021;12(1):5349. [38] MOU F, LI Y, CHEN C, et al. Single-component TiO2 tubular microengines with motion controlled by light-induced bubbles. Small. 2015;11(21):2564-2570. [39] ZHOU D, LI YC, XU P, et al. Visible-light controlled catalytic Cu2O-Au micromotors Nanoscale. 2017;9(3):1315. [40] CAI L, WANG H, YU Y, et al. Stomatocyte structural color-barcode micromotors for multiplex assays. Natl Sci Rev. 2020;7(3):644-651. [41] WU Z, WU Y, HE W, et al. Self-propelled polymer-based multilayer nanorockets for transportation and drug release. Angew Chem Int Edit. 2013;52(27):7000-7003. [42] ZHANG Q, DONG R, WU Y, et al. Light-driven Au-WO3@C janus micromotors for rapid photodegradation of dye pollutants. ACS Appl Mater Interfaces. 2017;9(5):4674-4683. [43] DAI B, WANG J, XIONG Z, et al. Programmable artificial phototactic microswimmer. Nat Nanotechnol. 2016;11(12):1087-1092. [44] WANG W, CASTRO LA, HOYOS M, et al. Autonomous motion of metallic microrods propelled by ultrasound. ACS Nano. 2012;6(7): 6122-6132. [45] ZHOU C, ZHAO L, WEI M, et al. Twists and turns of spinning metallic microparticles megahertz ultrasound. ACS Nano. 2017;12(7):7415-7415. [46] WANG X, CAI J, SUN L, et al. Facile fabrication of magnetic microrobots based on spirulina templates for targeted delivery and synergistic chemo-photothermal therapy. ACS Appl Mater Inter. 2019;11(5): 4745-4756. [47] WU Z, SI T, GAO W, et al. Superfast near-infrared light-driven polymer multilayer rockets. Small. 2016;12(5):577-582. [48] SU H, LI S, YANG GZ, et al. Janus micro/nanorobots in biomedical applications. Adv Healthc Mater. 2023;12(16):2202391. [49] ALAPAN Y, YIGIT B, BEKER O, et al. Shape-encoded dynamic assembly of mobile micromachines. Nat Mater. 2019;18(11):1244-1251. [50] 张政,谢叻.体内微型手术机器人运动仿真[J].中国数字医学, 2015,10(1):57-60. [51] SPADA C, SPERA G, RICCIONI M, et al. A novel diagnostic tool for detecting functional patency of the small bowel: The given patency capsule. Endoscopy. 2005;37(9):793-800. [52] LIEN GS, WU MS, CHEN CN, et al. Feasibility and safety of a novel magnetic-assisted capsule endoscope system in a preliminary examination for upper gastrointestinal tract. Surg Endosc. 2018;32(4): 1937-1944. [53] JIANG X, QIAN YY, LIU X, et al. Impact of magnetic steering on gastric transit time of a capsule endoscopy (with video). Gastrointest Endosc. 2018;88(4):746-754. [54] 刘菡萏,王石刚,徐威,等.微纳米生物机器人与药物靶向递送技术[J].机械工程学报,2008,44(11):80-86. [55] 杨佳,张闯,王晓东,等.微纳机器人的发展综述[J].中国科学(技术科学),2019,49(1):119-120. [56] 孙猛猛,谢晖.面向靶向医疗的微纳米机器人[J].自然杂志,2020, 42(3):187-200. [57] NOYHOUZER T, L’HOMME C, BEAULIEU I, et al. Ferrocene-modified phospholipid: An innovative precursor for redox-triggered drug delivery vesicles selective to cancer cells. Langmuir. 2016;32(17):4169-4178. [58] WANG S, LIU K, WANG F, et al. The application of micro- and nanomotors in classified drug delivery. Chem Asian J. 2019;14(14): 2336-2347. [59] SUN M, FAN X, MENG X, et al. Magnetic biohybrid micromotors with high maneuverability for efficient drug loading and targeted drug delivery. Nanoscale. 2019;11(39):18382-18392. [60] FELFOUL O, MOHAMMADI M, TAHERKHANI S, et al. Magneto-aerotactic bacteria deliver drug-containing nanoliposomes to tumour hypoxic regions. Nat Nanotechnol. 2016;11(11):941-947. [61] QU M, XIAO W, TIAN J, et al. Fabrication of superparamagnetic nanofibrous poly(l-lactic acid)/γ-Fe2O3 microspheres for cell carriers. J Biomed Mater Res B. 2019;107(3):511-520. [62] JEON S, KIM S, HA S, et al. Magnetically actuated microrobots as a platform for stem cell transplantation. Sci Robot. 2019;4(30): eaav4317. [63] TIRGARBAHNAMIRI P, BAGHERI-KHOULENJANI S. Biodegradable microrobots for targeting cell delivery. Med Hypotheses. 2017;102: 56-60. [64] CHEN XZ, LIU JH, DONG M, et al. Magnetically driven piezoelectric soft microswimmers for neuron-like cell delivery and neuronal differentiation. Mater Horiz. 2019;6(7):1512-1516. [65] ZHANG Y, YAN K, JI F, et al. Enhanced removal of toxic heavy metals using swarming biohybrid adsorbents. Adv Funct Mater. 2018;28(52): 1806340. [66] 吕毅,张欣.磁外科学:以神奇之力撬动医学科技跨越发展[J].科学通报,2020,65(13):1163-1164. |
| [1] | Chen Jing, Zhang Nan, Meng Qinghua, Bao Chunyu. Material characterization of finite element computational models of knee joints at different ages [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(34): 7369-7375. |
| [2] | Chen Senlin, Zhu Zhou, Wan Qianbing. Application of Janus micro/nanoparticles in biomedicine [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6101-6109. |
| [3] | Lan Xiaoqian, Feng Guangli, Qin Shiyi, Zhong Lianmei, Li Qing. New ideas and opportunities for polyurethane materials in peripheral nerve repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(28): 6127-6137. |
| [4] | Zhao Yue, Xu Yan, Zhou Jianping, Zhang Xujing, Chen Yutong, Jin Zhengyang, Yin Zhitao. Differences in structural design between traditional and bionic scaffolds in bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3458-3468. |
| [5] | Feng Shuqi, Zhang Shiyong, Yao Keyi, Tang Yufei, Wang Kai, Zhou Xuemei, Xiang Lin. Application of photoresponsive nanomaterials in bone tissue regeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3469-3475. |
| [6] | He Rui, Li Chongyi, Wang Ruiyao, Zeng Dan, Fan Daidi. Application of MXene-based hydrogels in wound repair [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3486-3493. |
| [7] | Hu Zhangjie, Zhang Baoguan, Zhang Zhiwu. Application of solid collagen-based materials in medical devices [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3503-3512. |
| [8] | Ye Chao, Liu Xiaohong. Regulatory strategies for foreign body reactions in biomaterials [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(16): 3513-3520. |
| [9] | Chen Jiahan, Feng Chao, Huang Xiaoxia, Niu Minghui, Wang Xin, Teng Yong. Two-dimensional black phosphorus materials for bone tissue engineering [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(10): 2124-2131. |
| [10] | Liu Haoyang, Xie Qiang, Shen Mengran, Ren Yansong, Ma Jinhui, Wang Bailiang, Yue Debo, Wang Weiguo . Application, research hotspots, and shortcomings of degradable zinc-based alloys in bone defect repair and reconstruction [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 839-845. |
| [11] | Chen Yilong, Zhang Xu, Li Hong. Mechanical analysis of fiber post combined with different crown restorations for endodontically treated non-carious cervical lesions [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 866-871. |
| [12] | Yu Ming, Wang Wen. Posterior cruciate ligament tibial attachment point avulsion fracture: materials, implants, and internal fixation techniques in arthroscopic treatment [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(4): 872-880. |
| [13] | Gao Xilin, Wu Si Zhang Chao Zhu Liguo, Fu Bifeng, Wang Ping. Mechanotransduction proteins in intervertebral disc degeneration [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(3): 579-589. |
| [14] | Lai Pengyu, Liang Ran, Shen Shan. Tissue engineering technology for repairing temporomandibular joint: problems and challenges [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(在线): 1-9. |
| [15] | Cheng Weilu, Wang Zehua, Zhang Yidan, Liu Yinghui. Application and regulatory challenges of organoid technology in medical field [J]. Chinese Journal of Tissue Engineering Research, 2025, 29(1): 202-210. |
| Viewed | ||||||
|
Full text |
|
|||||
|
Abstract |
|
|||||